PEMANFAATAN CENDAWAN ENTOMOPATOGEN
Lecanicillium lecanii, Beauveria bassiana
dan
Metarhizium
anisopliae
SEBAGAI MIKOINSEKTISIDA TERHADAP
KUTU LONCAT JERUK,
Diaphorina citri
Kuwayama
(HEMIPTERA: LIVIIDAE)
MUHAMMAD AGUNG PERMADI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “Pemanfaatan Cendawan Entomopatogen Lecanicillium lecanii, Beauveria bassiana dan Metarhizium anisopliae sebagai mikoinsektisida terhadap Kutu Loncat Jeruk, Diaphorina citri Kuwayama (Hemiptera: Liviidae)” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun ke perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis penelitian ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2016 Muhammad Agung Permadi
RINGKASAN
MUHAMMAD AGUNG PERMADI. Pemanfaatan Cendawan Entomopatogen Lecanicillium lecanii, Beauveria bassiana dan Metarhizium anisopliae sebagai mikoinsektisida terhadap Kutu Loncat Jeruk, Diaphorina citri Kuwayama (Hemiptera: Liviidae). Dibimbing oleh RULY ANWAR dan TEGUH SANTOSO. Kutu loncat jeruk, Diaphorina citri Kuwayama merupakan hama penting tanaman jeruk di beberapa negara. Meskipun tingkat kerusakan yang diakibatkan tidak tinggi, tetapi kutu ini merupakan vektor penyakit huanglongbing (HLB). HLB disebut juga citrus vein phloem degeneration (CVPD) di Indonesia. Penularan CVPD sangat bergantung pada kepadatan populasi serangga vektor, pemencaran serangga vektor, dan sifat patogen dalam tubuh serangga. Pengendalian penyakit CVPD dilakukan melalui eradikasi tanaman sakit dan penanaman bibit jeruk bebas penyakit. Di samping itu, dilakukan juga pengendalian terhadap vektor penyakit, yaitu D. citri yang umumnya dilakukan secara kimiawi dengan menggunakan insektisida sintesis.
Musuh alami yang digunakan untuk mengendalikan D. citri dapat berupa predator, parasitoid dan patogen serangga. Cendawan entomopatogen merupakan salah satu agen pengendalian hayati yang potensial untuk mengendalikan hama tanaman karena keefektifan yang cukup tinggi terhadap hama utama. Cendawan entomopatogen menginfeksi serangga dengan menembus kutikula inang. Sejumlah spesies cendawan entomopatogen telah dilaporkan dapat menginfeksi D. citri, yaitu Isaria fumosorosea Wize, Hirsutella citriformis Speare, Beauveria bassiana (Bals.) Vuill dan Lecanicillium lecanii (Zimm.) (Viegas) Zare and Gams. Penelitian ini bertujuan untuk mengukur kemampuan infeksi cendawan entomopatogen L. lecanii, B. bassiana dan Metarhizium anisopliae terhadap D. citri.
Penelitian ini dilakukan di Laboratorium Patologi Serangga, Fakultas Perta-nian, Institut Pertanian Bogor. Penelitian pertama disusun dengan rancangan acak lengkap faktorial dengan 2 faktor. Faktor pertama adalah cendawan entomopatogen dan faktor kedua adalah kerapatan konidia (103, 104, 105, 106, 107, dan 108 konidia/ml) dan kontrol. Masing-masing perlakuan diaplikasikan pada imago D. citri dan diulang sebanyak 3 kali. Pada penelitian kedua L. lecanii diaplikasikan pada telur D. citri. Kerapatan konidia yang digunakan adalah 104, 105, 106, 107, 108 konidia/ml dan kontrol (akuades + tween). Perlakuan diulang tiga kali dan disusun dalam rancangan acak lengkap (RAL). Nilai tengah diuji dengan menggunakan pengujian jarak berganda duncan (DMRT) dengan taraf nyata 5%.
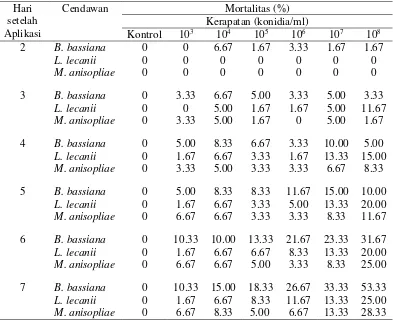
tidak ada perbedaan nyata antara cendawan yang diuji. Akan tetapi pada 6-7 HSA sudah terlihat perbedaan nyata antara cendawan dan kerapatan yang digunakan. Mortalitas imago D. citri tertinggi disebabkan infeksi B. bassiana yaitu sebesar 53.33%, M. anisopliae sebesar 28.33% sementara L. lecanii menyebabkan mortalitas terendah yaitu sebesar 25%, semua pada kerapatan 108 konidia/ml. Kemiringan tertinggi garis regresi ditunjukkan oleh B. bassiana yaitu 8.095, yang menunjukkan bahwa B. bassiana adalah cendawan yang paling efektif dari tiga cendawan entomopatogen yang diuji.
Hasil uji patogenisitas L. lecanii terhadap telur D. citri menunjukkan bahwa seluruh kerapatan konidia yang digunakan pada penelitian tidak memengaruhi per-kembangan telur D. citri. Hampir 100% telur D. citri masih mampu menetas. Hasil pengamatan mikroskopis menunjukkan bahwa telur D. citri yang telah mendapat perlakuan L. lecanii tidak memperlihatkan adanya gejala infeksi L. lecanii. Masa inkubasi telur D. citri hanya selama 2-3 hari sehingga konidia L. lecanii tidak memiliki waktu yang cukup untuk menembus dan menginfeksi ke bagian dalam telur
SUMMARY
MUHAMMAD AGUNG PERMADI. Utilization of Entomopathogenic fungi Lecanicillium lecanii, Beauveria bassiana and Metarhizium anisopliae as mycoinsecticides against Diaphorina citri Kuwayama (Hemiptera: Liviidae). Supervised by RULY ANWAR and TEGUH SANTOSO.
Asian citrus psyllid D. citri is an important pest of Citrus spp. (Sapindales: Rutaceae) in several countries. Itis also known as a vector of a serious virus citrus disease called greening disease or huanglongbing (HLB) as well. The transmission of HLB depends on the density of insect population, distribution of insect as vector, and pathogen in insect body. In Indonesia, HLB has been called as citrus vein phloem degeneration (CVPD). Management of CVPD is performed through the eradication of infected plants and planted disease-free citrus seedlings. In addition, to control the disease vectors, farmers use synthetic chemical insecticides.
Natural enemies, such as predators, parasitoids and pathogens, can be used to control D. citri. Entomopathogenic fungi can be very potential biological control agents, because of their high effectiveness against major pests. Fungi infect the insect host by penetrating host cuticle. Many species of fungi such as Isaria fumosorosea Wize, Hirsutella citriformis Speare, Beauveria bassiana (Bals.) Vuill and Lecanicillium lecanii (Zimm.) (Viegas) Zare and Gams have been reported to infect D. citri. The objective of this study was to measure the patogenicity of L. lecanii, B. bassiana and Metarhizium anisopliae against D. citri.
This research was conducted at the Laboratory of Insect Pathology, Faculty of Agriculture, Bogor Agricultural University. The first experiment was repeated three times and arranged in completely randomized factorial design with 2 factors. The first factor was entomophatogenic fungi and the second factor was conidial density (103, 104, 105, 106, 107, 108 conidia/ml and control). The fungal conidia were applied to adult of D. citri. The second experiment was pathogenicity of L. lecanii to the eggs of D. citri. Conidial densities i.e. 104, 105, 106, 107, 108 conidia/ml and control (distilled water + tween) were used. The experiment was repeated three times and arranged in a completely randomized design (CRD). Mean was analyzed by Duncan's multiple range test correction at the level α=0.05.
The results of pathogenicity test of L. lecanii against eggs of D. citri showed that all conidial density have no effect to the development of eggs of D. citri. All tested eggs hatched. Under microscopic observation, D. citri eggs that have been applied with L. lecanii did not show any symptoms of infection. The incubation period of the eggs was take place during 2-3 days, so that the conidia of L. lecanii did not have enough time to penetrate into the egg.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan IPB.
PEMANFAATAN CENDAWAN ENTOMOPATOGEN
Lecanicillium lecanii, Beauveria bassiana
dan
Metarhizium
anisopliae
SEBAGAI MIKOINSEKTISIDA TERHADAP
KUTU LONCAT JERUK,
Diaphorina citri
Kuwayama
(HEMIPTERA: LIVIIDAE)
MUHAMMAD AGUNG PERMADI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Entomologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Usulan : Pemanfaatan Cendawan Entomopatogen Lecanicillium lecanii, Beauveria bassiana dan Metarhizium anisopliae sebagai mikoinsektisida terhadap Kutu Loncat Jeruk, Diaphorina citri Kuwayama (Hemiptera: Liviidae) Nama Mahasiswa : Muhammad Agung Permadi
NRP : A351130161
Disetujui oleh Komisi Pembimbing
Dr Ir Ruly Anwar, MSi Dr Ir Teguh Santoso, DEA
Ketua Anggota
Diketahui oleh
Ketua Program Studi Entomologi Dekan Sekolah Pascasarjana
Dr Ir Pudjianto, MSi Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: Tanggal Lulus:
PRAKATA
Alhamdulillahirobbilalamin, Puji dan Syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan Nikmat dan Rahmat-Nya sehingga penulis da-pat menyelesaikan karya ilmiah ini yang berjudul “Pemanfaatan Cendawan Ento-mopatogen Lecanicillium lecanii, Beauveria bassiana dan Metarhizium anisopliae sebagai mikoinsektisida terhadap Kutu Loncat Jeruk, Diaphorina citri Kuwayama (Hemiptera: Liviidae)”. Penelitian ini dilaksanakan di Laboratorium Patologi Serangga, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor pada bulan Oktober 2014 sampai September 2015.
Penulis mengucapkan terima kasih Dr Ir Ruly Anwar, MSi dan Dr Ir Teguh Santoso, DEA selaku komisi pembimbing memberi motivasi, bimbingan, masukan dan saran dalam karya ilmiah ini, terima kasih kepada Endang Sri Ratna, Ph.D sebagai dosen penguji luar komisi dan Dr Ir Pudjianto, MSi. sebagai Ketua Program Studi Entomologi. Terimakasih penulis ucapkan kepada DIKTI yang telah memberikan beasiswa S2 sehingga penulis berkesempatan untuk melanjutkan pendidikan di Program Pascasarjana IPB. Ungkapan terimakasih juga penulis sampaikan kepada Ibu, Ayah, Mertua dan keluarga tercinta yang telah mendoakan dan memberikan dukungan yang luar biasa kepada penulis. Penulis juga mengucapkan terima kasih kepada istri tercinta, Angellita Intan Septiastri yang selalu memberikan semangat kepada penulis, serta anggota Laboratorium Patologi Serangga Susilawati, Kak Farriza Diyasti, Kak Silvia Permata Sari, Amaliatus Shalihah, Ferdika Mirasanti S, Ibu Sempurna Ginting, Humayra Winda Rangkuti dan teman-teman Entomologi 2013 Ihsan, Wildan, Mas Ichsan, Ridwan, Susi, Herni, Evie, Badrus, Bang Rudi, Pak Richard, Nia, Joanna, Mbak Indah dan teman-teman lain yang tidak dapat penulis tuliskan satu persatu yang telah membantu dan mendukung penulis dalam menyusun penelitian ini.
Penulis menyadari bahwa karya ilmiah ini masih banyak kekurangan. Oleh karena itu, penulis mengharapkan kritik dan saran yang bersifat membangun serta memotivasi penulis untuk menulis karya ilmiah yang lebih baik.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL xiii
DAFTAR GAMBAR xiii
DAFTAR LAMPIRAN xiii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
Hipotesis 2
TINJAUAN PUSTAKA 3
Lecanicillium lecanii 3
Metarhiziumanisopliae 4
Beauveria bassiana 5
Kutu Loncat Diaphorina citri 6
BAHAN DAN METODE 8
Waktu dan Tempat Penelitian 8
Metode Penelitian 8
Pemeliharaan D. citri 8
Perbanyakan Cendawan di Media PDA 8
Perbanyakan Cendawanpada Media Beras 9
Penyiapan Suspensi Cendawanuntuk Pengujian 10
Aplikasi Cendawanpada Imago D. citri 10
Aplikasi L. lecanii pada Telur D. citri 11
HASIL DAN PEMBAHASAN 12
Hasil 12
Pembahasan 15
SIMPULAN DAN SARAN 20
DAFTAR PUSTAKA 21
LAMPIRAN 26
DAFTAR TABEL
1. Mortalitas imago D. citri yang mendapat perlakuan cendawan entomo-patogen
13 2. Telur D. citri tidak menetas setelah aplikasi L. lecanii 15
DAFTAR GAMBAR
1. Koloni L. lecanii, pada media PDA dalam petri berdiameter 10 cm (A) pada media beras dengan berat 50 g (B)
8 2. Koloni B. bassiana, pada media PDA dalam petri berdiameter 10 cm (A)
pada media beras dengan berat 50 g (B)
9 3. Koloni M. anisopliae, pada media PDA dalam petri berdiameter 10 cm
(A) pada media beras dengan berat 50 g (B)
9 4. Tabung kaca yang beralaskan sponge, berisi daun kemuning dan
serangga uji
11 5. Laju mortalitas kumulatif imago D. citri, akibat infeksi B. bassiana (A),
L. lecanii (B) dan M. anisopliae (C)
13 6. Imago D. citri yang terinfeksi cendawan entomopatogen, B. bassiana
(A), L. lecanii (B) dan M. anisopliae (C)
14 7. Konidia cendawan yang berada dalam tubuh D. citri yang terinfeksi, B.
bassiana (A), L. lecanii (B) dan M. anisopliae (C) dengan perbesaran 400x
14
8. Telur D. citri dengan perbesaran 200x, telur belum menetas dan masih menempel pada tanaman (A), telur telah menetas dan masih menempel pada tanaman (B), telur belum menetas (C) dan telur telah menetas (D)
15
DAFTAR LAMPIRAN
1. Anova mortalitas imago D. yang mendapat perlakuan cendawan entomopatogen pada 2 HSA (Hari Setelah Aplikasi)
28 2. Anova mortalitas imago D. citri yang mendapat perlakuan cendawan
entomopatogen pada 3 HSA (Hari Setelah Aplikasi)
28 3. Anova mortalitas imago D. citri yang mendapat perlakuan cendawan
entomopatogen pada 4 HSA (Hari Setelah Aplikasi)
28 4. Anova mortalitas imago D. citri yang mendapat perlakuan cendawan
entomopatogen pada 5 HSA (Hari Setelah Aplikasi)
29 5. Anova mortalitas imago D. citri yang mendapat perlakuan cendawan
entomopatogen pada 6 HSA (Hari Setelah Aplikasi)
29 6. Anova mortalitas imago D. citri yang mendapat perlakuan cendawan
entomopatogen pada 6 HSA (Hari Setelah Aplikasi)
PENDAHULUAN
Latar Belakang
Kutu loncat jeruk, Diaphorina citri Kuwayama merupakan hama penting tanaman jeruk. Meskipun tingkat kerusakan yang diakibatkan tidak tinggi, tetapi kutu ini sangat merugikan karena merupakan vektor penyakit Huanglongbing (HLB). HLB disebut juga citrus vein phloem degeneration (CVPD) di Indonesia. CVPD telah menyebabkan hancurnya pertanaman jeruk di Asia dan Afrika (Bove 2006). Penularan CVPD sangat bergantung pada kepadatan populasi serangga vek-tor, pemencaran serangga vekvek-tor, dan sifat patogen dalam tubuh serangga. Tanaman yang terserang CVPD memperlihatkan gejala khas, yaitu bercak-bercak kekuningan (blotching, mottle). Pengendalian penyakit CVPD dilakukan melalui eradikasi ta-naman sakit dan penata-naman bibit jeruk bebas penyakit. Usaha ini hanya sekedar dapat mengurangi intensitas serangan dan menunda terjadinya wabah (Wijaya 2003). Disamping itu dilakukan pengendalian terhadap vektor penyakit, yaitu D. citri yang umumnya dilakukan secara kimiawi dengan menggunakan insektisida sintesis.
Di sisi lain, penggunaan insektisida sintetis dapat menimbulkan resistensi hama, resurjensi, ledakan hama sekunder dan masalah residu racun pada buah jeruk yang dikonsumsi. Pengendalian hayati dapat digunakan dalam usaha mengurangi pemakaian insektisida untuk pengendalian D. citri. Pengendalian hayati dilakukan dengan memanfaatkan parasitoid, predator, dan patogen untuk menekan populasi hama menjadi lebih sedikit kelimpahannya (Norris et al. 2003).
Cendawan entomopatogen merupakan salah satu agens pengendalian hayati yang potensial untuk mengendalikan hama tanaman. Hal ini disebabkan keefektifan cendawan entomopatogen cukup tinggi terhadap hama target. Cendawan entomo-patogen menginfeksi dengan menembus kutikula serangga inang, berbeda dengan bakteri dan virus yang harus termakan oleh serangga inang (Rai et al. 2014). Untuk serangga D. citri yang mempunyai tipe alat mulut menusuk dan menghisap, cen-dawan entomopatogen sangat sesuai untuk dipilih sebagai bioinsektisida. Sejumlah spesies cendawan entomopatogen telah dilaporkan dapat menginfeksi D. citri yaitu Isaria fumosorosea Wize (Pacheco et al. 2013), Hirsutella citriformis Speare (Hall et al. 2012), Beauveria bassiana (Bals.) Vuill. (Pacheco et al. 2013) dan Lecanicillium lecanii (Zimm.) (Viegas) Zare and Gams (Aragon & Ravelo 2000). Selain cendawan tersebut, di Indonesia cendawan Metarhizium anisopliae (Metch.) Sor. juga telah dikenal luas untuk pengendalian hama.
se-rangga akibat infeksi cendawan dipengaruhi oleh asal isolat dan sese-rangga inang (Sugimoto et al. 2003). Penelitian mengenai L. lecanii untuk pengendalian hama telah banyak dilakukan. Beberapa jenis hama yang dapat dikendalikan oleh cendawan ini di antaranya Aphis gossypii (Hemiptera: Aphididae) (Kim et al. 2001), Bemisia argentifolii (Hemiptera: Aleyrodidae) (Gindin et al. 2000), Thrips palmi (Thysanoptera: Thripidae) (Cuthbertson et al. 2005), larva Scolytus scolytus (Coleoptera: Scolytidae) (Barson 2008).
Cendawan B. bassiana juga telah banyak dieksplorasi kemampuannya dalam mengendalikan hama. Beberapa peneliti telah menguji keefektifan cendawan ini terha-dap beberapa jenis hama di antaranya Ostrinia furnacalis (Lepidoptera: Crambidae) (Agustin 2014), Cylas formicarius (Coleoptera: Brentidae) (Ahdiaty 2013),
Frankliniella occidentalis (Thysanoptera: Thripidae) (Gao et al. 2012), Sitophilus zeamais (Coleoptera: Curculionidae) (Surtikanti et al. 2011), Spodoptera litura (Lepi-doptera: Noctuidae) (Surtikanti & Yasin 2009), Crocidolomia pavonana (Lepidoptera: Crambidae) (Trizelia 2005) dan Leptinotarsa decemlineata (Coleoptera: Chrysomeli-dae) (Klinger 2003).
Pemanfaatan M. anisopliae untuk pengendalian hama juga telah banyak di-laporkan. Keefektifan cendawan ini telah diuji terhadap beberapa jenis hama di antaranya larva C. pavonana (Hasyim et al. 2009), larva S. litura(Widianti 2010), larva Spodoptera exigua (Lepidoptera: Noctuidae) (Freed et al. 2012), larva Chilo sacchariphagus (Lepidoptera: Crambidae) (Sianturi et al. 2014) dan Blissus antilus (Hemiptera: Lygaeidae) (Samuels et al. 2002).
Namun demikian data potensi cendawan entomopatogen L. lecanii, B. bassiana dan M. anisopliae tersebut sebagai bioinsektisida terhadap D. citri belum banyak tersedia di Indonesia. Penelitian ini diharapkan dapat berkontribusi membe-rikan data awal tentang kemampuan infeksi cendawan entomopatogen tersebut.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengukur dan membandingkan kemampuan infeksi L. lecanii, B. bassiana dan M. anisopliae terhadap imago D. citri dan mengukur kemampuan infeksi L. lecanii terhadap telur D. citri.
Manfaat Penelitian
Penelitian ini diharapkan mampu memberikan informasi mengenai potensi L. lecanii, B. bassiana dan M. anisopliae sebagai agens hayati untuk mengendalikan D. citri.
Hipotesis
TINJAUAN PUSTAKA
Lecanicillium lecanii
Cendawan L. lecanii merupakan cendawan dari Filum Ascomycota. Cenda-wan ini memiliki siklus tidak sempurna atau biasa disebut imperfect fungi. Cendawan dalam kelas ini mempunyai banyak spesies yang mampu menyebabkan penyakit pada serangga hama (Ferron 1985). Cendawan L. lecanii dapat digunakan untuk mengendalikan serangga hama terutama ordo Homoptera (Cloyd 2003) dan Hemiptera (Prayogo 2004).
L. lecanii mudah tumbuh pada berbagai media, terutama pada media PDA (potato dextrose agar) dan beras. Diameter koloni dapat mencapai 4–5.5 cm pada 3 hari setelah inokulasi pada PDA di dalam cawan petri. Koloni cendawan berwarna putih pucat. Dua hari setelah inokulasi, cendawan sudah mampu memproduksi ko-nidia. Kumpulan konidia ditopang oleh tangkai konidiofor yang membentuk pialid (whorls) seperti huruf V. Setiap tangkai menopang 5-10 konidia yang terbungkus dalam kantong lendir. Konidia berbentuk silinder hingga elip, terdiri dari satu sel, tidak berwarna dan berukuran 2.3-10.0 × 1.0-2.6 μm (Tanada & Kaya 1993).
Cendawan entomopatogen memerlukan kelembaban yang tinggi untuk tum-buh dan berkembang. Hal tersebut diperlukan selama proses pembentukan tabung kecambah (germ tube), sebelum terjadi penetrasi ke integumen serangga. L. lecanii tumbuh baik pada suhu 18-30o C dan kelembaban minimal 80%. Pada kelembaban lebih dari 90% cendawan tumbuh sangat baik (Cloyd 2003). Selain itu L. lecanii mampu hidup pada bahan organik yang mati dalam rentang waktu yang sangat pan-jang (Tanada & Kaya 1993).
Keefektifan cendawan entomopatogen dipengaruhi oleh waktu aplikasi, kare-na cendawan entomopatogen sangat rentan terhadap sikare-nar matahari khususnya sikare-nar ultra violet. Bila terkena sinar matahari dalam waktu 4 jam, L. lecanii akan kehi-langan viabilitas sebesar 16% dan bila terkena sinar matahari 8 jam viabilitas berku-rang hingga diatas 50%. Oleh karena itu, bila cendawan akan diaplikasikan pada musim kemarau perlu dihindarkan dari sinar matahari langsung dan sebaiknya apli-kasi dilakukan pada saat kelembaban udara tinggi yaitu sore hari (Prayogo & Suhar-sono 2005). Aplikasi L. lecanii pada sore hari mampu menyebabkan kematian hama penghisap polong kedelai R. linearis hingga 80%. Makin tinggi mortalitas serangga, jumlah biji yang rusak pun makin menurun (Prayogo 2004).
Keberhasilan pengendalian hama dengan cendawan entomopatogen juga di-tentukan oleh kerapatan cendawan yang diaplikasikan, yaitu kerapatan konidia da-lam setiap ml air. Jumlah konidia berkaitan dengan banyaknya biakan cendawan yang dibutuhkan setiap hektar. Kerapatan konidia yang dibutuhkan untuk mengen-dalikan hama bergantung pada jenis dan populasi hama yang akan dikenmengen-dalikan (Yusmani & Suharsono 2005). L. lecanii juga mampu memproduksi senyawa metabolit seperti cyclosporin dan dipiclonic acid yang sangat virulen terhadap beberapa jenis serang-ga hama (Cloyd 2003).
Thysanoptera, dan Coleoptera dengan tingkat mortalitas yang sangat bervariasi (Murakoshi et al. 2005). Perbedaan tingkat mortalitas serangga akibat infeksi cen-dawan ini dipengaruhi oleh asal isolat dan serangga inang (Sugimoto et al. 2003).
Menurut Kim et al. (2001), cendawan entomopatogen ini mampu mengin-feksi Aphis gossypii (Homoptera: Aphididae) dan menyebabkan mortalitas men-capai 50%. Gindin et al. (2000) melaporkan bahwa cendawan ini juga mampu menginfeksi kutu kebul Bemisia argentifolii (Homoptera: Aleyrodidae) dengan mortalitas mencapai 52%. Bahkan hasil penelitian Cuthbertson et al. (2005) menun-jukkan bahwa aplikasi cendawan tersebut mampu menyebabkan mortalitas Thrips palmi (Thysanoptera: Thripidae) di atas 90% dan larva kumbang Scolytus scolytus (Coleoptera: Scolytidae) juga dapat terinfeksi cendawan ini hingga menyebabkan mortalitas mencapai 100% (Barson 2008).
Olivares dan Lopez (2002) melaporkan bahwa V. lecanii juga dapat mengin-feksi telur nematoda parasit tanaman. Aviva dan Sikora (1992) juga menginforma-sikan bahwa cendawan tersebut sangat efektif untuk mengendalikan nematoda Globodera pallida Stone pada tanaman kentang. Selain itu cendawan ini dilaporkan juga sangat efektif untuk mengendalikan telur dan juvenil nematoda Heterodera glycines (Shinya et al. 2008). V. lecanii bahkan dilaporkan mampu memarasit spora penyakit embun tepung Sphaerotheca fuliginea dan busuk akar Phytium ultimatum pada mentimun, karat daun kedelai Phakopsora pachyrizi Syd, karat daun kopi Hemilia vastratix, serta kapang hijau Penicillium digitatum pada buah jeruk (Benhamou 2004). Oleh karena itu, Vu et al. (2007) menyatakan bahwa cendawan entomopatogen ini dapat digunakan sebagai salah satu agens hayati yang dapat di-padukan dengan cara pengendalian hama lainnya dalam program pengendalian ha-ma terpadu (PHT).
Metarhiziumanisopliae
Cendawan M. anisopliae termasuk ke dalam Filum Ascomycota, kelas Sorda-riomycetes, ordo Hypocreales dan famili Clavicipitaceae. Cendawan ini disebut de-ngan green muscardine fungus karena konidianya berwarna hijau dan tersebar luas di seluruh dunia (Tanada & Kaya 1993). Cendawan genus Metarhizium memiliki ciri miselium bersekat, berdiamater 1.98-2.97 µm, konidiofor tersusun tegak, ber-lapis dan bercabang yang pada ujungnya tersusun beberapa konidia. Konidia bersel satu, berbentuk jorong dengan ukuran 3.96 x 9.94 µm. Pada awal pertumbuhan, ko-loni cendawan berwarna putih, kemudian berubah menjadi hijau gelap dengan ber-tambahnya umur. Koloni dapat tumbuh dengan cepat pada beberpa media, seperti PDA, jagung, dan beras (Prayogo & Tengkano 2002).
Kemampuan cendawan M.anisopliae dalam mematikan serangga hama ber-variasi dan sangat dipengaruhi oleh karakter fisiologi dan genetik M. anisopliae. Ferron (1985) menggolongkan empat tahapan etiologi penyakit serangga yang dise-babkan oleh cendawan. Tahap pertama adalah inokulasi, yaitu kontak antara propa-gul cendawan dengan tubuh serangga. Tahap kedua adalah proses penempelan dan perkecambahan propagul cendawan pada integumen serangga, pada tahap ini dibu-tuhkan kelembaban yang tinggi dan air untuk perkecambahan propagul cendawan agar cendawan dapat memanfaatkan senyawa-senyawa yang terdapat pada inte-gumen. Tahap ketiga yaitu penetrasi dan invasi. Dalam melakukan penetrasi me-nembus integumen, cendawan membentuk tabung kecambah (apresorium). Dalam hal ini titik penetrasi sangat dipengaruhi oleh konfigurasi morfologi integumen. Pe-nembusan dilakukan secara mekanis dan kimiawi dengan mengeluarkan enzim dan toksin. Tahap keempat yaitu destruksi pada titik penetrasi dan terbentuknya blasto-spora yang kemudian beredar ke dalam hemolimfa dan membentuk hifa sekunder untuk menyerang jaringan lainnya (Strack 2003). Pada umumnya serangga sudah mati sebelum proliferasi blastospora.
Berbeda halnya dengan bakteri dan virus yang harus termakan oleh serangga agar efektif, cendawan biasanya menginfeksi serangga melalui kutikula. Kematian serangga karena rusaknya jaringan-jaringan tubuh serangga dan kadangkala oleh adanya toksin yang dihasilkan oleh cendawan. Larva yang terinfeksi cendawan pa-da umumnya menjadi lemah pa-dan tipa-dak aktif, dua atau tiga hari kemudian meng-ala-mi kematian, dan tubuhnya ditumbuhi oleh meng-ala-miselium cendawan. Pada umumnya mua cairan tubuh serangga habis digunakan cendawan, sehingga menyebabkan se-rangga mati dengan tubuh yang mengeras seperti mumi (Prayogo et al. 2005).
Cendawan M.anisopliae efektif membunuh Chrysodeixis chalcites (Lepido-ptera: Noctuidae), C. pavonana, Plutella xylostella (Lepidoptera: Yponomeutidae) dan Spodoptera sp. dalam 4-5 hari setelah inokulasi, baik secara semprotan, olesan langsung maupun dengan pencelupan daun kubis sebagai makanan larva pada sus-pensi konidia. Tiga hari setelah inokulasi, larva sudah mulai terlihat berwarna hijau yang merupakan massa spora cendawan M.anisopliae. Pada hari ke empat dan ke lima setelah inokulasi larva tidak bergerak lagi dan ditutupi oleh cendawan M. anisopliae yang berwarna hijau (Prayogo et al. 2005).
Beauveria bassiana
B. bassiana (Bals.) Vuill. tergolong dalam Filum Ascomycota, kelas Sorda-riomycetes, dan ordo Hypocreales. Cendawan ini mampu bertahan hidup di dalam tanah dalam bentuk konidia atau hifa saprofit. B. bassiana memiliki kemampuan bereproduksi secara aseksual dengan menghasilkan konidia. Cendawan ini juga ter-masuk dalam imperfect fungi (cendawan tidak sempurna) karena tidak ditemukan fase seksual.
Cendawan B. bassiana telah banyak diekplorasi kemampuannya dalam mengen-dalikan hama. Beberapa peneliti telah menguji keefektifan cendawan ini terhadap bebe-rapa jenis hama di antaranya O. furnacalis (Agustin 2014), C. formicarius (Ahdiaty 2013), F. occidentalis (Gao et al. 2012), S. zeamais (Surtikanti et al. 2011), S. litura
(Surtikanti & Yasin 2009), C. pavonana (Lepidoptera: Crambidae) (Trizelia 2005) dan
L. decemlineata (Klinger 2003).
Secara umum cendawan entomopatogen menginfeksi inangnya melalui integu-men. B. bassiana menembus integumen inang dengan membentuk apresorium (tabung kecambah) dari konidia dan kemudian masuk merusak jaringan tubuh inang. Penem-pelan konidia pada tubuh inang pada umumnya terjadi secara pasif dengan bantuan air dan angin. Perkecambahan konidia untuk menginfeksi tubuh inang memerlukan waktu. Hal ini disebabkan perkecambahan konidia tergantung pada kelembaban, suhu, cahaya, dan nutrisi (Tanada & Kaya 1993). Apabila keadaan kurang mendukung perkembangan cendawan hanya berlangsung di dalam tubuh serangga tanpa keluar menembus integu-men. Keberhasilan pengendalian hama dengan cendawan entomopatogen juga diten-tukan oleh kerapatan cendawan yang diaplikasikan, yaitu kerapatan konidia cendawan dalam setiap volume air.
Ciri yang paling mencolok pada serangga yang terinfeksi oleh B. bassiana adalah terdapat miselia berwarna putih menyelimuti bangkai serangga terinfeksi (Neves & Alves 2004). Gerakan serangga yang terinfeksi menjadi lamban, nafsu makan berkurang bahkan terhenti, lama-kelamaan diam dan akhirnya mati (Inglis et al. 2001). Inglis (2001) juga menyatakan selain kehabisan nutrisi, kematian se-rangga juga dapat disebabkan adanya tekanan fisik akibat masuknya hifa pada ja-ringan serangga, keracunan oleh mikotoksin B. bassiana serta aksi kombinasi keti-ganya. Beberapa toksin yang dihasilkan oleh B. bassiana adalan bassianin, beauvericin, bassianolide, beaverolides dan tenellin (Tanada & Kaya 1993).
Kutu Loncat Diaphorina citri
Distribusi kutu loncat D. citri meliputi negara-negara di Asia Pasifik (Catling 1970). Kutu loncat merupakan hama penting jeruk di beberapa negara dan berperan sebagai vektor patogen penyakit jeruk yang serius yang disebut greening desease atau Huanglongbing. Penyakit ini menyebabkan kehancuran industri jeruk di Asia dan Afrika (Bove 2006). D. citri menyebar di daerah tropik, subtropik dan dilapor-kan pada beberapa daerah geografi seperti: Afrika (Bove 2006), Karibia (Bahama, Pulau Cayman, Jamaika, Kuba, Puerto Riko) (Halbert & Nunez 2004), Indonesia (Wijaya et al. 2012), Malaysia (Sule et al. 2012), Meksiko (Pacheco et al. 2013), Amerika Selatan (Brazil, Argentina, Venezuela) (Hodkincon & White 1981) dan beberapa daerah lainnya.
Imago D. citri memiliki panjang 3–4 mm dengan belang-belang coklat pada tubuhnya. Kepalanya berwarna coklat terang. Sayap depan melebar hingga sete-ngah lingkaran, berbelang dan memiliki pita coklat di sepanjang tepi ujung sayap. Antena memiliki bercak hitam kecil di ujungnya, dan bercak coklat terang pada seg-men tengah. Dalam hidupnya D. citri mengeluarkan sekresi berupa lilin sehingga terlihat berdebu (Mead & Fasulo 2011).
kuning. Telur memiliki tangkai pada bagian pangkal telur yang menancap pada ja-ringan tanaman. Tangkai pada telur berfungi untuk mengokohkan posisi telur agar tidak terlepas dari tanaman. Pada bagian ujung, telur memiliki rongga udara. Telur yang baru diletakkan berwarna kuning pucat dan memiliki kuning telur pada bagian tengahnya, sedangkan telur yang akan menetas memiliki warna kuning yang lebih pekat. Nimfa instar I yang menetas keluar melalui sisi lateral telur, dan meninggal-kan cangmeninggal-kang telurnya. Imago betina dapat meletakmeninggal-kan telur lebih dari 800 butir se-lama hidupnya.
Nimfa D. citri berukuran 0.25 mm selama instar I, dan berukuran 1.5–1.7 mm pada instar V. Nimfa berwarna kuning-oranye, tidak memiliki spot di abdomen. Nimfa memiliki 5 instar. Siklus hidup D. citri antara 15 – 47 hari tergantung musim. Imago dapat hidup selama beberapa bulan. Liu dan Tsai (2000) melaporkan lama hidup D. citri adalah selama 117 hari pada suhu 15o C dan 51 hari pada suhu 30o C. Kutu loncat tidak memiliki masa diapause (Mead & Fasulo 2011). D. citri tidak dapat terbang sangat jauh atau melakukan penerbangan panjang karena memiliki otot sayap yang lemah dan ukuran sayap yang kecil (Sakamaki 2005). Durasi penerbangan terpanjang D. citri adalah 47-49 menit dengan jarak tempuh 978-1241 m. Pemencaran jarak jauh yang dilakukan D. citri merupakan pengulangan dari penerbangan jarak pendek yang terus menerus (Arakawa & Mivamolo 2007)
Nimfa dan imago D. citri mengisap daun sehingga menyebabkan daun jeruk menjadi layu kemudian mengering. Kerusakan yang berat dapat menyebabkan ke-matian tanaman. Di samping mengisap cairan daun, nimfa mengeluarkan sekresi berwarna putih berlilin berbentuk benang spiral dan embun madu. Sekresi dan em-bun madu tersebut sering jatuh pada permukaan daun dan menjadi media tumbuh-nya cendawan jelaga yang menyebabkan proses fotosintesis terganggu (Mead & Fasulo 2011). D. citri telah terbukti mengakibatkan penurunan produksi jeruk di berbagai daerah di Indonesia dan mempunyai daya rusak yang tinggi serta penye-barannya sangat cepat. Populasi psyllid tertinggi terjadi pada tanaman selama masa pertunasan waktu hujan.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan di Laboratorium Patologi Serangga, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, mulai bulan Okto-ber 2014 sampai dengan SeptemOkto-ber 2015.
Metode Penelitian
Pemeliharaan D. citri
Imago D. citri dikumpulkan dari perkebunan jeruk di Kampung Carang Pu-lang, Kelurahan Situ Gede, Kecamatan Bogor Barat, Kota Bogor. Imago yang telah didapatkan kemudian dimasukkan ke dalam kurungan serangga berukuran 100 cm x 50 cm x 100 cm (p x l x t) yang telah berisi tanaman kemuning (Murraya paniculata) sebagai tanaman inang.
Perbanyakan Cendawan di Media PDA
Dalam penelitian ini isolat L. lecanii dan B. bassiana yang digunakan ber-asal dari koleksi Laboratorium Patologi Serangga Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, dan isolat M. anisopliae berasal dari koleksi Balai Besar Perbenihan dan Proteksi Tanaman Perkebunan (BBPPTP) Sura-baya. Isolat cendawan ditumbuhkan pada media PDA (Gambar 1A, 2A, dan 3A). Komposisi media PDA yang digunakan yaitu kentang 400 g, dextrose 15 g, kloram-fenikol 1 g, agar 15 g dan akuades 1 l (Goettel & Inglis 1997). Media PDA dipadat-kan dalam cawan petri berdiameter 9 cm. Cendawan diinkubasi selama 14 hari pada suhu kamar.
Gambar 2 Koloni B. bassiana, pada media PDA dalam petri berdiameter 10 cm (A), dan pada media beras dengan berat 50 g (B)
Gambar 3 Koloni M. anisopliae, pada media PDA dalam petri berdiameter 10 cm (A), dan pada media beras dengan berat 50 g (B)
Perbanyakan Cendawanpada Media Beras
Penyiapan Suspensi Cendawanuntuk Pengujian
Masing-masing biakan L. lecanii, B. bassiana dan M. anisopliae pada media beras dibuat suspensi. Media beras yang telah ditumbuhi cendawan diambil seba-nyak 2 kantong (50 g/kantong), ditambahkan akuades steril sebaseba-nyak 100 ml dan larutan Tween 20 sebanyak 0.025 ml tiap 50 ml air (0.05%), dan digerus dalam mortar. Campuran tersebut disaring dengan kain kasa halus, kemudian dimasukkan ke dalam labu Erlenmeyer berukuran 100 ml dan dikocok dengan vortex selama 30 detik hingga homogen. Kerapatan konidia dari masing-masing suspensi dihitung dengan hemocytometer Neubauer-improved hingga didapatkan kerapatan konidia yang tertinggi yaitu 108 konidia/ml. Kerapatan konidia yang diperlukan diperoleh dengan membuat pengenceran bertingkat dengan campuran akuades steril + tween (Goettel & Inglis 1997).
Aplikasi Cendawanpada Imago D. citri
Masing-masing suspensi isolat L. lecanii, B. bassiana dan M. anisopliae yang sudah dihitung kerapatan konidianya kemudian diaplikasikan pada imago D. citri. Kerapatan konidia yang digunakan adalah 103, 104, 105, 106, 107, dan 108 ko-nidia/ml. Aplikasi dilakukan dengan cara menyemprotkan 0.5 ml suspensi konidia pada imago D. citri. Serangga uji dimasukkan ke dalam wadah plastik berukuran 20 cm x 15 cm x 5 cm (p x l x t) yang telah dialasi tisu dan ditutup menggunakan kain kasa. Sebagai kontrol, serangga uji disemprot dengan akuades yang telah di-campur tween dengan volume yang sama. Imago kemudian ditempatkan pada ta-bung kaca berukuran tinggi 22.5 cm dengan diameter 2.5 cm (Gambar 4). Tata-bung kaca tersebut berisi daun kemuning yang pada bagian tangkainya dibalut spons yang dibasahkan untuk menjaga kelembaban dan mencegah kehilangan air. Daun terse-but digunakan sebagai sumber pakan imago. Setiap satuan percobaan masing-masing terdiri dari 20 individu serangga ujidan diulang sebanyak 3 kali. Peubah yang diamati adalah jumlah imago yang mati akibat terinfeksi baik L. lecanii, B. bassiana,maupun M. anisopliae yang dihitung mulai waktu aplikasi sampai dengan 7 hari setelah aplikasi (HSA).
Persentase mortalitas imago dihitung menggunakan rumus: M = �
� x 100%
Keterangan:
M = Persentase mortalitas (%)
A = Jumlah serangga yang mati akibat infeksi cendawan D = Jumlah serangga yang diuji
Gambar 4 Tabung kaca, berisi daun kemuning yang tangkainya dibalut spons dan serangga uji
Aplikasi L. lecanii pada Telur D. citri
Kerapatan konidia L. lecanii yang digunakan adalah 104, 105, 106, 107, dan 108 konidia/ml. Masing-masing kerapatan konidia diaplikasikan pada telur D. citri dengan cara disemprot. Sebagai kontrol, telur uji disemprot dengan akuades yang telah dicampur tween dengan volume yang sama. Telur uji terdiri dari beberapa ke-lompok telur D. citri dengan jumlah minimal telur 20 butir. Telur diletakkan dalam cawan petri yang telah dialasi dengan tisu lembab. Kelompok telur yang telah di-aplikasi cendawan dipelihara sampai menetas. Percobaan diulang tiga kali dan per-cobaan disusun dalam rancangan acak lengkap (RAL). Nilai tengah diuji dengan pengujian jarak berganda duncan (DMRT) dengan taraf nyata 5%. Peubah yang diamati adalah persentase telur yang tidak menetas.
Persentase telur yang tidak menetas dihitung menggunakan rumus: M = x 100%
Keterangan:
M = Persentase telur yang tidak menetas (%) T = Jumlah telur yang tidak menetas
HASIL DAN PEMBAHASAN
Hasil
Pada pengamatan hari pertama setelah aplikasi (HSA), belum ada D. citri yang mengalami kematian akibat infeksi cendawan. Pada 2 HSA, hanya B. bassiana yang menyebabkan mortalitas D. citri yaitu sebesar 6.67%. Pada hari ketiga baru terlihat masing-masing cendawan menyebabkan mortalitas D.citri. Mortalitas D. citri akibat infeksi B. bassiana dan M. anisopliae cenderung sebanding sampai hari ke-4 setelah aplikasi, sedangkan L. lecanii menyebabkan mortalitas tertinggi pada kerapatan 108 konidia/ml sejak 3 HSA. Efek aplikasi cendawan B. bassiana terlihat jelas mulai 5 HSA sebesar 20%, sedangkan untuk keseluruhan mortalitas yang dise-babkan cendawan terlihat jelas setelah 5 HSA. Pada hari 6 dan 7 dengan ke-rapatan konidia yang sama, B. bassiana menyebabkan mortalitas lebih tinggi diban-dingkan M. anisopliae dan L. lecanii (Tabel 1).
M. anisopliae 0 3.33 5.00 3.33 3.33 6.67 8.33
Tubuh imago D. citri yang telah mati terinfeksi B. bassina dan L. lecanii ter-lihat diselimuti miselia berwarna putih seperti pada Gambar 6A dan 6B, sedangkan bangkai D. citri yang terinfeksi M. anisopliae diselimuti miselia yang awalnya ber-warna putih kemudian berubah menjadi ber-warna hijau (Gambar 6C).
Gambar 6 Imago D. citri yang terinfeksi cendawan entomopatogen, B. bassiana (A), L. lecanii (B) dan M. anisopliae (C)
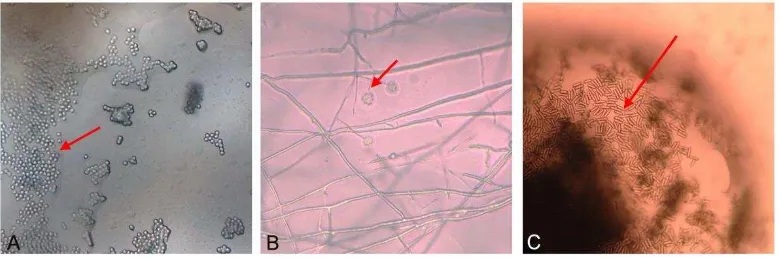
Pengamatan mikroskop cendawan yang tumbuh menyerang serangga me-nunjukkan konidia B. bassiana tidak bersepta, berbentuk bundar dan hialin serta tidak berwarna (Gambar 7A). Konidia L. lecanii berbentuk silinder hingga elips, terdiri dari satu sel, tidak bersepta, tidak berwarna. Setiap tangkai menopang 5-10 konidia yang terbungkus dalam kantong lendir (Gambar 7B). Konidia M. anisopliae bersel satu, tidak bersepta, berbentuk silindris, konidia membentuk rantai pararel jika jumlahnya banyak, berwarna hijau terang atau kuning kehijauan (Gambar 7C). Hal ini sesuai dengan yang dikemukakan Humber (1997).
Gambar 7 Konidia cendawan yang berada pada tubuh D. citri yang terinfeksi, B. bassiana (A), L. lecanii (B) dan M. anisopliae (C) dengan perbesaran 400x
tidak dapat menginfeksi telur D. citri dan telur menetas normal (Tabel 2 dan Gambar 8).
Tabel 2 Telur D. citri yang tidak menetas setelah aplikasi L. lecanii
Kerapatan konidia Telur tidak menetas (%) + SD
0 (Kontrol) 0 + 0 a
104 0 + 0 a
105 2.78 + 2.42 a
106 0.90 + 1.56 a
107 1.28 + 2.22 a
108 2.47 + 2.19 a
Keterangan: Angka yang diikuti huruf yang berbeda diartikan memiliki perbedaan yang nyata antara perlakuan yang satu dengan perlakuan yang lain pada taraf uji 0.05 menurut uji Duncan.
Gambar 8 Telur D. citri dengan perbesaran 200x, telur belum menetas dan masih menempel pada tanaman (A), telur telah menetas dan masih menempel pada tanaman (B), telur belum menetas (C) dan telur telah menetas (D)
Telur D. citri memiliki tangkai pada bagian pangkal telur yang menancap pa-da jaringan tanaman. Tangkai papa-da telur berfungi untuk mengokohkan posisi telur agar tidak terlepas dari tanaman. Pada bagian ujung, telur D. citri memiliki rongga udara. Nimfa instar I yang menetas keluar melalui sisi lateral telur, dan mening-galkan cangkang telurnya.
Pembahasan
ter-jadi pada hari kedua. Hal ini sesuai dengan pernyataan Steinhaus (1999) bahwa B. bassiana mampu berkecambah pada 24-48 jam setelah kontak bila kondisi lingkungan lembab. Kematian serangga akibat cendawan biasanya terjadi 2 hari sampai 14 hari setelah terinfeksi, namun kematian bisa pula terjadi kurang dari 24 jam. Besheli et al. (2006) menyatakan cendawan entomopatogen harus cocok de-ngan inangnya dan menghasilkan kombinasi enzim yang baik untuk dapat melaku-kan penetrasi tergantung kepada beberapa faktor patogenisitas, di antaranya faktor kesesuaian inang dan sifat fisiologis cendawan.
Pada 3 HSA B. bassiana menyebabkan kematian pada imago D. citri dengan mortalitas tertinggi 6.67% pada kerapatan 104 konidia/ml, L. lecanii sebesar 11.67% pada kerapatan 108 konidia/ml dan M. anisopliae sebesar 5% pada kerapat-an 104 dan 107 konidia/ml. Setelah 3 HSA baru terlihat M. anisopliae dan L. lecanii menyebabkan mortalitas terhadap D. citri. Hal ini sesuai dengan hasil penelitian Neves dan Alves (2004) yang menunjukkan bahwa penempelan konidia M. anisopliae pada kutikula Cornitermes cumulans (Kollar) (Isoptera; Termitidae) ter-jadi sampai 6 jam setelah aplikasi dan perkecambahan mulai terter-jadi antara 6-12 jam setelah aplikasi. Penetrasi terjadi 12-48 jam setelah inokulasi dan kematian serang-ga terjadi antara 72-96 jam setelah inokulasi. Adanya perbedaan patogenisitas terse-but dipengaruhi oleh asal isolat dan genetik dari cendawan terseterse-but. Hal ini sesuai dengan penyataan Trizelia (2005) bahwa sifat genetik dan fisiologi cendawan me-miliki peranan penting dalam patogenitas atau virulensi cendawan terhadap serang-ga hama.
Selanjutnya pada 4-5 HSA kematian imago D. citri terus bertambah namun hasil analisis ragam pada pada 4-5 HSA menunjukkan tidak ada perbedaan nyata antara cendawan yang diuji (Lampiran 4). Perbedaan nyata ditunjukkan oleh perbe-daan kerapatan (Lampiran 4). Akan tetapi pada 6-7 HSA sudah terlihat perbeperbe-daan nyata antara cendawan (DF= 2, F hit= 13.50, P< 0.0001) (Lampiran 6) dan kerapat-an ykerapat-ang digunakkerapat-an (DF= 6, F hit= 14.04, P< 0.0001) (Lampirkerapat-an 6). Mortalitas ima-go D. citri tertinggi disebabkan infeksi B. bassiana yaitu sebesar 53.33% pada kera-patan 108 konidia/ml diikuti oleh M. anisopliae sebesar 28.33% pada kerapatan 108 konidia/ml. L. lecanii menyebabkan mortalitas terendah yaitu sebesar 25% pada ke-rapatan 108 konidia/ml. Hal ini sejalan dengan penelitian Pacheco et al. (2013), B. bassiana dapat menyebabkan mortalitas pada D. citri sebesar 60.66% pada kerapat-an 108 konidia/ml dan M. anisopliae dapat menyebabkan mortalitas pada D. citri sebesar 49.02% pada kerapatan 108 konidia/ml. Persentase mortalitas lebih rendah ditunjukkan hasil penelitian Dwiastuti et al. (2007) bahwa B. bassiana hanya dapat menyebabkan mortalitas pada D. citri sebesar 31.99% pada kerapatan 108 koni-dia/ml dan M. anisopliae hanya dapat menyebabkan mortalitas pada D. citri sebesar 14.41% pada kerapatan 108 konidia/ml.
Hal yang berbeda ditunjukkan oleh infeksi L. lecanii. Pada penelitian ini in-feksi L. lecanii menyebabkan mortalitas yang rendah yaitu sebesar 25%. Kim et al. (2001) melaporkan bahwa L. lecanii menyebabkan mortalitas A. gossypii mencapai 50%. Gindin et al. (2000) juga menyatakan bahwa L. lecanii menyebabkan morta-litas kutu kebul B. argentifolii mencapai 52%. Cuthbertson et al. (2005) bahkan me-nunjukkan bahwa aplikasi cendawan tersebut menyebabkan mortalitas T. palmi di atas 90%.
Hal yang sama ditunjukkan oleh infeksi M. anisopliae. Pada penelitian ini in-feksi M. anisopliae juga menyebabkan mortalitas yang rendah yaitu sebesar 28.33%. Hasyim et al. (2009) melaporkan M. anisopliae dapat mematikan larva C. pavonana sampai 50.83%, Widianti (2010) mendapatkan hasil bahwa M. anisopliae dapat mematikan larva S. litura instar II sampai 47.5%. Hasil penelitian Freed et al. (2012) menunjukkan M. anisopliae menyebabkan mortalitas larva S. exigua sampai 87.5%. Bahkan mortalitas larva C. sacchariphagus diperoleh sampai 100% akibat infeksi M. anisoplie dalam penelitian Sianturi et al. (2014). Secara kumulatif apli-kasi menggunakan B. bassiana, L. lecanii dan M. anisopliae menunjukkan bahwa semakin tinggi kerapatan konidia yang digunakan, maka semakin tinggi pula morta-litas imago D. citri. Mortalitas serangga sangat ditentukan oleh kerapatan konidia cendawan yang digunakan. Kerapatan konidia yang optimal untuk mengendalikan hama bergantung pada jenis serangga hama yang akan dikendalikan. Meskipun mortalitas yang diakibatkan M. anisopliae dan L. lecanii yang diteliti rendah, na-mun setelah aplikasi di lapangan serangga yang mati akibat infeksi cendawan dapat menjadi sumber inokulum untuk infeksi selanjutnya. Hal ini yang membedakan de-ngan aplikasi insektisida kimia yang kurang memungkinkan terjadinya akumulasi mortalitas di lapangan.
Namun tingkat mortalitas serangga yang rendah juga dapat ditingkatkan bila aplikasi ditambah menjadi tiga kali berturut-turut selama 3 hari (Prayogo & Suhar-sono 2005). Sehingga hal ini mengindikasikan bahwa aplikasi cendawan entomopa-togen perlu dilakukan lebih dari satu kali, apalagi bila serangga hama mempunyai siklus hidup yang terdiri atas beberapa stadia. Aplikasi berulang diperlukan pula untuk mengantisipasi faktor lingkungan yang kurang mendukung sehingga tingkat keberhasilannya rendah. Umur biakan saat aplikasi cendawan juga sangat meme-ngaruhi virulensi cendawan. Biakan cendawan yang paling efektif adalah berumur 3-4 minggu. Pada biakan berumur 2 atau 3 bulan, nutrisi dalam media banyak digu-nakan untuk memproduksi konidia sehingga cendawan kehabisan cadangan nutrisi. Sehingga kualitas dan kuantitas nutrisi dari media sangat memengaruhi virulensi cendawan entomopatogen.
(per-sentase mortalitas) bernilai minus maka dianggap nol, karena belum ada kematian dan kematian tidak benilai minus.
Menurut Goettel dan Inglis (1997) kemampuan patogen untuk bisa menim-bulkan infeksi pada serangga ditentukan oleh tiga faktor yaitu patogen, inang dan lingkungan. Dari segi patogen, dosis dan cara aplikasi akan memengaruhi mortali-tas serangga, sedangkan dari segi inang, berbagai faktor fisiologi dan morfologi inang memengaruhi kerentanan serangga terhadap cendawan entomo-patogen. Se-lanjutnya Neves dan Alves (2004) menambahkan bahwa waktu infeksi sampai ke-matian serangga dipengaruhi oleh dosis aplikasi dan virulensi dari isolat. Cendawan entomopatogen biasanya menyebabkan kematian pada serangga inang dengan satu atau beberapa cara seperti toksinasi, defisiensi nutrisi, dan merusak jaringan. Kema-tian serangga biasanya terjadi karena toksinasi yang disebabkan cendawan, selan-jutnya rusaknya jaringan-jaringan tubuh serangga karena dipenuhi miselia yang me-nyebar dengan cepat dan memenuhi hemosel serangga inang, semua cairan inang digunakan untuk multipikasi cendawan sehingga menyebabkan serangga inang ma-ti dengan tubuh mengeras (Trizelia 2005). Toksin yang dihasilkan cendawan me-nyebabkan kenaikan pH hemolimfa, penggumpalan dan terhentinya peredaran he-molimfa serangga inang. Menurut penelitian Vey et al. (2001) toksin juga dapat menimbulkan gangguan pada fungsi hemolimfa dan nukleus serangga, sehingga mengakibatkan pembengkakan dan pengerasan pada serangga yang terinfeksi. Be-berapa toksin yang dihasilkan oleh B. bassiana adalah bassianin, beauvericin, bassianolide, beaverolides dan tenellin. Sedangkan yang dihasilkan L. lecanii ada-lah dipcolonic acid, hydroxy carboxylic acid dan cyclosporin. Selanjutnya toksin yang dihasilkan M. anisopliae adalah destruxin, viridoxin dan cyclic peptide toxin.
Tingkat patogenisitas cendawan entomopatogen dipengaruhi oleh perbedaan genetik, asal isolat dan faktor lingkungan seperti suhu dan kelembaban. Ketiga fak-tor di atas memengaruhi kemampuan cendawan entomopatogen untuk tumbuh dan berkembang serta melumpuhkan mekanisme pertahanan inang. Secara umum isolat yang memiliki fisiologi yang baik (daya kecambah konidia dan sporulasi yang ting-gi) akan lebih virulen. Selain faktor virulensi, kemampuan patogen yang untuk bisa hidup dan bertahan di lingkungan merupakan salah satu faktor penting dalam keber-hasilan pengendalian hayati. Beberapa cendawan entomopatogen bersifat virulen dan membunuh serangga inang dalam waktu yang singkat dan yang lainnya menye-babkan infeksi kronik yang lama (Tanada & Kaya 1993).
kondisi lingkungan yang kurang sesuai untuk perkembangan miselia cendawan di luar tubuh inangnya (Trizelia 2005).
Hasil uji patogenisitas L. lecanii terhadap telur D. citri menunjukkan bahwa seluruh kerapatan konidia yang digunakan pada penelitian tidak memengaruhi perkembangan telur D. citri. Hampir 100% telur D. citri masih mampu menetas wa-laupun telah diberi perlakuan suspensi konidia L. lecanii. Semua kerapatan konidia yang diuji tidak dapat menginfeksi telur D. citri dan telur menetas normal. Hasil pengamatan makroskopis menunjukkan bahwa telur D. citri yang telah diaplikasi dengan L. lecanii tidak memperlihatkan adanya gejala infeksi L. lecanii. Hal ini me-nunjukkan bahwa L. lecanii tidak bisa menginfeksi telur D. citri. Tidak terjadinya infeksi pada telur mungkin disebabkan oleh sifat fisik dan kimia telur D. citri yang diduga menghalangi tabung kecambah konidia menembus ke bagian dalam telur. Selain itu masa inkubasi telur D. citri hanya selama 2-3 hari sehingga konidia L. lecanii tidak memiliki waktu yang cukup untuk menembus dan menginfeksi ke ba-gian dalam telur karena pada penelitian tahap pertama, L. lecanii mampu meng-infeksi dan mematikan imago D. citri mulai hari ke-3 setelah aplikasi. Jadi telur te-lah menetas sebelum L. lecanii mampu menginfeksi telur. Hasil penelitian Del Prado et al. (2008) menunjukkan L. lecanii belum dapat menginfeksi telur Aleurodicus cocois (Hemiptera: Aleyrodidae) sampai hari ke-2 setelah aplikasi dan kematian te-lur tertinggi pada hari ke-7 setelah aplikasi yaitu sebesar 82.5% pada kerapatan 108 konidia/ml.
Penelitian lain menunjukkan hasil yang sama dengan penelitian Del Prado et al. (2008) di antaranya hasil penelitian Park et al. (2010) menunjukkan bahwa apli-kasi beberapa strain Lecanicillium dapat mematikan lebih dari 70% telur Bemisia tabaci (Hemiptera: Aleyrodidae) pada kerapatan 106 konidia/ml, lama inkubasi te-lur B. tabaci adalah 5.8 hari. Hasil penelitian Prayogo (2009) menunjukkan bahwa aplikasi L. lecanii pada kerapatan 108 konidia/ml dapat mematikan telur Riptortus linearis (Hemiptera: Alydidae) sebesar 91% dimana lama inkubasi telur R. linearis adalah 6.37 hari (Mawan et al. 2011). Solikhah (2013) melaporkan dalam hasil penelitiannya bahwa aplikasi L. lecanii pada kerapatan 109 konidia/ml dapat mema-tikan telur Helopeltis sp. sebesar 70% dan pada kerapatan 108 konidia/ml sebesar 57.50% dimana lama inkubasi telur Helopeltis sp. adalah 10.5 hari (Srikumar et al. 2013).
SIMPULAN DAN SARAN
Simpulan
Mortalitas imago D. citri tertinggi yang disebabkan infeksi B. bassiana sebe-sar 53.33%, 28.33% oleh M. anisopliae, dan 25% oleh L. lecanii, semuanya pada kerapatan 108 konidia/ml. Mortalitas serangga ditentukan oleh kerapatan konidia cendawan yang digunakan. L. lecanii tidak dapat menginfeksi telur D. citri pada kerapatan konidia mencapai 108 konidia/ml.
Saran
DAFTAR PUSTAKA
Agustin D. 2014. Keefektifan cendawan entomopatogen Beauveria bassiana (Balsa-mo) Vuillemin dan Lecanicillium lecanii (Zimm.) Zare & Gams terhadap peng-gerek batang jagung asia Ostrinia furnacalis Guenee (Lepidoptera: Crambidae) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Ahdiaty I. 2013. Pengaruh umur cendawan Beauveria bassiana (Balsamo) Vuillemin terhadap infektifitasnya pada Cylas formicarius Fabricius (Coleoptera: Brenti-dae) [skripsi]. Bogor (ID): Fakultas Pertanian, Institut Pertanian Bogor.
Aragon AR, Ravelo HG. 2000. Natural enemies of Diaphorina citri Kuw. (Homo-ptera: Psyllidae) in the central region of Cuba. Centro-Agricola 27 (3): 87. Arakawa K, Mivamolo K .2007. Flight ability of Asiatic citrus psyllid, Diaphorina
citri Kuwayama (Homoptera: Psyllidae), measured by a flight mill. Research Bulletin of the Plant Protection Service of Japan. 43: 23–26. Aviva U, Sikora RA. 1992. Use of non-target isolates of the enthomophatogenic
Verticillium lecanii (Zimm) Viegas to control the potato cyst nematode Globodera pallida (Stone). Nematol. 38 (4) : 123-130.
Barson G. 2008. Laboratory studies on the fungus Verticillium lecanii, a larval pathogen of the large elm bark beetle (Scolytus scolytus). Ann Appl Biol. 83: 207–214.
Benhamou N. 2004. Potential of the mycopparasite Verticillium lecanii to protect citrus fruit against Penicillium digigatum, the causal agent of green mold: A comparison with the effect of citosan. Biochem and Biol. 94 (7): 693-705. Besheli BA, Khambay B, Cameron S, Deadman ML, Butt TM. 2000. Inter and
intraspesific variation in destruxin production by insect pathogenesis Metarhizium spp., and its significance to pathogenesis. J of The Myco-phatology. 104: 447-452.
Bove JM. 2006. Huanglongbing: A Destructive, Newly-emerging, Century-old Disease of Citrus. J of Plant Pathology 88: 7-37.
Burge MN. 1988. Fungi in Biological Control System. Manchester (GB): Manches-ter University Pr.
Catling HD. 1970. Distribution of the psyllid vectors of citrus greening disease, with notes on the biology and bionomics of Diaphorina citri. FAO Plant Protection Bulletin. 18: 8-15.
Cloyd R. 2003. The entomopathogen Verticillium lecanii. Midwest Biological Control News. University of Illinois [Internet]. [diunduh pada 2015 Jan 6] Tersedia pada: http: // www.extension.umn.edu
Cuthbertson AGS, North JP, Walters KFA. 2005. Effect of temperature and host plant leaf morphology on the efficacy of two entomopathogen biocontrol agents of Thrips palmi (Thysanoptera: Thripidae). Bull Entomol Res. 95: 321-327.
Djuniadi D. 2003. Peranan industri pada pengelolaan hama terpadu dalam pertani-an berkelpertani-anjutpertani-an. Kongres Perhimpunpertani-an Entomologi Indonesia dpertani-an Simpo-sium Entomologi VI 2003. Cipayung, 5-7 Maret 2003.
Dos-Santos DC, Gregorio EA. 2003. Deposition of the eggshell layers in the sugar cane borrer (Lepidoptera: Pyralidae): Ultrastructure aspects. Acta Micros. 12 (1): 37-41.
Dwiastuti ME, Nawir W, Wurtantini. 2007. Uji patogenisitas jamur entomopatogen Hirsutella citriformis, Beauveria bassiana, dan Metarhizium anisopliae seca-ra eka dan dwiinfeksi untuk mengendalikan Diaphorina citri Kuwayama. J Hort. 17 (1): 75-80.
Ferron P. 1985. Fungal Control. Comprehensive Insect Phisiology. Biochem Pharmacol. 12: 313-346.
Freed S, Saleem MA, Khan MB, Naeem M. 2012. Prevalence and effectiveness of Metarhizium anisoplie against Spodoptera exigua (Lepidoptera: Noctuidae) in Southern Punjab, Pakistan. J Zoology Pakistan. 44 (3): 753-758.
Gao Y, Reitz SR, Wang J, Xu X, Lei Z. 2012. Potential of a strain of the entomopathogenic fungus Beauveria bassiana (Hypocreales: Cordycipita-ceae) as a biological control agent against western flower thrips, Frankliniella occidentalis (Thysanoptera: Thripidae). Biocontrol Science and Technology. 22(4): 491-495.
Gindin GG, Geschtovt NU, Raccah B, Barash I. 2000. Pathogenicity of Verticillium lecanii to different developmental stages of the silverleaf whitefly Bemisia argentifolii. Phytopar. 28 (3): 231-242.
Goettel MS, Inglis GD. 1997. Manual of techniques in insect pathology: Hypomy-cetes. Lacey LA, editor. California (US): Academic Pr.
Halbert SE, Nunez CA. 2004. Distribution of the asian citrus psyllid, Diaphorina citri Kuwayama (Rhynchota: Psyllidae), in the Caribbean basin. Florida En-tomologist. 87 (3).
Hall DG, Hentz MG, Meyer JM, Kriss AB, Gottwald TR, Boucias DG. 2012. Observations on the entomopathogenic fungus Hirsutella citriformis attack-ing adult Diaphorina citri (Hemiptera: Psyllidae) in a managed citrus grove. BioControl 57: 663-675.
Hasyim A, Nuraida, Trizelia. 2009. Patogenisitas jamur entomopatogen terhadap stadia telur dan larva hama kubis Crocidolomia pavonana Fabricius. J. Hor-tikultura. 19 (3): 334-343.
Himawati MK. 2003. Toksisitas Metoksifenosida terhadap Helicoverpa armigera. Agrosains 5: 1.
Hodkinson ID, White IM. 1981. The Neotropical Psylloidea (Homoptera: Insecta): an annotated check list. J Natural History 15: 491-523.
Humber RA. 1997. Manual of techniques in insect pathology: Identification. Lacey LA, editor. California (US): Academic Pr.
Inglis GD, Goettel MS, Butt TM, Strasser H. 2001. Use of Hypomyceteous Fungi for Managing Insect Pest. di dalam: Butt TM, Jacson CW, Magan N, editor. Fungi as biocontrol agents: progess, problem and potential. London (GB): CABI publishing.
Jaurhalina. 1999. Potensi Beauveria bassiana sebagai cendawan entomopatogen pada hama ulat grayak (Spodoptera litura). Agrista. 3(1): 64-67.
Kim JJ, Lee MH, Yoon CS, Kim HS, Yoo JK, Kim KC. 2001. Control of cotton aphid and greenhouse whitefly with a fungal pathogen. Biological Control of Green-house Pests. 8–15.
Klinger E. 2003. Susceptibility of adult colorado potato beetle (Leptinotarsa decemlineata) to the fungal entomopathogen Beauveria bassiana [tesis]. Maine (US): University of Maine.
Liu YH, Tsai JH. 2000. Effects of temperature on biology and life table parameters of the Asian citrus psyllid, Diaphorina citri Kuwayama (Homoptera: Psylli-dae). Annals of Applied Biology. 137: 201–206.
Luz C, Tigano MS, Silva IG, Cordeiro CMT, Aljanabi SM. 1998. Selection of Beauveria bassiana and Metarhizium anisopliae isolates to control Triato-ma infestans. Mem Inst Cruz. 93 (6): 839-846.
Mawan A, Amalia H. 2011. Statistika Demografi Riptortus linearis F. (Hemi-ptera:Alydidae) pada Kacang Panjang (Vigna sinensis L.). J Entomol Indones. 8 (1): 8-16.
Mead FW, Fasulo TR. 2011. Asian citrus psyllid, Diaphorina citri Kuwayama (In-secta: Hemiptera: Psyllidae). EENY. 33.
Meeks ETM, van Voorst S, Joosten NN, Fransen JJ, van Lenteren JC. 2002. Persistence of the fungal whitefly pathogen, Aschersonia aleyrodes, on three different plant species. Mycol Res. 104: 1234-1240.
Michaud JP, Olsen LE. 2004. Suitability of Asian citrus psyllid, Diaphorina citri, as prey for ladybeetles. Biological Control. 49: 417-431.
Murakoshi S, Suzuki A, Kanaoka M, Isogai A, Khinoe M, Tamura S. 2005. Presence of toxic substance in fungus bodies of the enthopathogenic fungi, Beaveria bassiana and Verticillium lecanii. Appl Entomol and Zoo 13 (2) : 97-102.
Neves PMOJ, Alves SB. 2004. External events related to the infection process of Cornitermes cumulans (Kollar) (Isoptera: Termitidae) by the entomopa-thogenic fungi Beauveria bassiana and Metarhizium anisopliae. Neotropi-cal Entomology. 33 (1): 051-056.
Norris KR, Caswell-Chen, Kogan M. 2003. Concept in integrated pest manage-ment. New Jersey (US): Prentice Hall.
Olivares-Bernabeu CM, Lopez-Llorcha LV. 2002. Fungal egg-parasites of plant-parasitic nematodes from Spanish soil. Rev Iberoam Micol. 19:104-110. Pacheco FLG, Wong LJG, Arroyo JIL, Guerra RR, Zapata IQ. 2013. Optimization
of pathogenicity tests for selection of native isolates of entomopathogenic fungi isolated from citrusgrowing areas of México on adults of Diaphorina citri Kuwayama (Hemiptera: Liviidae). Florida Entomologist 96 (1): 187-195.
Park H, Kim K. 2010. Selection of Lecanicillium Strains with High Virulence against Developmental Stages of Bemisia tabaci.Mycobiology. 38 (3): 210-214.
Prayogo Y, Tengkano W, Marwoto. 2005. Prospek cendawan entomopatogen Metarhizium anisopliae untuk mengendalikan ulat grayak Spodoptera litura pada kedelai. J Litbang Pertanian. 24(1): 19-26
Prayogo Y, Tengkano W. 2002. Pengaruh media tumbuh terhadap daya kecambah, sporulasi dan virulensi Metarhizium anisopliae (Metchnikoff) Sorokin iso-lat Kendalpayak pada larva Spodoptera litura. J Ilmiah Ilmu-ilmu Pertanian. 9 (4): 233−242.
Prayogo Y. 2004. Keefektifan lima jenis cendawan entomopatogen terhadap hama pengisap polong kedelai Riptortus linearis L. (Hemiptera: Alydidae) dan dampaknya terhadap predator Oxyopes javanus Thorell (Araneida: Oxyopi-dae) [tesis]. Bogor (ID): Sekolah Pascasarjana, Institut Pertanian Bogor. Prayogo Y. 2009. Kajian cendawan entomopatogen Lecanicillium lecanii (Zimm.)
(Viegas) Zare & Gams untuk menekan perkembangan telur hama penghisap polong kedelai Riptortus linearis (F.) (Hemiptera: Alydidae) [disertasi]. Bo-gor (ID): Sekalah Pascasarjana, Institut Pertanian BoBo-gor.
Rai D, Updhyay V, Mehra P, Rana M, Pandey AK. 2014. Potential of entomo-pathogenic fungi as biopesticides. Ind J Sci Res and Tech. 2(5):7-13. Sakamaki Y .2005. Possible migration of the Asian citrus psyllid, Diaphorina citri
Kuwayama (Homoptera: Psyllidae) between and within islands. Occasional Papers Kagoshima University Research Center for the Pacific Islands. 42: 121–125.
Samuels RI, Coracini LA, Martins dos Santos CA, Gava CAT. 2002. Infection of Blissus antillus (Hemiptera: Lygaeidae) Eggs by the Entomopathogenic Fu-ngi Metarhizium anisopliae and Beauveria bassiana. Biological Control. 23: 269-273.
Shinya R et al. 2008. Effect of fungal culture filtrates of Verticillium lecanii hybrid strain on Heterodera glycines eggs and juvenil. Bio Contr. 16 (5): 245-251. Sianturi NB, Pangestiningsih Y, Lubis L. 2014. Uji efektivitas jamur
entomopato-gen Beauveria bassiana (Bals.) dan Metarhizium anisopliae (Metch.) terha-dap Chilo sacchariphagus Boj. (Lepidoptera: Pyralidae) di laboratorium. J Online Agroekoteknologi. 2 (4).
Smith RJ, Grula EA. 1982. Toxic components on the larval surface of the Corn Earworm (Heliothis zea) and their effects on germination and growth of Beauveria bassiana. J. Invertebr. Pathol. (39):15-22.
Solikah DN. 2013. Infektifitas cendawan Lecanillium lecanii terhadap telur Helopeltis sp. (Hemiptera: Miridae) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Srikumar KK, Bhat PS. 2013. Biology of the tea mosquito bug (Helopeltis theivora Waterhouse) on Chromolaena odorata (L.) R.M. King & H. Rob. Chilean Journal of Agricultural Reseacrh. 73 (3): 309-314.
Steinhaus EA. 1999. The Effects of Diseases of Insect Populations. Hilgardia. 23 (9): 97-261.
Sugimoto M, Koike M, Hiyana M, Nagao H. 2003. Genetic morphological and virulence characterization of the entomophatogenic fungus Verticillium lecanii. J Invertebr Pathol. 82: 176-187.
Sule H, Muhammad R, Omar D, Hee AKW and Zazali C. 2012. Dispersion pattern and sampling of Diaphorina citri Kuwayama (Hemiptera: Psylidae) popu-lations on Citrus suhuiensis hort. Ex Tanaka in Padang Ipoh Terengganu, Malaysia. Tropical Agricultural Science 35: 25-36.
Surtikanti, Yasin M, Tandiabang J. 2011. Pengendalian hama kumbang bubuk menggunakan cendawan Beauveria bassiana Vuill. berupa tepung. Prosi-ding Seminar Nasional Serealia 2011; Maros. Maros (ID): Balai Penelitian Tanaman Serealia.
Surtikanti, Yasin M. 2009. Keefektifan entomopatogenik Beauveria bassiana Vuill. dari berbagai media tumbuh terhadap Spodoptera litura F. (Lepidoptera : Noc-tuidae) di laboratorium; 2009; Maros. Maros (ID): Balai Penelitian Tanaman Serealia.
Tanada Y, Kaya HK. 1993. Insect Pathology. California (US): Academic Pr. Inc.
Trizelia. 2005. Cendawan entomopatogen Beauveria bassiana (Bals.) Vuill. (Deutero-mycotina: Hypomycetes): keragaman genetik, karakterisasi fisiologi dan viru-lensinya terhadap Crocidolomia pavonana (F.) (Lepidoptera: Pyralidae) [disertasi] Bogor (ID): Institut Pertanian Bogor.
Vey A, Hoagland RE, Butt TM. 2001. Toxic metabolites of fungal biocontrol agent. Di dalam: Fungi as biocontrol agent, progress, problem, and potential. Butt TM, Jackson C and Magan N, editor. Oxford (UK): CABI Publishing. 246. Vu VH, Hong SII, Kim K. 2007. Selection of entomopathogenic fungi for aphid
control. J Bio Sci and Bio Engine. 104 (6): 498-505.
Widianti D. 2010. Virulensi beberapa isolat Metarhizium spp terhadap larva Spodo-ptera litura Fabricius (Lepidoptera: Noctuidae) [Skripsi]. Padang (ID): Uni-versitas Andalas.
Wijaya IN, Adiartayasa W, Sritamin M, Yuliadhi KA. 2010. Dinamika populasi Diaphorina citri Kuwayama (Homoptera: Psyllidae) dan deteksi CVPD de-ngan teknik PCR. J Entomol Indones. 7 (2): 78-87.
Wijaya IN, Sritamin M, Adnyana MM, Adiartayasa W, Bagus IGN. 2012. Pendi-dikan dan pelatihan pengendalian kutu loncat jeruk (Diaphorina citri Ku-wayama) sebagai hama dan vektor penyakit CVPD di Desa Taro, Gianyar. Udayana Mengabdi. 11 (2): 93 – 95.
Wijaya IN. 2003. Diaphorina citri Kuwayama (Homoptera: Psyllidae): Bioekologi dan peranannya sebagai vektor penyakit CVPD pada tanaman jeruk. [Diser-tasi]. Bogor (ID): Sekolah Pascasarjana, Institut Pertanian Bogor.
Wirawan IGP, Sulistyowati L, Wijaya IN. 2004. Penyakit CVPD pada Tanaman Je-ruk. Analisis Baru Berbasis Bioteknologi. Direktur Jenderal Bina Produksi Hortikultura: Departemen Pertanian.
Yang Y, Huang M, Andrew G, Beattie C, Xia Y, Ouyang G, Xiong J. 2006. Distri-bution, biology, ecology and control of the psyllid Diaphorina citri Kuwa-yama, a major pest of citrus: A status report for China. International Journal of Pest Management. 52 (4): 343-352.