GENOTIPE HOTONG [Setaria italica (L.) Beauv]
NIKE KARJUNITA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR
Dengan ini saya menyatakan bahwa tesis berjudul “Respon Akar terhadap Cekaman Salinitas dan Isolasi Gen SiNAC065 pada Empat Genotipe Hotong [Setaria italica (L.) Beauv]” adalah benar karya saya dengan arahan dari komisi
pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2016
Nike Karjunita
SiNAC065 pada Empat Genotipe Hotong [Setaria italica (L.) Beauv]. Dibimbing oleh SINTHO WAHYUNING ARDIE dan NURUL KHUMAIDA.
Cekaman salinitas telah mempengaruhi sekitar 19.5% lahan pertanian beririgasi di dunia dan merupakan salah satu masalah pada lahan pasang surut di Indonesia yang luasnya mencapai 20 juta ha. Foxtail millet (Setaria italica L. Beauv) atau yang dikenal sebagai hotong merupakan salah satu tanaman yang potensial dikembangkan pada lahan salin karena toleransinya yang cukup baik terhadap cekaman salinitas. Walaupun cukup toleran terhadap cekaman salinitas, taraf toleransi hotong terhadap cekaman tersebut dilaporkan bervariasi antar genotipe. Perbandingan respon antara genotipe toleran dan peka terhadap cekaman salinitas dapat mengidentifikasi karakter penting, baik morfologi, anatomi, fisiologi dan molekuler pada kondisi cekaman tersebut.
Akar merupakan organ tanaman yang pertama kali terpapar cekaman pada cekaman salinitas dan modifikasi akar merupakan respon yang menentukan toleransi tanaman terhadap cekaman salinitas. Respon tanaman secara anatomi dan morfologi terhadap cekaman salinitas ditentukan oleh sejumlah gen regulator (regulatory genes) yang disebut faktor transkripsi. Faktor transkripsi dari famili gen NAC (NAM, ATAF, CUC) merupakan salah satu faktor transkripsi yang terlibat erat dalam respon terhadap cekaman salinitas dan pembentukan akar lateral melalui lintasan sinyal etilen dan auksin.Gen SiNAC065 telah diisolasi dari tanaman hotong dan ekspresinya dilaporkan terinduksi oleh cekaman salinitas dan oleh aplikasi etilen eksogen. Oleh karena itu tujuan dari penelitian ini adalah (1) mempelajari respon anatomi, morfologi dan fisiologi tanaman hotong terhadap cekaman salinitas, khususnya peran etilen dalam modifikasi karakter akar, dan (2) mengisolasi dan mengkarakterisasi gen SiNAC065 terkait respon terhadap cekaman salinitas pada genotipe hotong toleran dan peka salinitas. Penelitian ini terdiri atas 2 percobaan. Percobaan 1 terdiri atas 2 sub percobaan, yaitu percobaan 1a terkait respon anatomi akar genotipe hotong toleran dan peka terhadap cekaman salinitas, dan percobaan 1b terkait respon genotipe hotong toleran dan peka cekaman salinitas terhadap aplikasi regulator etilen eksogen. Percobaan 1 dilakukan di rumah kaca kebun percobaan Cikabayan dan Laboratorium mikroteknik AGH-IPB pada bulan Mei hingga Agustus 2015.
kontrol (tanpa regulator etilen), etilen eksogen (12 ppm etephon) dan inhibitor aksi etilen (0.6µM AgNO3). Hasil percobaan menunjukkan bahwa interaksi antara konsentrasi NaCl dengan regulator etilen berpengaruh terhadap tinggi tajuk, jumlah daun, bobot kering tajuk dan pada beberapa variabel anatomi akar, yaitu tebal korteks, diameter stele, diameter akar dan jumlah protoxylem. Aplikasi etilen secara eksogen pada cekaman salinitas 60 mM semakin memperparah dampak cekaman, dengan semakin terhambatnya pertumbuhan tinggi tajuk, panjang akar dan berkurangnya bobot kering tajuk. Cekaman salinitas menyebabkan peningkatan diameter akar dengan meningkatnya tebal epidermis, tebal korteks dan diameter stele, sementara itu aplikasi etilen eksogen (12 ppm etephon) dapat mempertahankan ukuran diameter akar, tebal korteks, dan diameter stele seperti kondisi kontrol. Sebaliknya, aplikasi inhibitor etilen (0.6µM AgNO3) menyebabkan peningkatan diameter akar yang signifikan pada masing-masing genotipe. Korelasi negatif nyata antara diameter akar dengan jumlah daun dan bobot basah tajuk, menunjukkan bahwa semakin besar diameter akar menyebabkan penurunan jumlah daun dan mengurangi bobot basah tajuk. Aplikasi etilen eksogen lebih menekan tinggi tajuk pada genotipe peka (ICERI-4, ICERI-10) dibandingkan pada genotipe toleran (ICERI-5 dan ICERI-6).
Percobaan 1 menunjukkan bahwa respon hotong terhadap cekaman salinitas dipengaruhi oleh etilen. Gen SiNAC065 merupakan salah satu gen faktor transkripsi yang ekspresinya terinduksi oleh cekaman salinitas dan aplikasi etilen eksogen. Oleh karena itu, Percobaan 2, Isolasi gen SiNAC065 terkait respon tanaman terhadap cekaman salinitas pada hotong, dilaksanakan di Laboratorium
Plant Molecular Biology, Departemen Agronomi dan Hortikultura, IPB dan
Laboratory of Environmental Stress Tolerance Mechanisms, The University of Tokyo. Materi genetik yang digunakan adalah empat genotipe hotong (ICERI-4, ICERI-5, ICERI-6 dan ICERI-10). Fragmen berukuran ± 1300 pb telah teramplifikasi dari DNA genom keempat genotipe hotong menggunakan primer spesifik gen SiNAC065. Perunutan basa nukleotida menggunakan metode direct sequencing pada keempat fragmen yang teramplifikasi dan analisis kesejajaran menggunakan BLAST menunjukkan bahwa fragmen tersebut merupakan homolog gen SiNAC065. Metode direct sequencing hanya dapat membaca sebagian dari fragmen. Oleh karena itu, sub-cloning ke dalam plasmid pMD20 dilakukan agar sekuen full length dari keempat fragmen tersebut dapat diperoleh. Hasil perunutan basa nukleotida pada fragmen yang diinsersikan ke dalam pMD20 menunjukkan bahwa gen SiNAC065 yang diisolasi dari DNA genom keempat genotipe hotong berukuran 1 265 pb. Gen tersebut memiliki satu intron dan dua ekson. Gabungan antara kedua ekson merupakan coding sequence yang menyandikan 325 asam amino. Pensejajaran asam amino hasil translasi fragmen gen SiNAC065 dari empat genotipe hotong menunjukkan bahwa daerah terkonservasi gen SiNAC065 berada pada asam amino ke 19-325 dan memiliki 8 motif terkonservasi. Berdasarkan motif terkonservasinya, SiNAC065 dari genotipe ICERI-4, ICERI-5, ICERI-6, dan ICERI-10 termasuk ke dalam kelompok gen SNAC (stress responsive NACs) yang terlibat dalam respon terhadap cekaman abiotik.
Supervised by SINTHO WAHYUNING ARDIE and NURUL KHUMAIDA. Foxtail millet (Setaria Italica L. Beauv), also known as hotong in Indonesian, is one of carbohydrate sources with a fairly good tolerance to salinity stress. Salinity stress has affected about 19.5% of irrigated agricultural land in the world and is one of the important crop production limiting factors in the tidal area in Indonesia (approx. 20 million ha). Foxtail millet is also has high nutritional values and it is potential to be developed as functional food. Although foxtail millet has been considered as one of the salinity tolerant crops, the level of tolerance was reported to be varied among genotypes. Comparison of response between salt tolerant and salt sensitive foxtail millet genotypes to salinity stress may identify important morphological, anatomical, physiological and molecular characters under the stress condition.
Root is a plant organ that is first exposed to stress under salinity and root modification is a response that determine crop tolerance to salinity stress. Anatomical and morphological responses of plant to salinity are determined by a number of regulatory genes called transcription factors. Transcription factor gene family of NAC (NAM, ATAF, CUC) is a transcription factor that is tightly involved in the response to salinity stress and in the formation of lateral roots through ethylene and auxin signaling pathway. SiNAC065 gene has been isolated from foxtail millet and its expression level was induced by salinity and by the application of exogenous ethylene. Therefore the objectives of this study were (1) to study the root anatomical, morphological and physiological responses of foxtail millet genotypes under salinity, with the emphasize in the role of ethylene in the root anatomy modification, and (2) to isolate and characterize the SiNAC065
genes from salinity tolerant- and salinity sensitive- foxtail millet genotypes.
The study consisted of two experiments. Experiment 1 consisted of two sub-experiments, i.e Experiment 1a. Root Anatomical Responses of Salt-Tolerant and Salt-Sensitive Foxtail Millet Genotypes under Salinity Stress, and Experiment 1b. Responses of Salt-Tolerant and Salt-Sensitive Foxtail Millet Genotypes to Exogenous Application of Ethylene Regulators under Salinity Stress. Experiment 1 was conducted in a greenhouse at Cikabayan Experimental Field and in the Microtechnique Laboratory AGH-IPB from May to August 2015.
Sub-experiment 1b was arranged in randomized completely group design with two factors and three replications. The first factor was NaCl concentration consisted of 0 and 60 mM. The second factor was exogenous ethylene regulator application, consisted of control (without any exogenous ethylene regulator application), ethylene releaser (12 ppm etephon) and ethylene inhibitor (0.6 μM AgNO3). Our results showed that interaction between salt stress and exogenous ethylene regulator application significantly affected plant height, number of leaves, shoot dry weight and some root anatomy variables, such as cortex thickness, stele diameter, root diameter and number of protoxylem. Exogenous ethylene application (12 ppm ethephon) exacerbated the negative effect of salinity, i.e. higher reduction of plant height, root length and shoot dry weight. Similar to the results in Experiment 1a, salinity increased epidermis and cortex thickness and root diameter; however, exogenous ethylene application (12 ppm ethephon) inhibits the increase in those root anatomical variables. In contrast to exogenous ethylene application, application of ethylene inhibitor (0.6 M AgNO3) induced a significant increase in root diameter. Significant negative correlation was observed between root diameter, number of leaves and shoot fresh weight, indicating higher root diameter would reduce number of leaves and shoot fresh weight. The plant height suppression due to exogenous ethylene application under salinity stress was more pronounced in the sensitive genotypes (ICERI-4 and ICERI-10) than in the tolerant genotypes (ICERI-5 and ICERI-6).
The first experiment showed that ethylene is involved in the response of foxtail millet to salinity stress. Therefore, the Second Experiment, Isolation of
SiNAC065 Genes from Salt-Tolerant and Salt-Sensitive Foxtail Millet, was conducted in the Laboratory of Plant Molecular Biology, Department of Agronomy and Horticulture, IPB and in the Laboratory of Environmental Stress Tolerance Mechanisms, The University of Tokyo. Fragments (+ 1300 bp) were successfully amplified from the genomic DNA of four foxtail millet genotypes (ICERI-4, ICERI-5, ICERI-6 and ICERI-10) using gene specific primer. Direct sequencing of the four fragments and BLAST analysis confirmed that the four fragments were SiNAC065 gene homolog. Since direct sequence method could not read the full length sequence of the genes, the SiNAC065 fragments were sub-cloned into pMD20 plasmid and were further sequenced. Sequence analysis results showed that the SiNAC065 genes isolated from 4, 5, ICERI-6 and ICERI-10 genotypes were 12ICERI-65 bp in length with one intron and two exons. The two exons encode 325 amino acids with the conserved domain located between amino acid 19-325. The SiNAC065 protein identified in this study have 8 conserved motives in the conserved region which categorized them as SNAC (stress responsive NACs) orthologs that are involved in the abiotic stress responses.
© Hak Cipta Milik IPB, Tahun 2016 Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
GENOTIPE HOTONG [Setaria italica (L.) Beauv]
NIKE KARJUNITA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Pemuliaan dan Bioteknologi Tanaman
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Puji syukur penulis ucapkan kehadirat Allah SWT atas berkat rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan tesis ini. Tesis yang berjudul “Respon Akar terhadap Cekaman Salinitas dan Isolasi Gen SiNAC065 pada Empat Genotipe Hotong [Setaria italica (L.) Beauv]” disusun sebagai salah satu syarat
kelulusan untuk memperoleh gelar Magister Sains pada Fakultas Pertanian, Institut Pertanian Bogor.
Ucapan terima kasih diberikan kepada komisi pembimbing, Dr Sintho Wahyuning Ardie, SP MSi dan Dr Ir Nurul Khumaida, MSi. Terima kasih juga penulis sampaikan kepada dosen penguji Dr Edi Santosa, SP MSi dan kepada Ketua Program Studi Pemuliaan dan Bioteknologi Tanaman Dr Ir Yudiwanti Wahyu EK, MS. Ucapan terima kasih disampaikan kepada Prof. Tetsuo Takano atas kesempatan menganalisis sebagian data molekuler di Laboratory of Environmental Stress Tolerance Mechanisms, The University of Tokyo. Terima kasih kepada yang tercinta kedua orang tua Ayahanda Karnaini Mochtar, AMa Pd dan Ibunda Animas, SPd serta seluruh keluarga atas do‟a, restu dan motivasi selama penulis menempuh pendidikan pascasarjana di IPB. Kemudian ucapan terima kasih juga penulis sampaikan kepada seluruh staf pengajar dan teknisi laboratorium serta teman-teman S1, S2, S3 dan seluruh pihak yang telah ikut mendo‟akan, mendukung dan memotivasi hingga terselesaikannya tesis ini.
Sebagian dari tesis ini telah dipresentasikan pada The International Congress and General Meeting ISSAAS 2015 (Tokyo, 7 November 2015). Penulis berharap semoga tesis ini dapat menambah wawasan ilmu pengetahuan dan berguna bagi para pembaca untuk penelitian kedepan.
Bogor, Juni 2016
DAFTAR TABEL vi
Respon Anatomi Akar terhadap Cekaman Salinitas 7 Peran Etilen dalam Respon Tanaman terhadap Cekaman Salinitas 7
Faktor Transkripsi NAC 8
3 PERBEDAAN RESPON ANATOMI AKAR GENOTIPE
hotong terhadap variabel anatomi akar (5 HSP) 12 2 Tebal epidermis (TE), tebal korteks (TK), diameter akar (DA),
diameter metaxylem (DMX), jumlah protoxylem (ΣPX) dan jumlah rambut akar (ΣRA) bibit hotong pada 0, 60, dan 120 mM NaCl pada 5
HSP 13
3 Korelasi antar variabel anatomi akar hotong 13
4 Rekapitulasi sidik ragam pengaruh konsentrasi NaCl dan regulator etilen terhadap variabel anatomi akar hotong pada 5 HSP 20 5 Rekapitulasi sidik ragam pengaruh konsentrasi NaCl dan regulator
etilen terhadap pertumbuhan bibit hotong pada 14 HSP 21 6 Tebal epidermis (TE) dan jumlah protoxylem (ΣPX) bibit hotong pada
0 dan 60 mM NaCl pada 5 HSP 22
7 Hasil uji-t beberapa variabel anatomi akar hotong pada genotipe toleran (ICERI-5 dan ICERI-6) dan peka (ICERI-4 dan ICERI-10) pada 14
HSP pada 60 mM NaCl 22
8 Rata-rata tinggi tajuk (TT), panjang akar (PA), jumlah daun (JD), bobot basah tajuk (BBT), bobot basah akar (BBA), bobot kering tajuk (BKT), bobot kering akar (BKA) 4 genotipe hotong pada konsentrasi NaCl (0
dan 60 mM) 14 HSP 23
9 Hasil uji-t pertumbuhan bibit hotong pada genotipe toleran (ICERI-5 dan ICERI-6) dan peka (ICERI-4 dan ICERI-10) pada 14 HSP pada 60
mM NaCl 23
10 Korelasi antar variabel pengamatan genotipe hotong toleran dan peka
cekaman salinitas 25
11 Tebal epidermis (µm), jumlah metaxylem, diameter metaxylem (DMX) dan jumlah protoxylem (ΣPX) akar hotong pada 5 HSP 26 12 Hasil uji-t beberapa variabel anatomi akar hotong pada genotipe toleran
(ICERI-5 dan ICERI-6) dan peka (ICERI-4 dan ICERI-10) pada 14 HSP pada kontrol, 12 ppm etephon dan 0.6 M AgNO3 pada 60 mM
NaCl 27
13 Rata-rata tinggi tajuk (TT), panjang akar (PA), jumlah daun (JD), bobot basah tajuk (BBT), bobot basah akar (BBA), bobot kering tajuk (BKT), bobot kering akar (BKA) 4 genotipe hotong terhadap regulator etilen
saat 14 HSP 28
14 Hasil uji-t pertumbuhan bibit hotong pada genotipe toleran (ICERI-5 dan ICERI-6) dan peka (ICERI-4 dan ICERI-10) pada 14 HSP pada
kontrol, 12 ppm etephon dan 0.6 M AgNO3 29
15 Estimasi konsentrasi DNA genom 4 genotipe hotong berdasarkan
SiNAC065 pada genotipe hotong [Setaria italica (L.) Beauv] toleran
dan peka salinitas 4
2 Struktur biji hotong 6
3 Konvergensi jalur sinyal cekaman abiotik dan biotik 8
4 Penampang melintang akar bibit hotong 5 HSP 11
5 Keragaan ujung akar genotipe hotong toleran dan peka salinitas di
bawah perlakuan NaCl (0, 60, 120 mM) 12
6 Keragaan irisan melintang (±3 mm) dari ujung akar terpanjang genotipe hotong toleran dan peka salinitas di bawah perlakuan NaCl
(0, 60, 120 mM) 14
7 Tebal epidermis(A), jumlah rambut akar (B), dan jumlah protoxylem (C) pada genotipe hotong toleran (ICERI-5 dan ICERI-6) dan peka (ICERI-4 dan ICERI-10) salinitas pada 0, 60 dan 120 mM NaCl 15 8 Keragaan irisan melintang (±3 mm) dari ujung akar terpanjang
genotipe hotong toleran dan peka salinitas pada konsentrasi NaCl 0
dan 60 mM NaCl pada 5 HSP 30
9 Tebal korteks (A), diameter stele (B),diameter akar (C), dan jumlah protoxylem (D) pada genotipe hotong toleran (ICERI-5 dan ICERI-6) dan peka (ICERI-4 dan ICERI-10) dengan konsentrasi NaCl (0 dan 60 mM) dan regulator etilen (+ET= +12 ppm etephon, +Ag+= + 0.6 µM
AgNO3) pada 5 HSP 31
10 Tinggi tajuk (A), jumlah daun (B), bobot kering tajuk (C) bibit hotong terhadap konsentrasi NaCl dan aplikasi regulator etilen pada 14 HSP 32 11 Keragaan bibit hotong pada 14 HSP tanpa cekaman salinitas (0 mM
NaCl) dan dengan cekaman salinitas (60 mM NaCl) 33 12 Integritas pita DNA genom daun hotong genotipe ICERI-4, ICERI-5,
ICERI-6 dan ICERI-10 38
13 Visualisasi hasil elektroforesis amplifikasi random primer H5 pada 4
genotipe hotong 39
14 Elektroforegram produk amplifikasi PCR yang berasal dari DNA genom 4 genotipe hotong, menggunakan pasangan primer SiNAC065 40 15 Hasil pensejajaran nukleotida SiNAC065 yang berasal dari genotipe
hotong ICERI-4, ICERI-5, ICERI-6, ICERI-10, dan SiNAC065 dari genotipe Yugu1 (nomor aksesi GenBank: XM_004971405.1)
menggunakan CLUSTAL X (1.83) 42
16 Prediksi asam amino SiNAC065 dari hotong genotipe ICERI-4,
ICERI-5, ICERI-6 dan ICERI-10 44
17 Dendogram hasil filogenetik sekuen residu asam amino yang diprediksi dari SiNAC065 genotipe hotong 4, 5,
PENDAHULUAN
Latar Belakang
Salinitas merupakan kondisi sub-optimal akibat akumulasi garam berlebih pada tanah, seperti NaCl dan Na2SO4 (Li et al. 2006) sehingga menyebabkan electrical conductivity (EC) > 4.0 dS.m-1 (Muscolo et al. 2011). Cekaman salinitas telah mempengaruhi sekitar 19.5% lahan pertanian beririgasi di dunia (Koyro et al. 2012) dan merupakan salah satu masalah pada lahan pasang surut di Indonesia yang luasnya mencapai 20 juta ha (Alihamsyah 2004). Salinitas menyebabkan hambatan dalam pertumbuhan dan produktivitas tanaman (Hasanuzzaman et al. 2013) akibat dampak negatif toksisitas ion, cekaman osmotik, cekaman oksidatif dan defisiensi hara (Zhu 2007).
Foxtail millet (Setaria italica L. Beauv) atau yang dikenal sebagai hotong merupakan salah satu tanaman yang potensial dikembangkan pada lahan salin karena toleransinya yang cukup baik terhadap cekaman salinitas (Kafi et al. 2009). Selain toleransinya yang cukup baik pada cekaman salinitas, kandungan nutrisi hotong yang tinggi menjadikan tanaman ini potensial sebagai pangan fungsional. Biji hotong mengandung karbohidrat sebesar 72.8% (Cheng dan Dong 2010), yang setara dengan kandungan karbohidrat pada beras (80.4%) (Vaclavik dan Christian 2003). Biji hotong juga dilaporkan memiliki indeks glikemik yang rendah (Jali et al. 2012), serta kandungan antioksidan (Suma dan Urooj 2012) dan protein (Amadou et al. 2013) yang tinggi. Protein yang diekstrak dari kulit biji hotong dilaporkan berpotensi sebagai anti kanker usus (Shan et al. 2014). Adaptasi yang baik pada lingkungan sub-optimal dan kandungan nutrisi yang tinggi menjadikan hotong potensial sebagai sumber pangan alternatif. Walaupun hotong dilaporkan memiliki adaptasi yang cukup baik terhadap salinitas (Kafi et al. 2009), namun toleransi hotong terhadap salinitas bervariasi tergantung genotipe (Krishnamurthy et al. 2014; Ardie et al. 2015).
Akar merupakan organ tanaman yang pertama kali terpapar cekaman pada cekaman salinitas dan modifikasi akar merupakan respon yang menentukan toleransi tanaman terhadap cekaman salinitas (Julkowska et al. 2014). Cekaman salinitas dilaporkan mempengaruhi arsitektur akar (Julkowska et al. 2014; Zhang
et al. 2015) dan anatomi akar (Muhammad et al. 1999; Akram et al. 2002; Farhana et al. 2014). Perubahan arsitektur akar (Julkowska et al. 2014) dan anatomi akar (Akram et al. 2002; Muscolo et al. 2004; Younis et al. 2013) dilaporkan berasosiasi dengan toleransi tanaman terhadap cekaman salinitas.
tahapan selanjutnya dapat menyebabkan hambatan pertumbuhan pada cekaman salinitas.
Respon tanaman secara morfologi dan fisiologi terhadap cekaman salinitas merupakan respon ikutan (down-stream responses) yang diinduksi oleh respon awal (up-stream response) pada tingkat molekuler. Faktor transkripsi (transcription factor) dari famili gen NAC (NAM, ATAF, CUC) merupakan up-stream genes yang dilaporkan terlibat erat dalam respon terhadap cekaman abiotik, termasuk salinitas (Olsen et al. 2005). Anggota famili gen NAC dari A. thaliana,
AtNAC2, dilaporkan terlibat dalam respon terhadap cekaman salinitas dan pembentukan akar lateral melalui lintasan sinyal etilen dan auksin (He et al. 2005). Gen SiNAC065 telah diisolasi dari tanaman hotong dan ekspresinya dilaporkan terinduksi oleh cekaman kekeringan (20% PEG-6000), salinitas (250 mM NaCl) dan 100 M ethephon (Puranik et al. 2013).
Toleransi terhadap cekaman salinitas pada beberapa genotipe hotong pada tahap perkecambahan dan bibit dalam kultur hara telah dilaporkan oleh Ardie et al. (2015). Perbandingan respon antara genotipe toleran dan peka terhadap cekaman salinitas dapat mengidentifikasi karakter penting, baik morfologi, anatomi, fisiologi dan molekuler pada kondisi cekaman tersebut. Penelitian ini bertujuan untuk mempelajari respon tanaman hotong terhadap cekaman salinitas, khususnya peran etilen dalam modifikasi karakter akar, serta mengisolasi dan mengkarakterisasi gen SiNAC065 terkait respon terhadap cekaman salinitas pada genotipe hotong toleran dan peka salinitas.
Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Mempelajari respon anatomi, morfologi dan fisiologi tanaman hotong terhadap cekaman salinitas, khususnya peran etilen dalam modifikasi karakter akar;
2. Mengisolasi dan mengkarakterisasi gen SiNAC065 terkait respon terhadap cekaman salinitas pada empat genotipe hotong.
Manfaat Penelitian
Manfaat penelitian ini adalah:
1. Perbandingan respon antara genotipe toleran dan peka terhadap cekaman salinitas dapat mengidentifikasi karakter penting, baik morfologi, anatomi, fisiologi dan molekuler pada kondisi cekaman tersebut.
2. Mendapatkan informasi mengenai peran etilen dalam modifikasi karakter akar, sebagai salah satu hormon yang berperan dalam merespon perubahan fisiologi tanaman terhadap cekaman salinitas.
3. Gen SiNAC065 yang diisolasi dari genotipe hotong toleran dan peka salinitas merupakan informasi penting dalam mendukung program pemuliaan tanaman menggunakan pendekatan bioteknologi.
Ruang Lingkup Penelitian
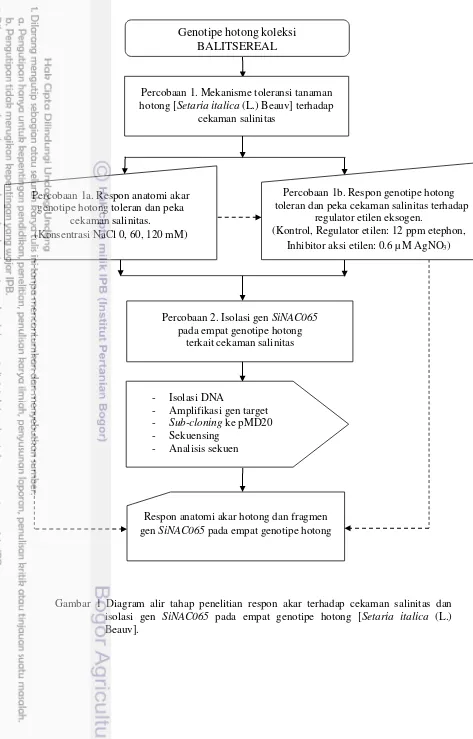
Gambar 1 Diagram alir tahap penelitian respon akar terhadap cekaman salinitas dan isolasi gen SiNAC065 pada empat genotipe hotong [Setaria italica (L.) Beauv].
- Isolasi DNA
- Amplifikasi gen target - Sub-cloning ke pMD20 - Sekuensing
- Analisis sekuen
Genotipe hotong koleksi BALITSEREAL
Percobaan 1. Mekanisme toleransi tanaman hotong [Setaria italica (L.) Beauv] terhadap
cekaman salinitas
Percobaan 1a. Respon anatomi akar genotipe hotong toleran dan peka
cekaman salinitas.
(Konsentrasi NaCl 0, 60, 120 mM)
Percobaan 1b. Respon genotipe hotong toleran dan peka cekaman salinitas terhadap
regulator etilen eksogen.
(Kontrol, Regulator etilen: 12 ppm etephon, Inhibitor aksi etilen: 0.6 µM AgNO3)
Percobaan 2. Isolasi gen SiNAC065 pada empat genotipe hotong
terkait cekaman salinitas
TINJAUAN PUSTAKA
Hotong (Setaria italica L. Beauv)
Hotong atau foxtail millet (Setaria italica L. Beauv) menempati urutan keenam sebagai serealia utama dan dikonsumsi sepertiga penduduk dunia yang hidup di daerah kering dan semi-kering (McDonough et al. 2000). Rata-rata produktivitas hotong di dunia 0.8-0.9 ton ha-1 (FAO 2014). Hotong merupakan salah satu jenis spesies millet yang paling banyak dibudidayakan dalam urutan produksi di seluruh dunia selain pearl millet (Pennisetum glaucum), proso millet (Panicum miliaceum), dan finger millet (Eleusine coracana) (Baker 2003). Hotong tersebar di berbagai wilayah di Indonesia, diantaranya adalah Pulau Buru, Enrengkang (Sulawesi Selatan), Pulau Rote dan Pulau Sumba (Alamendah 2015; Nurmala 2003).
Hotong termasuk dalam famili Graminae (Poaceae) (Hubbard 1915) yang merupakan tanaman semusim penghasil karbohidrat (Andoko 2001). Biji hotong merupakan bagian yang dikonsumsi sebagai sumber karbohidrat. Sulistiyowati (2015) melaporkan bahwa biji hotong memiliki panjang 0.58-0.76 mm, diameter biji 0.73-1.22 mm, dengan kisaran bobot 100 butir 0.09-0.28 g. Menurut Zhang et al. (2011), biji hotong terdiri atas 3 bagian yaitu: (1) kulit buah luar; (2) kulit buah dalam; dan (3) kulit biji luar, yang terdiri atas kulit ari dan kulit biji dalam (Gambar 2). Biji hotong memiliki kandungan karbohidrat yang cukup tinggi yaitu 72.8% (Cheng dan Dong 2010), dengan indeks glikemik yang rendah (Jali et al. 2012), kandungan antioksidan (Suma dan Urooj 2012) dan kandungan protein (Amadou et al. 2013) yang tinggi. Kandungan protein kasar hotong lebih tinggi 1-2% dibandingkan sorgum, dan kandungan lisin hotong lebih tinggi 21% dibandingkan jagung dan 36% dibandingkan sorgum (Tirajoh et al. 2012). Selain karbohidrat dan protein, kandungan nutrisi biji hotong per 100 g adalah vitamin B1 (37%), B2 (24%), B3 (31%), B5 (17%), B6 (29%), B9 (21%), dan mineral kalsium (1%), besi (23%), magnesium (32%), fosfor (41%), kalium (4%), dan seng (18%) (USDA 2015). Hotong juga dilaporkan berpotensi sebagai anti kanker usus (Shan et al. 2014).
Tanaman ini memiliki batang yang kecil dan tegak, dengan kisaran tinggi 60-120 cm. Sistem perakaran rapat. Daunnya tunggal berbentuk garis, panjang antara 16-32 cm dan lebar 1.5-2.5 cm dengan bagian ujung daun runcing. Bunga hotong menyerupai bulir dengan panjang 8-18 cm dan tangkai malai berkisar 25-30 cm, tegak atau melengkung. Biji berbentuk oval dengan warna yang bervariasi, kuning pucat, jingga, merah, hingga cokelat atau hitam (Maim dan Rachie 1971).
Gambar 2 Struktur biji Hotong (Zhang et al. 2011)
Cekaman Salinitas
Salinitas secara sederhana dapat diartikan sebagai suatu keadaan dimana garam dapat larut dalam jumlah yang berlebihan dan berakibat buruk bagi pertumbuhan tanaman. Garam-garam yang menyebabkan cekaman pada tanaman antara lain adalah NaCl, NaSO4, CaCl2, MgSO4, MgCl2 yang terlarut dalam air. Sebagian ion-ion garam akan terhidrolisis di dalam larutan tanah sehingga dapat mengubah pH larutan menjadi asam atau basa dan mempengaruhi daya hantar listrik (Vuorinen et al. 2006). Menurut Follet et al. (1981), tanah salin memiliki pH < 8.5 dengan daya hantar listrik > 4 mmhos.cm-1.
Follet et al. (1981) mengklasifikasikan tanah menurut salinitas atas tiga kelompok berdasarkan hasil pengukuran daya hantar listrik sebagai berikut :
1. Tanah salin dengan daya hantar listrik > 4.0 mmhos.cm-1, pH < 8.5 dan Na-dd < 15% dengan kondisi fisik normal. Kandungan garam larutan dalam tanah dapat menghambat perkecambahan, penyerapan unsur hara dan pertumbuhan tanaman.
2. Tanah sodik dengan daya hantar listrik < 4.0 mmhos.cm-1, pH > 8.5 dan Na-dd > 15% dengan kondisi fisik buruk. Garam yang terlarut dalam tanah relatif rendah, dan keadaan tanah cenderung terdispersi dan tidak
permeable terhadap air hujan dan air irigasi.
Respon Anatomi Akar terhadap Cekaman Salinitas
Akar merupakan organ pokok tanaman yang berperan penting dalam menjaga kelangsungan penyerapan hara dan air serta bertanggung jawab dalam menjaga kelangsungan hidup tanaman (Petricka et al. 2012; Giehl et al. 2014). Akar adalah bagian tanaman yang pertama kali terpapar cekaman salinitas. Tingkat pertumbuhan akar ditentukan melalui pembelahan, diferensiasi dan pemanjangan sel (Bennett dan Scheres 2010; Petricka et al. 2012; Giehl et al. 2014). Modifikasi akar merupakan respon yang menentukan toleransi tanaman terhadap cekaman salinitas. Julkowska et al. (2014) melaporkan bahwa konsentrasi NaCl di atas 75 mM menyebabkan penurunan panjang akar primer, panjang akar lateral dan jumlah akar lateral pada 4 genotipe Arabidopsis thaliana, perubahan arsitektur akar yang terjadi berasosiasi dengan rasio Na+/K+ pada tajuk tanaman. Selain arsitektur akar, dampak salinitas juga dilaporkan mempengaruhi anatomi akar. Respon anatomi akar bervariasi, tergantung pada spesies tanaman. Farhana et al. (2014) melaporkan cekaman salinitas 200 mM menurunkan jumlah dan diameter metaxylem pada akar jagung (Zea mays). Sebaliknya, jumlah dan diameter pembuluh xylem (metaxylem) pada akar bibit Kikuyu (Pennisetum clandestum Hoechst) dilaporkan meningkat pada kondisi salinitas (Muscolo et al.
2004).
Peran Etilen dalam Respon Tanaman terhadap Cekaman Salinitas
Etilen merupakan zat pengatur tumbuh berupa gas dalam suhu ruang memiliki struktur kimia yang sederhana, dengan rumus molekul C2H4 (Abeles 1973; Cawse et al. 1980). Produksi etilen bergantung pada tipe jaringan, spesies tumbuhan, dan tingkatan perkembangan (Salisbury dan Ross 1995). Etilen dibentuk dari metionin melalui 3 proses (McKeon et al. 1995), yaitu 1. ATP merupakan komponen penting dalam sintesis etilen. ATP dan air akan membuat metionin kehilangan 3 gugus fosfat. 2. Asam 1-amino siklopropana-1-karboksilat sintase (ACC-sintase) kemudian memfasilitasi produksi ACC dan SAM (S-adenosil metionin). 3. Oksigen dibutuhkan untuk mengoksidasi ACC dan memproduksi etilen. Reaksi ini dikatalisasi menggunakan enzim pembentuk etilen. Etilen dikategorikan sebagai hormon alami untuk penuaan dan pemasakan dan secara fisiologis sangat aktif dalam konsentrasi sangat rendah (<0.005 µL.L-1) (Wills et al. 2000).
Etilen terlibat secara fungsional dalam mengatur respon terhadap cekaman abiotik, seperti kekeringan, salinitas dan suhu tinggi (Fujita et al. 2006). Sejumlah studi melaporkan bahwa produksi etilen yang tinggi diperlukan untuk meningkatkan toleransi tanaman terhadap cekaman salinitas. Cao et al. (2007) melaporkan bahwa aplikasi ACC (1-aminocylopropane-1-carboxylic acid), prekursor biosintesis etilen dapat meningkatkan toleransi Arabidosis thaliana
pada cekaman salinitas. Selain itu, etilen dilaporkan terlibat dalam pemanjangan akar primer dan pembentukan akar lateral (Guzman dan Ecker 1990; Lewis et al.
2011). Daun dan akar dua tanaman halofita, Cakile maritima dan Thellungiella salsuginea, mengakumulasi ACC lebih tinggi dibandingkan tanaman glikofita
El-Iklil et al. (2000) melaporkan produksi etilen genotipe tomat toleran pada kondisi cekaman lebih rendah dibandingkan genotipe tomat peka. Etilen merespon cekaman dengan menginduksi sejumlah faktor transkripsi, salah satunya adalah kelompok famili gen NAC (Fujita et al. 2006; Gambar 3).
Gambar 3 Lintasan sinyal antara cekaman abiotik dan biotik (Fujita et al. 2006)
Faktor Transkripsi NAC
Respon tanaman terhadap cekaman salinitas merupakan karakter yang kompleks, bersifat kuantitatif, melibatkan fungsi banyak gen dan mekanisme fisiologis yang ekspresinya dipengaruhi oleh berbagai macam faktor lingkungan (Beck et al. 2007). Faktor transkripsi yang terlibat dalam respon terhadap cekaman abiotik, termasuk cekaman salinitas, adalah NAC (N-acetylcystein) (Puranik et al. 2013). Puranik et al. (2013) melaporkan bahwa SiNAC merupakan kelompok gen NAC dari tanaman hotong yang berperan penting dalam respon tanaman tersebut terhadap cekaman abiotik. Anggota famili gen NAC dari A. thaliana, AtNAC2, dilaporkan terlibat dalam respon terhadap cekaman salinitas dan pembentukan akar lateral melalui lintasan sinyal etilen dan auksin (He et al. 2005). Gen SiNAC065 telah diisolasi dari tanaman hotong dan ekspresinya dilaporkan terinduksi oleh cekaman kekeringan (20% PEG-6000), salinitas (250 mM NaCl) dan 100 M ethephon (Puranik et al. 2013). OsNAC6 dan OsNAC10
merupakan gen yang berasal dari Oryza sativa, juga dilaporkan berperan dalam respon terhadap cekaman abiotik dengan meningkatkan ekpresi beberapa gen pengkode protein dalam keadaan tercekam (Nakashima et al. 2007; Jeong et al.
2010). Overekspresi gen NAC dari tiga genotipe Arabidopsis thaliana (ANAC019,
ANAC055, ANAC072) juga meningkatkan ekspresi gen-gen terkait toleransi terhadap cekaman salinitas, kekeringan dan suhu rendah pada tanaman A. thaliana
PERBEDAAN RESPON ANATOMI AKAR GENOTIPE
HOTONG (Setaria italica L. Beauv) TOLERAN DAN
PEKA CEKAMAN SALINITAS
Abstrak
Hotong merupakan tanaman yang potensial ditanam pada lahan salin yang dapat menurunkan produksi tanaman. Tujuan dari penelitian ini adalah untuk mengidentifikasi perubahan anatomi akar hotong dengan toleransi yang berbeda terhadap cekaman salinitas. Empat genotipe hotong yang digunakan, yaitu ICERI-5 dan ICERI-6 (toleran) dan ICERI-4 dan ICERI-10 (peka), ditanam secara hidroponik selama satu minggu dengan perlakuan 60 dan 120 mM NaCl. Perubahan anatomi akar diamati pada hari kelima setelah perlakuan. Hasil penelitian menunjukkan bahwa cekaman salinitas secara signifikan menyebabkan perubahan anatomi pada akar hotong, yaitu peningkatan ketebalan epidermis, korteks, diameter akar, dan pertambahan jumlah rambut akar. Peningkatan ketebalan epidermis, diameter akar dan jumlah rambut akar pada perlakuan salinitas lebih terlihat nyata pada genotipe peka. Cekaman salinitas menginduksi peningkatan jumlah protoxylem pada genotipe toleran, sedangkan pada genotipe peka secara signifikan menurunkan jumlah protoxylem. Perubahan anatomi yang berbeda pada kondisi salin antara genotipe toleran dan peka menunjukkan bahwa beberapa karakter anatomi akar dapat menentukan tingkat toleransi hotong terhadap salinitas.
Kata kunci: hotong, salinitas, anatomi akar, protoxylem, rambut akar
Abstract
Foxtail millet is a potential crop to be grown in the areas where high salinity levels prevent crop production. The objective of this study was to identify anatomical changes in the roots of foxtail millet genotypes with different tolerance level to salt stress. Four foxtail millet genotypes, namely ICERI-5 and ICERI-6 (salt tolerant) and ICERI-4 and ICERI-10 (salt sensitive), were grown hydroponically for 1 week prior to 60 and 120 mM salt stress application. Root anatomical changes were observed on the fifth day after salt stress treatments. Our results showed that salt stress significantly induced some anatomical changes in the roots of foxtail millet genotypes, i.e. increased epidermis and cortex thickness, increased root diameter, and increased the number of root hairs. Salt stresses applied were not significantly affected the stele diameter and the number of metaxylem. The increase in epidermis thickness, root diameter and the number of root hairs due to the salt application were more pronounced in the sensitive genotypes. While salt stress induced a significant increase in the number of protoxylem in the tolerant genotypes, it significantly decreased the number of protoxylem in the sensitive genotypes. The different anatomical changes under salt stress between the tolerant- and sensitive genotypes indicate that some anatomical attributes of the roots might determine the salt tolerance level of foxtail millet.
Pendahuluan
Salinitas merupakan salah satu kendala pada lahan-lahan pertanian yang ada di Indonesia dan menjadi faktor pembatas untuk produksi tanaman pangan. Sopandie (2006) melaporkan bahwa lahan salin banyak ditemukan pada daerah dengan curah hujan sedikit yang tidak mencukupi untuk pencucian (leaching) dan pada daerah non irigasi sebagai akibat dari evaporasi dan transpirasi. Garam yang mendominasi pada lahan salin adalah NaCl (Tan 1991). Kebanyakan tanaman tidak bisa mengatasi tingginya konsentrasi garam dalam tanah, namun hotong (Setaria italica L. Beauv.) memiliki toleransi yang cukup baik untuk ditanami pada lahan dengan tingkat salinitas yang tinggi tersebut (Kafi et al. 2009).
Akar merupakan organ tanaman yang pertama kali terpapar cekaman pada cekaman salinitas dan modifikasi akar merupakan respon yang menentukan toleransi tanaman terhadap cekaman salinitas (Julkowska et al. 2014). Cekaman salinitas dilaporkan mempengaruhi arsitektur akar (Julkowska et al. 2014; Zhang
et al. 2015) dan anatomi akar (Muhammad et al. 1999; Akram et al. 2002; Farhana et al. 2014). Perubahan arsitektur akar (Julkowska et al. 2014) dan anatomi akar (Akram et al. 2002; Muscolo et al. 2004; Younis et al. 2013) dilaporkan berasosiasi dengan toleransi tanaman terhadap cekaman salinitas.
Perubahan anatomi akar pada cekaman salinitas diduga dapat menentukan tingkat toleransi tanaman. Meskipun hotong dilaporkan lebih toleran dibandingkan dengan tanaman sereal utama lainnya terhadap cekaman salinitas (Goron dan Raizada 2015), tingkat toleransi hotong bervariasi tergantung genotipe (Kafi et al. 2009; Ardie et al. 2015). Memahami perbedaan perubahan anatomi akar yang diinduksi oleh salinitas pada genotipe peka dan toleran diharapkan dapat memperdalam pemahaman terhadap mekanisme toleransi hotong saat bercekaman. Tujuan dari penelitian ini adalah mengamati perubahan anatomi akar pada genotipe hotong toleran dan peka terhadap cekaman salinitas.
Bahan dan Metode
Penelitian ini dilaksanakan dari bulan Juli hingga Agustus 2015 di Rumah Kaca Kebun Percobaan Cikabayan, Laboratorium PMB2, dan Laboratorium
Micro Technique Departemen Agronomi dan Hortikultura, Fakultas Pertanian, IPB. Percobaan disusun berdasarkan rancangan kelompok lengkap teracak (RKLT) dengan dua faktor dan 5 ulangan. Faktor pertama merupakan konsentrasi NaCl dengan tiga taraf, yaitu 0, 60 dan 120 mM. Faktor kedua merupakan 4 genotipe hotong yang terdiri atas 2 genotipe diduga toleran (ICERI 5 dan ICERI 6) dan 2 genotipe diduga peka (ICERI 4 dan ICERI 10) terhadap cekaman salinitas berdasarkan penelitian Ardie et al. (2015). Setiap unit percobaan terdiri atas satu pot berisi 2 L larutan hara dengan lima bibit.
Ohki (1987) dan Agustina (2011), yaitu mengandung 0.24 mM NH4NO3, 0.03
mM (NH4)2SO4, 0.088 mM K2SO4, 0.38 mM KNO3, 1.27 mM Ca(NO3)2.4H2O,
0.27 mM Mg(NO3)2.4H2O, 0.14 mM NaCl, 6.6 μM H3BO3, 5.1 μM MnSO4.4H2O,
0.61 μM ZnSO4.7H2O, 0.16 μM CuSO4.5H2O, 0.1 μM Na2Mo7.7H2O, 45 μM
FeSO4.7H2O-EDTA. Bibit umur 14 hari setelah semai dipindahkan ke larutan hara
baru dan diberi perlakuan cekaman pada 7 hari setelah kultur. Kondisi larutan hara (pH dan EC) dimonitor setiap 3 hari sekali menggunakan pH meter portable AD-110 dan TDS portable AD-310. Level pH larutan hara dikontrol pada ± 7.0 menggunakan 1 M HCl atau 1 M NaOH. Suhu dan kelembapan relatif rata-rata harian dalam rumah kaca ditentukan dengan mengacu kepada Handoko (1993). Rata-rata suhu dan kelembapan rumah kaca selama pengamatan berturut-turut adalah 31 ºC dan 59.7 %.
Pengamatan pertumbuhan dilakukan terhadap panjang tajuk, panjang akar, dan jumlah daun pada 7 hari setelah perlakuan (HSP). Pengamatan anatomi akar dilakukan pada irisan melintang ujung (+ 3 mm) akar terpanjang pada 5 HSP meliputi, tebal epidermis, tebal korteks, diameter stele, jumlah metaxylem, diameter metaxylem, jumlah protoxylem, rasio jumlah metaxylem/jumlah protoxylem, diameter akar, rasio diameter akar/diameter stele, dan jumlah rambut akar. Variabel-variabel anatomi yang diamati pada irisan melintang akar ditampilkan pada Gambar 4. Anatomi akar diamati menggunakan mikroskop Olympus BX51 dengan kameraDP25 (DP2-BSW). Data yang diperoleh diolah menggunakan analisis ragam dan jika terdapat pengaruh nyata (P<0.05) dilakukan uji lanjut menggunakan Duncan Multiple Range Test (DMRT) pada taraf α = 5%. Analisis korelasi dilakukan menggunakan aplikasi STAR.
Gambar 4 Penampang melintang akar bibit hotong 5 HSP
Hasil dan Pembahasan
akar:diameter stele, diameter metaxylem, jumlah protoxylem, dan jumlah rambut akar (Tabel 1).
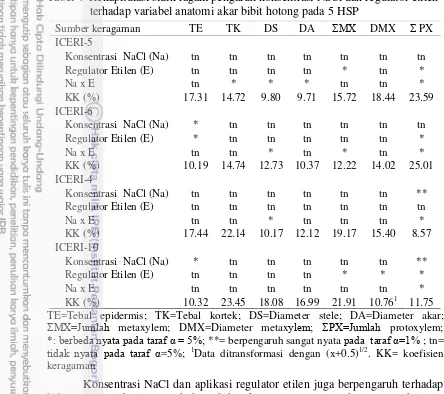
Genotipe berpengaruh terhadap tebal epidermis, diameter stele, rasio diameter akar:diameter stele, diameter metaxylem, jumlah protoxylem, rasio jumlah metaxylem:protoxylem, dan jumlah rambut akar. Interaksi antara cekaman salinitas dan genotipe berpengaruh terhadap tebal epidermis, rasio diameter akar:diameter stele, jumlah protoxylem, dan jumlah rambut akar.
Gambar 5 Keragaan ujung akar genotipe hotong toleran dan peka salinitas pada perlakuan NaCl (0, 60, 120 mM) pada 5 HSP
Tabel 1 Rekapitulasi sidik ragam pengaruh konsentrasi NaCl dan genotipe hotong terhadap variabel anatomi akar (5 HSP)
TE=Tebal Epidermis; TK=Tebal Kortek; DS=Diameter Stele; DA=Diameter Akar; ΣMX=Jumlah Metaxylem; DMX=Diameter Metaxylem; ΣPX=Jumlah Protoxylem; ΣRA=Jumlah Rambut Akar; *=nyata pada α=5% **=sangat nyata pada α=1%; tn=tidak nyata. KK= koefisien keragaman
Cekaman salinitas menyebabkan peningkatan diameter akar, tebal epidermis dan tebal korteks (Tabel 2). Korelasi positif nyata antara tebal epidermis dan tebal korteks dengan diameter akar (Tabel 3) menunjukkan bahwa peningkatan diameter akar hotong disebabkan oleh meningkatnya ketebalan epidermis dan korteks. Hajibagheri et al. (1985) melaporkan bahwa peningkatan diameter ujung akar akibat cekaman salinitas juga terjadi pada tanaman halofita (Suaeda maritima L. Dum) yang disebabkan oleh peningkatan tebal korteks. Sumber keragaman TE
(µm)
TK (µm)
DS (µm)
DA
(µm) ΣMX
DMX
(µm) ΣPX ΣRA
[NaCl] (Na) * ** tn ** tn * * **
Genotipe (G) ** tn * tn tn * * **
Na x G * tn tn tn tn tn ** **
Peningkatan tebal korteks tersebut diakibatkan oleh membesarnya vakuola sel korteks sebagai respon tehadap cekaman salinitas. Koyro (1997) juga melaporkan bahwa cekaman salinitas menyebabkan peningkatan ukuran sel korteks akibat membesarnya vakuola pada tanaman sorgum.
Tabel 2 Tebal epidermis (TE), tebal korteks (TK), diameter akar (DA), diameter metaxylem (DMX), jumlah protoxylem (ΣPX) dan jumlah rambut akar berbeda nyata berdasarkan DMRT pada taraf α = 5%.
Diameter metaxylem akar hotong menurun dengan meningkatnya konsentrasi NaCl (Tabel 2). Pengaruh salinitas pada xylem di akar tanaman dilaporkan bervariasi, tergantung pada jenis tanaman. Salinitas dilaporkan meningkatkan jumlah dan diameter pembuluh metaxylem pada bibit Kikuyu (Pennisetum clandestinum Hoechst) (Muscolo et al. 2004). Sebaliknya, peningkatan konsentrasi NaCl dilaporkan menurunkan area metaxylem pada akar gandum (Akram et al. 2002).
Tabel 3 Korelasi antar variabel anatomi akar hotong
Variabel TE TK DS DA ΣMX DMX ΣPX TE=Tebal Epidermis; TK=Tebal Korteks; DS=Diameter Stele; DA=Diameter Akar; ΣMX=Jumlah Metaxylem; DMX=Diameter Metaxylem; ΣPX=Jumlah Protoxylem; ΣRA= Jumlah Rambut Akar. **= sangat nyata pada taraf α=1% ; tn= tidak nyata pada taraf α=5%.
Gambar 6 Keragaan irisan melintang (±3 mm) dari ujung akar terpanjang genotipe hotong toleran dan peka salinitas pada perlakuan NaCl (0, 60, 120 mM) pada 5 HSP
diperlukan untuk pengambilan air dan hara penting seperti K+ pada kondisi cekaman salinitas. Islam et al. (2011) melaporkan bahwa konsentrasi Na+ meningkat secara signifikan pada jaringan akar, batang dan daun hotong pada kondisi cekaman salinitas dibandingkan dengan kontrol, sedangkan konsentrasi K+ tidak berubah. Genotipe hotong toleran diduga membiarkan sebagian Na+ masuk ke dalam jaringan tanaman untuk kemudian dikompartementasikan ke dalam vakuola. Peningkatan tebal korteks (Tabel 2) dan ukuran sel korteks yang lebih besar (Gambar 7A) saat cekaman salinitas mengindikasikan kapasitas hotong untuk mengkompartementasikan Na+ ke dalam vakuola sel akar.
Salinitas menyebabkan peningkatan jumlah protoxylem pada genotipe toleran, sebaliknya salinitas menyebabkan penurunan jumlah protoxylem pada genotipe peka (Gambar 7C). Jumlah protoxylem genotipe toleran, ICERI-5 dan ICERI-6, meningkat sebesar 34% dan 84% pada konsentrasi NaCl 120 mM dibandingkan pada 0 mM NaCl. Sementara itu, jumlah protoxylem genotipe peka, ICERI-4 dan ICERI-10, menurun hingga 47% dan 48% pada konsentrasi NaCl 120 mM dibandingkan pada 0 mM NaCl. Pengamatan pada penelitian ini dilakukan pada tahap bibit (28 HST), sehingga jaringan pembuluh yang diamati diduga masih dalam tahap awal perkembangannya. Protoxylem merupakan pembuluh xylem yang berkembang dan berfungsi pada awal perkembangan tanaman (Esau 1977), sehingga penurunan jumlah protoxylem pada genotipe peka diduga dapat menyebabkan gangguan dalam transportasi air dan hara dari akar ke tajuk bibit hotong. Perkembangan protoxylem dilaporkan dipengaruhi oleh salinitas. Hameed et al. (2010) melaporkan bahwa luas protoxylem pada akar
Cynodon dactylonmeningkat dengan meningkatnya konsentrasi NaCl, akan tetapi populasi dari Salt Range (area salin) menunjukkan peningkatan lebih besar dibandingkan populasi dari daerah Faisalabad (area non-salin).
Simpulan
Berdasarkan percobaan dapat disimpulkan bahwa :
1. Kondisi salin menginduksi perubahan anatomi akar, semakin tinggi konsentrasi NaCl semakin besar peningkatan diameter akar akibat pertambahan ukuran pada tebal epidermis dan tebal korteks serta terjadinya peningkatan pada jumlah rambut akar;
RESPON GENOTIPE HOTONG TOLERAN- DAN PEKA
SALINITAS TERHADAP APLIKASI REGULATOR ETILEN
SECARA EKSOGEN
Abstrak
Etilen merupakan salah satu hormon tumbuh yang terlibat erat dalam respon terhadap cekaman salinitas. Penelitian ini bertujuan untuk mempelajari respon genotipe hotong toleran dan peka cekaman salinitas terhadap aplikasi regulator etilen eksogen. Percobaan disusun berdasarkan rancangan kelompok lengkap teracak dengan dua faktor dan tiga ulangan. Faktor pertama merupakan konsentrasi NaCl yang terdiri atas 0 dan 60 mM. Faktor kedua adalah regulator etilen yang terdiri atas kontrol (tanpa regulator etilen), etilen eksogen (12 ppm etephon) dan inhibitor aksi etilen (0.6µM AgNO3). Hasil percobaan menunjukkan bahwa aplikasi etilen secara eksogen pada cekaman 60 mM NaCl semakin memperparah dampak cekaman, dengan semakin terhambatnya pertumbuhan tinggi tajuk, panjang akar dan berkurangnya bobot kering tajuk. Cekaman salinitas menyebabkan peningkatan diameter akar, tebal epidermis, tebal korteks dan diameter stele, sementara itu aplikasi etilen eksogen dapat mempertahankan diameter akar, tebal korteks, dan diameter stele seperti kondisi kontrol. Sebaliknya, aplikasi inhibitor etilen menyebabkan peningkatan diameter akar yang signifikan. Korelasi negatif nyata antara diameter akar dengan jumlah daun dan bobot basah tajuk, menunjukkan bahwa semakin besar diameter akar menyebabkan penurunan jumlah daun dan mengurangi bobot basah tajuk. Aplikasi etilen eksogen lebih menekan tinggi tajuk pada genotipe peka (ICERI-4, ICERI-10) dibandingkan pada genotipe toleran (ICERI-5 dan ICERI-6).
Kata kunci: salinitas, etilen, hotong, diameter akar, tinggi tajuk Abstract
Ethylene is one of plant hormones that is tightly involved in the plant responses to salinity stress. The objective of this study was to study the role of ethylene in the modification of root anatomy and growth of foxtail millet genotypes under salinity stress. The experiment was arranged on randomized completely group design with two factors and three replications. The first factor was NaCl concentration consisted of 0 and 60 mM. The second factor was exogenous ethylene regulator application, consisted of control (without any exogenous ethylene regulator application), ethylene releaser substance (12 ppm
etephon) and ethylene inhibitor (0.6μM AgNO3). Our results showed that exogenous ethylene application exacerbated the negative effect of salinity, i.e. higher reduction of plant height, root length and shoot dry weight. Salinity increased epidermis and cortex thickness and root diameter; however, exogenous ethylene application inhibits the increase in those root anatomical variables. In contrast to exogenous ethylene application, application of ethylene inhibitor induced a significant increase in root diameter. Significant negative correlation was observed between root diameter, number of leaves and shoot fresh weight, indicating higher root diameter would reduce number of leaves and shoot fresh weight. The plant height suppression due to exogenous ethylene application under salinity stress was more pronounced in the sensitive genotypes (ICERI-4 and ICERI-10) than in the tolerant genotypes (ICERI-5 and ICERI-6).
Pendahuluan
Etilen merupakan hormon tumbuh yang mengatur pertumbuhan dan perkembangan tanaman. Etilen berperan dalam memacu aktivitas reaksi enzimatik dan respirasi klimaterik, perubahan permeabilitas sel, degradasi klorofil, dan pelunakan buah (Kader 1985). Etilen meningkatkan aktivitas enzim-enzim katalase, peroksidase dan amilase (Mattoo dan Modi 1969). Selain itu, etilen terlibat secara fungsional dalam mengatur respon tanaman terhadap cekaman abiotik, seperti salinitas (Fujita et al. 2006).
Cekaman abiotik pada umumnya akan meningkatkan sintesis etilen endogen pada tanaman sebagai salah satu mekanisme lintasan sinyal (Shin dan Schachtman 2004) dan produksi etilen yang tinggi diperlukan untuk meningkatkan toleransi tanaman terhadap cekaman salinitas (Ma et al. 2012; Tao
et al. 2015). Cao et al. (2007) melaporkan bahwa aplikasi ACC ( 1-aminocylopropane-1- carboxylic acid), prekursor biosintesis etilen dapat meningkatkan toleransi Arabidosis thaliana pada cekaman salinitas. Daun dan akar dua tanaman halofita, Cakile maritima dan Thellungiella salsuginea, mengakumulasi ACC lebih tinggi dibandingkan tanaman glikofita Arabidopsis thaliana pada kondisi cekaman salinitas (Ellouzi et al. 2014). Selain itu, etilen juga dilaporkan terlibat dalam pemanjangan akar primer dan pembentukan akar lateral (Guzman dan Ecker 1990; Lewis et al. 2011). Namun sebaliknya, sejumlah studi lainnya melaporkan bahwa penekanan produksi etilen diperlukan untuk meningkatkan toleransi tanaman terhadap cekaman salinitas (El-Iklil et al. 2000; Chen et al. 2014). El-Iklil et al. (2000) melaporkan produksi etilen relatif tanaman tomat genotipe toleran pada cekaman salinitas lebih rendah daripada kondisi normal dibandingkan dengan genotipe peka. Tao et al. (2015) menduga bahwa etilen berperan penting pada respon awal terhadap cekaman salinitas, akan tetapi produksi etilen secara berlebihan pada tahapan selanjutnya dapat menyebabkan hambatan pertumbuhan pada cekaman salinitas.
Peran etilen dalam respon tanaman hotong terhadap cekaman salinitas belum dilaporkan hingga saat ini. Strader et al. (2009) mengaplikasikan senyawa pelepas etilen (etephon) dan inhibitor aksi etilen (AgNO3) secara eksogen untuk mengungkap peran etilen dalam perkembangan Arabidobsis thaliana. Etephon merupakan nama untuk 2-chloroethyl phosphonic acid yang telah diakui oleh
American Standards Institute, yang disebut juga sebagai: Ethrel, Florel, CEP, CEOA, 2-CEPA adalah prekursor biosintesis etilen (Bondad 1976). Sebaliknya,
Silver nitrate (AgNO3) dilaporkan dapat menghambat aksi etilen (Beyer 1976). Ion Ag+ berinteraksi dengan etilen dengan mengikat situs reseptor etilen sehingga menghambat respon etilen (Rodriguez et al. 1999; Zhao et al. 2002; Binder et al.
2007). Strader et al. (2009) melaporkan bahwa AgNO3 meningkatkan indole-3-acetic acid (IAA) untuk menghambat sinyal etilen pada ujung akar A. thaliana.
Bahan dan Metode
Percobaan ini dilakukan pada bulan Mei hingga Juli 2015 di rumah kaca kebun percobaan Cikabayan dan Laboratorium mikroteknik AGH-IPB. Percobaan terdiri atas 4 sub percobaan terpisah, masing-masing pada empat genotipe hotong yang telah diduga taraf toleransinya terhadap cekaman salinitas berdasarkan penelitian Ardie et al. (2015) dan hasil pada percobaan 1a. Empat genotipe hotong tersebut terdiri atas 2 genotipe diduga toleran (ICERI 5 dan ICERI 6) dan 2 genotipe diduga peka (ICERI 4 dan ICERI 10) terhadap cekaman salinitas. Percobaan pada tiap genotipe disusun berdasarkan rancangan kelompok lengkap teracak (RKLT) dengan dua faktor dan 5 ulangan. Faktor pertama merupakan konsentrasi NaCl yang terdiri atas 0 dan 60 mM. Faktor kedua adalah regulator etilen yang terdiri atas kontrol (tanpa regulator etilen), aplikasi senyawa penghasil etilen (12 ppm etephon) dan inhibitor etilen (0.6 µM AgNO3). Prosedur persiapan dan penanaman bibit sama dengan prosedur pada Percobaan 1a.
Pengamatan dilakukan pada 0, 3, 5, 7, 14 HSP yang meliputi panjang akar, tinggi tajuk dan jumlah daun. Bobot basah tajuk dan akar diamati pada 14 HSP. Bobot kering tajuk dan akar ditentukan setelah sampel dikeringkan menggunakan oven selama 72 jam pada suhu 600C. Pengamatan anatomi akar dilakukan pada irisan melintang ujung (+ 3 mm) akar terpanjang pada 5 HSP meliputi, tebal epidermis, tebal korteks, diameter stele, jumlah metaxylem, diameter metaxylem, jumlah protoxylem dan diameter akar dengan menggunakan mikroskop Olympus BX51 dengan kamera DP25 (DP2-BSW). Kondisi larutan hara (pH dan EC) dimonitor setiap 3 hari sekali menggunakan pH meter portable AD-110 dan EC
portable AD-310. Level pH larutan hara dikontrol pada ± 7.0 menggunakan 1 M HCl atau 1 M NaOH. Suhu dan kelembaban relatif rata-rata harian dalam rumah kaca ditentukan dengan mengacu kepada Handoko (1993). Rata-rata suhu dan kelembapan rumah kaca selama pengamatan berturut-turut adalah 31.5 ºC dan 60.4 %. Data yang diperoleh diolah menggunakan analisis ragam dan jika terdapat pengaruh nyata (P < 0.05) dilakukan uji lanjut menggunakan Duncan Multiple Range Test (DMRT) pada taraf α = 5%. Analisis korelasi menggunakan aplikasi
STAR.
Hasil dan Pembahasan
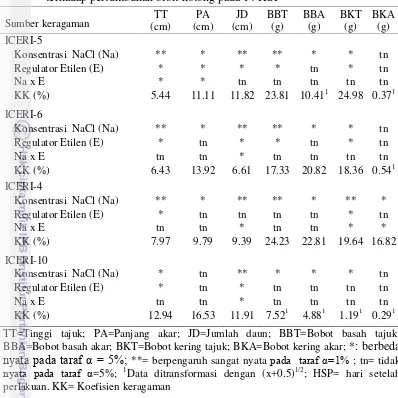
Berdasarkan hasil uji F, faktor pertama (konsentrasi NaCl) dan faktor kedua (aplikasi regulator etilen) berpengaruh terhadap beberapa variabel anatomi akar bibit keempat genotipe (Tabel 4). Interaksi antara konsentrasi NaCl dan aplikasi regulator etilen berpengaruh nyata terhadap beberapa variabel anatomi akar pada keempat genotipe.
Konsentrasi NaCl berpengaruh nyata pada variabel tebal epidermis pada genotipe ICERI-6 dan ICERI-10. Jumlah protoxylem dipengaruhi secara nyata oleh konsentrasi NaCl pada genotipe ICERI-4 dan ICERI-10. Konsentrasi NaCl tidak berpengaruh nyata pada variabel tebal korteks, diameter stele, diameter akar, jumlah metaxylem, dan diameter metaxylem pada keempat genotipe.
ICERI-5, diameter stele pada genotipe ICERI-5, ICERI-6 dan ICERI-4, diameter akar pada genotipe ICERI-5.
Tabel 4 Rekapitulasi sidik ragam pengaruh konsentrasi NaCl dan regulator etilen terhadap variabel anatomi akar bibit hotong pada 5 HSP
TE=Tebal epidermis; TK=Tebal kortek; DS=Diameter stele; DA=Diameter akar; ΣMX=Jumlah metaxylem; DMX=Diameter metaxylem; ΣPX=Jumlah protoxylem; *: berbeda nyata pada taraf α = 5%; **= berpengaruh sangat nyata pada taraf α=1% ; tn= tidak nyata pada taraf α=5%; 1Data ditransformasi dengan (x+0.5)1/2. KK= koefisien keragaman
Tabel 5 Rekapitulasi sidik ragam pengaruh konsentrasi NaCl dan regulator etilen terhadap pertumbuhan bibit hotong pada 14 HSP
TT=Tinggi tajuk; PA=Panjang akar; JD=Jumlah daun; BBT=Bobot basah tajuk; BBA=Bobot basah akar; BKT=Bobot kering tajuk; BKA=Bobot kering akar; *: berbeda nyata pada taraf α = 5%; **= berpengaruh sangat nyata pada taraf α=1% ; tn= tidak nyata pada taraf α=5%; 1Data ditransformasi dengan (x+0.5)1/2; HSP= hari setelah perlakuan. KK= Koefisien keragaman
Respon Anatomi Akar dan Pertumbuhan Bibit Hotong terhadap Cekaman Salinitas
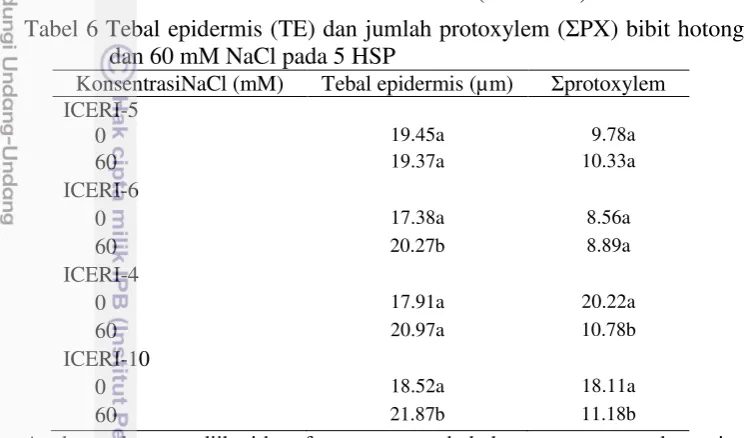
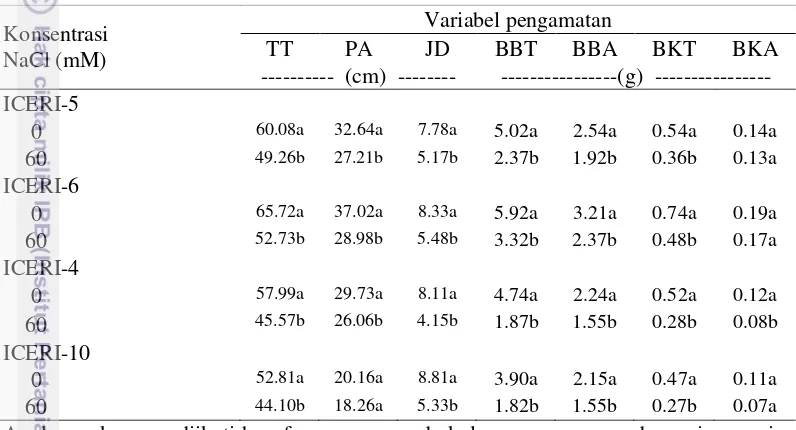
Perbedaan respon anatomi akar pada kondisi lingkungan bercekaman merupakan salah satu strategi adaptasi tanaman untuk bertahan hidup pada lingkungan yang tidak sesuai. Tebal epidermis genotipe toleran (ICERI-5 dan ICERI-6) tidak meningkat secara nyata pada konsentrasi NaCl 60 mM (Tabel 6). Hal ini sejalan dengan hasil Percobaan 1a yang menunjukkan bahwa konsentrasi NaCl 60 mM tidak menyebabkan peningkatan tebal epidermis pada genotipe ICERI-5 dan ICERI-6 (Gambar 7). Tebal epidermis genotipe peka, ICERI-10, meningkat sebesar 18% pada konsentrasi 60 mM NaCl (Tabel 6). Peningkatan tebal epidermis pada genotipe ICERI-10 pada konsentrasi 60 mM NaCl pada percobaan ini sejalan dengan hasil Percobaan 1a yang menunjukkan bahwa konsentrasi 60 mM NaCl menyebabkan peningkatan tebal epidermis sebesar 29% dibandingkan pada 0 mM NaCl (Gambar 7).
menyebabkan peningkatan jumlah protoxylem pada genotipe 5 dan ICERI-6 berturut-turut sebesar 43% dan 95% (Gambar 7). Walaupun respon genotipe toleran pada percobaan ini berbeda dengan hasil Percobaan 1a, respon genotipe peka tampak masih konsisten. Jumlah protoxylem genotipe peka (ICERI-4 dan ICERI-10) menurun secara nyata pada konsentrasi 60 mM NaCl (Tabel 6). Penurunan jumlah protoxylem pada genotipe peka pada percobaan ini sejalan dengan hasil pada Percobaan 1a yang menunjukkan bahwa konsentrasi 60 mM NaCl menyebabkan penurunan jumlah protoxylem pada genotipe ICERI-4 dan ICERI-10 sebesar 40% dan 42% berturut-turut (Gambar 7).
Tabel 6 Tebal epidermis (TE) dan jumlah protoxylem (ΣPX) bibit hotong pada 0 dan 60 mM NaCl pada 5 HSP
KonsentrasiNaCl (mM) Tebal epidermis (µm) Σprotoxylem ICERI-5
Angka-angka yang diikuti huruf yang sama pada kolom yang sama pada masing-masing genotipe menunjukkan tidak berbeda nyata berdasarkan DMRT pada taraf α = 5%.
Hasil uji-t beberapa variabel anatomi akar antara genotipe toleran (ICERI-5 dan ICERI-6) dan genotipe peka (ICERI-4 dan ICERI-10) menunjukkan bahwa tebal epidermis dan jumlah metaxylem genotipe peka pada konsentrasi 60 mM NaCl lebih rendah dibandingkan dengan genotipe toleran (Tabel 7). Jumlah protoxylem pada 60 mM NaCl tidak berbeda antara genotipe toleran dan genotipe peka. Data pada Tabel 6 dan Tabel 7 mengindikasikan bahwa penurunan jumlah protoxylem (selisih antara jumlah protoxylem pada 60 mM NaCl dan 0 mM NaCl), dan bukan jumlah protoxylem pada 60 mM NaCl, yang menentukan toleransi genotipe hotong terhadap cekaman salinitas.
Tabel 7 Hasil uji-t beberapa variabel anatomi akar pada genotipe toleran (ICERI-5 dan ICERI-6) dan peka (ICERI-4 dan ICERI-10) pada 14 HSP pada 60 mM NaCl
TE=Tebal epidermis; TK=Tebal kortek; DS=Diameter stele; DA=Diameter akar; ΣMX=Jumlah metaxylem; DMX=Diameter metaxylem; ΣPX=Jumlah Protoxylem.tn= tidak berbeda nyata pada taraf α = 5%; *=berbeda nyata pada taraf α = 5%.
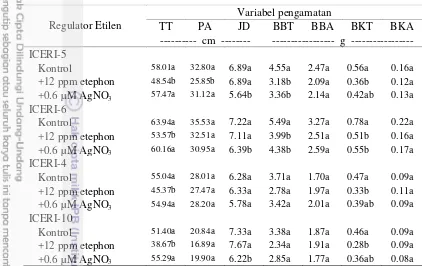
Cekaman salinitas sebesar 60 mM NaCl menyebabkan penurunan pada hampir seluruh variabel pertumbuhan pada keempat genotipe, yaitu variabel tinggi tajuk, panjang akar, jumlah daun, bobot basah tajuk, bobot basah akar dan bobot kering tajuk (Tabel 8). Bobot kering akar genotipe toleran (5 dan ICERI-6) tidak menurun secara nyata pada 60 mM NaCl, sedangkan bobot kering genotipe peka (ICERI-4) menurun secara nyata pada 60 mM NaCl dibandingkan pada 0 mM NaCl.
Tabel 8 Rata-rata tinggi tajuk (TT), panjang akar (PA), jumlah daun (JD), bobot basah tajuk (BBT), bobot basah akar (BBA), bobot kering tajuk (BKT), bobot kering akar (BKA) 4 genotipe hotong pada konsentrasi NaCl (0 dan 60 mM) 14 HSP
Angka-angka yang diikuti huruf yang sama pada kolom yang sama pada masing-masing genotipe menunjukkan tidak berbeda nyata berdasarkan DMRT pada taraf α = 5%.
Hasil uji-t beberapa variabel pertumbuhan bibit antara genotipe toleran (ICERI-5 dan ICERI-6) dan genotipe peka (ICERI-4 dan ICERI-10) menunjukkan bahwa tinggi tanaman, panjang akar, bobot basah tajuk, bobot basah akar, bobot kering tajuk dan bobot kering akar genotipe toleran lebih tinggi dibandingkan genotipe peka (Tabel 9).
Tabel 9 Hasil uji-t pertumbuhan bibit pada genotipe toleran (ICERI-5 dan ICERI-6) dan peka (ICERI-4 dan ICERI-10) pada 14 HSP pada 60 mM NaCl
TT= Tinggi tajuk; PA= Panjang akar; JD= Jumlah daun; BBT= Bobot basah tajuk; BBA= Bobot basah akar; BKT= Bobot kering tajuk; BKA= Bobot kering akar; tn= tidak berbeda nyata pada taraf α= 5%; *= berbeda nyata pada taraf α= 5%.
Korelasi negatif nyata antara tebal epidermis dengan tinggi tajuk, panjang akar, jumlah daun, bobot basah tajuk, bobot basah akar, dan bobot kering tajuk (Tabel 10) menunjukkan semakin besar peningkatan tebal epidermis menyebabkan penurunan tinggi tajuk, panjang akar, jumlah daun, bobot basah tajuk, bobot basah akar, dan bobot kering tajuk. Epidermis merupakan bagian luar akar tanaman yang berperan sebagai pelindung dan berfungsi untuk menyerap unsur hara dan air di dalam tanah (McMahon 2008). Sel-sel epidermis akan mengalami modifikasi membentuk rambut akar untuk memudahkan dalam penyerapan, sekresi maupun proteksi. Korelasi positif nyata antara tebal epidermis dan tebal korteks dengan diameter akar (Tabel 10) menunjukkan bahwa peningkatan diameter akar dipengaruhi oleh peningkatan tebal epidermis dan tebal korteks. Meningkatnya tebal korteks diduga akibat membesarnya vakuola sel korteks sebagai respon terhadap cekaman salinitas. Korteks merupakan jaringan dasar pada tanaman yang berfungsi untuk menyimpan hasil fotosintesis, air dan hara (Gregory 2006).
Stele merupakan bagian tengah akar yang di dalamnya terdapat jaringan pembuluh, seperti xylem dan floem. Pengaruh salinitas pada diameter stele masing-masing genotipe bervariasi. Diameter stele pada genotipe toleran (ICERI-5 dan ICERI-6) pada 60 mM NaCl menurun sebesar 10% dan 9% dibandingkan pada 0 mM NaCl, sedangkan pada genotipe peka, ICERI-4, diameter stele meningkat sebesar 37% pada konsentrasi 60 mM NaCl. Korelasi positif nyata antara diameter stele dengan diameter metaxylem (Tabel 10), menunjukkan bahwa semakin besar diameter stele disebabkan oleh peningkatan diameter metaxylem. Sinaga (2007) melaporkan bahwa peningkatan ukuran stele bisa terjadi akibat penambahan jumlah xylem dan diameter xylem.
TT=Tinggi tajuk; PA=Panjang akar; JD=Jumlah daun; BBT=Bobot basah tajuk; BBA=Bobot basah akar; BKT=Bobot kering tajuk; BKA=Bobot kering
akar; TE=Tebal epidermis; TK=Tebal korteks; DS=Diameter stele; DMX=Diameter metaxylem; ΣMX=Jumlah metaxylem; ΣPX=Jumlah protoxylem;
DA=Diameter akar.*= nyata pada taraf α=5%; **= sangat nyata pada taraf α=1%; tn= tidak nyata pada taraf α=5%. PA 0.68
JD 0.71** 0.40tn
BBT 0.96** 0.60** 0.76**
BBA 0.86** 0.55** 0.54** 0.88**
BKT 0.94** 0.59** 0.72** 0.96** 0.92**
BKA 0.70** 0.54** 0.41* 0.74** 0.87** 0.85**
TE -0.60** -0.41* -0.76** -0.67** -0.51* -0.57** -0.33tn
TK -0.53** -0.29tn -0.74** -0.60** -0.41* -0.50* -0.15tn 0.68**
DS 0.40tn 0.47* 0.29tn 0.34tn 0.30tn 0.36tn 0.35tn -0.05tn 0.07tn
DMX 0.23tn 0.10tn 0.24tn 0.19tn 0.14tn 0.19tn 0.16tn -0.13tn 0.05tn 0.47**
ΣMX 0.02tn 0.35tn -0.11tn -0.02tn -0.12tn -0.02tn 0.01tn 0.00tn 0.19tn 0.37tn -0.36tn
ΣPX -0.15tn -0.38tn 0.10tn -0.10tn -0.30tn -0.20tn -0.36tn -0.30tn -0.03tn -0.34tn 0.13tn 0.28tn
DA -0.33tn -0.08tn -0.59** -0.41* -0.25tn -0.30tn 0.02tn 0.69** 0.89** 0.40tn 0.20tn 0.22tn -0.23tn
Respon Anatomi Akar dan Pertumbuhan Bibit Hotong terhadap Aplikasi Regulator Etilen Eksogen
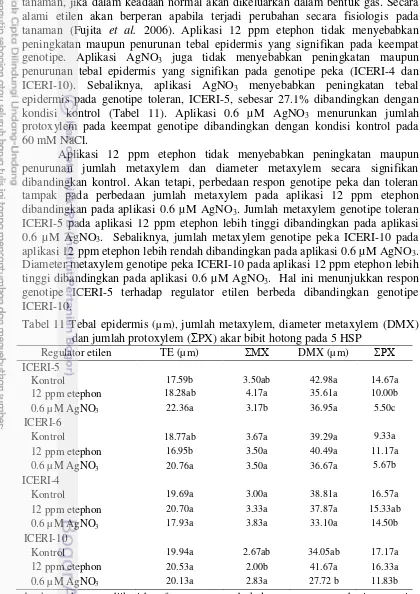
Senyawa etilen termasuk salah satu zat pengatur tumbuh (ZPT) pada tanaman, jika dalam keadaan normal akan dikeluarkan dalam bentuk gas. Secara alami etilen akan berperan apabila terjadi perubahan secara fisiologis pada tanaman (Fujita et al. 2006). Aplikasi 12 ppm etephon tidak menyebabkan peningkatan maupun penurunan tebal epidermis yang signifikan pada keempat genotipe. Aplikasi AgNO3 juga tidak menyebabkan peningkatan maupun penurunan tebal epidermis yang signifikan pada genotipe peka (ICERI-4 dan ICERI-10). Sebaliknya, aplikasi AgNO3 menyebabkan peningkatan tebal epidermis pada genotipe toleran, ICERI-5, sebesar 27.1% dibandingkan dengan kondisi kontrol (Tabel 11). Aplikasi 0.6 µM AgNO3 menurunkan jumlah protoxylem pada keempat genotipe dibandingkan dengan kondisi kontrol pada 60 mM NaCl.
Aplikasi 12 ppm etephon tidak menyebabkan peningkatan maupun penurunan jumlah metaxylem dan diameter metaxylem secara signifikan dibandingkan kontrol. Akan tetapi, perbedaan respon genotipe peka dan toleran tampak pada perbedaan jumlah metaxylem pada aplikasi 12 ppm etephon dibandingkan pada aplikasi 0.6 µM AgNO3. Jumlah metaxylem genotipe toleran ICERI-5 pada aplikasi 12 ppm etephon lebih tinggi dibandingkan pada aplikasi 0.6 µM AgNO3. Sebaliknya, jumlah metaxylem genotipe peka ICERI-10 pada aplikasi 12 ppm etephon lebih rendah dibandingkan pada aplikasi 0.6 µM AgNO3. Diameter metaxylem genotipe peka ICERI-10 pada aplikasi 12 ppm etephon lebih tinggi dibandingkan pada aplikasi 0.6 µM AgNO3. Hal ini menunjukkan respon genotipe ICERI-5 terhadap regulator etilen berbeda dibandingkan genotipe ICERI-10.
Tabel 11 Tebal epidermis (µm), jumlah metaxylem, diameter metaxylem (DMX) dan jumlah protoxylem (ΣPX) akar bibit hotong pada 5 HSP