PEMANFAATAN KARBONDIOKSIDA (CO2) UNTUK
KULTIVASI MIKROALGA
Nannochloropsis
sp. SEBAGAI
BAHAN BAKU BIOFUEL
FEMI ZUMARITHA
SKRIPSI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
ii
Dengan ini saya menyatakan bahwa Skripsi yang berjudul :
PEMANFAATAN KARBONDIOKSIDA (CO2) UNTUK KULTIVASI
MIKROALGA Nannochloropsis sp. SEBAGAI BAHAN BAKU BIOFUEL
adalah benar merupakan hasil karya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skripsi ini.
Bogor, Maret 2011
iii RINGKASAN
FEMI ZUMARITHA. Pemanfaatan Karbondioksida (CO2) untuk Kultivasi
Mikroalga Nannochloropsis sp. sebagai Bahan Baku Biofuel. Dibimbing oleh DIETRIECH G. BENGEN dan MUJIZAT KAWAROE
Penelitian dilakukan berdasarkan pada perkembangan bioteknologi mikroalga dewasa ini yang memanfaatkan mikroalga tidak hanya untuk pakan alami, sel protein tunggal, bidang farmasi dan kesehatan, tetapi juga digunakan sebagai sumber energi alternatif seperti penghasil biofuel. Tujuan dari penelitian ini adalah membandingkan kelimpahan sel mikroalga pada kultivasi tanpa aerasi, menggunakan aerasi dan menggunakan karbondioksida, serta mengkaji pengaruh pemanfaatan karbondioksida pada pertumbuhan mikroalga Nannochloropsis sp.
Penelitian ini dilakukan pada bulan Agustus 2009 hingga bulan April 2010 bertempat di Laboratorium Kultivasi Mikroalga di Pusat Penelitian Surfaktan dan Bioenergi, Lembaga Penelitian dan Pengabdian kepada Masyarakat, Institut Pertanian Bogor. Parameter yang diukur adalah suhu, salinitas dan pH, pada kultivasi dengan menggunakan karbondioksida pengukuran pH dilakukan dua kali untuk menghitung alkalinitas. Selain itu juga dilakukan perhitungan kelimpahan sel mikroalga. Penelitian dilakukan dua tahap, yaitu penelitian pendahuluan dan penelitian utama. Hasil dari penelitian pendahuluan akan dijadikan acuan untuk penelitian utama, pada penelitian pendahuluan didapatkan hasil bahwa pada perlakuan P2 dengan menggunakan karbondioksida peningkatan kelimpahan sel mikroalga merupakan yang tertinggi setiap harinya bila dibandingkan dengan kultivasi kontrol dan kultivasi perlakuan P1. Hasil dari penelitian utama menunjukkan bahwa penggunaan karbondioksida pada perlakuan P2 juga mengalami peningkatan kelimpahan sel tertinggi setiap harinya, pada perlakuan P2 dan P1 puncak kelimpahan sel terjadi pada hari ke-6 sedangkan pada kultivasi kontrol puncak kelimpahan sel terjadi pada hari ke-5.
Parameter kualitas air yang diukur antara lain suhu, salinitas dan pH. Suhu kultivasi berkisar antara 26-27 °C, salinitas berkisar antara 30-34 ‰, pH pada kultivasi kontrol dan kultivasi P1 berkisar antara 7-8. Nilai alkalinitas pada kultivasi P2 masih berada pada kisaran alkalinitas yang baik bagi perairan, dari nilai alkalinitas ini dapat disimpulkan bahwa penggunaan karbondioksida pada kultivasi mikroalga memberikan pengaruh yang baik bagi pertumbuhan
iv
© Hak cipta milik Femi Zumaritha, tahun 2011
Hak cipta dilindungi
v
PEMANFAATAN KARBONDIOKSIDA (CO2) UNTUK
KULTIVASI MIKROALGA
Nannochloropsis
sp. SEBAGAI
BAHAN BAKU BIOFUEL
FEMI ZUMARITHA C54050435
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
SKRIPSI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
vi
Judul Skripsi : PEMANFAATAN KARBONDIOKSIDA (CO2)
UNTUK KULTIVASI MIKROALGA Nannochloropsis sp. SEBAGAI BAHAN BAKU BIOFUEL
Nama Mahasiswa : FEMI ZUMARITHA
Nomor Pokok : C54050435
Departemen : Ilmu dan Teknologi Kelautan
Menyetujui,
Dosen Pembimbing
Prof. Dr. Ir. Dietriech G Bengen, DEA Dr. Ir. Mujizat Kawaroe, M.Si NIP. 19590105 198312 1 001 NIP. 19651312 199403 2 002
Mengetahui,
Prof. Dr. Ir. Setyo Budi Susilo, M.Sc NIP. 19580909 198303 1 003
vii
KATA PENGANTAR
Puji syukur ke hadirat Allah SWT atas segala limpahan rahmat, hidayah,
serta inayah yang diberikan, sehingga penulis dapat menyelesaikan skripsi yang
berjudul “Pemanfaatan Karbondioksida (CO2) untuk Kultivasi Mikroalga
Nannochloropsis sp. Sebagai Bahan Baku Biofuel”.
Penulis menyampaikan ucapan terimakasih kepada:
1. Kedua orangtua, serta kakak atas segala dukungan dan doanya.
2. Bapak Prof. Dr. Ir. Dietriech G. Bengen, DEA dan Ibu Dr. Ir. Mujizat
Kawaroe, M.Si. atas bimbingan, masukan dan kritik yang sangat berharga
selama penyusunan skripsi.
3. Nur Endah Fitrianto, S.Pi, Dahlia Wulan Sari, S.Pi, Dina Augustine, S.Pi
dan Ganjar Saefurahman, S.Pi. atas bantuan selama penelitan dan
saran-saran untuk penelitian.
4. Rekan-rekan ITK 42 dan warga ITK atas bantuan, saran, dan semangatnya.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna. Penulis
berharap, skripsi ini dapat memberikan kontribusi informasi dan wawasan yang
berguna bagi penulis dan pihak yang membacanya.
Bogor, Maret 2011
viii
3.3.2 Metode Penelitian Pendahuluan ... 13
3.3.3 Metode Penelitian Utama ... 15
3.3.4 Metode Analisis Data ... 16
3.3.4.1 Perhitungan Sel Mikroalga ... 16
3.3.4.2 Sidik Ragam ... 17
3.3.4.2 Alkalinitas... 18
4. HASIL DAN PEMBAHASAN ... 21
4.1 Hasil Penelitian Pendahuluan ... 21
4.2 Hasil Penelitian Utama... 24
4.2.1 Kelimpahan Sel ... 24
4.2.2 Laju Pertumbuhan Spesifik ... 27
4.2.3 Alkalinitas ... 33
5. KESIMPULAN DAN SARAN ... 35
5.1 Kesimpulan ... 35
ix
x
Halaman
1. Alat dan Bahan . ... 11
2. Kelimpahan Nannochloropsis sp. Pada Kontrol, P1, dan P2 ... 22
3. Kelimpahan Nannochloropsis sp. Pada Kontrol, P1, dan P2 ... 24
4. Kelimpahan dan Laju Pertumbuhan Spesifik (µ) Nannochloropsis sp. ... 27
xi
DAFTAR GAMBAR
Halaman
1. Nannochloropsis sp. ... 6
2. Siklus Karbon di Bumi ... 8
3. Diagram Alir Prosedur Penelitian Pendahuluan ... 14
4. Diagram Alir Prosedur Penelitian Utama ... 15
5. Kurva Kelimpahan Nannochloropsis sp. Penelitian Pendahuluan. ... 21
6. Kelimpahan Nannochloropsis sp.. ... 26
7. Kurva Pertumbuhan Nannochloropsis sp.Penelitian Utama ... 28
8. Perubahan rata-rata suhu kultivasi Nannochloropsis sp. ... 30
xii
Halaman
1. Data Kelimpahan Nannochloropsis sp. Penelitian Pendahuluan ... 40
2. Data Kelimpahan Nannochloropsis sp. Penelitian Utama ... 41
3. Data Suhu, Salinitas dan pH Kultivasi Mikroalga ... 43
4. Perhitungan Pertumbuhan Mikroalga ... 45
5. Perhitungan Laju Pertumbuhan ... 46
6. Statistik dan Uji Beda Nyata Terkecil ... 47
7. Tabel Perhitungan Alkalinitas (αH). ... 49
8. Tabel Perhitungan Alkalinitas (f). ... 50
9. Tabel Perhitungan Alkalinitas (A). ... 51
10. Tabel Perhitungan Alkalinitas (FT). ... 52
11. Tabel Perhitungan Alkalinitas (FP). ... 53
12. Tabel Perhitungan Alkalinitas (γ). ... 54
13. Perhitungan Konversi Satuan Alkalinitas. ... 55
14. Gambar Alat dan Bahan Penelitian. ... 56
15. Dokumentasi Penelitian Pendahuluan. ... 57
1
1.
PENDAHULUAN
1.1 Latar Belakang
Mikroalga adalah tumbuhan tingkat rendah yang dapat berfotosintesis dan
dapat tumbuh dengan cepat. Menurut Mata, et al, (2010), mikroalga merupakan
mikroorganisme prokariotik atau eukariotik yang dapat berfotosintesis dan dapat
tumbuh cepat pada kondisi yang sulit. Mikroalga dapat digunakan sebagai pakan
rotifer dan artemia. Salah satu cara untuk memproduksi biomassa mikroalga
dalam jumlah yang besar maka dilakukan kultivasi.
Kultivasi mikroalga dapat dilakukan pada beberapa tingkatan, dari skala
yang kecil hingga skala massal. Isnansetyo dan Kurniastuty (1995) dalam
bukunya juga menuturkan bahwa kultivasi mikroalga dimulai dari kegiatan isolasi
kemudian dikembangkan sedikit demi sedikit secara bertingkat. Kultivasi skala
laboratorium dilakukan pada volume 50 ml-3 liter, lalu dilakukan kultivasi semi
outdoor dengan volume 60-100 liter dan kultivasi massal dengan volume ≥ 1 ton.
Kultivasi mikroalga dengan penambahan karbondioksida merupakan salah satu
cara untuk meningkatkan kelimpahan sel mikroalga.
Pemanfaatan karbondioksida pada kultivasi mikroalga dilakukan untuk
meningkatkan kelimpahan sel mikroalga. Menurut Chiu, et al. (2008) dalam
penelitiannya penggunaan karbondioksida ke dalam kultivasi mikroalga dapat
meningkatan kelimpahan sel mikroalga hingga 50 %. Dengan demikian,
mikroalga khususnya mikroalga laut memiliki potensi untuk mengurangi
1.2 Tujuan
Tujuan dari penelitian ini adalah:
1. Membandingkan laju pertumbuhan sel mikroalga antara kultivasi kontrol,
perlakuan menggunakan aerasi, dan perlakuan menggunakan karbondioksida.
2. Mengkaji pengaruh pemanfaatan karbondioksida terhadap pertumbuhan
3
2. TINJAUAN PUSTAKA
2.1 Mikroalga Nannochloropsis sp.
Mikroalga merupakan mikroorganisme prokariotik atau eukariotik yang
dapat berfotosintesis dan dapat tumbuh dengan cepat serta dapat hidup dalam
kondisi yang sulit dengan struktur uniseluler atau multiseluler sederhana. Contoh
mikroorganisme prokariotik adalah Cyanobacteria (Cyanophyceae), dan contoh
mikroorganisme eukariotik adalah alga hijau (Chlorella) dan diatoms
(Bacillariophyta). Mikroalga dapat ditemukan dihampir semua ekosistem di
bumi, tidak hanya di perairan tetapi juga di daratan. Terdapat lebih dari 50.000
spesies akan tetapi hanya sekitar 30.000 saja yang sudah analisis dan dipelajari
(Mata, et.al., 2010).
Mikroalga Nannochloropsis sp. memiliki sel berwarna kehijauan, tidak
motil, dan tidak berflagel. Selnya berbentuk bola, berukuran kecil dengan
diameter 4-6 µm. Mikroalga dapat digunakan sebagai pakan untuk rotifer dan
artemia. Nannochloropsis sp. memproduksi asam eicosapentanoic (EPA)
(Barsanti dan Gualtieri, 2006).
Nannochloropsis sp. memiliki satu atau lebih plastid berwarna hijau
kuning yang mengandung klorofil a tidak mengandung klorofil c. Violaxanthin
merupakan pigmen tambahan yang berfungsi membantu dalam penyerapan
cahaya (Graham dan Wilcox, 2000). Nannochloropsis sp. merupakan alga yang
hidup bebas, tidak berkoloni dan bersifat kosmopolitan yaitu dapat hidup
dimanapun kecuali tempat yang sangat kritis bagi kehidupannya seperti gurun
Susunan klasifikasi Nannochloropsis sp. (Hibberd, 2000) adalah sebagai
berikut:
Domain: Eukaryota
Kingdom: Chromista
Filum: Ochrophyta
Class: Eustigmatophyceae
Genus: Nannochloropsis
Spesies: Nannochloropsis sp.
Komposisi asam lemak dari Nannochloropsis sp. dipengaruhi oleh
berbagai faktor lingkungan seperti intensitas cahaya. Faktor tersebut juga
mempengaruhi proses fotosintesis dan mempengaruhi sel asam lemak sintesis dan
metabolismenya. Nannochloropsis sp. juga memiliki pigmen seperti astaxanthin
dan canthaxanthin (Hu dan Gao, 2006). Chiu et al. (2008) dalam jurnalnya
mengatakan bahwa mikroalga Nannochloropsis sp. Dapat tumbuh dengan baik
dengan aerasi karbondioksida daripada aerasi biasa, kaitannya dengan
pertumbuhan mikroalga dengan sumber karbon yang cukup tanpa pembatasan
sumber karbon. Dibidang budidaya Nannochloropsis sp. banyak dimanfaatkan
sebagai tambahan nutrisi untuk pakan larva ikan dan udang. Wujud fisik
5
Gambar 1. Nannochloropsis sp. (CSIRO, 2009)
2.2 Kultivasi Mikroalga
Ada banyak tingkat dari pertumbuhan alga bergantung pada volume
kultivasi dan kepadatan alga. Asumsinya antara lain adalah, kumpulan alga
ditempatkan pada wadah bervolume besar, dan wadah tersebut tersedia cukup
karbondioksida (CO2) dan cahaya matahari untuk memicu pertumbuhan
maksimum (Richmond, 2003). Mikroalga dapat dikultivasi dalam kondisi di
bawah kondisi iklim yang biasa dan dapat memproduksi dalam jumlah besar dan
menghasilkan produk yang komersial seperti lemak, minyak, gula dan senyawa
bioaktif. Tujuan dari kultivasi mikroalga adalah meningkatkan kelimpahan sel
dan laju pertumbuhan (Rocha et al.,2003). Menumbuhkan mikroalga dalam
sebuah kultivasi, lingkungan atau kondisi diharapkan sesuai dengan kebutuhan
organisme tersebut. Faktor-faktor lingkungannya seperti, suhu, cahaya dan
mineral-mineral dapat mecukupi untuk digunakan oleh sel-sel mikroalga (Becker,
1994).
Pertumbuhan mikroalga dipengaruhi oleh beberapa faktor, antara lain
nutrisi, suhu, karbondioksida, pH, dan salinitas. Nutrisi yang mempengaruhi
pertumbuhan mikroalga terdiri dari makro dan mikro nutrien. Untuk makro
nutrien terdiri dari C, H, N, P, K, S, Mg dan Ca, sedangkan untuk mikro nutrien
antara lain Fe, Cu, Mn, Zn, Co, Mo, Bo, Vn dan Si. Dan yang menjadi faktor
pembatas untuk mikroalga adalah N dan P. Suhu optimum untuk pertumbuhan
mikroalga antara 20-24 °C, dan mikroalga masih dapat mentoleransi suhu antara
16-27 °C. Karbondioksida yang dibutuhkan untuk mikroalga akan digunakan
dalam proses fotosintesis. Rata-rata pH untuk seluruh jenis mikroalga antara 7-9
dan pH optimum rata-rata adalah 8.2-8.7. Mikroalga laut memiliki toleransi
tinggi terhadap perubahan salinitas, sebagian besar mikroalga laut dapat tumbuh
optimum pada kisaran salinitas 20-35 ‰.
Manfaat dan nilai komersial mikroalga bagi kepentingan industri telah cukup
lama dikenal. Sejak tahun 1940 penelitian dan pengembangan secara intensif telah
dilakukan di beberapa negara, baik dalam skala laboratorium maupun lapang.
Mikroorganisme fotosintetik ini telah dimanfaatkan dalam produksi biomassa,
produksi energi, produksi berbagai produk bermanfaat, bioakumulasi senyawa
tertentu serta berbagai proses biotransformasi. Produk-produk yang dihasilkan
mikroalga sebagian besar bersifat ekstraselular, mulai dari metabolit sederhana
hingga antibiotik kompleks, toksin, pigmen serta sejumlah produk bermanfaat
lainnya (Trevan dan Mak, 1988 dalam Kurniawan dan Gunarto, 1999). Chisti
(2007) mengatakan bahwa keuntungan biodiesel dari mikroalga adalah karena
7
Mikroalga menjadi satu-satunya sumber dari biodiesel yang sangat
potensial untuk menggantikan bahan bakar fosil, karena mikroalga berbeda dari
tanaman penghasil minyak lainnya yaitu dapat tumbuh dengan cepat dan menjadi
dua kali lipat lebih banyak dalam waktu 24 jam (Chisti, 2007).
2.3 Pemanfaatan Karbondioksida (CO2) oleh Mikroalga
Karbondioksida merupakan senyawa kimia yang terdiri dari dua atom
oksigen yang terikat secara kovalen dengan sebuah atom karbon, berbentuk gas
pada keadaan suhu dan tekanan standar dan berada di atmosfer bumi,
karbondioksida adalah gas yang tidak berwarna dan berbau. Karbondioksida
dihasilkan oleh semua hewan, tumbuh-tumbuhan, fungi dan mikroorganisme pada
proses respirasi dan digunakan oleh tumbuhan pada proses fotosintesis. Oleh
karena itu, karbondioksida merupakan komponen penting dalam kultivasi
(Borowitzka, 1988).
Siklus karbon di bumi adalah atmosfer dan perairan, terutama lautan. Laut
mengandung karbon lima puluh kali lebih banyak daripada karbon di atmosfer.
Perpindahan karbon dari atmosfer ke laut terjadi melalui proses difusi. Karbon
yang terdapat di atmosfer dan perairan diubah menjadi karbon organik melalui
proses fotosintesis, kemudian masuk kembali ke atmosfer melalui proses respirasi
dan dekomposisi yang merupakan proses biologis mahluk hidup (Effendi, 2003).
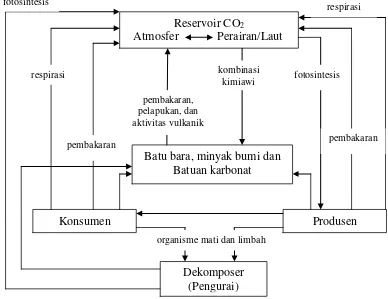
Gambar 2. Siklus Karbon di Bumi (Effendi, 2003).
Keseimbangan CO2 di atmosfer yaitu produksi primer kotor dan respirasi
oleh biosfer daratan, dan pertukaran fisik antara atmosfer dan laut. Perubahan
yang terus menerus ini kira-kira seimbang setiap tahun, tetapi
ketidakseimbangannya dapat mempengaruhi konsentrasi CO2 di atmosfer secara
signifikan dari tahun ke tahun. Panah yang tipis menandakan fluks alami
tambahan yang cukup penting pada skala waktu yang lebih panjang (IPCC, 2001).
Karbondioksida adalah hasil akhir dari organisme yang mendapatkan
energi dari penguraian gula, lemak dan asam amino dengan oksigen sebagai
bagian dari metabolisme dalam proses yang dikenal sebagai respirasi sel. Pada
tumbuh-tumbuhan karbondioksida diserap dari atmosfer pada proses fotosintesis,
dalam proses ini tumbuh-tumbuhan dapat mengurangi kadar karbondioksida di
atmosfer dengan melakukan proses fotosintesis yang disebut juga dengan Reservoir CO2
Atmosfer Perairan/Laut
Batu bara, minyak bumi dan Batuan karbonat
organisme mati dan limbah respirasi
9
asimilasi karbon dengan menggunakan energi cahaya untuk memproduksi materi
organik dengan mengkombinasi karbondioksida dengan air.
Di atmosfer kandungan karbondioksida semakin meningkat, oleh karena
itu dibutuhkan solusi agar karbondioksida di atmosfer dapat digunakan kembali
salah satunya untuk proses fotosintesis pada tumbuhan. Fiksasi biologi dari
karbondioksida merupakan pilihan yang menarik, karena tumbuhan secara alami
mengambil dan menggunakan karbondioksida sebagai bagian dari proses
fotosintesis.
Mikroalga laut merupakan calon yang sangat baik karena kemampuannya
untuk berfotosintesis yang cukup tinggi dan mudah dikultur pada air laut dimana
larutan karbondioksidanya cukup tinggi. Fiksasi karbondioksida oleh fotosintesis
mikroalga dan konversi biomassa menjadi bahan bakar cair dianggap mudah dan
tepat sebagai sirkulasi karbondioksida di bumi (Chiu et al., 2008).
Menurut Benemann (1997), penggunaan karbondioksida pada kultivasi
mikroalga memiliki beberapa keuntungan, seperti mikroalga tumbuh di air, lebih
mudah diamati pertumbuhannya daripada tumbuhan tingkat tinggi, mikroalga
dapat tumbuh sangat cepat dan mikroalga tidak membutuhkan tempat atau lahan
yang sangat luas untuk tumbuh. Untuk organisme seperti mikroalga,
karbondioksida merupakan faktor yang penting yang mempengaruhi pertumbuhan
dan metabolism mikroalga (Hoshida, et al., 2005).
Penggunaan karbondioksida pada kultivasi mikroalga juga dilakukan oleh
Olaizola et al. (2004), dalam jurnalnya dikatakan bahwa mikroalga dapat
menyerap karbondioksida pada kisaran pH dan konsentrasi gas karbondioksida
tergantung dari pH kultivasi tetapi tidak dipengaruhi oleh perbedaan konsentrasi
gas. Bentuk karbondioksida di air bergantung pada pH, suhu dan konsentrasi
nutrien. Pada sistem buffer yang buruk, sama halnya dengan kultivasi mikroalga,
pengaruh karbondioksida atau bikarbonat oleh pertumbuhan mikroalga yang
sangat cepat menyebabkan pergeseran kesetimbangan mengakibatkan peningkatan
nilai pH oleh mikroalga pada media kultivasi.
Brown dan Zeiler (1993) dalam Chiu et al. (2008) mengatakan gas rumah
kaca meningkat secara drastis di atmosfer bumi sebagai akibat dari aktivitas
manusia dan industrialisasi. Peningkatan konsentrasi gas rumah kaca
menyebabkan peningkatan suhu di permukaan udara dan permukaan laut.
Karbondioksida (CO2) merupakan gas rumah kaca, banyak percobaan fisika dan
kimia untuk melihat kandungan karbon dioksida di atmosfer. Pendekatan biologi
yang dilakukan, mikroalga dapat dengan efisien berfotosintesis daripada tanaman
darat dan merupakan kandidat terpenting yang efisien untuk fiksasi karbon
11
3. BAHAN DAN METODE
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Agustus 2009 hingga bulan April
2010 bertempat di Laboratorium Kultivasi Mikroalga di Pusat Penelitian
Surfaktan dan Bioenergi, Lembaga Penelitian dan Pengabdian kepada
Masyarakat, Institut Pertanian Bogor.
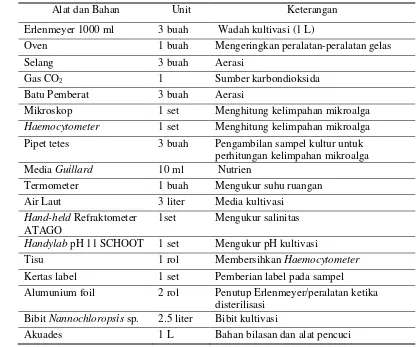
3.2 Alat dan Bahan
Alat dan bahan yang digunakan pada penelitian ini dicantumkan pada
Tabel 1.
Tabel 1. Alat dan Bahan
Alat dan Bahan Unit Keterangan
Erlenmeyer 1000 ml 3 buah Wadah kultivasi (1 L)
Oven 1 buah Mengeringkan peralatan-peralatan gelas
Selang 3 buah Aerasi
Gas CO2 1 Sumber karbondioksida
Batu Pemberat 3 buah Aerasi
Mikroskop 1 set Menghitung kelimpahan mikroalga
Haemocytometer 1 set Menghitung kelimpahan mikroalga
Pipet tetes 3 buah Pengambilan sampel kultur untuk
perhitungan kelimpahan mikroalga
Media Guillard 10 ml Nutrien
Termometer 1 buah Mengukur suhu ruangan
Air Laut 3 liter Media kultivasi
Hand-held Refraktometer
ATAGO
1set Mengukur salinitas
Handylab pH 11 SCHOOT 1 set Mengukur pH kultivasi
Tisu 1 rol Membersihkan Haemocytometer
Kertas label 1 set Pemberian label pada sampel
Alumunium foil 2 rol Penutup Erlenmeyer/peralatan ketika
disterilisasi Bibit Nannochloropsis sp. 2.5 liter Bibit kultivasi
3.3 Metode Penelitian
3.3.1 Tahap Persiapan
Tahap persiapan ini terdiri dari sterilisasi alat dan bahan sebelum proses
kultivasi dilakukan.
3.3.1.1 Sterilisasi Alat
Kegiatan sterilisasi ini diawali dengan mencuci dan merendam alat-alat
yang terbuat dari kaca, yaitu labu erlenmeyer dan pipet tetes, di dalam larutan
detergen. Bilas dengan air kran, sebelum dimasukkan ke dalam oven terlebih
dahulu erlenmeyer dan pipet tetes ditutup dengan alumunium foil. Erlenmeyer
dan pipet tetes dioven selama 5 jam dengan suhu 105 °C (Isnansetyo dan
Kurniastuty, 1995).
3.3.1.2 Sterilisasi Bahan
Bahan dan media kultivasi yang digunakan dalam penelitian ini juga
dilakukan sterilisasi untuk menghindari kontaminasi. Air laut yang digunakan
terlebih dahulu disaring dengan menggunakan kertas saring 0,45 µm, selanjutnya
disterilisasi dengan cara direbus hingga mendidih (Isnansetyo dan Kurniastuty,
1995). Nutrien yang digunakan disimpan dalam botol gelap dan disimpan di
dalam kulkas. Jika nutrien akan digunakan, terlebih dahulu dikeluarkan dari
kulkas dan didiamkan hingga suhunya sama dengan suhu ruang (27 °C). Bibit
mikroalga diperoleh dari koleksi batch mikroalga yang ada di laboratorium
Laboratorium Kultivasi Mikroalga di Pusat Penelitian Surfaktan dan Bioenergi,
13
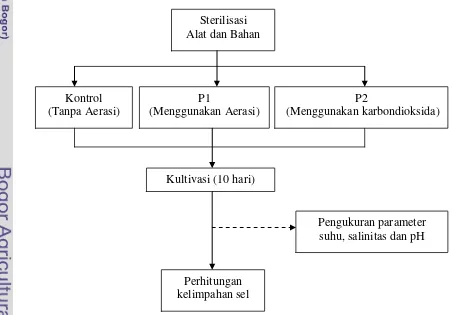
3.3.2 Metode Penelitian Pendahuluan
Penelitian pendahuluan dilakukan untuk mengamati pertumbuhan
Nannochloropsis sp. dengan penambahan karbondioksida pada salah satu
perlakuan. Hal ini dilakukan untuk menguji apakah penambahan karbondioksida
dapat dilakukan pada kultivasi mikroalga. Pengujian dapat dilihat dari jumlah sel
mikroalga yang bertambah atau tidak atau bahkan mati dalam kurun waktu
tertentu.
Tahapan pada penelitian pendahuluan ini adalah kultivasi 1000 ml pada
tiga buah erlenmeyer ukuran 1000 ml. Spesies yang digunakan adalah
Nannochloropsis sp., lalu dimasukkan air laut steril dan bibit mikroalga dengan
perbandingan 2/3 air laut steril dan 1/3 bibit mikroalga (Isnansetyo dan
Kurniastuty, 1995). Ketiga labu erlenmeyer diberi label/tanda agar tidak tertukar;
erlenmeyer pertama berisi air laut, bibit mikroalga media Guillard dan tidak diberi
aerasi dinamakan kontrol; erlenmeyer kedua berisi air laut, bibit mikroalga
media Guillard dan diberi aerasi dinamakan P1; erlenmeyer ketiga berisi air laut,
bibit mikroalga media Guillard, diberi aerasi dan penambahan karbondioksida
dinamakan P2, selanjutnya dilakukan di kultivasi selama 10 hari. Pada penelitian
pendahuluan ini tidak dilakukan ulangan pada tiap kultivasi, karena pada hari ke-8
kultivasi flowmeter mengalami kebocoran. Perhitungan kelimpahan sel
dilakukan dengan menggunakan haemocytometer dan mikroskop dihitung setiap
hari sejak hari pertama kultivasi.
Pengukuran suhu, salinitas dan pH dilakukan 1 kali setiap hari selama 10
hari. Pengukuran suhu pada penelitian pendahuluan menggunakan thermometer,
menggunakan indikator pH universal. Perhitungan alkalinitas pada penelitian
pendahuluan tidak dilakukan, karena pada hari ke-8 kultivasi terdapat kebocoran
pada flowmeter sehingga pengukuran pH tidak dilakukan. Pemberian
karbondioksida sebanyak 0,5 cc/min selama 6 jam atau ± 180 cc setiap 2 hari,
banyaknya pemberian karbondioksida pada kultur didasarkan pada penelitian
Chiu et al. (2008).
Hasil yang diperoleh dari penelitian pendahuluan akan dijadikan acuan
pada penelitian selanjutnya yaitu penelitian utama. Berdasarkan penelitian
pendahuluan didapatkan bahwa dengan penambahan karbondioksida pada
perlakuan P2 dapat meningkatkan pertumbuhan mikroalga. Data penelitian
pendahuluan disajikan pada Lampiran 1. Ringkasan penelitian pendahuluan
tercantum dalam Gambar 3.
15
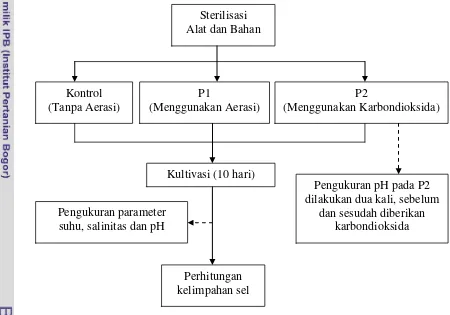
3.3.3 Metode Penelitian Utama
Penelitian utama ini banyak erlenmeyer yang digunakan sama seperti pada
penelitian pendahuluan. Hal ini dilakukan berdasarkan hasil dari penelitian
pendahuluan yang menunjukkan bahwa penambahan karbondioksida pada P2
mempengaruhi pertumbuhan sel mikroalga. Pertumbuhan sel mikroalga dengan
penambahan karbondioksida lebih tinggi daripada kontrol dan P1 . Data
penelitian utama disajikan pada Lampiran 2.
Gambar 4. Diagram Alir Prosedur Penelitian Utama
Tahapan kultivasi pada penelitian ini tidak terlalu berbeda dengan
penelitian pendahuluan. Penelitian utama terdiri dari kontrol dan 2 perlakuan
yaitu pada erlenmeyer kontrol berisi air laut bibit mikroalga media Guillard dan
tidak diberi aerasi, erlenmeyer dua merupakan P1 berisi air laut bibit mikroalga Sterilisasi suhu, salinitas dan pH
Pengukuran pH pada P2 dilakukan dua kali, sebelum
media Guillard dan diaerasi dan erlenmeyer tiga merupakan P2 berisi air laut bibit
mikroalga media Guillard diberi aerasi dan penambahan karbondioksida. Sedikit
berbeda pada penelitian pendahuluan pada penelitian utama ini penambahan
karbondioksida dilakukan setiap hari sebesar 0,5 cc/min selama 5 jam atau ± 150
cc setiap hari. Hal ini dilakukan agar pertumbuhan Nannochloropsis sp. menjadi
lebih maksimum. Ulangan yang dilakukan sebanyak 3 kali untuk mendapatkan
hasil yang terbaik. Data parameter suhu, salinitas dan pH disajikan pada
Lampiran 3.
3.3.4 Metode Analisis Data
3.3.4.1 Perhitungan Sel Mikroalga
Perhitungan kelimpahan sel mikroalga dari masing-masing Erlenmeyer
pada penelitian pendahuluan dan penelitian utama dilakukan setiap hari.
Perhitungan kelimpahan sel menggunakan Haemocytometer dan mikroskop.
Kelimpahan mikroalga dihitung dengan menggunakan formula Improved
Neubaeur Haemocytometer sebagai berikut:
(ind/ml) = ………. (1)
dimana,
N = jumlah sel mikroalga yang teramati
Perhitungan kelimpahan sel mikroalga disajikan pada Lampiran 4. Selain
menghitung kelimpahan sel mikroalga, juga dilakukan penghitungan laju
pertumbuhan spesifik (µ) (Krichnavaruk et al, 2004) dengan menggunakan
17
dimana,
Nt = kelimpahan populasi pada waktu t
No= kelimpahan populasi sel pada waktu o
To = waktu awal
Tt = waktu pengamatan
Laju pertumbuhan spesifik maksimum (µ maks) dihitung dari kelimpahan
pada saat awal kultur hingga puncak kelimpahan maksimum. Perhitungan laju
pertumbuhan spesifik disajikan pada Lampiran 5.
3.3.4.2 Sidik Ragam
Uji statistik yang dilakukan pada penelitian ini adalah untuk melihat
perbedaan tiap perlakuan dengan kontrol. Untuk sidik ragam (ANOVA)
menggunakan metode Rancangan Acak Kelompok (RAK) (Mattjik dan
Sumertajaya, 2006).
……….. (3)
dimana,
Yij = nilai pengamatan pada perlakuan ke-i, kelompok ke-j
µ = rata-rata umum populasi
τi = pengaruh aditif perlakuan ke-i
βj = pengaruh aditif perlakuan ke-j
Hipotesis yang diuji dalam analisis ini adalah sebagai berikut:
Ho: Karbondioksida yang diberikan tidak berpengaruh terhadap pertumbuhan
Nannochloropsis sp.
H1: Karbondioksida berpengaruh terhadap pertumbuhan Nannochloropsis sp.
Perhitungan sidik ragam dapat dilihat pada Lampiran 6.
3.3.4.3 Alkalinitas
Alkalinitas merupakan kemampuan suatu larutan untuk menetralkan asam
ke titik ekuivalen karbonat atau bikarbonat. Perhitungan alkalinitas dilakukan
untuk mendapatkan jumlah total karbondioksida pada larutan.
Untuk menentukan alkalinitas dilakukan pengukuran pH pada larutan, lalu
dihitung dengan menggunakan rumus (Strickland dan Parsons, 1972):
1. Apabila pH < 4 maka menggunakan rumus :
Alk tot = 2,5 (1250 )
f
H
……….. (4)
Apabila pH > 4 maka menggunakan rumus :
Alk tot = 3 (1300 )
Alk tot = alkalinitas total
αH = aktivitas ion hidrogen
f = faktor perhitungan total alkalinitas
19
2. Hitung alkalinitas karbonat (CA), menggunakan rumus :
CA = Alk tot – A ……….. (6)
dimana,
CA = alkalinitas karbonat
A = konversi alkalinitas total menjadi alkalinitas karbonat
Nilai A diperoleh dari tabel pada Lampiran 9
3. Hitung konsentrasi total karbondioksida dengan rumus :
Σ CO2 = CA x FT ……….. (7)
dimana,
Σ CO2 = karbondioksida total
FT = faktor konversi alkalinitas karbonat menjadi karbondioksida total
Nilai FT diperoleh dari tabel pada Lampiran 10
4. Hitung tekanan parsial dengan rumus :
PCO2 = CA x FP ……… (8)
dimana,
PCO2 = tekanan parsial karbondioksida
Fp = konversi karbondioksida total menjadi tekanan parsial karbondioksida
Nilai FP diperoleh dari tabel pada Lampiran 11
5. Hitung karbondioksida terlarut dengan menggunakan rumus :
[CO2] = PCO2x γ………. (9)
dimana,
γ = daya larut karbondioksida
Nilai γ diperoleh dari tabel pada Lampiran 12
Maka akan didapatkan hasil dengan satuan mmol/L CaCO3, agar sesuai
diinginkan yaitu mg/L CaCO3. Perhitungan konversi dari mmol/L CaCO3
menjadi mg/L CaCO3 dapat dilihat pada Lampiran 13.
Gambar alat dan bahan yang digunakan pada penelitian disajikan pada
lampiran 14. Dokumentasi penelitian pendahuluan disajikan pada Lampiran 15
21
4. HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian Pendahuluan
Kelimpahan Nannochloropsis sp. pada penelitian pendahuluan pada kultivasi
kontrol, kultivasi menggunakan aerasi (P1) dan kultivasi menggunakan
karbondioksida (P2) memperlihatkan hasil yang berbeda. Kelimpahan tertinggi
dicapai pada perlakuan P2 dengan penambahan karbondioksida. Kelimpahan sel
mikroalga disajikan pada Gambar 5 dan Tabel 2.
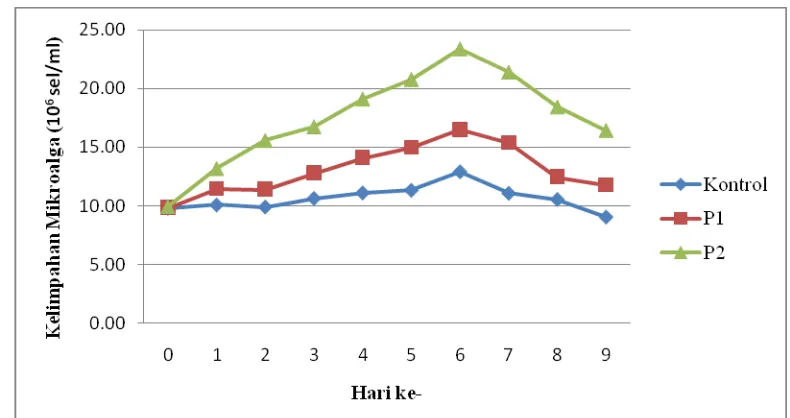
Gambar 5. Kurva Kelimpahan Nannochloropsis sp. Penelitian Pendahuluan
Menurut Mata et.al (2010), terdapat beberapa faktor abiotik dan biotik yang
mempengaruhi pertumbuhan mikroalga. Pengaruh faktor abiotik antara lain cahaya
(kualitas dan kuantitas), suhu, konsentrasi nutrien, oksigen (O2), karbondioksida
(CO2), pH dan salinitas. Faktor biotik yang mempengaruhi antara lain patogen
Gambar 5 menunjukkan pertumbuhan Nannochloropsis sp. selama 10 hari
pada saat penelitian pendahuluan. Kontrol dan P1 pada hari ke-2 sempat mengalami
penurunan kelimpahan sel, tetapi pada hari ke-3 mengalami peningkatan kembali
hingga hari ke-6 pada puncak kelimpahan sel. Kelimpahan sel Nannochloropsis sp.
pada P2 terus mengalami peningkatan hingga mencapai puncaknya pada hari ke-6.
Tabel 2. Kelimpahan Nannochloropsis sp. pada Kontrol, P1, dan P2
Hari ke-
P1 = kultivasi menggunakan aerasi
P2 = kultivasi dengan penambahan karbondioksida
Kultivasi Nannochloropsis sp. yang terbaik terdapat pada P2 dengan
penambahan karbondioksida. Hal ini dapat dilihat dari kelimpahan sel pada P2 setiap
harinya selalu yang tertinggi dibandingkan dengan kontrol dan P1. Nannochloropsis
sp. memiliki daya adaptasi yang cukup baik apabila ditambahkan dengan
karbondioksida secara langsung (Chiu et al., 2008).
Peningkatan kelimpahan sel Nannochloropsis sp. pada kontrol dari awal
23
kelimpahan sel sebesar 6,65 x 106 sel/ml dan pada P2 peningkatan kelimpahan sel
sebesar 13,4 x 106 sel/ml. Berdasarkan nilai tersebut terlihat bahwa penambahan
karbondioksida pada kultivasi mikroalga memberikan pengaruh yang sangat baik
terhadap pertumbuhan dan kelimpahan sel mikroalga.
Parameter kualitas air yang diukur pada saat penelitian antara lain suhu, pH
serta salinitas. Ruangan yang digunakan sebagai tempat dilakukannya kultur di atur
dengan menggunakan pendingin ruangan dengan suhu sebesar 20 °C. Selama
kultivasi dilakukan nilai salinitas mengalami peningkatan yang cukup signifikan
selama kultivasi dari 30-35 ‰, menurut Hu dan Gao (2006) Nannochloropsis sp.
dapat berkembang dengan baik pada salinitas 31 dan dapat terus menerus
berkembang pada kisaran salinitas 22-49. Pengukuran pH dilakukan dengan
menggunakan pH indikator universal, nilai pH yang terukur pada kontrol dan P1
konstan yaitu sebesar 8, sedangkan pada P2 pH berubah-ubah setiap harinya. Hal ini
dikarenakan pemakaian karbondioksida tidak konstan yaitu hanya dua hari sekali.
Nilai pH pada hari ketika tidak diberikan tambahan karbondioksida berkisar antara
7-8, sedangkan pada hari ketika ditambahkan karbondioksida pH berkisar antara 4-5.
4.2 Hasil Penelitian Utama
4.2.1 Kelimpahan Sel Nannochloropsis sp.
Kelimpahan sel Nannochloropsis sp. pada penelitian utama menunjukkan
pola yang hampir sama dengan penelitian pendahuluan. Kelimpahan sel mikroalga
Tabel 3. Kelimpahan Nannochloropsis sp. pada Kontrol, P1, dan P2
P1 = kultivasi menggunakan aerasi
P2 = kultivasi dengan penambahan karbondioksida
Menurut Rocha et al. (2003), salah satu parameter yang mempengaruhi
pertumbuhan Nannochloropsis sp. adalah nilai pH. Nilai pH ini dapat membuat
pertumbuhan mikroalga menurun bahkan sampai mati, dan ada pula jenis mikroalga
lain yang dapat tumbuh lebih baik pada media yang hanya di aerasi dengan blower.
Nannochloropsis sp. adalah salah satu mikroalga yang mempunyai kemampuan
adaptasi yang tinggi terhadap perubahan nilai pH dan termasuk yang terbaik bila
dikultur dengan menambahkan gas karbondioksida (Chiu et al., 2008). Pada Tabel 3
terlihat bahwa kelimpahan Nannochloropsis sp. lebih tinggi pada P2, sedangkan
pada kontrol dan P1 pertumbuhan Nannochloropsis sp. tidak terlalu tinggi.
Kelimpahan sel pada kontrol menunjukkan peningkatan yang kurang
25
perlakuan ini sehingga tidak semua mikroalga mendapat asupan cahaya dan nutrien
yang cukup. Puncak kelimpahan sel mikroalga terjadi pada hari ke-5 yaitu sebesar
4,25 x 106 sel/ml. Kelimpahan sel pada P1 terlihat mengalami peningkatan yang
cukup signifikan dan mengalami puncak kelimpahan pada hari ke-6 yaitu sebesar
5,40 x 106 sel/ml (Gambar 6). Peningkatan kelimpahan sel mikroalga pada hari ke-1
hingga puncak kelimpahan diduga karena pada hari-hari tersebut kandungan mineral
pada air media kultivasi masih cukup tinggi, sehingga mikroalga dapat memanfaatkan
secara maksimal untuk pertumbuhannya. Penurunan kelimpahan sel mikroalga pada
hari ke-7 hingga hari ke-9 diduga disebabkan karena nilai alkalinitas yang mengalami
penurunan, nilai alkalinitas yang kecil berarti bahwa air media kultivasi mikroalga
menjadi asam sehingga kandungan mineral pada media kurang menyebabkan
kematian pada sel mikroalga.
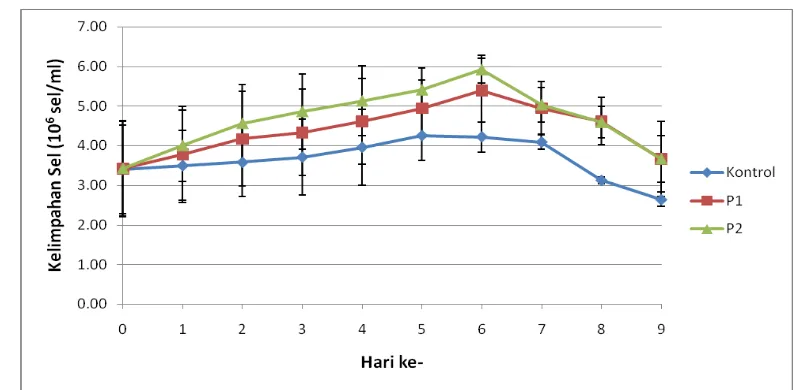
Gambar 6. Kelimpahan Nannochloropsis sp.
Kelimpahan sel mikroalga pada P2 menunjukkan peningkatan yang paling
signifikan dan memiliki puncak kelimpahan tertinggi dari ketiga perlakuan yaitu
Nannochloropsis sp. cepat memiliki daya adaptasi terhadap lingkungan yang baru
dan juga cepat beradapatasi dengan masukan karbondioksida. Hal ini diduga karena
air laut kultivasi media, bibit dan nutrien berasal dari laboratorium yang sama
sehingga mikroalga cepat beradaptasi.
Peningkatan kelimpahan sel Nannochloropsis sp. pada kontrol dari awal
kultivasi hingga puncak kelimpahan adalah 0,85 x 106 sel/ml, pada P1 peningkatan
kelimpahan sel sebesar 1,98 x 106 sel/ml dan pada P2 peningkatan kelimpahan sel
sebesar 2,50 x 106 sel/ml. Berdasarkan nilai tersebut terlihat bahwa penambahan
karbondioksida pada kultivasi mikroalga memberikan pengaruh yang sangat baik
terhadap pertumbuhan dan kelimpahan sel mikroalga.
4.2.2 Laju Pertumbuhan Spesifik
Berdasarkan Tabel 4. dapat diketahui bahwa pola pertumbuhan
Nannochloropsis sp. pada kontrol tanpa aerasi, perlakuan menggunakan aerasi dan
perlakuan menggunakan karbondioksida memiliki daya adaptasi yang berbeda, hal ini
27
Tabel 4. Kelimpahan dan Laju Pertumbuhan Spesifik (µ) Nannochloropsis sp.
Keterangan:
P1 = kultivasi menggunakan aerasi
P2 = kultivasi dengan penambahan karbondioksida
Fase lag dari Nannochloropsis sp. pada kontrol diduga terjadi kurang dari 24
jam, hal ini dapat dilihat dari kelimpahan pada awal kultivasi sebesar 3,40 x 106
sel/ml menjadi 3,50 x 106 sel/ml pada hari ke-1. Fase eksponensial diduga terjadi
dalam waktu kurang dari 24 jam hingga hari ke-5, fase ini menunjukkan pertumbuhan
pada Nannochloropsis sp. yang tinggi hingga mencapai puncaknya pada hari ke-5,
pada fase ini mikroalga sudah dapat beradaptasi dengan baik pada kondisi kultivasi
yang diberikan. Pada periode ini intensitas cahaya tidak terbatas dan perubahan
konsentrasi nutrien disebabkan oleh penyerapan mikroalga (Becker, 1994). Fase
stasioner diduga terjadi dari hari ke-5 hingga hari ke-6, terlihat dari nilai kelimpahan
sel dan laju pertumbuhan yang menurun dengan nilai µ sebesar -0,01 dan kelimpahan
sel sebesar 4,22 x106 sel/ml pada hari ke-6. Fase deklinasi terjadi pada hari ke-6
hingga hari ke-9 dimana nilai µ semakin menurun dengan nilai µ sebesar -0,17 pada
hari ke-9. Hal ini juga dapat dilihat dari kelimpahan sel mikroalga yang sangat kecil
yaitu sebesar 2,64 x106 sel/ml.
Fase deklinasi dapat terjadi karena nutrisi kultur telah habis dan terjadi
akumulasi senyawa NH4+ dalam konsentrasi tinggi dan adanya produk ekstraseluler
dari mikroalga yang meracuni diri sendiri sehingga dapat meningkatkan mortalitas
(Fogg, 1965 dalam Suantika, 2009).
Gambar 7. Kurva pertumbuhan Nannochloropsis sp. (Penelitian Utama)
Kelimpahan Nannochloropsis sp. pada P1 diawal kultivasi hingga hari ke-1
menunjukkan peningkatan yang drastis dari 3,42 x106 sel/ml menjadi 3,78 x106
sel/ml. Diduga dalam waktu kurang dari 24 jam fase lag terjadi, lalu fase
eksponensial terjadi dari hari ke-1 hingga hari ke-6 yaitu pada saat puncak
kelimpahan terjadi. Fase stasioner dimulai ketika terjadi keterbatasan mineral dan
akumulasi toksik, sehingga dapat menurunkan laju pertumbuhan dan kelimpahan sel
menurun (Becker, 1994). Fase stastioner pada P2 diduga terjadi dalam waktu kurang
29
terjadi penurunan kelimpahan sel diduga terjadi dari hari ke-7 hingga hari ke-9 dilihat
dari nilai µ yang semakin kecil mencapai nilai -0,23 pada hari ke-9.
Turunnya laju pertumbuhan Nannochloropsis sp. dapat disebabkan oleh
berkurangnya mikronutrien sebagai faktor pembatas karena telah banyak
dimanfaatkan selama fase eksponensial. Selain itu adanya toksik yang dihasilkan oleh
spesies mikroalga itu sendiri, sebagai hasil samping dari metabolisme dapat meracuni
mikroalga itu sendiri dan berkurangnya proses fotosintesis akibat bertambahnya
jumlah sel sehingga hanya bagian permukaan kultur saja yang memperoleh cahaya
(Riley dan Chester, 1971 dalam Nugraheny, 2001).
Fase lag pada P2 diduga terjadi dalam waktu kurang dari 24 jam, hal ini dapat
dilihat dari peningkatan kelimpahan sel yang terjadi pada hari ke-1 dari 3,43 x 106
sel/ml menjadi 4,00 x 106 sel/ml. Fase eksponensial terjadi dari hari ke-1 hingga hari
ke-6, terlihat dari Kelimpahan sel yang terus meningkat hingga mencapai puncaknya
pada hari ke-6 yaitu sebesar 5,93 x 106 sel/ml. Fase stasioner diduga terjadi dalam
waktu kurang dari 24 jam, hal ini dikarenakan pada hari ke-7 sel mengalami
penurunan yang cukup signifikan dengan nilai µ sebesar -0,16, lalu fase deklinasi
terjadi hingga hari ke-9 dimana kelimpahan sel mulai menurun hingga mencapai
kelimpahan sebesar 3,67 x 106 sel/ml dan nilai µ yang juga menurun hingga mencapai
nilai -0,23. Fase deklinasi terjadi ketika sel mikroalga mulai mati, ditandai dengan
menurunnya kelimpahan sel. Kondisi lingkungan tidak lagi menguntungkan, umur
kultivasi yang terlalu lama, terjadinya keterbatasan cahaya dan nutrien atau dapat
Kisaran suhu kultivasi selama kultivasi mikroalga berlangsung pada ketiga
perlakuan berkisar antara 26-27 °C (Gambar 10). Menurut Rocha et al. (2003)
Nannochloropsis sp. memiliki rentang suhu yang cukup besar untuk dapat tumbuh,
yaitu 25 ± 5 °C, sehingga dengan rentang suhu tersebut Nannochloropsis sp. masih
dapat bertumbuh dengan baik dan tidak menjadi faktor pembatas pertumbuhan.
Menurut Hu dan Gao (2006) Nannochloropsis sp. masih dapat tumbuh dengan baik
pada kisaran suhu 14-30 °C.
Gambar 8. Perubahan rata-rata suhu kultivasi Nannochloropsis sp.
Secara umum, kisaran salinitas kultivasi mukroalga pada setiap perlakuan
menujukkan karakteristik yang hampir sama. Salinitas kultivasi masing-masing
perlakuan semakin meningkat setiap harinya selama kultivasi, perubahan rata-rata
salinitas pada kultur Nannochloropsis sp.selama penelitian, besarnya salinitas
berkisar antara 30-34 ‰. Nannochloropsis sp. dapat berkembang dengan baik pada
salinitas 31 ‰ dan dapat terus menerus berkembang pada kisaran salinitas 22-49 (Hu
31
Gambar 9. Perubahan rata-rata salinitas kultivasi Nannochloropsis sp.
Sidik ragam yang dilakukan pada penelitian menunjukkan bahwa pemberian
karbondioksida pada kultivasi mikroalga memberikan pengaruh yang berbeda nyata
pada pertumbuhan mikroalga. Dan uji lanjut yang dilakukan memperlihatkan bahwa
tiap kultivasi memberikan pengaruh yang berbeda nyata pada pertumbuhan
mikroalga. Perhitungan sidik ragam dapat dilihat pada Lampiran 6.
4.2.3 Alkalinitas
Alkalinitas merupakan jumlah basa yang terkandung dalam sebuah perairan,
yang umumnya ditentukan oleh CO32- dan HCO3 dengan satuan CaCO3 (Dongoran, ,
2003). Menurut Effendi (2003) alkalinitas adalah gambaran kapasitas air untuk
menetralkan asam atau kuantitas anion di dalam air yang dapat menetralkan kation
hidrogen, serta sebagai kapasitas penyangga terhadap perubahan pH perairan.
Menurut Chiu et al. (2008), Nannochloropsis sp. merupakan salah satu
karena spesies ini mampu beradaptasi dengan cepat sehingga pertumbuhannya juga
sangat signifikan bila dibandingkan dengan kultur hanya menggunakan aerasi biasa.
Pada penelitian ini perhitungan alkalinitas hanya dilakukan pada kultivasi dengan
penambahan karbondioksida, karena pada kultivasi tanpa aerasi dan kultivasi dengan
aerasi, pH yang terukur tidak dapat masuk dalam kisaran rumus yang digunakan.
volume gas karbondioksida yang digunakan adalah 15 % CO2 (v/v), dengan laju alir
rata-rata sebesar 0.5 cc/min atau 0.5 ml/min selama 5 jam. Perubahan nilai pH dan
nilai alkalinitas disajikan pada Tabel 5.
Tabel 5. Perubahan Nilai pH dan Nilai Alkalinitas
Hari
Terlihat pada Tabel 5 bahwa kisaran nilai alkalinitas pada penelitian ini tidak
hanya dipengaruhi oleh pH setelah ditambahkan dengan karbondioksida, tetapi juga
dipengaruhi oleh pH sebelum ditambahkan karbondioksida. Selama kultur kisaran
nilai alkalinitas adalah antara 29,88-99,15 mg/L CaCO3, nilai tersebut masih cukup
baik bagi kehidupan organisme perairan dengan kisaran 30-500 mg/L CaCO3
33
Nilai alkalinitas pada awal kultivasi adalah 70,00 mg/L CaCO3, diduga pada
awal kultivasi mikroalga air media bersifat sadah atau air memiliki kadar mineral
yang tinggi. Pada hari ke-1 hingga hari ke 3 terjadi penurunan nilai alkalinitas,
diduga air media memiliki kadar mineral yang rendah. Berarti pada hari ke-1 hingga
hari ke-3 mikroalga memanfaatkan karbondioksida dan mineral-mineral. Hal ini
dapat dilihat dari kelimpahan sel hari ke-1 hingga hari ke-3 yang mengalami
peningkatan dan berada pada fase eksponensial. Pada hari ke-4 hingga hari ke-7 nilai
alkalinitas mengalami peningkatan, hal ini mungkin disebabkan karena kelimpahan
sel mikroalga sedang mengalami peningkatan, sel mikroalga tersebut selain
melakukan fotosintesis juga melakukan respirasi yang mengeluarkan karbondioksida
sehingga jumlah karbondioksida di air media menjadi jenuh dan mikroalga kurang
memanfaatkan karbondioksida. Dan pada hari ke 8 dan hari ke-9 nilai alkalinitas
mengalami penurunan, hal ini mungkin terjadi karena kelimpahan sel mikroalga
mengalami penurunan sehingga karbondioksida yang dihasilkan oleh mikroalga
menjadi sedikit sehingga mikroalga memanfaatkan karbondioksida yang dimasukkan.
Menurut Effendi (2003) perairan dengan nilai alkalinitas > 40 mg/L CaCO3 disebut
perairan sadah (hard water), sedangkan perairan dengan nilai alkalinitas < 40 mg/L
CaCO3 disebut perairan lunak (soft water).
Semakin tinggi nilai alkalinitas maka perairan tersebut cenderung bersifat
alkali. Menurut Zooneveld et al (1991) dalam Anggraeni (2002), nilai alkalinitas
yang tinggi dan cenderung bersifat alkali lebih produktif daripada perairan dengan
nilai alkalinitas yang rendah atau cenderung masam. Lebih produktifnya perairan
esensial lainnya yang meningkat kadarnya dengan meningkatnya nilai alkalinitas.
Alkalinitas tidak hanya dipengaruhi oleh pH juga dipengaruhi oleh komposisi
35
5. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Kelimpahan sel mikroalga dan laju pertumbuhan spesifik Nannochloropsis
sp. pada kultivasi dengan menggunakan karbondioksida memiliki nilai tertinggi
daripada kultivasi dengan aerasi maupun tanpa menggunakan aerasi. Kelimpahan
sel Nannochloropsis sp. pada hari ke-6 pada kultivasi menggunakan
karbondioksida memiliki jumlah tertinggi bila dibandingkan dengan kultivasi
tanpa aerasi dan kultivasi menggunakan aerasi. Kelimpahan sel mikroalga pada
kultivasi menggunakan karbondioksida meningkat tiga kali lipat bila
dibandingkan dengan kultivasi tanpa aerasi.
Nilai alkalinitas pada kultivasi menggunakan karbondioksida masih berada
pada kisaran yang cukup baik bagi kehidupan biota perairan. Penggunaan
karbondioksida pada kultivasi mikroalga memberikan pengaruh yang baik bagi
pertumbuhan dan kelimpahan sel mikroalga. Hal ini dapat dilihat dari kelimpahan
sel mikroalga pada kultivasi P2 setiap harinya yang selalu mengalami kelimpahan
tertinggi bila dibandingkan dengan kultivasi tanpa aerasi dan kultivasi
menggunakan aerasi.
5.2 Saran
Penelitian dengan menggunakan jenis mikroalga yang lain perlu dilakukan
untuk melihat pengaruh penggunaan karbondioksida terhadap pertumbuhan
36
DAFTAR PUSTAKA
Anggraeni, I. 2002. Kualitas Air Perairan Laut Teluk Jakarta selama Periode
1996-2002. Skripsi. Fakultas Perikanan dan Ilmu Kelautan. Institut
Pertanian Bogor. Bogor.
Anonim. 2007. Budidaya Fitoplankton dan Zooplankton. Balai Besar
Pengembangan Budidaya Laut Direktorat Jenderal Perikanan Budidaya.
Departemen Kelautan dan Perikanan. Jakarta.
Barsanti, L., dan P. Gualtieri. 2006. Algae : Anatomy, Biochemistry and
Biotechnology. CRC Press. New York.
Becker, E.W. 1994. Microalgae Biotechnology and Microbiology. University
Press. Cambridge.
Benemann, J.R. 1997. CO2 Mitigation with Microalgae Systems, Energy Convers.
38: S475-S479.
Borowitzka, M. A, Lesley J. B. 1988. Microalgal Biotechnology. University
Press. Cambridge.
Chisti, Y. 2007. Biodiesel from Microalgae, Biotechnol Adv. 25: 294-306.
Chiu, S. Y, Y. K. Chien, T.T. Ming, C.O. Seow, H.C. Chiun, dan S.L. Chih. 2008.
Lipid Accumulation and CO2 Utilization of Nannochloropsis oculata in
Response to CO2 Aeration, Bioresource Tech. 100: 833-838.
CSIRO. 2009. Microalgae –Nannochloropsis sp..
http://www.scienceimage.csiro.au/index.cfm?event=site.image.detail&id=
11605. [17 Maret 2011]
Dongoran, R.K. 2003. Pengaruh Alkalinitas Total dari Kalsium Karbonat
(CaCO3) terhadap Kelangsungan Hidup dan Pertumbuhan Larva Ikan
Jambal Siam (Pangasius sp.). Skripsi. Fakultas Perikanan dan Ilmu
37
Effendi, H. 2003. Telaah Kualitas Air bagi Pengelolaan Sumberdaya dan
Lingkungan Perairan. Kanisius. Yogyakarta.
Graham, L.E dan L.A. Wilcox. 2000. Algae. Prentice Hall, New Jersey.
Hibberd, B. 2000. Systema Naturae Classification.
http://taxonomicon.taxonomy.nl/TaxonTree.aspx. [9 Oktober 2009]
Hoshida, H, T. Ohira, A. Minematsu, R. Akada dan Y. Nishizawa. 2005.
Accumulation of Eicosapentaenoic Acid in Nannochloropsis sp. in
Response to Elevated CO2 Concentrations, Applied Phycology. 17: 29-34.
Hu, H dan K. Gao. 2006. Response of Growth and Fatty Acid Compositions of
Nannochloropsis sp. to Environmental Factors Under Elevated CO2
Concentration, Biotechnol Lett. 28: 987-992.
IPCC. 2001. The Carbon Cycle and Atmospheric Carbon Dioxide. The Scientific
Basis. In Climate Change 2001. 185-237.
Isnansetyo, A. dan Kurniastuty. 1995. Teknik Kultur Phytoplankton dan
Zooplankton Pakan Alami untuk Pembenihan Organisme Laut. Kanisius.
Yogyakarta.
Krichnavaruk, S., L, Worapanne., P, Sorawit., P, Prasert. 2004. Optimal Growth
Conditions and the Cultivation of Chaetoceros calcitrans in Airlift
Photobioreactor. Chemical Enginering. 105(2005): 91-98.
Kurniawan, H. dan G. Lukman. 1999. Aspek Industri Sistem Kultivasi Sel
Mikroalga Imobil. Jurnal Tinjauan Ilmiah Riset Biologi dan Bioteknologi
Pertanian. 2 (2).
Mata, T.M., A.A Martins dan N.S Caetona. 2010. Microalgae for Biodiesel
Production and Other Applications : A Review, Renewable and
Sustainable Energy Reviews. 14: 217-232
Mattjik, A.A. dan I.M. Sumertajaya. 2006. Perancangan Percobaan dengan
Nugraheny, N. 2001. Ekstraksi Bahan Anti-bakteri dari Diatom Laut Skeletonema
costatum. Skripsi. Fakultas Perikanan dan Ilmu Kelautan, Institut
Pertanian Bogor. Bogor.
Olaizola, M, T. Bridges, S. Flores, L. Griswold, J. Morency dan T. Nakamura.
2004. Microalgal Removal of CO2 from Flue Gases : CO2 Capture from a
Coal Combuster, Biotech. Bioproc. Eng. 8: 360-367
Punchard, N.A. Haemocytometer Instructions. Haemocytv3.doc.
http://search?haemocytometer+neubauer [9 Oktober 2009]
Richmond, A. 2003. Handbook of Microalgal Culture Biotechnology and Applied
Phycology. Blackwell Publishing.
Rocha, J.M.S, J.E.C Garcia dan M.H.F. Henriques. 2003. Growth Aspect of the
Marine Microalga Nannochloropsis gaditana, Biomolecular Engineering.
20 : 237-242.
Strickland, J.D.H dan T.R Parsons. 1972. A Practical Handbook of Seawater
Analysis. Fisheries Research Board of Canada. Ottawa.
Suantika, G., A. Pingkan, dan S. Yusuf. 2009. Pengaruh Kepadatan Awal
Inokulum terhadap Kualitas Kultur Chaetoceros gracilis (Schuut) pada
Sistem Batch. Institut Teknologi Bandung. Bandung.
Sutomo. 2005. Kultur Tiga Jenis Mikroalga (Tetraselmis sp., Chlorella sp., dan
Chaetoceros gracilis) dan Pengaruh Kepadatan Awal terhadap
Pertumbuhan C. Gracilis di Laboratorium. Oseaonologi dan Limnologi 37
Lampiran 1 Data Kepadatan Nannochloropsis sp. Penelitian Pendahuluan
Tabel Kelimpahan Mikroalga (juta ind/ml)
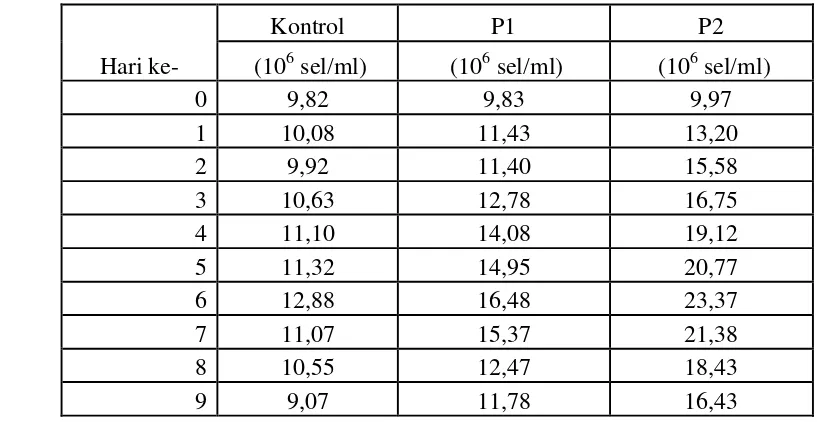
Hari ke- Tanpa Aerasi Menggunakan Aerasi Menggunakan CO2
0 9.82 9.83 9.97
1 10.08 11.43 13.20
2 9.92 11.40 15.58
3 10.63 12.78 16.75
4 11.10 14.08 19.12
5 11.32 14.95 20.77
6 12.88 16.48 23.37
7 11.07 15.37 21.38
8 10.55 12.47 18.43
41
Lampiran 2 Data Kepadatan Nannochloropsis sp. Penelitian Utama
Tabel Kelimpahan Mikroalga Ulangan Pertama (106 ind/ml)
Hari/Tanggal/Tahun Tanpa Aerasi Aerasi CO2
15/03/2010 3.7750 3.8083 3.8500
Tabel Kelimpahan Mikroalga Ulangan Kedua (106 ind/ml)
Hari/Tanggal/Tahun Tanpa Aerasi Aerasi CO2
Rataan Kepadatan Mikroalga
Tabel Kelimpahan Mikroalga (106 ind/ml)
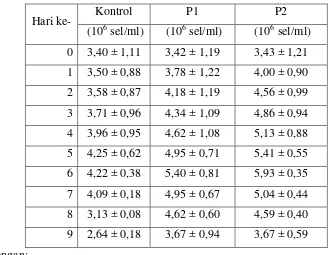
Hari ke- Tanpa Aerasi Menggunakan Aerasi Menggunakan CO2
0 3.40 3.42 3.43
Tabel Kelimpahan Mikroalga Ulangan Ketiga (106 ind/ml)
Hari/Tanggal/Tahun Tanpa Aerasi Aerasi CO2
43
Lampiran 3 Data Suhu, Salinitas dan pH Kultivasi Mikroalga
pH
Hari ke-
Tanpa Aerasi
Menggunakan Aerasi
Menggunakan CO2
0 7.99 7.60 5.38
1 8.05 7.64 5.53
2 8.08 7.63 5.38
3 7.99 7.58 5.34
4 7.94 7.54 5.38
5 7.97 7.55 5.25
6 8.00 7.59 5.46
7 8.07 7.63 5.37
8 8.10 7.66 5.68
45
Lampiran 4 Perhitungan Pertumbuhan Mikroalga
Perhitungan pertumbuhan mikroalga menggunakan Haemocytometer, diamati dengan menggunakan mikroskop dengan perbesaran 40x. Perhitungan
pertumbuhan mikroalga dengan cara sebagai berikut :
N = 579
(ind/ml) = 104
5 25
x x
N ……… (1)
(ind/ml) = 104
5 25
579x x
= 579 x (5 x 104)
= 579 x (5x104)
= 28950000 (dibagi 6, karena dilakukan 6 kali pengamatan)
Lampiran 5 Perhitungan Laju Pertumbuhan
Laju pertumbuhan spesifik (µ) mikroalga dihitung dengan rumus berikut
menurut Krichnavaruk et al (2004).
...
(2)
Contoh : kepadatan Nannochloropsis sp. pada perlakuan menggunakan
karbondioksida hari ke-0 = 3,43×106 ind/ml, kepadatan hari ke-1 = 4,00×106
ind/ml, kepadatan hari ke-2 = 4,56×106 ind/ml dan kepadatan maksimum pada
hari ke-6 = 5,93×106 ind/ml.
Laju pertumbuhan spesifik (µ) pada hari ke-1 adalah
= 0,16
Laju pertumbuhan spesifik (µ) pada hari ke-2 adalah
= 0,13
Laju pertumbuhan spesifik maksimum (µ maks) adalah
47
Lampiran 6 Statistik dan Uji Beda Nyata Terkecil
Anova: Two-Factor Without Replication
SUMMARY Count Sum Average Variance
Row 1 3 10.25 3.416666667 0.0001466
Row 2 3 11.28055556 3.760185185 0.06420782
Row 3 3 12.31944444 4.106481481 0.2452572
Row 4 3 12.90833333 4.302777778 0.33145833
Row 5 3 13.70833333 4.569444444 0.34540123
Row 6 3 14.61388889 4.871296296 0.34007973
Row 7 3 15.54444444 5.181481481 0.75977109
Row 8 3 14.075 4.691666667 0.27435957
Row 9 3 12.34444444 4.114814815 0.73087449
Row 10 3 9.975 3.325 0.35020833
Column 1 10 36.48333333 3.648333333 0.26232373
Column 2 10 43.91944444 4.391944444 0.40317635
Column 3 10 46.61666667 4.661666667 0.61390055
ANOVA
Source of
Variation SS df MS F P-value F crit
Rows 10.13958359 9 1.126620399 14.748248 1.345E-06 2.45628
Columns 5.508506687 2 2.754253344 36.0551001 5.0639E-07 3.55456
Error 1.375022119 18 0.076390118
Total 17.0231124 29
Karena fcritical< F ; maka tolak H0
Perlakuan karbondioksida memberikan pengaruh yang berbeda nyata terhadap
Lampiran 6 (lanjutan)
LSD = 0.08
Nilai Tengah Perlakuan
1. Tanpa Aerasi = 3.65
2. Aerasi = 4.39
3. Menggunakan CO2 = 4.66
Selisih Nilai Tengah Perlakuan
1 2 3
1 0 0.74 1.01
2 0 0.27
3 0
Selisih > LSD ; tolak H0
Setelah dilakukan uji lanjut diketahui bahwa setiap perlakuan memberikan
49
51
53
55
Lampiran 13 Perhitungan Konversi Satuan Alkalinitas
Satuan alkalinitas yang didapat adalah mmol/L CaCO3 akan diubah
menjadi mg/L CaCO3.
Misal : nilai alkalinitas = 0.6952 mmol/L
Jawab :
mmol akan diubah terlebih dahulu menjadi mol (x10-3)
maka : 0.6952 x 10-3
6.952 x 10-4 mol
mol akan diubah menjadi gram (x berat atom CaCO3)
berat atom CaCO3 adalah : Ca : 40.08
C : 12
O : 16
berat atom CaCO3 adalah : 100.8
maka, 6.952 x 10-4 mol x 100.8 = 0.0700 gram
gram akan diubah menjadi mg (x103)
Lampiran 14 Gambar Alat dan Bahan Penelitian
Tabung CO2 Erlenmeyer Aerator
Mikroskop Flow meter Bibit Nannochloropsis sp.
Pipet tetes
57
Lampiran 15 Dokumentasi Penelitian Pendahuluan
Kultivasi Mikroalga
Tanpa Aerasi Menggunakan Aerasi Menggunakan CO2
Lampiran 16 Dokumentasi Penelitian Utama
Kultivasi Mikroalga
Tanpa Aerasi Menggunakan Aerasi Menggunakan CO2
59
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 25 Maret 1987
dari pasangan ayah Fauzan Mansoer dan ibu Suminten. Penulis
merupakan anak kedua dari dua bersaudara.
Pada Tahun 2005 penulis menyelesaikan pendidikan di
Sekolah Menengah Atas Negeri (SMAN) 112 Jakarta . Pada
Tahun yang sama penulis diterima di Institut Pertanian Bogor melalui jalur Seleksi
Penerimaan Mahasiswa Baru (SPMB). Setelah melewati Tingkat Persiapan Bersama
(TPB) selama satu tahun akhirnya penulis di terima di Departemen Ilmu dan
Teknologi Kelautan.
Selama menempuh pendidikan sarjana di IPB penulis aktif di Himpunan
Mahasiswa Ilmu dan Teknologi Kelautan (HIMITEKA-IPB) 2007-2009 sebagai Biro
Kesekretariatan dan Anggota Divisi PSDM dan mengikuti berbagai kepanitiaan.
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan pada
Departemen Ilmu dan Teknologi Kelautan, penulis menyelesaikan skripsi dengan
judul ”Pemanfaatan Karbondioksida (CO2) untuk Kultivasi Mikroalga
iii
FEMI ZUMARITHA. Pemanfaatan Karbondioksida (CO2) untuk Kultivasi
Mikroalga Nannochloropsis sp. sebagai Bahan Baku Biofuel. Dibimbing oleh DIETRIECH G. BENGEN dan MUJIZAT KAWAROE
Penelitian dilakukan berdasarkan pada perkembangan bioteknologi mikroalga dewasa ini yang memanfaatkan mikroalga tidak hanya untuk pakan alami, sel protein tunggal, bidang farmasi dan kesehatan, tetapi juga digunakan sebagai sumber energi alternatif seperti penghasil biofuel. Tujuan dari penelitian ini adalah membandingkan kelimpahan sel mikroalga pada kultivasi tanpa aerasi, menggunakan aerasi dan menggunakan karbondioksida, serta mengkaji pengaruh pemanfaatan karbondioksida pada pertumbuhan mikroalga Nannochloropsis sp.
Penelitian ini dilakukan pada bulan Agustus 2009 hingga bulan April 2010 bertempat di Laboratorium Kultivasi Mikroalga di Pusat Penelitian Surfaktan dan Bioenergi, Lembaga Penelitian dan Pengabdian kepada Masyarakat, Institut Pertanian Bogor. Parameter yang diukur adalah suhu, salinitas dan pH, pada kultivasi dengan menggunakan karbondioksida pengukuran pH dilakukan dua kali untuk menghitung alkalinitas. Selain itu juga dilakukan perhitungan kelimpahan sel mikroalga. Penelitian dilakukan dua tahap, yaitu penelitian pendahuluan dan penelitian utama. Hasil dari penelitian pendahuluan akan dijadikan acuan untuk penelitian utama, pada penelitian pendahuluan didapatkan hasil bahwa pada perlakuan P2 dengan menggunakan karbondioksida peningkatan kelimpahan sel mikroalga merupakan yang tertinggi setiap harinya bila dibandingkan dengan kultivasi kontrol dan kultivasi perlakuan P1. Hasil dari penelitian utama menunjukkan bahwa penggunaan karbondioksida pada perlakuan P2 juga mengalami peningkatan kelimpahan sel tertinggi setiap harinya, pada perlakuan P2 dan P1 puncak kelimpahan sel terjadi pada hari ke-6 sedangkan pada kultivasi kontrol puncak kelimpahan sel terjadi pada hari ke-5.
Parameter kualitas air yang diukur antara lain suhu, salinitas dan pH. Suhu kultivasi berkisar antara 26-27 °C, salinitas berkisar antara 30-34 ‰, pH pada kultivasi kontrol dan kultivasi P1 berkisar antara 7-8. Nilai alkalinitas pada kultivasi P2 masih berada pada kisaran alkalinitas yang baik bagi perairan, dari nilai alkalinitas ini dapat disimpulkan bahwa penggunaan karbondioksida pada kultivasi mikroalga memberikan pengaruh yang baik bagi pertumbuhan
PEMANFAATAN KARBONDIOKSIDA (CO2) UNTUK
KULTIVASI MIKROALGA
Nannochloropsis
sp. SEBAGAI
BAHAN BAKU BIOFUEL
FEMI ZUMARITHA
SKRIPSI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
1 1.1 Latar Belakang
Mikroalga adalah tumbuhan tingkat rendah yang dapat berfotosintesis dan
dapat tumbuh dengan cepat. Menurut Mata, et al, (2010), mikroalga merupakan
mikroorganisme prokariotik atau eukariotik yang dapat berfotosintesis dan dapat
tumbuh cepat pada kondisi yang sulit. Mikroalga dapat digunakan sebagai pakan
rotifer dan artemia. Salah satu cara untuk memproduksi biomassa mikroalga
dalam jumlah yang besar maka dilakukan kultivasi.
Kultivasi mikroalga dapat dilakukan pada beberapa tingkatan, dari skala
yang kecil hingga skala massal. Isnansetyo dan Kurniastuty (1995) dalam
bukunya juga menuturkan bahwa kultivasi mikroalga dimulai dari kegiatan isolasi
kemudian dikembangkan sedikit demi sedikit secara bertingkat. Kultivasi skala
laboratorium dilakukan pada volume 50 ml-3 liter, lalu dilakukan kultivasi semi
outdoor dengan volume 60-100 liter dan kultivasi massal dengan volume ≥ 1 ton.
Kultivasi mikroalga dengan penambahan karbondioksida merupakan salah satu
cara untuk meningkatkan kelimpahan sel mikroalga.
Pemanfaatan karbondioksida pada kultivasi mikroalga dilakukan untuk
meningkatkan kelimpahan sel mikroalga. Menurut Chiu, et al. (2008) dalam
penelitiannya penggunaan karbondioksida ke dalam kultivasi mikroalga dapat
meningkatan kelimpahan sel mikroalga hingga 50 %. Dengan demikian,
mikroalga khususnya mikroalga laut memiliki potensi untuk mengurangi
2
1.2 Tujuan
Tujuan dari penelitian ini adalah:
1. Membandingkan laju pertumbuhan sel mikroalga antara kultivasi kontrol,
perlakuan menggunakan aerasi, dan perlakuan menggunakan karbondioksida.
2. Mengkaji pengaruh pemanfaatan karbondioksida terhadap pertumbuhan