1.1 Latar Belakang
Terbentuk radikal bebas dalam tubuh kita secara terus-menerus melalui peristiwa metabolisme sel normal, peradangan, kekurangan gizi dan akibat respons terhadap pengaruh dari luar tubuh misalnya polusi lingkungan, sinar ultraviolet dan asap rokok. Lingkungan tercemar, kesalahan pola makan dan gaya hidup, mampu merangsang tumbuhnya radikal bebas (free radical) yang dapat merusak tubuh kita (Mega dan Swastini 2010). Radikal bebas merupakan salah satu penyebab timbulnya penyakit degeneratif antara lain kangker, aterosklerosis, stroke, rematik dan jantung (Steinberg 2009; Theroux dan Libby 2005).
Upaya untuk mencegah atau mengurangi resiko yang ditimbulkan oleh aktivitas radikal bebas adalah dengan mengkonsumsi makanan atau suplemen
yang mengandung antioksidan. Antioksidan dapat menetralkan radikal bebas dengan cara mendonorkan satu atom protonnya sehingga membuat radikal bebas
stabil dan tidak reaktif (Lusiana 2010). Berdasarkan sumbernya, secara umum antioksidan digolongkan dalam dua jenis, yaitu antioksidan sintetik dan antioksidan alami. Contoh antioksidan sintetik yang sering digunakan masyarakat antara lain butylated hydroxyanisole (BHA), butylated hydroxytoluene (BHT), tert-butylhydroquinone (TBHQ) dan α-tocopherol (Irianti 2008). Keuntungan menggunakan antioksidan sintetik adalah aktivitas anti radikalnya yang sangat kuat, namun ternyata terdapat kekurangannya. Berdasarkan hasil penelitian yang dilakukan Wichi (1988) dan Thompson & Moldeus (1988), antioksidan sintetik BHA dan BHT berpotensi karsinogenik. Untuk itu pencarian sumber antioksidan alami sangat dibutuhkan untuk menggantikan peran antioksidan sintetik. Irianti (2008) menyatakan bahwa antioksidan alami sebenarnya telah lama digunakan secara turun temurun, namun belum banyak diteliti aktivitas dan kandungan bioaktifnya.
tanaman mangrove. Indonesia merupakan negara yang memiliki hutan mangrove terluas di dunia, dengan luas hutan mangrove sekitar 3,5 juta hektar (Noor et al. 2006). Sekitar 202 jenis spesies mangrove di Indonesia telah teridentifikasi dan dari sekian banyak tanaman mangrove yang tumbuh subur di Indonesia tersebut, Api-api (Avicennia marina) merupakan jenis mangrove yang sangat berpotensi untuk diteliti kandungan bioaktifnya, terutama kandungan antioksidan.
Mangrove Api-api merupakan salah satu jenis mangrove yang tersebar diseluruh Indonesia dengan kondisi yang melimpah (Noor et al. 2006). Api-api (A. marina) telah dikenal sejak dulu oleh masyarakat karena banyaknya manfaat yang dimilikinya. Mahera et al. (2011) mengatakan bahwa Api-api merupakan salah satu spesies mangrove yang sangat penting. Miles et al. (1998) menyebutkan bahwa Api-api menunjukkan aktifitas antimalaria dan aktivitas sitotoksik. Daun Api-api telah lama digunakan dalam pengobatan tradisional
untuk pengobatan penyakit kulit, rematik, cacar, bisul dan pakan hewan di peternakan (Fauvel et al. 1993; Bandaranayake 2002). Di Indonesia, khususnya masyarakat pantai Cilincing Jakarta Utara ada yang memanfaatkan daun tumbuhan Api-api yang masih muda sebagai bahan sayur urap, demikian pula
masyarakat pantai di Jawa Timur (Santoso et al. 2005). Potensi Api-api (A. marina) yang begitu besar, maka perlu dilakukan penelitian mengenai
karakteristiknya meliputi struktur jaringan, komposisi kimiawi, kandungan bioaktif dan aktivitas antioksidannya, serta aplikasi senyawa antioksidan dalam menghambat proses oksidasi pada minyak.
1.2 Tujuan
Tujuan penelitian ini adalah:
1) Mempelajari karakteristik daun tanaman mangrove Api-api (A. marina) yang meliputi struktur jaringan dan komposisi kimiawi (karbohidrat, kadar lemak, kadar protein, kadar abu, kadar air dan kadar serat kasar).
2) Menentukan aktivitas antioksidan dari ekstrak daun Api-api (A. marina) yang diperoleh dari ekstraksi berbagai pelarut.
Ekosistem mangrove merupakan sumber alami tannin dan kayu yang bernilai tinggi. Sebagai contoh, batang kayu rizhopora yang keras digunakan untuk pembuatan kapal tahan rayap dan organisme laut (Rao 1994). Tanaman
mangrove dipakai sebagai obat masyarakat untuk mengobati beragam penyakit selama berabad-abad. Beberapa tanaman mangrove telah ditapis beberapa
aktivitasnya, yaitu antiviral, antibakteri, antibisul, dan antiinflamasi (Agoramoorthy et al. 2008)
Tumbuhan A. marina merupakan salah satu jenis mangrove yang sudah lama dikenal oleh penduduk di Indonesia, mereka mengenalnya dengan nama yang berbeda-beda tergantung pada daerah masing-masing. Di Pulau Jawa tumbuhan ini dikenal dengan nama pohon Api-api, di Pulau Bali dikenal dengan nama pohon Prapat dan di Sumatera Selatan dikenal dengan nama kayu Api-api betina (Yusuf 2010). Bentuk dan morfologi daun Api-api dapat dilihat pada Gambar 1. Klasifikasi A. marina menurut Duke et al. (2008) adalah sebagai berikut:
Kingdom : Plantae Filum : Thacheophyta Kelas : Magnoliopsida Ordo : Lamiales
Famili : Avicenniaceae Genus : Avicennia
Spesies : Avicennia marina (Forsk.) Vierh
Tanaman Api-api (A. marina) termasuk pepohonan semak hingga medium dengan ketinggian 2-5 meter (Peng dan Xin-men 1983). Spesies ini ditemukan dari daerah hilir hingga pertengahan perairan payau di semua kawasan pasang surut (Robertson dan Alongi 1992). Menurut Peng dan Xin-men (1983) A. marina ditemukan di mulut sungai atau di area pasang terendah dan toleran terhadap salinitas maksimum air payau, yaitu 85 ppt (part per thousand). Pertumbuhan
optimal terdapat pada salinitas 0-30 ppt (Robertson dan Alongi 1992). Supriharyono (2002) menyatakan bahwa A. marina merupakan salah satu jenis penyusun magrove yang dapat bertahan pada tempat-tempat yang bersalinitas
hingga lebih dari 90 ‰.
Tanaman Api-api (A. marina) memiliki banyak sekali manfaat dan
kegunaan, baik dalam bidang pangan, pakan, perumahan, farmasi dan lain sebagainya. Yusuf (2010) menyebutkan, tumbuhan kayu Api-api (A. marina) dapat digunakan untuk kayu bakar, perabot rumah tangga, mengasapi ikan, juga dapat digunakan untuk membuat lumpang padi. Kulit batangnya dapat dimanfaatkan sebagai obat-obatan tradisional misalnya obat sakit gigi, dan menurut Yusuf (2010) kulit batangnya mempunyai khasiat terhadap penurunan produksi hormon seksual (afrodisiaka) dan sering digunakan sebagai antifertilitas. Buahnya dapat dimakan dengan merebusnya terlebih dahulu, kemudian direndam semalam lalu dibersihkan dari kotorannya. Api-api (A. marina) secara tradisional telah dimanfaatkan sebagai obat-obatan untuk rematik, cacar air, borok/bisul dan penyakit ringan lainnya (Bandaranayake 2002). Tariq et al. (2007) menyatakan bahwa A. marina melepaskan senyawa- senyawa yang bersifat toksik terhadap nematoda yaitu phenol, tannin, azadirachtin dan ricinin.
2.2 Radikal Bebas
Radikal bebas adalah molekul yang kehilangan elektron, sehingga molekul tersebut menjadi tidak stabil dan selalu berusaha mengambil elektron dari molekul
hidrogen peroksida, asam hipoklorit (HOCl), asam hipobromous (HOBr), dan peroksinitrit (ONOO-). Reactive Oxygen Spesies (ROS), Reactive Nitrogen Spesies (RNS) diproduksi di dalam tubuh manusia secara fisiologis dan patologis (Fang et al. 2002).
Radikal bebas dapat menyebabkan oksidasi DNA, sehingga DNA termutasi dan menimbulkan kanker (Muchtadi 2000). Radikal bebas merupakan
penyebab timbulnya penyakit jantung koroner. Hal ini dikarenakan molekul besar lemak yang disebut LDL atau low density lipoprotein teroksidasi oleh radikal bebas akan mengendap di pembuluh darah jantung sehingga menjadi sempit dan
aliran darah terganggu sehingga sebagian sel-sel jantung tidak cukup makanan dan mati. Selain itu, kerusakan protein akibat elektronnya diambil oleh radikal bebas dapat mengakibatkan sel-sel jaringan tempat protein berada menjadi rusak dan banyak terjadi pada lensa mata sehingga menyebabkan penyakit katarak (Kumalaningsih 2006).
2.3 Antioksidan
2.3.1 Definisi antioksidan, jenis dan sumbernya
Secara umum, antioksidan didefinisikan sebagai senyawa yang dapat menunda, memperlambat dan mencegah proses oksidasi. Dalam arti khusus, antioksidan adalah zat yang dapat menunda atau mencegah terjadinya reaksi oksidasi radikal bebas dalam oksidasi lipid (Kochar dan Rossell 1990). Sauriasari (2006) menyatakan bahwa antioksidan adalah zat yang dapat melawan pengaruh bahaya radikal bebas atau Reactive Oxygen Spesies (ROS) yang terbentuk sebagai hasil dari metabolisme oksidatif yaitu hasil dari reaksi- reaksi kimia dan proses metabolik yang terjadi di dalam tubuh.
Antioksidan sangat beragam jenisnya. Berdasarkan sumbernya antioksidan dibagi dalam dua kelompok, yaitu antioksidan sintetik (antioksidan yang diperoleh dari hasil sintesis kimia) dan antioksidan alami (antioksidan hasil ekstraksi bahan alami) (Trilaksani 2003)
1) Antioksidan sintetik
Diantara beberapa contoh antioksidan sintetik yang diijinkan untuk
makanan, ada lima antioksidan yang penggunaannya meluas dan menyebar di seluruh dunia, yaitu Butylated Hidroxy Anisol (BHA), Butylated Hidroxy Toluen (BHT), propil galat, Tert-Butylated Hidroxy Quinone (TBHQ) dan tokoferol. Antioksidan tersebut merupakan antioksidan alami yang telah diproduksi secara sintesis untuk tujuan komersial (Buck 1991)
Butilated Hidroxy Anisole memiliki kemampuan antioksidan yang baik pada lemak hewan dalam sistem makanan panggang, namun relatif tidak efektif pada minyak tanaman. BHA bersifat larut lemak dan tidak larut air, berbentuk padat putih dan dijual dalam bentuk tablet atau serpih, bersifat volatil sehingga berguna untuk penambahan ke materi pengemas (Buck 1991; Coppen 1983)
Antioksidan BHT memiliki sifat serupa BHA, dan akan memberikan efek sinergis bila dimanfaatkan bersama BHA, berbentuk kristal padat putih dan digunakan secara luas karena relatif murah (Sherwin 1990). Antioksidan propil galat mempunyai karakteristik sensitif terhadap panas, terdekomposisi pada titik cairnya 148 oC, dapat membentuk komplek warna dengan ion metal, sehingga kemampuan antioksidannya rendah. Propil galat berbentuk kristal padat putih, sedikit tidak larut lemak tetapi larut air, serta memberi efek sinergis dengan BHA dan BHT (Buck 1991). Rahardjo & Hernani (2006) menyatakan bahwa kedua senyawa antioksidan (BHT dan BHA) tersebut banyak dimanfaatkan dalam
industri makanan dan minuman, namun beberapa hasil penelitian yang dilakukan oleh para ilmuwan telah membuktikan bahwa antioksidan tersebut mempunyai
efek samping yang tidak diinginkan, yaitu berpotensi sebagai karsinogenik terhadap efek reproduksi dan metabolisme, bahkan dalam jangka waktu lama tidak terjamin keamanannya.
memiliki kemampuan antioksidan yang baik pada penggorengan tetapi rendah pada pembakaran. Tert-Butylated Hidroxy Quinone (TBHQ) direkomendasikan dengan BHA yang memiliki kemampuan antioksidan yang baik pada pemanggangan, maka akan memberikan kegunaan yang lebih luas. Antioksidan TBHQ berbentuk bubuk putih sampai coklat terang, mempunyai kelarutan cukup pada lemak dan minyak, tidak membentuk kompleks warna dengan Fe dan Cu
tetapi dapat berubah menjadi warna merah jambu dengan adanya basa (Buck 1991). Tokoferol merupakan antioksidan alami yang dapat ditemukan pada hampir di setiap minyak tanaman, tetapi saat ini telah dapat diproduksi secara
kimia. Tokoferol memiliki karakteristik berwarna kuning terang, cukup larut dalam lipida karena rantai C panjang. Pengaruh nutrisi secara lengkap dari tokoferol belum diketahui, tetapi α-tokoferol dikenal sebagai sumber vitamin E. Di dalam jaringan hidup, aktivitas antioksidan tokoferol cenderung α->β-> ->δ -tokoferol, tetapi dalam makanan aktivitas tokoferol terbalik δ-> ->β-> α-tokoferol (Belitz et al. 2009). Tetapi menurut Sherwin (1990), urutan tersebut terkadang bervariasi tergantung pada substrat dan kondisi lain.
2) Antioksidan alami
Antioksidan alami di dalam makanan dapat berasal dari (a) senyawa antioksidan yang sudah ada dari satu atau dua komponen makanan, (b) senyawa antioksidan yang terbentuk dari reaksi- reaksi selama proses pengolahan, (c) senyawa antioksidan yang diisolasi dari sumber alami dan ditambahkan ke makanan sebagai bahan tambahan (Pratt 1992). Senyawa antioksidan alami diantaranya adalah asam fenolik, flavonoid, β- karoten, vitamin E (tokoferol), vitamin C, asam urat, bilirubin dan albumin (Gheldof et al. 2002). Zat-zat gizi mineral misalnya mangan, seng, tembaga dan selenium juga berperan sebagai
antioksidan (Mega dan Swastini 2010).
Antioksidan berdasarkan aktivitasnya dapat dibedakan menjadi antioksidan
Antioksidan sekunder adalah suatu zat yang dapat mencegah kerja prooksidan sehingga dapat digolongkan secara sinergik. Beberapa asam organik tertentu, biasanya asam di- atau trikarboksilat, dapat mengikat logam-logam (sequestran). Contoh lain antioksidan sekunder antara lain turunan-turunan asam fosfat, senyawa karoten, sterol, fosfolipid, dan produk-produk reaksi Maillard. Tujuan dasar dari antioksidan sekunder adalah mencegah terjadinya radikal yang
paling berbahaya yaitu radikal hidroksil (BlueFame Forums 2008)
Ketaren (1986) menyatakan bahwa umumnya antioksidan memiliki struktur inti yang sama, yaitu mengandung cincin benzena tidak jenuh disertai
gugus hidroksil atau asam amino. Antioksidan berdasarkan gugus fungsinya dibagi atas tiga golongan, yaitu golongan fenol, amin dan aminfenol. Adapun penggolongan antioksidan menurut Ketaren (1986), adalah sebagai berikut:
1) antioksidan golongan fenol
Antioksidan yang termasuk golongan ini biasannya memiliki ciri intensitas warna yang rendah atau tidak berwarna sama sekali dan banyak digunakan karena beracun. Antioksidan golongan fenol meliputi sebagian besar antioksidan yang dihasilkan alam dan sejumlah kecil antioksidan sintesis. Beberapa contoh antioksidan yang termasuk golongan ini antara lain hidrokuinon, gosipol, katekol, resorsiol, dan eugenol.
2) antioksidan golongan amin
Antioksidan yang mengandung gugus amino dan diamino yang terikat pada cincin benzene berpotensi tinggi sebagai antioksidan, namun beracun dan biasanya menghasilkan warna yang intensif jika dioksidasi atau bereaksi dengan ion logam, selain itu umumnya stabil pada suhu panas dan ekstrasi dengan kaustik. Antioksidan yang termasuk dalam golongan ini adalah N,N difenilen
diamin, difenilhidrasin, difenil guanidine dan difenil amin. 3) antioksidan golongan aminfenol
terikat pada cincin aromatis memegang peranan penting dalam aktivitas antioksidan. Potensi antioksidan tersebut diperbesar oleh adanya substitusi gugus lain yang terikat pada cincin aromatis.
2.3.2 Mekanisme Oksidasi Lemak
Meyer (1973) dan Hamilton (1983) menyebutkan bahwa autooksidasi lipida berlangsung dalam dua tahap. Selama tahap pertama autooksidasi berjalan
lambat dengan laju kecepatan seragam. Tahap pertama ini sering disebut periode induksi. Oksidasi periode induksi ini berlangsung beberapa waktu sampai pada waktu titik tertentu dimana reaksi memasuki tahap kedua yang mempunyai laju
oksidasi dipercepat. Laju pada oksidasi tahap kedua beberapa kali lebih cepat dari laju oksidasi tahap pertama. Umumnya lemak dan minyak mulai terasa tengik pada awal tahap kedua. Asam lemak yang memiliki ikatan rangkap lebih banyak (misalnya asam linoleat) bereaksi lebih cepat dibanding yang berikatan rangkap lebih sedikit (asam oleat) sehingga periode induksinya lebih pendek.
Mekanisme oksidasi lipida tidak jenuh dimulai dengan tahap inisiasi, yaitu terbentuknya radikal bebas (R*) bila lipida kontak dengan panas, cahaya, ion metal dan oksigen. Reaksi ini terjadi pada group metilen yang berdekatan dengan ikatan rangkap –C=C- (Buck 1991). Hal ini diperkuat oleh pernyataan Gordon (1990) bahwa tahap inisiasi terjadi karena bantuan sumber energi eksternal misalnya panas, cahaya atau energi tinggi dari radiasi, inisiasi kimia dengan terlarutnya ion logam dan metaloprotein misalnya haem.
Tahap selanjutnya adalah tahap propagasi dimana autooksidasi berawal ketika radikal lipida (R*) hasil tahap inisiasi bertemu dengan oksigen membentuk radikal peroksida (ROO*). Reaksi oksigenasi ini terjadi sangat cepat dengan energi aktivitas hampir nol sehingga konsentrasi ROO* yang terbentuk jauh lebih
besar dari konsentrasi R* dalam system makanan dimana oksigen berada (Gordon 1990). Radikal peroksida yang terbentuk akan mengekstrak ion hidrogen dari
lipida lain (R1H) membentuk hidroperoksida (ROOH) dan molekul radikal lipida baru (R1*). Selanjutnya reaksi autooksidasi ini akan berulang sehingga merupakan reaksi berantai.
berantai pendek yaitu aldehid, keton, alkohol dan asam (Trilaksani 2003). Buch (1991) menyebutkan faktor-faktor dan kondisi yang dapat ikut berperan pada oksidasi lipida antara lain (a) panas, setiap peningkatan suhu sebesar 10 oC laju kecepatan meningkat dua kali lipat, (b) cahaya, terutama ultraviolet yang merupakan inisiator dan katalisator kuat, (c) logam berat, logam terlarut misalnya Fe, Cu merupakan katalisator kuat meski dalam jumlah kecil, (d) kondisi alkali,
kondisi basa, ion alkali merangsang radikal bebas, (e) tingkat ketidakjenuhan, jumlah dan posisi ikatan rangkap pada molekul lipida berhubungan langsung dengan kerentanan terhadap oksidasi, sebagai contoh asam linoleat lebih rentan
dibanding asam oleat, dan (f) ketersediaan oksigen.
2.3.3 Mekanisme kerja antioksidan
Sesuai mekanisme kerjanya, antioksidan memiliki dua fungsi. Fungsi pertama merupakan fungsi utama dari antioksidan yaitu sebagai pemberi atom hidrogen. Antioksidan (AH) yang mempunyai fungsi utama tersebut sebagai antioksidan primer. Senyawa ini dapat memberikan atom hidrogen secara cepat ke radikal lipida (R*, ROO*) atau mengubahnya ke bentuk lebih stabil, sementara turunan radikal antioksidan (A*) tersebut memiliki keadaan lebih stabil dibanding radikal lipida. Fungsi kedua merupakan fungsi sekunder antioksidan, yaitu memperlambat laju autooksidasi dengan berbagai mekanisme di luar mekanisme pemutusan rantai autooksidasi dengan pengubahan radikal lipida ke bentuk lebih stabil (Gordon 1990).
Penambahan antioksidan (AH) primer dengan konsentrasi rendah pada lipida dapat menghambat atau mencegah reaksi autooksidasi lemak dan minyak. Penambahan tersebut dapat menghalangi reaksi oksidasi pada tahap inisiasi maupun propagasi. Radikal- radikal antioksidan (A*) yang terbentuk pada reaksi
tersebut relatif stabil dan tidak mempunyai cukup energi untuk dapat bereaksi dengan molekul lipida lain membentuk radikal lipida baru. Menurut Hamilton
Gambar 2 Reaksi penghambatan antioksidan primer terhadap radikal lipida (Gordon 1990)
Besarnya konsentrasi antioksidan yang ditambahkan dapat berpengaruh pada laju oksidasi. Pada konsentrasi tinggi, aktivitas antioksidan grup fenolik sering lenyap, bahkan antioksidan tersebut menjadi prooksidan. Pengaruh jumlah konsentrasi pada laju oksidasi tergantung pada struktur antioksidan, kondisi dan sampel yang akan diuji.
AH + O2 --- A* + HOO*
AH + ROOH --- RO* + H2O + A*
Gambar 3 Antioksidan bertindak sebagai prooksidan pada konsentrasi tinggi (Gordon 1990)
Trilaksani (2003) berpendapat bahwa penghambatan oksidasi lipida oleh antioksidan melalui lebih dari satu mekanisme tergantung pada kondisi reaksi dan sistem makanan. Ada empat kemungkinan mekanisme penghambatan tersebut
yaitu (a) pemberian hidrogen, (b) pemberian elektron, (c) penambahan lipida pada cincin aromatik antioksidan, (d) pembentukan kompleks antara lipida dan cincin
aromatik antioksidan. Studi lebih lanjut menunjukkan bahwa ketika atom hidrogen labil pada suatu antioksidan tertentu diganti dengan deuterium, antioksidan tersebut menjadi tidak efektif. Hal ini menunjukkan bahwa mekanisme penghambatan dengan pemberian atom hidrogen lebih baik dibanding pemberian elektron. Beberapa peneliti percaya bahwa pemberian hidrogen atau elektron merupakan mekanisme utama. Sementara pembentukan kompleks antara antioksidan dengan rantai lipida adalah reaksi sekunder.
Antioksidan sekunder, misalnya asam sitrat, asam askorbat, dan esternya, sering ditambahkan pada lemak dan minyak sebagai kombinasi dengan antioksidan primer. Kombinasi tersebut dapat memberi efek sinergis sehingga
Inisiasi ; R* + AH ---RH + A* Radikal lipida Antioksidan
menambah keefektifan kerja antioksidan primer. Antioksidan sekunder ini bekerja dengan satu atau lebih mekanisme berikut (a) memberikan suasana asam pada medium (sistem makanan), (b) meregenerasi antioksidan lama, (c) mengkelat atau mendeaktifkan kontaminan logam prooksidan, (d) menangkap oksigen, (e) mengikat singlet osigen dan mengubahnya ke bentuk triplet oksigen (Gordon 1990)
Trilaksani (2003) menegaskan bahwa antioksidan sebaiknya ditambahkan ke lipida seawal mungkin untuk menghasilkan efek maksimum. Menurut Coppen (1983), antioksidan hanya akan benar-benar efektif bila ditambahkan seawal
mungkin selama periode induksi, yaitu suasana periode awal oksidasi lipida terjadi, dimana oksidasi masih berjalan secara lambat dengan kecepatan seragam.
2.3.4 Metode uji aktifitas antioksidan
Pengujian anti radikal bebas senyawa-senyawa bahan alam atau sintesis dapat dilakukan secara reaksi kimia dengan menggunakan 1,1-Di Phenyl-2-Picryl Hydrazyl (DPPH) sebagai senyawa radikal bebas yang stabil dengan melihat proses penghambatan panjang gelombang maksimumnya pada spektrofotometer UV-Vis. Molyneux (2004) mengemukakan bahwa metode uji DPPH merupakan salah satu metode yang paling banyak digunakan untuk memperkirakan efisiensi kinerja dari substansi yang berperan sebagai antioksidan. Hannani et al. (2005) juga menambahkan bahwa metode DPPH dipilih karena sederhana, murah, cepat dan peka serta hanya memerlukan sedikit sampel.
1,1-Di Phenyl-2-Picryl Hydrazyl ( DPPH ) merupakan radikal bebas yang stabil pada suhu kamar dan sering digunakan untuk mengevaluasi aktivitas antioksidan beberapa senyawa atau ekstrak bahan alam. Prinsip dari uji aktivitas antioksidan dengan DPPH adalah DPPH yang menerima elektron atau radikal
hidrogen akan membentuk molekul diamagnetik yang stabil. Interaksi antioksidan dengan DPPH baik secara transfer elektron atau radikal hidrogen pada DPPH,
Penghambatan warna ungu merah (absorbansi pada 517 ± 20 nm) dikaitkan dengan kemampuan sebagai anti radikal bebas (free radical scavenger) (Mega dan Swastini 2006). Molyneux (2004) mengatakan bahwa DPPH adalah radikal bebas yang bersifat stabil dan beraktivitas dengan cara mendelokalisasi elektron bebas pada suatu molekul, sehingga molekul tersebut tidak reaktif sebagaimana radikal bebas lain. Proses delokalisasi ini ditunjukkan dengan
adanya warna ungu (violet) pekat yang dapat dikarakterisasi pada pita absorbansi dalam pelarut etanol pada panjang gelombang 520 nm.
Adapun reaksi penghambatan DPPH dengan senyawa anti radikal bebas
dapat dilihat pada Gambar 4.
Gambar 4 Contoh mekanisme penghambatan antioksidan (tokoferol) terhadap radikal bebas (DPPH) (Mega dan Swastini 2010)
2.4 Ekstraksi Senyawa Aktif
Khopkar (2003) menyatakan bahwa ekstraksi adalah suatu proses penarikan komponen yang diinginkan dari suatu bahan dengan cara pemisahan satu atau lebih komponen dari suatu bahan yang merupakan sumber komponennya. Faktor- faktor yang berpengaruh terhadap proses ekstraksi adalah lama ekstraksi, suhu, dan jenis pelarut yang digunakan. Ekstraksi dapat dilakukan
dengan dua cara yaitu fase air dan fase organik. Fase air dilakukan dengan menggunakan pelarut air dan fase organik merupakan ekstraksi yang dilakukan dengan menggunakan pelarut organik (Winarno et al. 1973). Hal yang harus diperhatikan dalam pemilihan jenis pelarut yang digunakan adalah daya melarutkan, titik didih, sifat toksik, mudah tidaknya terbakar, dan sifat korosif terhadap peralatan ekstraksi.
Menurut Harborne (1984) hal lain yang perlu diperhatikan dalam pemilihan pelarut adalah selektivitas, kemampuan untuk mengekstrak, toksisitas, kemudahan untuk diuapkan, dan harga pelarut. Jenis dan mutu pelarut yang digunakan sangat menentukan keberhasilan proses ekstraksi, pelarut yang digunakan harus dapat melarutkan zat yang diinginkannya, mempunyai titik didih yang rendah, murah, tidak toksik dan tidak mudah terbakar (Ketaren 1986). Nur dan Adijuwana (1989) menyatakan bahwa sifat penting yang harus diperhatikan dalam pemilihan pelarut adalah kepolaran senyawa yang dilihat dari gugus polarnya (misal gugus OH, COOH). Derajat polaritas tergantung pada konstanta dielektrik, makin besar konstanta dielektrik semakin polar pelarut tersebut. Beberapa pelarut organik dan sifat-sifat fisiknya dapat dilihat pada Tabel 1.
Tabel 1 Beberapa pelarut organik dan sifat fisiknya
Pelarut non polar merupakan salah satu pelarut yang dikenal efektif terhadap alkaloid dalam bentuk basa dan terpenoid dari bahan. Pelarut nonpolar juga mengekstrak senyawa kimia misalnya lilin, lemak, dan minyak yang mudah menguap. Pelarut semi polar mampu mengekstrak senyawa fenol, terpenoid, alkaloid, aglikon dan glikosida. Pelarut yang bersifat polar, mampu mengekstrak senyawa alkaloid kuartener, komponen fenolik, karotenoid, tanin, gula, asam
amino dan glikosida (Harbone 1987).
Metode ekstraksi dikelompokkan menjadi dua yaitu ekstraksi sederhana dan ekstraksi khusus (Harborne 1984). Ekstraksi sederhana antara lain terdiri atas
maserasi, perkolasi, reperkolasi, evakolasi dan diakolasi. Ekstraksi sederhana menurut Harbone (1984) adalah sebagai berikut:
a) maserasi, yaitu metode ekstraksi dengan cara merendam sampel dalam pelarut dengan atau tanpa pengadukan;
b) perkolasi, yaitu metode ekstraksi secara berkesinambungan;
c) reperkolasi, yaitu perkolasi dimana hasil perkolasi digunakan untuk melarutkan sampel di dalam perkolator sampai senyawa kimianya terlarutkan;
d) evakolasi, yaitu perkolasi dengan pengurangan tekanan udara; e) diakolasi, yaitu perkolasi dengan penambahan tekanan udara.
Metode ekstraksi khusus antara lain soxhletasi, arus balik, dan ultrasonik. Ekstraksi khusus menurut Harbone (1984) antara lain:
a) soxhletasi, yaitu metode ekstraksi secara berkesinambungan untuk melarutkan sampel kering dengan menggunakan pelarut bervariasi;
b) arus balik, yaitu metode ekstraksi secara berkesinambungan dimana sampel dan pelarut saling bertemu melalui gerakan aliran yang berlawanan;
c) ultrasonik, yaitu ekstraksi dengan menggunakan alat yang menghasilkan
frekuensi bunyi atau getaran antara 25-100 KHz.
Proses ekstraksi terdiri dari beberapa tahap yaitu tahap penghancuran
perendaman yang dilakukan disebut maserasi. Tahap selanjutnya adalah tahap pemisahan yang terdiri dari penyaringan dan evaporasi. Penyaringan dilakukan untuk memisahkan residu bahan dan pelarut yang telah mengandung senyawa bioaktif. Pemisahan pelarut dengan senyawa bioaktif yang terikat dilakukan dengan evaporasi sehingga pelarut akan menguap dan diperoleh senyawa hasil ekstraksi. Hasil ekstrak yang diperoleh akan tergantung pada beberapa faktor
antara lain kondisi alamiah senyawa tersebut, metode ekstraksi yang digunakan, ukuran partikel sampel, kondisi dan waktu penyimpanan, lama waktu ekstraksi, dan perbandingan jumlah pelarut terhadap jumlah sampel (Darusman et al. 1995)
2.5 Komponen Bioaktif
Bentuk metabolit sekunder menunjukkan sejumlah molekul yang sedikit penting terhadap tanaman dan memiliki peranan utama dalam perlindungan tanaman dari tekanan lingkungan atau dalam pengontrolan pertumbuhan tanaman (Harborne 1999).
2.5.1 Terpenoid/steroid
Terpenoid atau isoprenoid dicirikan dengan biosintesis dari isopentenil dan dimetilalil pirofosfat dan sifatnya yang secara umum lipofilik. Terpenoid adanya di kelenjar trikoma daun, di pucuk exudates dan kayu damar. Secara kimia, terpenoid pada dasarnya hidrokarbon tidak jenuh siklik, dengan derajat keragaman oksigenasi dalam kelompok pengganti yang dilekatkan terhadap kerangka karbon utama. Terpenoid dikelompokkan berdasarkan jumlah 5-atom karbon (C5) (Harborne 1999). Monomer aktif dari isoprenoid adalah isopentenilpirofosfat (IPP) yang digunakan untuk membangun monoterpen (C10), sesquiterpen (C15), dan diterpen (C20) (Edwards dan Gatehouse 1999).
Terpenoid memiliki potensi anti-inflamasi tidak hanya in-vivo pada sel hewan, tetapi juga ex-vivo. Beberapa terpenoid bertindak sebagai hormon tanaman yang mengatur fungsi fisiologis yang berbeda dan metabolit sekunder
Tabel 2 Subklasifikasi terpenoid
Kelas terpenoid Deskripsi
Monoterpenoid Volatil, unsur minyak esensial
Iridoid Lakton yang berasa pahit, biasanya dalam bentuk glikosidik
Unsur minyak esensial yang tinggi titik didihnya
Karakteristik dari famili Compositae
Gambar 5 Beberapa terpenoid dan alkaloid steroid (Robinson 1995)
2.5.2 Alkaloid dan metabolit nitrogen lainnya
Alkaloid merupakan basa-basa organik yang memiliki sebuah atom nitrogen sebagai bagian dari srukturnya, biasanya terkait ke dalam suatu sistem siklik lima atau enam karbon. Distribusi alkaloid terbatas pada tumbuhan tingkat tinggi, sekitar 20 % dari spesies angiospermae. Metabolit-nitrogen juga terbatas di alam. Keterbatasan distribusi metabolit ini disebabkan oleh ketersediaan unsur dari metabolit ini juga terbatas. Metabolit-nitrogen merupakan turunan dari satu atau lebih asam amino protein (Harborne 1999).
Metabolit-nitrogen lainnya yang berperan penting adalah glukosinolat, cianogenik glikosida, dan asam amino non-protein. Bentuk lebih lanjut dari metabolit-nitrogen adalah betalain, pigmen tanaman. Asam amino lisin, ornitin, fenilalanin, tirosin, triptofan, dan histidin merupakan sumber N dari mayoritas alkaloid pada tanaman (Edwards dan Gatehouse 1999).
Alkaloid biasanya diekstraksi dari tumbuhan dengan pelarut alkohol yang bersifat asam lemah (HCl 1M atau asam asetat 10%), kemudian diendapkan dengan amoniak pekat. Pemurnian selanjutnya dilaksanakan dengan ekstraksi pelarut (ekstraksi cair-cair). Adanya alkaloid pada ekstrak nisbi kasar dapat diuji
Tabel 3 Klasifikasi alkaloid dan metabolit-nitrogen lainnya pada tanaman
Metabolit Metabolit
Alkaloid: 11. Pirolizidin
1) Amaryllidaceae 12. Quinolin
2) Betalain 13. Quinolizidin
3) Diterpenoid (kadang beracun) 14. Steroidal
4) Indol 15. Tropana
5) Isoquinolin (kelompok terbesar alkaloid) Asam amino non-protein
6) Likopodium Amina
7) Monoterpen Cianogenik glikosida
8) Sesquiterpen Glukosinolat
9) Peptida Purin dan Pirimidin (termasuk
kafein pada kopi dan teh)
10) Pirolidin dan piperidin
Sumber : Harborne (1999)
Struktur beberapa senyawa alkaloid (Robinson 1995) dapat dilihat pada Gambar 6 berikut.
Gambar 6. Beberapa penggolongan alkaloid (Robinson 1995)
2.5.3 Metabolit fenol
tanaman termasuk pertahanan dari herbivor dan patogen, penyerapan cahaya, penarik pollinator, penghambat pertumbuhan dari tanaman pesaing, dan simbiosis dengan bakteri penyedia nitrogen (Wildman 2001).
Fenol turut andil dalam biosintetis dari fenilalanin, merupakan salah satu dari tiga asam amino protein yang dibentuk dari sedoheptulosa melalui jalur shikimate. Asam p-hidroksisinamik dibentuk dari fenilalanin melalui deaminasi
dan p-hidroksilasi, yang menempati peranan sentral dalam pembentukan beragam kelas dari fenol tanaman (Harborne 1999).
Flavonoid merupakan kelompok polifenol yang paling dikenal, memiliki
rangka karbon yang sama dengan flavon atau 2-fenilbenzopiron dan terdiri dari 4000 struktur. Flavonoid dapat ditemukan di sebagian besar tanaman dan sama dengan struktur fenilpropanoid dan asam hidroksibenzoat (Harborne 1999). Flavonoid adalah turunan dari chalcones yang dibentuk dari shikimate dan prekursor asetat (Edwards dan Gatehouse 1999).
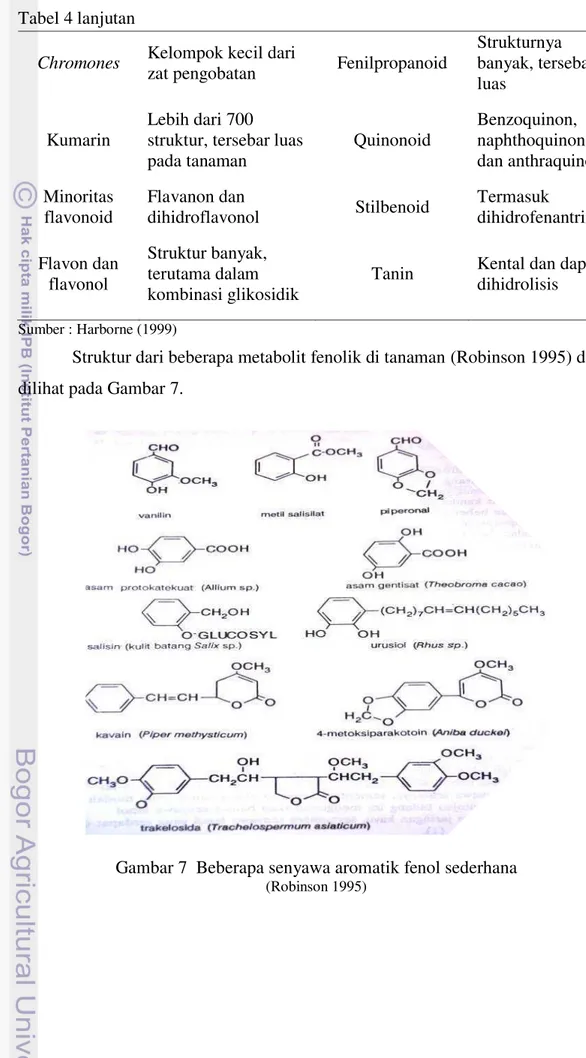
Sebagian besar karakteristik dari fenolik adalah kemampuan untuk mengionisasi. Beberapa polifenol memiliki kelompok catechol dan karena itu memiliki kemampuan untuk mengkelat ion logam divalen atau trivalen. Beberapa antosianin menjadi pengkelat terhadap magnesium atau besi. Fenol dengan substitusi o- atau p-dihidroksi dapat teroksidasi sesuai dengan quinon dan beberapa p-quinon (Harborne 1999). Klasifikasi bagian-bagian fenolik dapat dilihat pada Tabel 4.
Tabel 4 Klasifikasi bagian-bagian fenolik
Subkelas Deskripsi Subkelas Deskripsi
Tabel 4 lanjutan
Struktur dari beberapa metabolit fenolik di tanaman (Robinson 1995) dapat dilihat pada Gambar 7.
3 METODOLOGI 3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan April 2011-Juni 2011. Sampel berupa daun tanaman mangrove Api-api (A. marina) diambil dari daerah Belanakan Kabupaten Subang, Jawa Barat. Penelitian bertempat di Laboratorium Karakteristik Bahan Baku, Laboratorium Bioteknologi Hasil Perairan 1, Laboratorium Bioteknologi Hasil Perairan 2, Laboratorium Mikrobiologi Hasil Perairan Departemen Teknologi Hasil Perairan, Laboratorium Proling Departemen Manajemen Sumber Daya Perairan Fakultas Perikanan dan Ilmu Kelautan, Laboratorium Mikroteknik Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam, Laboratorium Mikrobiologi Terpadu Fakultas Kedokteran Hewan.
3.2 Bahan dan Alat
Bahan utama yang dibutuhkan untuk penelitian ini adalah daun tanaman mangrove Api-api (A. marina). Bahan-bahan yang dibutuhkan untuk analisis
Daun Api-api (A. marina)
larutan FeCl3 5%, peraksi Molisch, asam sulfat pekat, pereaksi Benedict, pereaksi Biuret dan larutan Ninhidrin 0,10%. Bahan-bahan yang dibutuhkan untuk pengujian bilangan peroksida yaitu asam asetat glasial, kloroform, minyak kelapa, kalium iodida, natrium tiosulfat dan indikator pati.
Alat-alat yang diperlukan dalam penelitian ini meliputi jangka sorong, pisau, sudip, cawan porselen, timbangan digital, botol film dan botol kaca kecil,
holder, kotak blok, pinset, kuas, oven, mikrotom Yamato RV-240, hot plate, gelas obyek, rak pewarna, mikroskop cahaya Olympus tipe CH20 dan kamera mikroskop Olympus DP12, alumunium foil, gegep, desikator, oven, kompor listrik, tanur pengabuan, kertas saring Whatman 42 bebas abu, kapas bebas lemak, labu lemak, kondensator, tabung Soxhlet, penangas air, labu Kjeldahl, destilator, labu Erlenmeyer, buret, pipet volumetrik, pipet mikro, pipet tetes, gelas ukur, grindmill, orbital shaker, rotary vacuum evaporator, corong kaca, botol gelas, gelas piala, tabung reaksi, spektrofotometer UV-VIS, inkubator dan vortex.
3.3 Metode Penelitian
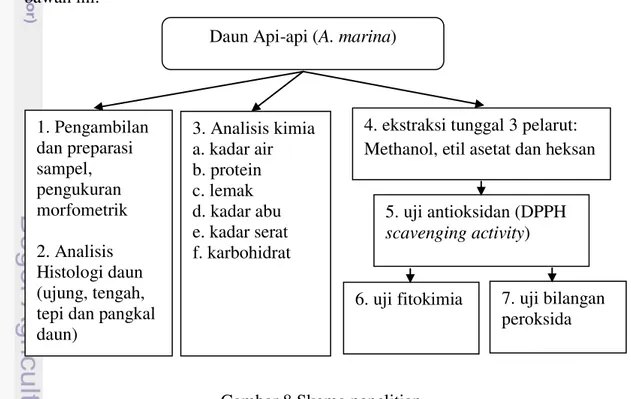
Rangkaian penelitian ini mengikuti skema yang tertera pada Gambar 8 di bawah ini.
3.3.1 Pengambilan dan preparasi sampel
Sampel daun mangrove api-api diambil di daerah Belanakan, Kabupaten Subang, Jawa Barat. Pengambilan sampel dilakukan dengan mengumpulkan daun mangrove api-api dari beberapa titik pada lokasi tersebut. Daun dimasukkan ke dalam wadah plastik berwarna gelap dan dilakukan identifikasi dan pengukuran morfometrik yang meliputi panjang, lebar dan tebal daun. Sejumlah sampel
disimpan dalam wadah tertutup yang berisi larutan etanol 70%, sampel ini akan digunakan untuk analisis histologis.
Daun mangrove api-api kemudian dibagi menjadi dua bagian. Bagian
pertama untuk uji kadar air, protein, lemak, abu dan abu tidak larut asam. Bagian kedua dikeringkan dan dipergunakan untuk uji aktivitas antioksidan, bilangan peroksida dan fitokimia.
3.3.2 Analisis proksimat
Analisis proksimat merupakan suatu analisis yang dilakukan untuk mengetahui komposisi kimia yang terkandung dalam suatu bahan, termasuk di dalamnya analisis kadar air, protein, lemak, abu dan abu tidak larut asam.
1) Analisis kadar air (AOAC, 2005)
Prinsip dari analisis kadar air yaitu untuk mengetahui kandungan atau jumlah kadar air yang terdapat dalam suatu bahan. Tahap pertama untuk menganalisis kadar air yaitu mengeringkan cawan porselen dalam oven pada suhu 105 oC selama 1 jam. Cawan kemudian diletakkan ke dalam desikator selama kurang lebih 15 menit dan dibiarkan sampai dingin kemudian ditimbang. Cawan tersebut ditimbang kembali hingga beratnya konstan. Sampel sebanyak 1 gram dimasukkan ke dalam cawan setelah terlebih dahulu dipotong kecil-kecil. Cawan tersebut lalu dimasukkan ke dalam oven dengan suhu 150 oC selama 8 jam atau
hingga beratnya konstan. Cawan kemudian dimasukkan ke dalam desikator dan dibiarkan sampai dingin kemudian ditimbang. Kadar air dihitung dengan
2) Analisis kadar lemak (AOAC 2005)
Daun mangrove api-api seberat 2 gram (W1) dimasukkan ke dalam kertas saring yang telah dibuat menjadi bentuk selongsong (thimble) dan kedua ujungnya ditutup dengan kapas. Sampel yang telah dibungkus dimasukkan ke dalam labu lemak yang sudah ditimbang berat tetapnya (W2). Pelarut lemak (n-heksan) dituangkan ke dalam labu lemak kemudian labu lemak dihubungkan
dengan soxhlet dan direfluks selama 6 jam. Sampel dikeluarkan, labu lemak dan soxhlet dipasang kembali lalu didestilasi hingga pelarut lemak yang ada dalam labu lemak menguap. Setelah itu, labu lemak dan soxhlet diangkat dan pelarut
dikeluarkan. Labu lemak dikeringkan dalam oven pada suhu 100 oC selama satu jam. Labu kemudian didinginkan dalam desikator sampai beratnya konstan (W3). Kadar lemak dapat dihitung dengan rumus berikut:
% Kadar lemak =
3) Analisis kadar protein (AOAC 2005)
Prinsip dari analisis protein yaitu untuk mengetahui kandungan protein kasar (crude protein) pada suatu bahan. Tahap-tahap yang dilakukan dalam analisis protein terdiri dari tiga tahap yaitu dekstruksi, destilasi dan titrasi. Pengukuran kadar protein dilakukan dengan metode Kjeldahl.
(a) Tahap destruksi
Daun mangrove api-api ditimbang sebanyak 1 gram kemudian dimasukkan ke dalam labu Kjeldahl. Selenium 0,25 gram dimasukkan ke dalam tabung tersebut dan ditambahkan 3 mL H2SO4 p.a 98%. Tabung yang berisi larutan tersebut dimasukkan ke dalam alat pemanas dengan suhu 400 oC selama 1 jam. Proses destruksi dilakukan sampai larutan menjadi /jernih/ bening.
(b) Tahap destilasi
Brom Cresol Green-Methyl Red berwarna merah muda. Setelah volume hasil tampungan (destilat) menjadi 10 mL dan berwarna hijau kebiruan, proses destilasi dihentikan dan selanjutnya destilat ditritasi.
(c) Tahap titrasi mg contoh x faktor koreksi alat
Keterangan :
% Kadar Protein = %N x faktor konversi (6,25)
4) Analisis kadar abu (AOAC 2005)
Prinsip dari analisis kadar abu yaitu untuk mengetahui jumlah abu yang terdapat pada suatu bahan terkait dengan mineral dari bahan yang dianalisis. Cawan pengabuan dikeringkan dalam oven selama 1 jam pada suhu 105 oC, kemudian didinginkan selama 15 menit di dalam desikator dan ditimbang hingga didapatkan berat yang konstan. Sampel daun sebanyak 1 gram dimasukkan ke
dalam cawan pengabuan dan dipijarkan di atas nyala api hingga tidak berasap lagi. Cawan tersebut kemudian dimasukkan ke dalam tanur pengabuan dengan
suhu 600 oC selama 2 jam. Cawan didinginkan di dalam desikator lalu ditimbang hingga didapatkan berat yang konstan. Kadar abu ditentukan dengan rumus
5) Kadar serat kasar (AOAC 2005)
Residu hasil saringan dibilas dengan 20-30 mL air mendidih dan dengan 24 mL air sebanyak 3 kali.
Residu didestruksi kembali dengan NaOH 1,25 % selama 30 menit, lalu disaring dengan cara yang sama seperti sebelumnya dan dibilas berturut-turut dengan 25 mL H2SO4 1,25% mendidih dan 25 mL air sebanyak tiga kali dan 25 mL alkhohol. Residu dan kertas saring dipindahkan ke cawan porselen dan
dikeringkan dalam oven pada suhu 130 oC selama 2 jam. Residu yang sudah dingin bersama cawan porselen ditimbang (A), kemudian dimasukkan ke dalam tanur pada suhu 600 oC selama 30 menit, didinginkan dan ditimbang kembali (B).
Bobot serat kasar dihitung dengan persamaan berikut:
% Kadar serat kasar =
Bobot serat kasar (gram)
X 100% Bobot sampel (gram)
Keterangan: Bobot serat kasar = W – Wo
W = bobot residu sebelum dibakar dalam tanur
= A - (bobot kertas saring+cawan) : A : bobot residu + kertas saring + cawan Wo = bobot residu setelah dibakar dalam tanur
= B – (bobot cawan): B : (bobot residu + cawan)
3.3.3 Analisis mikroskopis (Johansen 1940)
Gambar 9 Bagian-bagian daun ( keterangan: TKD = tangkai daun, PKD = pangkal daun, TPD = tepi daun, TGD = tengah daun, UD= ujung daun )
Fiksasi dilakukan selama 5 hari dalam larutan FAA, setelah itu larutan fiksasi dibuang dan sampel dicuci dengan etanol 50% sebanyak 4 kali dengan waktu penggantian masing-masing selama 30 menit. Kemudian dilakukan dehidrasi dan penjernihan secara bertahap melalui perendaman dalam larutan seri Johansen I-VII pada suhu ruang dengan perincian :
1. Johansen I selama 2 jam 2. Johansen II selama 24 jam 3. Johansen III selama 2 jam 4. Johansen IV selama 2 jam 5. Johansen V selama 2 jam
6. Johansen VI (TBA murni) selama 24 jam 7. Johansen VI (TBA murni) selama 2 jam 8. Johansen VI (TBA murni) selama 2 jam 9. Johansen VI (TBA murni) selama 2 jam 10. Johansen VII selama 4 jam
Proses infiltrasi dimulai dari perendaman sampel dalam Johansen VII (TBA : minyak paraffin 1:1) dan 1/3 parafin beku dan disimpan pada suhu kamar selama 4 jam yang dilanjutkan pengovenan pada suhu 58 ˚C selama 18 jam.
Kemudian pergantian paraffin dilakukan setiap 5 jam sekali sebanyak 4 kali pergantian. Proses penanaman dilakukan dengan cara sampel dari tahap infilrasi dimasukkan ke dalam blok kotak yang berisi paraffin cair dan disimpan pada suhu ruang hingga benar-benar membeku. Proses penyayatan dilakukan dengan menggunakan mikrotom putar setebal 10 μm. Blok paraffin terlebih dahulu dipotong dan dirapihkan kemudian ditempelkan pada holder lalu disayat. Hasil
sayatan direkatkan pada gelas obyek yang telah diolesi albumin-gliserin dan ditetesi air. Gelas berisi pita parafin kemudian dipanaskan pada hot plate dengan suhu 45 ºC selama 3-5 jam.
Proses pewarnaan dilakukan dengan safranin 2% dalam air dan fast green 0,5% dalam etanol 95% serta safranin 2% dan aniline blue dalam alkohol 88%. Pewarnaan diawali dengan perendaman gelas obyek ke dalam larutan xilol 1 dan
2 masing-masing selama 15 menit, dilanjutkan perendaman dalam etanol absolut (100%), 95%, 70%, 50%, dan 30% masing-masing selama 3 menit. Setelah itu, obyek dibilas dengan akuades dan dimasukkan ke dalam safranin 2% selama 2
hari. Selanjutnya, gelas obyek dibilas ke dalam akuades dan dimasukkan ke dalam etanol 30%, 50%, 70%, 95%, dan absolut masing-masing selama 3 menit. Kemudian obyek dimasukkan ke dalam pewarna fast green 0,5% selama 10 menit lalu etanol absolut 1 dan 2 selama 3 menit. Gelas obyek kemudian direndam dalam xilol 1 dan xilol 2 selama 10 menit. Pewarnaan dengan aniline blue dilakukan sebagai pengganti fast green. Gelas obyek dimasukkan ke dalam aniline blue + alkohol 88% selama 10 menit, setelah etanol 70%. Kemudian obyek dimasukkan ke dalam etanol 95% + HCl 2 tetes selama beberapa detik dan dilanjutkan ke dalam etanol 95% selama 3 menit, seterusnya.
Proses selanjutnya adalah penutupan dengan pemberian entellan atau Canada balsam pada gelas obyek dan ditutupi dengan gelas penutup. Proses pengambilan gambar dilakukan dengan mikroskop cahaya Olympus CH20 dan kamera digital merek Olympus DP12.
3.3.4 Analisis aktivitas antioksidan
1) Ekstraksi bahan aktif daun mangrove Api-api (Quinn 1988 dalam Darusman et al. 1995, yang telah dimodifikasi)
Tahap selanjutnya adalah ekstraksi. Metode ekstraksi yang digunakan adalah metode ekstraksi tunggal (Quinn 1988 dalam Darusman et al. 1995) yang telah dimodifikasi. Ekstraksi dilakukan dengan 3 jenis pelarut dengan tingkat kepolaran yang berbeda, yaitu methanol p.a (polar), etil asetat p.a (semi polar) dan heksana p.a (non polar).
Sampel daun mangrove Api-api yang telah dihancurkan ditimbang
sebanyak 25 gram dan dimaserasi dengan masing-masing pelarut sebanyak 150 mL selama 24 jam. Hasil maserasi yang berupa larutan kemudian disaring dengan kertas saring Whattman 42 sehingga didapat filtrat dan residu. Filtrat
yang diperoleh dievaporasi hingga pelarut memisah dengan ekstrak menggunakan rotary vacuum evaporator pada suhu ± 50 oC. Berdasarkan proses ini maka akan diperoleh ekstrak metanol (EM), ekstrak etil asetat (EEA) dan ekstrak heksana (EH).
Ekstrak yang diperoleh selanjutnya dihitung persentase rendemennya dengan rumus:
Rendemen (%) =
Berat ekstrak (g)
X 100% Berat sampel awal (g)
2) Uji aktivitas antioksidan (DPPH) (Blois 1958 dalam Hanani et al. 2005, yang dimodifikasi)
Kontrol positif antioksidan yang digunakan dalam uji ini adalah antioksidan sintetik yaitu Butylated Hydroxy Toluene (BHT). Herawati dan Akhlus (2006) menyatakan bahwa selain memiliki aktifitas yang baik terhadap radikal , BHT juga cukup tahan terhadap proses pemanasan. Konsentrasi BHT yang digunakan dalam uji ini adalah 2 ppm, 4 ppm, 6 ppm dan 8 ppm.
Larutan ekstrak dan larutan antioksidan pembanding BHT yang telah
dibuat, masing-masing diambil 4,5 mL dan direaksikan dengan 500 µ L larutan DPPH 1 mM dalam tabung reaksi yang berbeda yang telah diberi label. Campuran tersebut kemudian diinkubasi pada suhu 37 oC selama 30 menit dan
diukur absorbansinya dengan menggunakan spektrofotometer UV-Vis pada panjang gelombang 517 nm. Absorbansi larutan blanko juga diukur untuk menghitung persen inhibisi. Larutan blanko dibuat dengan mereaksikan 4,5 mL pelarut metanol dengan 500 µ L larutan DPPH 1 mM dalam tabung reaksi. Larutan blanko dibuat hanya satu kali ulangan saja. Setelah itu, aktivitas antioksidan dari masing-masing sampel dan antioksidan pembanding BHT dinyatakan dengan persen inhibisi yang dihitung dengan rumus berikut:
% Inhibisi =
Absorbansi blanko – absorbansi sampel
X 100 % Absorbansi blanko
Nilai konsentrasi sampel (ekstrak maupun antioksidan pembanding BHT) dan persen inhibisinya diplot masing-masing pada sumbu x dan y pada persamaan
regresi linear. Persamaan regresi linear yang diperoleh dalam bentuk persamaan y = a + bx digunakan untuk mencari nilai IC50 (inhibitor concentration 50%) dari
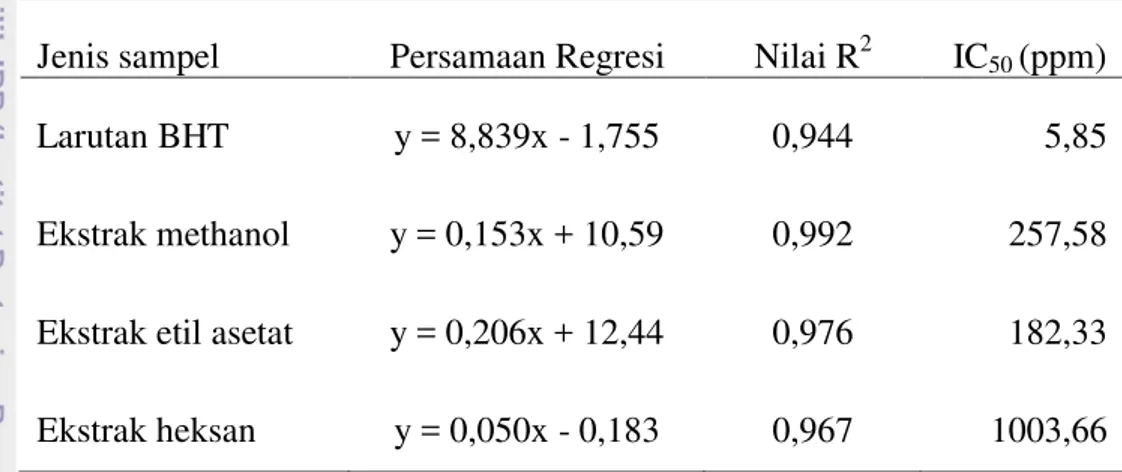
masing-masing sampel dengan menyatakan nilai y sebesar 50 dan nilai x yang akan diperoleh sebagai IC50. Nilai IC50 menyatakan besarnya konsentrasi larutan sampel (ekstrak maupun antioksidan pembanding BHT) yang dibutuhkan untuk mereduksi radikal bebas DPPH sebesar 50%.
3.3.5 Uji fitokimia (Harborne 1984)
steroid/triterpenoid, flavonoid, saponin, fenol hidrokuinon, Molisch, Benedict, Biuret dan Ninhidrin. Metode uji ini berdasarkan Harborne (1984).
a) Alkaloid
Sejumlah sampel dilarutkan dalam beberapa tetes asam sulfat (H2SO4) 2 N. Pengujian menggunakan tiga pereaksi alkaloid yaitu pereaksi Dragendorff, pereaksi Meyer dan pereaksi Wagner.
Pereaksi Dragendorff dibuat dengan cara 0,8 gram bismutsubnitrat ditambahkan dengan 10 mL asam asetat dan 40 mL air. Larutan ini dicampur dengan larutan yang dibuat dari 8 gram kalium iodida dalam 20 mL air. Sebelum
dihunakan, 1 volume campuran ini diencerkan dengan 2,3 volume asam asetat glasial dan 100 mL air. Pereaksi ini berwarna jingga.
Pereaksi Meyer dibuat dengan cara menambahkan 1,36 gram HgCl2 dengan 0,5 gram KI lalu dilarutkan dan diencerkan dengan akuades menjadi 100 mL dengan labu takar. Pereaksi ini tidak berwarna.
Pereaksi Wagner dibuat dengan cara 10 mL akuades ditambahkan 2,5 gram iodine dan 2 gram KI lalu dilarutkan dan diencerkan dengan akuades menjadi 200 mL dalam labu takar. Pereaksi ini berwarna coklat.
Hasil uji dinyatakan positif bila dengan pereaksi Dragendorff terbentuk endapan merah hingga jingga, endapan putih kekuningan dengan pereaksi Meyer dan endapan coklat dengan pereaksi Wagner.
b) Steroid / triterpenoid
Sejumlah sampel dilarutkan dalam 2 mL kloroform dalam tabung reaksi yang kering. Setelah itu ditambahkan 10 tetes anhidra asetat dan 3 tetes asam sulfat pekat. Reaksi positif ditunjukkan dengan terbentuknya larutan berwarna merah untuk pertama kali kemudian berubah menjadi biru dan hijau.
c) Flavonoid
Sejumlah sampel ditambahkan 0,1 mg serbuk magnesium dan 0,4 mL
d) Saponin (uji busa)
Saponin dapat dideteksi dengan uji busa dalam air panas. Busa yang stabil selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2 N menunjukkan adanya saponin.
e) Fenol hidrokuinon (pereaksi FeCl3)
Sampel sebanyak 1 gram diekstrak dengan 20 mL etanol 70%. Larutan
yang dihasilkan diambil sebanyak 1 mL kemudian ditambahkan 2 tetes larutan FeCl3 5%. Adanya senyawa fenol dalam bahan ditunjukkan dengan terbentuknya warna hijau atau hijau biru.
f) Uji Molisch
Larutan sampel sebanyak 1 mL diberi 2 tetes pereaksi Molisch dan 1 mL asam sulfat pekat melalui dinding tabung. Uji positif yang menunjukkan adanya karbohidrat ditandai dengan terbentuknya kompleks warna ungu diantara 2 lapisan cairan.
g) Uji Benedict
Larutan sampel sebanyak 8 tetes dimasukkan ke dalam 5 mL pereaksi Benedict. Campuran dikocok dan dididihkan selama 5 menit. Adanya gula pereduksi ditunjukkan dengan terbentuknya warna hijau, kuning atau endapan merah bata.
h) Uji Biuret
Sebanyak 1 mL larutan sampel ditambahkan 4 mL pereaksi Biuret. Campuran dikocok dengan seksama. Hasil uji positif adanya peptida ditunjukkan dengan terbentuknya larutan berwarna ungu.
i) Uji Ninhidrin
Larutan sampel sebanyak 2 mL ditambah beberapa tetes larutan ninhidrin
0,1%. Campuran dipanaskan dalam penangas air selama 10 menit. Reaksi positif terhadap adanya asam amino ditunjukkan dengan larutan berwarna biru.
3.3.6 Evaluasi aktivitas antioksidan (penentuan bilangan peroksida) (Santoso et al. 2004)
melalui pembuatan minyak kelapa dan sistem emulsinya yang dilanjutkan dengan evaluasi aktivitas antioksidan dengan penentuan bilangan peroksida.
1) Pembuatan minyak kelapa dan sistem emulsinya
Minyak yang digunakan dalam penelitian dibuat dari parutan kelapa yang diperas untuk diambil santan kentalnya. Santan kental tersebut dipanaskan dengan cara direbus untuk memisahkan komponen minyak yang terkandung di
dalamnya, kemudian dilakukan penyaringan untuk memisahkan minyak dan ampas parutan kelapa. Filtrat yang dihasilkan kemudian disaring lagi dengan kertas Whatman agar diperoleh minyak kelapa yang bening. Sistem emulsi
minyak dibuat dengan mengacu pada metode Santoso et al. (2004) yang dimodifikasi, yaitu dengan menghomogenkan 3% minyak kelapa dan 97% air yang mengandung 0,3% Tween 20.
2) Penentuan bilangan peroksida
Sistem emulsi lemak ditambahkan ekstrak daun mangrove Api-api terbaik dari tahap sebelumnya sebanyak 0 ppm (tanpa penambahan ekstrak), 50 ppm, 100 ppm, 200 ppm dan 300 ppm yang selanjutnya disebut sampel minyak. Sampel minyak selanjutnya disimpan selama tujuh hari dalam inkubator bersuhu 37 oC untuk mempercepat oksidasi. Sampel minyak kemudian ditimbang sebanyak 5 gram di dalam labu erlenmeyer kemudian ditambahkan 30 mL pelarut yang terdiri dari 60% asam asetat glasial dan 40% kloroform. Minyak yang telah larut ditambahkan 0,5 mL larutan KI jenuh dan didiamkan 15 menit dalam ruang gelap sambil dikocok. Iod yang terbentuk dititrasi dengan larutan Na2S2O3 0,01 N dengan indikator pati 1%. Titrasi dihentikan saat larutan sampel menjadi tidak berwarna. Hasil pengurangan volume akhir terhadap volume awal larutan Na2S2O3 0,01 N yang ditunjukkan oleh skala pada buret merupakan volume total
larutan Na2S2O3 0,01 N yang digunakan untuk titrasi sampel. Cara yang sama dibuat juga untuk penerapan blanko. Nilai bilangan peroksida dinyatakan dengan
miliequivalen per 1 kg minyak atau lemak yaitu dengan rumus:
Miliequivalen/Kg bahan =
(a-b) x N x 1000
Keterangan:
a = jumlah ml larutan Na2S2O3 untuk titrasi sampel b = jumlah ml larutan Na2S2O3 untuk titrasi blanko N = normalitas larutan Na2S2O3
g = berat sampel (gram)
3.4 Rancangan Percobaan dan Analisis Data (Steel dan Torrie 1991)
Analisis data dilakukan terhadap hasil pada tahap aplikasi terhadap emulsi minyak. Tahapan aplikasi terhadap emulsi minyak bertujuan untuk menentukan seberapa besar konsentrasi ekstrak terpilih yang mampu menghambat
pembentukan peroksida dalam emulsi minyak. Faktor yang digunakan adalah konsentrasi ekstrak dengan lima taraf yaitu 0 ppm, 50 ppm, 100 ppm, 200 ppm dan 300 ppm. Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan model:
Yij = µ + αi + Ɛij
Keterangan:
Yij = respon pengaruh konsentrasi pada taraf i ulangan ke-j µ = pengaruh rata-rata umum
αi = pengaruh konsentrasi pada taraf i
Ɛij = pengaruh acak (galat percobaan) pada konsentrasi taraf i ulangan ke-j i = 0 ppm, 50 ppm, 100 ppm, 200 ppm dan 300 ppm ( penentuan
konsentrasi ekstrak terpilih )
Hipotesis untuk penentuan konsentrasi ekstrak terpilih:
Ho = Konsentrasi ekstrak tidak mempengaruhi aktivitas antioksidan ekstrak daun mangrove api-api
H1 = Konsentrasi ekstrak mempengaruhi aktivitas antioksidan ekstrak daun mangrove api-api.
Keterangan:
Rp = Nilai kritikal untuk perlakuan yang dibandingkan p = Perlakuan
dbs = Derajat bebas
4 HASIL DAN PEMBAHASAN
4.1 Karakteristik Daun Api-api (A. marina)
Sampel daun Api-api yang diambil dari daerah Belanakan, kabupaten Subang, Jawa Barat dipreparasi untuk mempermudah proses penelitian. Sampel daun yang diambil selanjutnya dipilih yang baik dan dibersihkan dari kotoran-kotoran yang menempel. Sampel daun selanjutnya dibagi menjadi 3 bagian, yaitu: bagian segar, bagian yang diawetkan dan bagian yang dikeringkan. Bagian
segar digunakan untuk analisa proksimat, bagian yang diawetkan digunakan untuk analisa struktur jaringan dan bagian yang dikeringkan untuk pengujian aktivitas antioksidan.
4.1.1 Karakteristik Fisik daun Api-api (A. marina)
Tahap pertama yang dilakukan setelah mempreparasi sampel daun adalah karakterisasi secara fisik (meliputi morfologi luar, morfometrik dan struktur jaringan daun) dan secara kimiawi. Bentuk morfologi luar daun Api-api dapat dilihat pada Gambar 10. Hasil pengamatan karakteristik fisik daun Api-api disajikan pada Tabel 5.
Gambar 10 Bentuk daun Api-api, A = tampak atas, B = tampak bawah
A
Tabel 5 Karakteristik fisik daun Api-api
No Karakteristik fisik Keterangan
1 Warna daun Bagian atas berwarna hijau tua, sedangkan bagian bawah berwarna hijau kekuningan dengan beberapa bagian terlihat putih
2 Bentuk daun Daun berbentuk oval dengan ujung runcing membundar, tepi daun rata
3 Permukaan daun Daun memiliki tekstur halus pada bagian atas dan agak kasar pada bagian bawah
Sampel daun yang digunakan dalam penelitian ini memiliki karakteristik fisik antara lain warna daun yang berbeda antara bagian permukaan atas dengan
bagian bawah, dimana bagian permukaan daun berwarna hijau, semakin tua daun maka warnanya semakin hijau, sedangkan bagian bawah daun berwarna hijau
kekuningan dan semakin tua berberapa bagian memutih. Ciri fisik lainnya adalah bentuk daun oval/bulat telur panjang dengan ujung yang membulat runcing. Daun Api-api memiliki permukaan daun yang berbeda antara bagian atas dengan bagian bawah, permukaan atas daun memiliki tekstur licin halus, sedangkan permukaan bawah memiliki tekstur yang lebih kasar.
4.1.2 Morfometrik daun Api-api (A. marina)
Morfometrik daun Api-api meliputi panjang, lebar dan tebal daun. Hasil pengukuran morfometrik daun Api-api sebanyak 30 sampel dapat dilihat pada Tabel 6.
Tabel 6 Morfometrik daun Api-api
Parameter Rata – rata (mm)
Panjang daun 69,36 ± 5,12
Lebar daun 36,29 ± 3,39
Tebal daun 0,77 ± 0,11
Keterangan: Data diperoleh dari 30 sampel daun Api-api (A. marina)
rata-rata sebesar 36,29 mm dan tebal daun rata-rata-rata-rata sebesar 0,77 mm. Ukuran tersebut tidak jauh berbeda dengan ukuran daun Api-api yang diteliti oleh Noor et al. (2006), daun Api-api memiliki panjang 90 mm dan lebar 45 mm.
Metusalach (2007) menyatakan bahwa pertumbuhan suatu biota dipengaruhi faktor eksternal dan internal. Faktor eksternal yaitu habitat, musim, suhu perairan, jenis makanan yang tersedia dan faktor lingkungan lainnya,
sedangkan faktor internalnya yaitu umur, ukuran, jenis kelamin, kebiasaan makan dan faktor biologis lainnya.
4.1.2 Struktur jaringan daun Api-api (A. marina )
Daun merupakan suatu bagian tumbuhan yang penting dan umumnya tiap tumbuhan mempunyai sejumlah besar daun (Tjitrosoepomo 2007). Pernyataan lain menerangkan bahwa daun termasuk organ pokok pada tubuh tumbuhan. Umumnya berbentuk pipih bilateral, berwarna hijau dan merupakan tempat terjadinya proses fotosintesis. Secara umum jaringan daun tersusun atas jaringan epidermis, palisade, bunga karang dan jaringan pengangkut (Nugroho et al. 2006).
Berdasarkan jumlah daun yang ada di setiap aksis/tangkai daun, daun Api-api termasuk daun tunggal. Hal ini karena pada tanaman mangrove Api-Api-api, setiap aksis/tangkai daun hanya menyokong satu helai daun saja. Menurut Nugroho et al. (2006) daun tunggal adalah daun yang pada satu aksisnya (tangkai daunnya) hanya mendukung satu helaian daun dengan ciri khasnya adalah daun tidak terbentuk bersamaan dan gugur dari urutan tua ke muda.
Daun Api-api juga tergolong daun tak lengkap, karena daun Api-api hanya memiliki tangkai dan helai daun (lamina) saja. Daun dikatakan lengkap jika daun memiliki pelepah daun (sheat), tangkai daun (petiole) dan helain daun (lamina),
A. Tangkai daun Api-api (petiole)
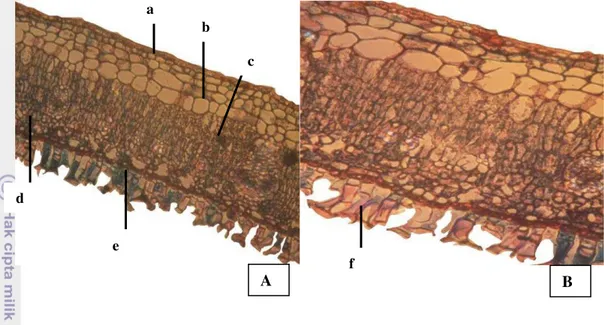
Tangkai daun adalah bagian daun yang berbentuk silindris sebagai perantara antara upih atau batang dengan helaian daun. Tangkai daun memiliki sejumlah berkas pengangkut. Struktur anatomi tangkai daun Api-api dapat dilihat pada Gambar 11.
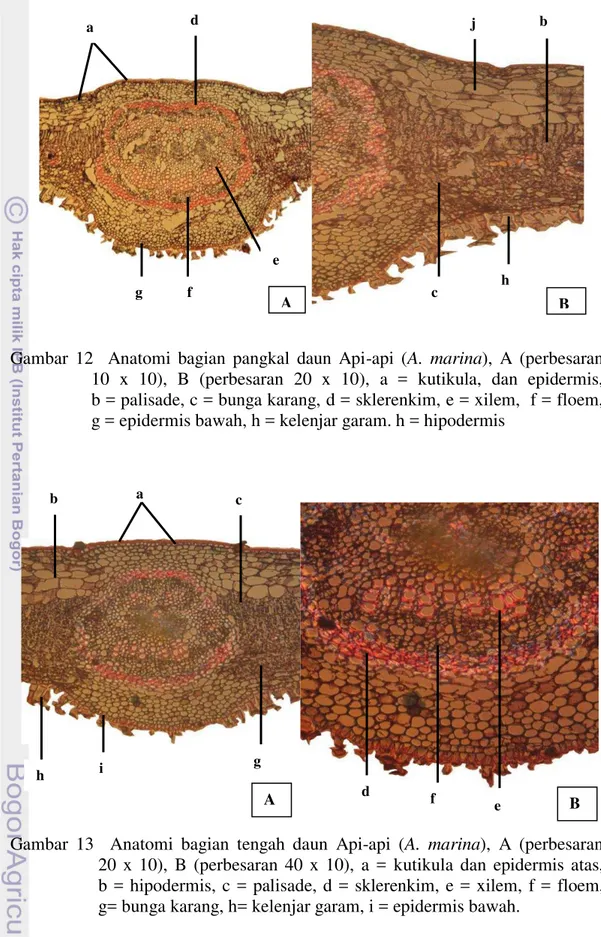
Gambar 11 Anatomi bagian tangkai daun Api-api (A. marina), A (perbesaran 4 x 10), B (perbesaran 10 x 10), a = kutikula dan epidermis atas, b = parenkim, c = sklerenkim, d = xilem, e = floem, f = parenkim sentral,
g = epidermis bawah, h = kelenjar garam
Potongan melintang tangkai daun Api-api memperlihatkan adanya jaringan epidermis, korteks, floem, xilem dan parenkim sentral. Tampak pada Gambar 11, sel sel epidermis pada sisi atas tangkai daun Api-api saling berhubungan dan secara keseluruhan terlihat lebih rata dibandingkan dengan rangkaian sel-sel epidermis bagian bawah tangkai daun.
Sel epidermis atas tangkai daun Api-api terlihat lebih kecil dibandingkan dengan sel-sel di bawahnya, dinding tangensial atas relatif lebih tebal dibandingkan dinding tangensial bawahnya. Berbeda dengan sel epidermis atas, sel-sel epidermis bawah tangkai daun Api-api lebih memiliki bentuk dan ukuran yang berbeda, dan sebagian terdiferensiasi menjadi trikoma dan kelenjar garam (extrude salt gland).
hipodermis dan parenkim korteks. Tampak pada Gambar 11d beberapa sel pada jaringan parenkim korteks mengalami penebalan dinding sekunder dan berubah bentuk menjadi sel-sel sklerenkim yang terlihat berwarna lebih terang jika dilihat menggunakan mikroskop. Dinding sel sklerenkim terlihat berwarna merah bila diwarnai dengan larutan Safranin.
Jaringan pengangkut dijumpai pada pusat jaringan dan pada kedua tepi
jaringan tangkai daun Api-api. Jaringan pengangkut terdiri dari parenkim xilem dan sklerenkim floem. Sel sklerenkim xilem tersusun berdampingan mengarah ke parenkim sentral dan terlihat berdinding lebih tebal bila dibandingkan dinding sel
di sekitarnya. Sel – sel parenkim xilem terlihat lebih besar dibandingkan sel-sel floem. Terdapat dua berkas jaringan pengangkut pada bagian tepi jaringan tangkai daun Api-api yang secara keseluruhan lebih kecil daripada jaringan pengangkut utama.
B. Helaian daun Api-api (lamina)
Helaian daun (lamina atau blade) merupakan bagian daun yang berbentuk pipih dorsoventral, berwarna hijau, berupa daging daun (interfenium) dan urat daun serta berguna untuk fotosintesis. Daun memiliki bentuk helaian, pangkal, tepi, ujung dan pertulangan yang beragam.
Bentuk helaian daun sangat menentukan bentuk daun, sedangkan tangkai dan upih daun tidak ikut menentukan bentuk daun. Bentuk helaian daun dibagi menjadi empat seri atau pola pokok yaitu seri elips, seri bulat telur, seri bulat telur terbalik, dan seri garis (Nugroho et al. 2006).
Berdasarkan perbandingan antara panjang dan lebar daun yang ada pada Tabel 6, helaian daun Api-api termasuk seri elips dengan bentuk jorong (ovalis; elipticus), hal ini karena perbandingan panjang dan lebar daun Api-api adalah 1,9 : 1. Helaian daun dikatakan berbentuk jorong jika perbandingan panjang dan lebar adalah 1,5 - 2 : 1 (Tjitrosoepomo 2007). Struktur anatomi helaian daun
Api-api dapat dilihat pada Gambar 12-15.
g = epidermis bawah, h = kelenjar garam. h = hipodermis
Gambar 13 Anatomi bagian tengah daun Api-api (A. marina), A (perbesaran 20 x 10), B (perbesaran 40 x 10), a = kutikula dan epidermis atas, b = hipodermis, c = palisade, d = sklerenkim, e = xilem, f = floem, g= bunga karang, h= kelenjar garam, i = epidermis bawah.
Gambar 14 Anatomi bagian tepi daun Api-api (A. marina), A (perbesaran 20 x 10), B (perbesaran 40 x 10), a = kutikula, dan epidermis atas, b = hipodermis, c = palisade, d = bunga karang, e = epidermis bawah, f = kelenjar garam
Gambar 15 Anatomi bagian ujung daun Api-api (A. marina), A (perbesaran 20 x 10), B (perbesaran 40 x 10), a = kutikula dan epidermis atas, b = hipodermis, c = palisade, d = bunga karang, e = korteks, f = epidermis bawah, g = kelenjar garam
Daun Api-api bertipe dorsiventral, mengingat daun Api-api hanya memiliki jaringan palisade (tiang) pada sisi bagian atas daun saja. Daun dikatakan mempunyai tipe dorsiventral apabila jaringan palisade hanya terdapat pada sisi atas daun (Nugroho et al. 2006). Daun yang bertipe dorsiventral
A B
b
c a
f d
e
A B
a
b
c
d
f e
biasanya memiliki permukaan atas yang lebih berwarna (biasanya lebih berwarna hijau) dibandingkan bagian bawah, karena kandungan kloroplas lebih banyak pada jaringan palisade sehingga warna hijau lebih terlihat pada permukaan atas daun dibandingkan permukaan bawah daun. Hal ini terbukti, daun Api-api memiliki perbedaan penampakan bagian atas dan bawah, bagian atas berwarna hijau cerah sedangkan bagian bawah berwarna hijau kekuningan.
Helaian daun Api-api memiliki dua lapis jaringan epidermis, yaitu epidermis atas dan epidermis bawah. Jaringan epidermis atas daun Api-api tersusun atas 1 lapis sel tipis yang dilapisi kutikula. Jaringan epidermis bawah
disusun oleh 1 lapis sel tipis yang terdiferensiasi membentuk organ tambahan berupa kelenjar garam (salt extruding gland). Hipodermis daun Api-api disusun
atas sel-sel yang lebih besar daripada sel penyusun, jaringan epidermis atas. Borkar et al. (2011) menyatakan hipodermis pada helaian daun Api-api berfungsi sebagai tempat penyimpan air
Jaringan mesofil helaian daun Api-api yang terlihat pada Gambar 12 sampai Gambar 15 terdiri dari jaringan palisade dan jaringan bunga karang. Umumnya pada tumbuhan Dicotyledoneae, jaringan mesofil berdiferensiasi menjadi jaringan palisade dan bunga karang (Nugroho et al. 2006). Palisade pada daun Api-api disusun atas 2 sampai 3 lapis sel yang memanjang vertikal dibawah hipodermis. Jaringan bunga karang pada daun Api-api disusun oleh 2 sampai 3 sel tipis di bawah jaringan palisade dan tersusun secara tidak beraturan, sehingga membentuk rongga udara. Jaringan berkas pengangkut pada helaian daun Api-api dapat dilihat pada semua gambar anatomi bagian-bagian daun Api-api. Gambar 12 menunjukkan bahwa berkas pengangkut daun Api-api terdiri atas pembuluh xilem pada bagian dalam dan floem pada bagian luar. Berkas
pengangkut pada daun Api-api termasuk dalam tipe kolateral terbuka, karena xilem dan floem terletak berdampingan dan dibatasi oleh kambium.
akibat adaptasi terhadap kelebihan garam pada daun. Setiap kelenjar garam pada daun Api-api terdiri atas 2 sampai 4 kumpulan sel, 1 sel batang dan 8-12 sel ekskresi. Kelenjar garam yang ada pada daun Api-api juga mengalami adaptasi sesuai dengan habitatnya. Menurut Borkar et al. (2011) pada salinitas yang lebih rendah kelenjar garam akan lebih pendek sedangkan pada salinitas yang lebih tinggi kelenjar garam akan lebih panjang. Adanya kelenjar garam dan
kemampuan kelenjar garam beradaptasi terhadap lingkungan yang memiliki salinitas berbeda membuat mangrove Api-api dapat hidup di habitat yang salinitasnya rendah maupun ekstrim.
4.1.3 Komposisi kimia daun Api-api (A. marina)
Daun Api-api (A. marina) yang masih muda oleh sebagian masyarakat
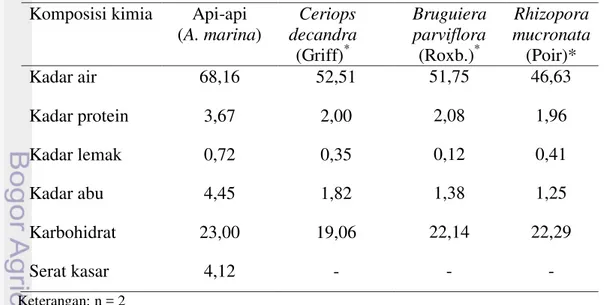
dimanfaatkan sebagai bahan pangan dalam bentuk sayur urap. Sangatlah penting untuk diketahui kandungan gizi atau komposisi kimia yang terdapat di dalamnya agar lebih jelas. Komposisi kimia daun Api-api dapat diketahui melalui analisis proksimat. Analisis proksimat merupakan cara untuk melihat kandungan atau komposisi kimia suatu bahan pangan secara kasar. Komposisi kimia daun Api-api dapat dilihat pada Tabel 7.
Tabel 7 Komposisi kimia daun Api-api (% berat basah)
1) Kadar air
Air merupakan bahan yang sangat penting bagi kehidupan manusia dan fungsinya tidak pernah dapat digantikan oleh senyawa lain. Air juga merupakan komponen penting dalam bahan makanan (Winarno 2008)
Kadar air merupakan jumlah air yang terkandung dalam bahan pangan. Kadar air merupakan salah satu karakteristik yang sangat penting pada bahan
pangan, karena air dapat mempengaruhi penampakan, tekstur, dan cita rasa pada bahan pangan. Kadar air dalam bahan pangan ikut menentukan kesegaran dan daya awet bahan pangan tersebut, kadar air yang tinggi mengakibatkan mudahnya
bakteri, kapang dan khamir untuk berkembang biak sehingga akan terjadi perubahan pada bahan pangan yang dapat mempercepat pembusukkan (Winarno 2008).
Hasil analisa proksimat pada Tabel 7 menunjukkan daun Api-api mengandung kadar air sebesar 68,16%. Kadar air daun Api-api lebih besar jika dibandingkan dengan kadar air daun mangrove lainnya. Secara umum nilai kadar air pada daun mangrove relatif kecil. Hal ini mungkin disebabkan habitat mangrove yang bersalinitas tinggi dan suhu habitat yang tinggi karena pengaruh transfer panas dari laut, sebagaimana yang dikemukakan oleh Krzynowek dan Murphy (1987) bahwa kadar lemak dan kadar air untuk beberapa spesies berfluktuasi tergantung dengan musim dan lokasi pengambilan.
2) Kadar protein
Potein berperan penting dalam proses metabolisme tanaman, hewan dan manusia. Protein berfungsi sebagai enzim, alat pengangkut dan penyimpan, pengatur pergerakan, penunjang mekanis, pertahanan tubuh, media perambatan impuls syaraf dan pengendalian pertumbuhan (Winarno 2008).
Berdasarkan hasil analisa proksimat pada Tabel 7 kadar protein kasar daun Api-api sebesar 3,67%. Kandungan protein daun Api-api lebih besar jika