i
KEMAMPUAN Bacillus sp. PENGHASIL AHL-LAKTONASE
DALAM MENGHAMBAT PROSES QUORUM SENSING
PATOGENISITAS BAKTERI FITOPATOGEN
ZAHRAH NURLITA LUBIS
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
iii
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Kemampuan Bacillus
sp. penghasil AHL-Laktonase dalam Menghambat Proses Quorum Sensing
Patogenisitas Bakteri Fitopatogen adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2013
Zahrah Nurlita Lubis
ABSTRAK
ZAHRAH NURLITA LUBIS. Kemampuan Bacillus sp. penghasil AHL-Laktonase dalam Menghambat Proses Quorum Sensing Patogenisitas Bakteri Fitopatogen. Dibimbing oleh IMAN RUSMANA dan ALINA AKHDIYA.
Quorum Sensing (QS) merupakan suatu proses komunikasi antar bakteri melalui sekresi sinyal yang disebut autoinducer (AI). Molekul AI berupa N-acylhomoserine lactone (AHL) pada bakteri Gram negatif. Enzim pendegradasi AHL adalah enzim Acyl Homoserine Lactonase (AHL-lactonase). AHL-laktonase merupakan senyawa anti-QS yang dapat digunakan sebagai alternatif dalam pengendalian bakteri patogen. Penelitian ini bertujuan menguji kemampuan isolat
Bacillus sp. penghasil AHL-Laktonase dalam menghambat proses QS patogenisitas beberapa bakteri. Bioesei yang dilakukan terhadap penghambatan QS Chromobacterium violaceum menunjukkan indeks penghambatan produksi violacein tertinggi dicapai Bacillus sp. SGT3g dengan nilai 0.33. Uji penghambatan QS pada Erwinia chrysanthemi menunjukkan Bacillus sp. INT1c dapat menghambat produksi faktor virulensi pada kentang. Uji in planta pada tanaman tembakau juga menunjukkan bahwa isolat Bacillus sp. NTT3a, NTT3e, SGT3g dan INT1c mampu menghambat timbulnya gejala nekrotik jaringan daun yang diinokulasi Ralstonia solanacearum, Pseudomonas syringae pv. glycines,
Pseudomonas fluorescens, dan Xanthomonas oryzae. Persentase penghambatan gejala nekrotik oleh keempat Bacillus tersebut mencapai lebih dari 99%.
Kata kunci: AHL-laktonase, autoinducer, bioluminesen, quorum sensing, virulensi
ABSTRACT
ZAHRAH NURLITA LUBIS. The Ability of Bacillus sp. Producing AHL- Lactonase to Inhibit Pathogenicity Quorum Sensing Process of Phytopatogen Bacteria. Supervised by IMAN RUSMANA and ALINA AKHDIYA.
Quorum Sensing (QS) is a process that bacteria are be able to communicate using a secreted signal molecule called autoinducer (AI). AI molecule of Gram negative bacteria is N-acylhomoserine lactone (AHL). The AHL can be degraded by an enzyme called Acyl Homoserine Lactonase (AHL-Lactonase). AHL-laktonase is an anti-QS compound can be used as to control bacterial pathogen virulence. This study aimed to test the ability of Bacillus sp. producing AHL lactonase in inhibiting QS processes of phytopatogenic bacteria. The highest inhibition index of violacein production by Chromobacterium violaceum was achieved by Bacillus sp. SGT3g with a value of 0.33. Inhibition test of QS process in Erwinia chrysanthemi showed that Bacillus sp. INT1c could inhibit its virulence in potatoes. Test in tobacco plants also showed that Bacillus
sp. NTT3a, NTT3e, SGT3g and INT1c was able to inhibit the emergence of necrotic leaf tissue symptoms of Ralstonia solanacearum, Pseudomonas syringae
pv. glycines, Pseudomonas fluorescens, dan Xanthomonas oryzae. Inhibition percentage inhibition of necrotic symptoms by the four Bacillus isolates was up to 99%.
Key word: AHL-lactonase, autoinducer, bioluminescens, quorum sensing, virulence
vii
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biologi
KEMAMPUAN Bacillus sp. PENGHASIL AHL-LAKTONASE
DALAM MENGHAMBAT PROSES QUORUM SENSING
PATOGENISITAS BAKTERI FITOPATOGEN
ZAHRAH NURLITA LUBIS
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
13
Judul Skripsi :Kemampuan Bacillus sp. Penghasil AHL-Laktonase dalam Menghambat Proses Quorum Sensing Patogenisitas Bakteri Fitopatogen
Nama :Zahrah Nurlita Lubis NIM :G34090092
Disetujui oleh
Dr Ir Iman Rusmana, MSi Pembimbing I
Alina Akhdiya, MSi Pembimbing II
Diketahui oleh
Dr Ir Iman Rusmana, MSi Ketua Departemen
2
PRAKATA
Alhamdulillahirabbil’alamiin. Puji syukur kehadirat Allah SWT atas limpahan rahmat dan karunia-Nya, sehingga saya dapat menyelesaikan karya ilmiah yang berjudul Kemampuan Bacillus sp. Penghasil AHL-Laktonase dalam Menghambat Proses Quorum Sensing Patogenisitas Bakteri Fitopatogen. Terhitung dari bulan Februari-Juni 2013 di rumah kaca dan Laboratorium Mikrobiologi, Departemen Biologi IPB.
Penulis mengucapkan terima kasih kepada Bapak Dr Ir Iman Rusmana, MSi selaku dosen pembimbing pertama dan Ibu Alina Akhdiya, MSi selaku pembimbing kedua yang telah memberi pengarahan dan dukungan materi selama penelitian dan penyusunan skripsi. Terima kasih kepada Ibu Dr Ir Y M Diah Ratnadewi selaku dosen penguji sekaligus perwakilan komisi pendidikan Departemen Biologi atas saran dan masukan selama penyelesaian karya ilmiah ini. Tak lupa juga penulis ucapkan terima kasih kepada Masrukhin, Olii, Della, Randi, Munjiati, Mba Aay, Agus, Yani, Dwi, Mba Sari, Ka Andri dan IR crew, serta staf Laboratorium Mikrobiologi IPB yang tidak dapat disebutkan satu-persatu. Ungkapan terima kasih juga penulis sampaikan kepada keluarga tercinta, terutama kedua orang tua, Bang Ami, Bang Anan, Rafid dan Dede yang senantiasa memberikan doa, dukungan dan limpahan kasih sayang. Tak lupa penulis ucapkan terima kasih kepada teman-teman Biologi 46 atas kerjasama, dukungan, dan semangatnya.
Semoga karya ilmiah ini dapat menambah wawasan dan pengetahuan bagi kita semua.
Bogor, September 2013
3
DAFTAR ISI
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vi
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 2
METODE ... 2
Waktu dan Tempat ... 2
Bakteri dan Pengkulturannya ... 2
Uji Penghambatan Proses QS ... 2
HASIL DAN PEMBAHASAN ... 4
Hasil ... 4
Pembahasan ... 9
SIMPULAN DAN SARAN ... 11
DAFTAR PUSTAKA ... 12
LAMPIRAN ... 13
2
DAFTAR TABEL
1 Penghambatan produksi violacein C. violaceum oleh Bacillus sp. 4 2 Luas nekrotik, intensitas virulensi, dan warna daun tembakau setelah
inokulasi patogen 7
3 Persentase penghambatan pembentukan gejala nekrotik jaringan daun tembakau pada minggu pertama dan minggu kedua 9
DAFTAR GAMBAR
1 Zona degradasi AHL yang terbentuk di sekitar paper disc 4 2 Uji penghambatan QS E. chrysanthemi oleh Bacillus sp. menggunakan
media umbi kentang 5
3 Kontrol negatif dan gejala nekrotik pada daun tembakau setelah
inokulasi patogen 6
4 Persentase luas jaringan nekrotik pada daun tembakau minggu pertama
dan minggu kedua 8
DAFTAR LAMPIRAN
3
PENDAHULUAN
Latar Belakang
Tanaman pangan merupakan sumber hayati yang sangat vital bagi kehidupan manusia. Salah satu faktor yang dapat mempengaruhi produktivitas tanaman pangan yaitu serangan patogen. Mikroba patogen tumbuhan (fitopatogen) dapat berupa bakteri, cendawan, atau virus. Beberapa bakteri fitopatogen penting antara lain Ralstonia solanacearum, Pseudomonas syringae pv. glycines, Pseudomonas fluorescens, Erwinia sp., dan Xanthomonas oryzae. R. solanacearum merupakan penyebab penyakit layu bakteri pada hampir 450 jenis tanaman dan pembusukan umbi kentang (Weller et al. 2000). P. syringae pv.
glycines menyebabkan penyakit bercak berwarna kekuningan hingga kecoklatan pada daun kedelai (Hettewer et al. 1998). Beberapa strain P. fluorescsens dapat menyebabkan penyakit bercak noda berwarna merah muda sampai kecoklatan pada umbi kentang (Garrood et al. 2004). E. chrysanthemi dapat menyebabkan penyakit busuk lunak pada kentang (Semangun 1988), sedangkan X. oryzae
merupakan penyebab penyakit hawar daun bakteri pada tanaman padi (Suparyono
et al. 2003).
Salah satu usaha untuk mengatasi masalah tersebut tanpa mencemari lingkungan adalah penggunaan bakteri sebagai agen biokontrol yang dilakukan tanpa mempengaruhi pertumbuhan bakteri patogennya. Hal tersebut dilakukan guna menghindari adanya tekanan seleksi yang mengakibatkan timbulnya resistensi (White dan Finan 2009). Mekanisme pengendalian patogen oleh agen biokontrol diantaranya dapat melalui mekanisme antibiosis, kompetisi ruang dan nutrisi, serta anti QS (Quorum Sensing). QS merupakan mekanisme komunikasi antar bakteri melalui senyawa autoinducer (AI) yang disekresikan. Mekanisme ini bergantung pada populasi bakteri. Setiap individu sel bakteri secara continue
mensekresikan molekul signal yang dapat dideteksi oleh sel-sel bakteri lain di sekitarnya. Signal-signal ini memacu koordinasi ekspresi proses tertentu seperti ekspresi faktor virulensi. Faktor-faktor virulensi tersebut diantaranya berupa enzim pendegradasi dinding sel, toksin, dan hormon.
N-acylhomoserine lactone (AHL) merupakan senyawa AI yang dihasilkan dan digunakan untuk komunikasi intraspesies oleh bakteri Gram negatif sedangkan pada bakteri Gram positif yaitu senyawa peptida (Rukayadi dan Hwang 2009). AHL dapat dihidrolisis ikatan laktonnya oleh enzim Acyl Homoserine Lactonase (AHL-lactonase). Enzim ini disandikan oleh gen aiiA yang dimiliki oleh Bacillus (Dong et al. 2000). Oleh karena itu, AHL-laktonase berpotensi untuk dikembangkan sebagai salah satu alternatif pengendalian bakteri fitopatogen melalui mekanisme anti-QS.
Tujuan Penelitian
Penelitian ini bertujuan menguji kemampuan isolat Bacillus sp. penghasil
2
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Februari 2013 sampai Juni 2013 bertempat di rumah kaca dan Laboratorium Mikrobiologi, Departemen Biologi, FMIPA IPB.
Bakteri dan Pembiakannya
Bakteri yang digunakan pada penelitian ini terdiri dari 4 isolat Bacillus sp., yaitu NTT3a dan NTT3e (Fitriyah 2011) serta SGT3g dan INT1c (Afiah 2011). Enam bakteri patogen yang digunakan, yaitu R. solanacearum, E. chrysanthemi, Chromobacterium violaceum, X. oryzae, P. fluorescens dan P. syringae pv. glycines. Bakteri-bakteri tersebut merupakan bakteri koleksi Dr Ir Iman Rusmana, MSi dan Alina Akhdiya, MSi.
Keempat isolat Bacillus sp. dan C. violaceum diremajakan pada media agar Luria Berthani (LB Agar) dan diperbanyak pada media kaldu Luria Berthani
(LB Broth). Inkubasi kultur Bacillus sp. dilakukan selama 48 jam sedangkan inkubasi C. violaceum dilakukan sampai kultur berwarna ungu (24 jam). Peremajaan kultur bakteri fitopatogen dilakukan pada media Trypticase Soy Agar
(TSA) dan perbanyakan kultur pada media Trypticase Soy Broth (TSB) (Lampiran 1). Inkubasi kultur bakteri patogen dilakukan selama 48-72 jam. Penyimpanan biakan kerja C. violaceum dilakukan pada suhu ruang, sedangkan bakteri yang lainnya disimpan dalam lemari pendingin.
Uji Penghambatan Proses QS
QS pada C. violaceum. Kultur cair Bacillus sp. umur 48 jam disentrifus selama 30 menit pada kecepatan 12000 rpm. Sebanyak 100 µl supernatan diteteskan pada paper disc steril (d:1.3 cm) yang diletakkan di permukaan LB agar semipadat yang telah diinokulasi dengan 1% kultur cair C. violaceum. Cawan tersebut kemudian diinkubasi pada suhu ruang selama 24 jam. Masing-masing cawan berisi 3 ulangan untuk satu perlakuan. Kontrol negatif dibuat dengan cara meneteskan media LB steril sebagai pengganti supernatan. Paper disc yang dikelilingi oleh zona tidak berwarna ungu menunjukkan adanya aktivitas penghambatan QS. Indeks penghambatan QS dihitung dengan cara sebagai berikut:
IP = Ø zona tidak ungu - Ø paper disc
Ø paper disc
Keterangan:
Ø zona tidak ungu = diameter zona tidak berwarna ungu (cm) Ø paper disc = diameter paper disc (cm)
3
permukaan potongan kentang yang diletakkan dalam cawan petri steril. Masing-masing kentang yang telah dipotong, terlebih dahulu ditusuk 3 kali menggunakan tusuk gigi steril. Potongan kentang tersebut diinokulasi dengan 0.1 ml suspensi E. chrysanthemi (dalam garam fisiologis, OD600 = 0.162). Setelah itu cawan petri berisi kentang ditutup dan diinkubasi pada suhu ruang selama 24 jam. Pengamatan dilakukan terhadap timbulnya gejala pembusukan jaringan kentang.
QS pada R. solanacearum, P. syringae pv. glycines, P. fluorescens, dan X. oryzae. Uji aktivitas penghambatan QS terhadap keempat bakteri tersebut dilakukan secara in planta pada tanaman tembakau (Nicotiana tabacum). Koloni keempat Bacillus sp. umur 48 jam diambil menggunakan ose lalu masing-masing disuspensikan dalam larutan garam fisiologis sampai diperoleh kepadatan 108 CFU/ml (Lampiran 2). Suspensi Bacillus sp. tersebut masing-masing disemprotkan ke tanaman tembakau umur 2 bulan. Setelah disemprot, tanaman disungkup dengan plastik bening. Tiga hari kemudian, daun tanaman tembakau yang telah disemprot tersebut diinokulasi dengan 0.5 ml suspensi bakteri fitopatogen lalu disungkup kembali dengan plastik. Inokulasi fitopatogen dilakukan menggunakan syringe tanpa jarum. Setiap perlakuan dibuat 10 titik inokulasi sebagai ulangan dan setiap helai daun dibuat 20 titik inokulasi. Inokulum fitopatogen disiapkan dengan cara mensuspensikan 2-3 koloni bakteri ke dalam 1 ml garam fisiologis. Sebagai kontrol negatif, tanaman disemprot suspensi Bacillus sp. tapi tidak diinokulasi dengan patogen. Sebagai kontrol positif, tanaman disemprot garam fisiologis lalu diinokulasi bakteri fitopatogen. Luas jaringan nekrotik pada daun diamati pada minggu pertama dan kedua setelah inokulasi patogen. Persentase penghambatan dan persentase gejala nekrotik dihitung dengan rumus sebagai berikut:
4
HASIL DAN PEMBAHASAN
Hasil
Penghambatan QS C. violaceum
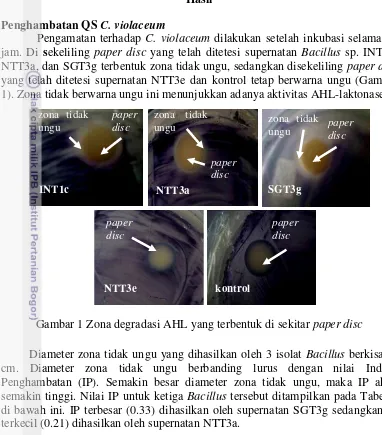
Pengamatan terhadap C. violaceum dilakukan setelah inkubasi selama 24 jam. Di sekeliling paper disc yang telah ditetesi supernatan Bacillus sp. INT1c, NTT3a, dan SGT3g terbentuk zona tidak ungu, sedangkan disekeliling paper disc
yang telah ditetesi supernatan NTT3e dan kontrol tetap berwarna ungu (Gambar 1). Zona tidak berwarna ungu ini menunjukkan adanya aktivitas AHL-laktonase.
Gambar 1 Zona degradasi AHL yang terbentuk di sekitar paper disc
Diameter zona tidak ungu yang dihasilkan oleh 3 isolat Bacillus berkisar 1 cm. Diameter zona tidak ungu berbanding lurus dengan nilai Indeks Penghambatan (IP). Semakin besar diameter zona tidak ungu, maka IP akan semakin tinggi. Nilai IP untuk ketiga Bacillus tersebut ditampilkan pada Tabel 1 di bawah ini. IP terbesar (0.33) dihasilkan oleh supernatan SGT3g sedangkan IP terkecil (0.21) dihasilkan oleh supernatan NTT3a.
Tabel 1 Penghambatan produksi violacein C. violaceum oleh Bacillus sp.
Isolat Diameter zona tidak
ungu (cm) IP ± SE
INT1c 1.70 0.31 ± 0.08
NTT3a 1.57 0.21 ± 0.04
NTT3e - -
SGT3g 1.73 0.33 ± 0.09
5
Penghambatan QS E. chrysanthemi
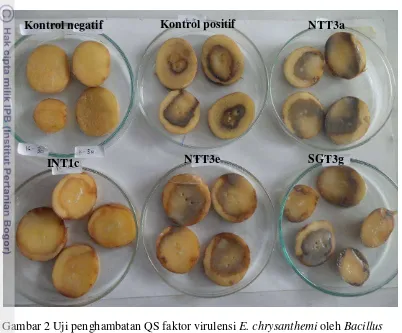
Hasil pengamatan menunjukkan adanya proses pembusukan yang lebih cepat (24 jam) pada jaringan kentang kontrol positif, perlakuan NTT3a, NTT3e, dan SGT3g, sedangkan proses pembusukan kentang yang di inokulasi E. chrysanthemi setelah ditetesi kultur Bacillus sp. INT1c berlangsung lambat dan gejala pembusukannya lebih ringan dibandingkan kontrol positif dan ketiga perlakuan tersebut. Kentang kontrol negatif tidak mengalami pembusukan (Gambar 2).
Gambar 2 Uji penghambatan QS faktor virulensi E. chrysanthemi oleh Bacillus
sp. pada umbi kentang
Penghambatan QS R. solanacearum, P. syringae pv. glycines, P. fluorescens, dan X. oryzae
Penghambatan QS fitopatogen pada tanaman tembakau diamati dari warna dan luas jaringan daun yang nekrotik pada titik-titik inokulasi. Hasil pengamatan menunjukkan daun pada tanaman kontrol negatif tidak mengalami gejala nekrotik (Gambar 3a), sedangkan daun pada tanaman kontrol positif menunjukkan adanya gejala nekrotik. Tanaman yang telah disemprot dengan Bacillus sp. menunjukkan intensitas yang lebih ringan dibandingkan kontrol positifnya (Gambar 3b).
Kontrol positif
NTT3e INT1c
NTT3a
6
(a)
Isolat P. fluorescens P. syringae pv.
glycines
R. solanacearum
X. oryzae
Kontrol positif
NTT3a
NTT3e
SGT3g
INT1c
(b)
Gambar 3 Kondisi daun tembakau yang tidak diinokulasi (kontrol negatif) (a) dan yang diinokulasi patogen (b) 2 minggu setelah inokulasi.
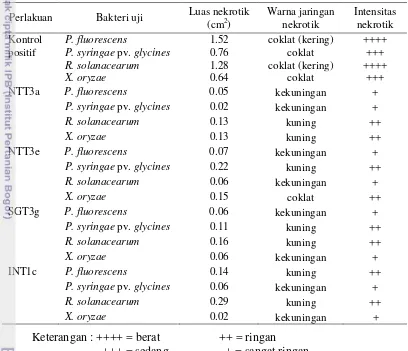
Luas jaringan nekrotik terbesar pada kontrol positif disebabkan oleh P. fluorescens (1.52 cm2). Pada daun yang disemprot Bacillus NTT3a, luas nekrotik terbesar disebabkan oleh R. solanacearum dan X. oryzae (0.13 cm2) dan pada daun yang disemprot Bacillus NTT3e, luas nekrotik terbesar disebabkan oleh P. syringae pv. glycines (0.22 cm2). Sedangkan luas jaringan nekrotik terbesar pada daun yang disemprot Bacillus SGT3g dan INT1c disebabkan R. solanacearum
7
Intensitas gejala nekrotik diukur secara kuantitatif (luas jaringan nekrotik) dan kualitatif (warna / keadaan jaringan nekrotik). Berdasarkan kedua parameter tersebut, intensitas nekrotik yang teramati dikelompokkan menjadi 4 kategori yaitu berat, sedang, ringan dan sangat ringan. Intensitas nekrotik kategori berat dan sedang hanya terdapat pada tanaman kontrol positif, sedangkan semua tanaman yang disemprot Bacillus menunjukkan gejala nekrotik yang ringan dan sangat ringan (Tabel 2).
Tabel 2 Intensitas nekrotik berdasarkan luas dan warna/ keadaan jaringan pada daun tembakau pada pengamatan 2 minggu setelah inokulasi patogen.
Perlakuan Bakteri uji Luas nekrotik (cm2)
Pengamatan pada 1 minggu setelah inokulasi menunjukkan persentase luas gejala nekrotik terbesar pada kontrol positif disebabkan oleh R. solanacearum
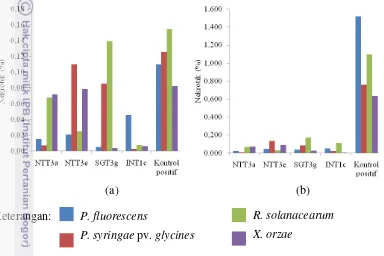
(0.15%). Pada perlakuan Bacillus NTT3a, persentase gejala nekrotik terbesar disebabkan oleh X. oryzae (0.07%). P. syringae pv. glycines menyebabkan gejala nekrotik dengan persentase luas terbesar (0.11%) pada perlakuan Bacillus NTT3e. Persentase luas nekrotik terbesar yang disebabkan R. solanacearum (0.14%) ditunjukkan pada perlakuan Bacillus SGT3g. Sedangkan daun yang disemprot
8
Persentase gejala nekrotik minggu kedua pada kontrol positif terbesar disebabkan oleh P. fluorescens (1.52%). Persentase gejala nekrotik terbesar disebabkan oleh X. oryzae (0.07%) pada perlakuan Bacillus NTT3a. Daun yang disemprot Bacillus NTT3e menunjukkan persentase gejala nekrotik terbesar disebabkan P. syringae pv. glycines (0.13%). Persentase gejala terbesar disebabkan oleh R. solanacearum (0.17%) pada perlakuan Bacillus SGT3g. Pada perlakuan Bacillus INT1c persentase gejala terbesar disebabkan oleh R. solanacearum (0.11%) (Gambar 4b).
(a) (b) Keterangan:
Gambar 4 Persentase luas jaringan nekrotik daun tembakau pada minggu pertama (a) dan minggu kedua (b) setelah inokulasi
Bacillus NTT3a, NTT3e, dan SGT3g mampu menghambat pembentukan gejala nekrotik yang disebabkan oleh P. fluorescens pada daun tembakau dengan persentase 99.99%. Persentase penghambatan yang sama juga diperoleh dari daun yang disemprot Bacillus NTT3a dan diinokulasi dengan P. syringae pv. glycines
serta tanaman yang disemprot Bacillus SGT3g dan diinokulasi dengan X. oryzae.
Bacillus sp. INT1c menunjukkan rata-rata tertinggi penghambatan gejala nekrotik yang disebabkan oleh P. syringae pv. glycines, R. solanacearum, dan X. oryzae. Persentase penghambatan terhadap ketiga bakteri patogen tersebut juga mencapai 99.99%.
Berbeda dengan minggu pertama, pada minggu kedua persentase penghambatan tertinggi Bacillus sp. NTT3a terhadap P. syringae pv. glycines
(99.99%). Persentase penghambatan tertinggi pada perlakuan Bacillus NTT3e terhadap R. solanacearum (99.97%). Persentase penghambatan tertinggi pada perlakuan SGT3g terhadap X. oryzae (99.98%). Persentase penghambatan tertinggi pada perlakuan Bacillus INT1c terhadap X. oryzae (99.99%) (Tabel 3).
P. fluorescens
P. syringae pv. glycines
9
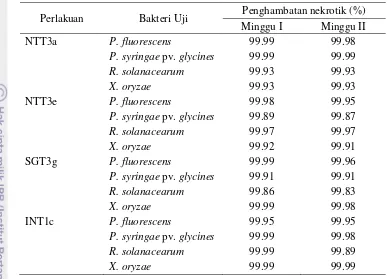
Tabel 3 Persentase penghambatan pembentukan gejala nekrotik jaringan daun tembakau pada minggu pertama dan minggu kedua telah inokulasi
Perlakuan Bakteri Uji Penghambatan nekrotik (%) Minggu I Minggu II NTT3a P. fluorescens 99.99 99.98
P. syringae pv. glycines 99.99 99.99
R. solanacearum 99.93 99.93
X. oryzae 99.93 99.93
NTT3e P. fluorescens 99.98 99.95
P. syringae pv. glycines 99.89 99.87
R. solanacearum 99.97 99.97
X. oryzae 99.92 99.91
SGT3g P. fluorescens 99.99 99.96
P. syringae pv. glycines 99.91 99.91
R. solanacearum 99.86 99.83
X. oryzae 99.99 99.98
INT1c P. fluorescens 99.95 99.95
P. syringae pv. glycines 99.99 99.98
R. solanacearum 99.99 99.89
X. oryzae 99.99 99.99
Pembahasan
Bioesei yang dilakukan terhadap keempat isolat Bacillus (NTT3a, NTT3e, SGT3g dan INT1c) menunjukkan bahwa NTT3a, INT1c dan SGT3g mampu menghambat pembentukan pigmen ungu pada Chromobacterium violaceum, sedangkan NTT3e tidak mampu menghambat pembentukan pigmen ungu (Gambar 1 dan Tabel 1). Pigmen ungu tersebut adalah senyawa yang bersifat antimikrob bernama violacein (McClean et al. 1997).
Produksi pigmen violacein pada C. violaceum diregulasi melalui proses QS. Zona berwarna tidak ungu yang terbentuk disekitar paper disc yang telah ditetesi supernatan kultur Bacillus NTT3a, INT1c, dan SGT3g menunjukkan adanya penghambatan QS yang mengatur produksi violacein. QS pada C. violaceum
10
bakteri dipengaruhi oleh suhu dan pH. Suhu dan pH optimum aktivitas AHL-laktonase yaitu 20 oC dengan pH 8 (Chen et al. 2010), namun Wang et al.
(2004) menyatakan bahwa enzim AHL-laktonase masih stabil pada suhu di bawah 37 oC. Selain suhu dan pH, produksi enzim juga dipengaruhi oleh kandungan nutrisi, tekanan osmotik, tingkat aerasi, dan kontrol terhadap kontaminasi (Pandey
et al. 2000).
Kemampuan isolat Bacillus dalam penghambatan proses QS juga bisa diuji menggunakan bakteri dari genus Erwinia. Kentang merupakan sayuran yang memiliki kandungan pektin tinggi. E. chrysanthemi adalah salah satu fitopatogen dari genus Erwinia yang mampu memanfaatkan pektin pada umbi kentang dan menyebabkan pembusukan kentang (Purwoko 2009). Produksi enzim ekstraselular pektinase pada genus bakteri ini dikendalikan melalui mekanisme QS yang melibatkan senyawa yang berperan sebagai molekul signal. Hasil uji menunjukkan bahwa supernatan Bacillus sp. INT1c mampu menghambat pembusukan umbi kentang yang diinokulasi E. chrysanthemi. Ini mengindikasikan bahwa AHL-laktonase yang terdapat dalam supernatan INT1c mampu menghambat QS proses produksi enzim pektinase yang merupakan salah satu faktor virulensi E. chrysanthemi.
Bakteri fitopatogen dapat masuk kedalam jaringan tanaman melalui lubang alami seperti stomata, lentisel, dan bagian yang luka. Elisitor dan faktor-faktor virulensi yang dihasilkan fitopatogen akan merangsang munculnya respon hipersensitif pada jaringan yang terinfeksi sebagai salah satu cara untuk melokalisir fitopatogen (Fenselau et al. 1992). Regulasi sintesis faktor-faktor virulensi pada bakteri fitopatogen Gram negatif seperti Erwinia, Pseudomonas, dan Ralstonia berlangsung memelalui proses QS (Fuqua dan Greenberg 2002; Loh et al. 2002; Williams et al. 2007). Oleh karena itu, penghambatan QS oleh
Bacillus sp. juga dapat diamati dari kemampuannya dalam menghambat pembentukan gejala nekrotik jaringan daun yang diinfeksi secara buatan dengan bakteri fitopatogen. Pengamatan menunjukkan persentase luas jaringan daun yang nekrotik rata-rata semakin besar pada 2 msi (minggu setelah infeksi). Besarnya peningkatan persentase luas jaringan nekrotik pada tanaman kontrol dibandingkan dengan tanaman yang disemprot Bacillus sp. (Gambar 4) mengindikasikan adanya penghambatan proses QS ekspresi faktor-faktor virulensi bakteri fitopatogen. Penghambatan proses QS-nya tersebut dapat disebabkan antara lain oleh degradasi senyawa AHL yang disekresikan bakteri fitopatogen oleh aktivitas enzim AHL-laktonase yang diekresikan Bacillus sp.
Persentase penghambatan gejala nekrotik yang besar oleh isolat-isolat
11
SIMPULAN
Bacillus sp. NTT3a, NTT3e, SGT3g dan INT1c memiliki kemampuan menghambat proses QS bakteri fitopatogen. Bacillus sp. SGT3g dapat menghambat QS C. violaceum dengan nilai Indeks Penghambatan tertinggi (0.33) dibandingkan isolat lainnya. Bacillus sp. INT1c dapat memperlambat proses pembusukan pada kentang yang disebabkan E. crhysanthemi. Keempat isolat
Bacillus sp. tersebut juga mampu menghambat timbulnya gejala nekrotik pada daun tembakau yang diinfeksi dengan C. violaceum, E. chrysanthemi, R. solanacearum, P. fluorescens, P. syringae pv. glycines, dan X. oryzae.
Berdasarkan bioesei penghambatan QS yang dilakukan terhadap 6 patogen diatas, Bacillus INT1c merupakan isolat yang paling potensial karena memiliki aktivias penghambatan QS yang paling kuat dibandingkan ketiga isolat Bacillus
lainnya.
DAFTAR PUSTAKA
Afiah TSN. 2011. Isolasi dan karakterisasi bakteri penghasil acyl homoserine lactonase (AHL-laktonase) asal lahan pertanian di Jawa [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Chen R, Zhou Z, Cao Y, Bai Y, Yao B. 2010. High yield expression of an AHL-lactonase from Bacillus sp. B546 in Pichia pastoris and its application to reduse Aeromonas hydrophia mortality in aquaculture. Microbial Cell Factories. 9:39-49.
Dong YH, Xu JL, Li XC, Zhang LH. 2000. aiiA, a novel enzyme inactivates acyl homoserine-lactone quorum-signal and attenuated the virulence of Erwinia carotovora. Proc Natl Acad Sci. 97:3526-3531.
Fitriyah A. 2011. Isolasi dan karakterisasi bakteri penghasil AHL-laktonase asal lahan pertanian luar pulau Jawa [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Fenselau S, Balbo I, Bonas U. 1992. Determination of pathogenicity in
Xanthomonas campestris pv. vesicatoria are related to proteins involved in secretion in bacterial pathogen animals. Mol Plant Microb Interact. 5:390-396.
Fuqua C, Greenberg EP. 2002. Listening in on bacteria: acyl-homoserine lactone signalling. Nat Rev Mol Cell Biol. 3:685-695.
Garrood MJ, Wilson PDG, Brocklehurst TF. 2004. Modeling the rate of attachment of Listeria monocyotgenes, Pantoea agglomerans, and
Pseudomonas fluorescens to, and the probability of their detachment from 1 potato tissue at 10 oC. Appl Environl Microbiol. 70:3558-3565.
Hettewer U, Jaeckel FR, Boch J, Meyer M, Rudolph K, Ullrich MS. 1998. Cloning nucleotide sequence, and expression in Escherichia coli of levansucrase genes from the plant pathogen Pseudomonas syringae pv. glycinea and P. syringae pv. phaseolicola. Appl Environ Microbiol.
12
Loh J, Pierson EA, Pierson LS, Stacey G, Chatterjee A. 2002. Quorum sensing in plant-associated bacteria. Curr Opin Plant Biol. 5:285-290.
McClean KH, Winson MK, Fish L, Taylor A, Chhabra SR, Camara M, Daykin M, Lamb JH, Swift S, Bycroft BW, Stewart GSAB, Williams P. 1997. Quorum sensing and Chromobacterium violaceum: exploitation of violacein production and inhibition for the detection of N-acylhomoserine lactones.
Microbiology. 143:3703-3711.
Pandey A, Nigam P, Soccol CR, Soccol VT, Singh D, Mohan R. 2000. Advances in microbial amylases. Biotechnol Appl Biochem. 31:135-152.doi:10.1042/BA19990073
Purwoko T. 2009. Fisiologi Mikroba. Jakarta (ID): PT Bumi Aksara.
Rukayadi Y, Hwang JK. 2009. Pencegahan quorum sensing: suatu pendekatan baru dalam mengatasi infeksi bakteri. Medicinus. 22:22-27.
Semangun H. 1988. Penyakit-penyakit Tanaman Perkebunan di Indonesia. Fakultas Pertanian Universitas Gadjah Mada. Yogyakarta (ID): Gadjah Mada Univ Pr.
Suparyono J, Catindig LA, Pena FA, Ona IP. 2003. Bacterial Leaf Blight. [Internet]. [diunduh 2013 April 7]. Tersedia pada: http://www.knowledgebank.irri.org.
Wang LH, Weng LX, Dong YH, Zhang LH. 2004. Specifity and enzyme kinetics of the quorum-quenching N-acyl homoserine lactone lactonase (AHL-lactonase). J Biol Chem. 279:13645-13651.doi:10.1074/jbc.
Williams P, Winzer K, Chan W, Camara M. 2007. Look who’s talking: communication and quorum sensing in the bacterial world. Philos Trans R Soc London B Biol Sci. 362:1119-1134.
Weller SA, Elphinstone JG, Smith NC, Boonham N, Stead DE. 2000. Detection of
Ralstonia solanacearum strain with a quantitative, multiplex, real-time, fluorogenic PCR (Taq Man) assay. Appl Environ Microbiol. 66:2853-2858. White CE, Finan TM. 2009. Quorum sensing in Agrobacterium tumefaciens:
LAMPIRAN
Lampiran 1 Komposisi media yang digunakan A. Media Luria Berthani Agar (LB Agar)
- 1 g Trypton - 1 g NaCl
- 0.5 g yeast axtract
- 0.1 g CaCO3 - 1.5 g agar - 100 ml akuades
B. Media Luria Berthani Agar (LB Agar) semi padat - 1 g Trypton
- 1 g NaCl
- 0.5 g yeast extract
- 0.1 g CaCO3 - 1 g agar
- 100 ml akuades
C. Media Luria Berthani Broth (LB Broth) - 1 g Trypton
- 1 g NaCl
- 0.5 g yeast extract
- 100 ml akuades
D. Media Trypticase Soy Broth (TSB) - 3 g trypticase soy broth
- 100 ml akuades
E. Media Trypticase Soy Agar (TSA) - 3 g trypticase soy broth
- 2 g agar
14
Lampiran 2 Kurva standar isolat Bacillus sp. NTT3a (a), NTT3e (b), SGT3g (c) dan INT1c (d)
(a) (b)
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 12 November 1991 dari ayah Nurhasyim Lubis dan ibu Juningsih Bachtiar. Penulis merupakan anak ketiga dari lima bersaudara. Tahun 2009 penulis lulus dari MA Negeri 1 Bekasi. Pada tahun yang sama, penulis lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI) di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam. Penulis mendapatkan beasiswa Peningkatan Prestasi Akademik (PPA) pada tahun 2009 dan Bantuan Belajar Mahasiswa (BBM) dari DIKTI pada tahun 2010-2013.