ABSTRAK
ANIS ARIYANI. Pembuatan Komposit Magnet Oksida Besi-Karbon Aktif sebagai
Adsorben Cs dan Sr. Dibimbing oleh BETTY MARITA SOEBRATA dan ADEL FISLI.
Oksida besi dan komposit magnet oksida besi-karbon aktif telah dibuat
menggunakan metode kopresipitasi pada suhu 70
oC. Nisbah oksida besi-karbon aktif
yang digunakan 1:1, 1:2, dan 1:3. Komposit magnet dibuat untuk mendapatkan bahan
penjerap yang dapat merespons medan magnet sehingga dapat dipisahkan dari medium
berair melalui teknik pemisahan magnet sederhana. Hasil karakterisasi menggunakan
difraksi sinar-X menunjukkan kesamaan puncak difraksi oksida besi dan komposit
magnet dengan puncak khas basis data program PCDFWIN nomor arsip 11-0614 yang
merupakan oksida besi dari fase magnetit (Fe
3O
4). Nilai magnetisasi hasil pengukuran
magnetometri getar cuplikan pada sampel oksida besi dan komposit magnet yang dibuat
berturut-turut sebesar 76.59, 25.6, 18.9, serta 11 emu/g. Penurunan nilai magnetisasi
disebabkan oleh jumlah fraksi oksida besi yang semakin berkurang. Pencirian
menggunakan mikroskop elektron payaran memperlihatkan bentuk partikel kecil dari
oksida besi. Mikrostruktur karbon aktif berupa pori-pori besar, sedangkan pada komposit
magnet terlihat partikel kecil oksida besi yang menutupi dan mengelilingi pori-pori
karbon aktif. Pengukuran luas permukaan menggunakan alat Brunauer, Emmett, dan
Teller menunjukkan penurunan luas permukaan pada karbon aktif yang telah terkomposit
oksida besi. Uji adsorpsi memperlihatkan kapasitas penjerapan Cs dan Sr terbesar terjadi
pada jumlah adsorben 0.0125 g dan konsentrasi awal 200 ppm. Keadaan pH optimum
penjerapan Cs terjadi pada pH 7, sedangkan penjerapan Sr lebih rendah, yaitu pada pH 6.
ABSTRACT
ANIS ARIYANI. Preparation of Iron Oxide-Activated Carbon Magnetic Composite as
Adsorbent for Cs and Sr. Supervised by BETTY MARITA SOEBRATA and ADEL
FISLI.
PENDAHULUAN
Saat ini, ilmu pengetahuan dan teknologi nuklir telah banyak dimanfaatkan pada bidang penelitian, pertanian, kesehatan, industri, dan lain-lain. Pemanfaatan teknologi nuklir dapat meningkatan kesejahteraan dan kemakmuran manusia, tetapi terdapat pula potensi bahaya radiasi terhadap lingkungan hidup. Bahaya radiasi tersebut berasal dari limbah radioaktif yang ditimbulkan dari kegiatan industri nuklir (Suryantoro 2006). Sesium dan strontium merupakanradionuklida hasil fisi bahan bakar yang dominan dalam limbah nuklir dan sangat berbahaya bagi makhluk hidup, karena dapat menyebabkan gangguan kesehatan bahkan kematian. Hal ini dikarenakan Cs dan Sr yang bersifat radioaktif memiliki waktu paruh relatif panjang, yaitu 30 tahun (137Cs) dan 29.1
tahun (90Sr) (Khan et al. 1995). Radionuklida
tersebut dapat masuk ke dalam rantai makanan melalui media udara, air, dan tanah (Tjahaja dan Sukmabuana 2008).
Oleh karena itu, diperlukan suatu penanganan khusus untuk mencegah kontaminasi lingkungan oleh kedua radionuklida tersebut. Salah satunya adalah dengan menggunakan material penjerap atau adsorben karbon aktif. Penelitian dengan karbon aktif untuk menjerap Cs dan Sr telah dilakukan oleh Alarifi dan Hanafi (2010), serta oleh Chegrouche et al. (2009), yang
menjerap Sr di dalam medium berair. Kedua penelitian di atas menyimpulkan bahwa Cs dan Sr dapat terjerap dengan baik pada karbon aktif karena adanya gugus karbonil pada sisi aktif karbon aktif. Namun, penjerapan pada kedua penelitian di atas menggunakan metode tumpak sehingga diperlukan penyaringan untuk memisahkan karbon aktif dengan larutan adsorbat. Penyaringan tersebut membutuhkan waktu lama dan diperlukan penyaring yang dapat menahan seluruh ukuran karbon aktif, sehingga diperlukan modifikasi terhadap karbon aktif, yaitu dengan mengompositkan partikel magnet oksida besi. Magnetit atau Fe3O4 merupakan salah satu
fase oksida besi yang memiliki sifat magnet terbesar di antara fase-fase lainnya (Sulungbudi et al. 2006) sehingga karbon
aktif yang telah terkomposit magnetit dapat merespons medan magnet dan akan memudahkan proses pemisahannya. Penelitian sebelumnya yang dilakukan oleh Oliveira et al. (2002), membuat komposit magnet oksida
besi-karbon aktif sebagai adsorben berbagai kontaminan, danCastro et al. (2009) membuat
komposit karbon aktif-oksida besi sebagai
adsorben atrazin di dalam medium berair. Secara umum, terjadi penurunan luas permukaan yang mengakibatkan penurunan kapasitas penjerapan pada komposit karbon aktif-oksida besi. Namun, hal ini diimbangi dengan kemudahan pada proses pemisahan, yaitu dengan memanfaatkan sifat magnet dari komposit karbon aktif-oksida besi.
Penelitian ini bertujuan membuat komposit magnet oksida besi-karbon aktif sehingga didapat komposit yang memiliki dua sifat dari material penyusunnya, yaitu kemampuan menjerap yang baik dari karbon aktif dan kemampuan merespons medan magnet dari oksida besi sehingga akan memudahkan proses pemisahan karbon aktif di dalam medium berair. Selanjutnya, pencirian komposit dilakukan dengan menggunakan berbagai instrumen, yaitu difraksi sinar-X (XRD) untuk menentukan fase oksida besi yang terbentuk, nilai magnetisasi dengan magnetometri getar cuplikan (VSM), alat Brunauer, Emmett, dan Teller (BET) untuk menentukan luas permukaan, serta mikroskop elektron payaran (SEM) untuk mengetahui mikrostruktur permukaan komposit.
Uji penjerapan dilakukan untuk melihat pengaruh penjerapan komposit magnet oksida besi-karbon aktif terhadap Csdan Srdengan menggunakan metode tumpak. Parameter yang digunakan dalam uji adsorpsi ini adalah ragam jumlah adsorben, ragam pH larutan, dan ragam konsentrasi awal kation Cs serta Sr. Konsentrasi Cs dan Sr yang tersisa di dalam larutan setelah penjerapan berlangsung ditentukan menggunakan spektroskopi serapan atom (AAS).
TINJAUAN PUSTAKA
Karbon Aktif
Arang atau karbon aktif dapat dihasilkan dari bahan-bahan yang mengandung karbon atau dari arang dengan aktivasi secara fisik menggunakan CO2 atau uap air, atau secara
kimia mengggunakan bahan kimia untuk mendapatkan permukaan yang lebih luas. Luas permukaan karbon aktif berkisar antara 300 dan 3500 m2/g. Oleh karena itu, karbon
PENDAHULUAN
Saat ini, ilmu pengetahuan dan teknologi nuklir telah banyak dimanfaatkan pada bidang penelitian, pertanian, kesehatan, industri, dan lain-lain. Pemanfaatan teknologi nuklir dapat meningkatan kesejahteraan dan kemakmuran manusia, tetapi terdapat pula potensi bahaya radiasi terhadap lingkungan hidup. Bahaya radiasi tersebut berasal dari limbah radioaktif yang ditimbulkan dari kegiatan industri nuklir (Suryantoro 2006). Sesium dan strontium merupakanradionuklida hasil fisi bahan bakar yang dominan dalam limbah nuklir dan sangat berbahaya bagi makhluk hidup, karena dapat menyebabkan gangguan kesehatan bahkan kematian. Hal ini dikarenakan Cs dan Sr yang bersifat radioaktif memiliki waktu paruh relatif panjang, yaitu 30 tahun (137Cs) dan 29.1
tahun (90Sr) (Khan et al. 1995). Radionuklida
tersebut dapat masuk ke dalam rantai makanan melalui media udara, air, dan tanah (Tjahaja dan Sukmabuana 2008).
Oleh karena itu, diperlukan suatu penanganan khusus untuk mencegah kontaminasi lingkungan oleh kedua radionuklida tersebut. Salah satunya adalah dengan menggunakan material penjerap atau adsorben karbon aktif. Penelitian dengan karbon aktif untuk menjerap Cs dan Sr telah dilakukan oleh Alarifi dan Hanafi (2010), serta oleh Chegrouche et al. (2009), yang
menjerap Sr di dalam medium berair. Kedua penelitian di atas menyimpulkan bahwa Cs dan Sr dapat terjerap dengan baik pada karbon aktif karena adanya gugus karbonil pada sisi aktif karbon aktif. Namun, penjerapan pada kedua penelitian di atas menggunakan metode tumpak sehingga diperlukan penyaringan untuk memisahkan karbon aktif dengan larutan adsorbat. Penyaringan tersebut membutuhkan waktu lama dan diperlukan penyaring yang dapat menahan seluruh ukuran karbon aktif, sehingga diperlukan modifikasi terhadap karbon aktif, yaitu dengan mengompositkan partikel magnet oksida besi. Magnetit atau Fe3O4 merupakan salah satu
fase oksida besi yang memiliki sifat magnet terbesar di antara fase-fase lainnya (Sulungbudi et al. 2006) sehingga karbon
aktif yang telah terkomposit magnetit dapat merespons medan magnet dan akan memudahkan proses pemisahannya. Penelitian sebelumnya yang dilakukan oleh Oliveira et al. (2002), membuat komposit magnet oksida
besi-karbon aktif sebagai adsorben berbagai kontaminan, danCastro et al. (2009) membuat
komposit karbon aktif-oksida besi sebagai
adsorben atrazin di dalam medium berair. Secara umum, terjadi penurunan luas permukaan yang mengakibatkan penurunan kapasitas penjerapan pada komposit karbon aktif-oksida besi. Namun, hal ini diimbangi dengan kemudahan pada proses pemisahan, yaitu dengan memanfaatkan sifat magnet dari komposit karbon aktif-oksida besi.
Penelitian ini bertujuan membuat komposit magnet oksida besi-karbon aktif sehingga didapat komposit yang memiliki dua sifat dari material penyusunnya, yaitu kemampuan menjerap yang baik dari karbon aktif dan kemampuan merespons medan magnet dari oksida besi sehingga akan memudahkan proses pemisahan karbon aktif di dalam medium berair. Selanjutnya, pencirian komposit dilakukan dengan menggunakan berbagai instrumen, yaitu difraksi sinar-X (XRD) untuk menentukan fase oksida besi yang terbentuk, nilai magnetisasi dengan magnetometri getar cuplikan (VSM), alat Brunauer, Emmett, dan Teller (BET) untuk menentukan luas permukaan, serta mikroskop elektron payaran (SEM) untuk mengetahui mikrostruktur permukaan komposit.
Uji penjerapan dilakukan untuk melihat pengaruh penjerapan komposit magnet oksida besi-karbon aktif terhadap Csdan Srdengan menggunakan metode tumpak. Parameter yang digunakan dalam uji adsorpsi ini adalah ragam jumlah adsorben, ragam pH larutan, dan ragam konsentrasi awal kation Cs serta Sr. Konsentrasi Cs dan Sr yang tersisa di dalam larutan setelah penjerapan berlangsung ditentukan menggunakan spektroskopi serapan atom (AAS).
TINJAUAN PUSTAKA
Karbon Aktif
Arang atau karbon aktif dapat dihasilkan dari bahan-bahan yang mengandung karbon atau dari arang dengan aktivasi secara fisik menggunakan CO2 atau uap air, atau secara
kimia mengggunakan bahan kimia untuk mendapatkan permukaan yang lebih luas. Luas permukaan karbon aktif berkisar antara 300 dan 3500 m2/g. Oleh karena itu, karbon
2
Karbon aktif bersifat sangat aktif dan akan menjerap apa saja yang kontak dengannya, terutama logam berat. Logam yang dijerap akan melekat pada permukaan karbon aktif secara fisik (ikatan van der Waals) maupun secara kimia (ikatan kovalen atau ikatan ionik). Selain itu, karbon aktif memiliki jaringan berpori yang sangat luas dan dapat berubah-ubah bentuk sehingga dapat menerima molekul pengotor berukuran besar maupun kecil (Arifin 2008).
Karbon aktif dibedakan menjadi dua macam, yaitu karbon aktif sebagai pemucat dan sebagai penjerap uap. Karbon aktif sebagai pemucat berbentuk serbuk yang sangat halus dengan diameter pori mencapai
1000 Ǻ, digunakan dalam fase cair, berfungsi
sebagai pemindah zat-zat pengganggu yang dapat menyebabkan warna dan bau, serta dapat diperoleh dari bahan baku serbuk gergaji dan ampas pembuatan kertas. Sementara, karbon aktif sebagai penjerap uap berbentuk granul, sangat keras, berdiameter 10–200 Ǻ, berpori halus, digunakan dalam fase gas, berfungsi untuk memperoleh kembali pelarut, sebagai katalis, untuk memisahkan dan memurnikan gas, serta dapat diperoleh dari bahan baku tempurung kelapa, tulang, batu bata, dan bahan-bahan yang memiliki struktur keras.
Oksida Besi
Oksida besi termasuk salah satu mineral dalam tanah. Mineral-mineral oksida besi bersifat amfoter dan memiliki daya serap yang tinggi (Notodarmojo 2005). Oksida besi memiliki empat fase yaitu magnetit (Fe3O4),
magemit ( -Fe2O3), hematit (α-Fe2O3), dan
geotit (FeO(OH)). Hanya magnetit dan magemit yang bersifat magnet (Gong et al.
2009).
Hematit merupakan mineral berwarna merah yang terdapat dalam jumlah banyak pada batuan dan tanah (Teja dan Koh 2009). Mineral ini dapat bersifat antiferomagnetik pada suhu di bawah -10 oC (Hadi 2009). Tipe
oksida besi yang lain, yaitu geotit, memiliki ciri fisik berwarna kuning kecokelatan dan juga bersifat antiferomagnetik.
Secara fisik, magnetit berwarna hitam. Struktur magnetit dapat dilihat pada Gambar 1. Sementara itu, magemit berwarna cokelat kemerah-merahan. Fase magnetit dan magemit memiliki sifat magnet yang baik, maka sering digunakan dalam berbagai aplikasi, misalnya dalam aplikasi biomedis sebagai ’contrast agent’ untuk pencitraan resonans magnet (MRI) dan dapat digunakan
sebagai penjerap logam berat dalam pengolahan air, terutama fase magnetit (Fe3O4) yang memiliki sifat megnet terbesar
atau ferimagnetik.
Gambar 1 Struktur magnetit.
Sifat Kemagnetan Bahan (Geo 2007)
Sifat kemagnetan bahan dikelompokkan menjadi lima golongan, yaitu diamagnetik, paramagnetik, feromagnetik, ferimagnetik, dan antiferomagnetik. Bahan diamagnetik memiliki elektron-elektron yang berpasangan sehingga tidak menghasilkan momen magnet. Contoh bahan diamagnetik ialah tembaga, perak, emas, kalsit (CaCO3), dan air.
Bahan paramagnetik memiliki elektron-elektron yang tidak berpasangan dengan rangkaian spin yang tidak beraturan sehingga memiliki sifat kemagnetan yang kecil, contohnya antara lain magnesium, molibdenum, litium, dan tantalum. Di sisi lain, sifat feromagnetik dimiliki oleh bahan yang elektron-elektronnya tidak berpasangan dengan spin yang tersusun secara paralel. Karena itu, sifat kemagnetannya sangat besar, contohnya adalah besi, nikel, dan kobalt.
Bahan ferimagnetik juga memiliki elektron-elektron yang tidak berpasangan. Namun, spin elektron tersusun secara antiparalel dengan besar momen spin yang berbeda. Total momen magnet yang positif membuat sifat kemagnetannya besar, contohnya adalah magnetit, magemit, MnFe2O4, Fe7S8, Fe3S4, dan -FeOOH. Sifat
antiferomagnetik dimiliki oleh bahan yang memiliki elektron-elektron tidak berpasangan dengan spin yang tersusun antiparalel dan momen setiap spin saling meniadakan sehingga momen magnet totalnya nol. Contoh bahan antiferomagnetik adalah hematit, FeS, FeTiO2, dan α-FeOOH.
Komposit
3
kimia dan fisika, sehingga diperoleh bahan baru dengan mutu yang lebih baik (Fisli et al.
2007).
Strontium
Strontium (Sr) merupakan salah satu unsur dalam tabel periodik yang banyak ditemukan pada batuan, tanah, minyak, dan batu bara. Selain itu, Sr juga ditemukan di dalam mineralnya seperti kalestit (SrSO4), dan
strontianit (SrCO3). Sr digunakan sebagai
bahan dasar pembuatan berbagai macam produk keramik dan gelas, pewarna cat, lampu flouresens, dan obat-obatan. Strontium memiliki empat bentuk isotop yang stabil di alam, yaitu 84Sr, 86Sr, 87Sr, dan 88Sr. Bentuk
stabil Sr tidak berbahaya pada dosis kurang dari 4000 μg/L di dalam air minum, tetapi berbahaya bagi pertumbuhan tulang pada anak-anak (Gerberding 2004).
Sr memiliki bentuk yang aktif atau bersifat radioaktif yaitu 90Sr. Bentuk aktif ini berasal dari limbah hasil pembelahan bahan bakar nuklir dan letusan senjata-senjata nuklir. 90Sr
sangat berbahaya bagi makhluk hidup, karena dapat memancarkan partikel- dan memiliki
waktu paruh yang panjang, yaitu 29 tahun. Radionuklida ini dapat masuk ke dalam tubuh makhluk hidup melalui tanah, udara, dan air (Tjahaja dan Sukmabuana 2008). Jika berada di atas ambang batas radiasi (8 pikocurie/L air minum), 90Sr dapat menyebabkan gangguan
kesehatan bagi makhluk hidup termasuk manusia. Gangguan kesehatan tersebut dapat berupa penyakit anemia, kerusakan pada tulang, penggumpalan darah, bahkan penyakit berbahaya seperti kanker tulang, kanker kulit, dan leukemia.
Sesium
Sesium merupakan logam yang banyak terdapat pada mineral polusit. Sebanyak 13% sesium oksida terkandung di dalam mineral tersebut. 133Cs merupakan logam stabil yang
menyerupai merkuri, karena pada suhu kamar (± 28 oC) berwujud cair. Selain itu, Cs juga
mudah bereaksi jika kontak dengan air dingin. Cs dalam bentuk stabil digunakan sebagai bahan pembuatan keramik dan gelas serta sebagai alat optik, sedangkan Cs yang bersifat radioaktif dapat digunakan sebagai bahan sterilisasi pada produk makanan (Butterman
et. al. 2005).
Unsur ini memiliki sebelas bentuk isotop yang bersifat radioaktif. Namun, hanya tiga bentuk isotop yang memiliki waktu paruh panjang, yaitu 134Cs, 135Cs, dan 137Cs.
Isotop-isotop ini memancarkan radiasi sinar- dengan
waktu paruh masing-masing 2.1, 2.3 х 106,
dan 30 tahun, sedangkan isotop lainnya hanya memiliki waktu paruh dua minggu. Radionuklida ini dapat masuk ke dalam tubuh makhluk hidup karena mudah terserap oleh daun tumbuhan yang tanahnya terkontaminasi. Selain itu, Cs juga dapat masuk ke dalam tubuh makhluk hidup melalui makanan, minuman, dan udara. Ancaman kesehatan bagi manusia jika terkontaminasi Cs adalah penyakit kanker.
Adsorpsi
Adsorpsi atau penjerapan merupakan
proses perpindahan massa dari fase gerak (fluida pembawa adsorbat) ke permukaan adsorben (penjerap). Proses ini terjadi akibat adanya gaya tarik-menarik antara molekul adsorbat (zat yang akan dijerap) dan tapak-tapak aktif di permukaan adsorben. Ada tiga tahapan dasar dalam penjerapan, yaitu terjerapnya adsorbat pada bagian luar adsorben, bergeraknya adsorbat menuju pori-pori adsorben, dan terjerapnya adsorbat pada dinding bagian dalam adsorben.
Penjerapan terjadi melalui dua cara, yaitu fisisorpsi dan kimisorpsi. Molekul-molekul dalam fase cair diikat pada permukaan fase padat oleh gaya tarik-menarik pada permukaan padatan (adsorben). Hal ini mengatasi energi kinetik antarmolekul kontaminan dalam fluidanya. Fisisorpsi terjadi karena adanya antaraksi van der Waalsantara adsorbat dan substrat. Menurut Wonorahardjo (2006), proses ini dapat terjadi secara bolak-balik akibat adanya sistem kesetimbangan di permukaan dan tidak mengakibatkan perubahan struktur dalam partikel-partikel yang berinteraksi. Sementara itu, kimisorpsi terjadi jika partikel yang melekat pada permukaan membentuk ikatan kimia (ikatan kovalen) dan cenderung mencari tempat yang memaksimumkan bilangan koordinasinya dengan adsorben. Molekul yang mengalami proses kimisorpsi dapat terpisah karena adanya tuntutan valensi atom permukaan yang tidak terpenuhi (Atkins 1999). Ciri lain kimisorpsi ialah adanya perubahan energi yang cukup signifikan yang mengakibatkan perubahan reaksi kimia secara permanen dan bersifat tidak dapat balik.
4
Jika kapasitas penjerapan masih cukup besar, maka akan ada yang terjerap dan terikat di permukaan. Namun, jika permukaan sudah dalam keadaan jenuh atau mendekati jenuh maka akan terjadi dua hal, yaitu terbentuk lapisan adsorpsi kedua dan seterusnya di atas lapisan pertama adsorbat (adsorpsi multilapisan) atau tidak terbentuk lapisan kedua dan seterusnya; adsorbat yang belum terjerap kembali berdifusi ke dalam fluida pembawa adsorbat (Wijayanti 2009).
Faktor-faktor yang memengaruhi penjerapan adalah sifat fisika dan kimia adsorben (luas permukaan, pori-pori, dan komposisi kimia), sifat fisika dan kimia adsorbat (ukuran partikel, polaritas molekul, dan komposisi kimia), jumlah adsorben, konsentrasi adsorbat dalam fluida, sifat fluida, dan suhu, serta lamanya proses penjerapan. Adsorben yang baik memiliki kapasitas penjerapan yang tinggi. Kapasitas penjerapan dapat dihitung dengan menggunakan rumus
Q
=
x V
Keterangan:
Q = kapasitas penjerapan per bobot
molekul (mg/g)
V = volume larutan (ml)
C1 = konsentrasi awal larutan (mg/L)
C2 =` konsentrasi akhir larutan (mg/L)
m = bobot adsorben (g)
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah karbon aktif komersial, FeCl3.6H2O (p.a
Merck), FeSO4.7H2O (p.a Merck), NaOH (p.a
Merck), HCl, CsNO3 (p.a Merck), Sr(NO3)2
(p.a Merck), dan air demineralisasi.
Alat-alat yang digunakan adalah peralatan kaca, shaker, hot plate dan pengaduk magnet,
pH meter, XRD Shimadzu XD-610, VSM Oxford tipe 1.2T, alat BET, SEM Philip, dan AAS Analys 400.
Metode
Penelitian ini terdiri atas tiga tahapan, yaitu pembuatan oksida besi dan komposit magnet oksida besi-karbon aktif (OB:KA), pencirian oksida besi serta komposit magnet OB:KA, dan uji adsorpsi komposit magnet OB:KA terhadap Cs+ dan Sr2+ (Lampiran 1).
Pembuatan Oksida Besi (Lee et al. 2004)
Sebanyak 600 ml larutan garam besi yang terdiri atas 7.6 g FeCl3.6H2O dan 3.9 g
FeSO4.7H2O diaduk serta dipanaskan hingga
mencapai suhu 70 oC. Setelah itu, 100 ml
larutan NaOH 5 M ditambahkan tetes demi tetes sehingga terbentuk endapan berwarna hitam. Endapan yang terbentuk dicuci dengan air demineralisasi lalu dikeringkan di dalam oven pada suhu 100 oC selama 3 jam.
Pembuatan Komposit Magnet (Oliviera et al. 2002)
Suspensi karbon aktif dibuat dengan mencampurkan 6.5 g karbon aktif dengan 300 ml air demineralisasi lalu dipanaskan hingga mencapai suhu 70 oC. Sebanyak 300 ml
larutan garam besi yang terdiri atas 7.6 g FeCl3.6H2O dan 3.9 g FeSO4.7H2O
ditambahkan ke dalam campuran tersebut. Campuran lalu diaduk selama 30 menit sebelum ditambahkan 100 ml NaOH 5 M tetes demi tetes sehingga diperoleh komposit OB:KA dengan nisbah bobot 1:2 (Lampiran 2). Komposit yang terbentuk dicuci dengan air demineralisasi lalu dikeringkan di dalam oven pada suhu 100 oC selama 3 jam. Selain itu,
dibuat juga komposit magnet dengan nisbah bobot oksida besi dan karbon aktif 1:1 dan 1:3. Kode sampel yang digunakan ditunjukkan pada Tabel 1.
Tabel 1 Kode sampel komposit magnet Kode sampel Nisbah bobot OB:KA
Sampel A Karbon aktif Sampel B Oksida Besi Sampel C OB:KA (1:1) Sampel D OB:KA (1:2) Sampel E OB:KA (1:3)
Pencirian
Sampel dicirikan menggunakan XRD untuk menentukan fase oksida besi yang terbentuk. Sifat magnet dan nilai magnetisasi ditentukan dengan menggunakan VSM, alat BET untuk menentukan luas permukaan, dan SEM untuk melihat mikrostruktur permukaan sampel.
Uji Penjerapan
Uji adsorpsi dengan parameter jumlah adsorben diawali dengan menimbang sebesar 0.0125, 0.025, 0.05, 0.075, dan 0.1 g masing-masing sampel A, C, D, dan E dan dimasukkan ke dalam Erlenmeyer yang berbeda. Lalu ditambahkan 50 ml larutan Cs+
dan Sr2+ 50 ppm (Lampiran 3) kemudian
4
Jika kapasitas penjerapan masih cukup besar, maka akan ada yang terjerap dan terikat di permukaan. Namun, jika permukaan sudah dalam keadaan jenuh atau mendekati jenuh maka akan terjadi dua hal, yaitu terbentuk lapisan adsorpsi kedua dan seterusnya di atas lapisan pertama adsorbat (adsorpsi multilapisan) atau tidak terbentuk lapisan kedua dan seterusnya; adsorbat yang belum terjerap kembali berdifusi ke dalam fluida pembawa adsorbat (Wijayanti 2009).
Faktor-faktor yang memengaruhi penjerapan adalah sifat fisika dan kimia adsorben (luas permukaan, pori-pori, dan komposisi kimia), sifat fisika dan kimia adsorbat (ukuran partikel, polaritas molekul, dan komposisi kimia), jumlah adsorben, konsentrasi adsorbat dalam fluida, sifat fluida, dan suhu, serta lamanya proses penjerapan. Adsorben yang baik memiliki kapasitas penjerapan yang tinggi. Kapasitas penjerapan dapat dihitung dengan menggunakan rumus
Q
=
x V
Keterangan:
Q = kapasitas penjerapan per bobot
molekul (mg/g)
V = volume larutan (ml)
C1 = konsentrasi awal larutan (mg/L)
C2 =` konsentrasi akhir larutan (mg/L)
m = bobot adsorben (g)
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah karbon aktif komersial, FeCl3.6H2O (p.a
Merck), FeSO4.7H2O (p.a Merck), NaOH (p.a
Merck), HCl, CsNO3 (p.a Merck), Sr(NO3)2
(p.a Merck), dan air demineralisasi.
Alat-alat yang digunakan adalah peralatan kaca, shaker, hot plate dan pengaduk magnet,
pH meter, XRD Shimadzu XD-610, VSM Oxford tipe 1.2T, alat BET, SEM Philip, dan AAS Analys 400.
Metode
Penelitian ini terdiri atas tiga tahapan, yaitu pembuatan oksida besi dan komposit magnet oksida besi-karbon aktif (OB:KA), pencirian oksida besi serta komposit magnet OB:KA, dan uji adsorpsi komposit magnet OB:KA terhadap Cs+ dan Sr2+ (Lampiran 1).
Pembuatan Oksida Besi (Lee et al. 2004)
Sebanyak 600 ml larutan garam besi yang terdiri atas 7.6 g FeCl3.6H2O dan 3.9 g
FeSO4.7H2O diaduk serta dipanaskan hingga
mencapai suhu 70 oC. Setelah itu, 100 ml
larutan NaOH 5 M ditambahkan tetes demi tetes sehingga terbentuk endapan berwarna hitam. Endapan yang terbentuk dicuci dengan air demineralisasi lalu dikeringkan di dalam oven pada suhu 100 oC selama 3 jam.
Pembuatan Komposit Magnet (Oliviera et al. 2002)
Suspensi karbon aktif dibuat dengan mencampurkan 6.5 g karbon aktif dengan 300 ml air demineralisasi lalu dipanaskan hingga mencapai suhu 70 oC. Sebanyak 300 ml
larutan garam besi yang terdiri atas 7.6 g FeCl3.6H2O dan 3.9 g FeSO4.7H2O
ditambahkan ke dalam campuran tersebut. Campuran lalu diaduk selama 30 menit sebelum ditambahkan 100 ml NaOH 5 M tetes demi tetes sehingga diperoleh komposit OB:KA dengan nisbah bobot 1:2 (Lampiran 2). Komposit yang terbentuk dicuci dengan air demineralisasi lalu dikeringkan di dalam oven pada suhu 100 oC selama 3 jam. Selain itu,
dibuat juga komposit magnet dengan nisbah bobot oksida besi dan karbon aktif 1:1 dan 1:3. Kode sampel yang digunakan ditunjukkan pada Tabel 1.
Tabel 1 Kode sampel komposit magnet Kode sampel Nisbah bobot OB:KA
Sampel A Karbon aktif Sampel B Oksida Besi Sampel C OB:KA (1:1) Sampel D OB:KA (1:2) Sampel E OB:KA (1:3)
Pencirian
Sampel dicirikan menggunakan XRD untuk menentukan fase oksida besi yang terbentuk. Sifat magnet dan nilai magnetisasi ditentukan dengan menggunakan VSM, alat BET untuk menentukan luas permukaan, dan SEM untuk melihat mikrostruktur permukaan sampel.
Uji Penjerapan
Uji adsorpsi dengan parameter jumlah adsorben diawali dengan menimbang sebesar 0.0125, 0.025, 0.05, 0.075, dan 0.1 g masing-masing sampel A, C, D, dan E dan dimasukkan ke dalam Erlenmeyer yang berbeda. Lalu ditambahkan 50 ml larutan Cs+
dan Sr2+ 50 ppm (Lampiran 3) kemudian
5
selama 24 jam. Setelah itu, filtrat dipisahkan dari sampel C, D, dan E dengan cara mendekatkan batang magnet permanen pada permukaan Erlenmeyer. Konsentrasi filtrat ditentukan menggunakan Spektroskopi Serapan Atom (AAS).
Ragam pH larutan dilakukan dengan cara menimbang sampel A, C, D, dan E masing-masing sebesar 0.05 g lalu dimasukkan ke dalam Erlenmeyer. Sebanyak 50 ml larutan Cs+ dan Sr2+ 50 ppm ditambahkan lalu diatur
pH 2-10. Setelah itu, penjerapan dilakukan dengan waktu kontak selama 24 jam lalu filtrat dipisahkan dari sampel C, D, dan E dengan cara mendekatkan batang magnet permanen pada permukaan Erlenmeyer. Konsentrasi filtrat ditentukan menggunakan Spektroskopi Serapan Atom (AAS).
Ragam konsentrasi awal Cs+ dan Sr2+
dilakukan dengan menimbang masing-masing 0.05 g sampel A, C, D, dan E. Sebanyak 50 ml larutan Cs+ dan Sr2+ dengan variasi konsentrasi 10, 25, 50, 100, dan 200 ppm dimasukkan ke dalam Erlenmeyer dan penjerapan dilakukan dengan waktu kontak selama 24 jam. Setelah itu, filtrat dipisahkan dari sampel C, D, dan E dengan cara mendekatkan batang magnet permanen pada permukaan Erlenmeyer. Konsentrasi filtrat ditentukan menggunakan Spektroskopi Serapan Atom (AAS).
HASIL DAN PEMBAHASAN
Pembuatan Oksida Besi dan Komposit Magnet
Oksida besi dibuat menggunakan metode kopresipitasi pada suhu 70 oC, yaitu melalui
pencampuran Fe3+ dan Fe2+ dengan
penambahan larutan basa (NaOH) sehingga terbentuk Fe(OH)2 dan Fe(OH)3. Pemanasan
pada suhu 70 oC menyebabkan proses pelepasan air atau hidrasi pada hidroksida besi sehingga terbentuk oksida besinya. Jumlah Fe3+ dan Fe2+ yang dicampurkan didasarkan
pada nisbah mol 2:1. Nisbah mol Fe3+ dan
Fe2+ (2:1) merupakan stoikiometri yang
dibutuhkan untuk membentuk oksida besi dari fase magnetit atau Fe3O4.
Pembuatan komposit oksida besi pada karbon aktif diawali dengan penjerapan ion-ion Fe2+dan Fe3+ oleh karbon aktif. Ion-ion
tersebut membentuk endapan hidroksida besi atau Fe(OH)2 dan Fe(OH)3 lalu membentuk
oksida besi karena proses hidrasi pada pemanasan di suhu 70 oC sehingga terbentuk
oksida besi yang terkomposit pada struktur karbon aktif.
Fe2++ 2Fe3++ 8OH- Fe(OH)
2 + 2Fe(OH)3
FeO.Fe2O3 atau Fe3O4 + 4H2O
Pencirian
Pencirian dengan XRD bertujuan menentukan fase oksida besi yang terbentuk pada sampel. Gambar 2 memperlihatkan pola difraksi sampel A, B, C, D, dan E. Pola XRD tersebut dapat dijelaskan dengan melihat puncak-puncak khas yang dihasilkan dari setiap sampel. Kemudian, puncak-puncak tersebut dibandingkan dengan puncak khas basis data program PCDFWIN versi 1.30 International Centre for Diffraction Data tahun 1997.
0
200
400
600
800
1000
1200
1400
1600
0
20
40
60
80
100
β θ
In te n s it a sGambar 2 Pola XRD pada sampel A, B, C,
`D, dan E.
Sampel A (karbon aktif) memiliki kesamaan puncak dengan basis data nomor arsip 02-0456 (Tabel 2). Nomor arsip tersebut merupakan puncak khas untuk pola
A
B
C
D
5
selama 24 jam. Setelah itu, filtrat dipisahkan dari sampel C, D, dan E dengan cara mendekatkan batang magnet permanen pada permukaan Erlenmeyer. Konsentrasi filtrat ditentukan menggunakan Spektroskopi Serapan Atom (AAS).
Ragam pH larutan dilakukan dengan cara menimbang sampel A, C, D, dan E masing-masing sebesar 0.05 g lalu dimasukkan ke dalam Erlenmeyer. Sebanyak 50 ml larutan Cs+ dan Sr2+ 50 ppm ditambahkan lalu diatur
pH 2-10. Setelah itu, penjerapan dilakukan dengan waktu kontak selama 24 jam lalu filtrat dipisahkan dari sampel C, D, dan E dengan cara mendekatkan batang magnet permanen pada permukaan Erlenmeyer. Konsentrasi filtrat ditentukan menggunakan Spektroskopi Serapan Atom (AAS).
Ragam konsentrasi awal Cs+ dan Sr2+
dilakukan dengan menimbang masing-masing 0.05 g sampel A, C, D, dan E. Sebanyak 50 ml larutan Cs+ dan Sr2+ dengan variasi konsentrasi 10, 25, 50, 100, dan 200 ppm dimasukkan ke dalam Erlenmeyer dan penjerapan dilakukan dengan waktu kontak selama 24 jam. Setelah itu, filtrat dipisahkan dari sampel C, D, dan E dengan cara mendekatkan batang magnet permanen pada permukaan Erlenmeyer. Konsentrasi filtrat ditentukan menggunakan Spektroskopi Serapan Atom (AAS).
HASIL DAN PEMBAHASAN
Pembuatan Oksida Besi dan Komposit Magnet
Oksida besi dibuat menggunakan metode kopresipitasi pada suhu 70 oC, yaitu melalui
pencampuran Fe3+ dan Fe2+ dengan
penambahan larutan basa (NaOH) sehingga terbentuk Fe(OH)2 dan Fe(OH)3. Pemanasan
pada suhu 70 oC menyebabkan proses pelepasan air atau hidrasi pada hidroksida besi sehingga terbentuk oksida besinya. Jumlah Fe3+ dan Fe2+ yang dicampurkan didasarkan
pada nisbah mol 2:1. Nisbah mol Fe3+ dan
Fe2+ (2:1) merupakan stoikiometri yang
dibutuhkan untuk membentuk oksida besi dari fase magnetit atau Fe3O4.
Pembuatan komposit oksida besi pada karbon aktif diawali dengan penjerapan ion-ion Fe2+dan Fe3+ oleh karbon aktif. Ion-ion
tersebut membentuk endapan hidroksida besi atau Fe(OH)2 dan Fe(OH)3 lalu membentuk
oksida besi karena proses hidrasi pada pemanasan di suhu 70 oC sehingga terbentuk
oksida besi yang terkomposit pada struktur karbon aktif.
Fe2++ 2Fe3++ 8OH- Fe(OH)
2 + 2Fe(OH)3
FeO.Fe2O3 atau Fe3O4 + 4H2O
Pencirian
Pencirian dengan XRD bertujuan menentukan fase oksida besi yang terbentuk pada sampel. Gambar 2 memperlihatkan pola difraksi sampel A, B, C, D, dan E. Pola XRD tersebut dapat dijelaskan dengan melihat puncak-puncak khas yang dihasilkan dari setiap sampel. Kemudian, puncak-puncak tersebut dibandingkan dengan puncak khas basis data program PCDFWIN versi 1.30 International Centre for Diffraction Data tahun 1997.
0
200
400
600
800
1000
1200
1400
1600
0
20
40
60
80
100
β θ
In te n s it a sGambar 2 Pola XRD pada sampel A, B, C,
`D, dan E.
Sampel A (karbon aktif) memiliki kesamaan puncak dengan basis data nomor arsip 02-0456 (Tabel 2). Nomor arsip tersebut merupakan puncak khas untuk pola
A
B
C
D
6
difraksi karbon (grafit) pada program PCDFWIN versi 1.30 (Lampiran 4).
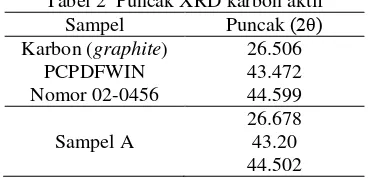
Tabel 2 Puncak XRD karbon aktif Sampel Puncak (βθ)
Karbon (graphite) 26.506
PCPDFWIN Nomor 02-0456
43.472 44.599 26.678 Sampel A 43.20
44.502
Oksida besi hasil sintesis pada penelitian ini (sampel B) memiliki kesamaan puncak dengan basis data nomor arsip 11-0614 (Lampiran 5) yang merupakan oksida besi dari fase magnetit atau Fe3O4 (Tabel 3).
Tabel 3 Puncak XRD oksida besi Sampel Puncak (βθ)
18.277 30.105 Magnetit (Fe3O4) 35.451
PCPDFWIN 43.123 Nomor 11-0614 53.478 57.012 62.585 74.603 18.468 30.278
Sampel B 35.541 43.24 53.62 57.26 62.839 74.480
Kesamaan puncak ini menunjukkan bahwa sampel B merupakan magnetit. Selain itu, berdasarkan Oliviera et al. (2002), jarak
bidang pendifraksi atau d = 2.50, 2.91, dan
1.60 Å menunjukkan keberadaan magnetit. Hal ini sesuai dengan jarak bidang pendifraksi yang didapat pada sampel B yaitu d = 2.52,
2.94, dan 1.60 Å.
Gambar 2 juga menunjukkan kesamaan pola XRD sampel C, D, dan E dengan pola XRD sampel B. Hal ini menunjukkan terdapat magnetit pada sampel C, D, dan E. Kesamaan pola difraksi ketiga sampel tersebut dengan sampel B dapat diperjelas dengan melihat puncak-puncak khas yang dihasilkan dari setiap sampel (Lampiran 6). Keberadaan magnetit pada sampel C, D, dan E dibuktikan pula dengan melihat kesamaan puncak sampel-sampel tersebut dengan basis data nomor arsip 11-0614. Dengan demikian, dapat
dikatakan di dalam struktur karbon aktif telah terkomposit partikel magnetit.
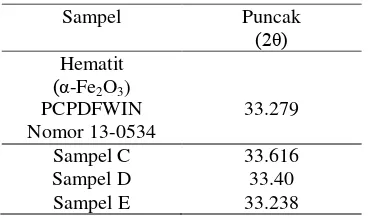
Namun, terjadi pelemahan pola difraksi sampel C, D, dan E seiring dengan berkurangnya fraksi oksida besi pada sampel (Gambar 2). Hal ini dikarenakan oksida besi yang terbentuk ditutupi keberadaannya oleh karbon aktif yang jumlahnya semakin meningkat. Selain itu, melemahnya pola XRD sampel C, D, dan E juga dapat disebabkan oleh terbentuknya fase oksida besi selain magnetit, yaitu hematit. Sampel C, D, dan E memiliki kesamaan puncak dengan basis data nomor arsip 13-0534 (Lampiran 7) yang menunjukkan fase oksida besi hematit atau α -Fe2O3 (Tabel 4). Menurut Oliveira et al.
(2002), jarak bidang pendifraksi d = 2.70 Å
menunjukkan keberadaan hematit. Hal ini sesuai dengan bidang pendifraksi yang dimiliki oleh sampel C, D, dan E masing-masing d = 2.66, 2.68, dan 2.69 Å.
Tabel 4 Puncak XRD pada sampel C, D, E, dan hematit
Sampel Puncak
(βθ)
Hematit
(α-Fe2O3)
PCPDFWIN
Nomor 13-0534 33.279 Sampel C 33.616 Sampel D 33.40 Sampel E 33.238
Melemahnya pola difraksi sampel C, D, dan E juga dibuktikan dengan hasil pencirian menggunakan VSM. VSM digunakan untuk mengukur nilai magnetisasi dan sifat magnet sampel. Sampel yang akan diukur diberikan medan magnet sebesar 1 Tesla dengan kecepatan tertentu. Jika sampel bersifat magnet, maka sampel akan mengalami magnetisasi sehingga menghasilkan momen magnet. Momen magnet yang dihasilkan akan menentukan sifat magnet dan nilai magnetisasi sampel.
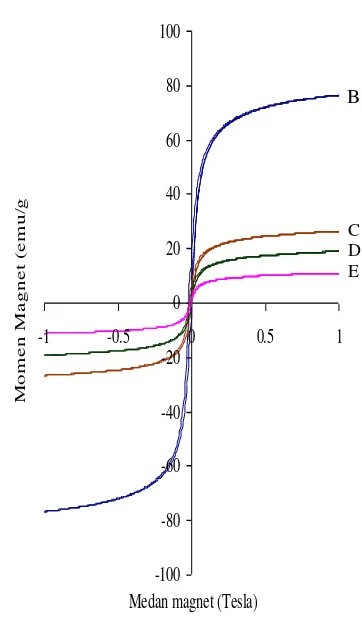
Hasil pencirian sampel B, C, D, dan E menggunakan VSM dapat dilihat pada Gambar 3. Nilai magnetisasi paling besar dimiliki oleh sampel B yaitu 76.59 emu/g. Nilai magnetisasi yang besar pada sampel B sesuai dengan hasil pencirian dengan XRD sampel tersebut tersusun atas magnetit, fase oksida besi yang memiliki sifat magnet tertinggi (Sulungbudi et al. 2006). Magnetit
7
-100 -80 -60 -40 -20 0 20 40 60 80 100-1 -0.5 0 0.5 1
Medan magnet (Tesla)
M o m e n M a g n e t (e m u /g )
Gambar 3 Hasil pencirian sampel B, C, D,
```````````````dan E menggunakan VSM.
Sampel C, D, dan E berturut-turut memiliki nilai magnetisasi sebesar 26.5, 18.9, dan 11 emu/g. Nilai ini lebih kecil dari perhitungan yang didasarkan pada nilai magnetisasi sampel B per jumlah oksida besi pada setiap komposisi sampel C, D, dan E atau nilai yang seharusnya (Tabel 5). Hal ini disebabkan oleh terbentuknya fase oksida besi yang lain, yaitu hematit. Hematit merupakan fase oksida besi yang tidak memiliki sifat magnet sehingga jumlah Fe2+ atau Fe3+ yang
merupakan prekusor pembentukan magnetit berkurang. Menurut Kahani et al. (2007), nilai
magnetisasi sangat dipengaruhi oleh jumlah magnetit di dalam suatu sampel sehingga berkurangnya magnetit yang terbentuk akan berpengaruh pula pada nilai magnetisasinya.
Tabel 5 Nilai magnetisasi sampel A, C, D,
`````````````dan E
Sampel Hasil VSM (emu/g)
Hasil seharusnya
(emu/g)
A 76.59 -
C 26.5 38.30 D 18.9 25.53
E 11 19.15
Selain itu, lebih kecilnya nilai magnetisasi hasil VSM dari nilai yang seharusnya juga dikarenakan oleh adanya ion Fe2+ dan Fe3+ di
dalam struktur karbon aktif yang masih berbentuk ion. Hal ini disebabkan oleh terhalangnya ion Fe2+ dan Fe3+ oleh oksida besi yang lebih dahulu terbentuk di dalam struktur pori berlapis karbon aktif.
Pencirian menggunakan SEM bertujuan mengetahui perbedaan mikrostruktur permukaan oksida besi (sampel B), karbon aktif (sampel A), dan karbon aktif yang telah terkomposit oksida besi (sampel D). Keadaan struktur permukaan ketiga sampel tersebut dapat dilihat pada Gambar 4–6. Gambar 4 menunjukkan keadaan permukaan sampel B yang memperlihatkan bahwa sampel B terdiri dari partikel-partikel kecil oksida besi.
Gambar 4 Foto SEM sampel B.
Gambar 5 Foto SEM sampel A.
Gambar 6 Foto SEM sampel D. B
8
Gambar 5 dan 6 juga menunjukkan secara jelas perbedaan struktur permukaan sampel A dengan D. Pori-pori sampel A terlihat lebih besar bila dibandingkan dengan sampel D. Selain itu, permukaan sampel D tampak lebih padat dibandingkan dengan sampel A. Hal ini dikarenakan sebagian permukaan karbon aktif pada sampel D dikelilingi dan ditutupi oleh partikel-partikel kecil oksida besi.
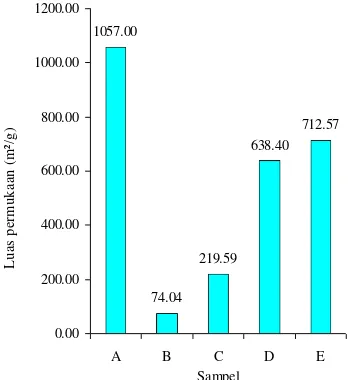
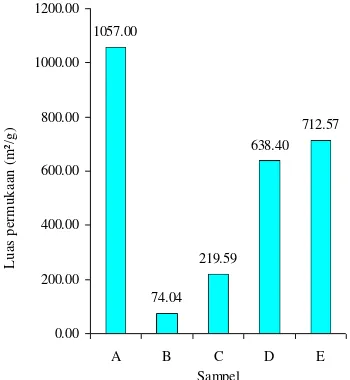
Luas permukaan sampel A, B, C, D, dan E yang diukur menggunakan alat BET dapat dilihat pada Gambar 7.
1057.00 74.04 219.59 638.40 712.57 0.00 200.00 400.00 600.00 800.00 1000.00 1200.00
A B C D E
Sampel L ua s pe rm uk aa n (m ²/ g) `````
Gambar 7 Luas permukaan sampel A, B, C,
`dan D
Luas permukaan sampel A lebih besar daripada sampel C, D, dan E. Hal ini menunjukkan bahwa pengompositan partikel oksida besi ke dalam struktur karbon aktif akan menutupi permukaan karbon aktif dan karena itu, menurunkan luas permukaan (Tabel 6). Sampel E memiliki luas permukaan yang lebih besar daripada sampel C dan D. Hal ini menunjukkan bahwa semakin sedikit jumlah oksida besi yang terkomposit, maka luas permukaan sampel akan semakin besar.
Tabel 6 Penurunan luas permukaan sampel A,
```````````C, D, dan E
Sampel
Luas permukaan
(m2/g)
Penurunan luas permukaan
(%)
A 1057.00 -
C 219.59 79.23 D 638.40 39.60 E 712.57 32.59
Hasil pencirian dengan menggunakan XRD, VSM, dan SEM menunjukkan bahwa proses pengompositan partikel oksida besi (magnetit) pada karbon aktif menghasilkan suatu material baru yang dapat berperan sebagai penjerap dan juga bersifat magnet, yaitu komposit oksida besi-karbon aktif atau OB-KA. Sifat magnet yang dimiliki sampel ini akan memudahkan proses pemisahan karbon aktif dari medium berair. Hal ini dikarenakan komposit OB:KA dapat dikendalikan pergerakannya melalui tarikan oleh batang magnet permanen (Fisli et al.
2007) (Gambar 8).
Gambar 8 Sampel A, B, C, D, dan E yang
`didekatkan dengan magnet
`permanen.
Uji Penjerapan
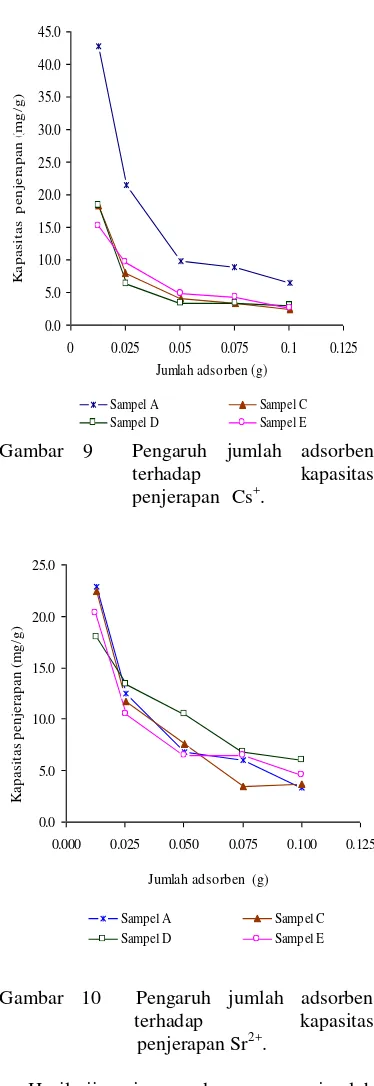
Ragam Jumlah Adsorben
Gambar 9 menunjukkan pengaruh jumlah adsorben terhadap penjerapan Cs+. Kapasitas penjerapan terbesar terjadi pada jumlah sampel A, C, D, dan E sebesar 0.0125 g, yaitu berturut-turut 42.19, 18.35, 18.31, dan 15.23 mg/g (Lampiran 8). Pengaruh jumlah adsorben terhadap kapasitas penjerapan Sr2+
9
0.0 5.0 10.0 15.0 20.0 25.0 30.0 35.0 40.0 45.00 0.025 0.05 0.075 0.1 0.125 Jumlah adsorben (g)
K ap as it as p en je ra p an ( m g /g ) ``
Sampel A Sampel C Sampel D Sampel E
Gambar 9 Pengaruh jumlah adsorben
````````````````````terhadap kapasitas
````````````````````penjerapan `Cs+.
0.0 5.0 10.0 15.0 20.0 25.0
0.000 0.025 0.050 0.075 0.100 0.125
Jumlah adsorben (g)
K ap as it as p en je ra p an ( m g /g )
Sampel A Sampel C Sampel D Sampel E
Gambar 10 Pengaruh jumlah adsorben
````````````````terhadap kapasitas
``````````````````` `penjerapan Sr2+.
Hasil uji penjerapan dengan ragam jumlah adsorben terhadap Cs+ dan Sr2+
menggambarkan bahwa kapasitas penjerapan menurun ketika jumlah adsorben ditingkatkan. Pada jumlah adsorben tertentu, adsorbat dan adsorben mengalami keadaan jenuh: tidak ada lagi adsorbat yang dapat terjerap pada adsorben. Dalam kondisi ini, peningkatan jumlah adsorben tidak akan berdampak pada peningkatan jumlah adsorbat yang terjerap (peningkatan kapasitas penjerapan). Sebaliknya, kapasitas penjerapan akan
menurun karena jumlah adsorben yang semakin banyak.
Ragam Kondisi pH Larutan
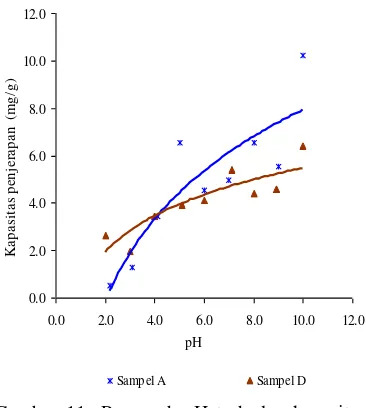
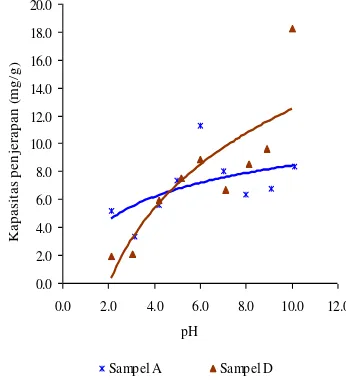
Komposit magnet oksida besi-karbon aktif yang digunakan pada uji penjerapan ragam pH larutan adalah OB:KA 1:2 (sampel D) dengan karbon aktif (sampel A) sebagai pembanding. Penggunaan sampel D dikarenakan sampel ini memiliki luas permukaan dan nilai magnetisasi yang besar bila dibandingkan dengan dua sampel lainnya. Pengaruh pH terhadap kapasitas penjerapan sampel A dan D dengan Cs+ sebagai adsorbat
dapat dilihat pada Gambar 11. Kapasitas penjerapan sampel A dan D terhadap Cs+
semakin meningkat seiring peningkatan pH (Lampiran 10). Kapasitas penjerapan paling besar terjadi pada saat pH=5 dengan kapasitas penjerapan sebesar 6.55 mg/g. Namun, kapasitas penjerapan sampel A menurun pada pH=6. Penjerapan kembali meningkat pada pH 7-10, karena pada pH tersebut terbentuk endapan CsOH sehingga kapasitas penjerapan meningkat.
Sementara itu, kapasitas penjerapan sampel D paling besar saat pH=7, yaitu sebesar 5.40 mg/g. Terjadi penurunan kapasitas penjerapan saat pH=8, namun meningkat kembali pada pH 9-10. Hal ini dikarenakan pada pH 9-10 terbentuk endapan CsOH sehingga kapasitas penjerapan meningkat. 0.0 2.0 4.0 6.0 8.0 10.0 12.0
0.0 2.0 4.0 6.0 8.0 10.0 12.0 pH K ap as it as p en je ra p an ( m g /g )
Sampel A Sampel D
Gambar 11 Pengaruh pH terhadap kapasitas `penjerapan Cs+.
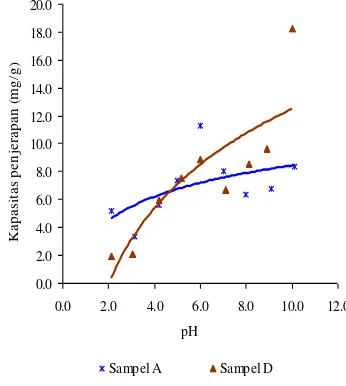
10
dan D juga mengalami peningkatan seiring dengan meningkatnya pH (Lampiran 11). Sampel A dan D memiliki kapasitas penjerapan paling besar pada pH=6, yaitu berturut-turut sebesar 11.28 dan 8.90 mg/g. Namun, kapasitas penjerapan sampel A menurun pada pH 7-8 dan meningkat kembali pada pH 9-10. Sedangkan, sampel D mengalami penurunan kapasitas penjerapan pada pH=7 dan meningkat kembali pada pH 8-10. Peningkatan kapasitas penjerapan sampel A dan D pada pH basa dikarenakan telah terbentuknya endapan Sr(OH)2.
0.0 2.0 4.0 6.0 8.0 10.0 12.0 14.0 16.0 18.0 20.0
0.0 2.0 4.0 6.0 8.0 10.0 12.0 pH K ap as it as p en je ra p an ( m g /g )
Sampel A Sampel D
Gambar 12 Pengaruh pH terhadap kapasitas
```````` penjerapan Sr2+.
Kapasitas penjerapan sampel A dan D terhadap Cs+ dan Sr2+ meningkat seiring
dengan peningkatan pH. Hal ini dikarenakan pada pH asam terjadi kompetisi antara H+
dengan Cs+ dan Sr2+ untuk terjerap pada
sampel (Qaiser et al. 2007) sehingga jumlah
Cs+ dan Sr2+ yang terjerap sedikit. Seiring
dengan peningkatan pH, jumlah H+ akan
semakin sedikit sehingga kapasitas penjerapan akan meningkat.
Ragam Konsentrasi Awal Cs+ dan Sr2+
Pengaruh ragam konsentrasi awal Cs+ dan
Sr2+ terhadap besarnya kapasitas penjerapan
dapat dilihat pada Gambar 13 dan 14. Gambar tersebut memperlihatkan peningkatan kapasitas penjerapan seiring dengan meningkatnya konsentrasi awal Cs+ dan Sr2+.
Kapasitas penjerapan sampel A, C, D, dan E terbesar terjadi pada konsentrasi awal Cs+ dan
Sr2+ sebesar 200 ppm, yaitu berturut-turut 23.95, 9.34, 12.06, dan 7.84 mg/g (untuk Cs+)
serta 22.51, 23.94, 23.34, dan 16.26 mg/g
(untuk Sr2+) (Lampiran 12 dan 13). Hal ini
sesuai dengan pernyataan Qaiser et al. 2007
bahwa kapasitas penjerapan akan meningkat seiring dengan peningkatan konsentrasi awal ion logam. Kondisi ini terjadi karena semakin besar konsentrasi awal Cs+ dan Sr2+ yang diberikan, akan semakin banyak pula Cs+ dan
Sr2+ yang terjerap pada sampel. Hal ini terjadi
bila keberadaan tapak aktif sampel masih memungkinkan untuk menjerap Cs+ dan Sr2+
yang konsentrasi atau jumlahnya semakin meningkat. 0.0 5.0 10.0 15.0 20.0 25.0 30.0
0 50 100 150 200 250
Konsentrasi awal (ppm)
K ap as it as p en je ra p an ( m g /g )
Sampel A Sampel C Sampel D Sampel E
Gambar 13 Pengaruh konsentrasi awal Cs+
`````````````````terhadap kapasitas penjerapan
`````````````````Cs+.
0.0 5.0 10.0 15.0 20.0 25.0 30.0
0 50 100 150 200 250
Konsentrasi awal (ppm)
K ap as it as p en je ra p an ( m g /g )
Sampel A Sampel C Sampel D Sampel E
Gambar 14 Pengaruh konsentrasi awal Sr2+
````````````terhadap kapasitas penjerapan
11
SIMPULAN DAN SARAN
Simpulan
Oksida besi dan komposit magnet oksida besi-karbon aktif dibuat dengan metode kopresipitasi pada suhu 70 oC. Nisbah oksida
besi-karbon aktif yang dibuat, yaitu 1:1, 1:2, dan 1:3. Pencirian terhadap oksida besi dan komposit magnet oksida besi-karbon aktif dilakukan untuk menentukan fase oksida besi yang terbentuk dan mengetahui pengaruh pengompositan oksida besi ke dalam karbon aktif. Oksida besi dan komposit magnet oksida besi-karbon aktif memiliki kesamaan puncak pola XRD dengan puncak no arsip 11-0614 yang merupakan magnetit (Fe3O4).
Pengukuran mengggunakan VSM menunjukkan bahwa oksida besi dan komposit magnet oksida besi-karbon aktif bersifat magnet. Namun, nilai magnetisasi pada komposit magnet oksida besi-karbon aktif menurun seiring dengan berkurangnya jumlah oksida besi yang terkomposit pada karbon aktif. Hasil foto SEM memperlihatkan pori permukaan karbon aktif ditutupi dan dikelilingi oleh partikel kecil oksida besi. Terkompositnya oksida besi pada karbon aktif berpengaruh terhadap menurunnya luas permukaan pada sampel. Uji penjerapan memperlihatkan kapasitas penjerapan Cs dan Sr terbesar terjadi pada jumlah adsorben 0.0125 g dan konsentrasi awal 200 ppm. Keadaan pH optimum penjerapan Cs terjadi pada pH 7, sedangkan penjerapan Sr lebih rendah, yaitu pada pH 6.
Saran
Perlu dilakukan uji adsorpsi dengan parameter ragam waktu kontak. Selain itu, perlu pula dilakukan penentuan kondisi optimum penjerapan menggunakan metode rancangan acak lengkap faktorial dan penentuan isoterm adsorpsi.
DAFTAR PUSTAKA
Alarifi A dan Hanafi HA. 2010. Adsorption of cesium, thalium, strontium, and cobalt radionuclides using activated carbon. J At Mol Sci 10:1-9.
Arifin. 2008. Potensi karbon aktif sebagai media adsorpsi logam berat timbal (Pb) dan kadmium (Cd) [skripsi]. Tangerang:
Fakultas Teknik Kimia, Universitas Islam Syekh Yusuf.
Atkins PW. 1999. Kimia Fisika Edisi ke-4.
Kartohadiprodjo II, penerjemah; Jakarta: Erlangga. Terjemahan dari: Physical Chemistry 4th Edition.
Butterman WC, Brooks WE, Reese RG. 2005. Mineral commodity profiles: Cesium. [terhubung berkala] http://pubs.usgs.gov/of/2004/1432/2004-1432.pdf. [21 Okt 2010].
Castro CS, Guerreiro MC, Goncalves M, Oliveira LCA, Anastacia AS. 2009. Activated carbon/iron oxide composites for the removal of atrazine from aqueous medium. J Hazardous Mat 164:609–614.
Chegrouche S, Mellah A, dan Barkat M. 2009. Removal of strontium from aqueous solutions by adsorption onto activated carbon: kinetic and
thermodynamic studies. J Desalination 235:306–318.
Fisli A, Hamsah D, Wardiyati S, Ridwan. 2007. Pengaruh suhu pembuatan nanokomposit oksida besi bentonit. J Sains MatIndones 2:145-149.
Gerberding JL. 2004. Toxcicological profile for strontium. Atlanta: Agency for Toxic Substances and Disease Registry.
Gong J, Wang B, Zeng G, Yang C, Niu C, Niu Q, Zhou W, dan Liang Y. 2009. Removal of cationic dyes from aqueous solution using magnetic multi-wall carbon nanotube nanocomposite as adsorbent. J Hazardous Mat
164:1517-1522.
Geo. 2007. Classes of Magnetic Materials.
[terhubung berkala]http//www.geo.umn.e du.html. [27 Jul 2010].
Hadi AP. 2009. Kajian transformasi antar fasa pada komposit Fe3O4/Fe2O3 [Skripsi].
Surabaya: Jurusan Fisika Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Teknologi Sepuluh November.
PEMBUATAN KOMPOSIT MAGNET OKSIDA
BESI-KARBON AKTIF SEBAGAI ADSORBEN Cs DAN Sr
ANIS ARIYANI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
11
SIMPULAN DAN SARAN
Simpulan
Oksida besi dan komposit magnet oksida besi-karbon aktif dibuat dengan metode kopresipitasi pada suhu 70 oC. Nisbah oksida
besi-karbon aktif yang dibuat, yaitu 1:1, 1:2, dan 1:3. Pencirian terhadap oksida besi dan komposit magnet oksida besi-karbon aktif dilakukan untuk menentukan fase oksida besi yang terbentuk dan mengetahui pengaruh pengompositan oksida besi ke dalam karbon aktif. Oksida besi dan komposit magnet oksida besi-karbon aktif memiliki kesamaan puncak pola XRD dengan puncak no arsip 11-0614 yang merupakan magnetit (Fe3O4).
Pengukuran mengggunakan VSM menunjukkan bahwa oksida besi dan komposit magnet oksida besi-karbon aktif bersifat magnet. Namun, nilai magnetisasi pada komposit magnet oksida besi-karbon aktif menurun seiring dengan berkurangnya jumlah oksida besi yang terkomposit pada karbon aktif. Hasil foto SEM memperlihatkan pori permukaan karbon aktif ditutupi dan dikelilingi oleh partikel kecil oksida besi. Terkompositnya oksida besi pada karbon aktif berpengaruh terhadap menurunnya luas permukaan pada sampel. Uji penjerapan memperlihatkan kapasitas penjerapan Cs dan Sr terbesar terjadi pada jumlah adsorben 0.0125 g dan konsentrasi awal 200 ppm. Keadaan pH optimum penjerapan Cs terjadi pada pH 7, sedangkan penjerapan Sr lebih rendah, yaitu pada pH 6.
Saran
Perlu dilakukan uji adsorpsi dengan parameter ragam waktu kontak. Selain itu, perlu pula dilakukan penentuan kondisi optimum penjerapan menggunakan metode rancangan acak lengkap faktorial dan penentuan isoterm adsorpsi.
DAFTAR PUSTAKA
Alarifi A dan Hanafi HA. 2010. Adsorption of cesium, thalium, strontium, and cobalt radionuclides using activated carbon. J At Mol Sci 10:1-9.
Arifin. 2008. Potensi karbon aktif sebagai media adsorpsi logam berat timbal (Pb) dan kadmium (Cd) [skripsi]. Tangerang:
Fakultas Teknik Kimia, Universitas Islam Syekh Yusuf.
Atkins PW. 1999. Kimia Fisika Edisi ke-4.
Kartohadiprodjo II, penerjemah; Jakarta: Erlangga. Terjemahan dari: Physical Chemistry 4th Edition.
Butterman WC, Brooks WE, Reese RG. 2005. Mineral commodity profiles: Cesium. [terhubung berkala] http://pubs.usgs.gov/of/2004/1432/2004-1432.pdf. [21 Okt 2010].
Castro CS, Guerreiro MC, Goncalves M, Oliveira LCA, Anastacia AS. 2009. Activated carbon/iron oxide composites for the removal of atrazine from aqueous medium. J Hazardous Mat 164:609–614.
Chegrouche S, Mellah A, dan Barkat M. 2009. Removal of strontium from aqueous solutions by adsorption onto activated carbon: kinetic and
thermodynamic studies. J Desalination 235:306–318.
Fisli A, Hamsah D, Wardiyati S, Ridwan. 2007. Pengaruh suhu pembuatan nanokomposit oksida besi bentonit. J Sains MatIndones 2:145-149.
Gerberding JL. 2004. Toxcicological profile for strontium. Atlanta: Agency for Toxic Substances and Disease Registry.
Gong J, Wang B, Zeng G, Yang C, Niu C, Niu Q, Zhou W, dan Liang Y. 2009. Removal of cationic dyes from aqueous solution using magnetic multi-wall carbon nanotube nanocomposite as adsorbent. J Hazardous Mat
164:1517-1522.
Geo. 2007. Classes of Magnetic Materials.
[terhubung berkala]http//www.geo.umn.e du.html. [27 Jul 2010].
Hadi AP. 2009. Kajian transformasi antar fasa pada komposit Fe3O4/Fe2O3 [Skripsi].
Surabaya: Jurusan Fisika Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Teknologi Sepuluh November.
12
Carbons. Nanotechnology and Its Applications 7:183-188.
Khan SA, Rehman R, Khan MA. 1996. Sorption of strontium on bentonite. Waste Management 15:641-650.
Lee S, Jeong J, Shin S, Kim JC, dan Kim JD. 2004. Synthesis and characterization of superparamagnetic maghemite nanoparticles prepared by coprecipitation technique. J Magnetism Magnet Mat
282:147-150.
Notodarmojo S. 2005. Pencemaran Tanah dan Air Tanah. Bandung: ITB Pr.
Oliveira LCA, Rios RVRA, Fabris JD, Garg V, Sapag K, Lago RM. 2002. Activated carbon/iron oxide magnetic composites for the absorption of contaminants in water. Carbon 40:2177-2183.
Qaiser S, Saleemi AR, Ahmad MM. 2007. Heavy Metal Uptake by Agro Based Waste Materials. J Biotechnol
10:409-416.
Sembiring MT, Sinaga TS. 2003. Arang aktif (Pengenalan dan proses pembuatannya). USU Media Library. [terhubungberkala] http://www.google.co.id/library.usu.ac.idi ndustri-melita.pdf [7 Agu 2009].
Sulungbudi G.Tj, Mujamilah, Ridwan. 2006. Variasi komposisi Fe(II)/Fe(III) pada proses sintesis Spion dengan metode
presipitasi. J Sains Mat Indones 8:31-34.
Suryantoro. 2006. Persyaratan Pengangkutan Limbah Radioaktif. Tangerang: Pusat
Teknologi Limbah Radioaktif BATAN.
Teja AS, Koh P. 2009. Synthesis, properties, and applications of magnetic iron oxide nanoparticles. Prog Crystal Growth and Characterization of Mat 55:22-45.
Tjahaja PI dan Sukmabuana P. 2008. Penjerapan 134Cs dari tanah oleh tanaman
bunga matahari (Helianthus anuus Less). J Sains Teknol Nuklir Indones 9:25-36.
Wijayanti R. 2009. Arang aktif dari ampas tebu sebagai adsorben pada pemurnian minyak goreng bekas [Skripsi]. Bogor: Fakultas Matemetika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Wonorahardjo S. 2006. Dinamika di permukaan adsorben dan beberapa konsep untuk memahami adsorptivitas partikel kecil. [terhubung berkala]
http://www.google.co.id/web.pdf. [7 Agu 2009].
.
PEMBUATAN KOMPOSIT MAGNET OKSIDA
BESI-KARBON AKTIF SEBAGAI ADSORBEN Cs DAN Sr
ANIS ARIYANI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
ANIS ARIYANI. Pembuatan Komposit Magnet Oksida Besi-Karbon Aktif sebagai
Adsorben Cs dan Sr. Dibimbing oleh BETTY MARITA SOEBRATA dan ADEL FISLI.
Oksida besi dan komposit magnet oksida besi-karbon aktif telah dibuat
menggunakan metode kopresipitasi pada suhu 70
oC. Nisbah oksida besi-karbon aktif
yang digunakan 1:1, 1:2, dan 1:3. Komposit magnet dibuat untuk mendapatkan bahan
penjerap yang dapat merespons medan magnet sehingga dapat dipisahkan dari medium
berair melalui teknik pemisahan magnet sederhana. Hasil karakterisasi menggunakan
difraksi sinar-X menunjukkan kesamaan puncak difraksi oksida besi dan komposit
magnet dengan puncak khas basis data program PCDFWIN nomor arsip 11-0614 yang
merupakan oksida besi dari fase magnetit (Fe
3O
4). Nilai magnetisasi hasil pengukuran
magnetometri getar cuplikan pada sampel oksida besi dan komposit magnet yang dibuat
berturut-turut sebesar 76.59, 25.6, 18.9, serta 11 emu/g. Penurunan nilai magnetisasi
disebabkan oleh jumlah fraksi oksida besi yang semakin berkurang. Pencirian
menggunakan mikroskop elektron payaran memperlihatkan bentuk partikel kecil dari
oksida besi. Mikrostruktur karbon aktif berupa pori-pori besar, sedangkan pada komposit
magnet terlihat partikel kecil oksida besi yang menutupi dan mengelilingi pori-pori
karbon aktif. Pengukuran luas permukaan menggunakan alat Brunauer, Emmett, dan
Teller menunjukkan penurunan luas permukaan pada karbon aktif yang telah terkomposit
oksida besi. Uji adsorpsi memperlihatkan kapasitas penjerapan Cs dan Sr terbesar terjadi
pada jumlah adsorben 0.0125 g dan konsentrasi awal 200 ppm. Keadaan pH optimum
penjerapan Cs terjadi pada pH 7, sedangkan penjerapan Sr lebih rendah, yaitu pada pH 6.
ABSTRACT
ANIS ARIYANI. Preparation of Iron Oxide-Activated Carbon Magnetic Composite as
Adsorbent for Cs and Sr. Supervised by BETTY MARITA SOEBRATA and ADEL
FISLI.
2
Judul :
`
Pembuatan Komposit Magnet Oksida Besi-Karbon Aktif sebagai
```
Adsorben Cs dan Sr
Nama : Anis Ariyani
NRP : G44060915
Menyetujui
Pembimbing I Pembimbing II
Betty Marita Soebrata, S.Si, M.Si. Drs. Adel Fisli, M.Si.
NIP 19630621 198703 2013 NIP 19651205 199201 1001
Mengetahui
Ketua Departemen Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor,
Prof. Dr. Ir. Tun Tedja Irawadi, MS.
NIP 19501227 197603 2 002
ii
PEMBUATAN KOMPOSIT MAGNET OKSIDA
BESI-KARBON AKTIF SEBAGAI ADSORBEN Cs DAN Sr
ANIS ARIYANI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
iii
PRAKATA
Segala puji senantiasa penulis panjatkan kepada Allah SWT karena atas rahmat,
hidayah, dan ridho-Nya penulis dapat menyelesaikan karya ilmiah ini. Shalawat serta
salam selalu penulis curahkan kepada Nabi Muhammad SAW, keluarga, sahabat, serta
pengikutnya hingga akhir zaman. Penulis melaksanakan penelitian sejak bulan April 2010
dengan tema penelitian Pembuatan Komposit Magnet Oksida Besi-Karbon Aktif sebagai
Adsorben Cs dan Sr.
Penulis menyampaikan ucapan terima kasih kepada Ibu Betty Marita Soebrata, S.Si,
M.Si. dan Bapak Drs. Adel Fisli, M.Si. sebagai pembimbing yang selalu memberikan
saran dan meluangkan waktu selama berkonsultasi. Terima kasih kepada seluruh staf
Departemen Kimia dan Bidang Karakterisasi Analisis Nuklir (BKAN) PTBIN-BATAN,
serta seluruh staf Lab. Fisik dan Lingkungan Departemen Kimia.
Terima kasih yang tak terhingga penulis sampaikan kepada Bapak, Ibu, Kakak, dan
Adikku atas segala bantuan, doa, moril, materil, cinta dan kasih sayangnya. Kepada
teman-teman kimia angkatan 43 atas suka dan dukanya selama tiga tahun kebersamaan
(Tifah, Muthea, inna, Nova, Nisa, Anggi, dan Wahyu), teman-teman laboratorium kimia
fisik dan lingkungan. Tidak lupa penulis ucapkan terima kasih kepada seluruh penghuni
pondok asad atas semangat dan doanya, serta MIB 43.
Semoga karya ilmiah ini dapat memberikan manfaat baik bagi penulis maupun
pembaca.
Bogor, Februari 2011
iv
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta, pada tanggal 16 Juni 1988 dari Bapak Dirto dan Ibu
Rusi. Penulis merupakan putri kedua dari empat bersaudara.
Tahun 2006 penulis lulus SMA Negeri 2 Tangerang Selatan dan pada tahun yang
sama lulus seleksi masuk IPB melalui jalur Seleksi Penerimaan Mahasiswa Baru
(SPMB). Penulis memilih Program Studi Kimia, Departemen Kimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis aktif menjadi pengurus Ikatan Mahasiswa
Kimia (Imasika) dan Himpunan Pelajar Mahasiswa Bogor (HPMB). Penulis pernah
menjadi asisten praktikum Kimia Fisik S1 mayor Kimia, asisten praktikum Kimia Fisik
S1 layanan Ilmu Teknologi Pangan (ITP), asisten Kimia Fisik S1 layanan Biokimia, dan
asisten Kimia Fisik Ekstensi S1 Kimia pada tahun 2010. Pada tahun 2009 penulis
melaksanakan Praktik Lapangan di Bidang Karakterisasi Analisis Nuklir,
PTBIN-BATAN
dengan judul laporan “Uji Adsorpsi Komposit Magnet Oksida Besi
-Karbon
v
DAFTAR ISI
Halaman
DAFTAR TABEL... ...vii
DAFTAR GAMBAR ... ...vii
DAFTAR LAMPIRAN ... ..viii
PENDAHULUAN ... ... 1
TINJAUAN PUSTAKA
Karbon Aktif ... 1
Oksida Besi ... 2
Sifat Kemagnetan Bahan ... 2
Komposit ... 2
Stronsium ... 3
Cesium ... 3
Adsorpsi ... 3
BAHAN DAN METODE
Alat dan Bahan... 4
Metode Percobaan... 4
Pembuatan oksida besi ... 4
Pembuatan komposit magnet ... 4
Karakterisasi ... 4
Uji adsorpsi ... 4
HASIL DAN PEMBAHASAN
Pembuatan Oksida Besi dan Komposit Magnet ... 5
Karakterisasi ... 5
Uji Adsorpsi ... 8
SIMPULAN DAN SARAN
Simpulan ... 11
Saran ... 11
vi
DAFTAR TABEL
Halaman
1 Kode sampel komposit magnet ...4
2 Puncak difraksi sinar-X pada karbon aktif ...6
3 Puncak difraksi sinar-X pada oksida besi ...6
4 Puncak difraksi sinar-X pada sampel C, D, E, dan hematit ...6
5 Nilai magnetisasi komposit A, C, D, dan E ...7
6 Penurunan luas permukaan sampel A, C, D, dan E ...8
DAFTAR GAMBAR
Halaman
1 Struktur magnetit ...2
2 Pola difraksi sinar-X pada sampel A, B, C, D, dan E.…...5
3 Hasil karakterisasi sampel B, C, D, dan E menggunakan VSM...7
4 Foto SEM sampel B .
……….
7
5 Foto SEM sampel A .
……….7
vii
DAFTAR LAMPIRAN
Halaman
PENDAHULUAN
Saat ini, ilmu pengetahuan dan teknologi nuklir telah banyak dimanfaatkan pada bidang penelitian, pertanian, kesehatan, industri, dan lain-lain. Pemanfaatan teknologi nuklir dapat meningkatan kesejahteraan dan kemakmuran manusia, tetapi terdapat pula potensi bahaya radiasi terhadap lingkungan hidup. Bahaya radiasi tersebut berasal dari limbah radioaktif yang ditimbulkan dari kegiatan industri nuklir (Suryantoro 2006). Sesium dan strontium merupakanradionuklida hasil fisi bahan bakar yang dominan dalam limbah nuklir dan sangat berbahaya bagi makhluk hidup, karena dapat menyebabkan gangguan kesehatan bahkan kematian. Hal ini dikarenakan Cs dan Sr yang bersifat radioaktif memiliki waktu paruh relatif panjang, yaitu 30 tahun (137Cs) dan 29.1
tahun (90Sr) (Khan et al. 1995). Radionuklida
tersebut dapat masuk ke dalam rantai makanan melalui media udara, air, dan tanah (Tjahaja dan Sukmabuana 2008).
Oleh karena itu, diperlukan suatu penanganan khusus untuk mencegah kontaminasi lingkungan oleh kedua radionuklida tersebut. Salah satunya adalah dengan menggunakan material penjerap atau adsorben karbon aktif. Penelitian dengan karbon aktif untuk menjerap Cs dan Sr telah dilakukan oleh Alarifi dan Hanafi (2010), serta oleh Chegrouche et al. (2009), yang
menjerap Sr di dalam medium berair. Kedua penelitian di atas menyimpulkan bahwa Cs dan Sr dapat terjerap dengan baik pada karbon aktif karena adanya gugus karbonil pada sisi aktif karbon aktif. Namun, penjerapan pada kedua penelitian di atas menggunakan metode tumpak sehingga diperlukan penyaringan untuk memisahkan karbon aktif dengan larutan adsorbat. Penyaringan tersebut membutuhkan waktu lama dan diperlukan penyaring yang dapat menahan seluruh ukuran karbon aktif, sehingga diperlukan modifikasi terhadap karbon aktif, yaitu dengan mengompositkan partikel magnet oksida besi. Magnetit atau Fe3O4 merupakan salah satu
fase oksida besi yang memiliki sifat magnet terbesar di antara fase-fase lainnya (Sulungbudi et al. 2006) sehingga karbon
aktif yang telah terkomposit magnetit dapat merespons medan magnet dan akan memudahkan proses pemisahannya. Penelitian sebelumnya yang dilakukan oleh Oliveira et al. (2002), membuat komposit magnet oksida
besi-karbon aktif sebagai adsorben berbagai kontaminan, danCastro et al. (2009) membuat
komposit karbon aktif-oksida besi sebagai
adsorben atrazin di dalam medium berair. Secara umum, terjadi penurunan luas permukaan yang mengakibatkan penurunan kapasitas penjerapan pada komposit karbon aktif-oksida besi. Namun, hal ini diimbangi dengan kemudahan pada proses pemisahan, yaitu dengan memanfaatkan sifat magnet dari komposit karbon aktif-oksida besi.
Penelitian ini bertujuan membuat komposit magnet oksida besi-karbon aktif sehingga didapat komposit yang memiliki dua sifat dari material penyusunnya, yaitu kemampuan menjerap yang baik dari karbon aktif dan kemampuan merespons medan magnet dari oksida besi sehingga akan memudahkan proses pemisahan karbon aktif di dalam medium berair. Selanjutnya, pencirian komposit dilakukan dengan menggunakan berbagai instrumen, yaitu difraksi sinar-X (XRD) untuk menentukan fase oksida besi yang terbentuk, nilai magnetisasi dengan magnetometri getar cuplikan (VSM), alat Brunauer, Emmett, dan Teller (BET) untuk menentukan luas permukaan, serta mikroskop elektron payaran (SEM) untuk mengetahui mikrostruktur permukaan komposit.
Uji penjerapan dilakukan untuk melihat pengaruh penjerapan komposit magnet oksida besi-karbon aktif terhadap Csdan Srdengan menggunakan metode tumpak. Parameter yang digunakan dalam uji adsorpsi ini adalah ragam jumlah adsorben, ragam pH larutan, dan ragam konsentrasi awal kation Cs serta Sr. Konsentrasi Cs dan Sr yang tersisa di dalam larutan setelah penjerapan berlangsung ditentukan menggunakan spektroskopi serapan atom (AAS).
TINJAUAN PUSTAKA
Karbon Aktif
Arang atau karbon aktif dapat dihasilkan dari bahan-bahan yang mengandung karbon atau dari arang dengan a