PEMBUATAN KOMPOSIT KARBON
AKTIF-NANOMAGNETIT-PIRAZOLON
(1-FENIL-3-METIL-5-PIRAZOLON) SEBAGAI ADSORBEN ION LOGAM KADMIUM
DEWI PRATIWI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Pembuatan Komposit Karbon Aktif-Nanomagnetit-Pirazolon(1-fenil-3-metil-5-pirazolon) sebagai Adsorben Ion Logam Kadmium adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2016
Dewi Pratiwi
RINGKASAN
DEWI PRATIWI. Pembuatan Komposit Karbon Aktif-Nanomagnetit-Pirazolon (1-fenil-3-metil-5-pirazolon) sebagai Adsorben Ion Logam Berat. Dibimbing oleh ETI ROHAETI dan DEDEN SAPRUDIN.
Kadmium merupakan salah satu logam berat yang bersifat toksik. Oleh karena itu penting untuk mengurangi jumlah ion logam kadmium di lingkungan terutama lingkungan perairan. Salah satu cara untuk mengurangi logam berat adalah dengan proses adsorpsi menggunakan suatu adsorben. Karbon aktif merupakan salah satu adsorben logam berat. Namun, kapasitas adsorpsi karbon aktif relatif rendah dan belum bisa mengadsorpsi logam berat secara selektif. Oleh karena itu, penambahan atau pemodifikasian karbon aktif dilakukan untuk meningkatkan kapasitas adsorpsi karbon aktif. Nanomagnetit digunakan untuk meningkatkan kapasitas adsorpsi karbon aktif dan proses adsorpsi yang dilakukan mudah. Ligan spesifik diperlukan untuk meningkatkan selektivitas penjerapan karbon aktif. Ligan yang dapat digunakan diantaranya yaitu pirazolon.
Tujuan penelitian ini adalah untuk membuat adsorben yang selektif terhadap ion logam kadmium. Adsorben dibuat dengan tiga bahan yaitu karbon aktif (komersial), nanomagnetit (hasil sintesis menggunakan metode hidrotermal), dan pirazolon (1-fenil-3-metil-5-pirazolon). Ketiga bahan kemudian dikompositkan dengan mensintesis komposit karbon aktif-nanomagnetit menggunakan metode hidrotermal kemudian mensintesis komposit karbon aktif-nanomagnetit-pirazolon dengan cara impregnasi pirazolon pada komposit karbon aktif-nanomagnetit.
Respons Surface Method (RSM) digunakan untuk memperoleh persen adsorpsi yang optimum. Penentuan kondisi optimum dilakukan pada tiga adsorben yaitu karbon aktif, komposit karbon aktif-nanomagnetit, dan komposit karbon aktif-nanomagnetit-pirazolon. Kondisi optimum yang diperoleh adalah pada pH 6, bobot 500 mg, dan waktu kontak 25 menit untuk karbon aktif. Sedangkan komposit karbon aktif-nanomagnetit diperoleh kondisi optimum pada pH 4, bobot 500 mg, dan waktu kontak 5 menit. Kondisi optimum komposit karbon aktif-nanomagnetit-pirazolon pada pH 8, bobot 500 mg, dan waktu kontak 25 menit.
Hasil penelitian menunjukkan kapasitas adsorpsi komposit karbon-nanomagnetit-pirazolon lebih rendah dibandingkan dengan komposit karbon aktif-nanomagnetit namun lebih tinggi dibandingkan dengan karbon aktif. Sehingga dapat disimpulkan bahwa komposit karbon aktif-nanomagnetit merupakan adsorben terbaik dari karbon aktif dan karbon aktif-nanomagnetit-pirazolon untuk adsorpsi ion logam kadmium, tembaga, dan timbal. Namun, ketiga adsorben tidak menunjukkan adsorbsi yang selektif terhadap salah satu logam berat.
SUMMARY
DEWI PRATIWI. Synthesis of Activated Carbon-Nanomagnetite-Pyrazolone(1-phenyl-3-methyl-5-pyrazolone) Composite as Metal Adsorbent of Ion Cadmium. Supervised by ETI ROHAETI and DEDEN SAPRUDIN.
Cadmium is a toxic heavy metal. Therefore, it is important to reduce the amount of cadmium metal ions at water environtment. One of the ways to reduce the heavy metal is adsorption process using an adsorbent. Activated carbon is one of the heavy metal adsorbent. However, the adsorption capacity of activated carbon low and can not selectively adsorb heavy metals. Therefore, addition or modification of activated carbon can improve that adsorption capacity. Nanomagnetite was used to enhance the adsorption capacity of activated carbon and adsorption process was carried out easily. A specific ligand is needed to improve the selectivity of the entrapment of activated carbon. One of the ligand could be used is pyrazolone.
The aim of this study was to make selective adsorbent for cadmium metal ions. The adsorbent was made with three chemicals namely activated carbon (commercial), nanomagnetite (synthesized by hydrothermal method), and pyrazolone (1-phenyl-3-methyl-5-pyrazolone). These three chemicals were then composited to synthesize activated carbon-nanomagnetite composite by hydrothermal method and then synthesize the active nanomagnetite-pyrazolone composite by impregnation of nanomagnetite-pyrazolone on activated carbon-nanomagnetite composite. Response Surface Method (RSM) was used to obtain the optimum adsorption percent. Determination of the optimum conditions was conducted in three adsorbents, activated carbon, activated carbon-nanomagnetite composite, and activated carbon-nanomagnetite-pyrazolone composite. The optimum conditions were obtained at pH 6, adsorbent dossage 500 mg, and adsorption time was 25 minutes for activated carbon. While activated carbon-nanomagnetite composite obtained at pH 4, 500 mg, adsorption time of 5 minutes, and activated carbon-nanomagnetite-pyrazolone composite at pH 8, adsorbent dossage 500 mg, and adsorption time was 25 minutes.
The results showed the adsorption capacity of the activated nanomagnetite-pyrazolone composite was lower than the activated carbon-nanomagnetite composite but higher than the activated carbon. It could be concluded that the activated carbon-nanomagnetite composite was the best adsorbent than activated carbon and activated carbon-nanomagnetite-pyrazolone composite for the adsorption of metal ions cadmium, copper, and lead. However, the three adsorbents didn’t indicate the selective adsorbent toward one of heavy metals.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Kimia
PEMBUATAN KOMPOSIT KARBON
AKTIF-NANOMAGNETIT-PIRAZOLON
(1-FENIL-3-METIL-5-PIRAZOLON) SEBAGAI ADSORBEN ION LOGAM KADMIUM
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
2
3 Judul Tesis : Pembuatan Komposit Karbon Aktif-Nanomagnetit-Pirazolon
(1-fenil-3metil-5-pirazolon) sebagai Adsorben Ion Logam Kadmium Nama : Dewi Pratiwi
NIM : G451130091
Disetujui oleh Komisi Pembimbing
Dr Eti Rohaeti, MS Ketua
Dr Deden Saprudin, MSi Anggota
Diketahui oleh
Ketua Program Magister Kimia
Prof Dr Dyah Iswantini Pradono, MScAgr
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
4
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2015 hingga Januari 2016 ini ialah adsorpsi ion logam Cd(II), dengan judul Pembuatan Komposit Karbon Aktif-Nanomagnetit-Pirazolon (1-fenil-3-metil-5-pirazolon) sebagai Adsorben Ion Logam Kadmium.
Terima kasih penulis ucapkan kepada Ibu Dr Eti Rohaeti MS dan Bapak Dr Deden Saprudin MSi selaku pembimbing yang telah banyak meluangkan waktu dan pikiran beserta dukungan moril dan materil hingga terselesaikannya tulisan ini. Ibu Sri Sugiarti PhD selaku penguji luar komisi. Ibu Prof Dr Dyah Iswantini MscAgr dan Ibu Dr Gustini Sabirin MS selaku ketua dan sekretaris program magister kimia serta seluruh dosen Pascasarjana Kimia atas segala bimbingan dan ilmu yang diberikan.
Terima kasih juga penulis sampaikan kepada Direktorat Jenderal Pendidikan Tinggi (Dikti) Kementerian Pendidikan dan Kebudayaan yang telah memberikan bantuan dana berupa beasiswa BPPDN untuk menempuh kuliah di Sekolah Pascasarjana IPB dan semua pihak khususnya teman-teman kimia pascasarjana angkatan 2013 serta kepada seluruh staf Laboratorium Kimia Analitik IPB (Om
eman, Pak Dede, Bu Nunung, dan Pak Kosasih) yang telah membantu dan
memberikan dukungan serta motivasi dalam penyelesaian karya ilmiah ini.
Ungkapan terima kasih untuk yang teristimewa kepada Ayahanda Chazuardi, Ibunda Rina, Mas Herry Sujatmianto, Along Arif Rahman, Chafiz Rizki, Dedek Tsaqif Chairurraziqin, Along Windiawati, Destria Chasi Kirani, Arzachel Adya Rahman serta seluruh keluarga atas segala doa, motivasi dan kasih sayangnya serta dukungan moril maupun materil. Ucapan terimakasih juga disampaikan kepada seluruh rekan dan sahabat yang tidak dapat penulis sebutkan satu persatu yang telah membantu dalam penyelesaian tesis ini. Penulis juga menyampaikan permohonan maaf apabila selama studi dan pelaksanaan penelitian maupun penulisan karya ilmiah ini terdapat tutur kata, sikap, serta perbuatan yang
kurang berkenan. Semoga hasil penelitian dan tulisan ini dapat bermanfaat sebagai
bahan informasi dalam kemajuan ilmu pengetahuan alam dan teknologi.
Bogor, Juli 2016
5
DAFTAR ISI
DAFTAR TABEL ix
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN ix
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 3
Ruang Lingkup Penelitian 3
2 TINJAUAN PUSTAKA 3
Karbon Aktif 3
Nanomagnetit 4
Pirazolon (1-fenil-3-metil-5-pirazolon) 5
Isoterm Adsorpsi 6
Kadmium (Cd) 7
3 METODE 8
Waktu dan Tempat Penelitian 8
Bahan 8
Alat 8
Prosedur Kerja 9
Sintesis Nanomagnetit 9
Sintesis Komposit Karbon Aktif-Nanomagnetit 9
Sintesis Komposit Karbon Aktif-Nanomagnetit-Pirazolon 9
Penentuan Kondisi Optimum Percobaan 9
Penentuan Isoterm Adsorpsi 10
Penentuan Pengaruh Ion Logam Cu(II) dan Pb(II) 10
4 HASIL DAN PEMBAHASAN 11
Hasil Sintesis dan Karakterisasi Adsorben 11
Kondisi Optimum Adsorpsi Cd(II) 13
Isoterm Adsorpsi 17
Pengaruh Ion Logam Cu(II) dan Pb(II) 19
5 SIMPULAN DAN SARAN 20
DAFTAR PUSTAKA 21
LAMPIRAN 24
7
DAFTAR TABEL
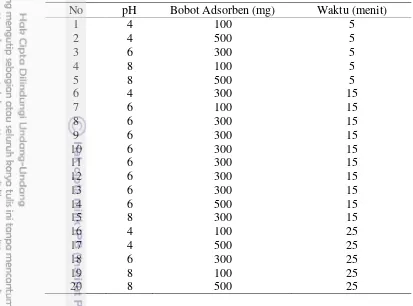
1 Rancangan Percobaan optimasi CCD untuk adsorpsi Cd oleh KA, KA-
NM, KA-NM-PZ 10
2 Pola nilai hkl magnetit dan komposit KA-NM hasil sintesis 12 3 Kapasitas adsorpsi dan persen adsorpsi KA, KA-NM, dan KA-NM- PZ
pada ragam pH, bobot adsorben, dan waktu 14
4 Persen adsorpsi, dan kapasitas adsorpsi adsorben KA, KA-NM, dan
KA-NM-PZ 17
5 Parameter isoterm Langmuir dan Freundlich 18
DAFTAR GAMBAR
1 Struktur kristal magnetit 4
2 Struktur 1-fenil-3-metil-5-pirazolon 5
3 Difraktogram serbuk hasil sintesis 11
4 Spektrum FTIR KA, NM, Pirazolon, KA-NM dan KA-NM-PZ 12 5 Perbandingan kapasitas adsorpsi dan persen adsorpsi terhadap ion
logam Cd(II) untuk beberapa adsorben 15
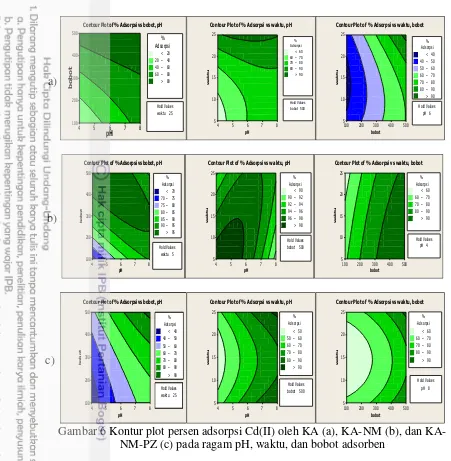
6 Kontur plot persen adsorpsi Cd(II) oleh KA (a), NM (b), dan KA-NM-PZ (c) pada ragam pH, waktu, dan bobot adsorben 16 7 Isoterm adsorpsi model Langmuir (a) dan Freundlich (b) pada adsorpsi
Cd(II) oleh KA, KA-NM, dan KA-NM-PZ 18
8 Pengaruh ion logam Cu(II) dan Pb(II) pada kapasitas adsorpsi Cd(II) 19
DAFTAR LAMPIRAN
9 Diagram alir penelitian 25
10 Kurva kalibrasi 26
11 Data analisis gugus fungsi menggunakan FTIR 28
12 Standar magnetit JCPDS No. 19-0629 31
13 Data hasil analisis XRD perhitungan kristalinitas NM 32 14 Data hasil analisis XRD perhitungan kristalinitas KA-NM 33 15 Penentuan pola h2+k2+l2 NM hasil sintesis 34
16 Penentuan ukuran kristal NM hasil sintesis 35
17 Penentuan pola h2+k2+l2 komposit KA-NM 36
18 Penentuan ukuran kristal komposit KA-NM hasil sintesis 37 19 Data hasil estimasi koefisien regresi dan analisis ragam pengolahan
CCD menggunakan minitab 38
20 Data hasil analisis isoterm Langmuir dan Freundlich adsorpsi Cd(II)
8
21 Data hasil analisis isoterm Langmuir dan Freundlich adsorpsi Cd(II)
oleh KA-NM 41
22 Data hasil analisis isoterm Langmuir dan Freundlich adsorpsi Cd(II)
oleh KA-NM-PZ 42
23 Perhitungan persentase penurunan kapasitas adsorpsi adsorben terhadap
9
1
PENDAHULUAN
Latar Belakang
Logam berat kadmium (Cd) diketahui bersifat toksik dan dalam jumlah tertentu dapat menimbulkan efek terhadap kesehatan manusia. Environtmental Protection Agency (EPA 2012) memberikan batas maksimum kadar logam Cd dalam air minum sebesar 0.005 mg/L sementara World Health Organization
(WHO 2011) sebesar 0.003 mg/L. Waalkes (2003) menyatakan bahwa logam Cd bersifat karsinogenik dan dapat menyebabkan kanker paru-paru. Selain itu, logam Cd juga dapat berpengaruh terhadap ginjal, hipertensi, dan kerapuhan tulang (Sudarmaji et al. 2006). Logam Cd dapat masuk dan terakumulasi dalam tubuh manusia melalui makanan, minuman, dan lingkungan air maupun udara. Oleh karena itu, penting untuk mengurangi konsentrasi logam Cd yang terdapat di lingkungan terutama lingkungan perairan. Pengurangan konsentrasi logam Cd diantaranya dilakukan cara adsorpsi oleh suatu adsorben.
Karbon aktif merupakan salah satu adsorben yang banyak digunakan untuk mengurangi logam berat dalam lingkungan air. Pertimbangan digunakannya karbon aktif sebagai adsorben dikarenakan luas permukaannya yang tinggi, struktur mikro pori, dan adanya gugus fungsi yang terdapat pada permukaan adsorben. Struktur pori karbon aktif dapat dimodifikasi melalui fungsionalisasi permukaan karbon aktif sehingga dapat dengan mudah mengadsorpsi ion logam berat. Fungsionalisasi permukaan karbon aktif telah dilakukan oleh Jia dan Thomas (2000) dengan cara oksidasi menggunakan asam nitrat dan Machida et al.
(2012) menggunakan larutan ammonium peroksidisulfat yang dapat meningkatkan kapasitas adsorpsi karbon aktif. Modifikasi kimia atau biologi pada permukaan karbon aktif juga telah diakui sebagai cara yang efektif untuk meningkatkan kapasitas adsorpsi karbon aktif (Mahmoud et al. 2012). Beberapa peneliti yang melakukan modifikasi kimia dan biologi, seperti Lu et al. (2014) melakukan modifikasi permukaan karbon aktif menggunakan asam peroksida yang dapat meningkatkan kapasitas adsorpsi logam Hg(II). Oleh karena itu, peningkatan kapasitas adsorpsi dengan modifikasi adsorben karbon aktif sangat menarik untuk dilakukan.
Nanomagnetit yang diimobilisasi pada karbon aktif dapat meningkatkan luas permukaan karbon aktif sehingga kapasitas adsorpsinya juga meningkat. Zach-Maor et al. (2012) dalam studinya memperoleh kapasitas adsorpsi karbon aktif sebesar 68% sedangkan karbon aktif yang dimodifikasi nanomagnetit menghasilkan kapasitas adsorpsi sebesar 91% untuk adsorpsi logam Cr(VI) sementara kapasitas adsorpsi terhadap logam Cu(II) meningkat dari 32% menjadi 85% masing-masing oleh karbon aktif dan karbon aktif terimobilisasi nanomagnetit. Namun, nanomagnetit dapat membentuk agregat dari sifat magnetiknya (Lyles et al. 2004). Terbentuknya agregat menyebabkan proses adsorpsi menjadi kurang efisien sehingga perlu dilakukan modifikasi permukaan nanomagnetit.
10
menyatakan bahwa nanomagnetit yang diimobilisasi EDTA berhasil diaplikasikan pada ekstraksi ion logam Cu, Cd, Co, dan Pb. Namun, tidak dapat secara spesifik terhadap salah satu logam karena persentase ekstraksi dari keempat logam tersebut tidak berbeda secara signifikan. Kapasitas adsorpsi nanomagnetit yang diimobilisasi dengan EDTA pada ekstraski ion logam Cd sekitar 0.32 µmol/g (Jang dan Lim 2010). Sehingga perlu adanya pengembangan dan pemilihan ligan lain untuk mengetahui selektivitas dari adsorben.
Senyawa pirazolon dan turunannya telah digunakan untuk ekstraksi logam lantanida dan logam berat golongan transisi seperti La(III), Eu(III), Lu(III), Cu(II), Ni(II), Zn(II), Cd(II), Hg(II), Pb(II), Mo(VI) (Bou-Maroun et al. 2006; Oliva et al.
2002; Hamzah et al. 2011; Ihesinachi et al. 2011). Gugus keto yang terdapat pada senyawa pirazolon dapat membentuk kompleks dengan ion logam. Todorova et al.
(1993) memodifikasi silika gel dan kieselguhr dengan senyawa pirazolon (1-fenil-3-metil-5pirazolon) menghasilkan kapasitas adsorpsi terbesar pada komposit kieselguhr dengan pirazolon sebesar 0.71, 0.26, 0.58, dan 0,83 mmol/g untuk masing-masing logam Cu(II), Mn(II), Cd(II), dan Pb(II). Adsorpsi logam berat menggunakan karbon aktif dari aprikot dimodifikasi dengan pirazolon juga dilakukan oleh Lakov et al. (1998) yang menghasilkan kapasitas adsorpsi terhadap logam Cd sebesar 0.54 mmol/g.
Pada penelitian ini dilakukan modifikasi terhadap karbon aktif dengan nanomagnetit dan senyawa pirazolon sehingga diharapkan komposit hasil sintesis dapat mengadsorpsi ion logam Cd secara selektif dan kapasitas adsorpsi yang dihasilkan juga besar.
Perumusan Masalah
Berdasarkan latar belakang yang telah dikemukakan sebelumnya, maka rumusan masalah dalam penelitian ini adalah untuk mengurangi kadar kadmium yang terdapat dalam perairan yang melebihi ambang batas sehingga perlu dikembangkan adsorben yang handal, daya adsorpsi tinggi dan spesifik. Karbon aktif-nanomagnetit dan karbon aktif yang dimodifikasi ligan sebagai pengadsorpsi logam berat telah dilaporkan, namun belum spesifik terhadap salah satu logam berat. Oleh karena itu, penambahan ligan spesifik pirazolon pada komposit karbon aktif-nanomagnetit diharapkan dapat menjerap ion kadmium secara selektif.
Tujuan Penelitian
11 Manfaat Penelitian
Memperoleh data kinerja komposit karbon aktif-nanomagnetit dan karbon aktif-nanomagnetit-pirazolon yang digunakan sebagai alternatif adsorben untuk adsorpsi ion logam berat.
Ruang Lingkup Penelitian
Tahapan penelitian terdiri dari sintesis dan karakterisasi nanomagnetit, komposit karbon aktif-nanomagnetit, komposit karbon aktif-nanomagnetit-pirazolon, serta aplikasi sampel adsorben yang diperoleh sebagai penjerap logam berat Cd(II) dengan metode batch. Aplikasi dari penelitian ini terdiri dari tiga rangkaian percobaan yaitu penentuan kondisi optimum percobaan adsorpsi dengan metode Respons Surface Methode (RSM) menggunakan model Central Composite Design (CCD), percobaan isoterm adsorpsi, dan pengaruh ion logam asing (Cu dan Pb). Tahapan penelitian dapat dilihat pada diagram alir penelitian pada Lampiran 1.
2
TINJAUAN PUSTAKA
Karbon Aktif
Karbon aktif secara luas digunakan sebagai adsorben karena karbon aktif merupakan material yang unik yaitu berisi dengan rongga-rongga (kosong, pori,
spaces) yang berukuran molekul. Hal ini dapat dikatakan bahwa walaupun densitas elektronnya nol, pori-porinya memliki gaya van der waals yang kuat dan sangat mendukung pada proses adsorpsi. Pori-pori karbon aktif mempunyai bentuk dan ukuran yang bervariasi dan tidak teratur. Ukuran pori karbon dibagi kedalam tiga kategori yaitu mikropori < 2 nm, mesopori 2-50 nm, dan makropori > 50 nm (Marsh 2006). Ukuran pori ini dapat menentukan bagaimana adsorpsi terjadi sehingga dapat menangkap atau menjerap partikel-partikel sangat halus (molekul). Semakin banyak zat-zat yang diadsorpsi maka pori-pori ini pada akhirnya akan jenuh sehingga karbon aktif tidak akan berfungsi lagi.
12
karbon aktif biasanya didominasi oleh gugus fungsi permukaan (Jia dan Thomas 2000).
Gugus fungsi yang terdapat pada permukaan karbon aktif beraneka ragam. Mahmoud et al. (2015) menyatakan bahwa permukaan karbon aktif terdapat gugus karbonil, karboksil, dan karboksilat. Lu et al. (2014) juga mengindikasikan bahwa gugus fungsi yang terdapat pada karbon aktif adalah gugus fungsi karboksilat. Gugus karboksilat dapat terionisasi menjadi COO- dan H+. Merkuri teradsorpsi melalui reaksi kompleksometri antara gugus karboksilat dan Hg2+. Gugus karboksilat berperan penting dalam adsorpsi Hg2+ (Lu et al. 2014).
Nanomagnetit
Magnetit (Fe3O4) banyak ditemukan dialam yang terdapat didasar laut,
tanah, batu, meteorit, debu atmosfer, bakteri dan organisme hidup lainnya. Magnetit juga biasanya dihasilkan dari korosi besi dan baja. Magnetit merupakan salah satu fase dari besi oksida. Selain dapat ditemukan dialam, besi oksida dapat disintesis dan sintesisnya secara intesif dikembangkan tidak hanya untuk kepentingan ilmiah fundamental namun dapat juga diaplikasikan dalam berbagai bidang. Baru-baru ini, penggunaan besi oksida berdasarkan nanomaterial dengan sifat dan fungsinya secara luas dipelajari karena ukurannya yang kecil, luas permukaan tinggi, dan sifat magnetik.
Gambar 1 Struktur kristal magnetit (Roonasi 2007)
Struktur kristal pada Gambar 1 menunjukkan adanya molekul oksigen, besi pada sisi tetrahedral dan oktahedral yang berperan pada sifat magnetik dan warna magnetit. Nanomagnetit berwarna hitam karena intervalensi transfer muatan antara Fe(II) dan Fe(III) dalam struktur kristal. Sifat magnetik dalam magnetit juga berasal dari atom Fe(II) dan Fe(III) pada sisi tetra dan oktahedral.
Adsorpsi permukaan mineral merupakan fenomena yang sangat penting pada hubungan proses teknikal dan lingkungan. Sebagai contoh, banyak proses geokimia pada bumi seperti kerusakan karena iklim, disolusi, pengendapan dan kristalisasi dapat dipengaruhi oleh adsorpsi mineral. Demikian juga pada industri, adsorpsi merupakan faktor krusial pada proses katalisis dan korosi bijih besi. Perubahan sifat ini didasarkan pada sistem partikel mineral oleh adsorpsi karena perubahan atau modifikasi permukaan kimia mineral.
13 Potensi nanomagnetit secara ekstensif telah dikembangkan melalui teknik sintesis yang diklasifikasikan dalam tiga kategori yaitu metode fisika, kimia, dan biologi (Xu et al. 2014). Pada penelitian ini, sintesis nanomagnetit dilakukan dengan metode kimia melalui proses hidrotermal. Kelebihan dari metode hidrotermal yaitu bentuk dan ukuran partikel dapat dikontrol, kelemahannya memerlukan suhu reaksi dan tekanan yang tinggi. Nanomagnetit umumnya tidak stabil dan mudah teragregasi sehingga mempengaruhi kekuatan dispersi dalam larutan karena energi permukaannya tinggi. Nanomagnetit (nanopartikel Fe3O4)
mudah teroksidasi menjadi nanopartikel Fe2O3 dengan adanya oksigen. Untuk
mengatasi berbagai kelemahan tersebut, telah dikembangkan berbagai metode modifikasi permukaan nanomagnetit dengan menambahkan zat kimia atau biologi selama atau setelah proses sintesis untuk meningkatkan dispersibilitas, stabilitas, biokompatibilitas, dan biodegradabilitas untuk tujuan spesifik. Stabilitas, dispersitas, dan biokompatibilitas nanomagnetit dapat meningkat dengan modifikasi permukaan yang sesuai serta meminimalisir proses oksidasi dari nanopartikel Fe3O4 menjadi nanopartikel Fe2O3 dapat diminimalisir (Xu et al.
2014).
Pirazolon (1-fenil-3-metil-5-pirazolon)
Pirazolon merupakan turunan dari senyawa pirazola yang beranggotakan lima cincin laktam dan mempunyai tambahan gugus keto. Pada umumnya pirazolon berada dalam bentuk keto. Namun senyawa pirazolon juga dapat berada dalam bentuk menjadi enol. Senyawa pirazolon dapat berada dalam bentuk enol karena senyawa ini mempunyai hidrogen α yang melekat pada karbon α. Kedua bentuk ini disebut sebagai sepasang tautomer. Senyawa pirazolon didalam larutan air dapat bersifat sebagai asam lemah karena struktur molekulnya dapat berubah-ubah dari struktur enol ke struktur keto sesuai dengan perberubah-ubahan pH larutan (Akama et al. 1996). Struktur dari senyawa 1-fenil-3-metil-5-pirazolon diberikan pada Gambar 2. Gambar 2 Struktur 1-fenil-3-metil-5-pirazolon
14
Isoterm Adsorpsi
Isoterm adsorpsi memberikan informasi yang paling penting tentang distribusi molekul adsorbat antara fase cair dan fase padat. Isoterm adsorpsi merupakan hubungan kesetimbangan antara potensial kimia adsorbat dalam gas atau cairan dan potensial kimia adsorbat di permukaan adsorben pada suhu tetap. Kesetimbangan adsorpsi biasanya digambarkan dengan persamaan isoterm yang parameter-parameternya menunjukkan sifat permukaan dan afinitas dari adsorben. Isoterm adsorpsi yang paling umum digunakan adalah isoterm adsorpsi Langmuir dan Freundlich. Isoterm Langmuir didasarkan pada dua asumsi bahwa kekuatan interaksi antara molekul teradsorpsi dapat diabaikan dan molekul menempati sebuah situs yang tidak terjadi penyerapan lebih lanjut (Subramanyam dan Das 2009). Menurut Atkins dan Paula (2006), Isoterm adsorpsi Langmuir berdasarkan pada asumsi sebagai berikut :
1. Adsorpsi hanya terjadi pada lapisan tunggal (monolayer) 2. Semua bagian dan permukaannya bersifat homogen 3. Tidak ada interaksi antara molekul yang teradsorpsi
Persamaan isoterm adsorpsi Langmuir dapat diturunkan secara teoritis dengan mengganggap terjadinya kesetimbangan antara molekul-molekul yang diadsorpsi pada permukaan adsorben dengan molekul-molekul yang tidak teradsorpsi. Persamaan isoterm adsorpsi Langmuir dapat dituliskan sebagai berikut.
= + ��
Dengan :
qe = jumlah adsorbat yang teradsorpsi per unit bobot adsorben pada
kesetimbangan (mg/g)
qm = kapasitas adsorpsi maksimum (mg/g)
Ce = konsentrasi kesetimbangan adsorbat dalam larutan (mg/L)
b = konstanta yang berhubungan dengan energi bebas adsorpsi (L/mg)
Isoterm Freundlich mengasumsikan suatu permukaan adsorpsi yang heterogen dan terdapat perbedaan energi pada tapak aktif (Koumanova dan Peeva-Antova 2002). Model isoterm ini menganggap bahwa pada semua tapak aktif permukaan adsorben akan terjadi proses adsorpsi di bawah kondisi yang diberikan. Isoterm Freundlich tidak memperkirakan adanya tapak-tapak pada permukaan yang mampu mencegah tercapainya adsorpsi pada kesetimbangan. Hanya ada beberapa tapak aktif saja yang mampu mengadsorpsi molekul terlarut. Persamaan isoterm adsorpsi Freundlich didasarkan pada asumsi sebagai berikut :
1. Terbentuknya adsorpsi beberapa lapisan (multilayer) dari molekul-molekul adsorbat pada adsorben
2. Bagian tapak aktif pada permukaan adsorben bersifat heterogen
3. Hanya melibatkan gaya Van Der Waals sehingga adsorbat dapat bergerak dari satu bagian permukaan ke bagian permukaan lain dari adsorben
Persamaan isoterm adsorpsi Freundlich dapat dituliskan sebagai berikut :
= � ⁄
Dengan Kf = konstanta, yang menggambarkan kapasitas adsorpsi relatif dari
15 Dalam persamaan Freundlich, nilai n dalam rentang 1-10 menggambarkan adsorpsi yang baik (Fan et al. 2008).
Kurva persamaan garis lurus Langmuir dan Freundlich diperoleh dengan memplot berturut-turut Ce/qe vs Ce dan log qe vs log Ce dan dari persamaan
isoterm tersebut dapat dicari kapasitas adsorpsi optimum adsorben terhadap adsorbat. Persamaan Langmuir digunakan untuk memperoleh nilai RL atau faktor
pemisahan yang menggambarkan dimensi parameter kesetimbangan. Jika RL > 1
proses adsorpsi bersifat tidak baik (unfavorable) karena adsorpsi pada zat padat relatif rendah; RL = 1 proses adsorpsi linear yang artinya jumlah adsorbat yang
teradsorpsi pada adsorben sebanding dengan konsentrasinya dalam fluida; 0<RL<1 proses adsorpsi bersifat baik (favorable) yang artinya adsorpsi relatif
tinggi pada adsorbsi terjadi pada konsentrasi fluida rendah; dan RL = 0 proses
adsorpsi tidak dapat balik (irreversible) (Ghassabzadeh et al. 2010). Persamaan RL dapat dituliskan sebagai berikut :
� = + �
Jika RL > 1, proses adsorpsi bersifat unfavorable karena adsorpsi pada zat
padat realtif rendah. RL = 1 proses adsorpsi linear yaitu jumlah adsorbat sebanding
dengan konsentrasinya dalam fluida. Sedangkan 0<RL<1 proses adsorpsi favorable yaitu adsorpsi relative tinggi pada adsorben terjadi pada konsentrasi rendah dan RL=0 proses adsorpsi bersifat irreversible atau tidak dapat balik
(Ghassabzadeh et al. 2010). Simbol b merupakan konstanta yang berhubungan dengan energy bebas adsorpsi dan Co merupakan konsentrasi awal adsorbat (mg/L).
Kadmium (Cd)
Kadmium (Cd) pertama kali ditemukan pada tahun 1817 oleh ahli kimia Jerman, F. Stromeyer. Logam Cd terutama ditemukan dalam seng, timbal-seng, timbal-tembaga-besi seng, dan konsentrasinya biasanya berkaitan dengan kadar seng. Logam Cd juga ditemukan dalam berbagai jumlah sebagai komponen alami di lingkungan seperti dalam permukaan batu, tanah, air, udara, jaringan tumbuhan dan hewan. Sifat geokimia Cd sama dengan seng karena struktur elektron dan potensial ionisasinya sama dari dua unsur. Logam Cd alami hampir selalu ada dalam bentuk Cd2+ dan terdapat delapan isotop yang stabil (Basel 1986).
Logam Cd sulit membentuk ikatan kovalen dengan karbon dalam lingkungan perairan. Logam Cd bertindak sebagai akseptor asam lunak dalam reaksi koordinasi sehingga lebih mudah berinteraksi dengan sulfur, selenium, atau nitrogen. Di alam, Cd dapat bercampur dengan zat organik maupun anorganik sehingga untuk memisahkan Cd dalam campurannya perlu dilakukan pemisahan yang melibatkan reaksi seperti adsorpsi logam, adsorpsi ligan, pembentukan permukaan kompleks, pertukaran ion,dan adsorpsi logam kompleks.
16
keramik. Logam Cd juga sering digunakan dalam lempengan elektroda, pengecatan, stabilizer dalam pabrik plastik dan baterai serta sebagai campuran logam (alloy). Di perairan, kelarutan Cd dalam konsentrasi tertentu dapat membunuh biota perairan. Pada konsentrasi 200 µg/L menyebabkan keracunan pada ikan. Logam Cd juga mengalami proses biotransformasi dan bioakumulasi dalam organisme hidup (tumbuhan, hewan, dan manusia).
Keracunan Cd bersifat akut dan kronis. Sistem tubuh yang dapat dirusak adalah ginjal, paru-paru, kekurangan darah, kerapuhan tulang, mempengaruhi sistem reproduksi dan organ-organnya. Keracunan akut muncul setelah 4-10 jam sejak penderita terpapar oleh Cd. Keracunan Cd bisa menimbulkan penyakit paru-paru akut. Paparan Cd secara akut dapat menyebabkan kehilangan nafsu makan, daya tahan tubuh lemah, kanker, sakit kepala, kedinginan hingga menggigil, nyeri otot dan diare bahkan bisa menyebabkan kematian. Keracunan kronis Cd bisa menyerang saluran pencernaan, ginjal, hati, dan tulang serta saluran pernafasan (Sudarmaji et al. 2006).
3
METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Maret 2015-Januari 2016 di Laboratorium Kimia Analitik Departemen Kimia IPB, Laboratorium Bersama Departemen Kimia IPB, dan Laboratorium Q-Lab Fakultas Farmasi Universitas Pancasila.
Bahan
Bahan-bahan yang digunakan adalah FeCl3.6H2O, natrium sitrat, urea,
karbon aktif, 1-fenil-3-metil-5-pirazolon, NaHCO3 10%, dan larutan standar
kadmium dari Merck (Jerman).
Alat
Alat-alat yang digunakan dalam penelitian ini adalah timbangan analitik Sartorius BT 224 S dengan ketelitian 0.1 mg, teflon hidrotermal, shaker water bath unitronic OR P Selecta, pH meter Hanna Instruments HI 2211, Oven, Flame Atomic Absorption Spektroscopy (FAAS) Shimadzu AA-6800, X-Ray Diffraction
17 Prosedur Kerja
Sintesis Nanomagnetit (NM)
Sintesis NM dilakukan dengan metode hidrotermal (Modifikasi Cheng et al.
2010). FeCl3.6H2O 0.2 M ditambahkan dengan natrium sitrat 0.4 M dan urea 0.6
M yang dilarutkan dengan 100 ml aquades. Larutan diaduk menggunakan magnetik stirer selama 30 menit kemudian dimasukkan dalam teflon hidrotermal dan dipanaskan dalam oven pada suhu 200˚C selama 12 jam. Padatan hitam yang terbentuk kemudian dicuci dengan aquades dan etanol lalu dikeringkan pada suhu 60˚C semalaman. Serbuk hasil sintesis kemudian dikarakterisasi menggunakan analisis FTIR dan XRD.
Sintesis Komposit Karbon Aktif-Nanomagnetit (KA-NM)
Sintesis KA-NM dilakukan dengan metode hidrotermal (Modifikasi Cheng
et al. 2010). FeCl3.6H2O 0.2 M ditambahkan dengan natrium sitrat 0.4 M, urea 0.6
M dan 5 g karbon aktif yang dilarutkan dengan 100 ml aquades. Larutan diaduk menggunakan magnetik stirer selama 30 menit kemudian dimasukkan dalam teflon hidrotermal dan dipanaskan dalam oven pada suhu 200˚C selama 12 jam. Padatan hitam yang terbentuk kemudian dicuci dengan aquades dan etanol lalu dikeringkan pada suhu 60˚C semalaman. Serbuk hasil sintesis kemudian dikarakterisasi menggunakan analisis FTIR dan XRD.
Sintesis Komposit Karbon Aktif-Nanomagnetit-Pirazolon (KA-NM-PZ) KA-NM 5 g ditambahkan dengan pirazolon 10 g dalam 250 ml larutan NaHCO3 10% dan diaduk menggunakan stirer selama 20 jam. Kemudian filtrat
dan endapan dipisahkan menggunakan sentrifuga lalu padatan dicuci dengan aquades, aseton ditambah aquades dengan perbandingan 1:1, dan aquades sampai pH netral (Modifikasi Todorova et al. 1993). Serbuk hasil sintesis kemudian dikarakterisasi menggunakan analisis FTIR.
Penentuan Kondisi Optimum Percobaan
18
Percobaan ini dilakukan setelah diperoleh data kondisi optimum. Konsentrasi awal larutan Cd(II) 10, 20, 30, 40, dan 50 mg/L (pH optimum) dalam erlenmeyer masing-masing ditambahkan dengan sejumlah adsorben pada bobot optimum. Kemudian larutan dikocok menggunakan shaker pada waktu optimum. Kemudian larutan disaring menggunakan kertas saring, konsentrasi Cd dalam filtrat diukur menggunakan FAAS pada panjang gelombang 228.8 nm.
Penentuan Pengaruh Ion Logam Cu(II) dan Pb(II)
19
4
HASIL DAN PEMBAHASAN
Hasil Sintesis dan Karakterisasi Adsorben
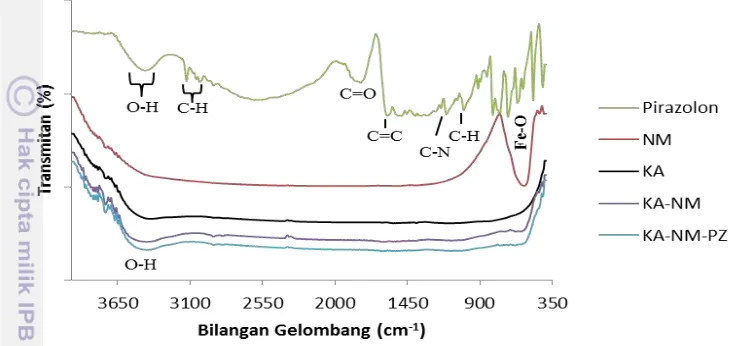
Sintesis yang dilakukan pada penelitian ini adalah sintesis nanomagnetit (NM), karbon aktif-nanomagnetit (KA-NM) dan karbon aktif-nanomagnetit-pirazolon (KA-NM-PZ) yang kemudian hasilnya dikarakterisasi menggunakan analisis Difraksi Sinar-X (XRD) dan Fourier Transform Infra-Red (FTIR). Komposit KA-NM dan NM disintesis menggunakan metode hidrotermal dan dilakukan selama 12 jam. Hasil sintesis berupa padatan hitam yang dapat tertarik magnet. Namun kekuatan penarikan oleh magnet pada komposit KA-NM lebih lemah dibandingkan dengan NM yang tidak terkomposit KA. Hasil ini sesuai dengan Oliveira et al. (2002) yang melakukan pengukuran magnetisasi besi oksida dan komposit besi oksida-karbon aktif yang menghasilkan magnetisasi komposit besi oksida-karbon aktif lebih rendah dibandingkan dengan besi oksida murni. Karakterisasi XRD bertujuan untuk mengetahui fase NM yang terbentuk pada sampel, derajat kristalinitas, ukuran kristal, dan bentuk kristal hasil sintesis. Hasil analisis XRD untuk sampel NM dan KA-NM ditunjukkan pada Gambar 3. Sedangkan hasil analisis FTIR untuk NM dan KA-NM ditunjukkan pada Gambar 4 beserta hasil analisis FTIR sampel KA, pirazolon, dan KA-NM-PZ yang juga dapat dilihat pada Lampiran 3.
Gambar 3 Difraktogram serbuk hasil sintesis
Difraktogram hasil sintesis dibandingkan dengan JCPDS 19-0629 tahun 2002 program PCPDFWIN versi 2.3 International Centre for Diffraction Data
(Lampiran 4). Puncak-puncak yang dihasilkan sesuai dengan standar magnetit pada JCPDS tersebut untuk puncak dengan intensitas tertinggi (100) yaitu pada 2θ 35.422°, 35.353°, dan 35.445° masing-masing untuk standar magnetit, NM hasil sintesis, dan komposit KA-NM yang merupakan puncak khas dari magnetit. Sehingga dapat dinyatakan bahwa serbuk hasil sintesis merupakan magnetit dan komposit dengan KA juga tidak mengubah struktur kristal dari magnetit. Perbedaannya terletak pada background KA-NM lebih besar dibandingkan dengan NM karena KA merupakan material yang amorf. Kwon et al. (2014) menyatakan sifat amorf dari KA pada pola XRD muncul pada nilai 2θ 20–30. Sifat amorf dari KA juga telah menurunkan derajat kristalinitas sampel hasil
10 20 30 40 50 60 70 80
Intensita
s
2 θ
KA-NM
20
sintesis yaitu dari 64.07% untuk NM menjadi 38.42% untuk KA-NM. Perhitungan kristalinitas NM dan KA-NM dapat dilihat pada Lampiran 5 dan 6.
Analisis XRD juga dapat menentukan ukuran kristal dan bentuk kristal sintesis juga sesuai dengan pola nilai hkl magnetit yang dihasilkan oleh Cheng et al. (2010). Penentuan pola nilai h2+k2+l2 hasil sintesis NM dapat dilihat pada Lampiran 7 dan ukuran kristal dihitung menggunakan persamaan Scherrer yang dapat dilihat pada Lampiran 8. Sedangkan pola nilai h2+k2+l2 KA-NM dapat
dilihat pada Lampiran 9 dan ukuran kristal pada Lampiran 10.
Tabel 2 Pola nilai hkl magnetit dan komposit KA-NM hasil sintesis
Magnetit KA-NM
Karakterisasi FTIR dilakukan untuk mengetahui gugus fungsi suatu senyawa. Adanya gugus fungsi pada suatu senyawa ditunjukkan dengan munculnya puncak-puncak karakteristik yang spesifik pada spektrum FTIR yang dihasilkan. Hasil analisis gugus fungsi dari spektrum FTIR untuk material penyusun komposit menunjukkan karakteristik yang berbeda. Pada KA tidak menunjukkan adanya serapan gugus fungsi spesifik. Hal ini dikarenakan KA tidak dilakukan proses fungsionalisasi permukaan sehingga tidak menunjukkan adanya gugus fungsi permukaan secara spesifik. Spektrum FTIR untuk NM hasil sintesis ditunjukkan dengan puncak tajam pada daerah serapan bilangan gelombang 565 cm-1. Puncak tajam ini merupakan daerah serapan ikatan Fe-O yang terletak pada daerah serapan bilangan gelombang < 570 cm-1 (Waldron 1955; Kwon et al.
2014).
Pirazolon mempunyai beberapa puncak khas dengan daerah bilangan gelombang tertentu pada analisis gugus fungsi menggunakan FTIR. Pada daerah 1805 cm-1 menunjukkan adanya gugus C=O (karbonil) dari cincin pirazolon. Gugus C=C dari gugus fenil ditunjukkan dengan adanya serapan pada 1601 cm-1.
Puncak dengan daerah bilangan gelombang 1151 cm-1 menunjukkan vibrasi dari C-N. Pada daerah bilangan gelombang 1027 cm-1 menunjukkan vibrasi C-H dari gugus etil (CH2). Puncak dengan daerah bilangan gelombang 3056 dan 3029 cm-1
21 Pavia (2001) menyatakan bahwa daerah vibrasi gugus karbonil terletak pada 1820-1660cm-1, daerah vibrasi C=C aromatik berada pada daerah 1600-1475cm-1
dan C-N pada daerah bilangan gelombang 1350-1000 cm-1, daerah vibrasi C-H
dari gugus hidrokarbon aromatik berada pada daerah sekitar 3000 cm-1, puncak vibrasi C-H dari gugus metil terletak pada daerah bilangan gelombang 3100-2500 cm-1 dan vibrasi O-H berada pada 3600-3200 cm-1.
Gambar 4 Spektrum FTIR KA, NM, Pirazolon, KA-NM dan KA-NM-PZ
Spektrum FTIR untuk komposit KA-NM dan KA-NM-PZ tidak menunjukkan perbedaan yang signifikan dengan hasil analisis gugus fungsi KA. Sehingga dapat disimpulkan bahwa pada komposit tidak menunjukkan adanya pembentukan ikatan baru. Namun terdapat perubahan serapan OH dan Fe-O dengan puncak yang lemah yang menandakan adanya senyawa pirazolon dan nanomagnetit pada komposit.
Kondisi Optimum Adsorpsi Cd(II)
22
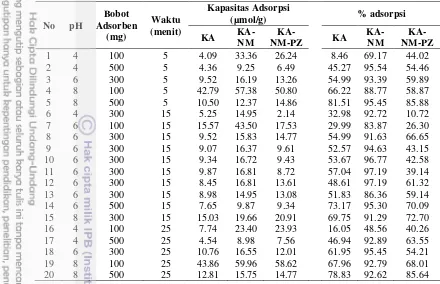
Tabel 3 Kapasitas adsorpsi dan persen adsorpsi KA, KA-NM, dan KA-NM-PZ pada ragam pH, bobot adsorben, dan waktu
No pH
Persen adsorpsi KA, KA-NM, dan KA-NM-PZ berturut-turut adalah berkisar antara 9-82 %, 49-97%, dan 11-86% (Tabel 3). Hal ini menunjukkan bahwa KA yang telah dikompositkan dengan NM mempunyai kemampuan mengadsorpsi yang lebih besar dibandingkan dengan yang tidak terkomposit. Namun setelah dikompositkan lagi dengan pirazolon persentase adsorpsi adsorben menurun. Hal ini diduga karena situs aktif permukaan KA-NM terlindungi oleh senyawa pirazolon. Akan tetapi pada suasana basa, adsorben KA-NM-PZ dapat menghasilkan persen adsorpsi mencapai 86% karena senyawa pirazolon stabil dalam bentuk keto sehingga muatan parsial negatif dari atom oksigen gugus karbonil senyawa pirazolon (Gambar 2 halaman 5) dapat berikatan langsung dengan logam. Sedangkan pada kondisi asam, senyawa pirazolon lebih mudah mengambil hidrogen α sebagai proton (Hart 2003) sehingga senyawa pirazolon sulit membentuk kompleks dengan logam.
23
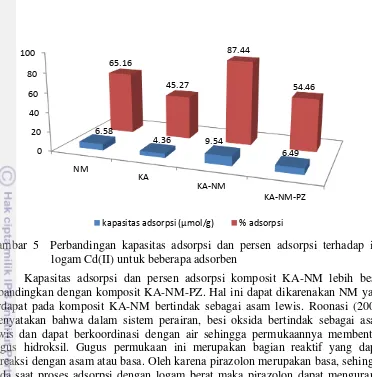
Gambar 5 Perbandingan kapasitas adsorpsi dan persen adsorpsi terhadap ion logam Cd(II) untuk beberapa adsorben
Kapasitas adsorpsi dan persen adsorpsi komposit KA-NM lebih besar dibandingkan dengan komposit KA-NM-PZ. Hal ini dapat dikarenakan NM yang terdapat pada komposit KA-NM bertindak sebagai asam lewis. Roonasi (2007) menyatakan bahwa dalam sistem perairan, besi oksida bertindak sebagai asam lewis dan dapat berkoordinasi dengan air sehingga permukaannya membentuk gugus hidroksil. Gugus permukaan ini merupakan bagian reaktif yang dapat bereaksi dengan asam atau basa. Oleh karena pirazolon merupakan basa, sehingga pada saat proses adsorpsi dengan logam berat maka pirazolon dapat mengurangi situs aktif yang terdapat pada KA-NM. Buhani et al. (2006) menyatakan bahwa proses imobilisasi selain dapat meningkatkan situs aktif permukaan adsorben juga dapat mengurangi situs aktif.
Kontur plot persen adsorpsi dapat memberikan gambaran kisaran kondisi optimum percobaan adsorpsi yang telah dilakukan. Persen adsorpsi pada kondisi optimum ditunjukkan dengan warna hijau paling gelap pada kontur plot. Kondisi optimum dari hasil pengolahan data menggunakan CCD untuk KA diperoleh pada pH 6, bobot adsorben 500 mg, dan waktu kontak 25 menit. Bobot dan pH optimum sesuai dengan yang dilakukan oleh Narin et al. (2000) menggunakan metode konvensional pada adsorpsi logam Cd dengan KA. Sedangkan untuk KA-NM diperoleh kondisi optimum masing-masing pada pH 4, waktu kontak 5 menit, bobot adsorben 500 mg dan KA-NM-PZ pada pH 8, waktu kontak 25 menit, bobot adsorben 500 mg. Gambar 6(a) menunjukkan kontur plot untuk KA pada kondisi optimum. Sedangkan kontur plot untuk KA-NM dan KA-NM-PZ masing-masing ditunjukkan pada Gambar 6(b) dan 6(c).
24
Contour Plot of % Adsorpsi vs bobot, pH
pH Contour Plot of % Adsorpsi vs waktu, pH
bobot
Contour Plot of % Adsorpsi vs waktu, bobot
pH
Contour Plot of % Adsorpsi vs bobot, pH
pH
Contour Plot of % Adsorpsi vs waktu, pH
bobot
Contour Plot of % Adsorpsi vs waktu, bobot
pH
Contour Plot of % Adsorpsi vs bobot, pH
pH
Contour Plot of % Adsorpsi vs waktu, pH
bobot
Contour Plot of % Adsorpsi vs waktu, bobot
Gambar 6 Kontur plot persen adsorpsi Cd(II) oleh KA (a), NM (b), dan KA-NM-PZ (c) pada ragam pH, waktu, dan bobot adsorben
Penentuan kondisi optimum menggunakan RSM adalah untuk memperhatikan hubungan antara variabel terhadap respon yang dapat dilihat pada estimasi koefisien regresi (Lampiran 11). Persen adsorpsi merupakan respon yang digunakan pada proses pengolahan terhadap pengaruh tiap variabel. Nilai P mengindikasikan pengaruh tiap variabel dan interaksi antar variabel terhadap respon persen adsorpsi dengan nilai P<0.05. Hasil analisis menunjukkan bahwa variabel yang memberikan pengaruh terhadap respon adalah pH dan bobot adorben untuk ketiga adsorben. Sedangkan variabel waktu tidak memberikan pengaruh secara signifikan terhadap persen adsorpsi. Hal ini ditunjukkan dengan nilai P pada variabel pH yaitu 0.000, 0.007, dan 0.004 masing-masing untuk adsorben KA, KA-NM, dan KA-NM-PZ. Variabel bobot adsorben memberikan nilai P sebesar 0.000, 0.001, dan 0.016 serta sebesar 0.343, 0.305, 0.842 pada variabel waktu masing-masing untuk adsorben KA, KA-NM, dan KA-NM-PZ. a)
b)
25 Kesesuaian antara model dengan data pada proses adsorpsi dapat digunakan hasil analisis ragam (ANOVA) yang juga dapat dilihat pada Lampiran 11. Azari et al. (2015) menyatakan bahwa kesesuaian model dapat dilihat dari nilai Lack-of-Fit
(LoF) pada hasil analisis ragam dengan nilai P LoF>0.05 dan nilai koefisien determinasi (R2). Hasil analisis menunjukkan bahwa model yang digunakan signifikan yang menunujukkan nilai p LoF sebesar 0.057, 0.149, dan 0.317 masing-masinguntuk adsorben KA, KA-NM, dan KA-NM-PZ. Nilai R2 dari hasil analisis untuk ketiga adsorben sebesar 0.97, 0.87, dan 0.73 masing-masing untuk adsorben KA, KA-NM, dan KA-NM-PZ.
Isoterm Adsorpsi
Isoterm adsorpsi dapat mendeskripsikan interaksi yang terjadi antara adsorben dengan adsorbat serta mengidentifikasi kondisi keseimbangan, kapasitas adsorpsi maksimum dan hubungan antara konsentrasi adsorbat dengan adsorben (Gurgel et al. 2008; Mahmoud et al. 2012,2015). Isoterm adsorpsi pada kondisi optimum tiap adsorben ditentukan pada suhu ruang dengan variasi konsentrasi awal adsorbat 10-50 mg/L. Kapasitas adsorpsi serta persen adsorpsi yang diperoleh dapat dilihat pada Tabel 4.
Tabel 4 Persen adsorpsi dan kapasitas adsorpsi adsorben KA, NM, dan KA-NM-PZ
[Cd(II)] (mg/L)
% Adsorpsi Kapasitas Adsorpsi (µmol/g) KAa KA-akondisi optimum KA pada pH 6, bobot 500 mg, waktu 25 menit
bkondisi optimum KA-NM pada pH 4, bobot 500 mg, waktu 5 menit ckondisi optimum KA-NM-PZ pada pH 8, bobot 500 mg, waktu 25 menit
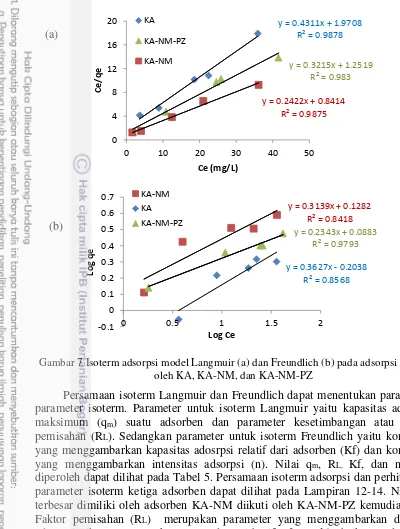
Data hasil percobaan isoterm adsorpsi Cd(II) menggunakan adsorben KA, KA-NM, dan KA-NM-PZ dianalisis dengan model isoterm Langmuir dan Freundlich. Model isoterm yang diperoleh untuk ketiga adsorben adalah model isoterm Langmuir. Hal ini dapat dilihat pada nilai R2 pada persamaan garis tiap
model isoterm. Model isoterm yang dipilih adalah model isoterm dengan nilai R2
26
Gambar 7 Isoterm adsorpsi model Langmuir (a) dan Freundlich (b) pada adsorpsi Cd(II) oleh KA, KA-NM, dan KA-NM-PZ
Persamaan isoterm Langmuir dan Freundlich dapat menentukan parameter-parameter isoterm. Parameter untuk isoterm Langmuir yaitu kapasitas adsorpsi maksimum (qm) suatu adsorben dan parameter kesetimbangan atau faktor
pemisahan (RL). Sedangkan parameter untuk isoterm Freundlich yaitu konstanta
yang menggambarkan kapasitas adosrpsi relatif dari adsorben (Kf) dan konstanta yang menggambarkan intensitas adsorpsi (n). Nilai qm, RL, Kf, dan n yang
diperoleh dapat dilihat pada Tabel 5. Persamaan isoterm adsorpsi dan perhitungan parameter isoterm ketiga adsorben dapat dilihat pada Lampiran 12-14. Nilai qm
terbesar dimiliki oleh adsorben KA-NM diikuti oleh KA-NM-PZ kemudian KA. Faktor pemisahan (RL) merupakan parameter yang menggambarkan dimensi
adsorpsi. Jika 0<RL<1 maka proses adsorpsi besifat favorable (baik). Berdasarkan
nilai RL yang diperoleh diperoleh menunjukkan bahwa proses adsorpsi ketiga
adsorben bersifat baik yang menunjukkan proses adsorpsi relatif tinggi pada adsorben terjadi pada konsentrasi rendah.
Tabel 5 Parameter isoterm Langmuir dan Freundlich
Adsorben Langmuir Freundlich
27 Parameter isoterm Freundlich meliputi nilai n dan Kf. Nilai n memiliki arti
jika nilai n berada pada rentang 1-10 menunjukkan bahwa proses adsorpsi
favorable (Fan et al. 2008). Sedangkan Kf merupakan kapasitas adsorpsi relatif
adsorben. Sehingga dapat dikatakan bahwa ketiga adsorben menunjukkan proses adsorpsi favorable.
Komposit KA-NM pada penelitian ini menghasilkan kapasitas adsorpsi maksimum lebih besar dibandingkan dengan karbon aktif. Hal ini berbanding terbalik dengan komposit karbon aktif-magnetit yang telah disintesis menggunakan metode kopresipitasi oleh beberapa peneliti yaitu Oliveira et al.
(2002), Kwon et al. (2014), Mahmoud et al. (2015), dan Han et al. (2015) yang menghasilkan kapasitas adsorpsi lebih kecil dibandingkan dengan karbon aktif yang belum terkomposit magnetit. Kapasitas adsorpsi komposit yang lebih rendah dibandingkan dengan karbon aktif yang belum terkomposit kemungkinan dikarenakan luas permukaan yang kecil dari besi oksida yang dapat menurunkan luas permukaan total dari material sekitar 30% (Oliveira et al. 2002).
Pengaruh Ion Logam Cu(II) dan Pb(II)
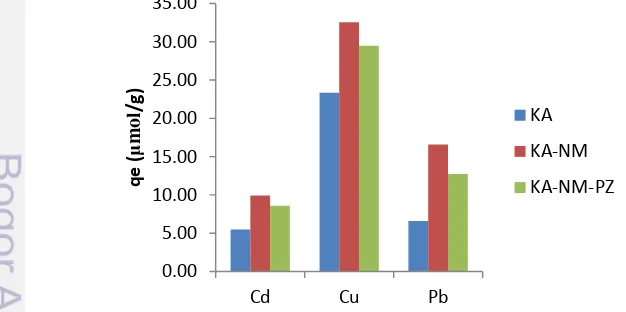
Ion logam berat yang sering berada dalam perairan yang tercemar selain logam Cd adalah logam Cu dan Pb. Oleh karena itu, pengaruh ion logam Cu dan Pb dilakukan dalam penelitian ini untuk mengetahui seberapa besar kapasitas adsorpsi Cd(II), Cu(II), dan Pb(II) dalam campurannya oleh ketiga adsorben sehingga dapat diketahui selektifitas dari adsorben. Kapasitas adsorpsi Cd(II), Cu(II), dan Pb(II) oleh ketiga adsorben dapat dilihat pada Gambar 8. Kapasitas adsorpsi ion logam Cu(II) oleh ketiga adsorben lebih tinggi dibandingkan dengan Cd(II) dan Pb(II). Tingginya kapasitas adsorpsi Cu(II) dapat dijelaskan karena Cu(II) bersifat lebih elektronegatif dibandingkan kedua ion logam Cd(II) dan Pb(II). Oleh karena itu, Cu(II) lebih mudah menarik pasangan elektron bebas dari adsorben. Nilai keelektronegatifan menurut estimasi skala Pauling yaitu Cu(II)>Pb(II)>Cd(II) dengan nilai keelektronegatifan sebesar 2.00, 1.87, dan 1.69 (Huheey et al. 1993). Allen dan Brown (1995) menyatakan bahwa semakin elektronegatif ion logam maka ion logam tersebut semakin tertarik ke permukaan adsorben.
Gambar 8 Pengaruh ion logam Cu(II) dan Pb(II) pada kapasitas adsorpsi Cd(II)
28
Keberadaan ion logam Cu(II) dan Pb(II) mempengaruhi efisiensi dan kapasitas adsorpsi ketiga adsorben terhadap ion logam Cd(II). Adanya ion logam Cu(II) dan Pb(II) menurunkan kapasitas adsorpsi ketiga adsorben terhadap ion logam Cd(II). Nilai kapasitas adsorpsi terhadap ion logam Cd(II) tunggal pada konsentrasi 50 mg/L sebesar 17.79, 34.61, dan 26.60 µmol/g masing-masing untuk adsorben KA, KA-NM, dan KA-NM-PZ (Tabel 4). Sedangkan nilai kapasitas adsorpsi terhadap ion logam Cd(II) dalam campurannya sebesar 5.50, 9.92, dan 8.58 µmol/g masing-masing untuk adsorben KA, NM, dan KA-NM-PZ. Sehingga dari hasil perhitungan (Lampiran 15), adsorben KA mengalami penurunan kapasitas adsorpsi terhadap logam Cd(II) sebesar ±69%. Sedangkan komposit KA-NM dan KA-NM-PZ mengalami penurunan masing-masing sebesar ±71% dan ±68%.
5
SIMPULAN DAN SARAN
SIMPULAN
Kapasitas adsorpsi terhadap ion logam Cd(II) dari komposit karbon nanomagnetit-pirazolon lebih rendah dibandingkan dengan komposit karbon aktif-nanomagneit namun lebih tinggi dibandingan dengan karbon aktif. Kapasitas adsorpsi maksimum karbon aktif, komposit karbon aktif-nanomagnetit, dan komposit karbon aktif-nanomagnetit-pirazolon masing-masing sebesar 20.64, 36.73, dan 27.67 µmol/g. Model isoterm ketiga adsorben mengikuti model isoterm Langmuir. Adsorben karbon aktif, karbon nanomagnetit, dan karbon aktif-nanomagnetit-pirazolon tidak menunjukkan sebagai adsorben yang selektif terhadap adsorpsi ion kadmium ketika bercampur dengan ion logam Cu(II) dan Pb(II).
SARAN
29
DAFTAR PUSTAKA
Akama Y, Tong A, Matsumoto N, Ikeda I, Tanaka S. 1996. Raman spectroscopic studies on keto-enol tautomers of 1-phenyl-3-methyl-4-benzoyl-5-pyrazolone. Vibrational spectroscopy. 13:113-115.
Allen SJ, Brown PA. 1995. Isotherm analyses for single component and
multi-component metal sorption onto lignite. J chem technol biotechnol.
62(1):17-24.
Atkins P, Paula JD. 2006. Physical chemistry, eight edition.New York (US) : Oxford
University Press
Azari A, Kakavandi B, Kalantary RR, Ahmadi E, Gholami M, Torkshavand Z, Azizi M. 2015. Rapid and efficient magnetically removal of heavy metals by magnetite-activated carbon composite: a statistical design approach. J porous mater. Doi:10.1007/s10934-015-9983-z.
Basel BV. 1986. Kadmium in environment. Library of congress cataloging in publication data 50.doi:10.1007/978-3-0348-7238-6.
Bou-Maroun E, Chebib H, Leroy MJF, Boos A, Goetz-Grandmont GJ. 2006. Solvent extraction of lanthanum(III), europium(III) and lutetium(III) by bis(4-acyl-5-hydroxypyrazoles) derivatives. Separation and purification technology. 50:220-228.doi:10.1016/j.seppur.2005.11.029.
Buhani, Suharso, Sembiring Z. 2006. Biosorption of metal ions Pb(II), Cu(II), and Cd(II) on sargassum duplicatum immobilized silica gel matrix. Indo J chem. 6(3):245-250.
Cheng W, Tang K, Qi Y, Sheng J, Liu Z. 2010. One-step synthesis of superparamagnetic monodisperse porous Fe3O4 hollow and core-shell
spheres. J mater chem. 20:1799-1805.doi:10.1039/b919164j.
Dave PN, Chopda LV. 2014. Application of iron oxide nanomaterials for the removal of heavy metals. Hindawi. Doi:10.1155/2014/398569.
Ekekwe ND, Arinze AJ, Nnanna LA, Ukpabi CF, Agwu A, Ogwuegbu MOC. 2012. Synthesis, complexation and characterization of 1-phenyl-3-methyl-4-(p-nitrobenzoyl) pyrazolone-5(HNPz) and its complexes of Barium(II), Strontium(II) and Zinc(II). AJC. 2(2):52-56. doi:10.5923/j.chemistry.20120202.10.
[EPA] Environtmental Protection Agency (US). 2012. Edition of the drinking water standards and health advisories
Fan T, Liu Y, Feng B, Zeng G, Yang C, Zhou M, Zhou H, Tan Z, Wang X. 2008. Biosorption of kadmium (II), zinc(II), and lead(II) by Penicillium simplicissimum: Isotherm, kinetics and thermodynamics. J of Hazardous Materials. 160:655-661.doi:10.1016/j.jhazmat.2008.03.038.
Ghassabzadeh H, Torab-Mostaedi M, Mohaddespour A, Maragheh MG, Ahmadi SJ, Zaheri P. 2010. Characterizations of Co (II) and Pb (II) removal from aqueous solution using expanded perlite. Desalination 262: 73-79.
Gurgel LVAG, Junior OK, Gil RPF, Gil LF. 2008. Adsorption of Cu(II), Cd(II), and Pb(II) from aqueous single metal solutions by cellulose and mercerized cellulose chemically modified with succinic anhydride.
30
Hamzah B, Jalaluddin N, Wahab AW, Upe A. 2011. Pengaruh ion kadmium(II) dan nikel(II) pada ekstraksi ion tembaga(II) dengan ekstraktan 4-benzoil-1-fenil-3-metil-2-pirazolin-5-on menggunakan emulsi membran cair.
Jurnal natur Indonesia. 13(3):269-275.
Han Z, Sani B, Mrozik W, Obst M, Beckingham B, Karapanagioti HK, Werner D. 2015. Magnetite impregnation effects on the sorbent properties of activated carbons and biochars. Water research. 70:394-403.doi:10.1016/j.watres.2014.12.016.
Hart H, Craine LE, Hart DJ. 2003. Kimia Organik. Suatu Kuliah Singkat. Achmadi SS, penerjemah; Safitri A, editor. Jakarta (ID): Penerbit Erlangga. Terjemahan dari : Organic Chemsitry. A Short Course. Ed ke-11.
Huheey JE, Keiter EA, Keiter RL. 1993. Inorganic chemistry principles of structure
and reactivity. America (US): HarperCollins
Ihesinachi KA, Augustus UB, John CU. 2011. Extraction of Molybdenum (VI) with 4-adipoyl and 4-sebacoyl derivatives of bis(1-phenyl-3-methylpyrazolone-5) in acid media. Nature and science. 9 (3).
Jang JH, Lim HB. 2010. Characterization and analytical application of surface modified magnetic nanoparticles. Microchem J. 94:148-158. doi:10.1016/j.microc.2009.10.011.
Jia YF, Thomas KM. 2000. Adsorption of cadmium ions on oxygen surface sites in activated carbon. Langmuir. 16:1114-1122.doi:10.1021/la990436w. Klug H. P, Alexander E. 1974. X-Ray Diffraction Procedure, Monroe (ed). Jhon
Willey & Sons, New York.
Koumanova B, Antova PP. 2002. Adsorptionof p-chlorophenol from aqueoussolution on bentonite and perlite. J of Hazardous Materials.
90:229-234.
Kwon JH, Wilson LD, Sammynaiken R. 2014. Synthesis and characterization of magnetite and activated carbonbinary composites. Synthetic metals. 197:8-17.doi: http://dx.doi.org/10.1016/j.synthmet.2014.08.010.
Lakov L, Vassileva P, Peshev O. 1998. Sorption of heavy metals on pyrazolone-containing carbon sorbents. Carbon. 37:1655-1657.
Lu X, Jiang J, Sun K, Wang J, Zhang Y. 2014. Influence of the pore structure and surface chemical properties of activated carbon on the adsorption of mercury from aqueous solutions. Marine Pollution Bull. 78:69-76.doi:10.1016/j.marpolbul.2013.11.007.
Lyles BF, Terrot MS, Hammond PT, Gast AP. 2004. Directed patterned adsorption of magnetic beads on polyelectrolyte multilayers on glass.
Langmuir. 20:3028-3031.doi:10.1021/1a049486d.
Machida M, Fotoohi Y, Amamo Y, Ohba T, Kanoh H. 2012. Kadmium (II) adsorption using functional mesoporous silica and activated carbon. J of
Hazardous Materials. 221-222 : 220-227.
doi:10.1016/j.jhazmat.2012.04.039.
31 Mahmoud ME, Ahmed SB, Osman MM, Abdel-Fattah TM. 2015. A novel composite of nanomagnetite-immobilized-baker’s yeast on the surface of activated carbon for magnetik solid phase extraction of Hg (II). Fuel.
139:614-621.doi:10.1016/j.fuel.2014.09.002.
Marsh H, Rodriguez-Reinoso F. 2006. Activated carbon. University of Alicante (ES): Elsevier Science & Technology Books.
Narin I, Soylak M, Elci L, Dogan M. 2000. Determination of trace metal ions by AAS in natural water samples after preconcentration of pyrocatechol violet complexes on an activated carbon column. Talanta. 52:1041-1046.
Oliva A, Molinari A, Zuniga F, Ponce P. 2002. Studies on the liquid-liquid extraction of nickel(II), zinc(II), cadmium(II), mercury(II) and lead(II) with 1-phenyl-3-hydroxy-4-dodecyldithiocarboxylate-5-pyrazolone.
Microchim acta. 140:201-203.doi:10.1007/s00604-002-0905-9.
Oliveira LCA, Rios RVRA, Fabris JD, Garg V, Sapag K, Lago RM. 2002. Activated carbon/iron oxide magnetic composites for the adsorption of contaminants in water. Carbon. 40:2177-2183.
Pavia DL, Lampman GM, Kriz GS. 2001. Introduction to spectroscopy a guide for students of organic chemistry. Washington (US): Thomson learning. Roonasi P. 2007. Adsorption and surface reaction properties of synthesized
magnetite nano-particles. Licentiate thesis. 67.ISSN:1402-1757.
Subramanyam B, Das A. 2009. Linearized and non-linearized isotherm models comparative study on adsorption of aqueous phenol solution in soil. Int. J. Environ Sci Tech. 6(4):633-640.
Sudarmaji, Mukono J, IP Corie. 2006. Toksikologi Logam Berat B3 dan Dampaknya terhadap Kesehatan. J Kesehatan Lingkungan. 2(2):129-142. Todorova O, Vassileva P, Lakov L. 1993. Synthesis and characterization of
inorganic sorbents containing pyrazolone. Fresenius journal of analytical chemistry. 346:943-946.doi:10.1007/BF00322755.
Waldron RD. 1955. Infrared spectra of ferrites. Phys rev. 99:1727-1735.
Walkees MP. 2003. Cadmium carcinogenesis. Mutation. 533:107-120.doi:10.1016/j.mrfmmm.2003.07.011.
[WHO] World Health Organization. 2011. Cadmium in drinking-water
Xu JK, Zhang FF, Sun JJ, Sheng J, Wang F, Sun M. 2014. Bio and nanomaterilas based on Fe3O4. Molecules. 19:21506-21528.
doi:10.3390/molecules191221506.
Zach-Maor A, Seminat R, Shemer H. 2012. Removal of heavy metals by immobilized magnetite nano-particles. Desalination and water treatment.
32
33 Lampiran 1 Diagram alir penelitian
Penentuan kondisi optimum percobaan adsorpsi
Penentuan isoterm adsorpsi
Karbon Akif Nanomagnetit
Komposit KA-NM-Pirazolon
Komposit KA-NM Karakterisasi
XRD dan FTIR
Sintesis dengan metode hidrotermal
Karakterisasi FTIR
Uji Adsorpsi
Pirazolon
(1-fenil-3-metil-5-pirazolon) Natrium Sitrat
FeCl3.6H2O Urea
- Sintesis dengan metode hidrotermal
Penentuan pengaruh ion logam Cu(II) dan Pb(II) Variabel pH,
34
Lampiran 2 Kurva kalibrasi Kurva kalibrasi logam Cd(II)
NO Sampel Konsentrasi Absorbansi pH 4 pH 6 pH 8
35 Lanjutan Lampiran 2
Kurva kalibrasi logam Pb(II)
NO Sampel Konsentrasi Absorbansi pH 4 pH 6 pH 8 1 Standar 1 0.5 0.0073 0.008 0.007 2 Standar 2 1 0.0159 0.019 0.013 3 Standar 3 2 0.0399 0.045 0.024 4 Standar 4 4 0.0861 0.086 0.038 5 Standar 5 6 0.1310 0.130 0.050 6 Standar 6 8 0.1739 0.173 0.051 7 Standar 7 10 0.2337 0.235 0.055
y = 0.0232x - 0.0049 R² = 0.9963
y = 0.0234x - 0.0072 R² = 0.9978
y = 0.0051x + 0.0111 R² = 0.904
0 0.05 0.1 0.15 0.2 0.25
0 2 4 6 8 10 12
Abso
rbansi
Konsentrasi (mg/L)
36
Lampiran 3 Data analisis gugus fungsi menggunakan FTIR Analisis gugus fungsi karbon aktif (KA)
37 Lanjutan Lampiran 3
Analisis gugus fungsi pirazolon
38
Lanjutan Lampiran 3
40
Lampiran 5 Data hasil analisis XRD perhitungan kristalinitas NM
42
Lampiran 7 Penentuan pola h2+k2+l2 NM hasil sintesis
s = h2+k2+l2
d = sinθnλ Keterangan :
d = jarak antar bidang pendifraksi
= x . x . λ = panjang gelombang (Å)
θ = sudut payaran, misalnya 9,11910
43 Lampiran 8 Penentuan ukuran kristal NM hasil sintesis
2θ θ Cos θ FWHM(deg) W (rad) ukuran (nm)
18.2382 9.1191 0.9874 0.1600 0.0028 50.3129 35.3533 17.6767 0.9528 0.2611 0.0046 31.9502 36.9876 18.4938 0.9484 0.1500 0.0026 55.8742 42.9813 21.4907 0.9305 0.2250 0.0039 37.9653 53.3093 26.6547 0.8937 0.2300 0.0040 38.6672 56.8097 28.4049 0.8796 0.2267 0.0040 39.8597 62.4315 31.2158 0.8552 0.4066 0.0071 22.8575
Rata-rata 39.6410
Contoh perhitungan:
Ukuran kristal berdasarkan hukum Debye Scherer:
Untuk 2θ pertama
D = � �
� � � �=
, � ,
, � , = 50.3129 nm
Keterangan:
D : ukuran kristal (nm)
K : konstanta (0.9)
λ : panjang gelombang sinar-X (0.15406 nm)
44
Lampiran 9 Penentuan pola h2+k2+l2 komposit KA-NM
s = h2+k2+l2
d = sinθnλ Keterangan :
d = jarak antar bidang pendifraksi
= x . x . λ = panjang gelombang (Å)
θ = sudut payaran, misalnya 15.04950
45 Lampiran 10 Penentuan ukuran kristal komposit KA-NM hasil sintesis
2θ θ Cos θ FWHM(deg) W (rad) ukuran (nm)
30.0989 15.0495 0.9657 0.1400 0.0024 58.7901 35.4454 17.7227 0.9525 0.3600 0.0063 23.1787 43.1188 21.5594 0.9300 0.4367 0.0076 19.5700 53.4943 26.7472 0.8930 0.3400 0.0059 26.1785 57.0281 28.5141 0.8787 0.3400 0.0059 26.6045 62.6514 31.3257 0.8542 0.3400 0.0059 27.3668
Rata-rata 30.2814
Contoh perhitungan:
Ukuran kristal berdasarkan hukum Debye Scherer: Untuk 2θ pertama
D = � �
� � � � =
, � ,
, � , = 58.7901 nm
Keterangan:
D : ukuran kristal (nm) K : konstanta (0.9)
λ : panjang gelombang sinar-X (0.15406 nm)
46
Lampiran 11 Data hasil estimasi koefisien regresi dan analisis ragam pengolahan CCD menggunakan minitab
Estimasi koefisien regresi dan analisis ragam karbon aktif
Estimated Regression Coefficients for % Adsorpsi
Term Coef SE Coef T P
Analysis of Variance for % Adsorpsi
Source DF Seq SS Adj SS Adj MS F P
Estimasi koefisien regresi dan analisis ragam komposit karbon aktif - nanomagnetit
Estimated Regression Coefficients for % Adsorpsi
47 Lanjutan Lampiran 11
Analysis of Variance for % Adsorpsi
Source DF Seq SS Adj SS Adj MS F P
Estimasi koefisien regresi dan analisis ragam karbon aktif-nanomagnetit-pirazolon
Estimated Regression Coefficients for % Adsorpsi
Term Coef SE Coef T P
Analysis of Variance for % Adsorpsi
48
Lampiran 12 Data hasil analisis isoterm Langmuir dan Freundlich adsorpsi Cd(II) oleh KA
Ce Co qe Ce/qe log Ce log qe
Persamaan regresi linear
Langmuir Freundlich
3.6399 12.4443 0.8804 4.1342 0.5611 -0.0553
y = 0.4311x + 1.9708 R² = 0.9878
y = 0.3627x - 0.2038 R² = 0.8568 8.8558 25.3340 1.6478 5.3742 0.9472 0.2169
18.5851 36.8791 1.8294 10.1592 1.2692 0.2623
22.4392 43.1655 2.0726 10.8264 1.3510 0.3165
35.8684 55.9096 2.0041 17.8974 1.5547 0.3019
Keterangan : Ce = konsentrasi adsorbat dalam kesetimbangan (mg/L); Co = konsentrasi awal ion logam dalam larutan (mg/L); qe = konsentrasi adsorbat didalam adsorben pada kondisi kesetimbangan atau kapasitas adsorpsi (mg/g)
Langmuir :
y = 0.4311 x + 1.9708 ≈ ��
��= ��� +���
��= . → = . = 2.3196 mg/g =
. .
= 20.64 µmol/g
���= . → = . ��= . � . = . = . / �
� = + � = + . . = + . = . = .
Freundlich :
y = 0.3627x – 0.2038 ≈ Log = �� + � → n = 1/0.3627 = 2.7571 Log Kf = -0.2038 → Kf = antLog -0.2038 = 0.6255
Keterangan :
qm = kapasitas adsorpsi maksimum
49 Lampiran 13 Data hasil analisis isoterm Langmuir dan Freundlich adsorpsi Cd(II)
oleh KA-NM
Ce Co qe Ce/qe log Ce log qe
Persamaan regresi linear
Langmuir Freundlich
1.6244 14.5323 1.2908 1.2585 0.2107 0.1109
y = 0.2422x + 0.8414 R² = 0.9875
y = 0.3139x + 0.1282 R² = 0.8418 3.9918 30.5798 2.6588 1.5014 0.6012 0.4247
12.4272 44.8281 3.2401 3.8354 1.0944 0.5106
20.9936 53.0594 3.2066 6.5470 1.3221 0.5060
36.1014 75.0874 3.8986 9.2601 1.5575 0.5909
Keterangan : Ce = konsentrasi adsorbat dalam kesetimbangan (mg/L); Co = konsentrasi awal ion logam dalam larutan (mg/L); qe = konsentrasi adsorbat didalam adsorben pada kondisi kesetimbangan atau kapasitas adsorpsi (mg/g)
Langmuir :
y = 0.2422 x + 0.8414 ≈ ��
�� =��� +���
��= . → = . = 4.1288 mg/g =
. .
= 36.73 µmol/g
���= . → = . ��= . � . = . = . / �
� = + � = + . . = + . = . = .
Freundlich :