AKTIVITAS FITASE BEBERAPA KAPANG DAN
FORMULASI MEDIA FERMENTASI PADAT
CAROLINE OKTAVIANI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Aktivitas Fitase Beberapa Kapang dan Formulasi Media Fermentasi Padat adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Caroline Oktaviani
ABSTRAK
CAROLINE OKTAVIANI. Aktivitas Fitase Beberapa Kapang dan Formulasi Media Fermentasi Padat. Dibimbing oleh MARIA BINTANG dan I MADE SUDIANA.
Fitase (EC 3. 1. 3. 8) adalah enzim yang dapat memecah senyawa fitat menjadi mio-inositol dan fosfor anorganik (asam fosfat). Fitase terdapat dalam biji-bijian dan pada mikroba. Aktivitas fitase dipengaruhi oleh jenis kapang, substrat, pH, nutrisi dalam media, kadar air, dan suhu inkubasi. Tujuan penelitian ini adalah melakukan seleksi kapang penghasil aktivitas fitase tertinggi serta menentukan kondisi optimum enzim fitase dari kapang melalui formulasi media menggunakan fermentasi fase padat. Berdasarkan penelitian ini Aspergillus niger
str3 dan Neurospora crassa merupakan kapang terbaik untuk aktivitas fitase. Ampas kelapa yang ditambahkan dedak dengan perbandingan 1:1 (b/b) adalah media terbaik untuk pertumbuhan kapang, dengan aktivitas fitase sebesar 60.030 U/mL untuk A. niger str3 dan 45.844 U/mL untuk N. crassa pada kondisi pH 6 dengan penambahan tepung tapioka sebanyak 20%.
Kata kunci: Fitase, Aspergillus niger, Neurospora crassa, dan Fermentasi Fase Padat
ABSTRACT
CAROLINE OKTAVIANI. Phytase Activity of Fungals and Media Formulation under Solid State Fermentation. Supervised by MARIA BINTANG and I MADE SUDIANA.
Phytase (EC 3. 1. 3. 8) hydrolize phytate into mio-inositol and inorganic
phosphorus (phosphoric acid). Phytase can be found in the grains and produced by microorganism. Phytase production is influenced by the type of fungi, substrate, pH, nutrients of media, moisture content, and incubation temperature. The aim of this research was to screen fungi that produce the highest phytase activity and determine the optimum conditions for production of phytase by fungi using media formulated media under solid state fermentation. Based on this research, Aspergillus niger str3 and Neurospora crassa were the phytase producing fungi. Cocunut cakes supplemented with rice brand at the ration of 1:1 w/w was the best substrate for growth of fungi, with the phytase activity of 60.030 U/mL for A. niger str3 and 45.844 U/mL for N.crassa with addition of 20 % tapioca at pH 6.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Departemen Ilmu Nutrisi dan Teknologi Pakan
AKTIVITAS FITASE BEBERAPA KAPANG DAN
FORMULASI MEDIA FERMENTASI FASE PADAT
CAROLINE OKTAVIANI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PRAKATA
Puji serta syukur penulis ucapkan pada Tuhan Yang Maha Esa atas penyertaan dan pimpinan serta hikmat yang sudah diberikan sehingga penulis mampu menyelesaikan penelitian ini dengan lancar. Skripsi yang berjudul “Aktivitas Fitase Beberapa Kapang dan Formulasi Media Fermentasi Padat” ini telah dilakukan sejak bulan Februari 2015 hingga April 2015 di Laboratorium Ekologi dan Fisiologi, Pusat Penelitian Biologi – LIPI Cibinong.
Terima kasih penulis ucapkan pada Ibu Prof drh Maria Bintang, MS dan Bapak Prof Dr I Made Sudiana, MSc atas segala bimbingan dan arahan selama penelitian dan penulisan hasil penelitian ini. Tidak lupa penulis ucapkan terima kasih kepada kedua orang tua, kakak, dan adik-adik terkasih atas doa dan dorongan semangat yang telah diberikan. Penulis juga mengucapkan terima kasih kepada teman-teman di laboratorium (Cepi, Rizka, Meli, Hasbi, dan Lastri), kepada sahabat dekat (Lisa, Kathi, Chelsea, Desi, Kak Liya, Cindy, Ray, Sinta, Hasfan, Alex, Renti, Hanna, Dheva, Flora, dan Jordan), keluarga Wisma Jenius, teman-teman PMK IPB, serta teman-teman Biokimia 48 terkasih atas doa serta semangat yang diberikan kepada penulis selama penelitian hingga penyusunan karya ilmiah ini.
Semoga hasil penelitian ini dapat berguna bagi ilmu pengetahuan khususnya dalam pengembangan dan penerapan ilmu biokimia.
Bogor, Agustus 2015
DAFTAR ISI
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
METODE 2
Tempat dan Waktu Penelitian 2
Bahan 2
Alat 2
Metode Penelitian 2
HASIL 4
PEMBAHASAN 8
SIMPULAN DAN SARAN 12
Simpulan 12
Saran 12
DAFTAR PUSTAKA 12
DAFTAR GAMBAR
1 Aktivitas fitase pada berbagai jenis kapang 4
2 Aktivitas fitase berdasarkan ukuran partikel media 5 3 Aktivitas fitase inokulan A. niger str3 pada berbagai jenis media
menggunakan fermentasi fase padat 6
4 Aktivitas fitase inokulan N. crassa pada berbagai jenis media
menggunakan fermentasi fase padat 6
5 Aktivitas fitase menggunakan kombinasi media 6
6 Aktivitas fitase inokulan A. niger str3 pada media formulasi dengan
kondisi pH 5 hingga 8 7
7 Aktivitas fitase inokulan N. crassa pada media formulasi dengan
kondisi pH 5 hingga 8 7
8 Aktivitas fitase inokulan A. niger str3 dengan penambahan tepung
tapioka dan tepung jagung 8
9 Aktivitas fitase inokulan N. crassa dengan penambahan tepung tapioka
dan tepung jagung 8
DAFTAR LAMPIRAN
1 Alur penelitian 15
2 Kurva standar fosfat 16
3 Hasil perhitungan aktivitas fitase pada berbagai jenis kapang 17 4 Hasil perhitungan aktivitas Fitase berdasarkan ukuran partikel media 19 5 Hasil perhitungan aktivitas fitase pada berbagai jenis media
menggunakan fermentasi fase padat 20
6 Hasil perhitungan aktivitas fitase menggunakan kombinasi media 24 7 Hasil perhitungan aktivitas fitase pada media formulasi dengan kondisi
pH 5 hingga 8 25
8 Hasil perhitungan aktivitas fitase pada media formulasi dengan
penambahan tepung tapioka dan tepung jagung 26
9 Contoh perhitungan aktiivitas fitase pada jenis kapang Aspergillus niger
PENDAHULUAN
Serealia merupakan bahan pakan asal tanaman yang sering digunakan sebagai bahan pakan ternak monogastrik. Pada umumnya serealia seperti kedelai, jagung, dedak, dan gandum mengandung senyawa fitat (mioinositol heksakisfosfat) yang dapat mengikat mineral fosfor. Selain fosfor senyawa fitat juga mengikat mineral lain seperti Ca, Fe, Zn dan Mg, bahkan juga asam amino dan protein sehingga tidak dapat dimanfaatkan oleh ternak terutama ternak monogastrik (Vohra et al. 2011).
Ternak monogastrik seperti unggas, ikan, atau babi tidak mampu mendegradasi senyawa fitat yang mengikat fosfor dan mineral lainnya karena tidak adanya enzim fitase pada alat pencernaan sehingga menyebabkan rendahnya ketersediaan unsur fosfat bagi ternak. Rendahnya unsur fosfat dan mineral lainnya dalam tubuh ternak membuat produktivitas ternak menurun dan pertumbuhan ternak juga terhambat. Akibat buruk dari asam fitat dapat dikurangi dengan menambahkan enzim pemecah asam fitat seperti fitase ke dalam pakan ternak. Penambahan enzim fitase ini akan mengurangi aktivitas asam fitat dalam saluran pencernaan, sehingga bahan pakan lebih efisien untuk dicerna (Ravindran et al.
2000).
Fitase atau mioinositol heksakisfosfat fosfohidrolase (EC 3. 1. 3. 8) adalah enzim yang dapat menghidrolisis ikatan fosfoester pada asam fitat, menghasilkan fosfat anorganik dan ester fosfat (Mullaney dan Ullah 2003). Fitase terdapat di dalam tumbuhan dan mikroorganisme. Fitase dari mikroorganisme yang telah diteliti oleh para ahli antara lain: fitase dari Aspergillus niger (Nagashima 1999),
Aspergillus ficuum (Irving et al. 1972) Bacillus subtilis (Kerouvo et al. 2000),
Escherichia coli (Greiner et al. 1993), dan Klebsiella pneumonia (Sajidan et al. 2004).
Salah satu alternatif peningkatan mutu bahan pakan adalah teknik fermentasi secara substrat padat. Fermentasi dengan menggunakan kapang memungkinkan terjadinya perubahan komponen bahan yang sulit dicerna menjadi lebih tersedia, sehingga diharapkan pula nilai nutrisinya meningkat. Menurut Shrestha et al. (2008) melalui proses fermentasi kualitas gizi suatu bahan makanan dapat ditingkatkan, kandungan anti nutrisi dan toksin serta tingkat kontaminasinya dapat diturunkan.
Berdasarkan penelitian yang telah dilakukan pada pembuatan tempe kedelai, proses perendaman, perebusan, pengukusan, serta fermentasi berpengaruh terhadap kandungan asam fitat. Hasil penelitian Wyatt et al. (2008) terhadap kandungan asam fitat pada biji kedelai menunjukkan bahwa produk olahan kedelai tanpa fermentasi tetap mengandung asam fitat, sedangkan produk olahan kedelai dengan fermentasi dapat mengurangi, bahkan menghilangkan asam fitat.
2
(2000) fermentasi fase padat memiliki kelebihan dibandingkan jenis teknik fermentasi lainnya, yaitu fermentasi fase cair. Sistem fermentasi padat menghasilkan tingkat produktivitas yang lebih tinggi, biaya yang lebih murah, kebutuhan energi yang rendah, limbah yang dihasilkan sedikit, aerasi yang lebih mudah, media fermentasi yang digunakan lebih sederhana, serta kontaminasi yang lebih rendah.
Penelitian ini bertujuan melakukan seleksi kapang penghasil aktivitas fitase tertinggi serta menentukan kondisi optimum enzim fitase dari kapang melalui formulasi media menggunakan fermentasi fase padat. Manfaat penelitian ini adalah menghasilkan formulasi media dan kapang terbaik untuk produksi enzim fitase sehingga dapat diaplikasikan dalam meningkatkan kualitas pakan ternak.
METODE
Alat dan Bahan
Alat yang untuk preparasi dan inkubasi adalah autoklaf Tomy 5x-500,
laminar air flow cabinet Hitachi Clear Bench, cawan petri , dan inkubator Central Kagaku Corp CB-5, CB-L 30oC. Peralatan untuk analisis yaitu, sentrifugasi KOKUSAN H-15FR Pupick Fled, peralatan gelas Pyrex, spektrofotometer UV-Vis MAPADA V-1100D, kapas, plastik, alumunium foil, spatula, Shaker BR-3000LF, vortex SIBATA TTM-1, tabung eppendorf, pipet mikro 1000 µL dan 200 µL, tip 1000 µL dan 200 µL.
Bahan yang digunakan dalam penelitian ini kultur kapang Aspergillus niger str2 dan 3, Rhizopus oryzae, Neurospora crassa, Mucor circinelloides, dan
Trichoderma viridae koleksi dari Indonesian Culture Collection (InaCC) Biologi Cibinong. Bahan yang digunakan sebagai media adalah media Potato Dextrose Agar (PDA), glukosa, MgSO4, FeSO4, NaNO3, KCl, dan akuades. Bahan yang digunakan untuk keperluan analisis antara lain, kalsium fitat dan reagen campuran yang terdiri dari asam askorbat, kalium antimonil, asam sulfat, dan amonium molibdat.
Metode Penelitian
Penyiapan Inokulum dan Media
Media PDA digunakan sebagai media pertumbuhan kapang. Media dibuat dengan cara melarutkan 9.75 g PDA dalam 250 mL aquades. Aquades dipanaskan kemudian dimasukan media PDA sedikit demi sedikit sambil diaduk hingga larut sempurna. Media disterilkan dalam autoklaf suhu 121OC selama 15 menit. Sebanyak 10 mL media dituang ke dalam 12 cawan petri steril dan dibiarkan mengeras. Masing-masing media dalam cawan petri diinokulasikan miselium
3
Media kemudian dituang ke dalam 12 tabung reaksi besar masing-masing sebanyak 16 mL. Setiap media kemudian ditambahkan larutan kalsium fitat. Media dalam tabung reaksi besar diinokulasikan dengan mikroba yang sudah ditumbuhkan dalam media PDA, yaitu Aspergillus niger str 3, Aspergillus niger
str 2, Rhizopus oryzae, Trichoderma viridae, Mucor circinelloides, dan
Neurospora crassa. Masing-masing mikroba diinokulasi dalam tabung reaksi besar. Media berisi inokulan kemudian diinkubasi pada suhu 37.5oC selama 3 hari. Pemanenan enzim dilakukan setelah waktu inkubasi dan diuji aktivitas fitase. Percobaan dilakukan duplo.
Penentuan Aktivitas Fitase pada Berbagai Ukuran Partikel
Kacang kedelai dihancurkan kemudian disaring menggunakan saringan dengan ukuran 100 mesh dan 10 mesh. Sebanyak 80 g kacang kedelai yang telah disaring kemudian disterilkan pada suhu 121oC selama 15 menit. Masing-masing kacang kedelai steril yang telah disaring dimasukkan ke dalam plastik steril dan di ratakan kemudian diinokulasi dengan A. niger str3 atau N. crassa. Aquades steril 1:1 ditambahkan ke dalam media dan diinkubasi selama 3 hari. Percobaan dilakukan duplo. Pemanenan enzim dilakukan setelah waktu inkubasi dan diuji aktivitas fitase.
Seleksi Media Fermentasi
Media fermentasi yang digunakan dalam tahap ini adalah beras, gabah, dedak, kedelai, ampas kelapa dan jagung. Masing-masing substrat sebanyak 20 g disterilisasi dengan autoklaf suhu 121oC selama 15 menit. Media yang telah steril masing-masing diratakan pada plastik yang steril. Media fermentasi diinokulasikan dengan A. niger str3 dan N. crassa kemudian ditambahkan aquades steril 1:1 dan diinkubasi selama 3 hari. Pemanenan enzim dilakukan setelah waktu inkubasi dan diuji aktivitas fitase.
Formulasi Media
Kombinasi Media. Sebanyak 10 g ampas kelapa dicampurkan dengan dedak (1:1 b/b) kemudian disterilkan. Media dimasukkan ke dalam plastik steril dan diratakan kemudian diinokulasi dengan A. niger str3 dan N. crassa. Media ditambahkan aquades steril 1:1 dan diinkubasi selama 3 hari. Percobaan dilakukan duplo. Pemanenan enzim dilakukan setelah waktu inkubasi dan diuji aktivitas fitase.
Perlakuan pH. Sebanyak 10 g ampas kelapa dicampurkan dengan dedak (1:1 b/b) kemudian disterilkan. Media dimasukkan ke dalam plastik steril dan diratakan kemudian pH awal media ditepatkan menjadi pH 5, 6, 7, dan 8 menggunakan buffer asetat. Setelah itu media diinokulasi dengan A. niger str3 dan
N. crassa. Media ditambahkan aquades steril 1:1 dan diinkubasi selama 3 hari. Percobaan dilakukan duplo. Pemanenan enzim dilakukan setelah waktu inkubasi dan diuji aktivitas fitase.
4
dan N. crassa. Media ditambahkan aquades steril 1:1 dan diinkubasi selama 3 hari. Percobaan dilakukan duplo. Pemanenan enzim dilakukan setelah waktu inkubasi dan diuji aktivitas fitase.
Isolasi Enzim
Pemanenan enzim dalam media fermentasi dilakukan dengan mengambil sebanyak 1 g media dan diencerkan dengan 4 mL aquades. Selanjutnya dikocok dan disentrifugasi dengan kecepatan 8000 rpm selama 10 menit. Supernatan diambil untuk diuji aktivitas fitase.
Uji Aktivitas Fitase (APHA 1976)
Supernatan hasil sentrifugasi diambil sebanyak 50 µL dan ditambahkan kalsium fitat sebanyak 50 µL. Sampel diinkubasi selama 30 menit kemudian ditambah reagen campuran sebanyak 160 µL. Sampel diinkubasi 10-20 menit hingga timbul warna biru. Sampel diukur serapan menggunakan spektrofotometer
UV-Vis MAPADA V-1100D dengan λ= 880 nm.
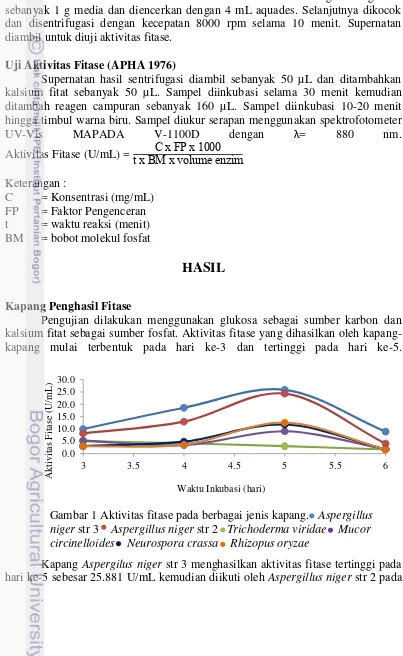
Pengujian dilakukan menggunakan glukosa sebagai sumber karbon dan kalsium fitat sebagai sumber fosfat. Aktivitas fitase yang dihasilkan oleh kapang-kapang mulai terbentuk pada hari ke-3 dan tertinggi pada hari ke-5.
Kapang Aspergilus niger str 3 menghasilkan aktivitas fitase tertinggi pada hari ke-5 sebesar 25.881 U/mL kemudian diikuti oleh Aspergillus niger str 2 pada
0.0
Gambar 1 Aktivitas fitase pada berbagai jenis kapang. Aspergillus niger str 3 Aspergillus niger str 2 Trichoderma viridae Mucor circinelloides Neurospora crassa Rhizopus oryzae
5
hari ke-5 sebesar 24.363 U/mL, Rhizophus oryzae pada hari ke-5 sebesar 12.548 U/mL, Neurospora crassa pada hari ke-5 sebesar 11.807 U/mL, Mucor circinlloides pada hari ke-5 sebesar 9.067 U/mL dan Trichoderma viride pada hari ke-3 sebesar 5.067 U/mL (Gambar 1). Selanjutnya kapang A. Niger Str 3 dan N. crassa dipilih sebagai inokulan untuk analisis aktivitas fitase.
Pengaruh Ukuran Partikel terhadap Aktivitas Fitase
Berdasarkan hasil seleksi kapang, selanjutnya A. niger str 3 dan N. crassa
digunakan sebagai inokulan untuk analisis aktivitas fitase. Kedua jenis kapang diinokulasikan pada media kedelai dengan ukuran partikel yang berbeda, yaitu 100 mesh (0,149 mm) dan 10 mesh (2 mm). Hasil yang ditunjukkan pada Gambar 2, ukuran partikel berpengaruh terhadap aktivitas fitase. Media kedelai dengan ukuran partikel 100 mesh yang diinokulasikan A. niger str 3 menghasilkan
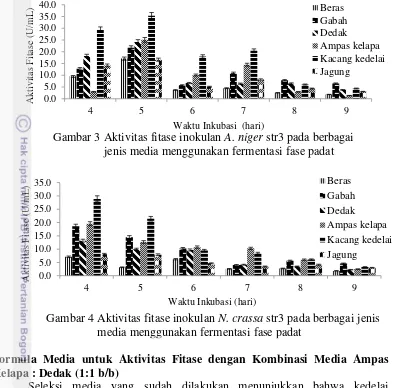
Setelah diperoleh ukuran partikel yang paling sesuai untuk aktivitas fitase, dilakukan seleksi media menggunakan fermentasi fase padat. Media yang digunakan adalah beras, gabah, dedak, ampas kelapa, kedelai, dan jagung. Pada Gambar 4 dan 5 terlihat bahwa kedelai merupakan media terbaik untuk menghasilkan aktivitas fitase tertinggi pada kedua jenis kapang (A. niger Str3, dan N. crassa ). Aktivitas fitase yang dihasilkan sebesar 35.289 U/mL untuk A. niger str 3 pada hari ke-5 dan 28.881 U/mL untuk N. crassa pada hari ke-4. Selanjutnya diikuti oleh ampas kelapa, dedak, gabah, jagung dan beras (Gambar.3 dan 4). Waktu optimum aktivitas fitase adalah sekitar 4-5 hari.
0.0
6
Formula Media untuk Aktivitas Fitase dengan Kombinasi Media Ampas Kelapa : Dedak (1:1 b/b)
Seleksi media yang sudah dilakukan menunjukkan bahwa kedelai merupakan media terbaik untuk pertumbuhan kapang penghasil fitase. Namun kedelai merupakan media yang mahal dan bersaing dengan pangan, oleh karena itu dilakukan formulasi media memanfaatkan kombinasi antara ampas kelapa dan dedak dengan perbandingan 1:1 (b/b). Aktivitas fitase yang dihasilkan dari kombinasi media ampas kelapa dan dedak ditunjukkan pada Gambar 5. Aktivitas fitase yang dihasilkan, yaitu 28.474 U/mL untuk Aspergillus niger str3 dan 27.659 U/mL untuk Neurospora crassa. Selanjutnya kombinasi media ini akan diberi perlakuan pH serta penambahan sumber karbon untuk meningkatkan aktivitas fitase.
Gambar 3 Aktivitas fitase inokulan A. niger str3 pada berbagai jenis media menggunakan fermentasi fase padat
Gambar 4 Aktivitas fitase inokulan N. crassa str3 pada berbagai jenis media menggunakan fermentasi fase padat
7
Formula Media dengan Perlakuan pH dan Penambahan Sumber Karbon Perlakuan pH
Setelah pengaruh jenis kapang, ukuran partikel media, dan jenis media diketahui, selanjutnya parameter-parameter tersebut digunakan sebagai standar untuk meningkatkan aktivitas fitase.
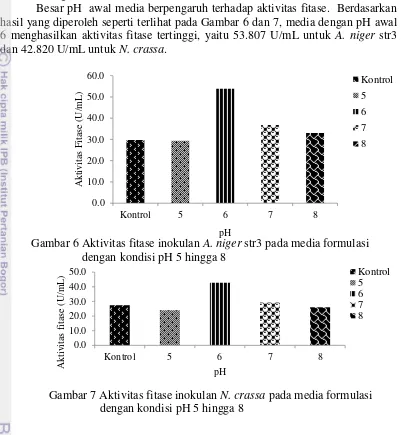
Besar pH awal media berpengaruh terhadap aktivitas fitase. Berdasarkan hasil yang diperoleh seperti terlihat pada Gambar 6 dan 7, media dengan pH awal 6 menghasilkan aktivitas fitase tertinggi, yaitu 53.807 U/mL untuk A. niger str3 dan 42.820 U/mL untuk N. crassa.
Penambahan Sumber Karbon
Selain pH, media juga diformulasi dengan penambahan sumber karbon. Penambahan sumber karbon tambahan bertujuan untuk mengetahui pengaruh penambahan karbon tambahan yaitu tepung tapioka dan tepung jagung terhadap aktivitas fitase. Tepung tapioka atau tepung jagung ditambahkan 20% pada media yang telah diformulasi sebelumnya, yaitu kombinasi antara ampas kelapa dan dedak dengan perbandingan 1:1 (b/b) dengan pH awal 6.
Hasil yang ditunjukkan pada Gambar 8 dan 9 penambahan sumber karbon meningkatkan aktivitas fitase dari A. niger str3 maupun N. crassa. Penambahan tepung tapioka 20% meningkatkan aktivitas fitase lebih tinggi dibandingkan tepung jagung. Fitase yang dihasilkan dari penambahan tepung tapioka 20% adalah 60.030 U/mL untuk A. niger str 3, sedangkan untuk N. crassa sebesar
Gambar 6 Aktivitas fitase inokulan A. niger str3 pada media formulasi dengan kondisi pH 5 hingga 8
8
45.844 U/mL. Fitase yang dihasilkan dari penambahan tepung jagung 20% adalah 58.770 U/mL untuk A. niger str 3, sedangkan untuk N. crassa sebesar 45.252 pada mikroba. Fitase pada biji-bijian menyerang gugus fosfat pada posisi nomor 6 dari asam fitat, sedangkan fitase yang terdapat pada mikroba pada posisi nomor 3 (Vats et al. 2009). Fitase pada mikroba dapat berasal dari bakteri maupun kapang. Beberapa mikroba yang diketahui memiliki aktivitas fitase diantaranya adalah
Enterobacter sp., Bacillus subtillis, Pseudomonas sp., Aspergillus, Mucor, dan
Rhizopus sp (Selle dan Ravindran 2007). Pada penelitian ini dilakukan seleksi pada beberapa kapang untuk mengetahui tingkat aktivitas fitase yang dihasilkan pada masing-masing kapang tersebut.
Kapang diseleksi menggunakan media glukosa yang mengandung kalsium fitat sebagai sumber fosfat. Berdasarkan hasil penelitian yang didapat, aktivitas fitase tertinggi dihasilkan oleh Aspergillus niger str3 pada hari kelima sebesar 25.881 U/mL kemudian diikuti oleh Aspergillus niger str2 sebesar 24.363 U/mL,
Rhizopus oryzae sebesar 12.548 U/mL, Neurospora crassa sebesar 11.807 U/mL,
Mucor circinelloides sebesar 9.067 U/mL, dan Trichoderma viridae sebesar 3.030
48.0
Gambar 8 Aktivitas fitase inokulan A. niger str3 dengan penambahan tepung tapioka dan tepung jagung
9
U/mL. Semua jenis kapang yang digunakan menghasilkan aktivitas fitase yang optimum pada hari kelima.
Menurut Susana et al. (2000) Aspergillus niger lebih cepat memproduksi enzim dibandingkan dengan kapang lain seperti Aspergillus ficuum dengan aktivitas lebih rendah dan lebih cepat menurun pada jam berikutnya. Hal ini sesuai dengan hasil penelitian yang menunjukkan A. niger baik str3 maupun 2 paling cepat menghasilkan aktivitas fitase dan optimum pada hari kelima kemudian menurun. Menurunnya aktivitas fitase setelah hari ke-4 dan 5 disebabkan tingginya konsentrasi fosfat anorganik yang dibebaskan ke dalam media karena kerja enzim fitase yang diproduksi dalam media sehingga fosfat anorganik dapat menghambat aktivitas katilitik enzim fitase (Rutherfurd et al. 2004). Perbedaan aktivitas yang dihasilkan oleh kapang-kapang ini tergantung pada kemampuan kapang tersebut untuk menggunakan asam fitat sebagai substrat dan menghasilkan fitase (Khrisna 2005).
Berdasarkan hasil seleksi kapang penghasil fitase, Aspergillus niger str3 dan N. crassa dipilih sebagai kapang terbaik dalam menghasilkan fitase dan selanjutnya digunakan sebagai inokulan untuk optimasi aktivitas fitase.
Pengaruh Ukuran Partikel terhadap Aktivitas Fitase
Aktivitas fitase dipengaruhi oleh beberapa faktor, diantaranya adalah kadar air, suhu, pH, dan ukuran partikel substrat. Ukuran partikel substrat memiliki pengaruh dalam aktivitas fitase. Partikel yang lebih kecil menyediakan luas permukaan kontak antara partikel dan miselia kapang yang lebih luas sehingga proses fermentasi dapat berlangsung dengan efisien. Semakin besar ukuran partikel semakin mengakibatkan peningkatan fraksi ruang kosong antara partikel sehingga mempermudah difusi oksigen, namun dapat mengurangi luas kontak antara permukaan partikel dengan miselia kapang (Khrisna 2005).
Ukuran partikel media pada penelitian ini terbukti memiliki pengaruh terhadap aktivitas fitase. Dua jenis ukuran partikel, yaitu 100 mesh (0.149 mm) dan 10 mesh (2 mm) menghasilkan aktivitas fitase yang berbeda. Ukuran partikel media yang lebih kecil, yaitu 100 mesh meningkatkan aktivitas fitase hampir 100%. Semakin kecil ukuran partikel media maka semakin mudah enzim beraktivitas. Kontak permukaan yang terjadi antara enzim dan media semakin besar dan sering terjadi apabila ukuran partikelnya semakin kecil. Penelitian yang dilakukan oleh Kamara et al. (2007) menunjukkan bahwa hidrolisis batang pohon pisang menggunakan T. viride dengan substrat berukuran 100 mesh menghasilkan kadar gula pereduksi paling tinggi dibandingkan ukuran substrat lainnya. Penelitian lainnya yang dilakukan oleh Sun (2002) menunjukkan bahwa kecepatan hidrolisis pati oleh T. viride pada limbah padat berukuran 200 mesh meningkat sebanyak 11% dibandingkan dengan substrat yang tidak dihancurkan. Fermentasi Fase Padat Menggunakan Berbagai Media
10
mengandung karbohidrat yang merupakan sumber energi bagi mikroorganisme. Pada tahap ini dilakukan seleksi media untuk menentukan media pertumbuhan yang paling baik bagi kapang untuk memproduksi fitase menggunakan fermentasi fase padat.
Media yang diseleksi pada tahap ini adalah beras, gabah, dedak, jagung, kedelai, dan ampas kelapa. Masing-masing media difermentasi dengan inokulan terpilih, yaitu A. niger str3 dan N. crassa. Hasil penelitian menunjukkan jenis media juga berpengaruh terhadap produksi fitase. Fermentasi menggunakan media kedelai menghasilkan aktivitas tertinggi dibandingkan dengan media lainnya. Fitase yang dihasilkan dari kedelai sebesar 35.289 U/mL untuk A. niger str3 dan 28.881 U/mL untuk Neurospora crassa, kemudian diikuti ampas kelapa, dedak, gabah, jagung, dan beras. Menurut Shrestha et al. (2008), degradasi asam fitat dalam suatu reaksi tergantung dengan jenis bijian, perlakuan panas pada bijian, dan kemampuan fitase. Berdasarkan penelitian ini kedelai merupakan media yang paling baik digunakan sebagai media pertumbuhan mikroba untuk menghasilkan fitase. Kedelai memiliki kandungan asam fitat mencapai 1.4 % dari bobot keringnya. Kandungan asam fitat pada kedelai inilah yang mampu menginduksi produksi fitase sehingga aktivitas fitase yang dihasilkan lebih tinggi dibandingkan media lainnya (Krishna 2005).
Formula Media untuk Aktivitas Fitase dengan Kombinasi Media Ampas Kelapa : Dedak (1:1 b/b)
Pemilihan media untuk pertumbuhan kapang penghasil fitase tidak hanya didasarkan pada kandungan nutrisi yang terdapat dalam media namun juga dipertimbangkan dengan harga dan ketersediaan bahan (Krishna 2005). Dalam hal ini kacang kedelai merupakan media yang paling baik untuk pertumbuhan A. niger str3 dan N. crassa dalam menghasilkan fitase, namun harga kacang kedelai tergolong mahal. Oleh karena itu dilakukan kombinasi media antara ampas kelapa dan dedak dengan perbandingan 1:1 (b/b).
Aktivitas fitase yang dihasilkan dari kombinasi antara ampas kelapa dan dedak adalah 28.474 U/mL untuk Aspergillus niger str3 dan 27.659 U/mL untuk
Neurospora crassa. Kombinasi antara kedua media ini sebelumnya sudah pernah diuji oleh Roopesh et al. (2006) dan menghasilkan aktivitas fitase sebesar 8.2 U/mL. Penelitian lainnya yang menggunakan kombinasi antara 2 media yang berbeda adalah Mala et al. (2007). Hasil penelitiannya menunjukkan bahwa campuran antara dedak gandum dan ampas biji wijen meningkatkan aktivitas lipase sebesar 36%. Selain itu Pujiyanto S (2000) melaporkan bahwa media campuran jerami dan bekatul dapat menghasilkan selulase dari A. niger yang lebih tinggi daripada produksi pada media jerami atau bekatul saja. Kombinasi antar media akan meningkatkan nilai nutrisi dalam media yang menjadi tempat pertumbuhan mikroorganisme. Karakteristik dari masing-masing media yang berbeda akan melengkapi kebutuhan nutrisi mikroorganisme sehingga produk yang dihasilkan oleh mikroorganisme tersebut meningkat (Roopesh et al. 2005).
Selanjutnya pada media yang telah dikombinasi, diberikan perlakuan berbagai jenis kondisi pH dan penambahan sumber karbon dengan inokulan
11
Formula Media dengan Perlakuan pH dan Penambahan Sumber Karbon Perlakuan pH
PH tidak hanya mempengaruhi media, tetapi juga menentukan sifat-sifat enzim yang dihasilkan. Suatu enzim dapat bekerja pada berbagai kondisi pH, tetapi aktivitasnya optimum pada kisaran pH yang sempit saja (Mahyudin et al.
2006). Seperti protein lainnya, enzim mempunyai beberapa gugus yang dapat terionisasi. Perubahan pH dapat menyebabkan perubahan pada gugus-gugus tersebut. Hal ini mengakibatkan perubahan struktur, konformasi, dan sisi aktif enzim (Lan et al. 2002). Selain itu, perubahan ekstrim dari pH dapat mengakibatkan denaturasi pada enzim,
Berdasarkan hasil penelitian, Aspergillus niger dan Neurospora crassa
memproduksi enzim optimum pada pH 6. Pada kondisi pH di atas 6, yaitu pH 7 fisiologis unggas (Jorquera et al. 2008).
Menurut Agustini (2009), aktivitas enzim berkaitan dengan strukturnya. Perubahan struktur dapat menyebabkan perubahan aktivitas enzim. Suasana yang terlalu asam atau terlalu basa menyebabkan konformasinya berubah sehingga aktivitas enzim akan terganggu. Enzim memiliki struktur yang sensitif terhadap pH dan secara umum denaturasi enzim terjadi pada nilai pH sangat rendah atau tinggi (Copeland 2000).
Penambahan Sumber Karbon
Pemilihan bahan yang akan dijadikan media fermentasi sangat menentukan struktur metabolit primer dan metabolit sekunder yang dihasilkan oleh mikroba. Oleh karena itu pemilihan sumber karbon sebagai penyusun utama dalam medium fermentasi harus disesuaikan dengan kebutuhan mikroba untuk pembentukan metabolit primer atau metabolit sekunder yang diharapkan (Thiry dan Cingolani 2002). Menurut Vohra dan Satyanarayana (2003), laju metabolisme sumber karbon berpengaruh terhadap pembentukan biomassa dan produk metabolit yang dihasilkan. Dengan demikian pemilihan sumber karbon merupakan salah satu kunci keberhasilan untuk mendapatkan metabolit yang diharapkan (Greg dan Richard 2009).
12
yang melakukan optimasi aktivitas fitase dengan penambahan tepung jagung dan tepung tapioka pada Aspergillus flavus. Hasil penelitiannya menunjukkan bahwa tepung tapioka menjadi sumber karbon tambahan yang lebih baik dibandingkan dengan tepung jagung. Hal ini terlihat dari aktivitas fitase yang meningkat sebesar 12% ketika ditambahkan tepung tapioka sedangkan ketika ditambahkan tepung jagung meningkat sebesar 8%. Hal ini berkaitan dengan peran tepung jagung dan tepung tapioka sebagai ko-substrat untuk produksi fitase. Ko-substrat adalah senyawa pendamping substrat yang jenis senyawanya berbeda dengan substrat. Ko-substrat mengandung sumber karbon, nitrogen, kalsium, mineral, dan vitamin. Kandungan dari ko-substrat ini bisa digunakan oleh sel untuk menyediakan koenzim dan energi untuk kehidupannya sehingga diharapkan dengan penambahan ko-substrat dapat meningkatkan produksi fitase (Yulianto et al.
2006).
SIMPULAN DAN SARAN
Simpulan
Aspergillus niger str 3 dan Neurospora crassa merupakan kapang-kapang yang menghasilkan aktivitas fitase tertinggi dibandingkan kapang jenis lainnya. Aktivitas fitase oleh kedua kapang tersebut menghasilkan kedelai sebagai media terbaik untuk produksi fitase dengan aktivitas sebesar 35.289 U/mL untuk A. niger str3 dan 28.881 U/mL untuk N. crassa. Formulasi media yang mengandung ampas kelapa dan dedak dengan perbandingan 1:1 (b/b) dapat meningkatkan aktivitas fitase menjadi 60.030 U/mL untuk A. niger str3 dan 45.844 U/mL untuk
N. crassa dengan penambahan tepung tapioka 20% dan pH 6. Saran
Perlu dilakukan analisis kandungan asam fitat pada tepung jagung dan tepung tapioka untuk mengetahui hubungan antara aktivitas fitase dengan penambahan kedua tepung tersebut.
DAFTAR PUSTAKA
Agustini NWS, Kusmiati. 2009. Identifikasi dan uji aktivitas antibakteri senyawa aktif secara maserasi dan digesti dalam berbagai pelarut dari mikroalga Dunaliella salina. Seminar Nasional IX Pendidikan Tinggi FKIP UNS. Semarang (ID): Universitas Negeri Semarang. hlm 544-551.
APHA (American Public Health Association). 1976. Determination of inorganic Non Metailic Constituents, in: Standart Methods for the Examination of Water and Wastewater. Washington (US): APHA.
Copeland RA. 2000. Methods for Protein Analysis: A Practical Guide to Laboratory Protocols. New York (US): Chapman and Hall.
13
Greg AS, Richard AP. 2009. At the crossroads of bacterial metabolism and virulance factor synthesis in Staphylococci. Microbiol. Mol. Biol. Rev. 73 (2):233.
Greiner R, Konietzny, Jany KID. 1993. Purification and characterization of two phytase from Escherichia coli. Arch Biochem Biophys. 303:107-113.
Irving GCJ, Cosgrove DJ. 1970. Inositoal phosphate phosphatases of microbiological origin. Some properties of a partially purified bacterial
(Pseudomonas sp.) phytase. J Biol Sci. 24:547-557.
Jorquera MA, Martinez O, Maruyama F, Marschner, de la Luz Mora M. 2008. Current and future biotechnological applications of bacterial phytases and phytase-producing bacteria. Microb Environm. 23(3): 182-191.
Kamara DS, Rachman SD, Gaffar S. 2007. Degradasi enzimatik selulosa dari batang pohon pisang untuk produksi glukosa dengan bantuan aktivitas selulolitik Thricoderma viride [makalah penelitian]. Semarang (ID): Universitas Padjajaran.
Kerovou J, Lauraeus M, Nurminen P, Kalkinen N, Apajalahti J. 1998. Isolation, characterization. molecular gene cloning and sequencing of a novel phytase from Bacillus subtilis. Applied Environm Microbiol. 64: 2079-2085.
Khrisna C. 2005. Solid-state fermentation on system an overview. Biotechnol. 25: 1-30.
Lan GQ, Abdullah, Jalaludin, Ho. 2002. Culture conditions influencing phytase production of Mitsuokella jalaludinii, a new bacterial species from the rumen of cattle. J. Appl. Microbiol. 93: 668-674.
Mahyudin AR, Koesnandar, Gany H, Ahmad M, Ali R, Usman SFT. 2006. Optimasi dan stabilitas pH dan temperatur glukoamilase produksi Aspergillus niger BCS menggunakan sekam dan dedak sebagai penyangga fermentasi substrat padat. J Bioteknol. 6: 1-6.
Mala JG, Edwinoliver NG, Kamini NR, Puvanakrishnan R. 2007. Mixed substrate solid state fermentation for production and extraction of lipase from
Aspergillus niger MTCC 2594. J Gen Appl Microbiol. 53 (4): 247-253.
Mullaney EJ, Ullay AHJ. 2003. The term phytase comprises several different classes of enzymes. J Biochem and Biophys. 312: 179-184.
Nagashima T, Tange T, Anazawa H, 1999. Dephosporylation of phytate by using the Aspergillus niger phytase by a high affinity for phytate. Applied Environm
Microbiol. 65: 4682-4688.
Oh BC, Choi WC, Park S, Kim YO, Oh TK. 2004. Biochemical properties and substrate specificities of alkaline and histidine add phytase. Applied Microbiol and Biotech. 63 (4) : 362-372.
Pandey A, Soccol CR, Nigam P, Brand D, Moha R, Roussos S. 2000. Biotechonological potential of coffee pulp and coffee husk for bioprocesses.
Biochem Eng J. 6: 153-162.
Pujiyanto S. 2000. Pemanfaatan media campuran jerami dan bekatul sebagai substrat produksi enzim selulase oleh Aspergillus sp DUCC M-001 [skripsi]. Semarang (ID): Universitas Diponegoro.
14
Rahman RNZRA, M Basri, AB Saleh. 2003. Thermostable alkaline protease from
Bacillus stearothermophillus F1: nutritional factors effecting protease production. Annals Microbiol. 53: 199-210.
Ravindran V, Cabahug S, Ravindran G, Bryden WL, Selle PH. 2000. Response of broilers to microbial phytase supplementation as influenced by dietary phytic acid and non-phytat phosporus levels II effects on nutrient digestibility and retention. Br. Poult. Sci. 41:193-200.
Roopesh K, Ramachandran S, Nampoothiri KM, Szakacs G, Pandey A. 2006. Comparison of phytase production on wheat bran and oilcakes in solid-state fermentation by Mucor racemosus. J Biores Tech. 506-511.
Rutherfurd SM, Chung TK, Morel PCH, Moughan PJ. 2004. Effect of microbial phytase on ileal digestibility of phytat phosphorus, total phosporus, and amino acids in a low-phosporus diet for broilers. Poult Sci. 83: 61-68.
Sajidan A, Farouk A, Greiner R, Jungblut P, Muller EC, Borriss R. 2004. Molecular and physiological characterization of a 3-phytase from soil. Bacterium Klebsiella sp, Asr 1. Applied Environm Microbiol. 65:110-118.S Sant s , R sa AS, Da ’b it S, itch DA, Krig r N. 2 4. Th r a
denaturation: is solid state-fermentation really a good technology for the production of enzymes. Bioresour Technol. 93: 261-268.
Selle PH, Ravindran V. 2007. Microbial phytase in poultry nutrition. An Feed Sci Tech. 135: 1-41.
Shrestha P, Rasmussen M, Khanal SK. 2008. Solid substrate fermentation of corn fiber by Phanerochaete chrysosporium and subsequent fermentation of hydolysate into ethanol. J. Agric Food Chem. 56: 3918-3924.
Sun Y. 2002. Enzymatic hydrolysis of rye straw and bermudagrass for ethanol production [disertasi]. North Carolina (US): North Carolina University.
Susana IWR, Tangenjaya B, Hastiono S. 2000. Seleksi kapang penghasil fitase.
JITV. 5(2): 4-5.
Thyri M, Cingolani D. 2002. Optimizing scale up fermentation processes. Trends in Biotechnology. 10: 343-348.
Trismilah S, Sumaryanto. 2005. Pengaruh kadar nitrogen dalam media pada pembuatan protease menggunakan Bacillus megaterium DSM 319. JIKI. 3(1): 9-12.
Vats P, Bhushan B, Banerjee U. 2009. Studies on the dephosporylation of phytic acid in livestock feed using phytase from Aspergillus niger van Teighem.
Bioresour Tech. 100: 287-291.
Vohra A, Satyanarayana T. 2003. Phytases: microbial sources, production, purification, and potential biotechnological application. J Biotechnol. 23:29-31. Vohra A, Kaur P, Satyanarayana T. 2011. Production, characterstics, and application of cell bound phytase of Pitchia anomala. J Biotechnol. 99: 51-57. Wyatt CL, Parr T, Bedford M. 2008. Mechanisms of action for supplemental NSP
and phytase enzymes in poultry diets. Poul Nutr. 3: 12-22.
Yuliana N. 2008. Kinetika pertumbuhan bakteri asam laktat isolat T5 yang berasal dari tempoyak. Industrial Tech J and Agric. 13 (2).
15
Lampiran 1 Alur penelitian
SELEKSI KAPANG PENGHASIL FITASE
PENGARUH UKURAN PARTIKEL SUBSTRAT KULTUR KAPANG
FORMULASI MEDIA
SUMBER KARBON pH
KOMBINASI SUBSTRAT
16
Lampiran 2 Kurva standar fosfat
y = 0.001x - 0.0348 R² = 0.9943
-0.2 0 0.2 0.4 0.6 0.8 1 1.2
0 200 400 600 800 1000 1200
Abs
o
rba
ns
i
17
Lampiran 3 Hasil perhitungan aktivitas fitase pada berbagai jenis kapang
Mikroba Waktu Inkubasi (hari)
Blanko Sampel A
terkoreksi
[fosfat] ppm
Aktivitas fitase (U/mL) B1 B2 Rerata S1 S2 Rerata
Aspergillus niger
str 3 3 0,174 0,166 0,170 0,408 0,4 0,404 0,234 268,8 9,956 4 0,091 0,1 0,096 0,561 0,567 0,564 0,468 502,8 18,622 5 0,183 0,213 0,198 0,854 0,87 0,862 0,664 698,8 25,881 6 0,12 0,101 0,111 0,316 0,318 0,317 0,206 240,8 8,919
Aspergillus niger
str 2 3 0,153 0,164 0,159 0,35 0,34 0,345 0,186 220,8 8,178 4 0,173 0,154 0,164 0,49 0,468 0,479 0,315 349,8 12,956 5 0,085 0,09 0,088 0,709 0,713 0,711 0,623 657,8 24,363 6 0,127 0,131 0,129 0,208 0,198 0,203 0,074 108,8 4,030
Trchoderma
viridae 3 0,074 0,071 0,073 0,185 0,165 0,175 0,102 136,8 5,067
4 0,043 0,035 0,039 0,115 0,119 0,117 0,078 112,8 4,178 5 0,095 0,111 0,103 0,147 0,153 0,15 0,047 81,8 3,030 6 0,107 0,094 0,101 0,121 0,101 0,111 0,01 44,8 1,659
Mucor
circinelloides 3 0,029 0,034 0,032 0,136 0,144 0,14 0,108 142,8 5,289
4 0,04 0,047 0,044 0,104 0,098 0,101 0,057 91,8 3,400 5 0,022 0,031 0,027 0,242 0,232 0,237 0,21 244,8 9,067 6 0,076 0,069 0,073 0,081 0,091 0,086 0,013 47,8 1,770
Neurospora crassa 3 0,167 0,145 0,156 0,184 0,222 0,203 0,047 81,8 3,030
18
Lanjutan
Mikroba Waktu Inkubasi (hari)
Blanko Sampel A
terkoreksi
[fosfat] ppm
Aktivitas fitase (U/mL) B1 B2 Rerata S1 S2 Rerata
Rhizopus oryzae 3 0,043 0,047 0,045 0,084 0,096 0,009 0,045 79,8 2,956
19
Lampiran 4 Hasil perhitungan aktivitas fitase berdasarkan ukuran partikel media
20
Lampiran 5 Hasil perhitungan aktivitas fitase pada berbagai jenis media menggunakan fermentasi fase padat
Mikroba Substrat
Waktu inkubasi
(hari)
Blanko Sampel
A terkoreksi
[fosfat] ppm
Aktivitas fitase (U/mL) B1 B2 Rerata S1 S2 Rerata
Aspergillus niger
str3
Beras 4 0,103 0,12 0,112 0,331 0,339 0,335 0,223 257,8 9,548 5 0,127 0,126 0,127 0,544 0,564 0,554 0,427 461,8 17,104 6 0,092 0,093 0,093 0,162 0,156 0,159 0,066 100,8 3,733 7 0,113 0,11 0,112 0,213 0,185 0,199 0,087 121,8 4,511 8 0,083 0,084 0,084 0,12 0,118 0,119 0,035 69,8 2,585 9 0,054 0,063 0,059 0,075 0,073 0,074 0,015 49,8 1,844 Gabah 4 0,093 0,089 0,091 0,404 0,398 0,401 0,31 344,8 12,770
5 0,12 0,129 0,125 0,678 0,674 0,676 0,551 585,8 21,696 6 0,118 0,11 0,114 0,239 0,231 0,235 0,121 155,8 5,770 7 0,076 0,072 0,074 0,334 0,332 0,333 0,259 293,8 10,881 8 0,092 0,091 0,092 0,271 0,269 0,27 0,178 212,8 7,881 9 0,129 0,12 0,125 0,268 0,262 0,265 0,14 174,8 6,474 Dedak 4 0,032 0,045 0,039 0,487 0,505 0,496 0,457 491,8 18,215
21
Lanjutan
Mikroba Substrat
Waktu inkubasi
(hari)
Blanko Sampel
A terkoreksi
[fosfat] ppm
Aktivitas fitase (U/mL) B1 B2 Rerata S1 S2 Rerata
Aspergillus niger
str3
Ampas kelapa
4 0,077 0,079 0,078 0,127 0,121 0,124 0,046 80,8 2,993 5 0,1 0,111 0,106 0,745 0,753 0,749 0,643 677,8 25,104 6 0,109 0,102 0,106 0,352 0,336 0,344 0,238 272,8 10,104 7 0,088 0,098 0,093 0,452 0,448 0,45 0,357 391,8 14,511 8 0,104 0,111 0,108 0,149 0,159 0,154 0,046 80,8 2,993 9 0,109 0,102 0,106 0,113 0,105 0,109 0,003 37,8 1,400
Kacang Kedelai
4 0,156 0,176 0,166 0,927 0,923 0,925 0,759 793,8 29,400 5 0,104 0,101 0,103 1,034 1,008 1,021 0,918 952,8 35,289 6 0,122 0,12 0,121 0,577 0,567 0,572 0,451 485,8 17,993 7 0,129 0,12 0,125 0,644 0,638 0,641 0,516 550,8 20,400 8 0,103 0,102 0,103 0,239 0,225 0,232 0,129 163,8 6,067 9 0,113 0,12 0,117 0,211 0,189 0,2 0,083 117,8 4,363
Jagung
22
Lanjutan
Mikroba Substrat
Waktu inkubasi
(hari)
Blanko Sampel
A terkoreksi
[fosfat] ppm
Aktivitas fitase (U/mL) B1 B2 Rerata S1 S2 Rerata
Neurospora crassa
Beras 4 0,092 0,09 0,091 0,243 0,255 0,249 0,158 192,8 7,141 5 0,011 0,012 0,012 0,043 0,083 0,063 0,051 85,8 3,178 6 0,113 0,114 0,114 0,256 0,238 0,247 0,133 167,8 6,215 7 0,094 0,099 0,097 0,129 0,135 0,132 0,035 69,8 2,585 8 0,065 0,069 0,067 0,1 0,112 0,106 0,039 73,8 2,733 9 0,031 0,034 0,033 0,054 0,042 0,048 0,015 49,8 1,844 Gabah 4 0,023 0,021 0,022 0,487 0,493 0,49 0,468 502,8 18,622
5 0,139 0,0134 0,076 0,43 0,436 0,433 0,357 391,8 14,511 6 0,073 0,069 0,071 0,314 0,31 0,312 0,241 275,8 10,215 7 0,089 0,092 0,091 0,168 0,164 0,166 0,075 109,8 4,067 8 0,065 0,054 0,060 0,179 0,175 0,177 0,117 151,8 5,622 9 0,111 0,11 0,111 0,213 0,187 0,2 0,089 123,8 4,585 Dedak 4 0,119 0,121 0,120 0,443 0,439 0,441 0,321 355,8 13,178
23
Lanjutan
Mikroba Substrat
Waktu inkubasi
(hari)
Blanko Sampel
A terkoreksi
[fosfat] ppm
Aktivitas fitase (U/mL) B1 B2 Rerata S1 S2 Rerata
Neurospora crassa
Ampas kelapa
4 0,039 0,034 0,037 0,532 0,528 0,53 0,493 527,8 19,548 5 0,1 0,104 0,102 0,411 0,409 0,41 0,308 342,8 12,696 6 0,103 0,101 0,102 0,356 0,36 0,358 0,256 290,8 10,770 7 0,087 0,086 0,087 0,341 0,319 0,33 0,243 277,8 10,289 8 0,102 0,108 0,105 0,234 0,232 0,233 0,128 162,8 6,030 9 0,129 0,124 0,127 0,168 0,152 0,16 0,033 67,8 2,511
Kacang Kedelai
4 0,239 0,233 0,236 0,907 0,905 0,906 0,67 704,8 26,104 5 0,219 0,201 0,210 0,954 0,956 0,955 0,745 779,8 28,881 6 0,203 0,209 0,206 0,752 0,748 0,75 0,544 578,8 21,437 7 0,093 0,092 0,093 0,311 0,319 0,315 0,222 256,8 9,511 8 0,113 0,102 0,108 0,303 0,301 0,302 0,194 228,8 8,474 9 0,103 0,1 0,102 0,234 0,23 0,232 0,13 164,8 6,104
Jagung
24
Lampiran 6 Hasil perhitungan aktivitas fitase menggunakan kombinasi media
Mikroba Substrat
Waktu inkubasi
(hari)
Blanko Sampel
B1 B2 Rerata S1 S2 Rerata
A terkoreksi
[fosfat] ppm
Aktivitas fitase (U/mL)
Aspergillus
niger str3
Ampas kelapa +
dedak
4 0,124 0,127 0,126 0,547 0,549 0,548 0,422 456,8 16,919 5 0,223 0,224 0,224 0,958 0,958 0,958 0,734 768,8 28,474 6 0,093 0,09 0,092 0,554 0,548 0,551 0,459 493,8 18,289 7 0,176 0,177 0,177 0,59 0,592 0,591 0,414 448,8 16,622 8 0,21 0,219 0,215 0,508 0,502 0,505 0,29 324,8 12,030 9 0,089 0,08 0,085 0,197 0,195 0,196 0,111 145,8 5,400
Neurospora crassa
Ampas kelapa +
dedak
25
Lampiran 7 Hasil perhitungan aktivitas fitase pada media formulasi dengan kondisi pH 5 hingga 8
Mikroba Substrat pH
Blanko Sampel A terkoreksi
[fosfat] ppm
Aktivitas fitase (U/mL) B1 B2 Rerata S1 S2 Rerata
Aspergillus niger str3
Kontrol Kontrol 0,21 0,193 0,202 1,01 1,02 1,015 0,813 847,800 29,733 Ampas kelapa + Dedak 5 0,237 0,234 0,236 0,993 0,997 0,995 0,759 793,800 29,400 6 0,193 0,182 0,188 1,603 1,609 1,606 1,418 1452,800 53,807 7 0,204 0,219 0,212 1,167 1,171 1,169 0,957 991,800 36,733 8 0,178 0,19 0,184 1,043 1,037 1,04 0,856 890,800 32,993
Neurospora crassa
26
Lampiran 8 Hasil perhitungan aktivitas fitase pada media formulasi dengan penambahan tepung tapioka dan tepung Jagung
Mikroba Substrat Sumber C
Blanko Sampel A terkoreksi
[fosfat] ppm
Aktivitas fitase (U/mL) B1 B2 Rerata S1 S2 Rerata
Aspergillus
niger str3
Kontrol Kontrol 0,134 0,126 0,130 1,514 1,52 1,517 1,387 1421,8 52,659 Dedak + ampas kelapa Tapioka 0,183 0,189 0,186 1,778 1,766 1,772 1,586 1620,8 60,030 Jagung 0,192 0,183 0,188 1,739 1,741 1,74 1,552 1586,8 58,770
Neurospora crassa
27 Lampiran 9 Contoh perhitungan aktivitas fitase pada jenis kapang Aspergillus niger str3, waktu inkubasi 3 hari.
Sampel – blanko = 0.404-0.170 = 0.234 y= 0.234
Persamaan garis yang diperoleh adalah y= 0.001x - 0.0348, maka y= 0.001x + 0.0348
. . 4
Sehingga
.2 4 . 4 .
= 268.8 ppm
268.8 ppm = 0.268 mg/mL
Aktivitas Fitase (U/mL) = t v u n i = .2 .
28
RIWAYAT HIDUP
Caroline Oktaviani, lahir di Jakarta pada tanggal 1 Oktober 1995. Merupakan anak kedua dari lima bersaudara pasangan Sukiman dan Pujiati (alm). Penulis mengawali pendidikan kegiatan belajar dari SDN Sukabumi Utara 07 pagi, SMP Negeri 88 Jakarta dan pada tahun 2011 penulis lulus dari SMA Negeri 65 Jakarta dan pada tahun yang sama penulis lulus di Universitas Negeri yaitu IPB melalui seleksi masuk Institut Pertanian Bogor (IPB) dengan jalur Undangan Seleksi Masuk IPB (USMI) dan diterima di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.