KARAKTERISASI FRAGMEN DNA Burkholderia gladioli
YANG TERLIBAT DALAM AKTIVITAS ANTIFUNGI
Ganoderma boninense
RETNO TRI ASTUTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Karakterisasi Fragmen DNA Burkholderia gladioli yang Terlibat dalam Aktivitas Antifungi Ganoderma boninense adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, November 2015
Retno Tri Astuti
RINGKASAN
RETNO TRI ASTUTI. Karakterisasi Fragmen DNA Burkholderia gladioli yang Terlibat dalam Aktivitas Antifungi Ganoderma boninense. Dibimbing oleh ANTONIUS SUWANTO dan MARIA SUGIHARTI.
Elaeis guineensis Jacq. atau dikenal dengan kelapa sawit merupakan salah satu komoditas penting yang digunakan secara luas dalam industri makanan, kosmetik dan farmasi. Sebagai negara tropis, Indonesia diberkahi iklim dan kondisi yang tepat bagi pertumbuhan dan produksi kelapa sawit, sekaligus daratan luas yang memungkinkan perkebunan dalam skala besar. Sejak tahun 2007, Indonesia merupakan penghasil minyak kelapa sawit terbesar di dunia. Meskipun demikian, perkebunan kelapa sawit tidak lepas dari ancaman patogen yang menurunkan tingkat produksi. Cendawan G. boninense merupakan patogen paling mematikan dan merugikan industri kelapa sawit di Indonesia dan Malaysia.
Berbagai upaya telah dilakukan untuk mengatasi serangan G. boninense
meliputi pengendalian secara kimia, mekanis dan biologis, tetapi belum menunjukkan hasil yang memuaskan. Meskipun demikian, pengendalian secara biologis menarik banyak perhatian karena memiliki efek negatif yang relatif kecil bagi tanah, lingkungan maupun kesehatan manusia. Oleh karena itu, diperlukan suatu strategi pengendalian yang terstruktur dengan pendekatan-pendekatan baru seperti biologi molekuler atau pengembangan senyawa antifungi yang aman dipergunakan dalam jangka panjang.
Tujuan dari penelitian ini adalah untuk mengkarakterisasi gen-gen yang berperan dalam aktivitas antifungi bakteri antagonis G. boninense sebagai langkah awal untuk memahami mekanisme ekspresinya. Sebagai langkah pertama, dilakukan isolasi seratus dua puluh lima bakteri dari sampel uji berupa bag-log
(media tanam) jamur konsumsi, tanah pembibitan kelapa sawit dan janjangan kosong kelapa sawit. Sebanyak tiga belas isolat menunjukkan penghambatan dengan nilai lebih dari 50%. Salah satu isolat yaitu S.2.2 diketahui memiliki aktivitas penghambatan yang tinggi sekaligus stabil terhadap pemanasan dan perlakuan proteinase K. Analisis runutan gen penyandi 16S rRNA menunjukkan bahwa S.2.2 memiliki 99% kemiripan dengan Burkholderia gladioli strain ATCC 10248 (accession number CP009322.1). Isolat S.2.2 selanjutnya disebut sebagai
B. gladioli JR01
Untuk memahami mekanisme yang mendasari ekspresi senyawa antifungi JR01, dilakukan mutagenesis transposisi menggunakan mini-Tn5 menghasilkan 612 mutan transposon. Berdasarkan uji antagonis, ditemukan dua mutan yang mengalami penurunan aktivitas penghambatan yaitu BglK259 dan
BglK498. Karakterisasi runutan DNA pengapit transposon menunjukkan kemiripan yang tinggi dengan sebagian gen penyandi LysR-type transcriptional regulator (BglK259) dan gen proton-translocating NADH-quinone oxidoreductase (BglK498). Kedua gen ini diduga terlibat dalam aktivitas antifungi
B. gladioli sehingga inaktivasinya menyebabkan penurunan aktivitas.
Kata kunci: antifungi, Ganoderma boninense, mutagenesis transposon, analisis
SUMMARY
RETNO TRI ASTUTI. Characterization of DNA Fragment on Burkholderia gladioli Contribute for Anti-fungal Activity toward Ganoderma boninense. Supervised by ANTONIUS SUWANTO and MARIA SUGIHARTI.
Elaeis guineensis Jacq. or commonly known as oil palm is one of the most important commodities that are used widely in food, cosmetics and pharmaceutical industry. Our country is blessed with a great climate and other condition suitable for growth as well as extensive land allows giant plantation. Since 2007, Indonesia is the largest producer of palm oil in the world. Nevertheless, palm oil cultivation faces several threat that reduce production levels, one of them is pathogenic fungus Ganoderma boninense. G. boninense is the most serious and deadly pathogen of palm oil in Indonesia and Malaysia by causing basal stem root disease. The most significant economic loss due to high rate mortality of plant population.
Many efforts have been conducted to overcome G. boninense’s attack
including by chemical, mechanical and biological approach but no one was really succesful. However, biological control has received much attention because it causes smaller negative effect for soil, environment and human health as well as restoring the soil microbial ecosystem. Thus, we need to generate a well-planned biological control strategies with new approach such as by molecular biotechnology, or deployment of safe novel anti-fungal. In this stage, mechanism of antifungal expression become really important to be understanding.
The aim of this study is to clone and identify genes contribute for anti-fungal activities of antagonistic bacteria as a first step to understanding the mechanism of anti-fungal expression. As a first step,we have isolated one hundred and twenty five isolates from bag-log medium (culture material of edible fungi), soil and oil palm empty fruit bunches. Thirteen isolates has more than 50% inhibitory radial growth toward G. boninense. Based on culture filtrate assay, crude extract of S.2.2 showed high and stable activities after boiling and proteinase K treatment. Analysis of 16S rRNA sequences showed that S.2.2 was closely related to B. gladioli strain ATCC 10248 (accession number CP009322.1), furthermore designed as B. gladioli JR01.
In order to understand mechanism underlying in antifungal expression of Jr01, we have conducted a mutagenesis transpositional using mini-Tn5KmR generating 612 transposon-based mutant library. Based on antagonistic assay, we found two knock-out mutant designed as BglK259 and BglK498. Analysis of DNA sequence showed that the flanking DNA of mutant BglK259 closely related to transcriptional regulator LysR family and flanking DNA of mutant BglK498 showed high similarities to proton-translocating NADH-quinone oxidoreductase gene from B. gladioli ATCC 10248 (accession number CP009322.1).Those two gene suspected to contribute in antifungal activities on B. gladioli JR01 since inactivation generating knock-out antifungal mutant.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
Pada
Program Studi Bioteknologi
RETNO TRI ASTUTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
KARAKTERISASI FRAGMEN DNA Burkholderia gladioli
YANG TERLIBAT DALAM AKTIVITAS ANTIFUNGI
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Agustus 2014 hingga Juli 2015 ini ialah Karakterisasi Fragmen DNA Burkholderia gladioli yang Terlibat dalam Aktivitas Antifungi Ganodermaboninense.
Terima kasih penulis ucapkan kepada Prof Dr Ir Antonius Suwanto, MSi dan Dr Maria Sugiharti selaku pembimbing, atas segala arahan, saran, pembelajaran dan solusi selama pelaksanaan penelitian dan penyusunan karya ilmiah ini. Terima kasih kepada Prof Dr Aris Tri Wahyudi, MSi selaku penguji luar komisi atas saran dan pemikiran baru yang diberikan pada saat ujian tesis. Di samping itu, penulis mengucapkan terima kasih kepada direktorat jenderal perguruan tinggi (DIKTI) yang telah memberikan dana perkuliahan selama studi penulis di IPB melalui program beasiswa BPP-DN calon dosen tahun 2013/2014. Ucapan terima kasih juga penulis tujukan kepada PT Wilmar Benih Indonesia Cikarang atas segala fasilitas dan sarana dalam pelaksanaan penelitian.
Terima kasih kepada seluruh staf RnD PT Wilmar Benih Indonesia atas segala bantuan dan arahan selama pelaksanaan penelitian. Terima kasih kepada sahabat-sahabat seperjuangan Astri, Sasti, Tira, Nabilah, Natalia, Arif, Albert atas segala motivasi dan keceriaan selama masa studi. Terima kasih kepada Jekmal Malau yang telah menjadi partner terbaik sepanjang penelitian ini. Ungkapan terima kasih tak terhingga juga disampaikan kepada Bapak, Ibuk, Pratama serta seluruh keluarga, atas segala dukungan, doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
TINJAUAN PUSTAKA 3
Kelapa Sawit 3
Cendawan Ganoderma boninense 3
Transposon Mini-Tn5 4
Analisis Genome Walking 6
METODE 8
Kerangka Penelitian 8
Waktu dan Tempat Penelitian 8
Prosedur Penelitian 9
HASIL DAN PEMBAHASAN 14
Pemilihan Isolat bakteri Antagonis G. boninense 14
Mutagenesis Transposon 17
Identifikasi Sekuen Pengapit Transposon 20
KESIMPULAN DAN SARAN 24
Kesimpulan 24
Saran 24
DAFTAR PUSTAKA 25
LAMPIRAN 29
DAFTAR GAMBAR
1 Skema transposon Tn5 dan mini-Tn5 5
2 Peta suicide plasmid pUT yang membawa mini-Tn5-KmR 6 3 Prosedur genome walkiing menggunakan metode PCR berbasis
adaptor
7 4 Runutan nukleotida adaptor dan primer spesifik adaptor 7
5 Diagram alur penelitian 8
6 Peta fisik vektor pGEMT-Easy 12
7 Aktivitas penghambatan pertumbuhan miselium G. boninense
oleh empat isolat bakteri antagonis yang menunjukkan
penghambatan tertinggi pada uji tantang kultur 14 8 Hasil BLAST runutan gen penyandi 16S rRNA dari B. gladioli
JR01 dengan data gene bank 16
9 Perubahan aktivitas penghambatan mutan BglK259, BglK498, mutan BglK226 dibandingkan dengan pertumbuhan normal G. boninense dan penghambatan isolat tipe asal pada media PDA
setelah 10 hari inkubasi 18
10 Visualisasi hasil amplifikasi gen kanamisin menggunakan primer
spesifik Kan_1F dan Kan_1R 19
11 Visualisasi hasil amplifikasi PCR dengan penambahan adaptor
menggunakan DNA kromosom mutan BglK259 dan BglK498 20 12 Peta fragmen hasil amplifikasi genome walking pada mutan
BglK259 dan BglK498 21
13 Hasil pensejajaran runutan DNA pengapit transposon
mini-Tn5KmR dari mutan BglK498 21
14 Hasil pensejajaran runutan DNA pengapit transposon
mini-Tn5KmR dari mutan BglK498 22
DAFTAR TABEL
1 Daftar primer yang digunakan dalam penelitian 11 2 Aktivitas penghambatan oleh kandidat bakteri potensial terhadap
miselium G. boninense
15 3 Aktivitas penghambatan ekstrak kasar lima bakteri potensial
dengan aktivitas penghambatan tertinggi pada uji tantang kultur
16
DAFTAR LAMPIRAN
1
PENDAHULUAN
Latar Belakang
Elaeis guineensis Jacq. atau yang umum dikenal sebagai kelapa sawit adalah salah satu komoditas perkebunan yang digunakan secara luas dalam industri makanan, farmasi dan kosmetik (Paterson et al. 2009). Sejak tahun 2007, Indonesia menjadi produsen minyak kelapa sawit terbesar di dunia seiring dengan luas lahan perkebunan yang terus meningkat (Ditjenbun 2014). Saat ini, budidaya kelapa sawit menghadapi beberapa kendala yang menurunkan tingkat produksi, salah satunya adalah serangan cendawan Ganoderma boninense. Cendawan ini menyebabkan penyakit busuk pangkal batang (basal stem rot/BSR) yang merupakan penyakit paling serius pada perkebunan kelapa sawit di Malaysia (Singh 1991; Idris et al. 2001; Wong et al. 2012) dan Indonesia (Darmono 2000; Susanto et al. 2005). Kerugian karena penyakit ini terutama disebabkan karena kemampuannya dalam menurunkan populasi tanaman (Ariffin et al. 1996).
Serangan G. boninense di lapangan berjalan lambat sehingga sulit dideteksi dengan akurat pada fase awal infeksi. Gejala penyakit mulai terlihat setelah infeksi mencapai tahap lanjut (Sapak et al. 2008) yang seringkali ditandai dengan tumbuhnya tubuh buah pada pangkal batang (Turner 1981). Akan tetapi, pada fase ini pengendalian penyakit sudah sangat sulit dilakukan. Tanaman muda yang menunjukkan gejala ini biasanya akan mati setelah satu hingga dua tahun sedangkan tanaman dewasa dapat bertahan sekitar tiga tahun (Corley & Tinker 2003).
Berbagai upaya dan penelitian telah dikembangkan dalam usaha pengendalian G. boninense meliputi pengendalian secara teknis, kimiawi dan biologis, tetapi belum menunjukkan hasil yang memuaskan (Susanto 2002). Penggunaan senyawa kimia saat ini masih banyak dikembangkan dalam mengontrol penyebaran G. boninense di lapangan (Sapak et al. 2008). Akan tetapi, aplikasi senyawa kimia seperti fungisida seringkali bekerja dengan menyerang banyak mikroorganisme tanah tanpa pandang bulu termasuk mikroba yang menguntungkan bagi pertumbuhan tanaman. Selain itu, penggunaan senyawa kimia secara terus menerus juga mengakibatkan penurunan kualitas tanah, pencemaran lingkungan (Sarim 2013) hingga kekhawatiran pengendapan senyawa kimia beracun dalam produk pertanian dan perkebunan.
Strategi pengendalian biologis menggunakan agen hayati atau senyawa yang dihasilkannya menarik perhatian karena memiliki efek buruk yang rendah terhadap tanah, lingkungan maupun manusia, bahkan diharapkan dapat memperbaiki komposisi mikroba di dalam tanah yang memburuk karena aplikasi berbagai senyawa kimia (Sarim 2013). Beberapa golongan bakteri seperti
2
terhadap G. boninense. Kajian molekuler melalui mutagenesis transposon dilakukan untuk mempelajari fragmen gen yang terlibat dalam aktivitas penghambatan hifa G. boninense.
Perumusan Masalah
Cendawan patogen G. boninense merupakan salah satu patogen utama dalam perkebunan kelapa sawit di Indonesia. Berbagai usaha telah dilakukan untuk menekan serangan G. boninense tetapi belum menunjukkan hasil yang optimal. Pendekatan menggunakan agen biologis berupa bakteri yang menghasilkan senyawa antifungi dinilai memiliki efek yang relatif rendah baik bagi lingkungan maupun manusia, tetapi belum menunjukkan hasil yang memuaskan dalam aplikasi di lapangan. Penelitian mengenai mekanisme ekspresi senyawa antifungi penting dilakukan sebagai pondasi dalam menyusun strategi pengendalian yang lebih baik, efektif dan efisien.
Tujuan Penelitian
Penelitian ini dilakukan dengan tujuan untuk mengkarakterisasi gen-gen yang terlibat dalam mekanisme ekspresi senyawa antifungi dari isolat bakteri antagonis G. boninense.
Manfaat Penelitian
Hasil yang diperoleh dari penelitian ini diharapkan dapat memberikan informasi mengenai gen yang terlibat dalam aktivitas antifungi dari bakteri antagonis G. boninense. Pengetahuan tersebut akan menjadi dasar awal dalam pendekatan molekuler untuk menghasilkan aktivitas antifungi yang lebih kuat, stabil atau sifat lain yang diinginkan. Hasil dari penelitian ini juga dapat menjadi langkah awal mempelajari jalur metabolisme yang mendasari mekanisme ekspresi antifungi dari bakteri antagonis yang sangat penting diketahui untuk menyusun strategi pengendalian G. boninense yang lebih baik dan terstruktur.
Ruang Lingkup Penelitian
3
2
TINJAUAN PUSTAKA
Kelapa Sawit
Kelapa sawit (Elaeis guineensis) merupakan tanaman monokotil yang termasuk dalam famili Arecaceae (klasifikasi sebelumnya Palmae) (Corley dan Tinker 2003). Kelapa sawit dapat dibedakan menjadi tiga tipe berdasarkan ketebalan cangkang buahnya yaitu tipe dura, pisifera dan tenera. Tipe dura memiliki cangkang tebal antara 2.5-5 mm dengan daging buah relatif tipis. Kernel (daging biji) biasanya besar dengan kandungan minyak rendah. Sedangkan tipe pisifera memiliki tempurung yang tipis bahkan hampir tidak ada. Sebaliknya, persentase daging buah cukup tinggi dan daging biji sangat tipis. Tipe pisifera dikenal dengan bunga betina yang gugur pada fase dini sehingga sangat sulit diperbanyak tanpa disilangkan dengan jenis lain (Purba et al. 1997).
Untuk mendapatkan sifat unggul dari kedua tipe tersebut, dilakukan persilangan tipe dura sebagai induk betina dan pisifera sebagai induk jantan menghasilkan kelapa sawit tipe tenera. Tipe tenera adalah tipe yang banyak ditaman di perkebunan kelapa sawit saat ini. Tipe ini memiliki ketebalan cangkang sedang, berkisar antara 0.5-2.5 mm dengan persentase daging buah tinggi antara 60-96%. Tandan buah yang dihasilkan tenera lebih banyak daripada dura, tetapi ukuran tandannya relatif lebih kecil (Purba et al. 1997).
Sejarah industri kelapa sawit di Indonesia dimulai tahun 1915 ketika bibit kelapa sawit dari Kebun Raya Bogor ditanam di Sumatera Utara (Lubis 1992). Kelapa sawit kemudian berkembang di daerah ini dan dibudidayakan secara komersial. Pengembangan areal kelapa sawit berkembang pesat tidak hanya di Sumatera tetapi meluas di Kalimantan, Sulawesi, Irian Jaya hingga Jawa Barat (Treu 1998). Hingga saat ini, Indonesia sendiri adalah negara penghasil minyak sawit terbesar di dunia (Ditjenbun 2014).
Cendawan Ganoderma boninense
Di antara patogen yang menyerang tanaman kelapa sawit, G. boninense
4
Database Sumatra Bioscience menunjukkan adanya kematian 40-50% tanaman pada usia 25 tahun dimana tanaman yang masih hidup menunjukkan gejala serangan G. bonionense. Akan tetapi pada bagian dimana sisa tanaman terdahulu tertinggal di lapangan pada masa replanting, serangan penyakit menjadi lebih parah hingga mencapai 25% dalam tujuh tahun saja. Pada lahan bekas kelapa, serangan mencapai 25% pada usia tanaman 10 tahun dan meningkat menjadi 40% dua tahun kemudian (Ariffin et al. 1996.). Kematian tanaman mulai memberikan dampak finansial ketika penyakit menyerang lebih dari 10% tanaman (Hasan & Turner 1998). Rata-rata penurunan yield tandan buah segar (TBS) adalah 0.16t/ha untuk setiap tanaman yang mati. Pengurangan tanaman hidup sebesar 50% menurunkan sekitar 35% yield TBS (Subagio & Foster 2003).
Berbagai upaya telah dikembangkan dalam mengatasi serangan G. boninense baik secara kimia, teknis maupun biologis. Penggunaan senyawa kimia seperti fungisida saat ini masih banyak dikembangkan meskipun tidak cukup memuaskan dalam mengontrol penyebaran G. boninense di lapangan (Sapak et al. 2008; Chung 1990). Penggunaan fungisida sistemik melalui metode injeksi pada batang dilaporkan dapat memperpanjang usia produksi tanaman sakit, tetapi tidak mampu memberikan kontrol yang efektif sehingga tanaman akhirnya akan mati dalam waktu yang tidak terlalu lama (Idris et al. 2004). Tey dan Ahdly (2007) melaporkan bahwa tidak terdapat perbedaan tingkat penyakit pada tanaman yang diinjeksi fungisida hexaconazole dibandingkan dengan kontrol tanpa perlakuan setelah rentang waktu delapan belas bulan.
Pilihan lain yang dilakukan di lapangan saat ini adalah dengan mencegah penyebaran inokulum G. boninense melalui kultur teknis misalnya dengan sanitasi lahan. Cara ini dilakukan misalnya dengan pembangunan kanal untuk mengisolasi tanaman yang sakit. Meskipun dapat membatasi penyebaran inokulum melalui kontak langsung, metode ini seringkali melelahkan dan kurang efektif baik dalam pengerjaannya maupun hasil yang diberikan.
Kemungkinan penggunaan kontrol biologis telah banyak diteliti untuk mengetahui keefektifannya sebagai agen biokontrol. Beberapa genus bakteri seperti Burkholderia (Bivi et al. 2010), Burkholderia cepacia (Sapak et al, 2008) dan Bacillus (Susanto et al. 2005; Suryanto et al. 2012) juga cendawan
Trichoderma (Abadi 1987; Purba et al 1994; Illias & Abdullah 1999) terlihat menjanjikan pada pengujian secara in vitro atau pengujian menggunakan bibit kelapa sawit. Aktivitas mikoriza arbuskular diketahui juga berperan dalam menunda laju infeksi G. boninense pada bibit kelapa sawit (Coombs, 2012). Meskipun demikian, hasil tersebut terjadi pada lingkup penelitian laboratorium yang sangat terkontrol. Hasil yang berbeda mungkin terjadi pada aplikasi di lapangan. Selain itu, penggunaan agen biokontrol atau senyawa yang dihasilkannya relatif lebih mahal dibandingkan senyawa fungisida sintetik. Hingga saat ini, belum ada aplikasi agen biokontrol komersial yang diterapkan secara luas di lapangan dengan hasil yang memuaskan (Fee 2011).
Transposon Mini-Tn5
5
mengakibatkan terganggunya ekspresi gen tersebut. Pada kondisinya di alam, elemen loncat juga berperan dalam perpindahan gen yang mengkode suatu sifat seperti patogenitas atau resistensi antibiotik antar organisme. Peristiwa penyisipan transposon pada sekuen DNA lain dikenal dengan transposisi yang dikatalisis oleh suatu enzim yaitu transposase (Tnp) (Berg & Berg 1983).
Salah satu transposon yang sering digunakan adalah transposon Tn5. Transposon ini merupakan transposon komposit berukuran 5.7kb membawa gen transposase dan gen resisten antibiotik kanamisin, bleomisin, dan streptomisin yang diapit dua daerah yang disebut IS (Insertion sequence) yaitu IS50R dan IS50L. Transposon Tn5 dibatasi oleh runutan 19 bp direct repeat yaitu inside end
(IE) dan outside end (OE) yang merupakan sekuens pengenalan enzim transposase. Transposon ini merupakan agen mutasi dengan kemampuan transposisi tinggi dan tempat penyisipan yang relatif acak di dalam genom inang (Berg 1984). Meskipun demikian,keberadaan enzim transposase yang masih aktif setelah penyisipan transposon ke dalam genom memungkinkan transposon berpindah tempat dan menyebabkan hasil sisipan yang tidak stabil (Herrero et al.
1990).
Gambar 1 Skema transposon Tn5 (A) dan mini-Tn5 (B) (Reznikoff 2003) Pemindahan gen transposase keluar elemen transposon menghasilkan mini transposon yang bersifat lebih stabil. Pada pengembangannya, diciptakan mini transposon TN-5 (Gambar 1) yang hanya terdiri dari suatu gen biomarker yang dibatasi runutan OE dan IE (de Lorenzo et al. 1990) sedangkan gen yang menyandikan enzim transposase terletak di luar mini transposon yaitu pada plasmid vektor (Herrero et al. 1990). Elemen mini-Tn5 biasanya dikonstruksi dalam suatu vektor plasmid bunuh diri (suicide plasmid), yaitu plasmid yang akan terdegradasi jika bakteri inang yang digunakan tidak memiliki kemampuan untuk mereplikasi plasmid ini. Salah satu contoh suicide plasmid adalah plasmid pUT. Pada replikasi plasmid pUT, diperlukan protein π yang berperan sebagai inisiator yang akan menempel pada bagian iteron oriR6K sehingga proses replikasi dapat terjadi (Ya-Bin 1998)
Penggunaaan suicide plasmid dalam proses transposisi sangat penting dilakukan untuk memastikan plasmid yang membawa gen penyandi transposase tidak bertahan dalam sel bakteri penerima. Apabila plasmid yang digunakan
OE Resistensi antiobiotik IE
OE IE Resistensi antiobiotik IE OE
Tn5 (5700 pb)
IS50L IS50R
6
masih terdapat dalam sel resipien, enzim transposase terus diproduksi sehingga memungkinkan transposon berpindah tempat dan menyisip berulang kali dalam kromosom. Hal ini akan sangat mengganggu kestabilan transposon dalam DNA resipien yang mengakibatkan kegagalan dalam memperoleh mutan yang tepat dan kesulitan dalam analisis lebih lanjut (Herrero et al. 1990, Ya-Bin 1998).
Gambar 2 Peta suicide plasmid pUT yang membawa mini-Tn5KmR (Artiguenave
et al. 1997). Gen penyandi enzim transposase (tnp*) terletak di luar runutan mini-Tn5
Transposon yang dikemas dalam plasmid pUT (Gambar 2) dipindahkan dari bakteri donor ke penerima melalui mekanisme konjugasi, yaitu perpindahan materi genetik antar bakteri dengan melalui pili. Perpindahan ini memerlukan faktor F (fertility factor) yang terdiri dari gen tra dan oriT (origin of transfer). Gen tra sendiri tersusun dari komponen dtr (DNA transfer and replication) dan
mpf (mating pair formation). Secara umum, dtr berperan dalam replikasi dan perpindahan plasmid ke sel penerima sedangkan mpf berfungsi dalam membentuk pili sebagai jembatan dalam proses konjugasi (Snyder & Champness 2007). Jika faktor F berasal dari bakteri donor secara langsung, proses perpindahan disebut dengan konjugasi biparental mating, sedangkan jika bakteri donor tidak memiliki faktor F, dibutuhkan bakteri lain pembawa faktor F yang disebut sebagai helper. Proses perpindahan yang melibatkan helper disebut sebagai konjugasi triparental mating (Achtman et al. 1978).
Analisis Genome Walking
7
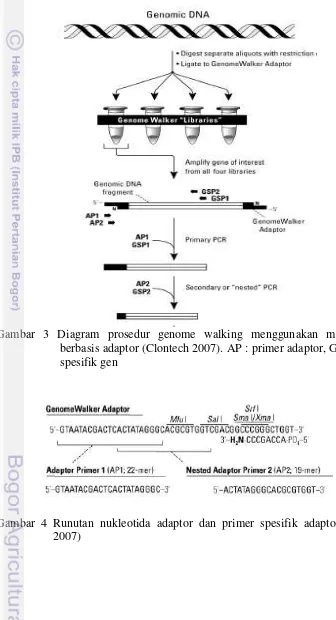
Pada penelitian ini, dilakukan strategi PCR berbasis adaptor untuk mengidentifikasi sekuen DNA pengapit transposon yang diasumsikan sebagai bagian dari gen yang berperan dalam aktivitas antifungi (Gambar 3). Fragmen adaptor disambungkan dengan kedua ujung fragmen DNA untuk memungkinkan amplifikasi daerah hulu dan hilir dari fragmen yang telah diketahui. Fragmen target diamplifikasi dengan menggunakan primer spesifik adaptor dan primer spesifik gen untuk mengetahui runutan DNA di antara primer tersebut (Clontech 2007).
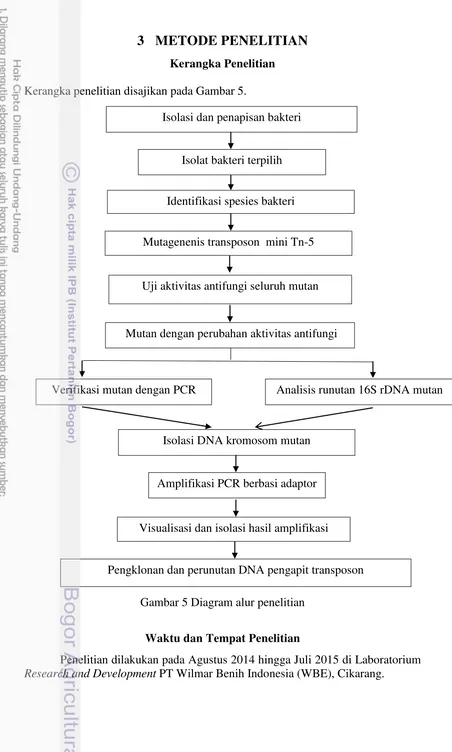
Gambar 3 Diagram prosedur genome walking menggunakan metode PCR berbasis adaptor (Clontech 2007). AP : primer adaptor, GSP : primer spesifik gen
8
3
METODE PENELITIAN
Kerangka Penelitian
Kerangka penelitian disajikan pada Gambar 5.
Gambar 5 Diagram alur penelitian
Waktu dan Tempat Penelitian
Penelitian dilakukan pada Agustus 2014 hingga Juli 2015 di Laboratorium
Research and Development PT Wilmar Benih Indonesia (WBE), Cikarang. Isolasi DNA kromosom mutan
Pengklonan dan perunutan DNA pengapit transposon Amplifikasi PCR berbasi adaptor
Visualisasi dan isolasi hasil amplifikasi Isolasi dan penapisan bakteri
Isolat bakteri terpilih
Identifikasi spesies bakteri
Mutan dengan perubahan aktivitas antifungi Uji aktivitas antifungi seluruh mutan
Mutagenenis transposon mini Tn-5
9
Prosedur Penelitian
Isolasi dan Penapisan Bakteri Antagonis G. boninense
Isolasi kandidat bakteri antagonis dilakukan dengan menggunakan tiga jenis sumber isolasi yaitu media tanam buatan jamur (tiram dan shitake), tanah rumah kaca dan janjangan kosong kelapa sawit. Isolasi dilakukan pada tiga jenis media agar yaitu media kings B, kings B 10% dan soil extract. Isolasi bakteri dilakukan dengan metode pengenceran bertingkat. Suspensi pada pengeceran 10-3, 10-4 dan 10-5 diambil masing-masing 100 µl dan disebar pada media agar dengan masing-masing 2 ulangan.
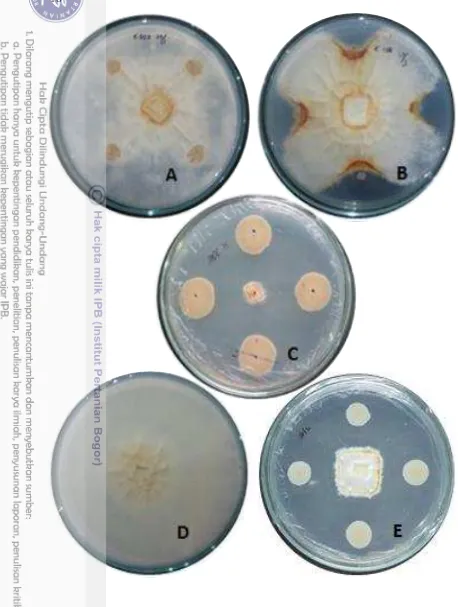
Skrining kandidat bakteri dilakukan berdasarkan kemampuan antagonisnya terhadap G. boninense secara in vitro pada media potato dextrose agar (PDA) yang dibagi menjadi delapan kuadran. Miselia G. boninense berumur tujuh hari diinokulasi tepat di tengah media PDA dan koloni bakteri diinokulasi pada bagian tepi kuadran dengan penotolan. Isolat bakteri E. coli dan aquades digunakan sebagai kontrol negatif sedangkan fitrat isolat CP01 digunakan sebagai kontrol positif. Isolat bakteri yang memiliki aktivitas penghambatan terhadap G. boninense diuji lebih lanjut dengan penotolan empat kuadran.
Uji Antagonis dengan Metode Tantang Kultur
Isolat bakteri yang menunjukkan aktivitas penghambatan pada penapisan awal diuji tantang dengan hifa G. boninense sesuai Jinantana dan Sariah (1998) dengan modifikasi pembuatan suspensi bakteri. Biakan bakteri antagonis ditumbuhkan pada media Kings B agar dan diinkubasi selama 2 x 24 jam. Hasil subkultur biakan bakteri diencerkan dalam larutan NaCl 0.8% hingga diperoleh suspensi bakteri dengan kerapatan sel 108 cfu mL-1 melalui pengukuran absorbansinya pada panjang gelombang 600nm (Sapak et al. 2008).
Isolat G. boninense B29 berumur tujuh hari diletakkan di tengah media PDA, kemudian suspensi bakteri digoreskan dengan jarak 3 cm dari miselium (gambar 2). Bakteri E. coli, media PDB, dan G. boninense tanpa perlakuan digunakan sebagai kontrol negatif sedangkan fitrat isolat CP01 dan fungisida digunakan sebagai kontrol positif. Aktivitas antagonis bakteri diamati setelah sepuluh hari inkubasi dengan menghitung radius pertumbuhan hifa normal G. boninense pada kontrol (R1) dan pertumbuhan hifa yang terhambat (R2). Data yang diperoleh ditransformasi menjadi nilai persentasi penghambatan pertumbuhan radial (percentage inhibition of radial growth/PIRG) sesuai Jinantana dan Sariah (1998) sebagai berikut :
x 100%
Uji Penghambatan Filtrat Bakteri terhadap G. boninense
10
Filtrat yang diperoleh dibagi menjadi tiga perlakuan yaitu tanpa pemanasan, pemanasan suhu 950C selama 15 menit dan penambahan proteinaseK 200 µg ml-1. Sebanyak 100µl filtrat masing-masing perlakuan dimasukkan ke dalam sumuran media PDA yang telah dicampurkan dengan suspensi miselium G. boninense. Filtrat bakteri E. coli, media King’s B, dan G. boninense tanpa filtrat digunakan sebagai kontrol negatif sedangkan fitrat isolat CP01 dan fungisida dithane digunakan sebagai kontrol positif. Masing-masing perlakuan dilakukan dengan 3 ulangan. Biakan diinkubasi pada suhu 28±2oC dan persentase nilai penghambatan pertumbuhan radial miselium G. boninense diukur setelah 3 hari inkubasi.
Identifikasi Spesies Bakteri Terpilih
Identifikasi spesies dilakukan melalui analisis gen penyandi 16s rRNA. Isolat bakteri ditumbuhkan dalam 10 mL media LB pada suhu 30oC selama 16 jam. DNA kromosom bakteri diisolasi sesuai protokol standar Wizard Genomic DNA Purification Kit (Promega, USA). Konsentrasi dan kemurnian DNA dianalisis menggunakan NanoDrop 2000 (Thermo Scientific, Wilmington, DE, USA). Amplifikasi gen penyandi 16S rRNA dilakukan dengan PCR menggunakan primer spesifik 63F dan 1387R sesuai Marchesi et al. 1998 (Tabel 1). Verifikasi dilakukan dengan elektroforesis pada gel agarosa 1% (w/v).
Produk PCR dimurnikan melalui purifikasi ExoSAP-IT sesuai protokol standar produk (ExoSAP-IT, USA). Sekuen nukleotida diurutkan melalui PCR cycle sesuai prosedur standar Big dye cycle sequencing kit. Purifikasi akhir hasil
PCR cycle dilakukan menggunakan Big dye x-terminator purification kit (Applied Biosystems, USA). Sekuen nukleotida diurutkan menggunakan ABI Prism 3030
Genetic Analyser (Applied Biosystems, USA). Analisis hasil sekuensing dilakukan dengan menggunakan software Geneious Pro™5.3.4 dan disejajarkan dengan dengan data base yang terdapat pada bank gen (www.ncbi.nlm.nih.gov)
melalui program Basic Local Alignment Search Tool (BLAST). Mutagenesis Menggunakan Transposon
Mutagenesis transposon terhadap isolat bakteri antagonis terpilih dengan menggunakan turunan transposon mini-Tn5KmR (de Lorenzo 1990) yang dikemas dalam plasmid pUT. Plasmid pUTmini-Tn5KmR diintroduksikan ke dalam sel bakteri antagonis menggunakan metode biparental mating pada kertas filter steril sesuai yang dideskripsikan oleh Oleza et al (2009). Bakteri donor E. coli S17-1( pir) dan bakteri antagonis terpilih (penerima) diinokulasi ke dalam media LB cair dengan penambahan antibiotik yang sesuai. Setelah disentrifugasi, sel bakteri donor dan resipien dicampurkan dengan perbandingan 1:1 (R+D). Campuran diinokulasi sebanyak 30 µl pada kertas filter milipore 0.45 µm steril dan diletakkan di atas media LA. Kultur bakteri donor (D) dan resipien (R) diinokulasi secara terpisah pada media LA sebagai kontrol negatif. Kertas filter berisi kultur bakteri diinkubasi selama 7 jam pada suhu 370C. Kertas filter berisi sel bakteri kemudian divortex dalam larutan NaCl 0.8% hingga diperoleh suspensi bakteri.
11
Suspensi bakteri yang sama (D+R) diencerkan hingga 10-6. Sebanyak 100 µL dari masing-masing pengenceran disebar pada media M9 tanpa penambahan antibiotik untuk menghitung total resipien. Kultur diinkubasi pada suhu yang sesuai selama 2 x 24 jam. Bakteri yang mampu tumbuh pada media M9+kanamisin ditandai sebagai bakteri penerima yang diduga telah disisipi mini-Tn5 pada genomnya. Frekuensi transkonjugasi dihitung sebagai jumlah bakteri konjugan yang tumbuh pada media selektif dibagi dengan jumlah keseluruhan sel resipien.
Penapisan bakteri mutan yang membawa mini-Tn5 dilakukan melalui uji antagonis G. boninense dengan metode totol empat kuadran. Mutan target yaitu mutan yang mengalami perubahan kemampuan penghambatan terhadap G. boninense diperkirakan telah mengalami mutasi pada sekuen gen yang berperan dalam aktivitas antifungi.Verifikasi mutan target dilakukan dengan analisis gen penyandi 16srRNA dan dibandingkan dengan isolat tipe awal. Verifikasi juga dilakukan dengan PCR koloni menggunakan primer spesifik kanamisin.
Deteksi dan Identifikasi Fragmen Gen Pengapit Transposon
Identifikasi DNA pengapit transposon pada mutan target dilakukan menggunakan metode genome walking melalui PCR dengan penambahan adaptor spesifik sesuai dengan protokol standar Clontech universal genome walker
(Clontech Laboratories Inc, Takara Bio Company). PCR dilakukan dengan menggunakan dua pasang primer spesifik gen dan primer spesifik adaptor (Tabel 1). Langkah pertama adalah mendesain dua pasang primer spesifik gen (gene spesific primer/GSP) berdasarkan pada runutan gen resisten kanamisin (Kmr) dari transposon Tn903 (Tabel 1). Desain GSP1 dirancang untuk mengamplifikasi DNA pengapit dari gen Kmr ke arah luar sedangkanGSP 2 dirancang dari runutan nukleotida di sebelah hulu atau hilir GSP 1 ke arah luar.
Tabel 1 Daftar primer yang digunakan dalam penelitian No Primer Sekuens (5’3’)
12
menggunakan T4 DNA Ligase (NEB, USA) dan digunakan sebagai cetakan dalam amplifikasi PCR genome walking.
Amplifikasi PCR primer dilakukan dalam campuran 10 l goTaq (Promega), 1 l primer GSP1 10 pmol, 1 l primer AP1 10 pmol (Clontech, USA), 1 l DNA cetakan dan 7 l ddH2O. Reaksi PCR dijalankan dengan kondisi sebagai berikut;95 °C 3 menit, 7 siklus (94 °C 25 detik, 72 °C 3 menit), dilanjutkan dengan 32 siklus (94 °C 25 menit, 67 °C 3 menit) dan 67°C 7 menit. Produk PCR primer digunakan sebagai cetakan pada PCR selanjutnya yaitu PCR sekunder atau PCR tersarang (nested PCR).
PCR tersarang dilakukan menggunakan 10 l goTaq (Promega), 1 l primer GSP2 10 pmol, 1 l primer AP2 10 pmol (Clontech, USA), 1 l DNA cetakan and 7 l ddH2O. Reaksi PCR dijalankan dengan kondisi sebagai berikut; 95 °C 3 menit, 5 siklus (94 °C 25 detik, 72 °C 3 menit), dilanjutkan dengan 20 siklus (94 °C 25 menit, 67 °C 3 menit) dan 67°C 7 menit. Visualisasi produk PCR dilakukan melalui elektroforesis pada gel agarosa 1% (w v-1) dengan pewarnaan
ethidium bromide (EtBr). Pita hasil amplifikasi dimurnikan menggunakan QIA Quick Gel Extraction Kit (Qiagen, Valencia, California).
Kloning gen penyandi protein antifungi
Produk amplifikasi genome walking disambungkan dengan plasmid pGEMT Easy (Gambar 6) menggunakan enzim T4 DNA ligase. Reaksi ligasi diinkubasi selama 16 jam pada suhu 16ºC. Pembuatan Escherichia coli Top10 kompeten dilakukan dengan perlakuan CaCl2 (Lampiran 1). Plasmid rekombinan diintroduksikan ke dalam sel kompeten dengan perlakuan kejut panas (heat shock) pada suhu 42oC selama 90 detik. Bakteri disebar pada media LA yang mengandung antibiotik ampisilin 100 µg mL-1. Seleksi bakteri transforman dilakukan dengan seleksi biru putih (blue white selection) seperti dideskripsikan oleh Sambrook (1989). Sebagai kontrol digunakan sel E. coli kompeten yang ditumbuhkan pada media LA dengan dan tanpa penambahan antibiotik ampisilin.
13
Analisis runutan DNA pengapit transposon
Fragmen DNA pengapit transposon digunakan sebagai cetakan dalam PCR
cycle sequencing menggunakan Big Dye® Terminator Cycle sequencing Kit v3.1 (Applied Biosystem, California) dengan primer GSP2 dan ASP2 untuk mengamplifikasi DNA sisipan. Produk Cycle sequensing dimurnikan mengikuti protokol standar BigDyeR X-Terminator Purification kit (Applied Biosystems, Foster City, California) dan dilakukan perunutan menggunakan perangkat ABI
Prism™ 3030 Genetic Analyzer (Applied Biosystems, Foster City, California). Analisis hasil sekuensing dilakukan dengan menggunakan software Geneious
Pro™5.3 dan disejajarkan dengan database pada bank gen (www.ncbi.nlm.nih.gov) melalui program Basic Local Alignment Search Tool
14
4
HASIL DAN PEMBAHASAN
Pemilihan Isolat Bakteri Antagonis G. boninense
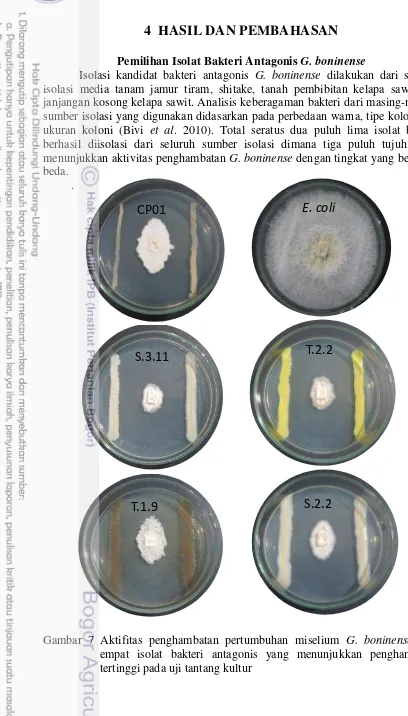
Isolasi kandidat bakteri antagonis G. boninense dilakukan dari sumber isolasi media tanam jamur tiram, shitake, tanah pembibitan kelapa sawit dan janjangan kosong kelapa sawit. Analisis keberagaman bakteri dari masing-masing sumber isolasi yang digunakan didasarkan pada perbedaan warna, tipe koloni dan ukuran koloni (Bivi et al. 2010). Total seratus dua puluh lima isolat bakteri berhasil diisolasi dari seluruh sumber isolasi dimana tiga puluh tujuh isolat menunjukkan aktivitas penghambatan G. boninense dengan tingkat yang berbeda-beda.
.
Gambar 7 Aktifitas penghambatan pertumbuhan miselium G. boninense oleh empat isolat bakteri antagonis yang menunjukkan penghambatan tertinggi pada uji tantang kultur
T. .
T. .9
S. .
S. .
E. coli
15
Komposisi bakteri pada media sampel bag-log jauh lebih sedikit dibandingkan sampel tanah, begitu juga jumlah bakteri yang menunjukkan aktivitas penghambatan. Hal ini mungkin disebabkan karena substrat dan interaksi antar bakteri yang terbatas. Selain itu, bag-log jamur telah melewati proses sterilisasi dengan perebusan sehingga komposisi mikroba di dalamnya telah banyak berkurang.
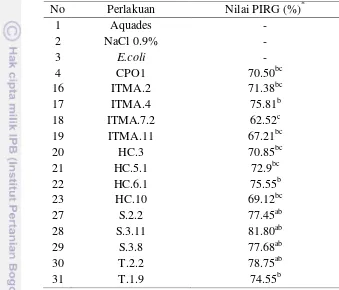
Tabel 2 Aktivitas penghambatan oleh kandidat bakteri potensial terhadap miselium G. boninense
*
Nilai PIRG setelahinkubasi selama 10 hari
Nilai yang ditandai dengan huruf yang sama tidak memiliki perbedaan yang signifikan berdasarkan uji Tukey’s (P<0,05).
Tiga belas isolat bakteri yang diteliti menunjukkan nilai penghambatan radial (percentage inhibition of radial growh/PIRG) di atas 50% (Tabel 2). Pada tahap ini, isolat S.3.11 menunjukkan penghambatan sel tertinggi (81.80%) diikuti isolat T.2.2 (78.75%). Nilai penghambatan ini lebih besar dibandingkan CP01 (70.50%). Hal ini menjadi awal yang menarik mengingat isolat CP01 merupakan bakteri antagonis G. boninense dengan penghambatan yang kuat dan stabil. Secara umum, bakteri yang memiliki nilai PIRG lebih dari 40% berpotensi untuk digunakan sebagai agen biokontrol (Susanto et al. 2005).
16
tersebut senyawa antifungi yang berupa protein akan rusak atau berkurang aktivitasnya.
Tabel 2 Aktivitas penghambatan ekstrak kasar lima bakteri potensial dengan aktivitas penghambatan tertinggi pada uji tantang kultur
Kode isolat Zona penghambatan setelah inkubasi selama 3 hari (mm) Tanpa perlakuan Pemanasan 950C
selama 15 menit
Dalam pengujian ini, aktivitas penghambatan oleh ekstrak kasar kelima isolat bakteri relatif stabil terhadap pemanasan maupun penambahan proteinase K. Meskipun demikian, derajat penghambatan oleh ekstrak kasar tidak selalu berbanding lurus dengan penghambatan oleh sel bakteri. Isolat dengan kode S.3.11 yang memiliki aktivitas penghambatan sel tertinggi pada uji tantang kultur menunjukkan nilai penghambatan ekstrak kasar yang lebih rendah dibandingkan S.2.2. Hasil ini menunjukan bahwa bakteri yang berbeda mungkin mensekresikan senyawa antifungi pada waktu yang berbeda sesuai dengan regulasi ekspresi pada isolat tersebut. Isolat S.2.2 menunjukkan aktivitas penghambatan hampir setara dengan aktivitas fungisida komersial dithane 0.1% sehingga memiliki potensi besar untuk dikembangkan sebagai biokontrol G. boninense.
17
Identifikasi spesies S.2.2 dengan amplifikasi gen penyandi 16S rRNA menghasilkan fragmen amplikon berukuran kurang lebih 1300 pb. Perunutan fragmen amplikon berhasil mengidentifikasi 1164 pb runutan gen penyandi 16S rRNA yang menunjukkan 99% kemiripan dengan Burkholderia gladioli strain ATCC 10248 (accession number CP009322.1) (Gambar 8). Isolat S.2.2 selanjutnya disebut sebagai B. gladioli JR01.
Mutagenesis Transposon
18
19
Selain perubahan pada aktivitas antifungi yang dimilikinya, mutan BglK498 juga menunjukkan penghambatan yang drastis pada pertumbuhannya. Di sisi lain, mutan BglK226 memperlihatkan warna koloni yang berubah dari putih susu menjadi cokelat terang dan penampakan koloni yang jauh lebih berlendir. Hal ini mungkin terjadi karena fragmen transposon menyisip pada gen yang berperan juga dalam pertumbuhan dan pigmentasi sel bakteri. Selain itu, kemungkinan fragmen transposon menyisip pada regulator tertentu yang mengontrol ekspresi lebih dari satu gen sehingga inaktivasinya dapat memunculkan beberapa perubahan fenotip tertentu. Menariknya, ketiga mutan tidak menunjukkan perubahan fisik yang berarti pada media LA dan King’s B . Hal ini mungkin disebabkan karena komposisi media yang berbeda sehingga mutan memberikan respon yang juga berbeda.
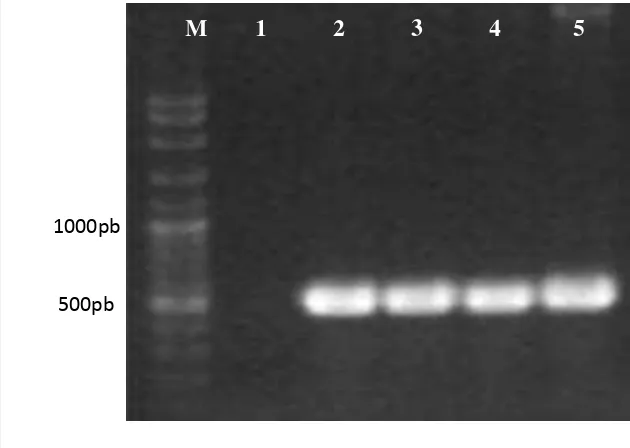
Gambar 10 Visualisasi hasil amplifikasi gen kanamisin menggunakan primer spesifik Kan_1F dan Kan_1R. Hasil positif menunjukkan adanya pita amplikon berukuran sekitar 600 pb
Meskipun memiliki penampakan morfologi yang berbeda dari isolat tipe asalnya, ketiga mutan tersebut dipastikan merupakan mutan JR01 yang disisipi elemen transfer dari transposon mini-Tn5. Hal ini dibuktikan dari hasil analisis gen 16s rRNA ketiga mutan yang menunjukkan 100% kesamaan dengan isolat JR01. Verifikasi melalui PCR koloni dilakukan untuk menghindari hasil positif palsu yang disebabkan karena mutasi spontan atau kontaminasi. Amplifikasi menggunakan primer 1F dan 1R menunjukkan adanya pita amplikon berukuran sekitar 600 pb pada ketiga mutan, tetapi tidak ada pada amplifikasi PCR koloni JR01 tipe asal (Gambar 10). Hal ini menunjukkan bahwa transposon mini-Tn5
telah berhasil menyisip pada bagian tertentu dalam kromosom mutan. Penyisipan fragmen transposon pada gen-gen yang diasumsikan berperan dalam aktivitas
M 1 2 3 4 5
1000pb
20
antifungi isolat JR01 menghasilkan ketiga mutan dengan perubahan aktivitas antifungi terhadap G. boninense.
Dalam penelitian ini,
Identifikasi Sekuen Pengapit Transposon Mini Tn5
Dua mutan yang mengalami penurunan aktivitas antagonis dikarakterisasi menggunakan teknik genome walking dengan PCR-adaptor. Pada tahap ini, DNA kromosom mutan diisolasi dan dipotong menggunakan enzim restriksi EcoRV,
SnaBI dan FspI. Pemotongan DNA kromosom dimaksudkan untuk memperkecil ukuran DNA dan memungkinkan penempelan adaptor. Fragmen-fragmen DNA kemudian disambung dengan adaptor untuk memberikan informasi runutan DNA pada kedua ujung fragmen agar dapat dilakukan amplifikasi PCR.
Gambar 11 Visualisasi hasil amplifikasi PCR dengan penambahan adaptor menggunakan DNA kromosom mutan BglK259 dan BglK498. Hasil amplifikasi DNA mutan BglK498 yang dipotong dengan EcoRV menunjukkan pita amplikon beukuran sekitar 650 pb (3b) sedangkan DNA mutan BglK259 yang dipotong dengan EcoRV menghasilkan pita amplikon berukuran sekitar 750 pb (3a). Amplifikasi pada DNA dengan pemotongan FspI dan SnaBI tidak menghasilkan pita amplikon. Keterangan: (M) Marker 1kb; (a) mutan BglK259; (b) mutan BglK498; DNA cetakan dipotong dengan enzim FspI (1),
SnaBI (2) dan EcoRV (3)
Amplifikasi PCR adaptor pada kedua mutan berhasil dilakukan pada DNA kromosom yang dipotong dengan EcoRV. Amplifikasi pada masing-masing mutan menghasilkan sebuah pita amplikon tunggal (Gambar 11). Meskipun demikian, amplifikasi menggunakan hasil pemotongan enzim FspI dan SnaBI tidak menghasilkan fragmen amplikon. Pemotongan dengan kedua enzim ini kemungkinan menghasilkan fragmen DNA target yang berukuran sangat besar. Metode berbasis PCR dapat mengamplifikasi fragmen DNA yang terbatas, sehingga tidak optimal untuk diterapkan pada runutan DNA genom yang terlalu
Primer GSP2 F dan ASP2 Primer GSP2 R dan ASP2
21
Analisis runutan nukleotida mengindikasikan adanya fragmen transposon mini Tn5 yang diakhiri dengan 19 pb runutan CTGTCTCTTGATCAGATCT (IE) atau ACTTGTGTATAAGAGTCAG (OE) (de Lorenzo et al. 1990). Posisi sekuen pengapit yang berhasil diamplifikasi dari kedua mutan berada pada sisi yang berbeda dari sekuen 19 pb (Gambar 12) mengindikasikan amplikon yang diperoleh berasal dari primer yang berbeda. Hal ini menunjukkan bahwa kedua primer yang digunakan dapat menghasilkan produk PCR genomewalking dengan benar melewati ujung 19 pb ke arah DNA pengapit.
Gambar 12 Peta fragmen hasil amplifikasi genome walking pada mutan BglK259 (atas) dan BglK498 (bawah)
Pensejajaran pada database bank gen menunjukkan kesamaan antara 157 pb runutan DNA pengapit transposon dari mutan BglK259 dengan sebagian regulator transkripsi tipe LysR dari B. gladioli strain ATCC 10248 (query cover 100%,
identity 100%) (Gambar 13). Regulator transkripsi tipe LysR (LysR-type transcriptional regulator/LTTR) merupakan regulator yang dapat berperan sebagai aktivator maupun represor bagi gen tunggal ataupun operon (Heroven & Dersch 2006).
Gambar 13 Hasil pensejajaran runutan DNA pengapit transposon mini-Tn5KmR dari mutan BglK498. Query : runutan DNA pengapit, Sbjct : runutan sebagian gen LTTR B. gladioli strain ATCC 10248 berdasarkan data base gene bank (www.ncbi.nlm.gov).
22
Kim et al. (2004) melaporkan bahwa LTTR berperan dalam mekanisme
quorum sensing pada Burkholderia glumae. Quorum sensing merupakan sistem komunikasi antar sel yang didasarkan pada pengeluaran suatu molekul sinyal ke lingkungan. Bersamaan dengan peningkatan pertumbuhan, konsentrasi molekul sinyal akan bertambah mencapai batas minimal yang memicu regulasi suatu gen target (Williams 2007). Beberapa penelitian melaporkan bahwa quorum sensing
juga mengatur ekspresi sebagian senyawa antifungi pada beberapa spesies
Burkholderia (Zhou et al. 2003; Schmidt et al. 2009). Inaktivasi pada gen regulator akan mengganggu mekanisme quorum sensing yang menyebabkan aktivitas antifungi menurun. Meskipun demikian, mekanisme quorum sensing
secara umum juga tergantung pada strain yang diteliti (Wopperer et al. 2006). Di sisi lain, 67 pb runutan DNA pengapit transposon mutan BglK498 menunjukkan kesamaan dengan sebagian gen penyandi proton-translocating NADH-quinone oxidoreductase (NDH-1) dari B. gladioli strainyang sama (query cover 100%, identity 97%) (Gambar 14). NDH-1 merupakan komponen penting reaksi fosforilasi oksidatif dan transfer elektron dari NADH ke quinone (Yagi et al. 1998; Yagi et al. 2001). Reaksi ini berperan dalam respirasi maupun fotosintesis (Spero 2015). Kegagalan dalam melakukan respirasi secara normal menyebabkan perubahan level ATP yang berfungsi sebagai sumber energi.
Gambar 14 Hasil pensejajaran runutan DNA pengapit transposon mini-Tn5KmR dari mutan BglK498. Query = runutan DNA pengapit, Sbjct = runutan sebagian gen NDH-1 B. gladioli strain ATCC 10248 berdasarkan data base gene bank (www.ncbi.nlm.gov).
Hipotesis awal menduga bahwa ketidakseimbangan level ATP seiring dengan penurunan ketersediaan energi pada mutan NDH-1 kemungkinan mengakibatkan ketidakseimbangan metabolisme yang mempengaruhi pertumbuhan maupun produksi metabolit sekunder, termasuk senyawa antifungi. Hipotesis ini didasarkan pada penelitian Lee et al. (2012) mengenai gen yang berperan dalam aktivitas antifungi bakteri biokontrol Burkholderia pyrrocinia
melalui inaktivasi gen pengkode adenylate kinase. Adenylate kinase memainkan peran kunci dalam reaksi konversi ATP + AMP menjadi ADP (Glaser et al. 1975). Kerusakan gen ini pada mutan B. pyrrocinia M208 menyebabkan ketidakseimbangan jumlah ATP/ADP/AMP di dalam sel yang berakibat hilangnya aktivitas antifungi sekaligus penghambatan pertumbuhan yang bersifat sementara. Meskipun demikian, diperkirakan bahwa penurunan aktivitas antifungi pada mutan
adenylate kinase tidak disebabkan karena gangguan pada pertumbuhannya.
23
Terdapat kemungkinan bahwa mutan BglK498 adalah mutan pleiotropic dimana NDH-1 sebenarnya tidak berperan dalam aktivitas antifungi. Penurunan aktivitas antifungi sebagai efek yang terjadi karena penghambatan pertumbuhan. Terganggunya level ATP di dalam sel mutan mengakibatkan mutan gagal tumbuh dengan baik dan mengganggu seluruh metabolisme di dalam sel termasuk produksi dan sekresi senyawa antifungi. Akan tetapi, penghambatan pertumbuhan mutan BglK498 hanya terjadi saat ditumbuhkan pada media PDA sedangkan pertumbuhan relatif normal pada media LA dan Kings’ B.
Sejauh yang diketahui, penelitian ini adalah yang pertama kali melaporkan keterlibatan gen NDH-1 dalam mekanisme antifungi B. gladioli.
24
5 KESIMPULAN DAN SARAN
Kesimpulan
B. gladioli JR01 menunjukkan aktivitas antagonis yang kuat dan stabil terhadap G. boninense pada pengujian in vitro. Mutagenesis transposon menggunakan mini-Tn5KmR menghasilkan dua mutan yang mengalami penurunan aktivitas penghambatan (down regulation) yaitu mutan BglK259 dan
BglK498. Karakterisasi runutan DNA pengapit transposon menunjukkan kemiripan yang tinggi dengan sebagian gen penyandi LysR-type transcriptional regulator (BglK259) dan gen proton-translocating NADH-quinone oxidoreductase (BglK498). Kedua gen ini diduga terlibat dalam aktivitas antifungi B. gladioli sehingga inaktivasinya menyebabkan penurunan aktivitas dimana gen NDH-1 terlibat juga dalam mengatur pertumbuhan.
Saran
25
DAFTAR PUSTAKA
Abadi Al. 1987. Biologi Ganoderma boninense Pat pada Kelapa Sawit (Elaeis guineensis Jacq) dan Pengaruh Beberapa Mikroba Tanah Antagonistik terhadap Pertumbuhannya [Disertasi]. Bogor : Institut Pertanian Bogor. Achtman M, Morelli G, Schwuchow. 1978. Cell-cell interactions in conjugating
Escherichia coli: role of F pili and fate of mating aggregates. J. Bacteriol
135:1053-1061.
Ariffin D, Idris AS, Singh G. 2000. Status of Ganoderma in oil palm (chapter) in Flood J, Bridge PD, Holderned P. Ganoderma Disease of Perennial Crops. CABI Wallingfod 49-68.
Artiguenave F, Vilagines R, Danglot C. 1997. High-efficiency mutagenesis by electroporation of a Pseudomonas fluorescens strain. FEMS Microbiol. 153: 363-369.
Ashoub A, Abdalla KS. 2006. A primer based approach to genome walking. Plant Mol Biol Reporter. 24: 237-243.
Berg DE, Berg CM. 1983. The Prokaryotic Transposable Element Tn5 Review Article. Nature Biotech Juli 1983.
Berg DE, Berg CM, Sasakawa C. 1984. Bacterial transposon Tn5: evolutionary inferences. Mol Biol Evol 1:411-422.
Bivi MR, Farhana MS, Khairulmazmi A, Idris A. 2010. Control of Ganoderma boninense: A Causal Agent of Basal Stem Rot Disease in Oil Palm with Endophyte Bacteria in Vitro. Int J Agric Biol 12(6): 833-839.
Clontech. 2007. Genome Walker TM universal kit manual.
Coombs A. 2012. Fighting microbes with microbes. The Scientist.
Corley R, Tinker P. 2003. Vegetative Propagation and Biotechnology. The Oil
de Lorenzo V, Herrero M, Jakubzik U, Timmis KN. 1990. Mini Tn-5 transposon derivatives for insertion mutagenesis, promoter probing and chromosomal insertion of cloned DNA in gram-negative eubacteria. J. Bacteriol
172:6568-6572.
[Ditjenbun] Direktorat Jenderal Perkebunan. 2014. Pertumbuhan Areal Kelapa Sawit. http://ditjenbun.pertanian.go.id/.2014.
Fee CG. 2011. Management of Ganoderma Diseases in Oil Palm Plantations.The Planter. 87(1022):325-339.
Glaser M, Nulty W, Vagelos PR. 1975. Role of adenylate kinase in the regulation of macromolecular biosynthesis in a putative mutant of Escherichia coli
defective in membrane phospholipid biosynthesis. J. Bacteriol 123:128-136.
Hasan Y, Turner PD. 1998. The comparative importance of different oil palm tissues as infection sources of basal stem rot in replanting. The Planter
74:117-135.
26
insertion of foreign genes in gram-negative bacteria. J. Bacteriol
172:6557-6567.
Ho YW, Nawawi A. 1985. Ganoderma boninense Pat. From basal stem rot of oil palm (Elaeis guineensis) in Peninsular Malaysia. Pertanika 8(3): 425-428. Idris AS, Arifin D, Watt TA, Swinburne TR. 2001. Distribution of species of
Ganoderma basal stem rot of oil palm in relation to the environmental condition in peninsular Malaysia. Proc PIPOC 2001. International Palm Oil Congress (Agriculture) Malaysia.
Idris AS, Kushairi A, Ismail S, Ariffin D. 2004. Selection for partial resistance in oil palm progenies to ganoderma basal stem rot. J of Oil Palm Research
16:12-8.
Jinantana J, Sariah M, 1997. Antagonistic effect of Malaysian isolates of
Tricoderma harzianum and Gliocladium viren on Sclerotium rolfsii. pertanika. J Trop Agric Sci. 20: 35-41.
Kim J, Kim JG, Kang Y, Jang JY, Jog GJ, Lim JY, Kim S, Suga H, Nagamatsu T and Hwang I. (2004). Quorum sensing and the LysR-type Transcriptional Activator ToxR Regulate Toxoflavin biosynthesis and transport in Burkholderia glumae. Mol Microbiol 54, 921–934.
Lee KW, Kong HG, Lee SW. 2012. Identification of a gene encoding adenylate kinase involved in antifungal activity expression of the biocontrol strain
Burkholderia pyrrocinia CH-67. Plant Pathol J. 28(4): 373-380.
Lubis A, Naibaho PM. 1995. Prospek pengembangan industri hilir pengolahan kelapa sawit. PPKS, Medan.
Marchesi JR, Sato T, Weightman AJ, Martin TA, Fry J, Hiom SJ, Wade WG. 1998. Design and evaluation of useful bacterium-specific PCR primers that amplify genes coding for bacterial 16s rRNA. App Environ Microbiol. 64(2): 795-799.
Oleza JA, Galmes AB, Lalucar J, Nogales B and Bosch R. MiniUIB, A Novel Minitransposon-Based System for Stable Insertion of Foreign DNA into the Genomes of Gram Negative and Gram Positive Bacteria. Appl Environ Microbiol 79:5 (1629-1638).
Paterson RRM, Moen S, Lima N. 2009. The feasibility of producing oil palm with altered lignin content to control Ganoderma disease. J Phytopathol 157 : 649-656.
Purba AR, Akiyat, Muluk C. 1997. Bahan tanaman kelapa sawit asal Pusat Penelitian Kelapa Sawit (PPKS). Proc. Pertemuan teknis kelapa sawit. Medan.
Purba RY, Sipayung A, Lubis RA. 1996. Pengaruh penambahan cendawan antagonis Trichoderma harzianum terhadap perkembangan inokulum
Ganoderma di tanah. Jurnal Penelitian Kelapa Sawit 4(2):69-75.
Purnamasari MI, Prihatna C, Gunawan AW, Suwanto A. 2012. Isolation and molecular identification of Ganoderma spp associated with basal stem rot disease in oil palm. J Fitopatol Indon. 8(1): 9-15.
Reznikoff WS. 2003. Microreview Tn5 as a model for understanding DNA transposition. Mol Microbiol. 47: 1199-1206.
27
Sapak Z, Meon S, Ahmad ZAM. 2008. Effect of Endophytic Bacteria on Growth and Suppression of Ganoderma Infection in Oil Palm. Int J Agri Biol. 10(2): 127-132.
Sarim D. 2013. Can beneficial microbes protect oil palm from Ganoderma boninense?. The Planter. 89(1053):895-907.
Schmidt S, Blom JF, Pernthaler J, Berg G, Baldwin A, Mahenthiralingam E et al. 2009. Production of The Antifungal Compound Pyrrolnitrin is Quorum Sensing-regulated in Members of the Burkholderia cepacia Complex. Environ. Microbiol. 11:1422–1437.
Semangun H. 1990. Penyakit-Penyakit Tanaman Perkebunan di Indonesia. Yogyakarta : Gajah mada University Press.
Snyder L, Champness W. 2007. Molecular Genetic of Bacteria. Washington DC. ASM Press.
Subagio A, Foster HL. 2003. Implication of Ganoderma disease on loss in stand and yield production of oil palm in North Sumatra. Proceeding of the MAPPS Conference. Kuala Lumpur.
Suryanto D, Wibowo RH, Siregar EBM, Munir E. 2012. A posibility of chitinolytic bacteria utilization to control basal stems disease caused by
Ganoderma boninense in oil palm seedling. Afr J Microbiol Res. 6(9): 2053-2059.
Susanto A. 2002. Kajian Pengendalian Hayati Ganoderma boninense Pat. Penyebab Penyakit Busuk Pangkal Batang Kelapa Sawit [Disertasi]. Bogor: Institut Pertanian Bogor.
Susanto A, Sudharto PS, Purba RY. 2005. Enhancing Biological Control of Basal Stem Rot Disease (Gnaoderma boninense) in Oil Palm Plantations.
Mycopathol. 159: 153-157.
Tey CC, Mohd Ahdly A. 2007. Mitigating measures againts Ganoderma basal stem rot of oil palm. In PIPOC 2007 Int Palm Oil Cong-Agris Biotech and Sustain Conf vol 2 (Ahmad Kushairi Din et al.) Malaysian palm Oil Board, Kuala lumpur 866-880.Turner PD. 1981. Oil Palm Diseases and Disorders. The incorporated Society of Planter. Kuala Lumpur. Oxford University Press. 280.
Treu R. 1998. Macro fungi in oil palm plantations of South East Asia. J. Gen. Mycol 12(1):10-14.
Turner PD. 1981. Oil Palm Diseases and Disorders. The incorporated Society of Planter. Kuala Lumpur. Oxpord University Press. 280.
Williams, P. 2007. Quorum sensing, Communication and Cross-kingdom Signalling in The Bacterial World. Microbiol 153:3923–3938.
Wong LC, Bong CFJ, Idris AS. 2012. Ganoderma spesies associated with basal stem rot disease of oil palm. Americ J App Sci. 9(6):879-885.
quorum-28
sensing-regulated functions within the Burkholderia cepacia complex.
Appl.Environ. Microbiol. 72:1579–1587.
Ya-bin L, Datta HJ, Bastia D. 1998. Mechanistic studies of initiator-initiator interaction and replication initiation. The EMBO J. 17: 5192-5200.
29
LAMPIRAN
Lampiran 1 Pembuatan sel kompeten dengan perlakuan CaCl2(Sambrook et al. 1989)
Sebanyak 2 mL biakan E.coliDH5α umur 12 jam dikulturkan ke dalam 40
30
RIWAYAT HIDUP
Penulis dilahirkan di Wonogiri pada tanggal 17 September 1989 sebagai anak ketiga dari pasangan Sutardi Hadi Wiyoto dan Kastini. Penulis menyelesaikan pendidikan menengah atas di SMA Negeri I Baturetno pada tahun 2007. Pendidikan sarjana ditempuh di Program Studi Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Sebelas Maret (UNS) Surakarta lulus pada tahun 2013. Pada tahun yang sama, penulis diterima sebagai mahasiswa Program Pascasarjana IPB di Departemen Bioteknologi dengan Beasiswa Pendidikan Pascasarjana Dalam Negeri (BPP-DN) yang diberikan oleh Direktorat pendidikan Tinggi (DIKTI) pada tahun 2013.