MEMENGARUHI PROFIL REPRODUKSI
TIKUS JANTAN DAN BETINA F0 DAN F1
UMI KULSUM
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Konsumsi Tepung Kedelai dan Isolat Protein Kedelai Memengaruhi Profil Reproduksi Tikus Jantan dan Betina F0 dan F1 adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2013
UMI KULSUM. Dietary Soy Flour and Soy Protein Isolate Affect Reproduction Profile of F0 and F1 Male and Female Rats. Under direction of NURHENI SRI PALUPI dan ENDANG PRANGDIMURTI.
Beside as protein source, soy flour and soy protein isolate contain isoflavone. Many research have shown that isoflavone has beneficial effect for female reproduction but the effect for male and their offspring reproduction still unclear. The aim of this study is to determine the effect of dietary soy flour and soy protein isolate on growth, weight organ and testosteron & estrogen of F0 and F1 rats and reproduction profile of F0 rats. The thirty five male and female rats were divided into seven groups (n=5), there are three of soy flour groups, three of soy protein isolate for different concentration and one with casein as control group. After 30 days, the rats were mated so that entered gestation and lactation period. After lactation period, the rat's offspring were treated during 30 days. Dietary soy flour (8,69%, 13,04%, 17,38%) and soy protein isolate (10,6%, 15,91%, 21,21%) increased the sperm concentration and decreased sperm abnormality of F0 male rats than control. Moreover, dietary soy protein isolate increased motility of sperm. In addition, dietary soy flour increased level of testosterone until exceeded normal concentration. No difference effect between dietary soy flour and soy protein isolate toward level of estrogen, percent of gestation and litter size of F0 female rats and level of estrogen F1 female rats. However, dietary soy flour (10%, 15%, 20%) and soy protein isolate (15,15%, 22,72%, 30,3%) during 30 days after lactation increased growth rate of F1 rats than control.
Memengaruhi Profil Reproduksi Tikus Jantan dan Betina F0 dan F1. Dibimbing oleh NURHENI SRI PALUPI dan ENDANG PRANGDIMURTI.
Kedelai merupakan salah satu bahan pangan yang selain bernilai gizi tinggi juga memiliki berbagai macam komponen bioaktif yang dapat menunjang kesehatan tubuh. Selain sebagai sumber protein, tepung kedelai dan isolat protein kedelai juga merupakan sumber isoflavon. Isoflavon disebut sebagai fitoestrogen sebab memiliki struktur kimia yang mirip dengan estrogen sehingga dapat berikatan dengan reseptor estrogen. Isoflavon tidak hanya dapat memberikan efek positif bagi reproduksi tetapi juga berpotensi menimbulkan efek sebaliknya pada tikus anak keturunannya (F1). Tujuan penelitian ini adalah untuk menjelaskan pengaruh konsumsi tepung kedelai dan isolat protein kedelai terhadap: 1). pertumbuhan dan berat organ tikus jantan dan betina F0, 2). profil reproduksi tikus jantan dan betina F0 serta 3). pertumbuhan, berat organ dan kadar testosteron tikus jantan dan kadar estrogen tikus betina F1.
Hewan percobaan yang digunakan pada penelitian ini adalah tikus putih (Rattus norvegicus) galur Sprague-Dawley berjenis kelamin jantan dan betina berumur 2 bulan dengan total 70 ekor yang terbagi ke dalam 7 kelompok (1 kelompok kontrol dan 6 kelompok perlakuan) dengan 5 ulangan. Perlakuan yang diberikan adalah tiga konsentrasi ransum tepung kedelai yaitu TP1 (17,38%), TP2 (13,04%) dan TP3 (8,69%) serta tiga konsentrasi isolat protein kedelai yaitu IS1 (21,21%), IS2 (15,91%) dan IS3 (10,6%), kelompok kontrol diberi ransum
standar. Ransum diberikan secara ad libitum. Tikus diberi perlakuan selama 30
hari kemudian dilakukan perkawinan. Setelah selesai perkawinan, tikus jantan diterminasi sedangkan tikus betina tetap diberi perlakuan hingga selesai masa kebuntingan dan persusuan. Selepas masa persusuan, tikus betina F0 diterminasi sedangkan tikus anak (F1) diberi perlakuan selama 30 hari. Selama masa kebuntingan, persusuan dan selepas persusuan, tikus kelompok perlakuan diberikan ransum TP1 (20%), TP2 (15%), TP3 (10%), IS1 (30,3%), IS2 (22,72%) dan IS3 (15,15%).
Rancangan percobaan yang digunakan pada parameter konsumsi ransum, berat organ, motilitas sperma, konsentrasi sperma dan kadar hormon adalah Rancangan Acak Lengkap (RAL). Percobaan ini terdiri atas tujuh kelompok yaitu Kontrol, TP1, TP2, TP3, IS1, IS2 dan IS3 dengan lima ulangan. Hasil yang didapat kemudian diolah dengan Analysis of Variance (ANOVA) dengan selang
kepercayaan 95% (α = 0,05). Bila terdapat pengaruh nyata maka akan dilakukan
uji lanjutan menggunakan uji Duncan dengan selang kepercayaan λ5% (α = 0,05).
Sebelum dilakukan pengujian kadar hormon estrogen tikus betina F0 dan F1, terlebih dahulu dilakukan pengamatan status reproduksi agar tikus betina dapat diterminasi pada fase reproduksi yang sama. Selain itu, dilakukan pula uji perbandingan nilai tengah (uji t) antara kelompok kontrol dengan tepung kedelai dan isolat protein kedelai serta analisis korelasi antara konsumsi protein kedelai dan isoflavon kedelai terhadap semua parameter.
Konsumsi tepung kedelai (8,69%, 13,04%, 17,38%) dan isolat protein kedelai (10,6%, 15,91%, 21,21%) dapat meningkatkan konsentrasi dan menurunkan abnormalitas sperma tikus jantan F0. Konsumsi isolat protein kedelai juga dapat meningkatkan motilitas sperma tikus jantan F0. Konsumsi isolat protein kedelai bahkan dapat meningkatkan konsentrasi dan motilitas sperma tikus jantan F0 dibandingkan dengan konsumsi tepung kedelai. Berdasarkan hal tersebut, konsumsi isolat protein kedelai memberikan dampak yang lebih baik bagi kualitas sperma tikus jantan F0 dibandingkan dengan konsumsi tepung kedelai. Berdasarkan analisis korelasi pearson, konsumsi protein kedelai dan isoflavon kedelai hanya berkorelasi terhadap penurunan abnormalitas sperma. Selain itu, konsumsi tepung kedelai (8,69%, 13,04%, 17,38%) dapat meningkatkan kadar hormon testosteron tikus jantan F0 hingga melebihi kadar normal (0,66 - 5,4 ng/mL) namun tidak terdapat perbedaan antara konsumsi tepung kedelai dan isolat protein kedelai terhadap kadar hormon estrogen serta persen kebuntingan dan jumlah anak yang dilahirkan tikus betina F0.
Konsumsi tepung kedelai (10%, 15%, 20%) dan isolat protein kedelai (15,15%, 22,72%, 30,3%) dapat meningkatkan laju pertumbuhan tikus jantan dan betina F1. Konsumsi tepung kedelai menunjukkan laju pertumbuhan yang lebih tinggi dibandingkan konsumsi isolat protein kedelai. Berdasarkan hal tersebut, konsumsi tepung kedelai memberikan dampak yang lebih baik terhadap pertumbuhan tikus jantan dan betina F1 dibandingkan dengan konsumsi isolat protein kedelai. Selain itu, konsumsi tepung kedelai dapat meningkatkan kadar hormon testosteron tikus jantan F1 hingga melebihi kadar normal (0,66 - 5,4 ng/mL) namun konsumsi tepung kedelai dan isolat protein kedelai tidak memberikan pengaruh terhadap kadar hormon estrogen tikus betina F1.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah dan pengutipan tersebut tidak merugikan kepentingan IPB
MEMENGARUHI PROFIL REPRODUKSI
TIKUS JANTAN DAN BETINA F0 DAN F1
UMI KULSUM
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Jantan dan Betina F0 dan F1
Nama Mahasiswa : Umi Kulsum
NRP : F251100061
Disetujui
Komisi Pembimbing
Dr. Ir. Nurheni Sri Palupi, M.Si Dr. Ir. Endang Prangdimurti, M.Si
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Ilmu Pangan
Dr. Ir. Ratih Dewanti, M.Sc Dr. Ir. Dahrul Syah, M.Sc. Agr
Segala puji dan syukur penulis panjatkan ke hadirat Allah SWT yang telah
memberikan rahmat dan karuniaNya sehingga karya ilmiah ini dapat penulis
selesaikan. Tesis ini dibuat sebagai salah satu syarat mahasiswa program
pascasarjana program S2 untuk meraih gelar Magister Sains pada Sekolah
Pascasarjana, Institut Pertanian Bogor.
Dalam penelitian ini penulis memilih topik tentang reproduksi dengan
judul Konsumsi Tepung Kedelai dan Isolat Protein Kedelai Memengaruhi Profil
Reproduksi Tikus Jantan dan Betina F0 dan F1. Dalam melakukan penelitian dan
penulisan tesis ini penulis banyak mendapatkan bantuan dan bimbingan dari
berbagai pihak. Ucapan terimakasih yang sangat tulus ingin penulis berikan
kepada Dr. Ir. Nurheni Sri Palupi, MSi. sebagai ketua komisi pembimbing yang
banyak memberi arahan kepada penulis. Kepada Dr. Ir. Endang Prangdimurti,
MSi. yang telah meluangkan waktu dalam memberikan motivasi, nasehat,
bimbingan dan saran bagi penyusunan tesis ini. Kepada Prof. Dr. Ir. Nuri
Andarwulan, M.Si, yang telah memberikan banyak masukan yang berharga pada
tesis ini. Tak lupa penulis ucapkan terima kasih kepada SEAFAST CENTER IPB
dan PT. Sari Husada yang telah mendanai penelitian ini.
Demikianlah tesis ini penulis buat. Penulis berharap semoga hasil
penelitian ini berguna bagi para peneliti, mahasiswa, pihak industri pangan dan
masyarkat luas. Penulis sangat mengharapkan masukan serta kritik yang
membangun demi kesempurnaan tesis ini.
Bogor, Januari 2013
Penulis dilahirkan di Jakarta pada tanggal 5 Oktober 1986 dari ayah Drs.
Arba'i Nawawi dan ibu Dra. Mudjiati M.Pd. Penulis merupakan putri pertama dari
tiga bersaudara.
Tahun 2004 penulis lulus dari SMA Negeri 6 Bekasi dan pada tahun yang
sama lulus seleksi masuk Universitas Padjadjaran (Unpad) melalui jalur Seleksi
Penerimaan Mahasiswa Baru (SPMB). Penulis memilih jurusan Teknologi
Pangan, Fakultas Teknologi Industri Pertanian (FTIP). Tahun 2010 penulis
diterima di Program Studi Ilmu Pangan pada Program Pascasarjana IPB.
Pendidikan di program pascasarjana IPB ditempuh atas biaya sendiri.
ix
D. Manfaat Penelitian………. 3
II. TINJAUAN PUSTAKA……… 5
A. Tepung Kedelai……….. 5
B. Isolat Protein Kedelai……… 8
C. Isoflavon Kedelai…..……….……… 9
D. Metabolisme Isoflavon…..……… 13
E. Hormon Estrogen………..……….… 16
F. Sistem Reproduksi Tikus Percobaan………. 19
III.METODE..……….…… 21
A. Bahan dan Alat……….. 21
B. Tempat dan Waktu Penelitian……… 21
C. Tahapan Penelitian……… 21
D. Prosedur Pengamatan dan Analisis……… 29
1. Komposisi kimia ransum tikus percobaan...……… 29
a. Kadar proksimat……… 2. Kondisi fisik dan kesuburan tikus percobaan..……… 32
a. Penampilan dan aktivitas fisik...………
b. Deteksi vaginal plug..………
c. Persen kebuntingan………
32
33
x
f. Abnormalitas sperma……… 35
3. Kadar hormon testosteron tikus jantan dan estrogen tikus
betina...………
a. Kadar hormon testosteron tikus jantan..………
b. Stadium siklus estrus tikus betina..………
c. Kadar hormon estrogen tikus betina..………
35 35
35
37
E. Rancangan Percobaan……… 38
IV.HASIL DAN PEMBAHASAN..………
A. Komposisi Kimia Tepung Kedelai dan Isolat Protein Kedelai..……
1. Kadar proksimat..………
2. Kadar serat kasar.………
3. Kadar isoflavon………
B. Pengaruh Konsumsi Tepung Kedelai dan Isolat Protein Kedelai
Terhadap Pertumbuhan dan Berat Organ Tikus Jantan dan Betina
Induk (F0) ……….
1. Pertumbuhan dan berat organ tikus jantan F0……….
2. Pertumbuhan dan berat organ tikus betina F0……….
C. Pengaruh Konsumsi Tepung Kedelai dan Isolat Protein Kedelai
Terhadap Profil Reproduksi Tikus Jantan dan Betina Induk (F0)….
1. Kesuburan tikus jantan F0………...………
2. Kesuburan tikus betina F0……….……..………
3. Kadar hormon testosteron tikus jantan F0...………
4. Kadar hormon estrogen tikus betina F0...………
D. Pengaruh Konsumsi Tepung Kedelai dan Isolat Protein Kedelai
Terhadap Pertumbuhan, Berat Organ dan Kadar Hormon
Testosteron Tikus Jantan dan Estrogen Tikus Betina Anak (F1)…..
1. Pertumbuhan tikus jantan dan betina F1……….
2. Berat organ tikus jantan dan betina F1...……….
3. Kadar testosteron tikus jantan F1………
4. Kadar estrogen tikus betina F1………
xi
xii
Halaman
1. Telaah penelitian terdahulu tentang pengaruh isoflavon kedelai
terhadap reproduksi tikus jantan dan betina F0 dan F1……… 13 2. Komposisi ransum standar ………..……… 23
3. Komposisi protein ransum dan total isoflavon yang dikonsumsi tikus
F0 di luar masa kebuntingan dan menyusui.……… 24
4. Komposisi protein ransum dan total isoflavon yang dikonsumsi tikus
F0 pada masa kebuntingan & menyusui serta tikus F1 ...……… 25
5. Tahapan pemeliharaan tikus percobaan………...…..………….. 26 6. Parameter penelitian berdasarkan tujuan dan output penelitian……... 27 7. Kadar proksimat kasein dan sampel ……… 41
8. Kadar isoflavon tepung kedelai dan isolat protein kedelai..………… 43
9. Berat organ tikus jantan F0 setelah 30 hari perlakuan.……… 52 10. Berat organ tikus jantan F0 setelah 30 hari antara kelompok kontrol,
TP dan IS……….……… 54
11. Berat organ tikus betina F0 setelah menyusui..……… 62
12. Berat organ tikus betina F0 antara kelompok kontrol, TP dan IS
selepas menyusui.……….… 63 13. Komposisi asam amino protein kedelai dan susu……… 66 14. Perbandingan kualitas sperma tikus jantan F0 setelah 30 hari
perlakuan antara kelompok kontrol, TP dan IS……… 73 15. Pengaruh konsumsi tepung kedelai dan isolat protein kedelai
terhadap jumlah anak tikus betina F0...……… 79 16. Berat organ tikus jantan F1 setelah 30 hari perlakuan.……… 97 17. Perbandingan berat organ tikus jantan F1 antara kelompok kontrol,
TP dan IS..……… 98 18. Berat organ tikus betina F1 setelah 30 hari perlakuan.……… 100 19. Perbandingan berat organ tikus betina F1 antara kelompok kontrol,
TP dan IS..……… 101
20. Pengaruh konsumsi tepung kedelai dan isolat protein kedelai
terhadap pertumbuhan, berat organ dan profil reproduksi tikus F0.… 110
21. Pengaruh konsumsi tepung kedelai dan isolat protein kedelai
xiii
1. Skema proses pembuatan tepung kedelai..……… 5
2. Skema proses produksi isolat protein kedelai……… 8
3. Struktur dasar isoflavon...……….……... 9
4. Struktur kimia genistein dan daidzein.……….……. 10
10. Tahapan pemeliharaan tikus percobaan serta parameter pengamatan dan analisis.……… 28
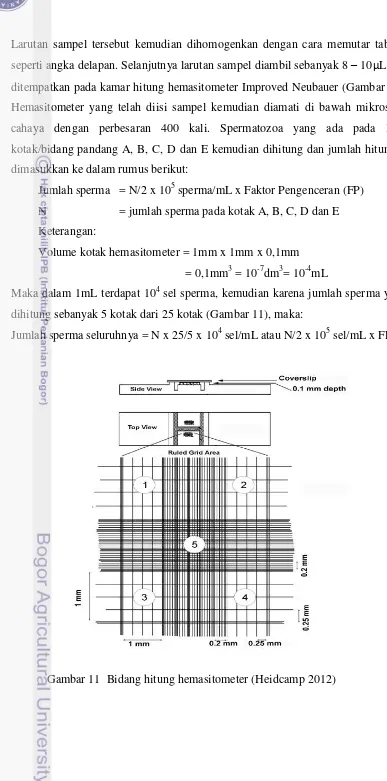
11. Kamar hitung hemasitometer.……… 34
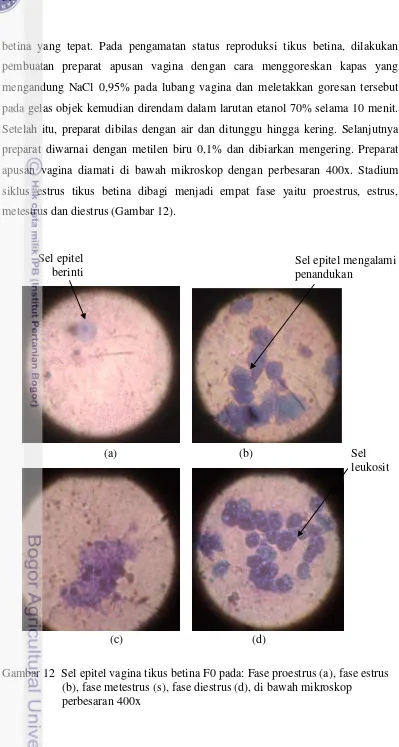
12. Sel epitel vagina tikus betina F0 pada: Fase proestrus (a), fase estrus (b), fase metestrus (s), fase diestrus (d), di bawah mikroskop perbesaran 400x………. 36
13. Prinsip pengujian hormon menggunakan perangkat ELISA…………. 37
14. Konsumsi ransum (kiri) dan kadar isoflavon yang dikonsumsi (kanan) tikus jantan F0 selama 30 hari perlakuan….……… 45
15. Penampilan fisik tikus jantan F0 kelompok kontrol (a), TP (b) dan IS (c) untuk semua ulangan (n =5) .……….…………..……… 47
16. Rata - rata laju pertumbuhan tikus jantan F0 (induk) pada berbagai kelompok selama 30 hari perlakuan.….………...………. 48
17. Rata - rata laju pertumbuhan tikus jantan F0 antara kelompok Kontrol (K), Tepung kedelai (TP) dan Isolat protein kedelai (IS)..……… 51
18. Konsumsi ransum (kiri) dan kadar isoflavon yg dikonsumsi (kanan) tikus betina F0 selama 30 hari perlakuan..………. 56
19. Konsumsi ransum (kiri) dan kadar isoflavon yg dikonsumsi (kanan) tikus betina F0 selama kebuntingan..………….……… 57
20. Konsumsi ransum (a) dan kadar isoflavon yg dikonsumsi (b) tikus betina F0 pada berbagai kelompok selama menyusui…….……..…… 58
21. Penampilan fisik tikus betina F0 kelompok kontrol (a), TP (b) dan IS (c) untuk semua ulangan (n = 5) ..………….……… 59
xiv
25. Persen abnormalitas sperma tikus jantan F0 pada berbagai kelompok…...… 70
26. Sperma tikus jantan F0 yang abnormal (ditandai dengan lingkaran
dan tanda panah)..……….. 71
27. Hubungan konsumsi protein dan isoflavon kedelai terhadap
abnormalitas sperma tikus jantan F0 setelah 30 hari perlakuan……… 72
28. Vaginal plug tikus betina F0 yang terbentuk setelah perkawinan
(ditandai dengan lingkaran dan tanda panah)..……….. 75
29. Persen vaginal plug tikus betina F0 pada berbagai kelompok..………. 76
30. Persen kebuntingan tikus betina F0 pada berbagai kelompok..……... 77
31. Kadar hormon testosteron tikus jantan F0 pada berbagai
protein kedelai (IS)……… 88
34. Konsumsi ransum tikus jantan dan betina F1 (anak) pada berbagai
kelompok setelah masa persusuan…..………... 90
35. Kadar isoflavon yang dikonsumsi tikus jantan dan betina F1 (anak)
pada berbagai kelompok setelah masa persusuan…..……… 91
36. Kondisi rambut tikus F1 kelompok kontrol (a), kelompok TP (b) dan
kelompok IS (c) baik jantan dan betina untuk semua ulangan……….. 92
37. Rata - rata laju pertumbuhan tikus jantan dan betina F1 (anak) pada
berbagai kelompok setelah masa persusuan……….. 94
38. Rata - rata laju pertumbuhan tikus jantan F1 (a) dan tikus betina F1
(b) kelompok kontrol (K). tepung kedelai (TP) dan isolat protein
kedelai (IS)………. 96
39. Kadar hormon testosteron tikus jantan F1 pada berbagai kelompok…. 103
40. Kadar hormon estrogen tikus betina F1 pada berbagai kelompok……. 105
41. Konsentrasi hormon testosteron tikus jantan F1 (a) dan estrogen tikus
betina F1 (b) kelompok kontrol (K). tepung kedelai (TP) dan isolat
xv
Halaman
1. Daftar komposisi ransum tikus tiap perlakuan……… 125
2. Perhitungan komposisi ransum dalam gram per 100g ransum…… 126
3. Rincian perhitungan komposisi ransum tikus berdasarkan modifikasi AIN-λ3M……….……….. 128
4. Rincian perhitungan komposisi ransum tikus berdasarkan modifikasi AIN-λ3G………..……….. 129
5. Komposisi kimia kasein, tepung kedelai dan isolat protein kedelai yang digunakan dalam pembuatan ransum percobaan……… 130
6. Sertifikat analisis kasein……….. 131
7. Sertifikat analisis tepung kedelai………. 132
8. Sertifikat analisis isolat protein kedelai………... 133
9. Hasil analisis isoflavon………... 134
10. Hasil analisis statistik semua parameter untuk tikus jantan F0…... 135
11. Hasil analisis statistik semua parameter untuk tikus betina F0…... 147
12. Hasil analisis statistik semua parameter untuk tikus jantan F1…... 155
I.
PENDAHULUAN
A. Latar Belakang
Kedelai merupakan salah satu bahan pangan yang selain bernilai gizi tinggi
juga memiliki berbagai macam komponen bioaktif yang dapat menunjang
kesehatan tubuh. Indonesia, melalui Balai Penelitian Tanaman Kacang–Kacangan
dan Umbi–Umbian (Balitkabi) telah mengeluarkan beberapa varietas kedelai lokal
unggulan diantaranya varietas Anjasmoro, Argomulyo, Grobogan, Burangrang,
Kaba dan Wilis (Balitkabi 2012). Menurut BPS (2012), produksi kedelai
Indonesia pada tahun 2012 sebesar 779.741 ton. Jumlah tersebut diperkirakan
akan terus meningkat hingga mencapai target 1,9 juta ton (Balitkabi 2012).
Salah satu produk olahan intermediet kedelai yang saat ini banyak
digunakan adalah tepung kedelai dan isolat protein kedelai. Selain sebagai sumber
protein, tepung kedelai dan isolat protein kedelai juga merupakan sumber
isoflavon. Isoflavon disebut sebagai fitoestrogen sebab memiliki struktur kimia
yang mirip dengan estrogen sehingga dapat berikatan dengan reseptor estrogen
(FSC & NFEC 2006).
Estrogen adalah hormon reproduksi utama pada wanita namun estrogen juga
diproduksi oleh pria yaitu pada organ testis, jaringan adiposa dan kelenjar adrenal.
Reseptor estrogen juga tersebar pada sel – sel testis dan berperan dalam
meregulasi fungsi testis (Kula et al. 2006). Pada hewan betina, estrogen memiliki
tiga fungsi utama yaitu menginisiasi perilaku estrus, merangsang perubahan organ
reproduksi (vagina, uterus dan tuba falopii) untuk mempersiapkan proses
fertilisasi dan menginisasi peningkatan hormon LH yang berperan dalam memicu
ovulasi (Ball dan Peter 2004). Pada pria dan hewan jantan, estrogen berperan
dalam spermatogenesis dan regulasi umpan balik hormon gonadotropin pada
kelenjar pituitari (Vincenzo et al. 2009).
Berdasarkan penelitian yang dilakukan oleh Garvita (2005), pemberian
ekstrak kedelai (kadar isoflavon sebesar 98,54%) sebanyak 5mg/100g bb/hari
kepada tikus betina selama 15 hari menunjukkan profil reproduksi yang lebih baik
daripada kontrol. Pemberian ekstrak kedelai dilakukan sebelum perkawinan. Hasil
meningkatkan berat ovari sebesar 125%, berat uterus 58%, berat kelenjar mamae
100% kuantitas produksi susu total dan pertambahan bobot badan anak yang
dilahirkan Berdasarkan penelitian tersebut, isoflavon sebagai fitoestrogen
menunjukkan pengaruh positif terhadap kesehatan reproduksi hewan betina.
Pemberian tepung kedelai kaya isoflavon yang dikombinasi dengan seng dan
vitamin E juga dapat meningkatkan motilitas dan konsentrasi spermatozoa, kadar
hormon testosteron serum serta jumlah sel spermatogenik pada tubulus seminiferi
testis. Dosis isoflavon optimum yang menghasilkan fertilitas tikus jantan terbaik
adalah 1,5mg/ekor/hari yaitu menyebabkan peningkatan berat testis, motilitas dan
konsentrasi sperma serta jumlah sel spermatogenik pada tubulus seminiferus testis
(Astuti 2009). Berdasarkan hal tersebut, isoflavon kedelai sebagai fitoestrogen
berperan positif terhadap kesehatan reproduksi, baik pada hewan jantan dan
betina.
Walaupun demikian, penelitian yang dilakukan oleh Delcols et al. (2001)
menyebutkan bahwa pemberian genistein hingga dosis 1250 ppm pada tikus
bunting menyebabkan penurunan berat badan dan konsumsi ransum tikus bunting
serta berat badan anak yang dilahirkannya mengalami penurunan dibandingkan
kontrol. Selain itu, anak yang dilahirkannya mengalami penurunan berat kelenjar
prostat serta peningkatan berat kelenjar pituitary. Selanjutnya, menurut
Wisniewski et al. (2003) pemberian genistein pada tikus bunting sebanyak 5 –
300 mg/kg berat badan /hari secara signifikan menimbulkan penurunan kadar
hormon testosteron pada tikus keturunannya.
Berdasarkan paparan tersebut, isoflavon tidak hanya dapat memberikan efek
positif bagi reproduksi tetapi juga berpotensi menimbulkan efek sebaliknya pada
tikus anak keturunannya (F1). Penelitian lebih lanjut mengenai pengaruh
konsumsi tepung kedelai dan isoflavon kedelai terhadap profil reproduksi tikus
induk (F0) dan anak keturunannya (F1) perlu dilakukan karena kedelai merupakan
sumber isoflavon dan dikonsumsi oleh masyarakat luas. Pemilihan tikus sebagai
hewan model dikarenakan tikus memiliki banyak kesamaan dengan sistem
reproduksi manusia. Selain itu, penggunaan tikus pada penelitian toksikologi
B. Perumusan Masalah
Bagaimana pengaruh konsumsi tepung kedelai dan isolat protein kedelai
terhadap profil reproduksi tikus induk (F0) dan anak (F1) baik jantan maupun
betina.
C. Tujuan Penelitian
Tujuan penelitian ini adalah untuk menjelaskan pengaruh konsumsi tepung
kedelai dan isolat protein kedelai terhadap: 1). pertumbuhan dan berat organ
jantan dan betina F0, 2). profil reproduksi tikus jantan dan betina F0 serta 3).
pertumbuhan, berat organ dan kadar hormon testosteron tikus jantan dan estrogen
tikus betina F1.
D. Manfaat Penelitian
Manfaat penelitian ini adalah sebagai sumber informasi dan penggunaan
produk berbasis kedelai yang memberi dampak positif terhadap sistem reproduksi
II. TINJAUAN PUSTAKA
A. Tepung Kedelai
Tepung kedelai diperoleh dari biji kedelai tanpa kulit yang telah mengalami
proses penggilingan dan pengayakan. Tepung kedelai dapat berasal dari bungkil
kedelai (kedelai yang telah dihilangkan minyaknya) atau berasal dari kedelai utuh
yang dihancurkan (tepung kedelai penuh) (Muchtadi 2010). Tepung kedelai penuh
umumnya dimanfaatkan dalam pembuatan produk roti, permen, frozen dessert,
tepung pancake, kulit pai, sweet goods, minuman instan dam kraker (Deak et al
2008). Skema proses pembuatan tepung kedelai dapat dilihat pada Gambar 1.
Gambar 1 Skema proses pembuatan tepung kedelai (Deak et al. 2008)
Biji kedelai
Penepungan Penepungan Penepungan
Tepung kedelai penuh memiliki kandungan protein yang lebih rendah dari
tepung kedelai bebas lemak. Menurut Muchtadi (2010), kadar protein tepung
kedelai penuh sebesar 40% sedangkan kadar protein tepung kedelai bebas lemak
minimal sebesar 50%. Standar komposisi kimia tepung kedelai penuh untuk
perusahaan di Amerika yaitu 42±1% protein, 21±0,5% lemak, 4,7±0,2% abu dan
maksimal 10% kadar air (Deak et al 2008).
Tepung kedelai penuh memang memiliki kadar protein yang lebih rendah
daripada tepung kedelai bebas lemak namun tepung kedelai penuh memiliki
sejumlah kelebihan yang tidak dimiliki oleh tepung kedelai bebas lemak. Tepung
kedelai penuh kaya akan asam lemak esensial, fosfolipid, spingolipid serta
sejumlah komponen bioaktif yang terlarut di dalam lemak seperti tokoferol,
fitosterol dan karotenoid. Masing – masing dari komponen tersebut berperan
dalam menunjang kesehatan tubuh terutama dalam pencegahan penyakit
degeneratif. Berikut penjelasan dari masing – masing komponen:
1 Asam lemak esensial
Asam lemak esensial utama pada kedelai yaitu linoleat sebesar 48 – 59% dan
linolenat sebesar 4,5 – 11% dari total asam lemak (Codex Alimentarius 2005
diacu dalam Gerde dan Pamela 2008). Asam linoleat berperan sebagai
hipokolesteroliemik sedangkan asam linolenat, selain sebagai
hipokole-sterolemik juga berperan sebagai anti-alergenik dan meningkatkan fungsi
kardiovaskuler (Sugano 2006).
2 Fosfolipid
Kadar fosfolipid kedelai sebesar 1 – 3% dari total minyak (Sugano 2006).
Fosfolipid utama yang terdapat pada kedelai adalah fosfatidil kolin, fosfatidil
etanol amin dan fosfatidil serin sedangkan fosfolipid lainnya yaitu fosfatidil
inositol dan asam fosfatidat. Gabungan dari fosfolipid tersebut secara komersial
disebut lesitin. Kolin yang banyak terkandung di dalam lesitin berperan sebagai
senyawa prekursor dalam sintesis asetilkolin yaitu salah satu neurotransmiter
(Wang 2008).
3 Spingolipid
Menurut Wang (2008), spingolipid berperan sebagai mediator pertumbuhan,
(2001) menyebutkan bahwa ceramida dan spingosin (kelompok utama
spingolipid pada kedelai) secara in vitro dapat menghambat transformasi sel
selama stadium awal karsinogenesis. Kadar ceramida pada kedelai sebesar 142
– 493 nmol/g berat kering (Gutierrez et al (2004) diacu dalam Wang (2008).
4 Tokoferol
Kedelai kaya akan tokoferol, terdapat berbagai jenis tokoferol diantaranya α
-tokoferol, β-tokoferol, -tokoferol dan δ-tokoferol. Diantara senyawa tersebut, -tokoferol merupakan tokoferol dengan jumlah terbanyak yaitu 737 mg/Kg
minyak kedelai, kemudian δ-tokoferol sebanyak β75 mg/Kg, α-tokoferol
sebanyak 16 mg/Kg dan β-tokoferol sebanyak 34 mg/Kg. Tokoferol berperan
sebagai antioksidan dan pencegah penyakit kardiovaskuler (Sugano 2006).
5 Fitosterol
Minyak kedelai mengandung fitosterol sebesar 300 – 400 mg/100g. Komponen
utama dari fitosterol kedelai adalah sitosterol (53 – 56%), kampesterol (20 –
23%) dan stigmasterol (17 – 21%). Struktur kimia fitosterol menyerupai
kolesterol namun terdapat perbedaan pada rantai samping kedua senyawa
tersebut. Fitosterol berperan dalam menurunkan kadar kolesterol darah dengan
cara menghambat penyerapan kolesterol (Ikeda 2006).
6 Karotenoid
Karotenoid merupakan komponon bioaktif minoritas diantara komponen
bioaktif kedelai lainnya. Menurut Wang (2008), karotenoid kedelai berada
kadar yang sangat rendah yaitu 0,8 – 3,7 ppm. Jenis karotenoid utama pada
kedelai adalah lutein dan β-karoten.
Tepung kedelai penuh yang dibuat dari kedelai utuh dengan proses
penyosohan memiliki manfaat yang sangat besar bagi kesehatan tubuh. Hal
tersebut disebabkan oleh berbagai jenis komponen bioaktif yang terkandung di
dalamnya. Peranan utama komponen bioaktif tersebut adalah sebagai antioksidan
dan antikanker. Selain komponen bioaktif yang larut dalam lemak, kedelai juga
mengandung komponen bioaktif lain yaitu isoflavon atau disebut juga
fitoestrogen. Pembahasan mengenai isoflavon ditulis secara terpisah pada sub bab
B. Isolat Protein Kedelai
Isolat protein kedelai terbuat dari serpihan atau tepung kedelai yang telah
diekstraksi minyaknya serta memiliki kadar protein terdispersi yang tinggi
(Muchtadi 2010). Serpihan ataupun tepung kedelai diekstraksi dengan air ataupun
larutan alkali encer. Ekstrak yang didapat kemudian dilakukan pengaturan pH
sampai terbentuk curd (protein yang terendapkan). Curd yang diperoleh kemudian
dicuci untuk menghilangkan karbohidrat, dinetralkan dan dikeringkan. Skema
proses produksi isolat protein kedelai dapat dilihat pada Gambar 2.
Gambar 2 Skema proses produksi isolat protein kedelai (Muchtadi 2010) Serpihan/tepung kedelai
(telah diekstraksi lemaknya)
Ekstraksi
Residu Ekstrak
s
Pengaturan pH (4,5)
Whey
Pencucian Pencucian
Pengeringan Pengeringan
Penetralan
Isolat protein kedelai (bentuk isoelektrik)
Selain menggunakan serpihan kedelai yang telah diekstrak lemaknya (white
flake), isolat protein kedelai juga dapat menggunakan kedelai yang dihilangkan
lemaknya secara parsial dengan metode ekstrusi dan metode tekanan uap (Deak et
al. 2008). Kedua metode tersebut dapat diaplikasikan untuk produksi skala kecil.
Metode tekanan uap dianggap lebih baik daripada metode ekstruksi karena dapat
menghasilkan isolat protein kedelai dengan kadar protein yang lebih tinggi dan
nilainya mendekati kadar protein pada isolat protein dari white flake yaitu 93,1%
(Wang dan Johnson (2001); Deak et al. (2007) diacu dalam Deak et al. (2008)).
Protein kedelai terdiri atas dua fraksi utama yaitu glisinin dan beta
konglisinin. Selain itu, terdapat pula beberapa enzim dan zat antinutrisi. Enzim
yang menjadi perhatian utama adalah lipoksigenase karena dapat mengoksidasi
asam linoleat menjadi produk hidroperoksida yang menyebabkan bau langu yang
tidak disukai pada isolat protein kedelai. Zat antinutrisi yang terdiri dari tripsin
inhibitor (inhibitor bowman birk dan inhibitor kunitz) dan lektin juga menjadi
perhatian utama pada produk protein kedelai (Murphy 2008), namun kadarnya
akan berkurang dan menjadi inaktif setelah melalui serangkaian proses produksi
isolat protein kedelai, terutama selama ekstraksi dan pengeringan.
C. Isoflavon Kedelai
Isoflavon tergolong kelompok flavonoid yang merupakan kelompok besar
dari polifenol. Seperti yang tampak pada Gambar 3, isoflavon terdiri atas dua
cincin benzene (C6) terikat pada suatu rantai propane (C3) sehingga membentuk
susunan C6-C3-C6 (Wagi dan Sugrani 2009). Isoflavon juga disebut sebagai
fitoestrogen karena kemampuannya untuk berinteraksi dengan reseptor estrogen
pada sel (Anderson & Garner 2000).
Isoflavon pada kedelai terdiri atas tiga macam bentuk aglikon (struktur yang
tidak mengikat molekul gula) yaitu genistein, daidzein dan glycitein. Selain itu,
terdapat juga bentuk glikosidanya atau struktur yang mengikat molekul gula yaitu
genistin, daidzin dan glicitin serta bentuk asetil glikosida dan bentuk malonil
(FSC & NFEC 2006). Komponen isoflavon yang paling banyak terdapat pada
kedelai adalah genistein dan daidzein (Watanabe et al. 2006). Struktur kimia
genistein dan daidzein dapat dilihat pada Gambar 4.
Gambar 4 Struktur kimia genistein (kiri) dan daidzein (kanan) (FSC dan NFEC 2006).
Berikut adalah karakteristik kimia yang dimiliki oleh kedua senyawa tersebut
(FSC & NFEC 2006).
a. Genistein: Rumus molekul= C15H10O5, Berat molekul = 270. Sifatnya tidak
berwarna, bentuknya seperti kristal – kristal jarum dan memiliki titik didih
296 – 2980C. Senyawa ini sulit larut dalam asam asetat glacial/etanol dingin
namun larut dengan baik pada eter atau etanol panas. Senyawa ini dapat
berubah menjadi kuning setelah dilarutkan pada larutan alkali dan berubah
menjadi merah gelap pada larutan etanolik besi klorida (III).
b. Daidzein: Rumus molekulnya: C15H10O4, BM = 254. Berbentuk batangan
kristal tak berwarna dengan titik didih 315 – 3200C. Tidak larut dalam air tapi
larut dalam metanol, etanol dan aseton. Dapat berubah warna menjadi kuning
pada larutan alkali dan dapat dideteksi membentuk fluoresen pada radiasi sinar
UV. Senyawa ini bisa rusak oleh asam format, resorcin dan
p-hydroxybenzoate dengan alkali.
Genistein memiliki kapasitas estrogenik yang beberapa kali lipat lebih tinggi
daripada daidzein. Aktivitas estrogenik isoflavon juga berbeda untuk tiap jaringan
alfa (ER-α) banyak terdapat pada korteks adrenal, ginjal dan testis sedangkan
reseptor estrogen beta (ER-β) banyak terdapat pada timus, kantung empedu, paru
– paru, tulang, prostat serta terdapat pula pada payudara dan uterus (Yamamoto &
Tsugane 2006).
Selain genistein, equol yang merupakan metabolit daidzen juga memiliki
potensi estrogenik dikarenakan kemiripan strukturnya. Equol terbentuk akibat
fermentasi yang terjadi pada gastrointestinal manusia (Dixon dan Ferreira 2002).
Kemiripan struktur metabolit isoflavon (equol) dengan estradiol (hormon
estrogen) dapat dilihat pada Gambar 5.
Efek estrogenik pada isoflavon telah diteliti pada berbagai kondisi dan
menunjukkan efek yang relatif rendah yaitu 1/100 hingga 1/10.000 kali jika
dibandingkan dengan estradiol (Yamamoto & Tsugane 2006). Berdasarkan
solubilized receptor ligand binding assay, genistein memiliki kekuatan ikat
sebesar 7/1000 kali dan daidzein sebesar 2/1000 kali dari estradiol. Kemudian
Kano et al (2003) diacu dalam FSC & NFEC (2006) menyebutkan bahwa daya
ikat genistein sebesar 4/1000 dari estradiol. Berdasarkan paparan tersebut,
genistein memiliki afinitas yang lebih tinggi daripada daidzein dalam hal daya ikat
dengan ER. Meskipun demikian, equol yang merupakan metabolit dari daidzein
memiliki daya afinitas yang lebih kuat dibandingkan genistein terhadap reseptor
estrogen (FSC & NFEC 2006).
Gambar 5 Struktur kimia estradiol (kiri) dan equol (kanan) (Dixon dan Ferreira 2002).
Peranan isoflavon sebagai fitoestrogen yaitu dapat meningkatkan profil
reproduksi wanita. Safrida (2008) menyebutkan bahwa kadar hormon estrogen
pada tikus ovariektomi (tikus yang ovariumnya dihilangkan dengan sengaja) yang
sebab terjadi proliferasi dan kornifikasi sel epitel vagina. Hal ini dikarenakan
estrogen merangsang sel epitel vagina untuk berkornifikasi atau menjadi
kehilangan inti sel (Bearden et al. 2004). Dengan demikian, pemberian tepung
kedelai dan tepung tempe pada tikus ovariektomi dapat mengoptimalkan hormon
estrogen dalam memunculkan fase estrus.
Selain berfungsi sebagai fitoestrogen, isoflavon juga dapat berfungsi sebagai
anti estrogen (FSC & NEFC 2006). Sifat yang saling bertolak belakang tersebut
bergantung dari konsentrasi estrogen di dalam tubuh. Isoflavon akan memiliki
efek estrogenik jika kadar estrogen di dalam tubuh rendah yaitu pada kondisi
postmenopous namun isoflavon akan memiliki efek antiestrogenik jika kadar
estrogen di dalam tubuh tinggi yaitu pada kondisi premenopous (Yamamoto &
Tsugane 2006).
Selain itu, secara in vivo isoflavon terbukti sebagai anti kanker sebab
isoflavon dapat menginduksi apoptosis sel kanker pada manusia (FSC & NFEC
2006). Kim GN et al. (2011) mengungkapkan hal yang sama, isoflavon secara
efektif dapat menginduksi apoptosis sel kanker kolon. Mekanisme apoptosis sel
kanker kolon adalah melalui reaksi berantai caspase-3. Isoflavon secara signifikan
dapat meningkatkan ekspersi gen caspase-3 pada sel kanker kolon pada
konsentrasi 500 dan 1000μg/mL selama 24 jam secara in vitro.
Beberapa studi tentang pemberian isoflavon kepada tikus dewasa
menyatakan bahwa isoflavon berdampak positif terhadap reproduksi. Disisi lain,
ada pula studi yang menyatakan bahwa pemberian isoflavon kepada tikus bunting
ternyata berdampak buruk bagi anak tikus yang dilahirkan (Tabel 1). Garvita
(2005) menyatakan bahwa pemberian ekstrak kedelai (kadar isoflavon sebesar
98,54%) sebanyak 5mg/100g bb/hari kepada tikus betina pra kebuntingan selama
15 hari dapat meningkatkan berat ovari sebesar 125%, berat uterus 58%, berat
kelenjar mamae 100% kuantitas produksi susu total dan pertambahan bobot badan
anak yang dilahirkan. Kemudian menurut Astuti (2009), pemberian tepung kedelai
kaya isoflavon sebanyak 1,5mg/ekor/hari yang dikombinasi dengan seng dan
vitamin E dapat meningkatkan motilitas dan konsentrasi spermatozoa, kadar
hormon testosteron serum serta jumlah sel spermatogenik pada tubulus seminiferi
Di sisi lain Delcols et al. (2001) menyatakan bahwa pemberian genistein
hingga dosis 1250 ppm pada tikus bunting menyebabkan penurunan berat badan
dan konsumsi ransum tikus bunting serta berat badan anak yang dilahirkannya
mengalami penurunan dibandingkan kontrol. Selain itu, anak yang dilahirkannya
mengalami penurunan berat kelenjar prostat serta peningkatan berat kelenjar
pituitari. Selanjutnya, menurut Wisniewski et al. (2003) pemberian genistein pada
tikus bunting sebanyak 5 – 300 mg/kg berat badan /hari secara signifikan
menimbulkan penurunan kadar hormon testosteron pada tikus keturunannya.
Tabel 1 Telaah penelitian terdahulu tentang pengaruh isoflavon kedelai terhadap reproduksi tikus jantan dan betina F0 dan F1
Peneliti Perlakuan Hasil penelitian
Garvita (2005) Pemberian ekstrak
kede-lai sebanyak 5mg/100g berat badan/hari selama 15 hari kepada tikus be-tina pra kebuntingan
a. Peningkatan berat ovarium sebesar
125%,
b. Peningkatan berat uterus sebesar
58%,
c. Peningkatan berat kelenjar mamae
sebesar 100%
d. Peningkatan produksi susu
e. Peningkatan bobot badan anak yang
dilahirkan
Astuti (2009) Pemberian tepung kedelai
kaya isoflavon yang di-kombinasi seng & vit E
a. Peningkatan berat testis
b. Peningkatan motilitas dan
kon-sentrasi sperma
c. Peningkatan jumlah sel
sperma-togenik pada tubulus seminiferus testis
Pemberian sebanyak 5–
300 mg/kg berat badan /hari
Penurunan hormon testosteron anak tikus yang dilahirkan
D. Metabolisme Isoflavon
Isoflavon kedelai terdapat dalam bentuk glikosida dan aglikon. Isoflavon
dalam bentuk glikosida akan dihidrolisis oleh enzim yang terdapat dalam saliva
(air liur) dan mukosa usus halus serta dihidrolisis pula oleh enzim β-glukosidase yang dikeluarkan oleh bakteri usus sehingga menghasilkan bentuk isoflavon
2006). Isoflavon genistein merupakan bentuk aglikon dari genistin dan isoflavon
daidzein merupakan bentuk aglikon dari daidzin.
Menurut Anderson dan Garner (2000), bentuk aglikon lebih mudah diserap
oleh usus halus sebagai bagian dari misel yang dibentuk oleh garam empedu.
Bentuk molekul aglikon bisa juga berasal dari metabolit isoflavon yang dihasilkan
di usus besar dan dari sebagian kecil glikosida yang tak tercerna secara sempurna
yang kemudian dibawa oleh kilomikron melalui jalur limfatik. Sirkulasi isoflavon
di dalam darah sangatlah kompleks, sebagian disebabkan oleh sifat kelarutannya
di dalam lemak dan sebagian lagi disebabkan karena senyawa tersebut juga
berikatan secara lemah dengan protein di dalam sirkulasi darah. Diantara berbagai
jenis molekul isoflavon, genistein memiliki bioavailabilitas yang paling tinggi.
Setelah mengalami penyerapan, aglikon dan metabolitnya akan ditransport
menuju hati melalui jalur vena porta. Metabolit sekunder dari isoflavon kedelai
terdiri atas equol dan o-desmethylangolensin (O-DMA) yang terbentuk dari
daidzein. Equol dan O-DMA berasal dari daidzein (salah satu jenis isoflavon
aglikon) yang difermentasi oleh mikroflora usus, perbedaannya yaitu O-DMA
tidak bersifat estrogenik seperti equol. Selain itu terdapat pula bentuk
dihydro-genistein dapat yang terbentuk dari dihydro-genistein yang juga difermentasi oleh
mikroflora usus (FSC & NEFC 2006). Skema metabolisme isoflavon secara
farmakokinetik yaitu studi tentang pola pemunculan dan hilangnya isoflavon
dalam plasma setelah diberikan dosis tunggal kedelai atau isoflavon dapat dilihat
pada Gambar 6.
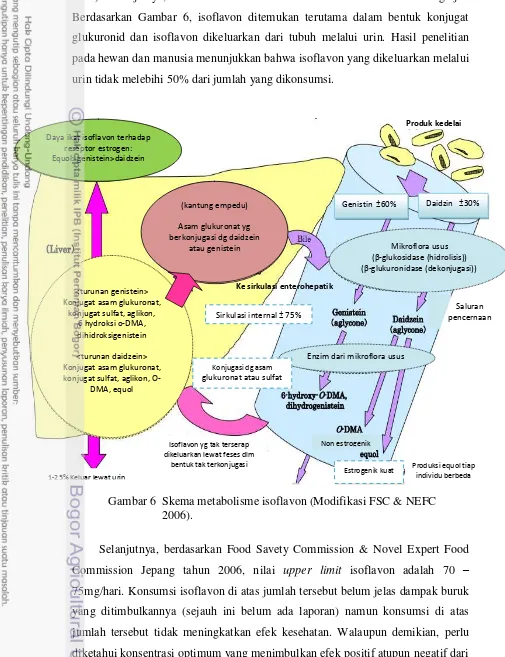
Berdasarkan Gambar 6, genistein lebih banyak terdapat pada produk kedelai
yaitu sekitar 60% sedangkan daidzein hanya 30%. Kemudian, genistein dan
daidzein akan difermentasi oleh mikroflora usus sehingga menghasilkan berbagai
macam metabolit. Diantara metabolit yang dihasilkan, equol merupakan metabolit
yang paling tinggi daya estrogeniknya. Dengan demikian, peranan mikroflora usus
terhadap bioavailabilitas di dalam tubuh sangatlah besar.
Menurut Muchtadi (2010) waktu paruh daidzein dan genistein dalam plasma
darah sebesar 7,9 jam pada orang dewasa dan konsentrasi tertinggi terdapat 6 – 8
jam setelah konsumsi. Konsumsi produk kedelai secara teratur akan menghasilkan
state). Selanjutnya, isoflavon akan dieliminasi dari dalam tubuh melalui ginjal.
Berdasarkan Gambar 6, isoflavon ditemukan terutama dalam bentuk konjugat
glukuronid dan isoflavon dikeluarkan dari tubuh melalui urin. Hasil penelitian
pada hewan dan manusia menunjukkan bahwa isoflavon yang dikeluarkan melalui
urin tidak melebihi 50% dari jumlah yang dikonsumsi.
Gambar 6 Skema metabolisme isoflavon (Modifikasi FSC & NEFC 2006).
Selanjutnya, berdasarkan Food Savety Commission & Novel Expert Food
Commission Jepang tahun 2006, nilai upper limit isoflavon adalah 70 –
75mg/hari. Konsumsi isoflavon di atas jumlah tersebut belum jelas dampak buruk
yang ditimbulkannya (sejauh ini belum ada laporan) namun konsumsi di atas
jumlah tersebut tidak meningkatkan efek kesehatan. Walaupun demikian, perlu
diketahui konsentrasi optimum yang menimbulkan efek positif atupun negatif dari Daya ikat isoflavon terhadap (β-glukuronidase (dekonjugasi))
Saluran
isoflavon pada berbagai level usia dan kondisi fisiologis tubuh (masa hamil,
menyusui dan pertumbuhan).
E. Hormon Estrogen
Estrogen adalah hormon reproduksi utama pada wanita. Estrogen termasuk
ke dalam hormon steroid di mana steroid adalah kelompok senyawa lipid yang
memiliki konfigurasi tetrasiklik (empat cincin). Selain estrogen, hormon steroid
lainnya adalah progesteron, testosteron dan glukokortikoid/kortisol (Bearden et al.
2004). Estrogen terdiri atas tiga macam senyawa yaitu estradiol-17β, estron dan
estriol. Estradiol-17β merupakan estrogen yang memiliki aktivitas biologis yang
paling tinggi. Estrogen disintesis pada lapisan theca interna dan granulose di
folikel ovarium serta disintesis pada plasenta dan embrio saat periode kebuntingan
(Ball dan Peter 2004). Bagan biosintesis estrogen yang terjadi pada sel theca dan
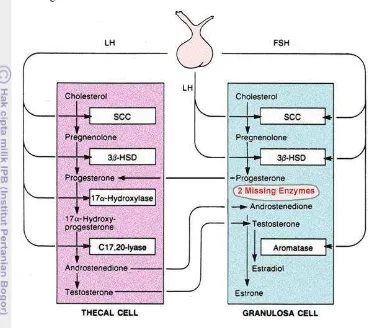
sel granulosa di dalam ovarium dapat dilihat pada Gambar 7. Berdasarkan
Gambar 7, senyawa prekursor dari estrogen adalah kolesterol dan salah satu
senyawa perantara pada sintesis estrogen adalah testosteron yang juga merupakan
hormon seks pada pria. Berdasarkan hal tersebut, hormon estrogen dan testosteron
memiliki kaitan yang sangat erat bagi wanita maupun pria.
Menurut Ball dan Peter (2004), estrogen memiliki tiga fungsi utama bagi
sistem reproduksi hewan betina, yaitu:
a) Menginisiasi perilaku kawin saat estrus. Perilaku kawin umumnya terlihat
pada saat malam hari, namun terkadang juga tampak pada siang hari.
Selama fase tersebut, hewan betina tampak lebih gelisah dari biasanya,
vulva menjadi bengkak dan selaput vagina memerah. Lamanya waktu
estrus bergantung pada faktor usia dan musim.
b) Mempersiapkan organ – organ reproduksi untuk menghadapi proses
fertilisasi. Estrogen merangsang vagina, serfiks, uterus dan tuba falopii
untuk mengembang sehingga memberi jalan bagi sperma untuk dapat
masuk dengan mudah. Estrogen juga meningkatkan aliran darah pada
saluran reproduksi dan menstimulasi vagina untuk memproduksi lendir
Menginisiasi peningkatan hormon LH yang dapat merangsang ovulasi
dengan cara memberikan umpan balik yang positif pada kelenjar hipotalamus
untuk mengeluarkan GnRH.
Gambar 7 Biosintesis estrogen (Modifikasi Griffin & Ojeda 1992).
Estrogen memiliki pengaruh yang sangat kuat terhadap berbagai organ
tubuh, baik organ reproduksi ataupun organ tubuh lainnya. Menurut Bearden et al.
(2004), estrogen juga berperan dalam merangsang timbulnya ciri kelamin
sekunder (ciri fisik yang tampak dari luar) serta perkembangan kelenjar susu. Hal
tersebut dapat terlihat jelas pada perubahan masa anak – anak menjadi dewasa
(masa puber) di mana organ kewanitaan mulai berkembang.
Selain berperan penting dalam sistem reproduksi wanita, estrogen juga
berperan dalam sistem reproduksi pria. Biosintesis estrogen pada pria dikontrol
oleh aktivitas enzim aromatase. Enzim aromatase merupakan kompleks enzim
P-450 monooksigenase yang terdapat pada organel reticulum endoplasma halus.
Enzim ini bekerja melalui tiga rangkaian reaksi hidroksilasi yang dampak
testosteron menjadi estradiol dibutuhkan untuk memberi umpan balik pada
pituitary dalam rangka normalisasi kadar hormon gonadotropin (Vincenzo et al.
2009).
Menurut Kula et al. (2006), estrogen berperan dalam regulasi proses
spermatogenesis. Peranan estrogen dalam menginisiasi spermatogenesis terbagi
menjadi tiga mekanisme yaitu: 1)berperan langsung dalam proses pembelahan
spermatogonium, 2)merangsang sekresi hormon FSH yang merupakan hormon
utama penginisiasi spermatogenesis dan 3)menghambat sekresi gonadotropin dan
menstimulasi apoptosis germ cell. Berdasarkan hal tersebut, kekurangan estrogen
pada pria dapat mengakibatkan gangguan spermatogenesis.
Selain dihasilkan oleh hewan, estrogen juga dihasilkan oleh tanaman dalam
bentuk isoflavon. Isoflavon merupakan senyawa yang bersifat estrogenik
dikarenakan kemampuannya untuk bekerja layaknya estrogen dan mempengaruhi
metabolisme estrogen di dalam tubuh hewan mamalia. Walaupun demikian,
isoflavon sebagai fitoestrogen ternyata tidak hanya mempengaruhi metabolisme
estrogen namun juga mempengaruhi hormon reproduksi lainnya baik wanita
maupun pria. Menurut Evans et al (1995) diacu dalam Yi at al (2002), pengujian
secara in vitro membuktikan bahwa isoflavon dapat menghambat aktivitas enzim
5α-reductase dimana enzim tersebut berperan dalam perubahan hormon
testosteron menjadi dihidrotestosteron (DHT).
DHT merupakan metabolit utama testosteron (Sachs & Miesel 1988). DHT
berperan penting dalam sistem reproduksi pria yaitu berperan dalam meregulasi
pembelahan sel pada epididimis dan kelenjar aksesoris serta merangsang aktivasi
perilaku seksual pada hewan jantan seperti kemampuan kopulasi dan ejakulasi
(Mainwaring 1977; Sachs & Miesel 1988). Dampak positif dari hal tersebut yaitu
isoflavon dapat mengurangi risiko kanker prostat karena perkembangan sel kanker
prostat diasosiasikan dengan tingginya kadar DHT di dalam tubuh (McCormick et
al. 2007). Walaupun demikian, penurunan kadar DHT pada pria normal (bukan
penderita kanker prostat) dikhawatirkan berakibat buruk terhadap sistem
reproduksi pria.
Kemudian, penurunan konsentrasi testosteron pada individu keturunan yang
gangguan biosintesis testosteron di testis, perubahan sensitivitas reseptor androgen
atau perubahan pada SHBG (Sex Hormone Binding Globuline) namun mekanisme
kerjanya masih belum diketahui pasti (Wisniewski AB, et al. 2003). Menurut
Hancock 2009, mekanisme kerja genistein dalam mempengaruhi sistem
reproduksi tikus jantan yaitu genistein dapat mengganggu ikatan antara reseptor
LH (Lutenizing hormone) transmembran dengan protein G. Reseptor LH yang
tidak berikatan dengan protein G dapat berpengaruh buruk terhadap fungsi
adenilat siklase dan mempengaruhi stimulasi LH di sel Leydig. Hal tersebut
berimbas pada steroidogenesis testicular (pembentukan hormon steroid di testis)
pada individu yang terekspos genistein dan produk berbasis kedelai.
F. Sistem Reproduksi Tikus Percobaan
Pada sistem reproduksi mamalia betina dikenal istilah siklus estrus yaitu
siklus terjadinya proses reproduksi. Lamanya siklus estrus berbeda – beda pada
tiap hewan. Siklus estrus pada tikus betina terjadi selama kurang lebih 5 hari.
Tikus merupakan hewan polioestrus yaitu dapat melakukan perkawinan sepanjang
tahun (Moore 2000). Siklus ini dibagi menjadi empat tahapan yaitu proestrus,
estrus, metestrus dan diestrus (Bearden et al. 2004). Berikut adalah penjelasan
dari masing – masing tahapan tersebut (Smith & Mangkoewidjojo 1989).
a. Proestrus: periode ini berlangsung sekitar 12 jam. Pada sediaan apus
vagina (vaginal smear) dapat dilihat hanya sel – sel kecil dengan inti bulat.
b. Estrus: periode di mana timbulnya keinginan untuk melakukan kopulasi.
Lama waktu estrus berkisar antara 9 – 15 jam dan ditandai dengan
aktivitas berlari yang sangat intens. Pada masa inilah terjadi proses
ovulasi.
c. Metestrus: periode yang terjadi sesaat setelah terjadi ovulasi. Periode ini
berlangsung antara 10 – 14 jam. Pada masa ini banyak sel darah putih
muncul pada lumen vagina bersamaan dengan munculnya sel – sel
kornifikasi.
d. Diestrus: periode ini berlangsung antara 60 – 70 jam di mana terjadi
kemunduran fungsi korpus luteum. Uterus baru mengalami sedikit
vagina, jika dilakukan vaginal smear maka hampir seluruh kandungan
cairannya adalah sel tersebut.
Tikus yang bunting dapat diketahui setelah 10 – 14 hari setelah
ditemukannya sumbat vagina dengan cara meraba perut tikus. Lama bunting
berkisar antara 20 – 22 hari dengan lama proses kelahiran antara 1 – 4 jam dan
anak tikus yang baru lahir memiliki berat sekitar 5 – 6g. Setelah itu anak disapih
sampai umur 18 – 28 hari dan setelah itu barulah berat anak tikus meningkat
menjadi 25 – 30g (Smith & Mangkoewidjojo 1989).
Kebanyakan tikus mulai kawin pada umur 8 – 9 minggu tetapi biasanya
lebih baik kalau tikus tidak dikawinkan sebelum umur 12 minggu. Tikus dapat
kawin sepanjang tahun. Tikus dapat kawin secara monogami ataupun poligami
namun jika betina lebih dari dua, setelah bunting harus dipisahkan agar dapat
menyusui dengan baik (Smith & Mangkoewidjojo 1989). Organ reproduksi tikus
dapat dilihat pada Gambar 8.
(a) (b)
Gambar 8 Organ reproduksi tikus: (a) jantan, (b) betina (Moore 2000).
Berdasarkan Gambar 8, tampak jelas bahwa tikus jantan memiliki organ
reproduksi yang sama dengan pria sedangkan tikus betina memiliki sedikit
perbedaan. Wanita hanya memiliki satu uterus (simplex) sedangkan tikus betina
memiliki 2 uterus yaitu bagian kiri dan kanan (tipe duplex). Masing – masing
percabangannya dapat membentuk beberapa plasenta di mana tiap plasenta
dimiliki oleh satu fetus. Jumlah rata – rata anak yang dilahirkan adalah 9 ekor
(Smith & Mangkoewidjojo 1989). Hal ini menandakan bahwa daya regenerasi
III.
METODE
A. Bahan dan Alat
Bahan utama yang digunakan adalah kacang kedelai varietas anjasmoro dan
isolat protein kedelai (merek Solae, Switzerland) dari PT. Sari Husada. Bahan –
bahan lain yang digunakan adalah protein kasein, minyak jagung, mineral mix,
carboxy methyl cellulose (cmc), agar – agar, vitamin merek Fitkom, pati jagung
dan air. Bahan – bahan kimia yang digunakan untuk analisis hormon adalah
Estrogen ELISA Kit Assay dan Testosteron ELISA Kit Assay produksi Cusabio.
Peralatan yang digunakan adalah peralatan untuk pemeliharaan dan
pembuatan ransum tikus percobaan seperti vary mixer, keranjang, botol minum
dan wadah makan serta peralatan gelas. Peralatan lain yaitu alat bedah (pisau,
gunting, pinset, dan bedah), wadah toples untuk pembiusan tikus, timbangan
tikus, neraca analitik dan ELISA reader serta mikroskop.
B. Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Rekayasa Proses Pangan dan
Biokimia Pangan Departemen Ilmu dan Teknologi Pangan (ITP) Fakultas
Teknologi Pertanian IPB, Laboratorium Bersama Hewan Percobaan SEAFAST
Center IPB dan Departemen ITP serta Laboratorium Terpadu Mikrobiologi Medik
dan Laboratorium Klinik, Reproduksi dan Patologi Fakultas Kedokteran Hewan
IPB. Penelitian dilakukan selama 7 bulan mulai bulan Januari hingga Juli 2012.
C. Tahapan Penelitian
Penelitian ini dibagi menjadi dua tahap yaitu tahap persiapan ransum dan
tahap percobaan menggunakan tikus percobaan F0 (induk) dan F1 (keturunan
pertama hasil perkawinan tikus F0). Pada tahap persiapan ransum digunakan dua
sampel yaitu tepung kedelai (TP) dan isolat protein kedelai (IS) masing – masing
terdiri atas tiga formula dengan kasein sebagai kontrol (K). Pada tahap percobaan,
pemeliharaan tikus dilakukan mulai dari tikus F0 dewasa hingga melahirkan tikus
F1 dan dilanjutkan dengan perlakuan tikus F1 hingga dewasa.
Ransum yang diberikan mengandung zat gizi yang terdiri atas protein,
lemak, karbohidrat, vitamin dan mineral dengan komposisi yang mengacu pada
AIN (1993) yang dimodifikasi. Sumber protein berasal dari kasein, tepung kedelai
atau isolat protein kedelai, sumber lemak berasal dari minyak jagung, sumber
karbohidrat berasal dari pati jagung, sumber vitamin dan mineral berasal dari
vitamin mix dan mineral mix kemudian sumber serat berasal dari carboxy methyl
cellulose (cmc) dan agar – agar dengan persentase yang mengacu pada Correa et
al (2009) yang dimodifikasi. Komposisi Ransum standar dapat dilihat pada Tabel
2. Tepung kedelai yang akan digunakan pada penelitian ini sudah mengalami
proses steam/pengukusan untuk menginaktifkan tripsin inhibitor. Diagram alir
pembuatan tepung kedelai dapat dilihat pada Gambar 9.
Gambar 9 Pembuatan tepung kedelai (SEAFAST, 2012). Kedelai
Penghancuran kasar
Pengukusan (1000C, 14 menit)
Pemisahan kulit
Pengeringan (600C, 5 jam)
Pengayakan (30 mesh) Penepungan
Table 2 Komposisi ransum standar (Modifikasi AIN 1993)
Komposisi gizi AIN-93G* AIN-93M**
Protein
*Komposisi protein selama masa kebuntingan, menyusui & pertumbuhan **Komposisi protein selama masa pemeliharaan tikus dewasa
b) Percobaan Menggunakan Tikus Percobaan
Hewan percobaan yang digunakan pada penelitian ini adalah tikus putih
(Rattus norvegicus) galur Sprague-Dawley berjenis kelamin jantan dan betina
berumur 2 bulan dengan total 70 ekor yang terbagi ke dalam 7 kelompok dengan 5
ulangan. Pemilihan tikus untuk tiap kelompok dilakukan secara random dengan
mempertimbangkan berat badan tikus sehingga perbedaan rata - rata berat badan
tikus diantara dan didalam kelompok tidak jauh berbeda. Perlakuan yang
diberikan pada tikus berupa 6 jenis ransum yang terdiri atas tiga konsentrasi
ransum tepung kedelai (TP) dan tiga konsentrasi isolat protein kedelai (IS) dengan
ransum standar sebagai kontrol. Ransum diberikan secara ad libitum.
Konsentrasi tepung kedelai yang pertama (TP 1) berdasarkan kandungan
lemak ransum maksimal 4%. Konsentrasi tepung kedelai yang kedua (TP 2) dan
ketiga (TP 3) sebanyak 75% dan 50% dari konsentrasi tepung kedelai yang
pertama. Konsentrasi isolat protein kedelai yang pertama (IS 1) berdasarkan
kandungan protein ransum maksimal. Konsentrasi isolat protein kedelai yang
kedua (IS 2) dan ketiga (IS 3) sebanyak 75% dan 50% dari konsentrasi isolat
protein kedelai yang pertama. Berdasarkan hal tersebut, faktor pembatas pada
penggunaan tepung kedelai adalah kadar lemaknya sedangkan pada isolat protein
kedelai adalah kadar proteinnya. Rincian ransum tiap perlakuan dapat dilihat pada
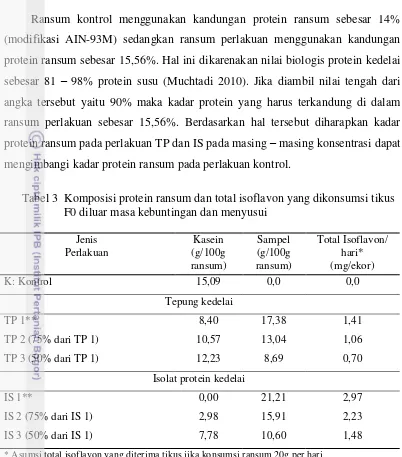
Ransum kontrol menggunakan kandungan protein ransum sebesar 14%
(modifikasi AIN-93M) sedangkan ransum perlakuan menggunakan kandungan
protein ransum sebesar 15,56%. Hal ini dikarenakan nilai biologis protein kedelai
sebesar 81 – 98% protein susu (Muchtadi 2010). Jika diambil nilai tengah dari
angka tersebut yaitu 90% maka kadar protein yang harus terkandung di dalam
ransum perlakuan sebesar 15,56%. Berdasarkan hal tersebut diharapkan kadar
protein ransum pada perlakuan TP dan IS pada masing – masing konsentrasi dapat
mengimbangi kadar protein ransum pada perlakuan kontrol.
Tabel 3 Komposisi protein ransum dan total isoflavon yang dikonsumsi tikus
F0 diluar masa kebuntingan dan menyusui
* Asumsi total isoflavon yang diterima tikus jika konsumsi ransum 20g per hari ** Konsumsi maksimum yang dapat diberikan mengikuti komposisi AIN-93M
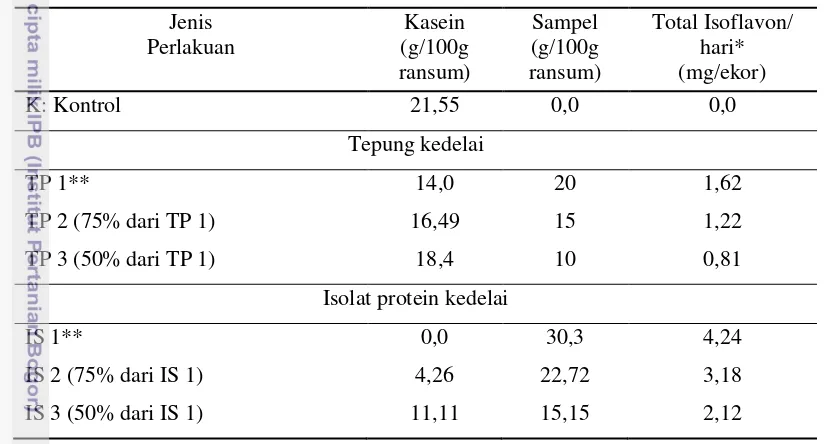
Saat masa kebuntingan, menyusui dan pasca menyusui, formula ransum
yang diberikan berdasarkan modifikasi AIN-93G dengan kadar protein 20%.
Berdasarkan nilai biologis protein kedelai sebesar 90% protein susu maka kadar
protein untuk ransum perlakuan sebesar 22,22%. Berdasarkan hal tersebut, jumlah
sampel yang diberikan baik sampel tepung kedelai maupun isolat protein kedelai
ikut berubah.
Pada sampel tepung kedelai, faktor yang membatasi pemberian jumlah
sampel bukan lagi lemak melainkan kadar serat sampel. Hal ini dikarenakan
sedangkan kadar serat tetap 5%. Pada sampel isolat protein kedelai, faktor
pembatasnya tetap kadar protein sampel. Rincian ransum tiap perlakuan dapat
dilihat pada Tabel 4. Kemudian, daftar komposisi ransum, perhitungan komposisi
ransum dan hasil analisis bahan - bahan yang digunakan dalam pembuatan ransum
dapat dilihat pada Lampiran 1 - 9.
Tabel 4 Komposisi protein ransum dan total isoflavon yang dikonsumsi tikus F0
pada masa kebuntingan & menyusui serta tikus F1
* Asumsi total isoflavon yang diterima tikus jika konsumsi ransum 20g per hari ** Konsumsi maksimum yang dapat diberikan mengikuti komposisi AIN-93G
Periode pemeliharaan tikus percobaan dibagi menjadi beberapa tahap.
Sebelum memulai intervensi, terlebih dahulu dilakukan masa penggenapan umur
tikus hingga 2 bulan agar tikus siap dikawinkan setelah selesai masa perlakuan.
Kemudian tikus mulai diberi perlakuan selama 30 hari. Selanjutnya tikus
dikawinkan sampai mengalami kebuntingan. Perlakuan dilanjutkan hingga tikus
F1 (anak tikus hasil kebuntingan yang pertama) mengalami perlakuan selama
sebulan selepas masa menyusui. Tahapan pemeliharaan tikus percobaan F0 dan
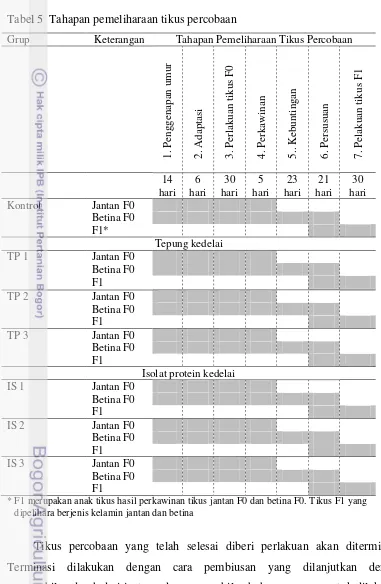
F1 dapat dilihat pada Tabel 5.
Berdasarkan Tabel 5, tahapan pemeliharaan tikus terdiri atas tujuh tahapan
yaitu tahap (1) penggenapan umur, (2) adaptasi, (3) perlakuan tikus F0, (4)
perkawinan, (5) kebuntingan, (6) persusuan dan (7) perlakuan tikus F1. Parameter
berdasarkan tujuan dan output penelitian. Semua parameter mengarah pada satu
topik besar yaitu tentang profil reproduksi tikus.
Tabel 5 Tahapan pemeliharaan tikus percobaan
Grup Keterangan Tahapan Pemeliharaan Tikus Percobaan
1. Pengg
* F1 merupakan anak tikus hasil perkawinan tikus jantan F0 dan betina F0. Tikus F1 yang dipelihara berjenis kelamin jantan dan betina
Tikus percobaan yang telah selesai diberi perlakuan akan diterminasi.
Terminasi dilakukan dengan cara pembiusan yang dilanjutkan dengan
pengambilan darah dari jantung dan pengambilan beberapa organ untuk dilakukan
masa perkawinan, terminasi tikus betina F0 dilakukan setelah selesai masa
menyusui sedangkan terminasi tikus jantan dan betina F1 dilakukan setelah selesai
masa perlakuan 30 hari.
Sebelum dilakukan diterminasi, tikus betina F0 & F1 akan melalui tahap
pemeriksaan status reproduksi. Terminasi tikus betina dilakukan pada status
reproduksi yang sama yaitu pada saat fase proestrus atau mendekati fase estrus.
Hal ini dikarenakan, pada saat fase proestrus kadar estrogen berada dalam
konsentrasi tertinggi (Beimborn et al. 2003). Salah satu parameter penelitian ini
adalah analisis kadar hormon reproduksi. Rincian parameter penelitian dapat
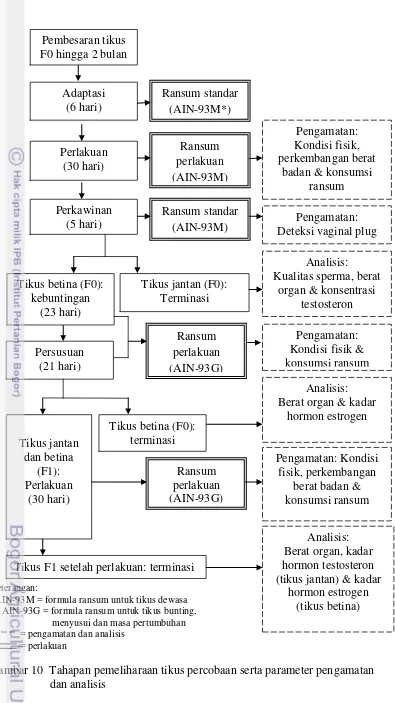
dilihat pada Tabel 6. Berdasarkan Tabel 5 dan 6, dibuatlah bagan yang
merepresentasikan seluruh kegiatan penelitian (Gambar 10).
Tabel 6 Parameter penelitian berdasarkan tujuan dan output penelitian
Parameter Tujuan Output
Jumlah konsumsi Ransum
Menjelaskan pengaruh konsumsi tepung kedelai dan isolat protein kedelai terhadap pertumbuhan dan berat organ tikus jantan dan betina F0 dan F1
Informasi mengenai dampak konsumsi tepung kedelai dan isolat protein kedelai
terhadap pertumbuhan dan berat organ tikus jantan dan betina F0 dan F1
Vaginal plug Menjelaskan pengaruh konsumsi
tepung kedelai dan isolat protein kedelai terhadap profil reproduksi tikus jantan dan betina F0 serta kadar hormon testosteron tikus jantan dan estrogen tikus betina F1
Informasi mengenai dampak konsumsi tepung kedelai dan isolat protein kedelai
Gambar 10 Tahapan pemeliharaan tikus percobaan serta parameter pengamatan dan analisis
Keterangan:
*AIN-93M = formula ransum untuk tikus dewasa ** AIN-93G = formula ransum untuk tikus bunting, menyusui dan masa pertumbuhan Tikus F1 setelah perlakuan: terminasi
Data yang diperoleh dari penelitian ini terdiri dari data kondisi fisik,
kesuburan dan kadar hormon tikus jantan dan betina F0 serta data kondisi fisik
dan kadar hormon tikus jantan dan betina F1. Data kesuburan tikus jantan dan
betina F1 tidak dapat diperoleh karena tikus masih dalam usia puber sehingga
belum dapat dikawinkan serta belum menghasilkan sperma. Pada akhir perlakuan,
tikus jantan dan betina F1 baru mencapai umur 7 - 8 minggu di mana pada umur
tersebut tikus sudah mencapai usia puber. Umur ideal untuk perkawinan tikus
adalah 10 - 12 minggu (Smith & Mangkoewidjojo 1989).
D. Prosedur Pengamatan dan Analisis
1. Komposisi kimia ransum tikus percobaan
a. Kadar proksimat
Kadar air (SNI 1992)
Metode analisis kadar air yang dipakai adalah metode oven. Prinsip dari
metode ini adalah mengukur kehilangan bobot pada pemanasan 1050C yang
dianggap sebagai kadar air yang terdapat pada sampel. Sebanyak 1 – 2g sampel
ditempatkan ke dalam wadah kemudian dikeringkan pada oven suhu 1050C
selama 3 jam. Setelah didinginkan di dalam desikator, sampel ditimbang kembali.
Pengeringan kembali dilanjutkan hingga memperoleh bobot yang konstan.
Selanjutnya dilakukan perhitungan sebagai berikut: % air = w/w1 x 100%
Keterangan: w = bobot sampel sebelum dikeringkan (gram)
w1= kehilangan bobot setelah dikeringkan (gram)
Kadar protein (AOAC 1995)
Metode yang digunakan adalah metode kjeldahl dengan prinsip
penghitungan jumlah nitrogen total yang kemudian dikali dengan faktor konversi.
Sebanyak 100 – 250mg sampel ditempatkan ke dalam labu Kjeldahl selanjutnya
ditambahkan 1,9g K2SO4, 40mg HgO, 2mL H2SO4 pekat dan beberapa butir batu
didih untuk mencegah bumping. Sampel kemudian dipanaskan secara bertahap
hingga diperoleh larutan jernih. Setelah dingin, sampel dipindahkan ke labu