PENGGUNAAN MUTAN
C. sakazakii
GFPuv UNTUK KAJIAN
PEMBENTUKAN BIOFILM MULTISPESIES
YUDAWAN AJI PRATOMO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Penggunaan Mutan C. sakazakii GFPuv Untuk Kajian Pembentukan Biofilm Multispesies adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2015
Yudawan Aji Pratomo
RINGKASAN
YUDAWAN AJI PRATOMO. Penggunaan Mutan C. sakazakii GFPuv Untuk Kajian Pembentukan Biofilm Multispesies. Dibimbing oleh RATIH DEWANTI-HARIYADI dan LILIS NURAIDA.
Biofilm adalah populasi sel mikroba yang menempel dan tumbuh pada suatu permukaan dan tertutup dalam matriks ekstraselular. Biofilm yang terbentuk dalam lingkungan pengolahan pangan perlu diberikan perhatian khusus karena memiliki potensi sebagai sumber kontaminasi mikroba yang dapat menyebabkan pembusukan makanan atau penularan penyakit. Bakteri dalam bentuk biofilm telah dilaporkan mengalami peningkatan ketahanan terhadap pembersihan dan sanitasi.
C. sakazakii adalah jenis bakteri patogen dalam kelompok Gram-negatif, berbentuk batang dan tidak membentuk spora. Pada beberapa penelitian C. sakazakii telah diketahui dapat melakukan penempelan dan membentuk biofilm pada beberapa macam jenis permukaan unit pengolahan pangan, seperti polikarbonat, stainless steel, kaca, silikon, karet dan polyvinyl chloride. Pada pengamatan biofilm bakteri wild-type dalam lingkungan koloni kompleks atau pada kondisi terjadinya kompetisi antar bakteri seringkali ditemui kesulitan dalam membedakan bakteri target dengan bakteri atau mikroorganisme lainnya. Pelabelan menggunakan Green Fluorescent Protein (GFP) dapat menjadi salah satu alternatif untuk mengamati bakteri pembentuk biofilm pada lingkungan koloni kompleks. C. sakazakii berlabel GFPuv dapat berfluoresen di bawah sinar UV menunjukkan koloni spesifik berwarna hijau fluoresen yang dapat dibedakan dengan bakteri lainnya.
Tujuan umum dari penelitian ini adalah untuk melihat pembentukan biofilm oleh C. sakazakii pada pelat stainless steel (SS), karet Buna-N dan Politetrafluoroetilena (PTFE) dengan atau tanpa adanya keberadaan bakteri lain dengan menggunakan bakteri C. sakazakii terlabel GFPuv. Tujuan khusus dari penelitian ini adalah : (1) Mempelajari pembentukan biofilm oleh isolat lokal C. sakazakii mutan GFPuv dan wild-type pada permukaan pelat SS, karet Buna-N dan PTFE (2) Mempelajari pembentukan biofilm C. sakazakii mutan GFPuv saat ditumbuhkan bersama Staphylococcus aureus dan bakteri asam laktat (BAL) dalam satu lingkungan (3) Mengevaluasi metode DMC dan metode pemupukan tuang untuk menghitung biofilm yang terbentuk oleh mutan C. sakazakii GFPuv.
Penelitian ini dibagi menjadi dua tahap, yaitu tahap persiapan yang meliputi persiapan kultur bakteri C. sakazakii mutan GFPuv FWHd16 dan YRt2a,
C. sakazakii wild-type FWHd16 dan YRt2a, L. rhamnosus R23 dan S. aureus
SA25923 dan persiapan pelat permukaan kontak pangan yang terdiri dari SS, buna-N dan PTFE di dalam media pertumbuhan TSB dan MRSB. Tahap penelitian meliputi pembentukan biofilm C. sakazakii mutan GFPuv dan wild-type
YRt2a dan FWHd16 pada pelat SS, Buna-N dan PTFE yang diinkubasi pada tiga waktu yang berbeda, yakni 24, 48 dan 72 jam. Mutan C. sakazakii juga digunakan untuk pembentukan biofilm menggunakan tiga bakteri berbeda, yakni C. sakazakii
C. sakazakii mutan GFPuv membentuk biofilm dengan jumlah dan pola yang relatif sama dengan C. sakazakii wild-type pada ketiga jenis permukaan kontak pangan. Uji statistik menunjukkan bahwa densitas biofilm C. sakazakii
tertinggi terjadi pada PTFE, diikuti oleh SS dan Buna-N. Waktu inkubasi berpengaruh pada pembentukan biofilm dengan densitas tertinggi untuk mutan C. sakazakii GFPuv dan wild-type C. sakazakii FWHd16 serta wild-type C. sakazakii
YRt2a terjadi saat 48 jam sedangkan untuk mutan C. sakazakii YRt2a terjadi saat 24 jam. Enumerasi densitas biofilm yang dihasilkan oleh mutan C. sakazakii
GFPuv dengan menggunakan metode DMC menghasilkan jumlah densitas 2 Log CFU/cm2 lebih tinggi dibandingkan dengan metode pemupukan. C. sakazakii
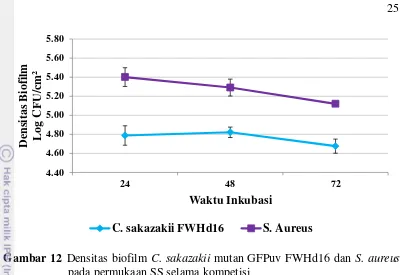
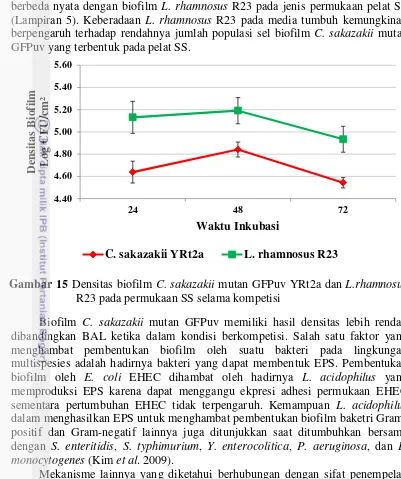
mutan GFPuv, S. aureus dan L. rhamnosus R23 mampu membentuk biofilm pada pemukaan SS saat ditumbuhkan bersama-sama dalam satu media pertumbuhan. Densitas biofilm C. sakazakii mutan GFPuv, baik galur FWHd16 dan YRt2a menghasilkan nilai terendah dibandingkan kedua jenis bakteri lain yakni, S. aureus dan L. rhamnosus R23 saat ditumbuhkan bersama-sama pada waktu inkubasi 48 dan 72 jam. Secara umum, kompetitor S. aureus dan L. rhamnosus
R23 memiliki jumlah populasi sel yang lebih tinggi saat membentuk biofilm pada permukaan SS saat dikompetiskan dengan C. sakazakii mutan GFPuv FWHd16 dan YRt2a. Mutan berlabel GFPuv dapat digunakan untuk membedakan suatu spesies bakteri dengan bakteri lainnya saat dilakukan pengamatan visual menggunakan mikroskop fluoresen.
SUMMARY
YUDAWAN AJI PRATOMO. Use of C. sakazakii Mutant GFPuv to Study Biofilm Multispecies Formation. Supervised by RATIH DEWANTI-HARIYADI and LILIS NURAIDA.
Biofilms are defined as sessile communities of bacterial cells attached to a surface or to each other and followed by growth and biofilm formation, usually enclosed in the extracellular polymeric substances produced by the bacteria. The biofilms formed in food processing environtment may potentially become sources of contamination resulting in food spoilage or foodborne illness. Biofilm cells has been reported are more resistant to antimicrobial agents than their planktonic counterparts.
Cronobacter sakazakii is a Gram-negative, rod-shaped, non-spore-forming pathogenic bacteria. C. sakazakii has been reported to be able to attach to and form biofilms on silicon, latex, polycarbonate, stainless steel, glass, and polyvinyl chloride. In observation of wild-type biofilm bacteria in a complex environment or the conditions of competition between bacteria often found difficulty in distinguishing the bacteria target with other bacteria. Green Fluorescent Protein (GFPuv) has become an especially valuable marker for nondestructively visualizing cells, particularly in biofilms. Labeling bacteria using GFPuv can be an alternative to observe biofilm-forming bacteria in complex environments or multispecies. C. sakazakii labeled GFPuv can become fluorescent under UV light to indicate the specific green fluorescent colonies that can be distinguished by other bacteria.
The purpose of this research is to investigate the behavior of C. sakazakii
mutant GFPuv in the formation of biofilm on several food contact surfaces and compare it to those by its wild-type as well as the formation of biofilm of this mutant in the presence of S. aureus and/or L. rhamnosus and the performance of direct microscopic count and plating method for enumeration of the adherent cells. This research was carried out into two stages. The first stage was prelimenary research consist of : (a) preparatory bacteria cultures C. sakazakii mutant GFPuv andwild-type FWHd16 and YRt2a, S. aureus SA25923 and L. rhamnosus R23 ; (b) preparatory food surface contact plates consist of SS, buna-N and PTFE in the growth media of TSB and mRSB. The second stage was compare GFPuv labeled and wild-type C. sakazakii strains pertaining their ability to biofilm formation on several food contact surfaces, i.e. SS, buna-N, and PTFEunder incubated at three different times, i.e 24, 48 and 72 h. Mutant C. sakazakii is also used for the formation of biofilms multispesies using three different bacteria, i.e C. sakazakii
mutant GFPuv FWHd16 and YRt2a, S. aureus SA25923 and L. rhamnosus R23 on stainless steel which also incubated at 24, 48 and 72 h.
biofilm density was formed at 48 h by wild-type and GFPuv labeled C. sakazakii
FWH16 as well as wild-type C. sakazakii YRt2a. The GFPuv labeled C. sakazakii
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Pangan
PENGGUNAAN MUTAN
C. sakazakii
GFPuv UNTUK KAJIAN
PEMBENTUKAN BIOFILM MULTISPESIES
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Penggunaan Mutan C. sakazakii GPFuv Untuk Kajian Pembentukan Biofilm Multispesies
Nama : Yudawan Aji Pratomo NIM : F251110491
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Ratih Dewanti-Hariyadi, MSc Ketua
Prof Dr Ir Lilis Nuraida, MSc Anggota
Diketahui oleh
Ketua Program Studi Ilmu Pangan
Prof Dr Ir Ratih Dewanti-Hariyadi, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juni 2014 ini adalah mikrobiologi keamanan pangan, dengan judul Penggunaan Mutan C. sakazakii
GPFuv Untuk Kajian Pembentukan Biofilm Multispesies. Bagian dari tesis ini juga telah dibuat dalam bentuk jurnal berjudul Use of GFPuv-labeled Mutant to Study Biofilm Formation by Cronobacter sakazakii in the Presence of Other Bacteria dan sedang dalam proses revisi ke Journal Food Science and Biotechnology.
Proses pembuatan tesis ini tentunya tidak terlepas dari bantuan banyak pihak. Oleh karena itu, penulis mengucapkan banyak terima kasih yang sebesar-besarnya kepada pihak-pihak yang telah banyak membantu penulis dalam menyelesaikan tesis ini, khususnya kepada Prof Dr Ir Ratih Dewanti-Hariyadi, MSc selaku Ketua Komisi Pembimbing dan Prof Dr Ir Lilis Nuraida, MSc selaku Anggota Komisi Pembimbing yang telah banyak memberi saran. Ucapan terima kasih juga tidak lupa penulis sampaikan kepada Dr Siti Nurjanah, STP MSi (penguji luar komisi) dan Dr Ir Dede R Adawiyah, MSi (penguji program studi), pengajar, pengelola program studi dan teknisi laboratorium serta teman-teman Program Pascasarjana Ilmu Pangan Institut Pertanian Bogor.
Secara khusus, penulis menyampaikan terima kasih kepada Ayahanda Sri Wuri Handono dan Ibunda Emmy Darmawati yang telah banyak mendukung penulis, dan kepada Danti Astrini. Tanpa dukungan keluarga, penulis tidak akan bisa berbuat yang terbaik.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2015
DAFTAR ISI
DAFTAR TABEL ii
DAFTAR GAMBAR ii
DAFTAR LAMPIRAN iii
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Hipotesis 3
Manfaat Penelitian 3
2 TINJAUAN PUSTAKA 4
Biofilm 4
Tahap Pembentukan Biofilm 5
Cronobacter spp. 6
Biofilm C. sakazakii 8
Mutan C. sakazakii Hasil Transformasi dengan Plasmid GFPuv 8 Kompetisi Bakteri dalam Penempelan dan Pembentukan Biofilm 9
Bakteri Asam Laktat 10
Staphylococcus aureus 11
3 METODOLOGI PENELITIAN 13
Waktu dan Tempat Penelitian 13
Bahan 13
Alat 13
Metode Penelitian 14
Tahap Persiapan 14
Persiapan Kultur Mutan C. sakazakii FWHd16 dan YRt2a 14 Persiapan Kultur Wild-type C. sakazakii, S. aureus dan L. rhamnosus 16
Persiapan Permukaan Kontak Pangan 16
Tahap Penelitian 17
Pembentukan Biofilm C. sakazakii Mutan dan Wild-type FWHd16 dan
YRt2a pada Permukan Kontak Pangan 17
Pembentukan Biofilm Multispesies pada Permukaan Kontak Pangan 17
Metode Analisis 17
Analisis Statistik 18
4 HASIL DAN PEMBAHASAN 18
Pembentukan Biofilm oleh C. sakazakii Mutan GFPuv dan Wild-type
pada Permukaan Kontak Pangan 18
Pembentukan Biofilm oleh C. sakazakii Mutan GFPuv saat
Pembentukan Biofilm oleh C. sakazakii Mutan GFPuv saat
Ditumbuhkan Bersama L. rhamnosus pada Permukaan Stainless Steel 26 Pembentukan Biofilm oleh C. sakazakii Mutan GFPuv saat
Ditumbuhkan Bersama S. aureus dan L. rhamnosus pada Permukaan
Stainless Steel 29
Pengunaan Metode DMC dan Metode Pemupukan untuk Evaluasi Densitas Biofilm C. sakazakii mutan GFPuv pada Permukaan Kontak
Pangan 32
5 SIMPULAN DAN SARAN 34
Simpulan 34
Saran 34
DAFTAR PUSTAKA 34
LAMPIRAN 43
RIWAYAT HIDUP 61
DAFTAR TABEL
1 Keterangan Isolat Bakteri 13
DAFTAR GAMBAR
1 Pembentukan biofilm 4
2 Cronobacter spp 7
3 Plasmid GFPuv 9
4 Staphylococcus aureus . 12
5 Diagram alir proses penelitian 15
6 Pengamatan biofilm dengan mikroskop epifluoresen (1000x) (A) C. sakazakii mutan GFPuv FWHd16, (B) C. sakazakii mutan GFPuv YRt2a, (C) C. sakazakii wild-type FWHd16 dengan perwarnaan
Acridine Orange, (D) C. sakazakiiwild-type YRt2a dengan perwarnaan
Acridine Orange 19
7 Densitas biofilm C. sakazakii mutan GFPuv FWHd16 pada permukaan
kontak pangan 20
8 Densitas biofilm C. sakazakii mutan GFPuv YRt2a pada permukaan
kontak pangan 20
9 Densitas biofilm C. sakazakii wild-type FWHd16 pada permukaan
kontak pangan 21
10 Densitas biofilm C. sakazakiiwild-type YRt2a pada permukaan kontak
pangan 22
11 Perbandingan densitas biofilm C. sakazakii mutan GFPuvdan wild-type
FWHd16 & YRt2a pada PTFE 24
12 Densitas biofilm C. sakazakii mutan GFPuv FWHd16 dan S. aureus
13 Densitas biofilm C. sakazakii mutan GFPuv YRt2a dan S. aureus pada
permukaan SS selama kompetisi 26
14 Densitas biofilm C. sakazakii mutan GFPuvFWHd16 dan L.rhamnosus
R23 pada permukaan SS selama kompetisi 27
15 Densitas biofilm C. sakazakii mutan GFPuv YRt2a dan L.rhamnosus
R23 pada permukaan SS selama kompetisi 28
16 Densitas biofilm C. sakazakii mutan GFPuvFWHd16, S. aureus dan L. rhamnosus R23 pada permukaan SS selama kompetisi 30 17 Densitas biofilm C. sakazakii mutan GFPuv YRt2a, S. aureus dan L.
rhamnosus R23 pada permukaan SS selama kompetisi 31 18 Perbandingan densitas biofilm mutan C. sakazakii GFPuv FWHd16 &
YRt2a pada permukaan PTFE menggunakan metode DMC dan
pemupukan 33
DAFTAR LAMPIRAN
1 Uji sidik ragam pengaruh jenis permukaan terhadap pembentukan biofilm oleh C. sakazakii GFPuv dan wild-type FWHd16 dan YRt2a
pada masing-masing waktu inkubasi 43
2 Uji lanjut Duncan pengaruh waktu inkubasi dan jenis permukaan pada pembentukan biofilm oleh C. sakazakii GFPuv dan wild-type FWHd16
dan YRt2a 47
3 Uji Independent Samples Test perbandingan densitas biofilm yang terbentuk oleh C. sakazakii GFPuv dan wild-type FWHd16 dan YRt2a
pada seluruh perlakuan 53
4 Uji sidik ragam pembentukan biofilm multispesies oleh C. sakazakii
GFPuv FWHd16 dan YRt2a dan S. aureus pada permukaan SS 55 5 Uji sidik ragam pembentukan biofilm multispesies oleh C. sakazakii
GFPuv FWHd16 dan YRt2a dan L. rhamnosus R23 pada permukaan SS 57 6 Uji sidik ragam pembentukan biofilm multispesies oleh C. sakazakii
GFPuv FWHd16 dan YRt2a, S. aureus dan L. rhamnosus R23 pada
1
PENDAHULUAN
Latar Belakang
Biofilm didefinisikan sebagai komunitas sel yang menempel pada permukaan dan biasanya terlindungi oleh matriks ekstraseluler yang diproduksi oleh bakteri (Donlan, 2002). Penempelan mikroorganisme pada permukaan biotik atau abiotik diikuti oleh pembentukan biofilm sehingga sel memiliki sifat lebih resisten terhadap kondisi lingkungan ekstrim dan memiliki kemampuan pertahanan yang lebih kuat terhadap proses sanitasi dan kehadiran antimikroorganisme (O'Toole et al. 2000). Biofilm yang terbentuk di lingkungan pengolahan pangan menjadi sangat penting karena memiliki potensi sebagai sumber kontaminasi mikroba yang dapat menyebabkan pembusukan makanan atau penularan penyakit.
C. sakazakii adalah jenis bakteri Gram-negatif, berbentuk batang dan tidak membentuk spora (Adekunte et al. 2010). C. sakazakii merupakan bakteri patogen oportunistik dan dapat menyebabkan meningitis, bakteremia, dan necrotizing enterocolitis pada bayi yang terlahir dalam kondisi prematur atau berat badan dibawah 2.5 kg. Susu formula bayi dan produk pangan segar diketahui sebagai kendaraan dalam wabah penyakit infeksi C. sakazakii (Lai, 2001). C. sakazakii
telah dilaporkan dapat melakukan penempelan dan membentuk biofilm pada silikon, lateks, polikarbonat, stainless steel, kaca, dan polyvinyl chloride (Iversen
et al. 2004; Lehner et al. 2005).
Dalam berbagai ekosistem di alam, mikroorganisme tidak hidup sebagai koloni tunggal, melainkan dalam sebuah koloni yang kompleks atau multispesies dengan berbagai interaksi kompetisi yang terjadi diantara mereka. Kompetisi terjadi ketika dua populasi hidup bersama-sama memperebutkan sumber nutrisi yang sama, sehingga dapat menyebabkan keterbatasan dalam pertumbuhan kedua jenis bakteri tersebut (Atlas dan Bartha, 1981). Salah satu cara pertahanan yang dilakukan oleh bakteri apabila kondisi lingkungan tidak menguntungkan adalah dengan membentuk biofilm. Biofilm dapat terbentuk dari suatu mikrokoloni yang terdiri dari satu populasi tunggal atau populasi campuran lebih dari satu spesies di dalamnya dengan berbagai variasi interaksi. Dua spesies akan dapat membentuk populasi campuran ketika dapat tumbuh dengan kesamaan jenis nutrisi yang dibutuhkan dan dapat hidup terpisah dengan spesies yang berbeda jenis nutrisinya (Nielsen et al. 2000). Sementara itu, jika terjadi interaksi kompetitif antara dua spesies tersebut akibat adanya metabolit sekunder, maka masing-masing mikroorganisme tersebut akan membentuk mikrokoloni dan biofilm yang terpisah (Tait dan Sutherland, 2002). Biofilm yang terbentuk pada lingkungan dengan kepadatan sel yang tinggi dan tingkat difusi yang rendah akan memberikan peluang bagi mikroorganisme untuk melakukan berbagai perilaku mulai dari kerjasama hingga munculnya kompetisi dalam memperebutkan nutrisi (Moons et al. 2009).
Bakteri asam laktat adalah bakteri yang diduga dapat mengurangi pembentukan biofilm oleh bakteri patogen. Salah satu bakteri asam laktat,
2
biofilm pada permukaan abiotik dengan efisiensi lebih tinggi dari strain
Lactobacillus lainnya (Lebeer et al. 2007). L. rhamnosus R23 juga dilaporkan mampu menempel dengan baik pada permukaan usus tikus dan mampu berkompetisi dengan EPEC saat terjadi penempelan (Nuraida, 2012). Hal ini mengindikasikan L. rhamnosus R23 dapat membentuk biofilm pada permukaan dan berkompetisi dengan bakteri lainnya dalam satu lingkungan. Staphylococcus aureus adalah salah satu bakteri patogen yang dapat diisolasi dari permukaan pada peralatan pabrik pengolahan pangan (Pastoriza et al. 2002). Patogenesis dari keracunan yang disebabkan oleh S. aureus dipengaruhi oleh kemampuan dari strain untuk dapat bertahan hidup, bermultiplikasi pada berbagai kondisi lingkungan dan memproduksi berbagai senyawa ekstraseluler (Carson et al., 2002). Kemampuan S. aureus dalam menempel dan membentuk biofilm pada permukaan kontak pengolahan pangan dapat meningkatkan kemampuan bertahan hidup dan memberikan perubahan fisiologis S. aureus dalam perannya sebagai bakteri patogen pangan (Herrera et al. 2007).
Interaksi multispesies dalam beberapa lingkungan dapat menyebabkan perubahan fisiologis dan regulasi pembentukan biofilm yang berkontribusi pada seleksi suatu mikroorganisme atau munculnya mutan yang beradaptasi dengan lingkungannya. Interaksi multispesies ini dapat mempengaruhi muncul atau terhambatnya suatu spesies dalam pembentukan biofilm (Dubey dan Ben-Yehuda, 2011). Pembentukan biofilm oleh E. coli jenis EHEC dihambat oleh hadirnya bakteri asam laktat L. acidophilus yang memproduksi EPS karena dapat menggangu ekspresi adhesin permukaan EHEC sedangkan pertumbuhan EHEC tidak terpengaruh. Kemampuan L. acidophilus dalam menghasilkan EPS yang menghambat pembentukan biofilm bakteri Gram-positif dan Gram-negatif lainnya juga ditunjukkan saat ditumbuhkan bersama dengan S. enteritidis, S. typhimurium,
Y. enterocolitica, P. aeruginosa, dan L. monocytogenes (Kim et al. 2009). Sundari (2002) menyebutkan bahwa kompetisi antara E. coli O157:H7 dan BAL pada pembentukan biofilm pada permukaan stainless steel mempengaruhi penempelan
E. coli O157:H7 dengan terjadinya pelepasan jumlah sel yang lebih banyak dibandingkan dengan BAL sedangkan dari pembentukan biofilm oleh BAL dihasilkan densitas lebih rendah dibandingkan dengan E. coli O157:H7 akibat kurangnya nutrisi yang lengkap pada media. Pada pembentukan biofilm oleh S. aureus pada permukaan stainless steel dilaporkan dihambat oleh kehadiran BAL. Ketika dikompetisikan dengan L. casei dalam lingkungan tumbuh yang sama, pertumbuhan dan pembentukan biofilm oleh S. aureus mengalami penghambatan hingga sebesar 0.4 Log (Kusumawardani, 2002).
3 (Nurjanah et al. 2014). Protein ini akan dapat berfluoresen di bawah sinar UV sehingga C. sakazakii yang terlabel akan menunjukkan koloni spesifik berwarna hijau fluoresen.
Tujuan Penelitian
Tujuan umum dari penelitian ini adalah untuk mengevaluasi pembentukan biofilm oleh C. sakazakii dan mempelajari pengaruh lingkungan terhadap karakterisktik biofilm yang dihasilkan. Tujuan khusus dari penelitian ini adalah : 1. Mempelajari pembentukan biofilm oleh C. sakazakii mutan GFPuv isolat
lokal dan biofilm C.sakazakiiwild type pada permukaan pelat SS, Buna-N, dan PTFE.
2. Mempelajari pembentukan biofilm C. sakazakii mutan GFPuv saat ditumbuhkan bersama Staphylococcus aureus dan L. rhamnosus (BAL) dalam satu lingkungan.
3. Mengevaluasi metode DMC dan metode pemupukan tuang untuk menghitung biofilm yang terbentuk oleh mutan C.sakazakii GFPuv
Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah :
1. Mutan C. sakazakii GFPuv mampu membentuk biofilm pada permukaan pelat SS, Buna-N, dan PTFE seperti galur wild-type.
2. Terjadi kompetisi pembentukan biofilm antara bakteri C. sakazakii mutan GFPuv dengan bakteri Staphylococcus aureus dan L. rhamnosus (BAL) pada permukaan pelat stainless steel.
3. Metode DMC dapat digunakan sebagai alternatif untuk mengevaluasi biofilm yang terbentuk oleh mutan berlabel GFPuv.
Manfaat Penelitian
4
2 TINJAUAN PUSTAKA
Biofilm
Biofilm adalah sekumpulan mikroba yang hidup berkoloni dan menempel pada permukaan padat, termasuk pada bahan ekstraseluler yang diproduksi oleh mikroba itu sendiri sehingga membentuk suatu matriks (Hood dan Zotolla, 1995). Penempelan mikroba dan perkembangan biofilm dapat terjadi di berbagai lingkungan. Informasi tentang biofilm kebanyakan berasal dari penelitian berkaitan dengan lingkungan laut, kedokteran dan sistem distribusi air. Pembentukan biofilm pada pipa-pipa, galangan kapal dan alat penukar panas akan menstimulasi korosi yang mengakibatkan menurunnya kinerja dan umur pakai alat sehingga sangat merugikan dari segi ekonomi. Di bidang kedokteran, akumulasi biofilm pada gigi dan gusi, saluran urine dan pada alat implant telah menyebabkan timbulnya berbagai gangguan kesehatan dan infeksi pada manusia. Pada sistem distribusi air, akumulasi biofilm akan menurunkan kualitas air dan meningkatkan resiko kesehatan (Dewanti dan Wong, 1995). Biofilm ternyata juga merupakan masalah yang kerap ditemukan pada beberapa sektor industri pangan, seperti pada industri minuman bir, proses pengolahan susu, produk buah dan sayuran segar, pengolahan produk unggas dan daging (Somers dan Wong, 2004; Chen et al.
2007).
Biofilm merupakan sekelompok sel bakteri terstruktur dan melekat pada permukaan hidup atau inert yang terperangkap di dalam matriks polimer yang dihasilkan oleh bakteri tersebut sebagai salah satu bentuk perlindungan diri (Prakash et al. 2003). Gambar 1 menunjukkan skema pembentukan biofilm di lingkungan, pembentukan dan perkembangan biofilm dipengaruhi oleh beberapa macam faktor, seperti lingkungan, nutrisi, strain bakteri tertentu (Borucki et al. 2003) hingga sifat-sifat material permukaan dan parameter lingkungan seperti pH dan suhu (Donlan, 2002).
Gambar 1 Pembentukan biofilm (Kokare et al. 2009)
5 mencegah atau mengurangi kontak dengan agen-agen antimikroba (O'Toole et al.
2000). Jenis mikroorganisme, baik yang bersifat pembusuk dan jenis patogen dapat membentuk biofilm dan memainkan peran kunci dalam timbulnya kontaminasi pada produk atau munculnya infeksi penyakit (Parsek dan Singh, 2003). Pada lingkungan yang tidak bersahabat, bakteri akan membentuk biofilm sebagai strategi kelangsungan hidup (Stepanovic et al. 2003).
Tahap Pembentukan Biofilm
Pembentukan biofilm terdiri dari beberapa tahap yaitu a) adsorpsi senyawa organik oleh permukaan, b) transport bakteri ke permukaan, c) adsorpsi bakteri oleh permukaan dan penempelan awal yang mungkin diikuti oleh : d) pelepasan sel bakteri ataupun e) penempelan tidak dapat balik yang dilanjutkan dengan, f) pertumbuhan sel dan pembentukan polidasakarida ekstraseluler sehingga sel biofilm terakumulasi dan g) setelah terbentuk akumulasi, bisa terjadi pelepasan atau penempelan kembali.
a. Adsorpsi Senyawa Organik oleh Permukaan
Pada tahap ini molekul organik akan ditranspor dari cairan ke permukaan padat. Beberapa molekul kemudian diadsorpsi oleh permukaan yang menyebabkan kondisi permukaan memungkinkan untuk penempelan bakteri. Adanya kontak pada permukaan padat dengan suatu permukaan lain seperti cairan, maka akan terjadi adsorpsi senyawa organik oleh permukaan padat dan dapat mengubah muatan permukaan (Characklis dan Marshall, 1990).
b. Transport Bakteri ke Permukaan
Characklis dan Marshall (1990) menyatakan pada tahap ini beberapa sel plantonik mikroba akan berpindah dari cairan ke permukaan, ditandai permukaan tersebut telah memiliki kondisi yang memungkinkan untuk penempelan sebagai akibat adsorpsi senyawa organik. Bakteri berflagella cenderung bergerak untuk mencapai makanan yang diperlukannya, sehingga terjadi transpor bakteri dari suspensi ke permukaan padat. Peristiwa ini mengawali terjadinya penempelan yang bersifat balik (Hood dan Zottola, 1995).
c. Adsorpsi Bakteri oleh Permukaan
Menurut Characklis dan Marshall (1990), pada tahap ini sel planktonik teradsorpsi ke permukaan untuk jangka waktu yang terbatas dan kemudian lepas kembali ke suspensi cairan. Tahap ini disebut penempelan dapat balik yang dipengaruhi permukaan bakteri dan permukaan substrat. Pemukaan bakteri adalah dinding sel dan aksesoris lainnya seperti fimbriae, lipopolisakarida, asam teikoat dan polisakarida ekstraseluler yang merupakan struktur terluar bakteri. Beberapa faktor yang berperan dalam adsorpsi bakteri ini antara lain adalah adanya interaksi hidrofobik, muatan bakteri serta kekasaran permukaan. Interaksi hidrofobik akan mempengaruhi penempelan sel, biofilm akan lebih mudah terbentuk bila interaksi hidrofobik ini semakin besar (Hood dan Zottola, 1995).
6
mikroorganisme pada permukaan yang kasar jumlahnya lebih tinggi dibandingkan pada permukaan yang lebih halus. Hal ini disebabkan oleh berkurangnya pelepasan karena melemahnya laju aliran dari suspensi cairan dan semakin luasnya tempat dipermukaan benda padat untuk terjadinya adsorpsi
d. Pelepasan Sel yang Menempel Menuju Fase Cair
Bakteri yang teradsorpsi secara dapat balik mudah sekali berpindah ke fase cair. Menurut Dewanti dan Wong (1995), pembentukan biofilm E.coli O157:H7 dalam medium kaya dapat mencegah terbentuknya penempelan tidak dapat balik pada permukaan SS. Pada kondisi ini diduga jumlah maksimum bakteri yang menempel pada satu jam pertama 1/100 kali lebih rendah dibanding jumlah bakteri yang menempel pada medium miskin nutrisi. Hal ini mungkin disebabkan bakteri lebih mudah mendapatkan nutrien di dalam cairan sehingga tidak harus membentuk biofilm.
e. Pertumbuhan Bakteri yang Teradsorpsi
Biofilm akan terbentuk dan berkembang serta memproduksi senyawa ektraseluler, bila kondisi lingkungan memungkinkan (Hood dan Zottola, 1995). Kondisi ini antara lain adalah status sel dalam kondisi kelaparan. Meningkatnya penempelan pada saat sel dalam kondisi kelaparan, mungkin merupakan akibat dari terdapatnya nutrien pada sistem cair yang akan meningkatkan konsentrasi pada permukaan dibandingkan pada suspensi atau cairan. Penempelan permukaan pada kondisi ini juga diduga sebagai teknil perlindungan dari sel bakteri yang menempel.
f. Akumulasi Biofilm
Bila sel bakteri tumbuh dan membentuk polisakarida ektraseluler serta mampu menarik bakteri lainnya untuk bergabung degan kelompok yang sudah menempel, maka bisa terakumulasi sel biofilm yang terdiri dari beberapa lapisan. Bakteri yang berada pada lapisan dalam akan terlindungi oleh lapisan yang lebih luar. Komunitas ini juga dapat memenuhi kebutuhan nutriennya sendiri karena sel-sel yang mati dapat berfungsi sebagai nutrien untuk sel yang masih hidup (Dewanti-Hariyadi et al. 1997).
g. Pelepasan Sel Biofilm
Sel penyusun biofilm dapat melepaskan diri, dimana sel-sel bakteri yang telah terakumulasi akan berpindah ke medium cair atau suspensi (Charaklis dan Marshall, 1990). Pelepasan sel mikroba ini menyebabkan terurainya komponen pembentuk biofilm, sehingga dapat mengkontaminasi bagian lain dari suatu sistem. Pelepasan biofilm dapat berupa erosi, sloughing atau abrasi. Erosi adalah hilangnya bagian-bagian kecil dari biofilm secara kontinu disebabkan oleh adanya gaya gesek. Sloughing adalah hilangnya sebagian besar dari biofilm yang disebabkan oleh perubahan kondisi lingkungan. Abrasi adalah hilangnya biofilm yang disebabkan oleh terjadinya tabrakan atau gesekan terus menurus dengan partikel permukaan (Characklis dan Marshall, 1990).
Cronobacter spp.
7 telah diklasifikasikan ke dalam empat jenis spesies: Cronobacter sakazakii,
Cronobacter turicensis, Cronobacter muytjensii, dan Cronobacter dublinesis.
Cronobacter spp. juga dibagi menjadi 16 biogroups berdasarkan karakteristik biokimia (Iversen et al. 2006). Gambar 2 menunjukkan visualisasi Cronobacter spp saat diamati menggunakan SEM (Scanning Electrone Microscope) dengan perbesaran 4800x.
Cronobacter spp. dikenal sebagai patogen pangan (food-borne pathogen). Penyakit infeksi yang disebabkan oleh Cronobacter spp. adalah meningitis, bacterimia, necrotizing enterocolitis, dan septicemia pada bayi dan neonatal (Hartmann et al. 2010). Lebih dari 500 Cronobacter spp. infeksi dilaporkan di Inggris selama 1999-2007, 90 persen di antaranya terjadi pada orang yang berusia 15 tahun keatas (FAO dan WHO, 2008). Cronobacter spp. tersebar di lingkungan dan telah berhasil diisolasi dari produk susu formula bayi, sereal makanan, minuman fermentasi, buah-buahan, dan sayuran. Iversen dan Forsythe (2003) menemukan bahwa 2.4 persen dari susu formula bubuk yang diproduksi di sembilan negara terkandung C. sakazakii. Nazarowec-White dan Farber (1997) meneliti susu formula bubuk yang diproduksi oleh lima perusahaan (48 kaleng per perusahaan) dan terdeteksi patogen pada populasi rata-rata 0.36 g CFU/100 di delapan kaleng. Bakteri ini dapat masuk melalui formula bahan yang terkontaminasi setelah proses drying komponen susu atau kedelai, dapat juga kontaminasi silang dari lingkungan sebelum pengemasan, atau selama kondisi saat preparasi. Kandhai et al. (2004) meneliti keberadaan C. sakazakii di pabrik-pabrik yang memproduksi susu bubuk, sereal, coklat, tepung kentang, dan pasta, serta di lingkungan rumah tangga, hasilnya tingkat kontaminasi 23-44 persen pada 147 sampel. Kontaminasi susu formula bayi menjadi umum terjadi karena faktor eksternal dan intrinsik. Berdasarkan distribusi usia kasus yang dilaporkan, ditemukan bahwa bayi di bawah usia satu tahun berada pada risiko tertentu terhadap patogen ini, meskipun C. sakazakii dapat menyebabkan penyakit pada semua kelompok umur (FAO dan WHO, 2004).
Gambar 2Cronobacter spp (Kunkel, 2009)
Sebagian besar wabah C. sakazakii yang terjadi dilaporkan berasal dari susu formula yang terkontaminasi karena susu formula tidak dirancang sebagai produk dengan hasil akhir steril. Heuvelink et al. (2001) menggunakan uji deteksi bakteri dalam 25 g susu bubuk, berhasil mendeteksi C. sakazakii pada 1 dari 40 susu bubuk formula untuk bayi dan 7 dari 170 susu bubuk. Beberapa penelitian lain, seperti Estuningsih et al. (2006) menjelaskan bahwa dari 74 sampel makanan bayi di Indonesia dan Malaysia, ditemukan 35 sampel (47 persen) positif
8
formula bayi dan Dewanti-Hariyadi et al. (2011) juga telah berhasil mengisolasi beberapa isolat yang diduga sebagai kelompok C. sakazakii, berdasarkan hasil identifikasi dan kemiripan isolat, dimana hasil penelitiannya menunjukkan bahwa terdapat 6 isolat yang diisolasi dari produk bayi, maizena dan bubuk coklat. Selain itu, C. sakazakii juga telah berhasil diisolasi dari sumber pangan jenis bumbu bubuk komersial dan produk bubuk lainnya (Hamdani, 2012).
Biofilm C. sakazakii
Pangan atau dan bahan pangan akan dapat terkontaminasi oleh C.sakazakii
dalam kondisi yang tidak cukup higienis. Friedemann (2007) melaporkan bahwa makanan dapat tercemar oleh C. sakazakii baik ketika masih dalam keadaaan mentah maupun setelah mengalami proses pengolahan. Pangan olahan yang dapat terkontaminasi bakteri ini cukup beragam, antara lain makanan kering, makanan segar, beku, siap saji, fermentasi, makanan matang, minuman dan air untuk mengolah makanan juga dapat terkontaminasi C. sakazakii (Shaker et al. 2007). Infeksi yang terkait dengan C. sakazakii dilaporkan melalui jalur transmisi susu formula bubuk (Drudy et al. 2006). Area drying dan filling pabrik makanan berpotensi sebagai sumber kontaminasi dan bakteri patogen dapat masuk ke dalam produk susu bubuk dari lingkungan dan saat penambahan atau pencampuran dengan bahan lain (Gurtler et al. 2005). Menurut Iversen dan Forsythe (2003) kapsul yang diproduksi oleh C. sakazakii dapat meningkatkan kemampuan untuk membentuk biofilm dalam permukaan peralatan.
Pada beberapa dekade ini, perhatian terhadap biofilm pada industri pangan semakin meningkat. Beberapa bakteri yang dapat membentuk biofilm dan sumber kontaminasi bahan pangan adalah Listeria monocytogenes, Pseudomonas fragi,
Bacillus subtilis dan Enterococcus hirae, Escherichia coli dan Salmonella sp. Iversen et al. (2004) mempelajari pembentukan biofilm C. sakazakii, bakteri ini memiliki kemampuan menempel pada silikon, lateks dan polikarbonat dan dalam jumlah besar pada stainless steel, sehingga direkomendasikan botol dan peralatan untuk menyiapkan susu formula bayi harus dibersihkan sesering mungkin untuk meminimalkan biofilm sebagai sumber infeksi. Jung (2013) melaporkan bahwa pembentukan biofilm oleh C. sakazakii dipengaruhi oleh berbagai kondisi seperti komposisi nutrisi pada media dan kelembaban relatif lingkungan. Telah dilaporkan juga bahwa C. sakazakii memiliki ketahanan terhadap proses pengeringan dengan rentang suhu 25oC hingga 45 oC, hal ini diduga adanya pembentukan biofilm yang dilakukan oleh C. sakazakii (Breeuwer et al. 2003).
Mutan C. sakazakii Hasil Transformasi dengan Plasmid GFPuv
9 parsial gen penyandi GFPuv di dalam total genom sel C. sakazakii mutan GFPuv sehingga diperoleh bakteri C. sakazakii berfluoresen yang dapat digunakan sebagai inokulum dalam suatu penelitian (Nurjanah et al. 2014).
Suatu plasmid yang disisipkan tidak selalu stabil di dalam sel inangnya, ketidakstabilan plasmid tersebut terjadi karena proses segregasi pada saat pembelahan sel lebih cepat dibandingkan dengan proses propagasi plasmid sehingga plasmid tidak terdapat pada sel yang baru. (Ma et al. 2011). Pada penyimpanan beku, subkultur 1 dan subkultur 2 C. sakazakii mutan GFPuv tidak mengalami gangguan petumbuhan dan isolat toksik FWHd16 tahan terhadap perlakuan pengeringan pada pengolahan jagung (Nurjanah et al. 2014).
Plasmid GFPuv ditunjukkan oleh Gambar 3, merupakan plasmid berukuran 3.3 kb mengandung gen yang menyandikan Green Fluorescents Protein dari ubur-ubur (Aequorea victoria) yang telah dioptimalkan untuk intensitas fluoresensi yang lebih tinggi ketika tereksitasi oleh sinar ulraviolet. Sekuens penyandi gen ini berada pada daerah Multiple Cloning Site (5’MCS -3’MCS) dengan kodon inisiasi lacZ sehingga protein gabungan β -galactosidase-GPFuv diekspresikan dari lac-promoter secara konstitutif. Plasmid ini juga mempunyai titik ori, sehingga dapat melakukan replikasi secara mandiri. Selain itu, mengandung gen resisten ampisilin (Amp) yang menyandikan protein β -lactamase yang dapat mendegradasi antibiotik ampisilin sehingga memiliki sifat resisten terhadap ampisilin (Clontech, 2013).
Gambar 3 Plasmid GFPuv (Clontech, 2013)
Kompetisi Bakteri dalam Penempelan dan Pembentukan Biofilm
10
Penelitian tentang kompetisi bakteri dalam melakukan penempelan juga cukup banyak dilaporkan, keberadaan Enterococcus faecium juga dapat menghambat penempelan E. coli K88 enterotoksigenik pada mukosa usus kecil (Jin et al. 2000). Penelitian mengenai D-Asam amino yang diproduksi oleh banyak bakteri pada tahap akhir pertumbuhan, termasuk fase stasioner dan pada saat membentuk biofilm menunjukkan kemampuan untuk memecah dan menghambat pembentukan biofilm suatu bakteri (Lam et al. 2009). Penelitian mengenai pengaruh D-asam amino menyebutkan bahwa keberadaan D-asam amino dapat menghambat pembentukan biofilm S. aureus dan biofilm P. aeruginosa (Kolodkin-Gal et al. 2010). Produksi D-asam amino oleh suatu bakteri pada lingkungan multispesies akan dapat mengganggu bakteri tetangganya dalam proses maturasi biofilm kompleks. Mekanisme berbeda dilaporkan D-asam amino dapat menghambat akumulasi protein matriks biofilm S. aureus dan pembentukan suatu biofilm mikrokoloni (Hochbaum et al. 2011).
Bakteri Asam Laktat
Bakteri asam laktat (BAL) merupakan bakteri Gram positif, katalase negatif, berbentuk kokus atau batang, tidak membentuk spora, tidak mempunyai sitokrom, aerotoleran, anaerobik hingga mikroaerofilik, membutuhkan nutrisi yang kompleks (Surono, 2004). Sifat terpenting dari BAL adalah kemampuannya memfermentasi gula menjadi asam laktat. BAL dapat memproduksi asam laktat dan metabolit lain yang bersifat antibakteri sehingga pertumbuhan mikroorganisme lain dapat dihambat (Savadogo et al. 2006). BAL dan Bifidobacteria termasuk dalam kelompok bakteri baik bagi manusia dan umumnya memenuhi status GRAS (Generally Recognized as Safe), yaitu aman bagi manusia. BAL diklasifikasikan berdasarkan morfologi, cara fermentasi glukosa, suhu pertumbuhan yang berbeda, bentuk produk asam laktat yang dihasilkan, kemampuan untuk tumbuh pada konsentrasi garam yang tinggi, serta ketahanannya terhadap asam atau alkali yang berbeda-beda (Surono, 2004).
Pada mulanya BAL terdiri dari empat genus, yaitu Lactobacillus,
Leuconostoc, Pediococcus, dan Streptococcus. Namun, klasifikasi terbaru menggolongkan BAL ke dalam 12 genus, yaitu Aerococcus, Carnobacterium,
Enterococcus, Lactobacillus, Lactococcus, Leuconostoc, Oenococcus,
Pediococcus, Streptococcus, Tetragenococcus, Vagococcus, dan Weissela (Ray dan Bhunia, 2008). Secara fisiologis dan berdasarkan aktivitas metabolismenya, BAL dikelompokkan ke dalam dua sub grup, yaitu homofermentatif dan heterofermentatif. BAL homofermentatif melibatkan jalur Embden Meyerhof, yaitu glikolisis untuk menghasilkan asam laktat, 2 mol ATP dari 1 molekul glukosa/heksosa dalam kondisi normal dengan tidak menghasilkan CO2 dan
menghasilkan biomassa sel dua kali lebih banyak dibanding BAL heterofermentatif. Pada BAL heterofermentatif metabolisme melalui jalur 6-fosfoglukonat/fosfoketolase selain menghasilkan asam laktat juga menghasilkan etanol, CO2, asam asetat, senyawa cita rasa, mannitol, serta 1 mol ATP dari
11 dimanfaatkan dalam industri susu untuk menghasilkan keju dan senyawa flavor, senyawa cita rasa maupun pengental, yaitu eksopolisakarida (Surono, 2004).
BAL memiliki kemampuan untuk melakukan penempelan terutama pada mukosa usus. Hal ini menunjukkan bahwa BAL pun memiliki potensi untuk membentuk biofilm yang sifat penempelannya dipengaruhi oleh asal isolat selain faktor umum lainnya. Menurut Salminen et al. (1992) Lactobacillus GG, yang merupakan isolat klinis, dapat mengkolonisasi saluran usus manusia dan menempel lebih kuat jika dibandingkan dengan Lactobacillus maupun
Streptococcus yang digunakan sebagai kultur starter dalam industri susu. Tannock (1990) melaporkan bahwa Lactobacillus dapat menempel pada dinding usus melalui zat ekstraseluler yang mengandung polisakarida, protein, lipid dan asam lipoteikoat. Bakteri asam laktat dapat menghambat adhesi patogen dan kolonisasi melalui kompetisi dalam memperebutkan nutrisi dan sumber daya yang terbatas (Collado et al.2007).
Lactobacillus rhamnosus merupakan bakteri asam laktat Gram positif, anaerobik fakultatif, tidak motil, tidak berspora dan berbentuk batang. L. rhamnosus pada awalnya diklasifikasikan sebagai Lactobacillus acidophilus, kemudian Lactobacillus casei yang pada akhirnya diklasifikasikan sendiri sebagai
Lactobacillus rhamnosus. L. rhamnosus yang diisolasi dari ASI ibu menyusui di Bogor memiliki potensi sebagai bakteri probiotik (Nuraida et al. 2012). Penelitian sebelumnya menyatakan bahwa L. rhamnosus R23 merupakan kandidat probiotik dengan sifatnya yang tahan terhadap pH lambung dan garam empedu serta memiliki sifat antimikroba (Hartanti, 2007). L. rhamnosus R23 mampu mencegah diare yang disebabkan infeksi Enteropathogenic E. coli (EPEC) dibandingkan dengan L. rhamnosus lainnya yang diisolasi dari ASI (Nuraida et al. 2012). L. rhamnosus R23 memiliki kemampuan dalam menurunkan jumlah Escherichia coli
pada feses dan sebagai antidiare berdasarkan uji in vivo (Hartanti, 2010).
Staphylococcus aureus
Staphylococcus aureus adalah bakteri non motil, Gram positif, berbentuk bulat, bersifat fakultatif anaerob, dan tidak membentuk spora, ukuran bakteri ini sangat kecil dengan diameter 0.5-1.5 μm (Eley, 1992). S. aureus dapat tumbuh dalam kondisi aerob dan anaerob. Secara umum suhu pertumbuhan S. aureus
berkisar antara 7-48 °C, dengan suhu optimum untuk pertumbuhan 35-37 °C. Kisaran pH untuk pertumbuhan bakteri ini antara 4-9.8 dengan pH optimum antara 6.0-7.0 (Adams dan Moss, 2008). Gambar 4 menunjukkan visualisasi S. aureus di bawah mikroskop elektron dengan perbesaran 5000x.
Kontaminasi S. aureus menjadi salah satu penyebab utama foodborne disease karena S. aureus dapat mengontaminasi produk makanan selama persiapan dan pengolahan (Le Loir et al. 2003). S. aureus hidup di kulit dan membran mukosa dari hewan berdarah panas, termasuk manusia. Sekitar 25-50 persen dari populasi manusia kemungkinan membawa S. aureus (Eley, 1992). Membran hidung merupakan habitat S. aureus yang sangat baik karena hangat dan basah. Diperkirakan 10-40 persen dari manusia dewasa ditemukan S. aureus
12
aureus (Le Loir et al. 2003). Staphylococcus aureus merupakan bakteri yang terlibat dalam infeksi nosokomial dan merupakan salah satu patogen yang sering diketahui dapat menginfeksi tubuh manusia, bentuk klinisnya tergantung dari bagian tubuh yang mengalami infeksi. Infeksi yang disebabkan oleh S. aureus dan paling sering menyebabkan kematian adalah septisemia, endokarditis, ensefalitis, dan toxic shock syndrome. S. aureus menghasilkan enterotoksin yang menyebabkan gastroenteritis. Jumlah sel yang diperlukan oleh S. aureus untuk menghasilkan toksin yang cukup sehingga bersifat meracuni adalah 106 CFU/g (Jay, 2000). Menurut Ray dan Bhunia (2008) keracunan S. aureus disebabkan karena terkonsumsinya toksin dalam jumlah 100-200 ng yang dihasilkan oleh 106 -107 CFU/ml atau CFU/g dalam 30 g makanan.
Gambar 4Staphylococcus aureus (Todar, 2007)
Staphylococcus aureus juga diketahui dapat hidup pada perlatan medis dan dapat membentuk biofilm pada permukaan suatu peralatan (Fowler et al. 2001). Beberapa strain S. aureus dapat membentuk koloni pada peralatan dan lingkungan tempat pengolahan makanan (Blackburn dan Mc Clure, 2002). S. aureus dapat menghasilkan biofilm multilayer yang berbentuk lapisan lendir dengan adanya ekspresi protein heterogen di seluruh lapisan tersebut. Studi awal menyebutkan terdapat lapisan glycocalyx yang terdiri dari asam teichoic (80 persen) pada protein yang dihasilkan oleh sel staphylococcal. Studi selanjutnya, polisakarida spesifik yang berperan dalam biofilm S. aureus berhasil diisolasi dan dikenal dengan PIA (polysaccharide intercellular adhesin) (Archer et al. 2011). Penempelan awal oleh S. aureus dengan PIA pada material peralatan kemudian diikuti oleh akumulasi bakteri dan pembentukan biofilm matang (Gotz, 2002). Pada penelitian Zmantar et al. (2010) menemukan 26 dari 46 (56.5 persen) strain
S. aureus menghasilkan biofilm dalam bentuk lapisan lendir, Gundogan et al. (2006) juga berhasil menganalisis pembentukan biofilm 58 dari 110 strain S. aureus menghasilkan lapisan lendir yang diisolasi selama 24-48 jam. S. aureus
dilaporkan dapat menempel pada permukaan stainless steel.
13 3 METODOLOGI PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Januari hingga Juni 2014 di Laboratorium Mikrobiologi Pangan Southeast Asian Food and Agricultural Science and Technology (SEAFAST) Center, Laboratorium Mikrobiologi Pangan Departemen Ilmu dan Teknologi Pangan, Ruang Persiapan dan Preparasi Departemen Ilmu dan Teknologi Pangan, Institut Pertanian Bogor.
Bahan
Bahan yang digunakan dalam penelitian ini adalah C. sakazakii mutan GFPuv galur FWHd16 dan YRt2a, C. sakazakii wild-type galur FWHd16 dan YRt2a, L. rhamnosus galur R23 dan S. aureus galur SA25923. Galur tersebut diisolasi dari sumber pangan dan dimutasi dalam penelitian sebelumnya (Tabel 1). Media dan bahan kimia yang digunakan, yakni Brain Heart Infusion (BHI),
Druggan Forsythe Iversen (DFI), Tryptic Soy Agar (TSA), Tryptic Soy Broth
(TSB), de Man Ragosa Sharpe Agar (MRSA), de Man Ragosa Sharpe Broth
(MRSB), membran filter 0.22 μm, larutan GF, N-heksametafosfat, Akuades, Ampisilin, Spiritus. Permukaan kontak pangan yang digunakan sebagai media penempelan bakteri adalah stainless steel (SS), karet gasket jenis buna-N dan Polytetrafluoroethylene (PTFE) yang lazim digunakan di industri pengolahan pangan. Pelat permukaan kontak pangan yang digunakan seluruhnya berukuran 1.0 x 1.0 cm.
Tabel 1. Keterangan Isolat Bakteri
No Kode Isolat Sumber Aktivitas
Sitotoksik
14
ml beserta tips jarum oose, pinset, bunsen, spatula, alumunium foil, termometer, plastik steril, swab dan alat-alat gelas seperti cawan petri, tabung reaksi, pipet volume 5 dan 10 ml, botol durham 250 ml, erlenmeyer 500 ml wadah gelas bertutup dan refrigerator dan ruang aseptik. Sterilisasi alat-alat gelas dilakukan pada oven pengering (140oC, 8 jam) sedangkan untuk bahan-bahan lainnya disterilisasi di dalam autoklaf (121oC, 1 atm) selama 15 menit.
Metode Penelitian
Penelitian ini dibagi menjadi dua tahap, yaitu tahap persiapan yang meliputi persiapan kultur bakteri C. sakazakii mutan FWHd16 dan YRt2a, C. sakazakii wild-type FWHd16 dan YRt2a, S. aureus dan L. rhamnosus R23 SA25923 dan persiapan pelat permukaan kontak pangan yang terdiri dari SS, Buna-N dan PTFE di dalam media pertumbuhan TSB dan MRSB. Tahap penelitian yang meliputi : (1) Pembentukan biofilm C. sakazakii mutan GFPuv dan wild-type galur FWHd16 dan YRt2a pada pelat SS, Buna-N dan PTFE yang diinkubasi pada tiga waktu yang berbeda, yakni 24, 48 dan 72 jam. (2) Pembentukan biofilm menggunakan tiga bakteri, yakni C. sakazakii mutan GFPuv FWHd16 dan YRt2a, S. aureus SA25923 dan L. rhamnosus R23 pada pelat stainless steel yang ditumbuhkan pada media yang sama dan diinkubasi pada tiga waktu berbeda, yakni 24, 48 dan 72 jam. Skema diagram alir proses penelitian ditunjukkan oleh Gambar 5.
Tahapan Persiapan
Persiapan Kultur Mutan C. sakazakii FWHd16 dan YRt2a
15
Gambar 5 Diagram alir proses penelitian
Kultur mutan C. sakazakii
16
Persiapan Kultur Wild-typeC. sakazakii, S. aureus dan L. rhamnosus
Isolat wild-typeC. sakazakii FWHd16 dan YRt2a stok dalam bentuk beku disegarkan dalam media 10 ml BHI kemudian diinkubasi pada suhu 37oC selama 24 jam. Setelah disegarkan, kultur kemudian dikonfirmasi dengan digores pada media agar DFI dan diinkubasi pada suhu 37oC selama 24 jam. Koloni hijau yang tumbuh pada agar DFI kemudian ditumbuhkan pada media 10 ml TSB dan diinkubasi pada suhu 37oC selama 24 jam selanjutnya digores pada media TSA miring dan diinkubasi pada suhu 37oC selama 24 jam kemudian dapat disimpan sebagai stok kultur. Kultur C. sakazakii yang disimpan pada TSA miring dapat disegarkan kembali dengan menginokulasikan satu ose koloni secara aseptik ke dalam 10 ml TSB dan diinkubasi pada suhu 37ºC selama 16-17 jam sehingga didapatkan kultur dengan populasi sel sekitar 108-109 CFU/ml (modifikasi Nurjanah et al. 2014)
Isolat S. aureus SA25923 stok dalam bentuk ampul disegarkan dalam media 10 ml TSB kemudian diinkubasi pada suhu 37oC selama 24 jam. Setelah disegarkan, kultur digores pada media TSA miring dan diinkubasi pada suhu 37oC selama 24 jam kemudian disimpan sebagai stok kultur. Kultur S. aureus SA25923 yang disimpan pada TSA miring dapat disegarkan kembali dengan menginokulasikan satu ose koloni secara aseptik ke dalam 10 ml TSB dan diinkubasi pada suhu 37ºC selama 16-17 jam sehingga didapatkan kultur dengan populasi sel sekitar 108-109 CFU/ml (modifikasi Dewanti-Hariyadi dan Cynthia, 2014)
Isolat L. rhamnosus R23 stok dalam bentuk ampul disegarkan dalam media MRSB kemudian diinkubasi pada suhu 37oC selama 24 jam. Kultur yang tumbuh kemudian ditumbuhkan pada media MRS semi solid miring menggunakan metode tusuk dan diinkubasi pada suhu 37oC selama 24 jam, hasilnya dapat disimpan sebagai stok kultur. Kultur L. rhamnosus R23 yang disimpan pada MRS semi solid disegarkan kembali dengan menginokulasikan satu ose koloni secara aseptik ke dalam 10 ml MRSB dan diinkubasi pada suhu 37ºC selama 16-17 jam sehingga didapatkan kultur dengan populasi sel sekitar 108-109 CFU/ml (modifikasi Nurdin, 2013)
Setiap kultur bakteri yang digunakan pada pembentukan biofilm dilakukan pengenceran terlebih dahulu sehingga diperoleh jumlah bakteri yang diperlukan dalam pembentukan biofilm.
Persiapan Permukaan Kontak Pangan
17 Tahap Penelitian
Pembentukan Biofilm C. sakazakii Mutan dan wild-type FWHd16 dan YRt2a pada Permukaan Kontak Pangan
Pembentukan sel biofilm pada pelat permukaan kontak pangan, yakni pelat SS, Buna-N dan PTFE dilakukan pada media 1/5 TSB. Biofilm dibuat dengan cara memindahkan 2 ml kultur (mengandung mikroba 107 CFU/ml) ke dalam erlenmeyer 500 mL yang berisi 200 ml media pertumbuhan sehingga jumlah awal bakteri 105 CFU/ml di dalam media dengan 1 jenis pelat permukaan kontak pangan, kemudian diinkubasi pada suhu kamar (28-30oC) dengan agitasi 70 rpm selama 24, 48 dan 72 jam. Pengamatan pembentukan biofilm dilakukan menggunakan mikroskop epifluoresen. Densitas biofilm dinyatakan sebagai bakteri/cm2 atau
dianalisis dengan metode DMC pada masing-masing permukaan kontak pangan.
Pembentukan Biofilm Multispesies pada Permukaan Kontak Pangan
Biofilm multispesies dibentuk dengan menumbuhkan dua atau tiga jenis bakteri yang berbeda spesies dengan jumlah yang sama pada satu jenis media pertumbuhan dengan penambahan permukaan kontak pangan jenis pelat SS. Pembentukan biofilm multispesies yang dipelajari adalah sebagai berikut :
1. Kultur C. sakazakii mutan GFPuv dan S. aureus yang telah disegarkan dipindahkan masing-masing sebanyak 105 CFU/ml ke dalam erlenmeyer 500 mL yang berisi 200 ml media pertumbuhan 1/5 TSB dan pelat SS sehingga diperoleh jumlah awal bakteri masing-masing 103 CFU/ml di dalam media. 2. Kultur C. sakazakii mutan GFPuv dan L. rhamnosus yang telah disegarkan
dipindahkan masing-masing sebanyak 105 CFU/ml ke dalam erlenmeyer 500 mL yang berisi 200 ml media pertumbuhan 1/5 MRSB dan pelat SS sehingga diperoleh jumlah awal bakteri masing-masing 103 CFU/ml di dalam media. 3. Kultur C. sakazakii mutan GFPuv, S. aureus dan L. rhamnosus yang telah
disegarkan dipindahkan masing-masing sebanyak 105 CFU/ml ke dalam erlenmeyer 500 mL yang berisi 200 ml media pertumbuhan 1/5 MRSB dan pelat SS sehingga diperoleh jumlah awal bakteri masing-masing 103 CFU/ml di dalam media.
Ketiga jenis biofilm multispesies ini kemudian diinkubasi pada suhu kamar (28-30oC) dengan agitasi 70 rpm selama 24, 48 dan 72 jam. Pengamatan dilakukan menggunakan mikroskop epifluoresen untuk melihat pembentukan biofilm multispesies yang terjadi selama masa inkubasi.
Metode Analisis
18
perhitungan mikroskopis langsung (Direct Microscopic Count) menggunakan mikroskop epifluoresen berdasarkan Parizzi et al. 2004. Pada analisis densitas biofilm C. sakazakii mutan GFPuv FWHd16 dan YRt2a, permukaan kontak pangan dibilas terlebih dahulu dengan GF steril kemudian dilakukan perhitungan DMC sedangkan untuk jenis wild-type FWHd16 dan YRt2a, setelah permukaan kontak pangan dibilas dengan GF steril kemudian pelat direndam dalam acridine orange 0.0026 persen (Dewanti dan Wong, 1995) selama 5 menit dan dibilas kembali dengan GF steril baru kemudian dilakukan DMC untuk menghitung densitas biofilm. Hasil perhitungan yang diperoleh dinyatakan dalam bentuk Log CFU/cm2.
Enumerasi densitas biofilm C. sakazakii mutan GFPuv FWHd16 dan YRt2a juga dilakukan menggunakan metode pemupukan tuang berdasarkan Yunus (2000). Biofilm yang terbentuk pada permukaan kontak pangan selama waktu inkubasi 24, 48, dan 72 jam diswab kemudian dipindahkan ke dalam tabung reaksi yang berisi 9 ml larutan GF steril dan 1 ml larutan Na-heksametafosfat lalu divortex. Larutan kemudian diencerkan dan ditumbuhkan dengan menggunakan metode tuang (pour plate) dalam cawan petri steril berisi media TSAA kemudian diinkubasi pada inkubator 37oC selama 24 jam. Jumlah koloni yang tumbuh dan berpendar hijau saat di bawah sinar UV pada cawan dihitung berdasarkan
Standard Plate Count (BAM, 2001). Densitas biofilm pada masing-masing permukaan kontak pangan dinyatakan dalam Log CFU/cm2.
Pada analisis densitas biofilm multispesies, pelat SS dibilas dengan GF steril kemudian dihitung populasi bakteri C. sakazakii mutan GFPuv yang menempel pada pelat SS di bawah mikroskop epifluoresen (a). Setelah itu, pelat direndam dalam acridine orange 0.0026 persen (Dewanti dan Wong, 1995) selama 5 menit dan dibilas kembali dengan GF steril, kemudian dihitung kembali total populasi bakteri yang terdapat pada pelat SS (b). Selisih hasil dari perhitungan total populasi bakteri dengan jumlah populasi bakteri C. sakazakii mutan GFPuv (b-a) merupakan jumlah bakteri S.aureus SA25923 atau L. rhamnosus R23 yang membentuk biofilm saat ditumbuhkan bersama dengan C. sakazakii mutan GFPuv pada media yang sama.
Analisis Statistik
Semua eksperimen diulang dua kali dan duplo. Data diolah dengan ANOVA menggunakan SPSS untuk analisis sidik ragam dan uji Duncan untuk menentukan perbedaan yang signifikan antara nilai rata-rata dari kelompok perlakuan.
4 HASIL DAN PEMBAHASAN
Pembentukan Biofilm oleh C. sakazakii Mutan GFPuv dan Wild-type pada Permukaan Kontak Pangan
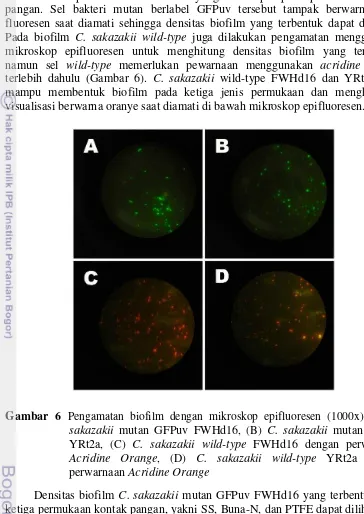
19 dengan mikroskop epifluoresen terhadap C. sakazakii mutan GFPuv selama waktu inkubasi memperlihatkan sel bakteri yang menempel pada permukaan kontak pangan. Sel bakteri mutan berlabel GFPuv tersebut tampak berwarna hijau fluoresen saat diamati sehingga densitas biofilm yang terbentuk dapat dihitung. Pada biofilm C. sakazakii wild-type juga dilakukan pengamatan menggunakan mikroskop epifluoresen untuk menghitung densitas biofilm yang terbentuk, namun sel wild-type memerlukan pewarnaan menggunakan acridine orange
terlebih dahulu (Gambar 6). C. sakazakii wild-type FWHd16 dan YRt2a juga mampu membentuk biofilm pada ketiga jenis permukaan dan menghasilkan visualisasi berwarna oranye saat diamati di bawah mikroskop epifluoresen.
Gambar 6 Pengamatan biofilm dengan mikroskop epifluoresen (1000x) (A) C. sakazakii mutan GFPuv FWHd16, (B) C. sakazakii mutan GFPuv YRt2a, (C) C. sakazakii wild-type FWHd16 dengan perwarnaan
Acridine Orange, (D) C. sakazakii wild-type YRt2a dengan perwarnaan Acridine Orange
20
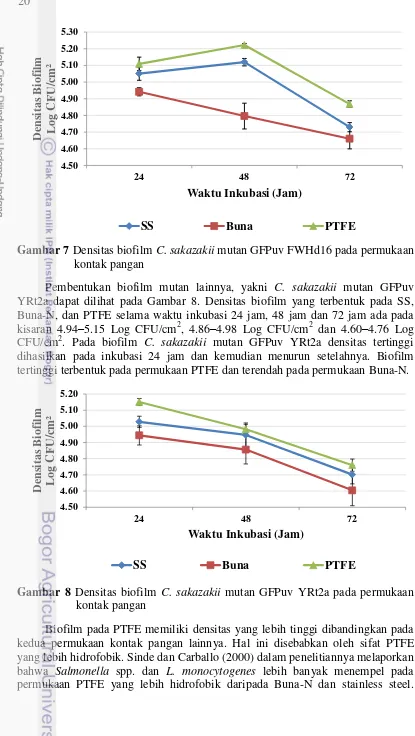
Gambar 7 Densitas biofilm C. sakazakii mutan GFPuvFWHd16 pada permukaan kontak pangan
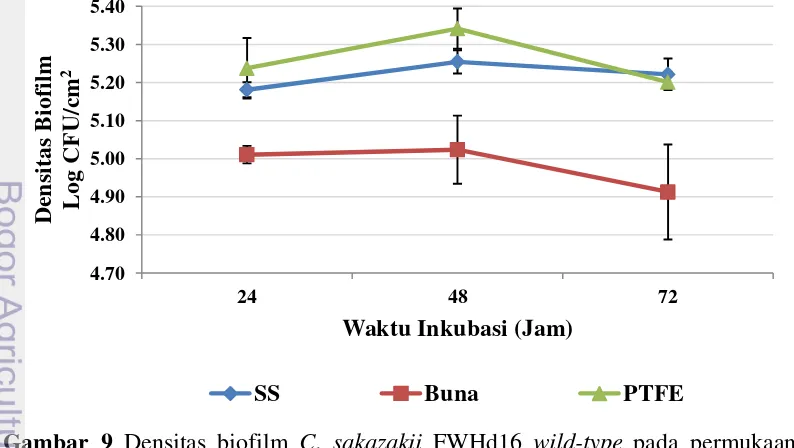
Pembentukan biofilm mutan lainnya, yakni C. sakazakii mutan GFPuv YRt2a dapat dilihat pada Gambar 8. Densitas biofilm yang terbentuk pada SS, Buna-N, dan PTFE selama waktu inkubasi 24 jam, 48 jam dan 72 jam ada pada kisaran 4.94–5.15 Log CFU/cm2, 4.86–4.98 Log CFU/cm2 dan 4.60–4.76 Log CFU/cm2. Pada biofilm C. sakazakii mutan GFPuv YRt2a densitas tertinggi dihasilkan pada inkubasi 24 jam dan kemudian menurun setelahnya. Biofilm tertinggi terbentuk pada permukaan PTFE dan terendah pada permukaan Buna-N.
Gambar 8 Densitas biofilm C. sakazakii mutan GFPuv YRt2a pada permukaan kontak pangan
Biofilm pada PTFE memiliki densitas yang lebih tinggi dibandingkan pada kedua permukaan kontak pangan lainnya. Hal ini disebabkan oleh sifat PTFE yang lebih hidrofobik. Sinde dan Carballo (2000) dalam penelitiannya melaporkan bahwa Salmonella spp. dan L. monocytogenes lebih banyak menempel pada permukaan PTFE yang lebih hidrofobik daripada Buna-N dan stainless steel.
21 Beberapa penelitian menyebutkan bahwa bakteri cenderung lebih mudah menempel pada permukaan hidrofobik, interaksi hidrofobik bakteri terhadap permukaan padat saat tumbuh pada media dengan keterbatasan nutrisi akan meningkat karena terjadinya perubahan morfologi ukuran sel bakteri menjadi lebih kecil yanng diikuti dengan peningkatan hidrofobisitas dan agregasi sel bakteri sehingga mempermudah proses transfer dan penempelan bakteri pada permukaan (Dewanti dan Wong, 1995). Interaksi hidrofobik antara bakteri dengan substrat pada permukaan kontak pangan menyebabkan sel menempel dan tidak dapat balik sehingga bertahan pada permukaan tersebut (Donlan, 2002). Biofilm C. sakazakii mutan GFPuv, baik dari galur FWHd16 atau YRt2a memiliki densitas tertinggi pada permukaan PTFE dan terendah pada Buna-N. Rendahnya densitas biofilm pada Buna-N diduga disebabkan adanya komponen dalam Buna-N yang dapat menghambat pertumbuhan organisme sehingga mempengaruhi pembentukan biofilm pada permukaan (Wong, 1998). Senyawa nitril telah terbukti dapat menghambat pertumbuhan beberapa Mycobacteria (Sanna et al.
2000). Salah satu jenis senyawa nitril, yakni acrylonitril adalah prekursor yang digunakan dalam karet sintesis dan merupakan komponen dalam buna-N yang bersifat toksin (Reyes et al. 2000) disinyalir dapat menghambat pertumbuhan mikroorganisme. Reyes et al. (2000) menunjukkan bahwa keberadaan acrylonitril pada media pertumbuhan bakteri dapat menyebabkan terjadinya autolisis bakteri B. subtilis.
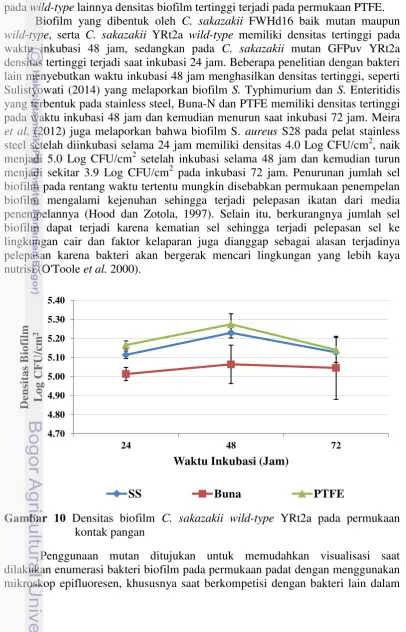
C. sakazakii wild type FWHd16 juga membentuk biofilm pada semua jenis permukaan kontak pangan (Gambar 9). Densitas biofilm C. sakazakii wild-type
22
Densitas biofilm C. sakazakii wild-type YRt2a pada ketiga permukaan kontak pangan pada inkubasi 24 jam berkisar antara 5.01–5.17 Log CFU/cm2. Ketika waktu inkubasi 48 jam nilainya naik menjadi 5.06–5.27 Log CFU/cm2, kemudian pada waktu inkubasi 72 jam nilai densitasnya turun menjadi berkisar antara 5.05–5.14 CFU/cm2 seperti ditunjukkan oleh Gambar 10. Seperti halnya pada wild-type lainnya densitas biofilm tertinggi terjadi pada permukaan PTFE.
Biofilm yang dibentuk oleh C. sakazakii FWHd16 baik mutan maupun
wild-type, serta C. sakazakii YRt2a wild-type memiliki densitas tertinggi pada waktu inkubasi 48 jam, sedangkan pada C. sakazakii mutan GFPuv YRt2a densitas tertinggi terjadi saat inkubasi 24 jam. Beberapa penelitian dengan bakteri lain menyebutkan waktu inkubasi 48 jam menghasilkan densitas tertinggi, seperti Sulistyowati (2014) yang melaporkan biofilm S. Typhimurium dan S. Enteritidis yang terbentuk pada stainless steel, Buna-N dan PTFE memiliki densitas tertinggi pada waktu inkubasi 48 jam dan kemudian menurun saat inkubasi 72 jam. Meira
et al. (2012) juga melaporkan bahwa biofilm S. aureus S28 pada pelat stainless steel setelah diinkubasi selama 24 jam memiliki densitas 4.0 Log CFU/cm2, naik menjadi 5.0 Log CFU/cm2 setelah inkubasi selama 48 jam dan kemudian turun menjadi sekitar 3.9 Log CFU/cm2 pada inkubasi 72 jam. Penurunan jumlah sel biofilm pada rentang waktu tertentu mungkin disebabkan permukaan penempelan biofilm mengalami kejenuhan sehingga terjadi pelepasan ikatan dari media penempelannya (Hood dan Zotola, 1997). Selain itu, berkurangnya jumlah sel biofilm dapat terjadi karena kematian sel sehingga terjadi pelepasan sel ke lingkungan cair dan faktor kelaparan juga dianggap sebagai alasan terjadinya pelepasan karena bakteri akan bergerak mencari lingkungan yang lebih kaya nutrisi (O'Toole et al. 2000).
Gambar 10 Densitas biofilm C. sakazakii wild-type YRt2a pada permukaan kontak pangan
Penggunaan mutan ditujukan untuk memudahkan visualisasi saat dilakukan enumerasi bakteri biofilm pada permukaan padat dengan menggunakan mikroskop epifluoresen, khususnya saat berkompetisi dengan bakteri lain dalam
23 lingkungan multispesies. Namun demikian, aplikasi mutan C. sakazakii untuk pembentukan biofilm ini sangat tergantung dari kestabilan plasmid. Mutan dengan kestabilan plasmid yang tinggi menghasilkan hasil yang akurat dalam mengevaluasi pembentukan biofilm oleh mutan selama waktu inkubasi berlangsung.
Pada penelitian ini mutan yang digunakan adalah C. sakazakii GFPuv galur FWHd16 dan YRt2a yang diperoleh dari penelitian sebelumnya (Nurjanah, 2014) yang memiliki kestabilan plasmid 96% dan 95% hingga subkultur 2. Artinya hingga hari kedua ditumbuhkan sel mutan yang baru masih memiliki plasmid GFPuv di dalam selnya sehingga saat diamati dalam proses selanjutnya mutan tetap dapat menghasilkan koloni bewarna hijau fluoresen. Penelitian lain oleh Yusnita (belum dipublikasikan) juga melaporkan bahwa galur FWHc3 memiliki kestabilan plasmid hingga subkultur 5, dalam penelitiannya juga disebutkan bahwa mutan dengan kestabilan plasmid diatas 95% saat subkultur 1 memiliki kestabilan yang tinggi hingga subkultur 3 yakni di atas 90%, dengan demikian penggunaan galur FWHd16 dan YRt2a untuk pembentukan biofilm selama waktu inkubasi hingga 72 jam selama penelitian dapat dilakukan.
Hasil uji sidik ragam densitas biofilm oleh masing-masing bakteri yang terbentuk pada permukaan kontak pangan pada tiap waktu inkubasi (Lampiran 1) menunjukkan bahwa jenis permukaan kontak pangan, waktu inkubasi, dan interaksi permukaan kontak pangan dengan waktu inkubasi berpengaruh terhadap densitas biofilm (p<0.05). Hasil uji sidik ragam dan uji lanjut Duncan pada seluruh data pengamatan menunjukkan hasil yang sama bahwa densitas biofilm pada permukaan PTFE dan SS tidak berbeda secara signifikan, sedangkan densitas biofilm pada permukaan Buna-N berbeda signifikan dengan densitas biofilm yang terbentuk pada permukaan PTFE dan SS.
Uji lanjut Duncan untuk pengaruh waktu inkubasi terhadap densitas biofilm yang dibentuk oleh masing-masing bakteri menunjukkan hasil yang bervariasi. Pada biofilm C. sakazakii mutan GFPuv FWHd16, densitas biofilm yang terbentuk pada waktu inkubasi 24 jam dan 48 jam tidak berbeda nyata, sedangkan densitas biofilm pada waktu inkubasi 72 jam berbeda nyata. Biofilm C. sakazakii
mutan GFPuv YRt2a menunjukkan densitas biofilm pada ketiga waktu inkubasi, yakni 24 jam, 48 jam dan 72 jam saling berbeda nyata. Hal yang berbeda juga terjadi pada C. sakazakii GFPuv wild-type YRt2a, densitas biofilm yang terbentuk pada waktu inkubasi 24 jam dan 72 jam tidak berbeda nyata, sedangkan densitas biofilm pada waktu inkubasi 48 jam berbeda nyata dengan waktu inkubasi 24 jam dan 72 jam. Biofilm yang dibentuk oleh C. sakazakii wild-type FWHd16 memiliki densitas yang tidak berbeda nyata pada ketiga waktu inkubasi. Hasil analisis statistik pada uji lanjut Duncan dapat dilihat pada Lampiran 2.