ABSTRAK
PEMURNIAN DAN KARAKTERISASI ENZIM CGT-ase (SIKLODEKSTRIN GLUKANOTRANSFERASE)
DARI BAKTERI ISOLAT LTi-A.24 Oleh
Tyas Rosawinda Khairunnisa
Penelitian mengenai pemurnian dan karakterisasi enzim CGT-ase dari bakteri isolat LTi-A.24 telah dilakukan. Penelitian ini bertujuan untuk mempelajari tahapan pemurnian enzim CGT-ase menggunakan metode ultrafiltrasi dan untuk memperoleh karakter enzim CGT-ase murni-sebagian (partial purified). Penelitian ini diawali dengan studi pendahuluan produksi enzim CGT-ase. Penentuan pertumbuhan sel, uji aktivitas dan uji kadar protein enzim CGT-ase dilakukan menggunakan spektrofotometer UV-VIS masing-masing secara berurutan pada panjang gelombang 600 nm, 550 nm dan 600 nm. Pemurnian enzim CGT-ase dilakukan menggunakan metode ultrafiltasi. Karakterisasi enzim CGT-ase hasil pemurnian, meliputi pengamatan terhadap pengaruh pH dan suhu terhadap aktivitas enzim, penentuan konstanta kinetik, dan penentuan substrat spesifitas terhadap beberapa jenis pati. Hasil penelitian menunjukkan bahwa
medium Horikoshi’s II dengan komposisi sumber nitrogen yeast ekstract-pepton dipilih sebagai komposisi medium terbaik untuk produksi enzim CGT-ase. Pada medium ini, enzim CGT-ase diproduksi optimum pada usia kultur 36 jam. Ekstrak kasar enzim pada medium tersebut memiliki kestabilan aktivitas dengan waktu paruh (t½) 2 hari. Enzim CGT-ase hasil pemurnian dengan metode ultrafiltrasi meningkat hingga 3 kali lipat, dengan perolehan 46%. Karakter enzim CGT-ase tersebut memiliki pH optimum 5,5, suhu optimum 65°C, konsentrasi substrat 1,25% dan substrat spesifitas tertinggi pada sumber pati jagung.
DAFTAR ISI
Halaman
DAFTAR ISI ... i
DAFTAR TABEL ... iv
DAFTAR GAMBAR ... vi
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 2
Manfaat Penelitian ... 3
TINJAUAN PUSTAKA ... 4
Bakteri ... 4
Pati ... 6
Enzim ... 8
Enzim CGT-ase dan Siklodekstrin ... 11
Pemurnian Enzim CGT-ase ... 15
METODE PENELITIAN ... 17
Waktu dan Tempat Penelitian ... 17
Alat dan Bahan ... 17
ProsedurPenelitian ... 18
Persiapan Alat ... 18
Pembuatan Medium Padat Horikoshi’s II ... 19
Pembuatan Medium Cair Horikoshi’s II ... 20
Pertumbuhan bakteri Amilolitik ... 20
Pembuatan Pereaksi ... 21
Substrat untuk Uji Aktivitas Enzim CGT-ase ... 21
Pereaksi Lowry ... 21
Penentuan Pertumbuhan Sel ... 22
Produksi Enzim CGT-ase ... 22
Uji Aktivitas Ekstrak Kasar Enzim CGT-ase ... 23
Uji Kadar Protein Enzim CGT-ase ... 24
Studi Pendahuluan Produksi Enzim CGT-ase ... 24
Uji Kestabilan Aktivitas Ekstrak Kasar Enzim CGT-ase ... 25
Pemurnian enzim CGT-ase ... 25
Karakteristik Enzim ... 26
Pengaruh pH Terhadap Aktivitas CGT-ase ... 26
Pengaruh Temperatur Terhadap Aktivitas CGT-ase ... 26
Penentuan Konstanta Kinetik CGT-ase... 27
Penentuan Substrat Spesifitas CGT-ase ... 27
Diagram Alir Prosedur Penelitian ... 28
IV. HASIL DAN PEMBAHASAN ... 29
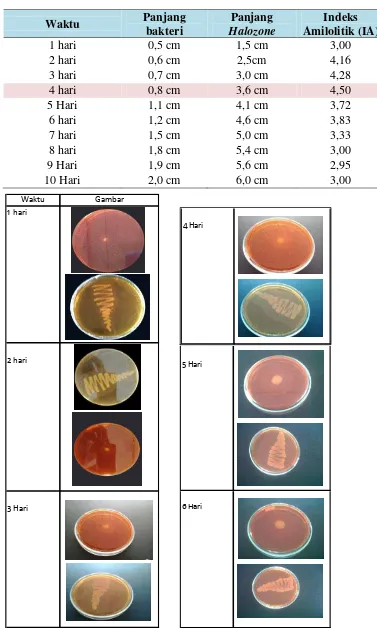
Pengukuran Indeks Amilolitik ... 29
Prinsip Pengukuran Aktivitas Enzim CGT-ase ... 31
Variasi Sumber Nitrogen ... 33
Profil Produksi Enzim CGT-ase pada Medium Horikoshi’s II dengan Sumber Nitrogen Yeast ekstract-Pepton ... 35
Profil Kestabilan Aktivitas Ekstrak Kasar Enzim CGT-ase ... 36
Pemurnian Enzim CGT-ase Isolat LTi-A.24 ... 39
Karakterisasi Enzim CGT-ase Isolat LTi-A.24 ... 41
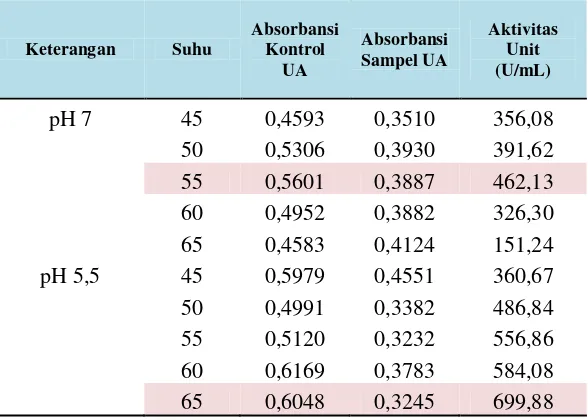
Pengaruh pH Terhadap Aktivitas CGT-ase ... 41
Pengaruh Temperatur Terhadap Aktivitas CGT-ase... 43
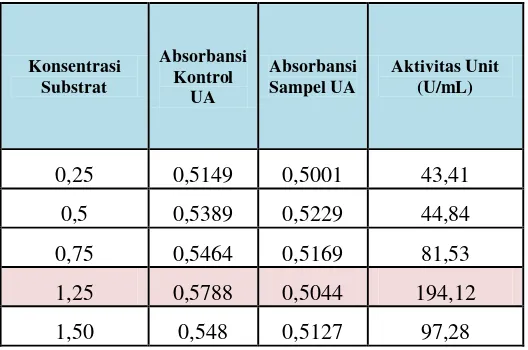
Penentuan Konstanta Kinetik Enzim CGT-ase ... 44
Penentuan KM dan Vmax Enzim CGT-ase Setelah Ultrafiltrasi ... 46
Penentuan Substrat Spesifitas Enzim CGT-ase ... 48
SIMPULAN DAN SARAN ... 50
Simpulan ... 50
Saran ... 51
DAFTAR PUSTAKA ... 52
I. PENDAHULUAN
A. Latar Belakang
Bakteri mesofilik amilolitik mampu mendegradasi pati menjadi glukosa dengan menghasilkan enzim amilase dan berpeluang menghasilkan enzim ekstraseluler lainnya seperti enzim siklodekstrin glukanotransferase (CGT-ase). Enzim CGT-ase merupakan enzim ekstraseluler yang dapat mengubah pati menjadi siklodekstrin (Tonkova, 1998).
Siklodekstrin merupakan oligosakarida berbentuk siklis yang tersusun atas
beberapa unit glukosa dengan ikatan α-1,4.Berdasarkan jumlah unit
glukosanya, siklodekstrin lebih dikenal dalam tiga bentuk yaitu -, -, dan -siklodekstrin, secara berurutan -, -, dan -siklodekstrin terdiri atas 6, 7
dan 8 unit glukosa. Struktur siklodekstrin berbentuk seperti silinder dengan permukaan luarnya bersifat hidrofilik sedangkan bagian dalam rongganya bersifat non polar. Struktur unik tersebut menjadikan siklodekstrin dapat digunakan dalam beberapa aplikasi diberbagai bidang seperti farmasi, pertanian, industri makanan dan lainnya.
Lampung Timur. Isolat LTi-A.24 diketahui memiliki aktivitas CGT-ase yang tinggi pada medium pati singkong (Sastrawiyana, 2011). Meskipun aktivitas dari isolat LTi-A.24 ini cukup tinggi berdasarkan penelitian sebelumnya, tetapi belum dilakukan tahap pemurnian dan karakterisasi enzim dari isolat tersebut. Untuk lebih mengetahui karakter enzim CGT-ase dari isolat ini, maka perlu dilakukan isolasi, pemurnian dan karakterisasi lebih lanjut. Pada penelitian ini dilakukan pemurnian enzim CGT-ase dari isolat LTi A.24 dengan menggunakan metode ultrafiltrasi.
B. Tujuan Penelitian
Tujuan dari penelitian ini adalah:
1. Mempelajari tahapan pemurnian enzim CGT-ase menggunakan metode ultrafiltrasi.
C. Manfaat Penelitian
II. TINJAUAN PUSTAKA
A. Bakteri
Bakteri merupakan mikroba uniseluler yang pada umumnya tidak
mempunyai klorofil. Bakteri tersebar luas di alam, di dalam tanah, di dalam air, pada sumber air panas, dalam tubuh hewan, manusia dan tumbuhan. Bakteri umumnya berukuran kecil dengan karakteristik dimensi 1 µm. Beberapa kelompok memiliki flagella dan dapat bergerak aktif. Bakteri memiliki berat jenis 1.05 - 1.1 g cm-3 dan berat sekitar 10-12 g. Ukuran aktual tergantung dari laju pertumbuhan, media tumbuh dan sebagainya. Ada tiga bentuk dasar bakteri, yaitu bentuk bulat atau kokus, bentuk batang silindris, bentuk lengkung atau vibri. Bentuk bakteri dipengaruhi oleh umur dan syarat pertumbuhan tertentu (Hidayat dkk., 2006).
rumen (Freer, 1993), serta hasil fermentasi ikan dan bahan makanan dari beras (Olympia et al., 1995).
Bakteri LTi-A2.4 Isolat amilolitik dipilih dan diseleksi berdasarkan kemampuan membentuk zona bening (diameter halozone 2.6 cm) pada sekitar koloni bakteri dan aktivitas enzim CGT-ase yang dihasilkan. Dari serangkaian kegiatan isolasi dan penapisan pada medium padat didapat 5 isolat, dan seleksi lebih lanjut pada medium cair diperoleh 2 isolat amilolitik potensial yaitu LTi-A2.4 dan LTi-21.3. Pada medium cair yang
mengandung berbagai jenis pati, pati singkong merupakan medium cair yang paling baik bagi isolat LTi-A2.4 untuk menghasilkan enzim CGT-ase dengan aktivitas yang cukup tinggi. Pewarnaan Gram isolat bakteri
menunjukkan bahwa isolat LTi-A2.4 merupakan bakteri Gram positif dan berbentuk basil (Sastrawiyana, 2011).
aerasi. Ketika derajat pertumbuhan bakteri telah menghasilkan populasi yang maksimum, maka akan terjadi keseimbangan antara jumlah sel yang mati dan jumlah sel yang hidup.
Fase stasioner merupakan saat laju pertumbuhan bakteri sama dengan laju kematiannya, sehingga jumlah bakteri keseluruhan akan tetap.
Keseimbangan jumlah keseluruhan bakteri ini terjadi karena adanya pengurangan derajat pembelahan sel. Hal ini disebabkan oleh kadar nutrisi yang berkurang dan terjadi akumulasi produk toksik sehingga mengganggu pembelahan sel. Fase stasioner ini dilanjutkan dengan fase kematian yang ditandai dengan peningkatan laju kematian yang melampaui laju
pertumbuhan (Volk dan Wheeler, 1993).
B. Pati
tidak larut disebut amilopektin (Winarno, 1986). Amilosa (15-20%) merupakan rantai panjang tidak bercabang yang terdiri dari molekul-molekul α-D-glukopiranosa yang bersambungan dengan ikatan α-1,4. Amilosa terdiri atas 250-300 unit D-glukosa yang terikat dengan ikatan α -1,4-glikosidik, jadi molekulnya merupakan rantai terbuka. Sedangkan amilopektin (80-85%) merupakan rantai bercabang sebanyak 20-30 molekul α-D-glukopiranosa yang bersambungan dengan ikatan α-1,4 dan α1,6.
Adanya ikatan α-1,6-glikosidik ini menyebabkan terjadinya cabang, sehingga molekul amilopektin berbentuk rantai terbuka dan bercabang (Anna, 1994). Pati sagu memiliki kandungan amilosa 25-35% dan
amilopektin 65-75%. Pati jagung normal mengandung 24-26% amilosa dan 74-76% amilopektin. Pati singkong dari tepung tapioka memiliki rasio 17% amilosa dan 83% amilopektin.
Amilum dalam kehidupan manusia dapat berperan sebagai sumber makanan penghasil energi utama dari golongan karbohidrat, di samping itu amilum juga dapat berperan sebagai bahan aditif pada proses pengolahan makanan, misalnya sebagai penstabil dalam proses pembuatan puding. Amilum juga berperan dalam pembuatan sirup dan pemanis buatan seperti sakarin. Dalam bidang non makanan, amilum digunakan untuk bahan baku dalam proses pembuatan kertas, pakaian dari katun, industri cat, maupun untuk produksi hidrogen (Liu,2005).
molekul-molekul yang lebih kecil yang dikenal dengan nama dekstrin. Jadi dekstrin adalah hasil antara pada proses hidrolisis amilum sebelum
terbentuk maltose (Anna, 1994). Untuk mengetahui adanya pati maka dilakukan pengujian dengan menggunakan larutan iodium (I2 dalam KI). Bila terdapat amilosa, polimer-polimer glukosa yang lebih besar dari 20 maka akan menghasilkan warna biru. Bila polimer-polimer glukosa kurang dari 20 maka akan menghasilkan warna merah. Dekstrin dengan polimer enam, tujuh, dan delapan akan memberikan warna coklat. Polimer yang lebih kecil dari lima tidak memberikan warna dengan iodium (Winarno, 1986).
C. Enzim
Enzim adalah suatu atau beberapa gugus polipeptida (protein) yang berfungsi sebagai katalis yaitu senyawa yang mempercepat proses reaksi tanpa habis bereaksi dalam suatu reaksi kimia. Berdasarkan cara
menghasilkannya, enzim dibagi menjadi dua, yaitu enzim ekstraseluler dan enzim intraseluler. Enzim ekstraseluler dapat diperoleh dalam keadaan murni pada biakan cair dengan cara pemisahan dan pemurnian yang tidak begitu rumit. Sedangkan enzim intraseluler memiliki peran dalam
mensintesis bahan seluler dan menguraikan nutrien untuk menyediakan energi yang dibutuhkan oleh sel (Wirahadikusumah, 1989).
yang diturunkan oleh suatu mol zat pada temperatur tertentu untuk membawa molekul kedalam aktifnya atau keadaan aktifnya, menurunkan energi aktivasi, mempercepat reaksi pada suhu dan tekanan tetap tanpa mengubah besarnya tetapan seimbangnya, dan mengendalikan reaksi (Wirahadikusumah, 1989).
Pengaruh suhu sangat menentukan aktivitas enzim pada waktu mengkatalisis suatu reaksi. Seluruh enzim memerlukan jumlah panas tertentu untuk dapat aktif. Meningkatnya suhu akan semakin meningkatkan aktivitas enzim. Aktivitas enzim meningkat pada kecepatan ini hingga mencapai kondisi optimum. Peningkatan suhu yang melebihi suhu optimumnya menyebabkan lemahnya ikatan di dalam enzim secara struktural (Pratiwi, 2008). Pada suhu maksimum enzim akan terdenaturasi karena struktur protein terbuka dan gugus non polar yang berada di dalam molekul menjadi terbuka keluar, kelarutan protein di dalam air yang polar menjadi turun, sehingga aktivitas enzim juga akan turun (Lehninger, 1997).
Aktivitas enzim juga dipengaruhi oleh konsentrasi substrat. Pada konsentrasi substrat rendah, enzim tidak mencapai konversi maksimum akibat sulitnya enzim menemukan substrat yang akan direaksikan. Seiring dengan meningkatnya konsentrasi substrat, kecepatan reaksi juga akan meningkat akibat makin cepatnya substrat terikat pada enzim. Peningkatan konsentrasi substrat pada titik jenuh tidak lagi dapat meningkatkan
Konstanta Michaelis-Menten (KM) dan laju reaksi maksimum (Vmaks) merupakan parameter dalam kinetika reaksi enzim. Setiap enzim memiliki nilai KM dan Vmaks yang khas dengan substrat spesifik pada suhu dan pH
tertentu (Kamelia et al., 2005). Penentuan harga KM dan Vmaks ini bertujuan untuk mengetahui konsentrasi substrat agar menghasilkan laju reaksi yang maksimal.
Nilai KM suatu enzim dapat dihitung dengan persamaan Lineweaver-Burk
yang diperoleh dari persamaan Michaelis-Menten yang kemudian dihasilkan suatu diagram Lineweaver-Burk (Page, 1997).
Diagram Lineweaver-Burk ( Suhartono, 1989) :
pH lingkungan juga berpengaruh terhadap kecepatan aktivitas enzim dalam mengkatalisis suatu reaksi. Hal ini disebabkan konsentrasi ion hidrogen mempengaruhi struktur tiga dimensi enzim dan aktivitasnya. Setiap enzim
memiliki pH optimum di mana pada pH tersebut struktur tiga dimensinya paling kondusif untuk mengikat substrat. Bila konsentrasi ion hidrogen berubah dari konsentrasi optimal, aktivas enzim secara progesif hilang sampai pada akhirnya enzim menjadi tidak fungsional (Lehninger, 1997).
Selain suhu, pH dan konsentrasi substrat, aktivitas enzim juga dipengaruhi oleh ada tidaknya inhibitor. Jika terdapat pengurangan laju reaksi oleh suatu senyawa, senyawa tersebut dinamakan inhibitor. Inhibitor dapat bersaing dengan substrat dalam berikatan dengan enzim, sehingga menghalangi substrat terikat pada tapak aktif enzim (Anna, 1994).
D. Enzim CGT-ase dan Siklodekstrin
Bacillus menghasilkan berbagi enzim yang penting yang digunakan dalam bidang industri. Beberapa spesies bakteri terutama Paenibacillus macerans (Kitahata et al.,1974), Bacillus circulans (Pongsawadi and Yagiswa, 1987), Bacillus megaterium (Kitahata and Okada, 1976), Bacillus firmus (Mori et al., 1994), Klebsiella sp. (Bender, 1977; Lee et al., 1992) dan Bacillus alkalofilik (Nakamura and Horikhosi, 1976) diketahui sebagai penghasil enzim CGT-ase yang potensial. Selain mikroorganisme alkalofilik, mikrooganisme psikrofilik, mesofilik dan termofilik juga menghasilkan enzim CGT-ase. Bacillus macerans (Takano et al., 1986; Fujiwara et al., 1992) dan Bacillus stearothermophilus (Fujiwara et al., 1992) yang dikenal produsen α-CGT-ase. Bacillus ohbensis (Sin et al., 1991), alkalofilik Bacillus sp. 38-2 (Horikoshi, 1999) dan Bacillus sp. 1011 (Kimura et al., 1987) yang dikenal produsen β-CGT-ase. Produsen CGT-ase yang menghasilkan -CGT-ase adalah Bacillus sp. AL-6 (Fujita et al., 1990).
Reaksi katalisis oleh enzim CGT-ase dapat terjadi secara intramolekul (siklisasi) dan antarmolekul (kopling, disproporsionasi), serta reaksi hidrolisis. Reaksi siklisasi yaitu transfer residu gula akhir ke residu gula yang lain pada rantai oligosakarida yang sama untuk membentuk suatu senyawa siklik. Ini merupakan reaksi intramolekul dimana pati
CGT-ase menghasilkan campuran dari tiga jenis siklodekstrin (CD) yaitu
α-CD, β-CD dan -CD. Kebanyakan CGT-ase menghasilkan terutama
α-CD dan β-CD dibandingkan -CD (Tonkova, 1998). Namun, untuk
menghasilkan CD yang terutama adalah tergantung metode dan kondisi inkubasi yang digunakan, sedangkan untuk menghasilkan α-CD, β-CD dan
Tabel 1. Jenis siklodekstrin utama yang dihasilkan berdasarkan asal enzim CGT-ase yang digunakan (Biwer et al., 2002)
Organisme Tipe
CGT-ase Referensi
Bacillus macerans strain IAM1234 Bacillus macerans strain IFO 3490 Thermococcus sp. Strain B1001 Thermococcus kodakaraensis KOD1 Bacillus sp. E1
Bacillus circulans 251 Bacillus circulans 8
Bacillus firmus var. alkalophilus Bacillus licheniformis strain CGT-A Thermoanaaerobacter sp.
Thermoanaaerobacter sp. ATCC 53627
Bacillus stearothermophilus NO2 T. thermosulfurigenes strain EM1 Alkalophilic Bacillus sp. 28-2 Alkalophilic Bacillus sp. 1011 Bacillus sp strain B1018 Bacillus sp strain KC201 Bacillus sp. A2-5a
Bacillus agaradhaerens strain LS-3C Bacillus ohbensis
Alkalophilic Bacillus clarkii 7364 Brevibacillus brevi CD162
Bacillus firmus/lentus strain 290-3 Nostoc sp. PCC 9229
α Fujiwara et al., 1992 Yamamoto et al., 2000 Rashid et al., 2002 Yong et al., 1996 Lawson et al., 1994 Nitschke et al., 1990 Park et al., 1999 Hill et al., 1990
Patent Appl DK 96 001/79 Jorgensen et al., 1997
Cincin luar struktur siklodekstrin bersifat tidak polar (hidrofobik) sedangkan bagian dalam rongga bersifat lebih polar (hidrofilik) (Szetjli, 1982). Produk siklik dapat terbentuk secara kompleks inklusi dengan senyawaan anorganik maupun organik. Sifat ini menyebabkan siklodektrin banyak digunakan dalam berbagai industri seperti pangan, kosmetika, farmasi, agrokimia serta untuk penanganan polusi (Bender, 1977; Kaneto and Fumithasi, 1996; Szetjli, 1982).
Pada bidang farmasi siklodekstrin berfungsi untuk mempermudah
pembuatan obat-obatan dalam bentuk tablet dengan menghambat zat volatil, selain itu siklodektrin juga meningkatkan stabilitas obat agar lebih tahan terhadap hidrolisis, oksidasi, panas, cahaya dan garam logam (Tonkova, 1998). Pada bidang pangan siklodekstrin berfungsi untuk menghaluskan tekstur kue dan daging, menstabilkan rasa bila makanan disimpan untuk waktu lama dan pembuatan susu yang rendah kolesterol (Szetjli, 1982).
E. Pemurnian Enzim CGT-ase
Pemurnian merupakan tahap yang penting setelah enzim diisolasi.
Prinsip pemisahan dengan proses ultrafiltrasi ialah memisahkan komponen berdasarkan bobot molekul. Pada ultrafiltrasi, molekul-molekul dipaksa melewati suatu membran dengan ukuran pori sangat kecil dengan menggunakan tekanan hidarulik. Ultrafiltrasi menghasilkan enzim yang lebih pekat dengan aktivitas spesifik yang lebih tinggi, aktivitas enzim CGT-ase dari isolat Alkaliphile Bacillus Pseudalcaliphilus 20RF meningkat dua kali lipat (Tonkova, 2011).
III. METODOLOGI PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Juni-November 2013. Penelitian ini dilakukan di Laboratorium Biokimia dan Laboratorium Biomassa Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
B. Alat dan Bahan
Bahan-bahan yang digunakan pada penelitian ini yaitu bakteri isolat LTi-A2.4, pati singkong, pati jagung, pati ubi jalar, pepton, yeast extract, K2HPO4, MgSO4.7 H2O, fenolftalein (PP), methyl orange, agar, Na2CO3,
NaCl, PH indikator, Na(K)-tartarat, CuSO4.5H2O, reagen folin ciocelteau,
akuadest, aquabidest, soluble starch, buffer asetat 0.1 M pH 5.5, fenolftalein 1 mM, pereaksi C, pereaksi D, spiritus, buffer fosfat 0,1 M, buffer sitrat 0,1 M, buffer asetat 0,1 M serta alkohol.
C. Prosedur Penelitian
1. Tahap Persiapan
a. Persiapan Alat
Semua peralatan gelas yang dipakai dicuci bersih, dikeringkan dan dilakukan sterilisasi agar alat-alat tersebut terhindar dari mikroba yang tidak diinginkan. Sterilisasi alat dilakukan dengan
menggunakan autoclave pada suhu 121°C dengan tekanan 1 atm selama 20 menit. Seluruh kegiatan dilakukan secara aseptik di dalam laminar air flow kecuali yang disebutkan secara khusus.
menggunakan sampel enzim, pada penelitian ini, kontrol enzim berupa kontrol negatif.
b. Pembuatan Medium Padat Horikhosi’s II
Medium padat Horikhosi ’s II disiapkan dengan cara menimbang 1g/l pati singkong, 0,5 g/l pepton, 0,5 g/l yeast extract, 0,1 g/l K2HPO4, 0,02 g/l MgSO4.7 H2O, 0,03 g/l fenolftalein, 0,01 g/l
methyl orange, 1,5 g/l agar. Kemudian semua bahan yang telah ditimbang tersebut dimasukkan ke dalam Erlenmeyer, dilarutkan dengan akuades sebanyak 80 mL dan dipanaskan di atas bunsen (larutan 1). Kemudian sebanyak 0,25 g/l Na2CO3 dimasukan ke
dalam Erlenmeyer dan dilarutkan dengan akuades sebanyak 25 mL (larutan 2), disiapkan juga akuades sebanyak 5 mL yang telah dimasukkan ke dalam Erlenmeyer (larutan 3). Larutan (1), larutan (2) dan larutan (3) kemudian disterilisasi dengan menggunakan autoclave pada suhu 121ºC dengan tekanan 1 atm selama 15 menit. Medium Horikoshi’s II disiapkan di dalam laminar air flow dengan mencampurkan larutan I sebanyak 80 mL, Larutan II sebanyak 17 mL dan larutan III sebanyak 3 mL. Setelah medium Horikhosi’s II tercampur rata, medium di cek pH nya, yakni harus pH 10,
dimiringkan atau dimasukkan ke dalam cawan plate hingga memadat pada suhu kamar.
c. Pembuatan Medium Cair Horikhoshi’s II
Medium cair starter digunakan untuk adaptasi awal pertumbuhan bakteri pada medium cair. Sedangkan untuk kultur digunakan medium cair Horikoshi’s II dengan volume yang lebih besar. Medium cair yang digunakan yaitu medium Horikhosi’s II yang mengandung pati singkong, pepton, yeast extract, K2HPO4,
MgSO4.7H2O tanpa fenolftalein, metil jingga dan agar.
d. Penumbuhan Bakteri Amilolitik.
2. Pembuatan Pereaksi
Pereaksi yang akan digunakan pada penelitian ini yaitu: pereaksi CGT-ase (Kaneko et al., 1987; Alves-Prado et al., 2008), dan pereaksi Lowry (Lowry et al., 1951). Pereaksi CGT-ase digunakan untuk menguji aktivitas ekstrak kasar enzim CGT-ase, sedangkan pereaksi Lowry digunakan untuk menguji kadar protein ekstrak kasar enzim CGT-ase.
a. Substrat untuk Uji Aktivitas Enzim CGT-ase.
Substrat yaitu larutan soluble starch 1% (w/v) disiapkan dengan cara melarutkan 1 gram soluble starch ke dalam 100 mL buffer asetat 0.1M pH 5.5, kemudian dipanaskan hingga larut. Untuk penentuan konstanta kinetik enzim CGT-ase, soluble starch yang digunakan diganti dengan konsentrasi 0,25%, 0,5%, 0,75%, 1,25% dan 1,50% dengan cara pembuatan yang sama.
b. Pereaksi Lowry.
Pereaksi Lowry terdiri atas 4 macam, yang meliputi Pereaksi A, B, C, dan D. Masing-masing pereaksi tersebut disiapkan sebagai berikut: Pereaksi A: 2 g Na2CO3 dilarutkan dalam 100 mL NaOH
0,1 N; Pereaksi B: 5 mL larutan CuSO4.5H2O 1% (w/v)
mL pereaksi B ditambah 100 mL pereaksi A; dan Pereaksi D: reagen Folin-Ciocelteau diencerkan dengan akuades 1:1.
b. Penentuan Pertumbuhan Sel
Penentuan pertumbuhan sel digunakan untuk mengetahui pertumbuhan dari sel bakteri dengan cara mengencerkan sampel kultur. Sebanyak 0,3 mL kultur dimasukan ke tabung reaksi, lalu ditambahkan 2,7 mL akuades, dan diukur serapannya
menggunakan spektrofotometer UV-VIS pada panjang gelombang 600 nm.
c. Produksi Enzim CGT-ase
Produksi enzim CGT-ase dilakukan dengan menyiapkan medium starter dan medium kultur yang akan digunakan. Starter
disiapkan dengan menginokulasikan 2 ose isolat ke dalam 5 ml medium cair Horikhoshi’s II (tanpa fenolftalein, metil jingga dan agar), kemudian diinkubasi pada shaker dengan kecepatan 140 rpm selama 17 jam (overnight:16-20 jam). Starter selanjutnya digunakan untuk diinokulasikan ke dalam medium kultur. Medium kultur sebanyak 100 ml yang telah disiapkan,
kultur dengan cara sentrifugasi selama 30 menit dengan kecepatan 5000 rpm untuk mendapatkan ekstrak kasar enzim CGT-ase yang kemudian dapat diuji aktivitasnya.
d. Uji Aktivitas Ekstrak Kasar Enzim CGT-ase (Kaneko et al.,
1987 dan Alves-Prado et al., 2008)
Sebanyak 100 µL larutan enzim ditambahkan 800 µL soluble starch 1% yang disiapkan dalam buffer asetat 0.1 M pH 5.5 diinkubasi selama 10 menit pada suhu 55oC di dalam waterbath. Kemudian ditambahkan 4 mL Na2CO3 0.25 M dan 0.1 mL larutan
fenolftalein 1 mM. Absorbansi diukur pada λmaks 550 nm. Untuk
e. Uji Kadar Protein Enzim CGT-ase
Sebanyak 100 µL larutan enzim ditambahkan 0,9 ml akuades dan ditambah 0,5 ml pereaksi D, kemudian diaduk-aduk dan
didiamkan selama 30 menit pada suhu kamar, lalu absorbansinya pada λmaks 600 nm. Untuk kontrol, enzim diganti dengan akuades.
Selanjutnya diperlakukan sama seperti sampel.
f. Studi Pendahuluan Produksi Enzim CGT-ase
Studi pendahuluan produksi enzim CGT-ase dilakukan dengan mengganti sumber nitrogen pada medium Horikoshi’s II dengan
g. Uji Kestabilan Aktivitas Ekstrak Kasar Enzim CGT-ase
Ekstrak kasar enzim CGT-ase disimpan di suhu 4°C, kemudian diukur aktivitas CGT-ase dan kadar proteinnya setiap 24 jam sejak kultur selama 5 hari berturut-turut.
h. Pemurnian Enzim CGT-ase
i. Karakteristik Enzim (Tonkova et al., 2011).
Enzim yang diperoleh dari fraksi ultrafiltrasi, dikarakteristik dengan beberapa pengamatan meliputi: Pengaruh pH terhadap aktivitas enzim, pengaruh suhu terhadap aktivitas enzim,
penentuan konstanta kinetik dan substrat spesifitas dari beberapa jenis pati.
a. Pengaruh pH Terhadap Aktivitas CGT-ase
Pengaruh pH terhadap aktivitas CGT-ase diamati dengan buffer sitrat 0.1 M untuk pH 4.5, buffer asetat 0.1 M untuk pH 5.5 dan buffer fosfat untuk interval pH 6.0 – 6.5.
b. Pengaruh Temperatur terhadap Aktivitas CGT-ase
c. Penentuan Konstanta Kinetik CGT-ase
Konstanta kinetika ditentukan dengan mengganti konsentrasi soluble starch sebagai substrat dengan konsentrasi 0,25%, 0.5%, 0.75%, 1,25 % dan 1.50% menggunakan pH dan temperatur terbaik yang diperoleh saat karakterisasi sebelumnya.
d. Penentuan Substrat Spesifitas CGT-ase
D. Diagram Alir Prosedur Penelitian
Data
Uji Aktivitas ekstrak kasar enzim CGT-ase
Penentuan Pertumbuhan Sel
Penanaman bakteri ke dalam media cair (starter)
Inokulasi dari media starter ke medium kultur Horikoshi’s II
Pemurnian Enzim CGT-ase dengan metode ultrafiltrasi
Produksi Enzim CGT-ase
Penentuan kadar protein enzim CGT-ase
Karakterisasi enzim CGT-ase Peremajaan bakteri isolat
III. METODOLOGI PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Juni-November 2013. Penelitian ini dilakukan di Laboratorium Biokimia dan Laboratorium Biomassa Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
B. Alat dan Bahan
Bahan-bahan yang digunakan pada penelitian ini yaitu bakteri isolat LTi-A2.4, pati singkong, pati jagung, pati ubi jalar, pepton, yeast extract, K2HPO4, MgSO4.7 H2O, fenolftalein (PP), methyl orange, agar, Na2CO3,
NaCl, PH indikator, Na(K)-tartarat, CuSO4.5H2O, reagen folin ciocelteau,
akuadest, aquabidest, soluble starch, buffer asetat 0.1 M pH 5.5, fenolftalein 1 mM, pereaksi C, pereaksi D, spiritus, buffer fosfat 0,1 M, buffer sitrat 0,1 M, buffer asetat 0,1 M serta alkohol.
C. Prosedur Penelitian
1. Tahap Persiapan
a. Persiapan Alat
Semua peralatan gelas yang dipakai dicuci bersih, dikeringkan dan dilakukan sterilisasi agar alat-alat tersebut terhindar dari mikroba yang tidak diinginkan. Sterilisasi alat dilakukan dengan
menggunakan autoclave pada suhu 121°C dengan tekanan 1 atm selama 20 menit. Seluruh kegiatan dilakukan secara aseptik di dalam laminar air flow kecuali yang disebutkan secara khusus.
menggunakan sampel enzim, pada penelitian ini, kontrol enzim berupa kontrol negatif.
b. Pembuatan Medium Padat Horikhosi’s II
Medium padat Horikhosi ’s II disiapkan dengan cara menimbang 1g/l pati singkong, 0,5 g/l pepton, 0,5 g/l yeast extract, 0,1 g/l K2HPO4, 0,02 g/l MgSO4.7 H2O, 0,03 g/l fenolftalein, 0,01 g/l
methyl orange, 1,5 g/l agar. Kemudian semua bahan yang telah ditimbang tersebut dimasukkan ke dalam Erlenmeyer, dilarutkan dengan akuades sebanyak 80 mL dan dipanaskan di atas bunsen (larutan 1). Kemudian sebanyak 0,25 g/l Na2CO3 dimasukan ke
dalam Erlenmeyer dan dilarutkan dengan akuades sebanyak 25 mL (larutan 2), disiapkan juga akuades sebanyak 5 mL yang telah dimasukkan ke dalam Erlenmeyer (larutan 3). Larutan (1), larutan (2) dan larutan (3) kemudian disterilisasi dengan menggunakan autoclave pada suhu 121ºC dengan tekanan 1 atm selama 15 menit. Medium Horikoshi’s II disiapkan di dalam laminar air flow dengan mencampurkan larutan I sebanyak 80 mL, Larutan II sebanyak 17 mL dan larutan III sebanyak 3 mL. Setelah medium Horikhosi’s II tercampur rata, medium di cek pH nya, yakni harus pH 10,
dimiringkan atau dimasukkan ke dalam cawan plate hingga memadat pada suhu kamar.
c. Pembuatan Medium Cair Horikhoshi’s II
Medium cair starter digunakan untuk adaptasi awal pertumbuhan bakteri pada medium cair. Sedangkan untuk kultur digunakan medium cair Horikoshi’s II dengan volume yang lebih besar. Medium cair yang digunakan yaitu medium Horikhosi’s II yang mengandung pati singkong, pepton, yeast extract, K2HPO4,
MgSO4.7H2O tanpa fenolftalein, metil jingga dan agar.
d. Penumbuhan Bakteri Amilolitik.
2. Pembuatan Pereaksi
Pereaksi yang akan digunakan pada penelitian ini yaitu: pereaksi CGT-ase (Kaneko et al., 1987; Alves-Prado et al., 2008), dan pereaksi Lowry (Lowry et al., 1951). Pereaksi CGT-ase digunakan untuk menguji aktivitas ekstrak kasar enzim CGT-ase, sedangkan pereaksi Lowry digunakan untuk menguji kadar protein ekstrak kasar enzim CGT-ase.
a. Substrat untuk Uji Aktivitas Enzim CGT-ase.
Substrat yaitu larutan soluble starch 1% (w/v) disiapkan dengan cara melarutkan 1 gram soluble starch ke dalam 100 mL buffer asetat 0.1M pH 5.5, kemudian dipanaskan hingga larut. Untuk penentuan konstanta kinetik enzim CGT-ase, soluble starch yang digunakan diganti dengan konsentrasi 0,25%, 0,5%, 0,75%, 1,25% dan 1,50% dengan cara pembuatan yang sama.
b. Pereaksi Lowry.
Pereaksi Lowry terdiri atas 4 macam, yang meliputi Pereaksi A, B, C, dan D. Masing-masing pereaksi tersebut disiapkan sebagai berikut: Pereaksi A: 2 g Na2CO3 dilarutkan dalam 100 mL NaOH
0,1 N; Pereaksi B: 5 mL larutan CuSO4.5H2O 1% (w/v)
mL pereaksi B ditambah 100 mL pereaksi A; dan Pereaksi D: reagen Folin-Ciocelteau diencerkan dengan akuades 1:1.
b. Penentuan Pertumbuhan Sel
Penentuan pertumbuhan sel digunakan untuk mengetahui pertumbuhan dari sel bakteri dengan cara mengencerkan sampel kultur. Sebanyak 0,3 mL kultur dimasukan ke tabung reaksi, lalu ditambahkan 2,7 mL akuades, dan diukur serapannya
menggunakan spektrofotometer UV-VIS pada panjang gelombang 600 nm.
c. Produksi Enzim CGT-ase
Produksi enzim CGT-ase dilakukan dengan menyiapkan medium starter dan medium kultur yang akan digunakan. Starter
disiapkan dengan menginokulasikan 2 ose isolat ke dalam 5 ml medium cair Horikhoshi’s II (tanpa fenolftalein, metil jingga dan agar), kemudian diinkubasi pada shaker dengan kecepatan 140 rpm selama 17 jam (overnight:16-20 jam). Starter selanjutnya digunakan untuk diinokulasikan ke dalam medium kultur. Medium kultur sebanyak 100 ml yang telah disiapkan,
kultur dengan cara sentrifugasi selama 30 menit dengan kecepatan 5000 rpm untuk mendapatkan ekstrak kasar enzim CGT-ase yang kemudian dapat diuji aktivitasnya.
d. Uji Aktivitas Ekstrak Kasar Enzim CGT-ase (Kaneko et al.,
1987 dan Alves-Prado et al., 2008)
Sebanyak 100 µL larutan enzim ditambahkan 800 µL soluble starch 1% yang disiapkan dalam buffer asetat 0.1 M pH 5.5 diinkubasi selama 10 menit pada suhu 55oC di dalam waterbath. Kemudian ditambahkan 4 mL Na2CO3 0.25 M dan 0.1 mL larutan
fenolftalein 1 mM. Absorbansi diukur pada λmaks 550 nm. Untuk
e. Uji Kadar Protein Enzim CGT-ase
Sebanyak 100 µL larutan enzim ditambahkan 0,9 ml akuades dan ditambah 0,5 ml pereaksi D, kemudian diaduk-aduk dan
didiamkan selama 30 menit pada suhu kamar, lalu absorbansinya pada λmaks 600 nm. Untuk kontrol, enzim diganti dengan akuades.
Selanjutnya diperlakukan sama seperti sampel.
f. Studi Pendahuluan Produksi Enzim CGT-ase
Studi pendahuluan produksi enzim CGT-ase dilakukan dengan mengganti sumber nitrogen pada medium Horikoshi’s II dengan
g. Uji Kestabilan Aktivitas Ekstrak Kasar Enzim CGT-ase
Ekstrak kasar enzim CGT-ase disimpan di suhu 4°C, kemudian diukur aktivitas CGT-ase dan kadar proteinnya setiap 24 jam sejak kultur selama 5 hari berturut-turut.
h. Pemurnian Enzim CGT-ase
i. Karakteristik Enzim (Tonkova et al., 2011).
Enzim yang diperoleh dari fraksi ultrafiltrasi, dikarakteristik dengan beberapa pengamatan meliputi: Pengaruh pH terhadap aktivitas enzim, pengaruh suhu terhadap aktivitas enzim,
penentuan konstanta kinetik dan substrat spesifitas dari beberapa jenis pati.
a. Pengaruh pH Terhadap Aktivitas CGT-ase
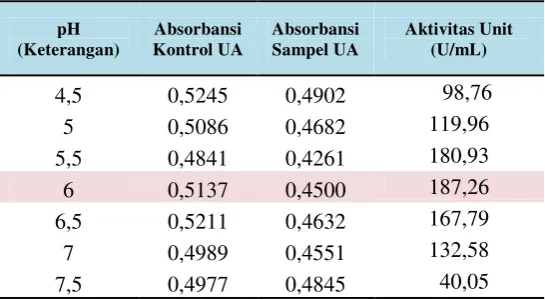
Pengaruh pH terhadap aktivitas CGT-ase diamati dengan buffer sitrat 0.1 M untuk pH 4.5, buffer asetat 0.1 M untuk pH 5.5 dan buffer fosfat untuk interval pH 6.0 – 6.5.
b. Pengaruh Temperatur terhadap Aktivitas CGT-ase
c. Penentuan Konstanta Kinetik CGT-ase
Konstanta kinetika ditentukan dengan mengganti konsentrasi soluble starch sebagai substrat dengan konsentrasi 0,25%, 0.5%, 0.75%, 1,25 % dan 1.50% menggunakan pH dan temperatur terbaik yang diperoleh saat karakterisasi sebelumnya.
d. Penentuan Substrat Spesifitas CGT-ase
D. Diagram Alir Prosedur Penelitian
Data
Uji Aktivitas ekstrak kasar enzim CGT-ase
Penentuan Pertumbuhan Sel
Penanaman bakteri ke dalam media cair (starter)
Inokulasi dari media starter ke medium kultur Horikoshi’s II
Pemurnian Enzim CGT-ase dengan metode ultrafiltrasi
Produksi Enzim CGT-ase
Penentuan kadar protein enzim CGT-ase
Karakterisasi enzim CGT-ase Peremajaan bakteri isolat
V. SIMPULAN DAN SARAN
A.Simpulan
Berdasarkan hasil yang diperoleh dari penelitian yang telah dilakukan, diperoleh simpulan sebagai berikut :
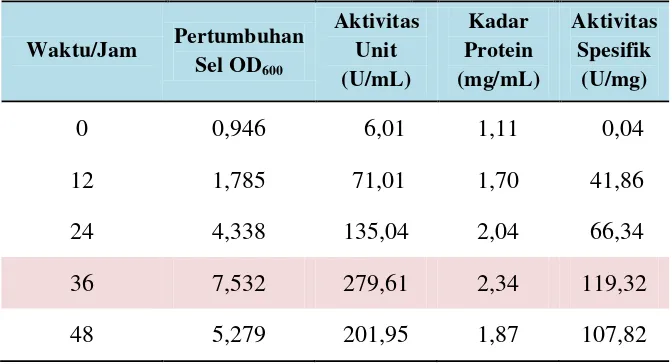
1. Medium Horikoshi’s II dengan komposisi sumber nitrogen Yeast extract-pepton, dipilih sebagai komposisi medium terbaik untuk produksi enzim CGT-ase isolat LTi-A.24. Pada medium ini, enzim CGT-ase mampu menghasilkan aktivitas yang tinggi pada waktu kultur 36 jam.
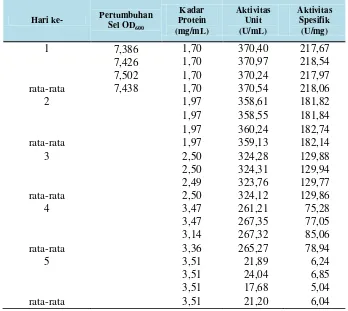
2. Enzim CGT-ase isolat LTi-A.24 memiliki kestabilan aktivitas pada jangka waktu (t½) 2 hari.
3. Kemurnian enzim CGT-ase isolat LTi-A.24 setelah ultrafiltrasi meningkat hingga mencapai 3 kali lipat dibandingkan kemurnian enzim CGT-ase ekstrak kasarnya.
B.Saran
DAFTAR PUSTAKA
Alves-Prado, H.F., Carneiro, A.A., Pavezzi, F.C., Gomes, E., Boscolo, M., Franco, C.M., and Silva, R. 2008. Production of Cyclodextrins by CGT-ase from Bacillus clausii Using Different Starches as Substrates. Appl Biochem Biotechnol. 146: 3–13.
Bender, L. 1977. Enzyme and Microbial Systems Involved in Starch Processing. Arch. Microbiol. 3: 272-282.
Biwer, A., Antranikian, G. and Heinzle, E. 2002. Enzymatic Production for Cyclodextrins. Applied Microbiology and Biotechnology. 59: 609-617 Bovetto, L.J., Backer, D.P., Villette, J.R., Sicard, P.J. and Bouquelet, S.J.L. 1992.
Cyclomaltodextrin Glucanotransferase from Bacillus circulans E 192. Biotechnology and Applied Biochemistry. 15: 48-58.
Chakrabarty, S.L. and S. Sen. 1984. Amylase from Lactobacilus Isolate from Vegetables Wastes. Technol. 62: 407-413.
Freer, S.N. 1993. Purification and Characterication α-Amylase from Streptococcus bovis. JBI Appl. Enviro. Microbial. 59: 1398-1402.
Fujita, Y., Tsubouchi, H., Inagi, Y., Tomita, K., Ozaki, A. and Nakanishi, K. 1990. Purification and Properties of Cyclodextrin Glycosyltransferase from Bacillus sp. AL-6. Journal of Fermentation and Bioengineering. 70: 150-154.
Fujiwara, S., Kakihara, H., Kim, B.W., Lejeune, A., Kanemoto, M., Sakaguchi, K. and Imanaka, T. 1992. Cyclization Characteristics of Cyclodextrin Glucanotransferase are Conferred by the NH2-Terminal Region of The
Enzyme. Applied and Environmental Microbiology. 58(12): 4016-4025. Hedges, A.R. 1992. Cyclodextrin : Production, Properties and Applications. In: Schenck, F.W. and Hebeda, R.E. Starch Hydrolysis Products. New York:
VCH Publishers. 319-334.
Horikoshi, K. 1999. Alkaliphiles: Some Applications of Their Products for Biotechnology. Microbiology and Molecular Biology Reviews. 63:
735-750.
Irianto, K. 2006. Mikrobiologi Menguak Dunia Mikroorganisme. Yrama Media. Bandung.
Kaneto, U. and Fumitashi, H. 1996. Improvement of Drug Properties by Cyclodextrins. Pract. Med. Chem. 14: 793-825.
Kimura, K., Kataoka, S., Ishii, I., Takano, T. and Yamane, K. 1987. Nucleotide Sequence of β-Cyclodextrin Glucanotransferase Gene of Alkalophilic Bacillus sp Strain 1011 and Similarity of Its Amino Acid Sequence to Those of α-Amylases. Journal of Bacteriology. 169(9): 4399-4402.
Kitahata, S., Tsuyama, N. and Okada, S. 1974. Purification and Some Properties of Cyclodextrin Glycosyltransferase from A Strain of Bacillus Species. Agric. Biot Chem. 38: 387-393.
Kitahata, S. and Okada, S. 1976. Actian of CycIodextrin Glycosyltransferase from Bacillus megaterium Strain no.5 on Strach. Agric. Biol. Chem. 33: 2413-14l7.
Lee, J.H, Choi, K.J.L., Choi, J.Y., Lee, Y.S., Kwon, I.B., and Yu, J.H. 1992. Enzymatic Production of Cyclodextrin Glucanotransferase of Klebsiella oxytoca 19-1. Enzyme Microb. Technol. 14: 1017-1020.
Leemhuis, H., Rozeboom, H.J., Dijkstra, B.W. and Dijkhuizen, L. 2003. The Fully Conserved Asp Residue in Conserved Sequence Region I of the α-Amylase Family is Crucial for The Catalytic Site Architecture and Activity. FEBS Letters. 541: 47-51.
Lehnninger, A.L. 1995. Dasar-Dasar Biokimia. Jilid 1. Diterjemahkan oleh Maggy Thenawidjaya. Erlangga. Jakarta. 369 halaman.
Lim, D. 1998. Microbiology, 2nd Edition. McGrow-Hill Book. New York. Liu, Q. 2005. Understanding Starch and Their Role in Foods. Taylor and
Francis Group, LLC.
Lowry, C.H., N.J. Roseburgh, Y.L. Farr, and R.J. Randall. 1951. Protein Measurement with The Folin Phenol Reagent. J. Biol. Chem. 193: 365-275. Mori, S., S. Hirose, T. Oya and S. Kitahata. 1994. Purification and Properties
Olympia, M., H. Fukuda, H. Ono, Y. Kaneko and M. Takano. 1995. Characterization and Hydrolyzing Lactic Acid Bacteria Isolate from A Fermented Fish and Rice Food “Burog Isda” and It’s Amylolitic Enzyme. J. Ferment. Bioeng. 80: 124-130.
Page, D.S. 1997. Prinsip-Prinsip Biokimia. Erlangga. Jakarta. 465 halaman. Park, S.C., Park, H.H. and Kim, S.H. 1989. A Rapid Screening Method for
Alkaline β-Cyclodextrin Glucanotransferase Using Phenolphthalein-Methyl Orange Containing Solid Media. Agriculural Biological Chemistry. 53: 1167-1169.
Poedjiadi, A. 1994. Dasar-Dasar Biokimia. UI Press. Jakarta.
Pongsawadi, P. and Yagiswa, M. 1987. Screening Anti Identification of Cyclodextrin Glucanotransferase Producing Bacteria. J. Fennent. Techno. 65: 463-467.
Pratiwi Sylvia T. 2008. Mikrobiologi Farmasi. Jakarta: Erlangga (hal;38-43) Sastrawiyana, H. 2011. Isolasi dan Penapisan Bakteri Amilolitik Isolat Lokal
Pendegradasi Pati Singkong Penghasil Enzim CGT-ase (Siklodekstrin Glukanotransferase). Unila: Lampung.
Schmidt, A.K., Cottaz, S., Driguez, H. and Schulz, G.E. 1998. Structure of Cyclodextrin Glucosyltransferase Complexed with a Derivative of Its Main Product β-Cyclodextrin. Journal of Biochemistry. 37: 5909-5915.
Shahib, M.N. 2005. Biologi: Molekular Medik I. UGM Press. Yogyakarta.
Sin, K., Nakamura, A., Kobayashi, K., Masaki, H. and Uozumi, T. 1991. Cloning and Sequencing of a Cyclodextrin Glucanotransferase Gene from Bacillus obhensis and Its Expression in Escherichia coli. Applied Microbiology and Biotechnolgy. 35: 600-605.
Suhartono, M.T. 1989. Enzim dan Bioteknologi. PAU IPB. Bogor.
Szejtli, J. 1982. Cyclodexrtins in Food, Cosmetics and Toiletries. Starch/Starke. 34: 379-385.
Szejtli, J. 1997. Utilization of Cyclodexstrin in Industrial Products and Processes. Journal of Material Chemistry. 7: 575-587.
Tonkova, A. 1998. Bacterial Cyclodextrin Glucotransferase. Enzyme and Microbial Technology. 22: 678-686.
Volk, W.A dan M.F. Wheeler. 1993. Mikrobiologi Dasar, Jilid 1, Edisi kelima. Alih bahasa oleh Soenarto Adisoemarto, Ph.D. Erlangga. Jakarta. 396 halaman.
Winarno, F.G. 1986. Enzim Pangan. PT Gedia Pustaka Utama. Jakarta.
Lampiran 1
Kurva Kalibrasi Larutan Standar Bovine Serum Albumine (BSA)
Kurva standar BSA digunakan untuk menentukan kadar protein (metode Lowry). Untuk mendapatkan gambar kurva standar BSA digunakan persamaan regresi linier Y = a + bx, dengan :
Absorbansi BSA pada berbagai konsentrasi untuk menentukan kurva standar protein yaitu:
Konsentrasi BSA (µg/mL) Absorbansi (λ=600 nm)
500 0,149
1000 0,238
1500 0,285
2000 0,389
2500 0,488
3000 0,598
3500 0,665
4000 0,782
4500 0,904
5000 1,005
Lampiran 2
Perhitungan Aktivitas Unit Enzim CGT-ase
Perhitungan aktivitas unit enzim CGT-ase berdasarkan metode Kaneko et al. (1987) dan dimodifikasi oleh Alves-Prado et al. (2008) dapat dilihat pada perhitungan dibawah ini :
Lampiran 3
Kurva Standar β-Siklodekstrin
% OD Decrease β-Siklodekstrin pada berbagai konsentrasi untuk
menentukan kurva standar β-Siklodekstrin
Konsentrasi β
-Siklodekstrin (mg/mL) % OD Decrease
0,2 5,43
0,4 8,22
0,6 10,58
0,8 13,51
1,0 16,57 2,0 29,39
Lampiran 4
Tabel 2. Indeks Amilolitik isolat LTi-A.24
7 hari 8 Hari
Lampiran 5
Tabel 3. Pertumbuhan sel, aktivitas unit, kadar protein dan aktivitas spesifik isolat LTi-A.24 pada variasi komposisi medium sumber nitrogen. Kontro= 0.019
Waktu Perlakuan Pertumbuhan Sel OD
600
Lampiran 6
Tabel 4. Pertumbuhan sel, aktivitas unit, kadar protein dan aktivitas spesifik isolat LTi-A.24 pada variasi waktu produksi enzim menggunakan
medium Horikoshi’s II dengan sumber nitrogen Yeast extract-Pepton.
Kontrol = 0,019
Waktu/Jam Pertumbuhan Sel OD600
Aktivitas Unit (U/mL)
Kadar Protein (mg/mL)
Aktivitas Spesifik
(U/mg)
0 0,946 6,01 1,11 0,04
12 1,785 71,01 1,70 41,86
24 4,338 135,04 2,04 66,34
36 7,532 279,61 2,34 119,32
Lampiran 7
Tabel 5. Pertumbuhan sel, aktivitas unit, kadar protein dan aktivitas spesifik dari isolat LTi-A.24 pada waktu inkubasi optimum 36 jam dengan jangka waktu penyimpanan enzim di suhu 4° selama 5 hari.
Hari ke- Pertumbuhan Sel OD600
Kontrol Lowry: 0,2298; 0,2356; 0,2444; 0,1960; 0,1970 Uji Aktivitas : 550nm ; Lowry dan OD: 600nm
Blanko Uji Aktivitas: 1,0982; 1,1945; 0,9932; 0,8051; 2,1137
Lampiran 8
Kurva pemurnian CGT-ase dari penelitian sebelumnya menggunakan metode fraksinasi garam ammonium sulfat dari isolat LTi-A.24.
Lampiran 9
Lampiran 10
Tabel 7.Aktivitas unit (U/mL) dari isolat LTi-A.24 pada variasi komposisi pH substrat saat uji aktivitas enzim setelah ultrafiltrasi dengan waktu inkubasi optimum 36 jam.
Variasi pH Sebelum Ultrafiltrasi (Ekstrak Kasar)
pH
Lampiran 11
Tabel 8. Aktivitas unit dari isolat LTi-A.24 pada variasi temperatur dengan waktu kultur optimum 36 jam serta pH substrat 5,5 dan pH 7.
Keterangan Suhu
Absorbansi Kontrol
UA
Absorbansi Sampel UA
Aktivitas Unit (U/mL)
pH 7 45 0,4593 0,3510 356,08
50 0,5306 0,3930 391,62
55 0,5601 0,3887 462,13
60 0,4952 0,3882 326,30
65 0,4583 0,4124 151,24
pH 5,5 45 0,5979 0,4551 360,67
50 0,4991 0,3382 486,84
55 0,5120 0,3232 556,86
60 0,6169 0,3783 584,08
Lampiran 12
Tabel 9. Aktivitas Unit CGT-ase (U/mL) dari isolat LTi-A.24 pada penentuan konstanta kinetik CGT-ase uji aktivitas enzim setelah ultrafiltrasi dengan pH 5,5 dan suhu 65°C.
Konsentrasi Substrat
Absorbansi Kontrol
UA
Absorbansi Sampel UA
Aktivitas Unit (U/mL)
0,25 0,5149 0,5001 43,41
0,5 0,5389 0,5229 44,84
0,75 0,5464 0,5169 81,53
1,25 0,5788 0,5044 194,12
1,50 0,548 0,5127 97,28
Lampiran 13
Tabel Lineweaver-Burk untuk penentuan konstanta Kinetik enzim CGT-ase.
Enzim Pemurnian a b vmaks km 1/km r2
1/[S] 1/V
0,40 0,023 0,0381 0,0075 131,69 5,0304 -0,20 0,989
0,20 0,015
0,13 0,012
0,08 0,011
0,07 0,010
Lampiran 14
Tabel 10. Aktivitas unit (U/mL) dari isolat LTi-A.24 pada penentuan substrat spesifitas CGT-ase saat uji aktivitas enzim setelah ultrafiltrasi dengan pH 5,5 dan suhu 65°C.
Substrat Absorbansi Kontrol UA
Absorbansi
Sampel UA Aktivitas Unit (U/mL)
Pati Singkong 0,5953 0,3742 560,88
Pati Jagung 1,1481 0,6286 683,31
Pati Ubi Jalar 0,5449 0,4364 300,70