ABSTRAK
PENINGKATAN KESTABILAN ENZIM SELULASE DARI Aspergillus niger L-51 DENGAN MODIFIKASI KIMIA
MENGGUNAKAN SITRAKONAT ANHIDRIDA
Oleh
Fatma Timur Iftiqoriyyah
Pada penelitian ini telah dilakukan modifikasi kimia enzim selulase dari Aspergillus niger L-51 menggunakan sitrakonat anhidrida untuk meningkatkan stabilitas enzim tersebut. Adapun tahapan yang dilakukan dalam penelitian ini meliputi : produksi, isolasi, pemurnian, modifikasi kimia menggunakan sitrakonat anhidrida dan karakterisasi enzim selulase hasil pemurnian sebelum dan setelah modifikasi meliputi penentuan suhu dan pH optimum, nilai KM dan Vmaks serta uji
stabilitas termal dan pH enzim. Hasil penelitian menunjukkan bahwa aktivitas spesifik enzim selulase hasil pemurnian 40,6094 U/mg, meningkat 13 kali dibandingkan dengan ekstrak kasar enzim yang mempunyai aktivitas spesifik 3,1046 U/mg. Enzim selulase hasil pemurnian mempunyai pH optimum 4,5; suhu optimum 50oC; KM = 79,96 mg/mL substrat; Vmaks = 10,14 μmol/mL.menit; ki =
0,0277 menit-1; waktu paruh (t1/2) = 25,02 menit dan ΔGi = 99,96 kJ/mol. Enzim
hasil modifikasi menggunakan sitrakonat anhidrida dengan variasi volume 20, 30, 40, dan 50 µL mempunyai pH optimum 4,0; suhu optimum 50oC; KM
berturut-turut sebagai berikut: 37,5; 22,1; 36,27 dan 48,77 mg/mL; Vmaks berturut-turut
sebagai berikut: 2,22; 1,47; 2,54 dan 2,99 μmol/mL.menit; ki berturut-turut
sebagai berikut: 0,0202; 0,0163; 0,0207 dan 0,0248 menit-1; waktu paruh (t1/2)
berturut-turut sebagai berikut: 34,31; 42,52; 33,48 dan 27,94 menit; ΔGi
berturut-turut sebagai berikut: 100,81; 101,38; 100,74 dan 100,25 kJ/mol. Berdasarkan penurunan nilai ki, peningkatan waktu paruh (t1/2) dan nilai ΔGi, diketahui bahwa
modifikasi kimia menggunakan sitrakonat anhidrida dapat meningkatkan stabilitas enzim selulase dari Aspergillus niger L-51.
i
Tujuan Penelitian ... 3
Manfaat Penelitian ... 4
TINJAUAN PUSTAKA ... 5
Enzim ... 5
Enzim Selulase. ... 12
Selulosa ... 14
Aspergilus niger ... 15
Isolasi dan Pemurnian Enzim Selulase ... 16
Pengujian Aktivitas Enzim Selulase dengan Metode Mandels ... 19
Penentuan Kadar Protein dengan Metode Lowry ... 20
Modifikasi Kimia ... 20
Kinetika Reaksi Enzim ... 23
Stabilitas Enzim ... 25
METODOLOGI PENELITIAN ... 28
Waktu dan Tempat Penelitian ... 28
Alat dan Bahan ... 28
Prosedur Penelitian ... 29
Pembuatan Media Inokulum, Inokulasi Aspergillus niger L-51 Produksi Enzim Selulase, dan Pembuatan Larutan Pereaksi ... 29
Pembuatan media inokulum ... 29
Inokulasi Aspergillus niger L-51 ... 29
ii
Pembuatan pereaksi untuk pengukuran aktivitas enzim selulase
Metode mandels ... 30
Pembuatan pereaksi untuk pengukuran kadar protein enzim Selulase metode lowry 30
Isolasi dan Pemurnian Enzim Selulase ... 31
Isolasi enzim Selulase ... 31
Pemurnian enzim Selulase ... 31
Fraksinasi dengan ammonium sulfat [(NH4)2SO4] ... 31
Dialisis ... 33
Uji Aktivitas Enzim Selulase ... 34
Pembuatan standar glukosa metode mandels ... 34
Uji aktivitas enzim selulase metode mandels ... 34
Penentuan kadar protein metode lowry ... 35
Modifikasi Kimia Enzim Selulase dengan Sitrakonat Anhidrida ... 35
Karakterisasi Enzim Selulase Hasil Pemurnian dan Hasil Modifikasi ... 36
Penentuan pH dan Suhu Optimum ... 36
Penentuan pH Optimum ... 36
Penentuan suhu optimum ... 36
Penentuan data kinetika enzim (nilai KM dan Vmaks) ... 36
Uji Stabilitas Termal dan Stabilitas pH Enzim (Yang et al., 1996) ... 37
Penentuan waktu paruh (t1/2), konstanta laju inaktivasi (ki), dan perubahan energi akibat denaturasi (∆Gi) ... 37
HASIL DAN PEMBAHASAN ... 40
Produksi dan Isolasi Enzim Selulase ... 40
Pemurnian Enzim Selulase ... 41
Fraksinasi menggunakan ammonium sulfat [(NH4)2SO4]... 41
Dialisis ... 43
Karakterisasi Enzim Selulase Hasil Pemurnian dan Hasil Modifikasi ... 44
Penentuan pH optimum enzim hasil pemurnian sebelum dan setelah Modifikasi ... 44
Penentuan suhu optimum enzim hasil pemurnian sebelum dan setelah modifikasi ... 47
Penentuan nilai KM dan Vmaks enzim hasil pemurnian sebelum dan setelah modifikasi ... 49
Stabilitas termal enzim hasil pemurnian sebelum dan setelah modifikasi dengan sitrakonat anhidrida ... 51
Perubahan Konstanta Laju Inaktivasi Termal (ki), Waktu Paruh(t1/2), Energi Akibat Denaturasi (ΔGi) Enzim Hasil Pemurnian Sebelum dan Setelah Modifikasi ... 53
Konstanta laju inaktivasi termal (ki) dan waktu paruh ... 54
iii
SIMPULAN DAN SARAN ... 57 Simpulan ... 57 Saran ... 58 DAFTAR PUSTAKA
1
I. PENDAHULUAN
A. Latar Belakang
Berkembangnya teknologi pemanfaatan enzim khususnya sebagai biokatalisator dalam industri pangan dan nonpangan, secara nyata dapat memberikan manfaat dan keuntungan bagi manusia (Reed, 1975; Wyk et al., 2003). Salah satu enzim yang memiliki peranan penting adalah enzim selulase. Enzim selulase dapat menghidrolisis selulosa menjadi glukosa yang dapat dimanfaatkan sebagai bahan baku pembuatan zat kimia lain seperti etanol, aseton, dan asam-asam organik sehingga memiliki nilai ekonomis yang lebih tinggi maupun sebagai sumber karbon dalam pertumbuhan bakteri untuk produksi antibiotik dan bermacam-macam enzim (Gunam et al., 2004). Enzim selulase dihasilkan secara
ekstraseluler oleh mikroba selulolitik dari golongan bakteri dan kapang (Duff and Murray, 1996). Menurut Purwadaria (2003), kemampuan kapang sebagai
2
lainnya yaitu mampu menghasilkan enzim selulase dengan komponen β
-glukosidase dalam jumlah tinggi.
Enzim selulase mengandung tiga komponen yang saling bekerjasama untuk menghidrolisis selulosa menjadi glukosa, yaitu enzim eksoglukanase,
endo-1,4-glukanase, dan β-glukosidase (Vrijc et al., 2002). Selulosa merupakan polimer
lurus dari β-1,4-D-Glukosa (Fessenden, 1992). Hidrolisis sempurna selulosa akan menghasilkan monomer selulosa yaitu glukosa, sedangkan hidrolisis tidak
sempurna akan menghasilkan disakarida dari selulosa yaitu selobiosa (Fan et al., 1982). Aplikasi nyata dari kerja enzim selulosa dapat dilihat pada berbagai industri diantaranya industri sakarifikasi bahan berselulosa, deterjen, industri makanan, dan pengolahan limbah pabrik kertas (Akiba et al., 1995). Penggunaan enzim dalam industri harus memenuhi beberapa kriteria khusus, antara lain
memiliki kestabilan pada kondisi suhu yang tinggi dan pH yang ekstrim (Goddette et al., 1993). Namun, secara umum enzim tidak tahan pada kondisi ekstrim,
hanya dapat sekali pakai dan hanya bekerja pada kondisi fisiologis. Untuk
mengatasi permasalahan tersebut, dapat dilakukan dengan meningkatkan stabilitas enzim yaitu dengan amobilisasi, modifikasi kimia, dan mutagenesis terarah
3
2005). Dengan adanya modifikasi kimia, struktur lisin akan terlindungi oleh gugus hidrofobik dari modifikator yang diharapkan dapat meminimalisir kontak enzim dengan air sehingga enzim lebih stabil.
Pada penelitian sebelumnya telah dilakukan modifikasi kimia enzim α-amilase menggunakan beberapa senyawa kimia, diantaranya dimetiladipimidat (Apriyanti, 2010), sitrakonat anhidrida (Sundari, 2011), dan asam glioksilat (Anggraini, 2011). Dari hasil penelitian tersebut diperoleh hasil bahwa modifikasi kimia
dapat meningkatkan stabilitas enzim α-amilase. Pada penelitian ini akan
dilakukan modifikasi kimia enzim selulase yang diisolasi dari Aspergillus niger L-51 menggunakan senyawa sitrakonat anhidrida dan diharapkan akan diperoleh peningkatan stabilitas enzim setelah dimodifikasi seperti pada penelitian
sebelumnya.
B. Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah :
1. Mengisolasi ekstrak kasar enzim selulase dari Aspergillus niger L-51 pada kondisi optimum sehingga diperoleh enzim yang memiliki aktivitas unit terbaik.
4
3. Meningkatkan stabilitas enzim selulase dengan modifikasi kmia
menggunakan sitrakonat anhidrida dengan variasi volume 20, 30, 40 dan 50 µL sehingga diperoleh enzim yang memiliki tingkat kestabilan terbaik yangdapat digunakan dalam bidang industri.
4. Melakukan karakterisasi enzim selulase hasil pemurnian dan hasil modifikasi meliputi penentuan pH dan suhu optimum, penentuan nilai kM dan Vmaks,
penentuan nilai ki, t1/2dan ΔGi. sehingga diperoleh informasi mengenai
pengaruh modifikasi dan pengaruh variasi penambahan volume sitrakonat anhidrida terhadap enzim selulase hasil pemurnian.
C. Manfaat Penelitian
Manfaat yang diperoleh dari penelitian ini adalah :
1. Memberikan informasi mengenai cara untuk meningkatkan stabilitas enzim selulase dengan metode modifikasi kimia menggunkan sitrakonat anhidrida. 2. Memberikan informasi mengenai pengaruh penambahan volume sitrakonat
anhidrida terhadap kestabilitas enzim selulase hasil pemurnian dari Aspergillus niger L-51.
5
II.TINJAUAN PUSTAKA
A. Enzim
Enzim merupakan katalisator protein yang mempercepat reaksi kimia dalam makhluk hidup atau dalam sistem biologik (Suhartono, 1992). Suatu enzim dapat mempercepat laju reaksi kira-kira 108 sampai 1011 kali lebih cepat dibandingkan dengan reaksi yang tidak dikatalisisis (Poedjiadi, 1994). Molekul enzim biasanya berbentuk bulat (globular), sebagian terdiri atas satu rantai polipeptida dan
sebagian lain terdiri dari lebih dari satu polipeptida (Wirahadikusumah, 1997) dan umumnya mempunyai berat molekul yang beraneka ragam berkisar 104–107 kDa (Dryer, 1993).
6
Kelebihan enzim dibandingkan katalis biasa adalah enzim bersifat spesifik dibandingkan dengan katalis anorganik, bekerja pada pH yang relatif netral dan suhu yang relatif rendah, aman, mudah dikontrol, dapat menggantikan bahan kimia yang berbahaya, serta dapat didegradasi secara biologis (Page, 1997). Enzim telah banyak digunakan dalam bidang industri pangan, farmasi dan industri kimia lainnya. Dalam bidang pangan misalnya amilase, glukosa-isomerase, papain dan bromelin. Sedangkan dalam bidang kesehatan contohnya amilase, lipase dan protease. Dalam banyak aplikasi bioteknologi, selulase digunakan dalam proses sakarifikasi bahan berselulosa, deterjen, industri makanan, dan pengolahan limbah pabrik kertas (Busto et al., 1995; Akiba et al., 1995). Enzim dapat diisolasi dari hewan, tumbuhan dan mikroorganisme. Namun, secara umum enzim diisolasi dari mikroorganisme karena pertumbuhan mikroorganisme relatif lebih cepat sehingga enzim yang dihasilkan lebih banyak.
1. Klasifikasi enzim
Klasifikasi enzim dapat dibedakan sebagai berikut :
a. Berdasarkan tempat bekerjanya enzim dibedakan menjadi dua, yaitu: 1. Endoenzim, disebut juga enzim intraseluler, yaitu enzim yang
bekerja di dalam sel.
2. Eksoenzim, disebut juga enzim ekstraseluler, yaitu enzim yang bekerja di luar sel.
7
dan nomor klasifikasi dari tiap enzim melukiskan reaksi yang dikatalisis berdasarkan IUPAC yaitu :
1. Oksidoreduktase, mengkatalisis reaksi oksidasi-reduksi, meliputi reaksi pemindahan elektron, hidrogen atau oksigen.
2. Transferase, mengkatalisis perpindahan gugus molekul dari suatu molekul ke molekul yang lain, seperti gugus amino, karbonil, metil, asil, glikosil atau fosforil.
3. Hidrolase, mengkatalisis pemutusan ikatan antara karbon dengan berbagai atom lain dengan adanya penambahan air.
4. Liase, mengkatalisis penambahan gugus fungsi dari suatu molekul tanpa melalui proses hidrolisis.
5. Isomerase, mengkatalisis reaksi isomerisasi.
6. Ligase, mengkatalisis reaksi penggabungan dua molekul dengan dibebaskannya molekul pirofosfat dari nukleosida trifosfat. c. Berdasarkan cara terbentuknya dibedakan menjadi dua, yaitu :
1. Enzim konstitutif, yaitu enzim yang jumlahnya dipengaruhi kadar substratnya, misalnya enzim amilase.
2. Enzim adaptif, yaitu enzim yang pembentukannya dirangsang oleh adanya substrat, contohnya enzim
8
2. Sifat katalitik enzim
Sifat-sifat katalitik dari enzim sebagai berikut :
a. Enzim mampu meningkatkan laju reaksi pada kondisi biasa (fisiologik) dari tekanan, suhu dan pH.
b. Enzim berfungsi dengan selektivitas tinggi terhadap substrat (substansi yang mengalami perubahan kimia setelah bercampur dengan enzim) dan jenis reaksi yang dikatalisis.
c. Enzim memberikan peningkatan laju reaksi yang tinggi dibanding dengan katalis biasa (Page, 1997).
3. Faktor yang mempengaruhi aktivitas enzim
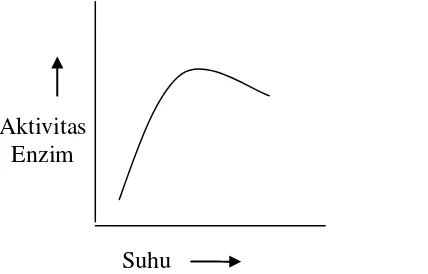
Beberapa faktor yang mempengaruhi aktivitas enzim sebagai berikut : a. Suhu
9
Gambar 1. Hubungan antara aktivitas enzim dengan suhu (Poedjiadi, 1994).
b. pH
Enzim pada umumnya bersifat amfolitik, yang berarti enzim mempunyai konstanta disosiasi pada gugus asam maupun gugus basanya, terutama pada gugus residu terminal karboksil dan gugus terminal aminonya, diperkirakan perubahan kereaktifan enzim akibat perubahan pH lingkungan (Winarno, 1986). Hubungan kecepatan reaksi dengan pH ditunjukkan pada Gambar 2.
Gambar 2. Hubungan kecepatan reaksi dengan pH (Page, 1997). pH optimum
pH Aktivitas
Suhu Aktivitas
10
c. Konsentrasi enzim
Konsentrasi enzim secara langsung mempengaruhi kecepatan laju reaksi enzimatik dimana laju reaksi meningkat dengan bertambahnya konsentrasi enzim (Poedjiadi, 1994). Laju reaksi tersebut meningkat secara linier selama konsentrasi enzim jauh lebih sedikit daripada konsentrasi substrat. Hal ini biasanya terjadi pada kondisi fisiologis (Page, 1997). Hubungan antara laju reaksi enzim dengan konsentrasi enzim ditunjukkan dalam Gambar 3.
Gambar 3. Hubungan antara laju reaksi dengan konsentrasi enzim (Page, 1997).
d. Konsentrasi substrat
11
e. Aktivator dan inhibitor
Beberapa enzim memerlukan aktivator dalam reaksi katalisnya.
Aktivator adalah senyawa atau ion yang dapat meningkatkan kecepatan reaksi enzimatis. Komponen kimia yang membentuk enzim disebut juga kofaktor. Kofaktor tersebut dapat berupa ion-ion anorganik seperti Zn, Fe, Ca, Mn, Cu atau Mg atau dapat pula sebagai molekul organik kompleks yang disebut koenzim (Martoharsono, 1984).
Menurut Wirahadikusumah (1997) inhibitor merupakan suatu zat kimia tertentu yang dapat menghambat aktivitas enzim. Pada umumnya cara kerja inhibitor adalah dengan menyerang sisi aktif enzim sehingga enzim tidak dapat berikatan dengan substrat dan fungsi katalitik enzim tersebut akan terganggu (Winarno, 1986).
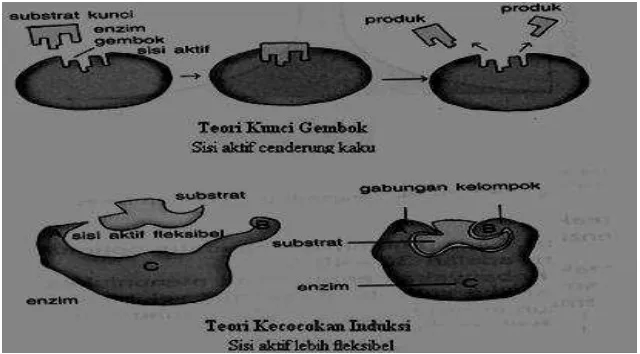
4. Teori pembentukan enzim-substrat
Cara kerja enzim dapat dijelaskan dengan dua teori, yaitu teori kunci-gembok (lock and key theory) dan teori kecocokan yang terinduksi (induced fit
12
Gambar 4. Teori kunci-gembok dan teori kecocokan induksi (Page, 1997).
Menurut teori kunci-gembok, enzim dan substrat bergabung bersama membentuk kompleks, seperti kunci yang masuk dalam gembok. Hal ini dikarenakan adanya kesesuaian bentuk ruang antara substrat dengan sisi aktif enzim, sehingga sisi aktif enzim cenderung kaku. Di dalam kompleks, substrat dapat bereaksi dengan energi aktivasi yang rendah. Setelah bereaksi, kompleks lepas dan melepaskan produk serta membebaskan enzim.
Sedangkan menurut teori kecocokan yang terinduksi, sisi aktif enzim
merupakan bentuk yang fleksibel. Ketika substrat memasuki sisi aktif enzim, bentuk sisi aktif termodifikasi melingkupi substrat membentuk kompleks. Ketika produk dihasilkan, maka enzim akan dilepaskan dalam bentuk bebas dan dapat bereaksi kembali dengan substrat yang baru.
B. Enzim Selulase
13
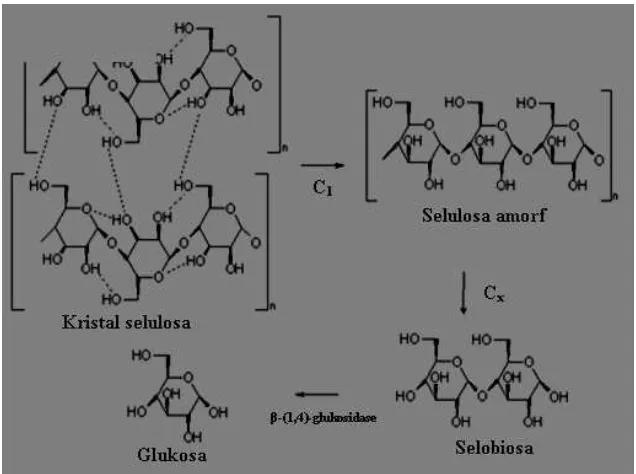
sistem multi-enzim yang terdiri dari tiga komponen. Untuk menghidrolisis selulosa yang tidak larut atau selulosa kristal diperlukan kerja sinergistik dari ketiga komponen enzim tersebut. Mekanisme hidrolisis selulosa oleh enzim selulase dapat dilihat dalam Gambar 5.
Gambar 5. Mekanisme hidrolisis selulosa oleh enzim selulase (Lee dan Koo, 2001).
Adapun ketiga komponen enzim tersebut yaitu :
1. Ekso-β-(1,4)-glukanase dikenal sebagai faktor C1. Faktor ini diperlukan
untuk menghidrolisis selulosa dalam bentuk kristal selulosa amorf. 2. Endo-β-(1,4)-glukanase dikenal sebagai faktor Cx. Faktor ini diperlukan
untuk menghidrolisis ikatan β-(1,4)-glukosida pada selulosa amorf menjadi
selobiosa.
14
C. Selulosa
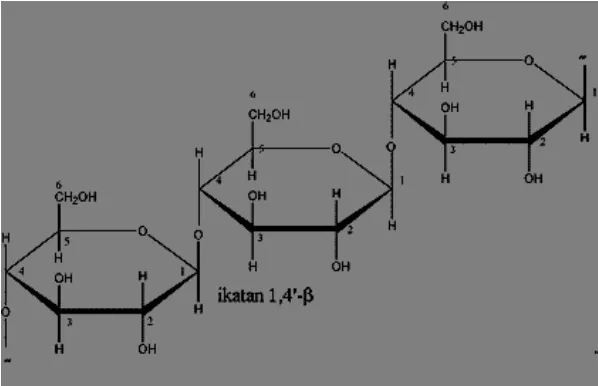
Selulosa merupakan senyawa organik yang paling melimpah di bumi,
diperkirakan sekitar 1011 ton selulosa dibiosintesis per tahun (Fessenden, 1992). Selulosa merupakan polisakarida yang terdiri atas satuan-satuan glukosa yang
terikat dengan ikatan β-1,4-glikosidik. Molekul selulosa merupakan mikrofibril
dari glukosa yang terikat satu dengan lainnya membentuk rantai polimer yang sangat panjang (Fan et al., 1982).
Rumus empiris selulosa adalah (C6H10O5)n, dengan banyaknya satuan glukosa
yang disebut derajat polimerisasi (DP), dimana jumlahnya mencapai 1.200-10.000 dan panjang molekul sekurang-kurangnya 5.000 nm. Berat molekul selulosa rata-rata sekitar 400.000 (Sjostrom, 1995). Adapun struktur selulosa dapat dilihat pada Gambar 6.
15
Berdasarkan strukturnya, selulosa dapat saja diharapkan mempunyai kelarutan yang tinggi dalam air, akan tetapi dalam kenyataannya selulosa tidak larut dalam air, bahkan pelarut lainnya. Hal ini disebabkan oleh tingginya rigiditas rantai dan gaya rantai akibat ikatan hidrogen antara gugus –OH pada rantai berdekatan. Faktor ini dipandang sebagai penyebab tingginya kekristalan dari serat selulosa (Cowd and Stark, 1991).
D. Aspergillus niger
Aspergillus niger merupakan fungi dari filum ascomycetes yang berfilamen,
mempunyai hifa berseptat, dan dapat ditemukan melimpah di alam. Fungi ini biasanya diisolasi dari tanah, sisa tumbuhan dan udara di dalam ruangan.
Koloninya berwarna putih pada agar dekstrosa kentang (PDA) 25oC dan berubah menjadi hitam ketika konidia dibentuk. Kepala konidia dari Aspergillus niger berwarna hitam, bulat, cendrung memisah menjadi bagian-bagian yang lebih longgar seiring dengan bertambahnya umur (Rao, 1994). Gambar Aspergillus niger dapat dilihat pada Gambar 7.
16
Aspergillus niger dapat tumbuh optimum pada suhu 35-37oC, dengan suhu minimum 6-8oC, dan suhu maksimum 45-47oC. Selain itu, dalam proses pertumbuhannya fungi ini memerlukan oksigen yang cukup (aerobik). Dalam metabolismenya Aspergillus niger banyak digunakan sebagai model fermentasi karena fungi ini tidak menghasilkan mikotoksin sehingga tidak membahayakan. Aspergillus niger dapat tumbuh dengan cepat, oleh karena itu banyak digunakan
secara komersial dalam produksi asam sitrat, asam glukonat, dan pembuatan enzim selulase (Dwidjoseputro, 2005).
E. Isolasi dan Pemurnian Enzim Selulase
Enzim selulase merupakan enzim ekstraseluler yang dihasilkan oleh mikroba selulolitik (Duff and Murray, 1996). Enzim ekstraseluler merupakan enzim yang diproduksi di dalam sel namun bekerja di luar sel, sehingga mudah diisolasi dan dipisahkan dari pengotor lain serta tidak banyak bercampur dengan bahan-bahan sel lain ( Pelczar and Chan, 1986 ).
1. Sentrifugasi
17
Prinsip sentrifugasi berdasarkan pada kenyataan bahwa setiap partikel yang berputar pada laju sudut yang konstan akan memperoleh gaya keluar (F). Besar gaya ini bergantung pada laju sudut ω (radian/detik) dan radius pertukarannya (sentimeter).
F = ω2 r
Gaya F dipengaruhi oleh gaya gravitasi bumi, karena itu dinyatakan sebagai gaya sentrifugal relatif (RCF dengan satuan g (gravitasi).
RCF = 980
2 r
Dalam praktiknya, alat sentrifugasi dioperasikan dengan laju rpm. Oleh sebab itu, harga rpm dikonversikan kedalam bentuk radian menggunakan persamaan: (Cooper, 1997 dalam Sariningsih, 2000).
2. Fraksinasi menggunakan ammonium sulfat [(NH4)2SO4]
18
ion, kelarutan enzim akan semakin besar atau disebut dengan peristiwa salting in, setelah mencapai suatu titik tertentu, dimana kandungan garam semakin tinggi akan menyebabkan kelarutan protein semakin menurun dan terjadi proses pengendapan protein. Peristiwa pengendapan protein ini disebut salting out (Wirahadikusumah, 1989). Pada kekuatan ion rendah, protein akan
terionisasi sehingga interaksi antar protein akan menurun dan kelarutan akan meningkat. Peningkatan kekuatan ion ini meningkatkan kadar air yang terikat pada ion, dan jika interaksi antar ion kuat, kelarutannya menurun akibatnya interaksi antar protein lebih kuat dan kelarutannya menurun (Agustien and Munir, 1997)
Senyawa elektrolit yang sering digunakan untuk mengendapkan protein ialah ammonium sulfat. Kelebihan ammonium sulfat dengan dibandingkan dengan senyawa-senyawa elektrolit lain ialah memiliki kelarutan yang tinggi, tidak mempengaruhi aktivitas enzim, mempunyai daya pengendap yang efektif, efek penstabil terhadap kebanyakan enzim, dapat digunakan pada berbagai pH dan harganya murah (Scopes, 1982).
3. Dialisis
diputar-19
putar. Selama proses tersebut, molekul kecil yang ada di dalam larutan protein atau enzim seperti garam anorganik akan keluar melewati pori-pori membran, sedangkan molekul protein atau enzim yang berukuran besar tetap tertahan dalam kantung dialisis. Keluarnya molekul menyebabkan distribusi ion-ion yang ada di dalam dan di luar kantung dialisis tidak seimbang. Untuk memperkecil pengaruh ini digunakan larutan bufer dengan konsentrasi rendah di luar kantung dialisis (Lehninger, 1982). Setelah tercapai keseimbangan, larutan di luar kantung dialisis diganti dengan larutan yang baru agar konsentrasi ion-ion di dalam kantung dialisis dapat dikurangi.
Proses ini dapat dilakukan secara terus menerus sampai ion-ion di dalam kantung dialisis dapat diabaikan (Mc Phie, 1971 dalam Boyer 1993). Difusi zat terlarut bergantung pada suhu dan viskositas larutan. Meskipun suhu tinggi dapat meningkatkan laju difusi, namun sebagian besar protein dan enzim stabil pada suhu 4-8°C sehingga dialisis harus dilakukan di dalam ruang dingin (Pohl, 1990).
F. Pengujian Aktivitas Selulase dengan Metode Mandels
Pengujian aktivitas selulase dilakukan dengan metode Mandels (Mandels et al.,1976), yaitu berdasarkan pembentukan glukosa dari substrat Carboxymethyl Cellulase (CMC) oleh enzim selulase yang dideteksi dengan penambahan pereaksi
20
G. Penentuan Kadar Protein dengan Metode Lowry
Salah satu metode yang digunakan untuk menentukan kadar protein adalah metode Lowry. Metode ini bekerja pada lingkungan alkali dan ion tembaga (II) bereaksi membentuk kompleks dengan protein. Selanjutnya reagen
folin-ciocelteau yang ditambahkan akan mengikat protein. Ikatan ini secara perlahan akan mereduksi reagen folin menjadi heteromolibdenum dan merubah warna larutan dari kuning menjadi biru keunguan.
Pada metode ini, pengujian kadar protein didasarkan pada pembentukan komplek Cu2+ dengan ikatan peptida yang akan tereduksi menjadi Cu+ pada kondisi basa. Cu+ dan rantai samping tirosin, triptofan, dan sistein akan bereaksi dengan reagen folin-ciocelteau. Reagen ini bereaksi menghasilkan produk yang tidak stabil yang tereduksi secara lambat menjadi molybdenum atau tungesteen blue. Protein akan menghasilkan intensitas warna yang berbeda tergantung pada kandungan triptofan dan tirosinnya.
Metode ini relatif sederhana dan dapat diandalkan serta biayanya relatif murah. Namun, kekurangan dari metode ini adalah sensitif terhadap perubahan pH dan konsentrasi protein yang rendah. Untuk mengatasi hal tersebut dapat dilakukan dengan menggunakan volume sampel dalam jumlah kecil sehingga tidak
mempengaruhi reaksi (Lowry et al., 1951).
H. Modifikasi Kimia
21
mutagenesis terarah. Modifikasi kimia merupakan metode yang lebih disukai untuk mendapatkan enzim yang stabil. Hal ini dikarenakan dalam amobilisasi enzim, terjadi penghambatan transfer massa oleh matriks pengamobil sehingga menyebabkan terjadinya penurunan kapasitas pengikatan maupun reaktivitas enzim. Sedangkan mutagenesis terarah memerlukan informasi yang lengkap mengenai struktur primer dan struktur tiga dimensi enzim tersebut.
Menurut Janecek (1993), modifikasi kimia merupakan salah satu metode yang dapat digunakan untuk meningkatkan stabilitas enzim yang larut dalam air. Keunggulan dari metode modifikasi kimia dibandingkan dengan metode amobilisasi enzim adalah : (1) interaksi antara enzim dengan substrat tidak terhalangi oleh adanya matriks yang tidak larut, sehingga penurunan aktivitas enzim dapat ditekan. (2) Pada proses amobil, mekanisme kerja enzim yang digunakan dalam bidang klinik selama interaksi dengan reseptor atau komponen lain dari membran seluler, kemungkinan berubah karena keberadaan matriks pendukung (Nubarov et al., 1987).
Untuk mendapatkan enzim hasil modifikasi kimia dengan ikatan kovalen yang stabil menurut Mozhaev et al., (1990), adalah dengan melakukan : (1) modifikasi dengan menggunakan pereaksi bifungsional (pembentukan ikatan silang antara gugus-gugus fungsi pada permukaan protein), (2) modifikasi kimia dengan menggunakan pereaksi nonpolar (meningkatkan interaksi hidrofobik), (3)
22
Menurut Nubarov et al., (1987), hidrofilisasi permukaan enzim dapat dilakukan dengan dua cara modifikasi langsung berbagai asam amino hidrofobik yang membentuk tapak-tapak hidrofobik pada permukaan enzim dengan pereaksi hidrofilik, atau hidrofilisasi terhadap asam amino yang berada dekat dengan tapak hidrofobik sehingga tapak tersebut terlindungi dari lingkungan berair.
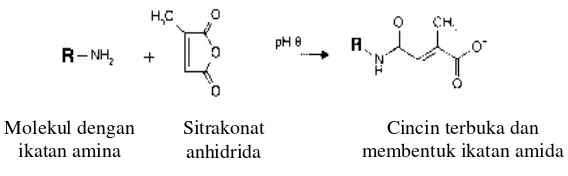
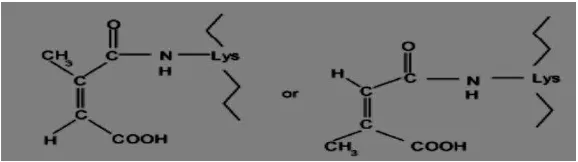
Dalam penelitian yang telah dilakukan oleh Khajeh et al., (2004), dijelaskan bahwa senyawa sitrakonat anhidrida merupakan reagen spesifik yang digunakan untuk memblok gugus amino pada residu lisin. Modifikator ini menghasilkan dua produk ikatan peptida yang dibentuk dari kedua gugus karbonil pada struktur molekulnya yang ditunjukkan dalam Gambar 8.
Gambar 8. Reaksi sitrakonat anhidrida dan gugus amina (Sundari, 2011).
Reaksi modifikasi ini diawali dengan pembukaan cincin sitrakonat anhidrida dengan suasana basa pada pH 8 dan kemudian gugus karbonil dari sitrakonat anhidrida berikatan dengan gugus amino pada residu lisin. Gambar 9
menunjukkan reaksi yang terjadi antara sitrakonat dengan gugus amino suatu protein seperti yang telah dilaporkan oleh Khajeh et al., (2004).
Molekul dengan ikatan amina
Sitrakonat anhidrida
23
Gambar 9. Modifikasi gugus amina suatu residu lisin dalam protein oleh sitrakonat anhidrida (Sundari, 2011).
I. Kinetika Reaksi Enzim
Parameter dalam kinetika reaksi enzim adalah konstanta Michaelis-Menten (KM) dan laju reaksi maksimum (Vmaks). Berdasarkan postulat Michaelis dan
Menten pada suatu reaksi enzimatis terdiri dari beberapa fase yaitu
pembentukan kompleks enzim substrat (ES), dimana E adalah enzim dan S adalah substrat, modifikasi dari substrat membentuk produk (P) yang masih terikat dengan enzim (EP), dan pelepasan produk dari molekul enzim (Shahib, 2005).
Setiap enzim memiliki sifat dan karakteristik yang spesifik seperti yang ditunjukkan pada sifat spesifisitas interaksi enzim terhadap substrat yang dinyatakan dengan nilai tetapan Michaelis-Menten (KM). Nilai KM
didefinisikan sebagai konsentrasi substrat tertentu pada saat enzim mencapai kecepatan setengah kecepatan maksimum. Setiap enzim memiliki nilai KM
dan Vmaks yang khas dengan substrat spesifik pada suhu dan pH tertentu
(Kamelia et al., 2005). Nilai KM yang kecil menunjukkan bahwa kompleks
24
sedangkan jika nilai KM suatu enzim besar maka enzim tersebut memiliki
afinitas rendah terhadap substrat (Page, 1997).
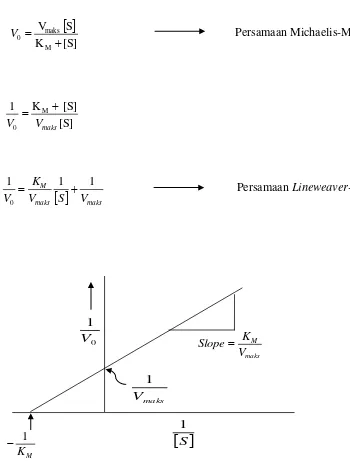
Nilai KM suatu enzim dapat dihitung dengan persamaan Lineweaver-Burk
yang diperoleh dari persamaan Michaelis-Menten yang kemudian dihasilkan suatu diagram Lineweaver-Burk yang ditunjukkan Gambar 9 (Page, 1997).
Gambar 10. Diagram Lineweaver-Burk ( Suhartono, 1989).
25
J. Stabilitas Enzim
Menurut Kazan et al., (1997), stabilitas enzim dapat diartikan sebagai kestabilan aktivitas enzim selama penyimpanan dan penggunaan enzim tersebut, serta kestabilan terhadap senyawa yang bersifat merusak seperti pelarut tertentu (asam atau basa), oleh pengaruh suhu dan kondisi – kondisi nonfisiologis lainnya.
Terdapat dua cara yang dapat dilakukan untuk mendapatkan enzim yang
mempunyai stabilitas tinggi, yaitu menggunakan enzim yang memiliki stabilitas ekstrim alami dan mengusahakan peningkatan stabilitas enzim yang secara alami tidak atau kurang stabil, salah satunya adalah dengan cara memodifikasi enzim menggunakan zat kimia tertentu.
1. Stabilitas termal enzim
Pada suhu yang terlalu rendah stabilitas enzim tinggi, namun aktivitasnya rendah, sedangkan pada suhu yang terlalu tinggi aktivitas enzim tinggi, tetapi kestabilannya rendah. Kenaikan suhu akan mempengaruhi kecepatan laju reaksi enzim, namun hanya sampai batas tertentu dan selanjutnya akan terjadi proses denaturasi protein. Daerah suhu saat stabilitas dan aktivitas enzim cukup besar disebut suhu optimum untuk enzim tersebut (Wirahadikusumah, 1997).
26
merupakan masalah utama dalam stabilitas enzim, karena enzim umumnya tidak stabil pada suhu tinggi.
Proses inaktivasi enzim pada suhu tinggi berlangsung dalam dua tahap, yaitu: a. Adanya pembukaan partial (partial unfolding) struktur sekunder, tersier,
atau kuartener molekul enzim.
b. Perubahan struktur primer enzim karena adanya kerusakan asam amino - asam amino tertentu oleh panas (Ahern and Klibanov, 1987).
Air memegang peranan penting pada kedua tahap di atas. Oleh karena itu, dengan menggunakan air seperti pada kondisi mikroakuos, reaksi inaktivasi oleh panas dapat diperlambat dan stabilitas termal enzim akan meningkat.
Stabilitas termal enzim akan jauh lebih tinggi dalam kondisi kering dibandingkan dalam kondisi basah. Adanya air sebagai pelumas membuat konformasi suatu molekul enzim menjadi sangat fleksibel, sehingga bila air dihilangkan molekul enzim akan menjadi lebih kaku (Virdianingsih, 2002).
2. Stabilitas pH enzim
27
28
III. METODELOGI PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini akan dilakukan pada bulan Mei-November 2013 di Laboraturium Biokimia Jurusan Kimia, Laboraturium Instrumentasi Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung serta
Laboraturium Biomassa terpadu Universitas Lampung.
B. Alat dan Bahan
Alat-alat yang digunakan pada penelitian ini adalah alat-alat gelas, pembakar spiritus, jarum ose, kertas pH universal, mikropipet Eppendroff, neraca analitik, termometer, magnetic stirrer, lemari pendingin, kantong selofan, batang pengaduk kaca, kompor gas, sentrifuga, autoclave model S-90N, oven, penangas, waterbath shaker incubator STUART SSL2, laminar air flow CRUMA model 9005-FL, waterbath incubator HAAKE dan spektrofotometer UV-VIS Cary Win UV 32.
Adapun bahan-bahan yang digunakan adalah Potato Dextrose Agar (PDA), (NH4)2SO4, KH2PO4, CaCl2, MgSO4, urea, FeSO4.7H2O, ZnSO4.7H2O, CoCl2,
pepton, glukosa, NaOH, Na2CO3, CuSO4.5H2O, Carboxymethyl Cellulase (CMC),
29
asam sitrat, pereaksi DNS (dinitrosalisilic acid), fenol, Na2SO3, alkohol, Bovine
Serum Albumin (BSA), dan sitrakonat anhidrida (Merck kode produk:
8413210100). Adapun mikroorganisme yang digunakan adalah jamur Aspergillus niger L-51 penghasil enzim selulase yang diperoleh dari Laboraturium
Mikrobiologi dan Teknologi Bioproses Jurusan Teknik Kimia Institut Teknologi Bandung.
C. Prosedur Penelitian
1. Pembuatan Medium Inokulum, Inokulasi Aspergillus niger L-51, Produksi Enzim selulase dan Pembuatan Larutan Pereaksi
a. Pembuatan medium inokulum
Medium inokulum yang digunakan (gL-1) terdiri dari (NH4)2SO4 1,4;
KH2PO4 2,0; urea 0,3; CaCl2 0,3; MgSO4 0,3; FeSO4.7H2O 0,005;
ZnSO4.7H2O 0,0014; CoCl2 0,002; pepton 0,75; glukosa 7,5 yang
dilarutkan dalam bufer fosfat pH 5,5, kemudian disterilkan pada suhu 121oC, tekanan 1 atm, selama 15 menit dalam autoclave.
b. Inokulasi Aspergillus niger L-51
30
c. Produksi enzim selulase
Produksi enzim selulase dilakukan dengan memindakan secara aseptis 20 mL (2% dari total volume media fermentasi) ke dalam media fermentasi yang terdiri dari (g.L-1) (NH4)2SO4 1,4; KH2PO4 2,0; urea 0,3; CaCl2
0,3; MgSO4 0,3; FeSO4.7H2O 0,005; ZnSO4.7H2O 0,0014; CoCl2
0,002; pepton 0,75; CMC 7,5, dilarutkan dalam bufer fosfat pH 5. Selanjutnya media fermentasi yang telah berisi 2% medium inokulum dikocok dalam waterbath shaker incubator dengan kecepatan 130 rpm pada suhu 32oC selama 64 jam.
d. Pembuatan pereaksi untuk pengukuran aktivitas enzim selulase metode Mandels (Mandels et al, 1976)
Ke dalam labu ukur 100 ml, dimasukkan 1% DNS (dinitrosalisilic acid), 1% NaOH, 1 mL Na(K) tartarat 40%, 0,2% fenol, dan 0,05% Na2SO3,
kemudian dilarutkan dalam 100 mL akuades hingga tanda batas.
e. Pembuatan pereaksi untuk penentuan kadar protein enzim selulase metode Lowry
Pereaksi A : 2 gram Na2CO3 dilarutkan dalam 100 mL NaOH
0,1 N.
Pereaksi B : 5 mL larutan CuSO4.5H2O 1% ditambahkan ke
dalam 5 mL larutan Na(K) tartarat 1%.
Pereaksi C : 2 mL pereksi B ditambahkan 100 mL pereaksi A Pereaksi D : reagen folin ciocelteau diencerkan dengan akuades
31
Larutan standar : larutan BSA (Bovine Serum Albumin) dengan kadar 0, 20, 40, 60, 80, 100, 120, dan 140 ppm.
2. Isolasi dan Pemurnian Enzim Selulase
a. Isolasi enzim selulase
Isolasi enzim selulase dilakukan menggunakan metode sentrifugasi. Prinsip sentrifugasi berdasarkan kecepatan sedimentasi dengan cara pemusingan. Sentrifugasi digunakan untuk memisahkan enzim
ekstraseluler dari sisa-sisa sel. Sentrifugasi dilakukan pada suhu rendah (di bawah suhu kamar) untuk menjaga kehilangan aktivitas enzim (Suhartono, 1989). Setelah media fermentasi yang berisi Aspergillus niger L-51 dikocok menggunakan Waterbath shaker incubator pada suhu 32oC selama 64 jam, selanjutnya enzim dipisahkan dari komponen sel lainnya dengan sentrifugasi pada kecepatan 5000 rpm dan suhu 4oC selama 25 menit. Filtrat yang diperoleh merupakan ekstrak kasar enzim yang selanjutnya dilakukan uji aktivitas enzim selulase dengan metode Mandels serta pengukuran kadar protein dengan metode Lowry.
b. Pemurnian enzim selulase
Pemurnian enzim selulase dilakukan dengan 2 tahap, yaitu fraksinasi menggunakan ammonium sulfat dan dialisis.
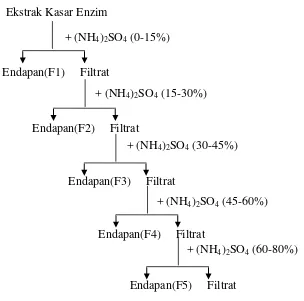
1. Fraksinasi dengan ammonium sulfat [(NH4)2SO4]
32
33
Gambar 11. Skema pengendapan protein enzim dengan ammonium sulfat.
2. Dialisis
Endapan enzim yang telah dilarutkan dari tiap fraksi amonium sulfat dengan aktivitas spesifik tertinggi dimasukkan ke dalam kantong selofan dan didialisis dengan bufer fosfat 0,01 M pH 6 selama 24 jam pada suhu dingin (Pohl, 1990). Selama dialisis, dilakukan pergantian bufer setiap 6 jam agar konsentrasi ion-ion di dalam kantong dialisis dapat dikurangi. Proses ini dilakukan secara kontinyu sampai ion-ion di dalam kantong dialisis dapat diabaikan. Selanjutnya dilakukan uji aktivitas dengan metode Mandels, serta diukur kadar proteinnya dengan metode Lowry.
+ (NH4)2SO4 (0-15%)
+ (NH4)2SO4 (15-30%)
Ekstrak Kasar Enzim
Endapan(F1) Filtrat
Endapan(F2) Filtrat
Endapan(F3) Filtrat
+ (NH4)2SO4 (30-45%)
Endapan(F4) Filtrat
+ (NH4)2SO4 (45-60%)
+ (NH4)2SO4 (60-80%)
34
3. Uji Aktivitas Enzim Selulase
a. Pembuatan standar glukosa metode Mandels
Standar glukosa dibuat dengan variasi konsentrasi 0-1,4 mg/mL. Sebanyak 0,25 mL akuades, 0,25 larutan glukosa konsentrasi 0-1,4 mg/mL dalam bufer fosfat pH 5,0 dicampur lalu diinkubasi selama 60 menit pada suhu 50oC. Kemudian ditambahkan 1 mL pereaksi DNS dan dididihkan selama 10 menit pada penangas air. Selanjutnya ditambahkan 1,5 mL akuades lalu
didinginkan. Setelah dingin, serapannya diukur menggunakan
spektrofotometer UV-VIS pada 510 nm. Selanjutnya, absorbansi masing-masing larutan diplotkan terhadap konsentrasinya sehingga diperoleh nilai slope, intercept, dan R2.
b. Uji aktivitas enzim selulase metode Mandels (Mandels et al., 1976)
Metode ini didasarkan pada glukosa yang terbentuk (Mandels et al., 1976). Sebanyak 0,25 mL enzim, 0,25 larutan CMC 0,5% dalam bufer fosfat pH 5,0 dicampur lalu diinkubasi selama 60 menit pada suhu 50oC. Kemudian ditambahkan 1 mL pereaksi DNS dan dididihkan selama 10 menit pada penangas air. Selanjutnya ditambahkan 1,5 mL akuades lalu didinginkan. Setelah dingin, serapannya diukur menggunakan spektrofotometer UV-VIS
pada 510 nm. Kadar glukosa yang terbentuk ditentukan dengan
35
c. Penentuan kadar protein metode Lowry (Lowry et al., 1951)
Kadar protein enzim ditentukan dengan metode Lowry (Lowry et al., 1951). Sebanyak 0,1 mL enzim selulase ditambahkan 0,9 mL akuades lalu
direaksikan dengan 5 mL pereaksi C dan diaduk rata. Kemudian dibiarkan selama 10 menit pada suhu ruang. Setelah itu ditambahkan dengan cepat 0,5 mL pereaksi D dan diaduk dengan sempurna, didiamkan selama 30 menit pada suhu kamar. Untuk kontrol, 0,1 mL enzim diganti dengan 0,1 mL akuades, selanjutnya perlakuannya sama seperti sampel. Serapannya diukur menggunakan spektrofotometer UV-Vis pada panjang gelombang 750 nm. Untuk menentukan konsentrasi protein enzim digunakan kurva standar BSA (Bovine Serum Albumin). Penentuan kadar protein enzim selulase dengan menggunakan metode Lowry ini dilakukan pada tahap isolasi dan pemurnian.
4. Modifikasi Kimia Enzim Selulase dengan Sitrakonat Anhidrida
Residu lisin pada suatu enzim secara spesifik dapat dimodifikasi dengan sitrakonat anhidrida yang prosedurnya telah dilaporkan oleh Khajeh et al., (2001). Sebanyak 10 mL enzim hasil pemurnian dalam 10 mL larutan bufer fosfat pH 8 ditambahkan reagen sitrakonat anhidrida sebanyak 20 L secara bertahap. Setiap penambahan reagen, pH larutan dijaga konstan pada pH 8 dengan menambahkan larutan Na2HPO4. 7H2O lalu diaduk mengunakan
36
5. Karakterisasi Enzim Selulase Hasil Pemurnian dan Hasil Modifikasi
Karakterisasi enzim selulase hasil pemurnian dan hasil modifikasi yang dilakukan meliputi :
a. Penentuan pH dan suhu optimum 1) Penentuan pH optimum
Untuk mengetahui pH optimum enzim sebelum dan sesudah modifikasi digunakan bufer sitrat 0.1 M dan bufer fosfat 0,1 M dengan variasi pH sebagai berikut : 4; 4,5; 5; 5,5; 6; 6,5; 7; 7,5 dan 8. Suhunya dijaga tetap pada 50°C, kemudian dilanjutkan dengan pengukuran aktivitas enzim dengan metode Mandels dan kadar proteinnya dengan metode Lowry.
2) Penentuan suhu optimum
Untuk mengetahui suhu optimum kerja enzim dilakukan dengan variasi suhu yaitu 45; 50; 55; 60; 65; 70, 75 dan 80°C, pH tetap dijaga pada pH optimum. Selanjutnya diukur aktivitas enzim dengan metode Mandels dan kadar proteinnya dengan metode Lowry.
b. Penentuan data kinetika enzim (nilai KM dan Vmaks)
Konstanta Michaelis-Menten (KM) dan laju reaksi maksimum (Vmaks)
enzim sebelum dan sesudah modifikasi ditentukan dari kurva Lineweaver-Burk. Kurva Lineweaver-Burk dibuat dengan menguji
37
0,6; 0,8 dan 1% dalam bufer fosfat pH 5 dan suhu 50oC selama 60 menit. Selanjutnya diukur aktivitas enzim dengan metode Mandels.
c. Uji stabilitas termal dan stabilitas pH enzim (Yang et al., 1996)
Penentuan stabilitas termal enzim dilakukan dengan mengukur aktivitas sisa enzim setelah diinkubasi selama periode waktu 100 menit pada pH dan suhu optimum hasil penentuan sebelumnya. Caranya adalah dengan mengukur aktivitas enzim menggunakan metode Mandels setelah proses pemanasan setiap interval waktu 10 menit. Aktivitas awal enzim (tanpa proses pemanasan) diberi nilai 100%.
Aktivitas sisa =
d. Penentuan waktu paruh (t1/2), konstanta laju inaktivasi (ki) dan
perubahan energi akibat denaturasi (∆Gi)
Penentuan nilai ki (konstanta laju inaktivasi termal) enzim selulase hasil
pemurnian dan hasil modifikasi kimia dilakukan dengan menggunakan persamaan kinetika inaktivasi orde 1 (Kazan et al., 1997) yaitu :
ln (Ei/E0) = - ki t
Sedangkan untuk perubahan energi akibat denaturasi (∆Gi) enzim hasil
pemurnian dan hasil modifikasi kimia dilakukan dengan menggunakan persamaan (Yandri et al., 2007) :
38
Keterangan :
R = konstanta gas (8,315 J K-1 mol-1) T = suhu absolut (K)
ki = konstanta laju inaktivasi termal
h = konstanta Planck (6,63 x 10-34 J det) kB = konstanta Boltzmann (1,381 x 10-23 JK-1)
39
Gambar 12. Diagram alir penelitian. Ekstrak kasar enzim selulase
Enzim hasil pemurnian
Enzim hasil pemurnian Modifikasi kimia
58
V. SIMPULAN DAN SARAN
A. Simpulan
Dari hasil penelitian ini dapat diambil beberapa kesimpulan sebagai berikut : 1. Ekstrak kasar enzim selulase yang digunakan dalam penelitian ini dihasilkan
setelah diinkubasi selama 64 jam pada pH 5 dan suhu 320C, memiliki aktivitas Unit sebesar 0,5189.
2. Aktivitas spesifik enzim selulase hasil pemurnian 40,6094 U/mg, meningkat 13 kali dibandingkan dengan ekstrak kasar enzim yang mempunyai aktivitas spesifik 3,1046 U/mg.
3. Enzim hasil pemurnian mempunyai pH optimum 4,5; suhu optimum 50oC ; KM
= 79,96 mg/mL substrat ; Vmaks = 10,14 μmol/mL.menit ; ki = 0,0277 menit-1;
t1/2 = 25,02 menit ; ΔGi = 99,96 kJ/mol.
4. Enzim hasil modifikasi dengan sitrakonat anhidrida 20 μL;30μL; 40μL dan
50μL mempunyai pH optimum 4; suhu optimum 50oC ; KM berturut-turut
sebagai berikut: 124,24 mg/mL; 22,11 mg/mL; 36,27 mg/mL dan 4877 mg/mL; Vmaks berturut-turut sebagai berikut: 7,22 μmol/mL.menit; 1,47
μmol/mL.menit; 2,54 μmol/mL.menit dan2,99 μmol/mL.menit; ki
58
27,94; ΔGi berturut-turut sebagai berikut : 100,81 kJ/mol; 101,38 kJ/mol;
100,74 kJ/mol dan 100,25 kJ/mol.
5. Pada penelitian ini, berdasarkan nilai ki,t1/2 dan ΔGi enzim yang dimodifikasi
dengan sitrakonat anhidrida 30 µL memiliki tingkat kestabilan tertinggi.
6. Peningkatan stabilitas enzim selulase dari Aspergillus niger L-51, meliputi kestabilan terhadap pH, suhu dan uji stabilitas termal dapat dilakukan dengan cara modifikasi kimia menggunakan sitrakonat anhidrida sehingga dapat diperoleh enzim dengan stabilitas tinggi dan dapat digunakan dalam proses industri yang membutuhkan lingkungan ekstrim.
B. Saran
59
DAFTAR PUSTAKA
Ahern, T.J. and A.M. Klibanov. 1987. Why do enzyme irreversibly inactive at high temperature. Biotec 1. Microbial Genetic Engineering and Enzyme Technology. Gustav Fischer. Stuttgart. New York.
Akiba, S., Y. Kiniura, K. Yamamoto, H. Kumagai. 1995. Purification and characterization of a protease.resistant cellulase from Aspergillus niger. Bioengineering. 79:125-130.
Anggraini, N. 2011. Peningkatan Kestabilitas Enzim α-amilase dari Bacillus subtilis ITBCCB148 Dengan Modifikasi Kimia Menggunakan Asam Glioksilat. (Skripsi). Universitas Lampung. Bandar Lampung.
Apriyanti. 2010. Peningkatan Kestabilitas Enzim α-amilase dari Bacillus subtilis ITBCCB148 Dengan Modifikasi Kimia Menggunakan Dimetiladipimidat. (Skripsi). Universitas Lampung. Bandar Lampung.
Boyer, R.F. 1993. Modern Experimental Biochemistry. Benjamin Cumming Publising Company. California.
Busto, M.D., N. Ortega, M. Perez-Mateos. 1995. Induction of β-glukosidase in fungal and soil bacterial cultures. Soil Biology and Biochemistry. 27: 949-954.
Duff, S.J.B and Murray, W.D. 1996. Bioconvertion of forest products industry waste cellulosics to fuel ethanol: a review. Bioresource Technology. 55. 1–33.
60
Eijnsink, G.H., Sirgit, G. Torben, V. Bertus van de Burg. 2005. Directed Evolution of Enzyme Stability. Biomolecular Engineering. Elsevier Science Inc. New York. 23:21-30.
Fan, L.T., Y.H. Lee, M.M. Gharpuray. 1982. The nature of lignocellulosics and their pretreatment for enzymztic hydrolysis. Advances in Biochemical Engineering. 23: 158-187.
Fessenden,R.J. and Fessenden, J.S. 1992. Kimia Organik Jilid II. Erlangga. Jakarta. 395-396.
Francis, G.E., C. Delgado and D. Fisher. 1992. PEG-modified Proteins In Stability of Protein Pharmaceuticals Part B. Ahern, T.J. and M. C. Manning editor. Plenum Press. New York. 246-247.
Goddete, D.W, C. Terri, F.L. Beth, L. Maria, R.M. Jonathan, P.Christian, B.R. Robert, S.Y.Shiow, C.R. Wilson. 1993. Strategy and implementation of a system for protein engineering. Journal of Biotechnology. 28: 41-54.
Gunam, I.B.W, Hardiman, T. Utami, 2004. Chemical Pretreatments on Bagasse to Enhance Hydrolysis of Its Cellulose Enzymatically. The 3th Hokkaido Indonesian Student Association Scientific meeting (HISAS 3). Sapporo.
Janecek, S. 1993. Strategies for Obtaining Stable Enzymes. Process Biochemistry. 28. 435-445.
Junita. 2002. Mempelajari Stabilitas Termal Enzim Protease dari Bacillus stearothermophillus Dalam Pelarut Heksana, Toluena, dan Benzena. (Skripsi). Institut Pertanian Bogor. Bogor.
Kamelia,R, Muliawati S, Dessy N. 2005. Isolasi dan karakterisasi protease intraseluler termostabil dari Bakteri Bacillus stearothermophilus RP1. Seminar Nasional MIPA. Departemen Kimia. Institut Pertanian Bogor. Bogor.
61
Khajeh, K, Naderi-Manesh, H., Ranjbar, B., Moosavi-Movahedi, A. A, Nemat-Gorgani, M. 2001. Chemical Modification of Lysine Residues in Bacillus Alpha-Amylases: Effect on Activity And Stability. Enzyme Microbiology Technology. 28: 543-549.
Khajeh, K., Azadeh E.H. and Mohsen N. G. 2004. Chemical Modification of Lysine Residue in Bacillus lincheniformis α-Amylase : Conversion of An Endo to Exo Type Enzyme. Journal Of Biochemistry and Molecular Biology. 37: 642-647.
Lay, B. W. and Sugyo,H. 1992. Mikrobiologi. Rajawali Pers. Jakarta. 107-112.
Lee, S.M., and Koo, Y.M. 2001. Pilot scale production of cellulose using
Trichoderma reesei Rut C-30 in fed-batch mode. Journal of Microbiology and. Biotechnology. 11: 229-233.
Lehninger, A.L. 1982. Dasar-Dasar Biokimia. Erlangga. Jakarta.369 halaman.
Lowry, O. H., N. J., Rosebrough, A. L., Farr, R. J. Randall. 1951. Protein measurement with the folin phenol reagent. Journal of Biology and Chemistry. 193-265.
Mandels, M., A. Raymond, R. Charles. 1976. Measurement of saccharifying cellulose. Biotechnology and Bioengineering. John Wiley & Sons Inc.
Martoharsono, S. dkk.1984. Biokimia. UGM Press. Yogyakarta.91.
Mozhaev, V.V. and K. Martinek. 1984. Structur-Stability Relationship in Protein: New Approaches to Stabilizing Enzymes. Enzyme Microbial Technology. 50-59.
62
Muchtadi, T.R. dan Sugiono. 1992. Ilmu Pengetahuan Bahan Pangan. Departemen Pendidikan dan Kebudayaan. Direktorat Jenderal
Tinggi Pusat Antar Universitas Pangan dan Gizi. Institut Pertanian Bogor. Bogor.
Nubarov, N.S., V.V. Mozheav, V.A. Siksnis, K. Martinek. 1987. Enzyme
Stabilization of α-Chymotrypsin by Reductive Alkylation with Glyoxylic Acid. Biotechnology. 9: 725-730.
Page, D.S. 1997. Prinsip-Prinsip Biokimia. Erlangga. Jakarta. 465 halaman.
Pelczar, M.J. and E. C. S. Chan. 1986. Dasar- Dasar Mikrobiologi. UI Press. Jakarta.
Poedjiadi, A.1994. Dasar-dasar Biokimia. Jakarta.UI-Press. 155, 158-160.
Pohl, T. 1990. Concentration of protein removal of salute dalam M.P. Deutscher, Methods of Enzymology: Guide to Protein Purification.Vol :182.
Academic Press. New York.
Purwadaria, T., P. A. Marbun, A. P. Sinurat, P. P. Ketaren. 2003. Perbandingan aktivitas enzim selulase dari bakteri dan kapang hasil isolasi dari rayap. Jurnal Ilmu Ternak dan Veteriner. 8(4): 213-219.
Rao, Subba N.S. 1998. Mikroorganisme Tanah dan Pertumbuhan. UI Press. Jakarta. 228-229.
Reed, G. 1975. Enzymes in Food Processing. Academic Press. New York. 212.
Reese, E.T. 1976. History of cellulase program at U.S. Army Natick Development Center. Biotechnology and Bioengineering. Vol: 6. John Wiley & Sons Inc.
63
Sariningsih, R. 2000. Produksi Enzim Protease oleh Bacillus subtilis BAC-4. (Skripsi). Institut Teknologi Bandung. Bandung.
Scopes, R.K. 1982. Protein Purification. Springer Verlag. New York.
Sebayang, F. 2005. Amobilisasi enzim penisilin asilase dari E.coli B1O4 dengan
poliakrilamida. Jurnal Komunikasi Penelitian .17 (3): 1-3.
Shahib, N. 2005. Biologi Molekular Medik I. Unpad Press. Bandung. 164-167
Soemitro, S. 2005. Pengaruh Modifikasi Kimiawi Selektif Terhadap Kestabilan
α-amilase dari Saccharomycopsis fibuligera. Journal of. Bionatura. 7(3): 259-273.
Stahl, S. 1999. Thermophilic Microorganism: The Biological Background for Thermophily and Thermoresistence of Enzyme in Thermostabilyty of Enzyme. Gupta M. N editor. Springer Verlag. New Delhi. 59-60.
Suhartono, M.T. 1989. Enzim dan Bioteknologi. PAU IPB. Bogor.
Sundari, Eka Sulis. 2011. Peningkatan Kestabilitas Enzim α-amilase dari Bacillus subtilis ITBCCB148 Dengan Modifikasi Kimia Menggunakan Sitrakonat Anhidrida. (Skripsi). Universitas Lampung. Bandar Lampung.
Virdianingsih, R. 2002. Mempelajari Stabilitas Termal dari Bacillus pumilus y1 dalam pelarut Heksana, Toluena, dan Benzena. (Skripsi). Institut
Pertanian Bogor. Bogor.
Vrijic de T, de Hass GG, Tan GB, Keijsers ERP, Claassen PAM. 2002.
Pretreatment of miscanthus for hydrogen production by Thermotoga elfii. Int J. Hydrogen Energy. 27. 1381-1390.
Walsh, G., and D.R. Headon. 1994. Protein Biotechnology. John Willey and Sons. New York.
64
Wirahadikusumah, M. 1997. Biokimia: Protein, Enzim dan Asam Nukleat. ITB. Press. Bandung. 91 halaman.
Wiramargana, M. 1991. Pengaruh Penggunaan Aditif Terhadap Stabilitas Enzim Protease Bacillus subtilis Selama Penyimpanan. (Skripsi). FATETA-IPB, Bogor.
Wyk, J.P.H.V., M. Mohulatsi. 2003. Biodegradation of wastepaper by cellulase from Trichoderma viride. Bioresource Technology. 86: 21–23.
Yandri, A.S., Dian H. and Tati S. 2007. Isolasi, Pemurnian dan Karakterisasi Enzim Protease Termostabil Dari Bakteri Isolat Lokal Bacillus subtilis ITBCCB148. Jurnal Sains MIPA . 13(2): 100-106.
Yang, Z., D. Michael, A. Robert, X.Y. Fang and J.R. Alan . 1996. Polyethylene Glycol-Induced Stabilization of Subtilisin. Enzyme Microbial
65
Lampiran 1
Tabel 3. Hubungan antara berbagai tingkat kejenuhan ammonium sulfat (0-80%) dengan aktivitas spesifik enzim selulase
No Fraksi Aktivitas Unit (U/mL)
Kadar Protein (mL/mg)
Aktivitas Spesifik (U/mg)
1 0-15 % 0.0431 0.4868 0.0884
2 15-30 % 0.1014 0.4625 0.2193
3 30-45 % 0.1193 0.1900 0.6279
4 45-60 % 0.1534 0.1465 1.0471
5 60-80% 0.1674 0.0700 2.3914
Tabel 4. Hubungan antara berbagai tingkat kejenuhan ammonium sulfat (0-80%) dengan aktivitas spesifik enzim selulase
No Fraksi Aktivitas Unit (U/mL)
Kadar Protein (mL/mg)
Aktivitas Spesifik (U/mg)
1 0-35 % 0.1223 0.1146 1.0667
66
Lampiran 2
Tabel 5. Hubungan antara pH dengan aktivitas unit enzim hasil pemurnian dan hasil modifikasi
Aktivitas Unit (U/mL)
No pH
Enzim Sitrakonat Sitrakonat Sitrakonat Sitrakonat hasil
Tabel 6. Hubungan antara pH dengan aktivitas sisa enzim hasil pemurnian dan hasil modifikasi
Aktivitas Sisa (%)
No pH
67
Lampiran 3
Tabel 7. Hubungan antara suhu dengan aktivitas unit enzim hasil pemurnian dan hasil modifikasi
Aktivitas Unit (U/mL)
No Suhu
Enzim Sitrakonat Sitrakonat Sitrakonat Sitrakonat hasil
Tabel 8. Hubungan antara suhu dengan aktivitas sisa enzim hasil pemurnian dan hasil modifikasi
Aktivitas Sisa (%)
No Suhu
68
Lampiran 4
Tabel 9. Data untuk penentuan KM dan Vmax enzim selulase hasil pemurnian
berdasarkan persamaan Lineweaver-Burk
Persamaan regresi untuk data diatas adalah : Y = 7.8836 x + 0.0986
Tabel 10. Data untuk penentuan KM dan Vmax enzim selulase hasil modifikasi
menggunakan sitrakonat anhidrida berdasarkan persamaan Lineweaver-Burk
Persamaan regresi linear untuk data di atas adalah sebagai berikut: Sitrakonat anhidrida 20 µL : Y = 16.9103 x + 0.4508
69
Lampiran 5
Tabel 11. Hubungan antara aktivitas unit enzim hasil pemurnian dan hasil modifikasi selama inaktivasi termal pada 50oC
70
Lampiran 6
Tabel 12. Hubungan antara aktivitas sisa enzim hasil pemurnian dan hasil modifikasi selama inaktivasi termal pada 50oC
No Waktu
Tabel 13. Penentuan ki (konstanta laju inaktivasi termal) enzim hasil pemurnian
71
Lampiran 7
Tabel 14. Penentuan ki (konstanta laju inaktivasi termal) enzim hasil modifikasi
dengan derajat modifikasi sitrakonat anhidrida 20 µL pada suhu 50oC
No Waktu (Menit) Aktivitas Sisa ( E ) ln (Ei/E0)
Tabel 15. Penentuan ki (konstanta laju inaktivasi termal) enzim hasil modifikasi
dengan derajat modifikasi sitrakonat anhidrida 30 µL pada suhu 50oC
72
Lampiran 8
Tabel 16. Penentuan ki (konstanta laju inaktivasi termal) enzim hasil modifikasi
dengan derajat modifikasi sitrakonat anhidrida 40 µL pada suhu 50oC
No Waktu (Menit) Aktivitas Sisa ( E ) ln (Ei/E0)
Tabel 17. Penentuan ki (konstanta laju inaktivasi termal) enzim hasil modifikasi
dengan derajat modifikasi sitrakonat anhidrida 50 µL pada suhu 50oC
73
Lampiran 9
Contoh perhitungan ΔGi enzim hasil pemurnian
Dari perhitungan menggunakan persamaan diperoleh nilai ki enzim hasil
pemurnian adalah 0,0277 menit-1 pada T = 323 K
⁄
⁄ ⁄
⁄ ⁄ ⁄
⁄
Dari persamaan waktu paruh reaksi orde satu ( t1/2 = 0,693/ki ), diperoleh waktu
paruh untuk enzim hasil pemurnian : t1/2 = 0,693/ki
= 0,693/0,0277 menit-1
74
Lampiran 10
Kurva standar glukosa
Kurva standar glukosa digunakan untuk uji aktivitas enzim.
Tabel 18. Absorbansi glukosa pada berbagai konsentrasi untuk penentuan kurva standar glukosa
Gambar 24. Kurva standar glukosa
75
Lampiran 11
Kurva standar serum albumin sapi (BSA)
Kurva standar serum albumin sapi digunakan untuk penentuan kadar protein pada metode Lowry.
Tabel 19. Absorbansi serum albumin sapi (BSA) pada berbagai konsentrasi untuk penentuan kurva standar serum albumin sapi (BSA)