ANALISIS RAPD (Random Amplified Polymorphic DNA)
POPULASI MANGGIS (Garcinia mangostana L.)
DI SUMATERA UTARA
TESIS
Oleh :
DAME HANNA YUSNITA L. TOBING
NIM : 127001001
PROGRAM MAGISTER AGROEKOTEKNOLOGI
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
MEDAN
ANALISIS RAPD (Random Amplified Polymorphic DNA)
POPULASI MANGGIS (Garcinia mangostana L.)
DI SUMATERA UTARA
TESIS
Oleh :
DAME HANNA YUSNITA L. TOBING
NIM : 127001001
Diajukan Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Magister Pertanian Dalam Program Studi Agroekoteknologi
Fakultas Pertanian Universitas Sumatera Utara
PROGRAM MAGISTER AGROEKOTEKNOLOGI
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
MEDAN
Telah diuji pada
Tanggal : 29 Desember 2014
PANITIA PENGUJI TESIS
Ketua : Dr. Ir. Lollie Agustina P. Putri, M.Si Anggota : Mohammad Basyuni, S. Hut, M.Si, Ph.D
Luthfi A.M.Siregar, SP, M.Agr.Sc, Ph.D Dr. Diana Sofia Hanafiah, SP, MP
LEMBAR PENGESAHAN
Judul Penelitian : Analisis RAPD (Random Amplified Polymorphic DNA) Populasi Manggis (Garcinia mangostana L.) Di Sumatera Utara
Mahasiswa : Dame Hanna Yusnita L. Tobing
N I M : 127001001
Program Studi : Agroekoteknologi
Menyetujui
Komisi Pembimbing
Dr. Ir. Lollie Agustina P. Putri, M.Si
Ketua Anggota
Mohammad Basyuni, S. Hut, M.Si, Ph.D
Ketua Program Studi Dekan Fakultas Pertanian
Prof. Dr. Ir. Abdul Rauf, MP
Prof. Dr. Ir. Darma Bakti, MS
ABSTRAK
DAME HANNA YUSNITA L. TOBING. Analisis RAPD (Random
Amplified Polymorphic DNA) Populasi Manggis (Garcinia mangostana. L) Di Sumatera Utara. Dibimbing oleh LOLLIE AGUSTINA P. PUTRI sebagai ketua komisi pembimbing dan MOHAMMAD BASYUNI sebagai anggota komisi pembimbing.
Tujuan penelitian ini adalah untuk mengetahui keragaman genetik populasi manggis alam di daerah Sumatera Utara berdasarkan marka RAPD (Random Amplified Polymorphic DNA). Tiga puluh aksesi manggis Sumatera Utara dianalisis keragaman genetiknya dengan menggunakan 10 marka RAPD. Aksesi tersebut meliputi TS1, TS2, TS3, TS5, TS5, Sim1, Sim2, Sim3, DS1, DS2, DS3, DS4, DS5, Srg1, Srg2, Srg3, Srg4, Srg5, Lkt1, Lkt2, Lkt3, Lkt4, Lkt5, Lkt6, Lkt7, Lkt8, Lkt9, Lkt10, Lkt11, Lkt12. Perhitungan dan analisis data dilakukan dengan bantuan program DARwin 5.05. Dari hasil penelitian diperoleh sebanyak 70 pita polimorfis dengan 10 primer RAPD. Koefisien dissimilarity Dice berkisar 0.06 – 0.48. Berdasarkan hasil analisis kluster, 30 aksesi manggis terbagi menjadi 3 group utama. Nilai PCoA (faktorial analisis) keragaman molekuler yang dapat dinyatakan oleh aksis 1 dan 2 pada 10 primer RAPD dengan 30 aksesi sampel sebesar 38.11%. Aksesi Lkt1 dan Lkt6 yang berasal dari Langkat diduga memiliki materi spesifik karena mengelompok sendiri saja dibandingkan aksesi yang berasal dari Langkat lainnya.
ABSTRACT
DAME HANNA YUSNITA L. TOBING. Genetic diversity analysis based on RAPD (Random Amplified Polymorphic DNA) markers of mangosteens (Garcinia mangostana L.) in North Sumatra. Supervised by LOLLIE AGUSTINA P. PUTRI and MOHAMMAD BASYUNI.
The objective of this research was to analyze genetic diversity based on RAPD (Random Amplified Polymorphic DNA) marker of mangosteen (Garcinia mangostana L.) in North Sumatra Region. Thirty accessions of mangosteens from North Sumatra Region were screened for RAPD marker. Thirty accessions were TS1, TS2, TS3, TS5, TS5, Sim1, Sim2, Sim3, DS1, DS2, DS3, DS4, DS5, Srg1, Srg2, Srg3, Srg4, Srg5, Lkt1, Lkt2, Lkt3, Lkt4, Lkt5, Lkt6, Lkt7, Lkt8, Lkt9, Lkt10, Lkt11, Lkt12. The genetic data was analyzed by DARwin 5.05 software. Ten random RAPD primers were chosen to differentiate the accessions, led a total of 70 polymorphic bands. Dice’s coefficient of dissimilarity ranged 0.06 – 0.48. The cluster analysis depicted that thirty accessions formed three main cluster. A principal coordinate analysis resulted 38.11% of the molecular variation. Average of PIC value was 0.447, suggested that 10 RAPD primers used may be suitable for mangosteen. Two accessions, namely Lkt1 and Lkt6 from Langkat District has been shown to have a specific material to cluster themselves and was distinguishable from other accessions originated from Langkat.
UCAPAN TERIMAKASIH
Puji dan Syukur penulis ucapkan kepada Tuhan Yang Maha Esa atas segala berkat dan rahmatNya sehingga penulis dapat menyelesaikan penulisan tesis ini.
Selama melakukan penelitian dan penulisan tesis ini penulis banyak mendapat bantuan moril dan materil dari berbagai pihak. Oleh karena itu pada kesempatan ini penulis menyampaikan ucapan terimakasih yang tulus kepada :
- Bapak Prof. Dr. dr. Syahril Pasaribu, DTM&H, M.Sc, (CTM), Sp.A(K), selaku Rektor Universitas Sumatera Utara.
- Bapak Prof. Dr. Ir. A. Rahim Matondang, MSIE, selaku Direktur Sekolah Pascasarjana Universitas Sumatera Utara.
- Bapak Prof. Dr. Ir. Darma Bakti, MS, selaku Dekan Fakultas Pertanian Universitas Sumatera Utara
- Bapak Prof. Dr. Ir. Abdul Rauf, MP, selaku Ketua Program Studi Magister Agroekoteknologi beserta segenap dosen dan staff tata usaha
- Ibu Dr. Ir. Lollie Agustina P. Putri, M.Si selaku ketua komisi pembimbing dan Bapak Mohammad Basyuni, S.Hut, M.Si, Ph.D selaku anggota komisi pembimbing.
- Bapak Luthfi A.M.Siregar, SP, M.Agr.Sc,Ph.D, Dr. Ibu Diana Sofia Hanafiah, SP, MP, Bapak Ir. Revandy I.M. Damanik, M.Si, M.Sc, Ph.D selaku komisi penguji.
- Dr. Tetty Aman Nasution beserta staff Laboratorium Terpadu Fakultas Kedokteran Universitas Sumatera Utara.
- Rektor Universitas Quality, (Alm). Hasfin Hardi, SE, M.Si, periode 2009-2013 dan Rektor Universitas Quality periode 2014 - 2018, Drs. A.P. Tambunan, M.Si
- Chornelys Antonius, SE, suami tercinta, dan kedua putri tersayang Cynthia Aretha Pratiwi dan Olivia Marvella Artha serta seluruh keluarga besar Tobing, ibu Sitionim Damanik dan Bapak Christianto.
- Keluarga petani dan pemilik manggis yang ada di Sumatera Utara yang menjadi sampel penelitian penulis.
- Rekan-rekan sejawat mahasiswa Magister Agroekoteknologi Fakultas Pertanian Universitas Sumatera Utara.
- Semua pihak yang tidak disebutkan namanya namun memberikan dukungan selama penulis melakukan penelitian tesis ini.
Penulis menyadari tesis ini masih banyak memiliki kekurangan dan jauh dari sempurna. Namun harapan penulis semoga tesis ini bermanfaat bagi seluruh pembaca. Kiranya Tuhan Yang Maha Esa memberkati kita semua.
Medan, Desember 2014
KATA PENGANTAR
Puji dan Syukur penulis ucapkan kepada Tuhan Yang Maha Esa atas
segala berkat dan rahmatNya sehingga penulis dapat menyelesaikan penulisan
tesis yang berjudul Analisis RAPD (Random Amplified Polymorphic DNA)
Populasi Manggis (Garcinia mangostana L.) Di Sumatera Utara yang merupakan
salah satu syarat untuk dapat memperoleh gelar magister pada Sekolah Pasca
Sarjana Program Agroekoteknologi, Fakultas Pertanian Universitas Sumatera
Utara
Pada kesempatan ini, penulis mengucapkan terimakasih yang sebesar –
besarnya kepada komisi pembimbing yang telah banyak memberikan bimbingan,
dukungan moril dan materil untuk menyelesaikan tesis ini yaitu kepada Ibu Dr. Ir.
Lollie Agustina P. Putri, M.Si selaku ketua komisi pembimbing dan Bapak
Mohammad Basyuni, S.Hut, M.Si, Ph.D selaku anggota komisi pembimbing.
Penulis menyadari tesis ini masih banyak memiliki kekurangan dan jauh
dari sempurna. Namun harapan penulis semoga tesis ini bermanfaat bagi seluruh
pembaca.
Medan, Desember 2014
RIWAYAT HIDUP
Dame Hanna Yusnita L. Tobing, dilahirkan pada tanggal 26 Juli 1978 di Pematang Siantar, Sumatera Utara dari Bapak (Alm) Drs. Jannus Lumban Tobing
dan Ibu Sitionim Damanik merupakan anak kedua dari tujuh bersaudara.
Riwayat pendidikan yang telah dicapai saat ini adalah :
1. Tahun 1984 – 1990, bersekolah di Sekolah Dasar SD ST. Petrus Medan
2. Tahun 1990 – 1993, bersekolah di Sekolah Menengah Pertama (SMP)
Negeri 1 Medan
3. Tahun 1993 – 1996, bersekolah di Sekolah Menengah Atas (SMA) Negeri
1 Medan
4. Tahun 1996 diterima di Fakultas Pertanian Universitas Sumatera Utara,
Program Studi Pemuliaan Tanaman, lulus tahun 2000
5. Tahun 2002, diterima pada Program Magister Manajemen Universitas
Sumatera Utara, lulus tahun 2004
6. Tahun 2012, diterima pada Program Magister Agroekoteknologi, Fakultas
Pertanian Universitas Sumatera Utara.
Sejak tahun 2009, penulis menjadi salah satu staff dosen Fakultas
DAFTAR ISI
ABSTRAK ... i
ABSTRACK ... ii
UCAPAN TERIMA KASIH ... iii
KATA PENGANTAR ... iv
RIWAYAT HIDUP ... v
DAFTAR ISI ... vi
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 1
Hipotesis Penelitian ... 2
Manfaat Penelitian ... 3
TINJAUAN PUSTAKA Botani Tanaman ... 4
Pemuliaan Manggis ... 6
Keragamaan Genetik ... 8
Marka RAPD ... 18
BAHAN DAN METODE Tempat Dan Waktu ... 22
Bahan Dan Alat ... 22
Metode Penelitian ... 23
Analisis Data ... 28
HASIL DAN PEMBAHASAN Hasil ... 30
Pembahasan ... 41
KESIMPULAN DAN SARAN Kesimpulan ... 46
Saran ... 46
DAFTAR TABEL
No Judul Hal
1. Karakter morfologis manggis yang tersebar di Jawa dan Sumatera ... 13
2. Hasil uji kuantitas dan konsentrasi DNA manggis populasi
Sumatera Utara dengan spektrofotometer ... 31
DAFTAR GAMBAR
No Judul Hal
1. Lokasi penyebaran manggis di Sumatera dan Jawa ... 10
2. Morfologi tanaman manggis ... 14
3. Hasil elektroforesis 30 DNA sampel manggis populasi manggis Sumatera Utara dengan 0.8% agarose ... 30
4. Hasil pola pita DNA sampel dengan primer OPD-20 ... 32
5. Hasil pola pita DNA sampel dengan primer OPN-03 ... 32
6. Hasil pola pita DNA sampel dengan primer OPH-06 ... 33
7. Hasil pola pita DNA sampel dengan primer OPC-07 ... 33
8. Hasil pola pita DNA sampel dengan primer OPC-12 ... 34
9. Hasil pola pita DNA sampel dengan primer OPD-03 ... 34
10.Hasil pola pita DNA sampel dengan primer OPD-13 ... 35
11.Hasil pola pita DNA sampel dengan primer OPD-16 ... 35
12.Hasil pola pita DNA sampel dengan primer OPI-20 ... 36
13.Hasil pola pita DNA sampel dengan primer OPH-09 ... 36
14.Faktorial analisis (Principal Coordinate Analysis) aksis 1 (horizontal) dan aksis 2 (vertical) dengan 10 marka RAPD ... 38
15.Profil Radial Neighbour-Joining dari 30 aksesi manggis populasi Sumatera Utara yang dianalisis berdasarkan Matrix Dissimilarity Simple Matching ……….. 39
DAFTAR LAMPIRAN
No Judul Hal
1. Bagan prosedur isolasi DNA ... 52
2. Siklus PCR ... 53
3. Data distance DARwin ... 54
4. Hasil uji kuantitas dan konsentrasi DNA manggis populasi Sumatera Utara dengan spektrofotometer/nanophotometer ... 55
5. Gambar kegiatan elektroforesis... 59
6. Gambar kegiatan di laboratorium... 60
7. Deskripsi pembuatan larutan stok ... 61
8. Peta lokasi penelitian manggis Sumatera Utara ... 63
9. Gambar aksesi manggis TS1 ... 64
10.Gambar aksesi manggis TS2 ... 65
11.Gambar aksesi manggis TS3 ... 66
12.Gambar aksesi manggis TS4 ... 67
13.Gambar aksesi manggis TS5 ... 68
14.Gambar aksesi manggis Sim1 ... 69
15.Gambar aksesi manggis Sim2 ... 70
16.Gambar aksesi manggis Sim3 ... 71
17.Gambar aksesi manggis DS1 ... 72
18.Gambar aksesi manggis DS2 ... 73
19.Gambar aksesi manggis DS3 ... 74
20.Gambar aksesi manggis DS4 ... 75
22.Gambar aksesi manggis Srg1 ... 77
23.Gambar aksesi manggis Srg2 ... 78
24.Gambar aksesi manggis Srg3 ... 79
25.Gambar aksesi manggis Srg4 ... 80
26.Gambar aksesi manggis Srg5 ... 81
27.Gambar aksesi manggis Lkt1 ... 82
28.Gambar aksesi manggis Lkt2 ... 83
29.Gambar aksesi manggis Lkt3 ... 84
30.Gambar aksesi manggis Lkt4 ... 85
31.Gambar aksesi manggis Lkt5 ... 86
32.Gambar aksesi manggis Lkt6 ... 87
33.Gambar aksesi manggis Lkt7 ... 88
34.Gambar aksesi manggis Lkt8 ... 89
35.Gambar aksesi manggis Lkt9 ... 90
36.Gambar aksesi manggis Lkt10 ... 91
37.Gambar aksesi manggis Lkt11 ... 92
ABSTRAK
DAME HANNA YUSNITA L. TOBING. Analisis RAPD (Random
Amplified Polymorphic DNA) Populasi Manggis (Garcinia mangostana. L) Di Sumatera Utara. Dibimbing oleh LOLLIE AGUSTINA P. PUTRI sebagai ketua komisi pembimbing dan MOHAMMAD BASYUNI sebagai anggota komisi pembimbing.
Tujuan penelitian ini adalah untuk mengetahui keragaman genetik populasi manggis alam di daerah Sumatera Utara berdasarkan marka RAPD (Random Amplified Polymorphic DNA). Tiga puluh aksesi manggis Sumatera Utara dianalisis keragaman genetiknya dengan menggunakan 10 marka RAPD. Aksesi tersebut meliputi TS1, TS2, TS3, TS5, TS5, Sim1, Sim2, Sim3, DS1, DS2, DS3, DS4, DS5, Srg1, Srg2, Srg3, Srg4, Srg5, Lkt1, Lkt2, Lkt3, Lkt4, Lkt5, Lkt6, Lkt7, Lkt8, Lkt9, Lkt10, Lkt11, Lkt12. Perhitungan dan analisis data dilakukan dengan bantuan program DARwin 5.05. Dari hasil penelitian diperoleh sebanyak 70 pita polimorfis dengan 10 primer RAPD. Koefisien dissimilarity Dice berkisar 0.06 – 0.48. Berdasarkan hasil analisis kluster, 30 aksesi manggis terbagi menjadi 3 group utama. Nilai PCoA (faktorial analisis) keragaman molekuler yang dapat dinyatakan oleh aksis 1 dan 2 pada 10 primer RAPD dengan 30 aksesi sampel sebesar 38.11%. Aksesi Lkt1 dan Lkt6 yang berasal dari Langkat diduga memiliki materi spesifik karena mengelompok sendiri saja dibandingkan aksesi yang berasal dari Langkat lainnya.
ABSTRACT
DAME HANNA YUSNITA L. TOBING. Genetic diversity analysis based on RAPD (Random Amplified Polymorphic DNA) markers of mangosteens (Garcinia mangostana L.) in North Sumatra. Supervised by LOLLIE AGUSTINA P. PUTRI and MOHAMMAD BASYUNI.
The objective of this research was to analyze genetic diversity based on RAPD (Random Amplified Polymorphic DNA) marker of mangosteen (Garcinia mangostana L.) in North Sumatra Region. Thirty accessions of mangosteens from North Sumatra Region were screened for RAPD marker. Thirty accessions were TS1, TS2, TS3, TS5, TS5, Sim1, Sim2, Sim3, DS1, DS2, DS3, DS4, DS5, Srg1, Srg2, Srg3, Srg4, Srg5, Lkt1, Lkt2, Lkt3, Lkt4, Lkt5, Lkt6, Lkt7, Lkt8, Lkt9, Lkt10, Lkt11, Lkt12. The genetic data was analyzed by DARwin 5.05 software. Ten random RAPD primers were chosen to differentiate the accessions, led a total of 70 polymorphic bands. Dice’s coefficient of dissimilarity ranged 0.06 – 0.48. The cluster analysis depicted that thirty accessions formed three main cluster. A principal coordinate analysis resulted 38.11% of the molecular variation. Average of PIC value was 0.447, suggested that 10 RAPD primers used may be suitable for mangosteen. Two accessions, namely Lkt1 and Lkt6 from Langkat District has been shown to have a specific material to cluster themselves and was distinguishable from other accessions originated from Langkat.
PENDAHULUAN Latar Belakang
Manggis (Garcinia mangostana L.) yang juga dikenal dengan sebutan
“the queen of tropical fruits” merupakan buah yang berasal dari daerah tropis dan
memiliki banyak manfaat bagi kesehatan. Manggis menduduki posisi teratas bagi
komoditi buah ekspor dan Indonesia menjadi negara kedua penghasil dan
pengekspor manggis di dunia setelah Thailand. Manfaat manggis bagi kesehatan
antara lain dapat menyembuhkan disentri, alergi, gatal, tuberculosis, kolera,
diabetes, gonorrhea, infeksi saluran kemih, infeksi kulit dan berbagai penyakit
lainnya. Ekstrak dan kandungan yang terdapat pada manggis yang dikenal dengan
xanthones telah teruji memiliki aktivitas farmakologikal yang sangat banyak
antara lain sebagai anti oksidan, anti jamur, anti bakteri, sitotosik, anti inflamasi,
anti histimin, anti HIV, anti kanker, mengobati malaria dan berbagai manfaat
lainnya (Obolskiy, et al. 2009).
Beberapa kendala utama dalam pemuliaan manggis adalah belum
ditemukannya varietas manggis dengan produktivitas dan kualitas buah yang lebih
baik. Selain itu masa TBM (Tanaman Belum Menghasilkan) yang cukup lama
bisa mencapai 8 – 15 tahun bila diperbanyak dengan biji, kualitas buah yang
masih rendah, penyakit burik dan getah kuning serta teknologi produksi dan pasca
panen yang belum diketahui dengan baik. Oleh sebab itu diperlukan strategi untuk
peningkatan di berbagai aspek, antara lain teknik budidaya, pasca panen maupun
kegiatan pemuliaan dan konservasi plasma nutfah.
Hasil observasi berdasarkan data BPS (2012), beberapa daerah kabupaten
Serdang, Serdang Bedagai, Simalungun dan Langkat. Namun saat ini tidak
diketahui secara mendalam informasi berbagai plasma nutfah populasi alami
manggis dan pola kekerabatan yang terdapat pada manggis di Sumatera Utara.
Selain itu penelitian analisis keragaman genetik manggis Sumatera Utara yang
berdasarkan marka molekuler RAPD (RAPD (Random Amplified Polymorphism
DNA) belum pernah dilakukan. Oleh karena itu dilaksanakan penelitian tentang
keragaman genetik dan pola kekerabatan manggis yang tersebar secara alami di
beberapa daerah di Sumatera Utara dengan penggunakan marka RAPD (Random
Amplified Polymorphism DNA), sehingga diperoleh tetua yang sesuai bagi
program pemuliaan dan konservasi plasma nutfah manggis.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui keragaman genetik populasi
manggis alam di daerah Sumatera Utara berdasarkan marka RAPD (Random
Amplified Polymorphism DNA)
Hipotesis Penelitian
Adanya keragaman genetik manggis pada populasi manggis Sumatera
Utara.
Manfaat Penelitian
Manfaat yang dapat diperoleh dengan mengidentifikasi keragaman genetik
manggis tersebut antara lain :
2. Tersedianya informasi mengenai keragaman genetik manggis
Sumatera Utara
3. Inventarisasi plasma nutfah manggis. Informasi ini bermanfaat dalam
usaha program pemuliaan melalui kultivar unggul yang dilakukan
dengan teknik pemuliaan konvensional maupun dengan teknik
pemuliaan modern melalui pendekatan bioteknologi.
Kerangka Penelitian
Identifikasi dan Pengambilan Sampel Daun Populasi manggis pada daerah –
daerah penyebaran di Sumut (Tapanuli Selatan, Simalungun, Deli Serdang,
Isolasi DNA
Analisis Molekuler dengan Marka RAPD
Keragaman Genetik Berdasarkan
Karakteristik Molekuler
Diketahui Keragaman Genetik
TINJAUAN PUSTAKA
Botani Tanaman
Tanaman manggis dapat diklasifikasikan sebagai berikut :
Kingdom : Plantae
Divisi : Magnoliophyta
Kelas : Magnoliopsida
Ordo : Malpighiales
Famili : Clusiaceae
Genus : Garcinia
Spesies : G. mangostana L.
Manggis merupakan salah satu buah yang digemari oleh masyarakat
Indonesia. Tanaman manggis berasal dari hutan tropis yang teduh di kawasan
Asia Tenggara, yaitu hutan belantara Indonesia. Dari Asia Tenggara, tanaman ini
menyebar ke daerah Amerika Tengah dan daerah tropis lainnya seperti Filipina,
Papua New Guinea, Kamboja, Thailand, Srilanka, Madagaskar, Honduras, Brazil
dan Australia Utara. Manggis merupakan salah satu buah unggulan Indonesia
yang memiliki peluang ekspor cukup menjanjikan. Permintaan manggis
meningkat dari tahun ke tahun seiring dengan kebutuhan konsumen terhadap
buah. (Prihatman, 2000)
Manggis dikenal dengan julukan ratu buah tropis yaity queen of fruits of
tropical fruit, (Fairchild, 1915). Tampilan buahnya yang eksotis serta rasa yang
khas belakangan dikenal sebagai salah satu buah yang bermanfaat bagi kesehatan
seiring dengan kebutuhan buah manggis dunia terutama Hongkong, Singapura,
dan Inggris (Prihatman, 2000).
Manggis mempunyai berbagai macam nama lokal khususnya di Indonesia
seperti manggu (Jawa Barat), manggus (Lampung), Manggusto (Sulawesi Utara),
manggista (Sumatera Barat). Pohon manggis dapat tumbuh di dataran rendah
sampai di ketinggian di bawah 1.000 m dpl. Pertumbuhan terbaik dicapai pada
daerah dengan ketinggian di bawah 500-600 m dpl. Buah manggis dapat disajikan
dalam bentuk segar, sebagai buah kaleng, dibuat sirop/sari buah. Secara
tradisional buah manggis digunakan sebagai obat sariawan, wasir dan luka. Kulit
buah dimanfaatkan sebagai pewarna termasuk untuk tekstil dan air rebusannya
dimanfaatkan sebagai obat tradisional. Batang pohon dipakai sebagai bahan
bangunan, kayu bakar/ kerajinan. (Prihatman, 2000)
Kulit manggis yang dahulu hanya dibuang saja ternyata dapat
dikembangkan sebagai obat. Kulit buah manggis setelah diteliti ternyata
mengandung beberapa senyawa dengan aktivitas farmakologi misalnya
antiinflamasi, antihistamin, pengobatan penyakit jantung, antibakteri, antijamur.
Beberapa senyawa utama kandungan kulit buah manggis adalah golongan xanton.
Senyawa xanton yang telah teridentifikasi, diantaranya alfa mangostin dan
gamma-mangostin. Pemanfaatan kulit buah manggis sebenarnya sudah dilakukan
sejak lama. Kulit buah manggis secara tradisional digunakan pada berbagai
pengobatan di Negara India, Myanmar Sri Langka, dan Thailand. Secara luas,
masyarakat Thailand memanfaatkan kulit buah manggis untuk pengobatan
penyakit sariawan, disentri, cystitis, diare, gonorea, dan eksim. Kulit buah
juga digunakan sebagai ramuan untuk mengobati luka, demam, diare, sariawan
dan sembelit, selain itu juga bubuk atau serbuk dari kulit manggis yang
dikeringkan juga bermanfaat untuk mengobati disentri (Mardiana, 2011).
Ekstrak dan kandungan alami yang berasal dari G. mangostana yang
dikenal sebagai xanthones, dilaporkan memiliki berbagai manfaat yang cukup
besar di bidang farmakologi. Berbagai manfaat antara lain sebagai antioksidan,
anti jamur, anti bakteri, sitotoksik, anti inflamasi, anti histimin, anti HIV dan
fungsi lainnya. (Obolskiy, et al. 2009)
Pemuliaan Manggis
Manggis termasuk dalam famili Clusiaceae dan genus Garcinia. Genus ini
terbagi dalam 400 spesies (Campbell 1996; Richard 1990). Pohon manggis
mencapai tinggi 10-25 meter. Diameter batang 25-35 cm dan kulit batang
biasanya berwarna coklat gelap atau hampir hitam, kasar dan cenderung
mengelupas. Getah manggis berwarna kuning dan terdapat pada semua jaringan
utama tanaman (Shabella, 2011)
Daun manggis merupakan daun tunggal, lonjong, ujung runcing, pangkal
tumpul, tepi rata, pertulangan menyirip, panjang 20-25 cm, lebar 6-9 cm, tebal,
tngkai silindris, hijau (Hutapea, 1994).
Buah manggis berbentuk bulat atau agak pipih dengan diameter 3,5-8 cm.
Berat buah bervariasi sekitar 75-150 gram, tergantung pada umur pohon dan
daerah geografisnya. Tebal kulit buah berkisar antara 0,8-1 cm, berwarna
keunguan dan biasanya mengandung cairan kuning yang rasanya pahit. Buah
sama dan biasanya mengandung 1-2 biji. Biji-biji besar berbentuk pipih berwarna
ungu gelap atau cokelat dengan panjang 2-2,5 cm, lebar 1,5-2,0 cm dan tebalnya
antara 0,7-1,2 cm tertutup oleh serat lunak yang menyebar sampai ke dalam
daging buah. Berat biji bervariasi antara 0,1-2,2 gram (Shabella, 2011)
Bunga manggis bersifat dioecius (berumah dua), tetapi hanya bunga betina
yang dapat dijumpai sebab bunga jantan mengalami rudimenter (Steenis 1975;
Cox 1988). Sehingga reproduksinya bersifat parthenogenesis. Manggis memiliki
jumlah kromosom 2n = 4x = 90, diduga tetraploid dan kemungkinan allotetraploid
atau amplidiploid. Merupakan turunan dari Garcinia malacensis (2n = 2x = 42)
dan Garcinia hambroniana (2n = 2x = 48), manggis merupakan turunan yang
memiliki morfologi intermediet antara 2 spesies diploid ini.
Biji manggis merupakan biji apomiksis yaitu biji yang terbentuk bukan
merupakan hasil perkawinan/seksual sehingga secara genetik turunan yang
dihasilkan akan sama dengan induk betina (Verheij dan Coronel,1992).
Tanda-tanda apomiksis pada manggis antara lain adalah terjadinya pengecambahan biji
tanpa adanya peran dari organ jantan, adanya proembryo adventitious
pertumbuhan secara vegetatif dari nucellar atau jaringan integumen, dan
menghasilkan beberapa kecambah dari satu biji (Richards 1990). Kihara (1951)
mengatakan bunga jantan tanaman manggis mengalami rudimenter sehingga hal
ini menjadi kendala untuk perbaikan varietas melalui persilangan. Pertumbuhan
lambat dan system perakaran manggis kurang berkembang (Cox, 1970).
Lambatnya pertumbuhan bibit manggis disebabkan akar lateral yang tidak
Perbanyakan manggis secara umum dilakukan melalui biji dan cara
perbanyakan lainnya, seperti penyusuan, sambung pucuk atau kultur jaringan.
Tanaman manggis bersifat apomiksis sehingga tanaman yang berasal dari biji
secara genetis akan sama dengan induknya (Horn 1940 ; Ochse et al . 1961; Cox
1976). Metode pemuliaan manggis yang telah diterapkan diantaranya adalah
dengan irradiasi sinar gamma dengan dosis tertentu, hibridisasi, transformasi gen,
irradiasi nodular kallus, dan irradiasi benih.
Keragaman Genetik
Keragaman genetik dalam populasi memiliki arti yang sangat penting
untuk pengembangan sumber genetik yang dibutuhkan bagi kegiatan pemuliaan
(Karsinah dkk. 2002). Keragaman genetik memainkan peranan penting dalam
adaptabilitas suatu spesies. Spesies yang memiliki derajat keragaman genetik yang
tinggi akan memiliki lebih banyak variasi alel yang dapat diseleksi (Elford dan
Stansfield, 2007).
Menurut Nijs dan Van Dijk (1993) manggis termasuk dalam
agamospermae sehingga biji yang dihasilkan biji apomiksis. Oleh sebab itu perlu
untuk membuat keragaman genetik pada tanaman manggis. Manggis termasuk
tanaman yang membiak dengan biji secara apomiksis sehingga manggis yang
berasal dari biji mempunyai kesamaan genotipe dengan induknya. Artinya
tanaman manggis yang diperbanyak dengan biji dan vegetatif akan mempunyai
susunan yang sama (Bradshaw, 1980). Verheij (1991) mengatakan bahwa pada
Manggis termasuk tanaman agamospermy yang reproduksinya secara
aseksual melalui jaringan proembrio jaringan ovular. Implikasi dari system
reproduksi yang aseksual tersebut seharusnya manggis menghasilkan buah yang
seragam dan hanya ada satu varietas (Horn, 1940, Richard 1990). Namun
kenyataannya dijumpai berbagai ragam bentuk, penampilan, ukuran daun dan
buah (Gonzales dan Quirino 1951, Mansyah et al. 1992).
Keragaman genetik pada manggis kemungkinan disebabkan
perkembangan ploidi. Dari hasil penelitian pada tiga group tetua dan progeni dari
manggis menunjukkan adanya keragaman genetik pada progeninya. Dimana
keragaman antara keturunan dan tetuanya bekisar 0.59 – 1.0. Hal ini dapat
menunjukkan bukti yang mendukung adanya keragaman genetik pada manggis
yang tergolong tanaman apomiksis (Mansyah et al. 2007). Seperti dalam
penelitian terdahulu (Mansyah et al. 2004) variasi genetik dapat terjadi antara
tanaman induk manggis dan keturunannya. Banyak bentuk keragaman genetik
yang mungkin timbul setelah terjadinya hibridisasi dari perkawinan seksual
dengan sifat reproduktif yang divergen (Spillane et al. 2001)
Hasil pengamatan Mansyah et al (1999) menunjukkan bahwa populasi
manggis Sumatera Barat memiliki variabilitas fenotif yang luas untuk karakter
panjang daun, jumlah buah per tandan, bobot buah, tebal kulit buah dan total
padatan terlarut. Namun dari hasil isoenzim glucose phosphate isomerase
diketahui bahwa manggis yang berasal dari lokasi yang berbeda diperoleh pola
pita yang sama.
Indonesia adalah salah satu negara penghasil manggis, dan pohon manggis
keragaman morfologi pada pohon manggis yang tersebar di Indonesia. Daerah
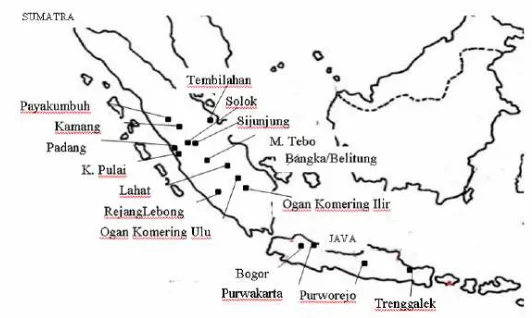
penyebaran manggis yang diobservasi meliputi Sumatera Barat (Padang,
Payakumbuh, Sawahlunto/Sijunjung, Lubuk Alung, Kamang, Pesisir Selatan,
Pasaman dan Solok), Riau (Tembilahan-Indragiri Hilir), Jambi (Muaro Tebo),
Sumatera Selatan (Lahat, Ogan Komering Ilir, and Ogan Komering Ulu),
Bengkulu (Pal VIII, Rejang Lebong), Bangka/Belitung (Badau, Buluh Tumbang,
Kelapa Kampit, Bantan, dan Pelulusan ). Di Jawa , survey meliputi Jawa Barat
(Leuwiliang-Bogor dan Wanayasa-Purwakarta), Jawa Tengah (Kaligesing –
Purworejo) dan Jawa Timur (Watulimo-Trenggalek).Survey ini meliputi 192
pohon yang berusia lebih besar dari 25 tahun. Lokasi survei dapat dilihat pada
Gambar 1.
Gambar 1. Lokasi penyebaran manggis di Sumatera dan Jawa (Mansyah, 2010)
Dari hasil observasi tersebut terdapat keragaman morfologi yang dapat
dikelompokkan dalam 11 karakter morfologi. Karakter tersebut meliputi : bentuk
kanopi/ canopy shape, warna daun dewasa/ mature leaf colour, jumlah bunga dan
buah per kluster/ number of flowers and fruits per cluster, panjang pedikal/
stigma/ stigma lobe shape, ukuran dan ketebalan/ size, and thickness, jumlah
segment buah/ the number of fruit segments, dan ketebalan kulit/ rind thickness.
Beberapa peneliti juga melaporkan adanya keragaman morfologi pada
manggis. Wester (1962) menggambarkan bahwa manggis Jolo memiliki bentuk
yang lebih besar dan kulit yang lebih tebal dibandingkan dengan yang ada di
Singapura dan Saigon. Rasanya lebih asam dari pada yang ada di Malaysia. Cox
(1970) melaporkan bahwa terdapat rasa yang paling enak dan ukuran yang lebih
besar dijumpai pada manggis Jawa dibandingkan yang biasa didapati pada
manggis di Filipina. Beberapa pohon di Burma didapati memiliki bercak kuning.
Di Nicaragua didapati pula ukuran manggis dan ukuran daun yang lebih kecil.
Manggis telah memberikan nilai value yang tinggi bagi buah ekspor
Indonesia. Untuk itu perlu adanya pengembangan ke arah peningkatan nilai
ekonomis. Kendala – kendala saat ini yang ada antara lain pertumbuhan yang
lambat, kualitas rendah dengan adanya bercak pada kulit buah, getah kuning pada
kulit dan buah. Indonesian Agency for Agricultural Research and Development
(IAARD) memberikan rekomendasi berdasarkan penelitian yang telah dilakukan
untuk pengembangan kualitas manggis yaitu : mempercepat pertumbuhan
manggis dengan memanipulasi penggunaan CO2, penggunaan mikoriza, teknologi
ramah lingkungan, pemupukan dan irigasi yang baik (Mansyah et al. 2013)
Pemuliaan secara konvensional sulit dilakukan pada tanaman manggis
dikarenakan polen mengalami rudimenter sehingga dapat dikatakan manggis tidak
memiliki polen dan masa pertumbuhan yang lama (Morton, 1987). Fauza et al
(2005) menyatakan bahwa iradiasi sinar gamma pada biji manggis
yang diamati seperti tinggi tanaman, jumlah daun per tanaman, diameter batang,
dan lebar daun. Induksi iradiasi sinar gamma dapat meningkatkan keragaman
genetik manggis. Keragaman genetik akibat iradiasi sinar gamma berdasarkam
marka ISSR meningkat sebesar 5% dibandingkan tanpa iradiasi. Pada tanaman
padi, radiasi dengan sinar gamma pada dosis tertentu diketahui dapat menginduksi
mutasi klorofil dan meningkatkan varaisi genetic ketahanan terhadap penyakit
blas (Mugiono, 1996).
Studi genetika populasi melalui persilangan sulit dilakukan pada tanaman
manggis karena merupakan tanaman berumur panjang dan bersifat apomiksis.
Pola keragaman genetika dan pewarisan sifat pada tanaman sejenis manggis
adalah dengan pengamatan langsung pada populasi yang ada dan bantuan marka
molekuler. Penggunaan marka molekuler mempunyai beberapa keuntungan
diantaranya tidak dipengaruhi oleh lingkungan serta memberikan informasi
langsung dari genom individu (Leverbre et al. 2001)
Upaya perbaikan sifat tanaman manggis dengan meningkatkan keragaman
genetiknya perlu dilakukan. Seperti telah diketahui, modal dasar pemulian
tanaman adalah adanya keragaman yang luas. Dengan adanya variabilitas yang
luas , proses seleksi dapat dilakukan secara efektif karena akan memberikan
peluang yang lebih besar untuk diperoleh karakter-karkter yang diinginkan (Sobir
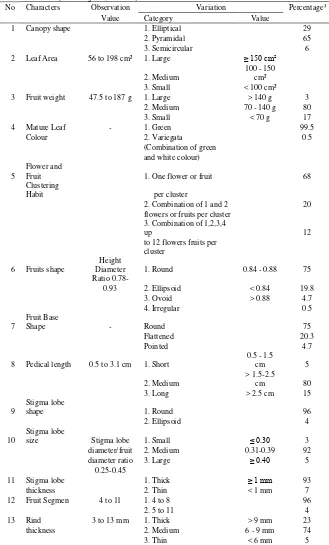
Tabel 1. Karakter morfologi manggis yang tersebar di Jawa dan Sumatera (Mansyah, 2010)
No Characters Observation Variation Percentage¹ Value Category Value
1 Canopy shape 1. Elliptical 29
2. Pyramidal 65
3. Semicircular 6
2 Leaf Area 56 to 198 cm² 1. Large ≥ 150 cm²
2. Medium
100 - 150 cm² 3. Small < 100 cm² 3 Fruit weight 47.5 to 187 g 1. Large > 140 g 3
2. Medium 70 - 140 g 80 3. Small < 70 g 17 4 Mature Leaf - 1. Green 99.5
Colour 2. Variegata 0.5
(Combination of green and white colour)
5
Flower and
Fruit 1. One flower or fruit 68 Clustering
Habit per cluster
2. Combination of 1 and 2 20 flowers or fruits per cluster
3. Combination of 1,2,3,4
up 12
to 12 flowers fruits per cluster
6 Fruits shape
Height
Diameter 1. Round 0.84 - 0.88 75 Ratio
0.78-0.93 2. Ellipsoid < 0.84 19.8 3. Ovoid > 0.88 4.7 4. Irregular 0.5
7
Fruit Base
Shape - Round 75
Flattened 20.3
Pointed 4.7
8 Pedical length 0.5 to 3.1 cm 1. Short
0.5 - 1.5
cm 5
2. Medium
> 1.5-2.5
cm 80 3. Long > 2.5 cm 15
9
Stigma lobe
shape 1. Round 96
2. Ellipsoid 4
10
Stigma lobe
size Stigma lobe 1. Small ≤ 0.30 3 diameter/fruit 2. Medium 0.31-0.39 92 diameter ratio 3. Large ≥ 0.40 5
0.25-0.45
11 Stigma lobe 1. Thick ≥ 1 mm 93 thickness 2. Thin < 1 mm 7 12 Fruit Segmen 4 to 11 1. 4 to 8 96
2. 5 to 11 4
Hasil Amplifikasi Fragment Length Polymorphism (AFLP) terhadap sembilan
sampel genom manggis menunjukkan adanya keragaman yang tinggi. Dengan
metode underweighted pair-group with arithme average (UPGMA) pada koefisen
jarak genetik 60% menghasilkan satu kelompok genom, dan pada koefisien
kesamaan genetik 70% menghasilkan tiga kelompok aksesi manggis. Informasi
variabilitas genetik diharapkan dapat mendukung program pemuliaan manggis
(Makful et al. 2010)
Ramage et al. (2004) melaporkan adanya hubungan kekerabatan antara 37
aksesi spesies manggis dan antara 11 aksesi dari 8 spesies Garcinia lainnya
dengan menggunakan marka molekular Randomly Amplified DNA Fingerprinting
(RAF). Hasilnya memperlihatkan pada 26 aksesi yang ada tidak terdapat variasi
yang dideteksi diatas 530 loci. 8 aksesi (22%) menunjukkan variasi namun pada
tingkat yang sangat rendah (0.2-1%) dan 3 aksesi lainnya (8%) menunjukkan
tingkat keragaman yang lebih ekstensif.
Sinaga et al. (2007) melaporkan keragaman genetik 99 aksesi manggis di
Indonesia dengan penanda RAPD diperoleh 88 pita DNA yang berbeda dengan
kisaran 0.2 – 2.0 yang diamplifikasi dengan menggunakan delapan primer terpilih
yaitu SBH 12, SBH 13, SBH 14, SBH 19, OPA 14, OPA 16, OPA 17, OPA 18.
Penggunaan DNA marker dengan teknik AFLP dengan menggunakan 4
jenis isoenzim yaitu Esterase (EST), Peroxidase (PER), Acid Phosphatase (ACP),
dan Malic dehydrogenase (MDH) pada 13 aksesi manggis dan tanaman yang
masih memiliki hubungan kekerabatan, diperoleh 220 pita polimorfik dan
Keragaman genetik pada tanaman menggis tergolong terbatas dan untuk
meningkatkan keragaman genetik dapat digunakan mutasi dengan sinar gamma
dan selanjutnya karakter morfologi seperti karakter pertumbuhan bibit, struktur
anatomi daun, system perakaran pada biji yang dilakukan pada dua varietas yaitu
Wanayasa dan Puspahiang. Radiasi sinar gamma juga dilakukan pada 22 putative
mutant yang diamplifikasi dengan 5 primer, dan diperoleh hasil bahwa keragaman
genetik tertinggi terjadi pada kalus nodular dibandingkan dengan perlakuan
radiasi pada biji (Sobir dan Poerwanto, 2007). Penelitian lain juga menunjukkan
biji manggis yang dikulturkan dalam medium 1/2 MS yang ditambahkan 5 ppm
BAP dan diberi perlakuan radiasi pada 11 level dosis sinar gamma juga
memperlihatkan perubahan morfologi pada akar, daun dan parameter anatomi
lainnya (Harahap, 2005).
Keragaman genetik manggis dengan menggunakan ISSR (Inter-simple
sequence repeat) pada 23 aksesi manggis di pulau Sumatera diperoleh koefisien
keragaman pada kisaran 0.44 – 0.96, dengan menggunakan 11 primer, 2 diantara
primer tersebut adalah monomorfik. Primer yang digunakan yaitu PKBT-2,
PKBT-3, PKBT-4, PKBT-5, PKBT-7, PKBT-8, PKBT-10, PKBT-11, PKBT-12,
PKBT-14 dan ISSRED-14 (Mansyah, et al. 2010).
Sobir et al. (2011) berhasil melakukan analisis keragaman dengan teknik
ISSR pada 28 aksesi manggis dan 11 kerabatnya dengan menggunakan 7 primer.
Primer yang digunakan antara lain : 2, 4, 5, 6,
PKBT-3, PKBT-10. Dari hasil dendrogram diperoleh 7 kerabat dekat G. mangostana
yaitu (G. sizygiifolia, G. hombroniana, G. celebica-2, G. livingstonei, G. bancana,
yang berada dalam 1 group dengan G. mangostana adalah G. xanthochymus, G.
malaccenensis, G. celebica-1 dan G. dulcis. Dengan koefisien keragaman pada
level 22%.
Untuk mengetahui keragaman manggis di pulau Jawa (Prabowo 2002 ;
Mansyah 2002) dengan teknik DNA, mengekstrak DNA dari 21 aksesi yang
terdiri dari 10 yang berasal dari Wanayasa, 5 dari Leuwiliang, 4 dari Kaligesing
dan 2 dari Watulimo. Lima primer terpilih yang digunakan adalah SB13, SB19,
OPH12, OPH13 dan OPH18. Dengan teknik RAPD ini berhasil diperoleh total 51
pola pita dan 42 pola pita (82.4%) yang polimorfik.
Sahasrabudhe and Deodhar (2010) melaporkan hasil RAPD manggis yang
berasal dari bagian barat Ghats, India. Enam primer yang digunakan yaitu
OPD-02, OPD-05, OPD-07, OPD-08, OPD-11 dan OPD-13 menghasilkan pola pita
polimorfik sebanyak 28 pola pita. Persentase polimorfis berada pada range 13 –
37.5%.
Yapwattanaphun et al. (2002) melaporkan hasil hasil ITS (internal
transcriber spacer region of ribosomal DNA/ nrDNA dari 17 spesies Garcinia
termasuk spesies G. mangostana diperoleh bahwa G. malaccensis adalah tetua
dari manggis dan satu lagi yang kemungkinan menjadi tetua manggis adalah G.
hombroniana. ITS sekuensing analisis juga memperlihatkan G. atroviridis,
G.cowa, G. dulcis, G. malaccensis, G. mangostana, G. rostrata dan G. vilersiana
memiliki dua nukleotida pada posisi nukleotida yang sama.
Adanya getah kuning pada buah manggis saat ini menjadi faktor
pengganggu bagi penerimaan konsumen terhadap kualitas buah manggis. Salah
wavelength near infrared (SW-NIR) transmittance spectroscopy. Sontisuk, et al.
(2006) melakukan teknik ini pada 193 manggis yang berasal dari Kasetsart
Agricultural and Agro-Industrial Product Improvement Institute, Bangkok,
Thailand. Dengan teknik ini dapat dideteksi adanya getah kuning dan diharapkan
dengan teknik ini juga dapat digunakan untuk mendeteksi karakter lainnya seperti
ukuran buah, ketebalan kulit, biji, kandungan getah dan warna kulit yang
bertujuan untuk peningkatan kualitas ekonomi buah manggis.
Untuk menentukan keragaman genetik tanaman dapat didasarkan pada
sifat agronomi, morfologi, biokimia, dan marka molekuler. Namun penanda
molekuler dapat menunjukkan perbedaan genetik pada tingkat yang lebih rinci
tanpa gangguan faktor lingkungan serta melibatkan teknik yang memberikan hasil
keragaman genetik yang cepat. Berbagai jenis penanda molekuler berbeda
potensinya dalam mendeteksi perbedaaan antara individu, biaya, fasilitas yang
dibutuhkan, konsistensi dan replikasi hasil (Mohammadi dan Prasanna, 2003 ;
Sudre et al. 2007)
Marka RAPD
Identifikasi dan karakterisasi manggis dan kerabat dekatnya penting
dilakukan untuk memperoleh sumber keragaman genetik baru, untuk pemanfaatan
konservasi dan pemuliaan genetiknya (Sinaga, et al. 2007). Metode yang sering
digunakan untuk studi keragaman genetik berdasarkan sidik jari DNA yang
berbasis polymerase chain reaction (PCR) seperti Random amplified polymorphic
Studi genetika pada tanaman yang apomiksis seperti manggis dibutuhkan
dua pendekatan yaitu pada tanaman tetua dan pada keragaman progeninya dengan
analisis molekular (Koltunov, 1993). Fase juvenile pada tanaman manggis yang
cukup lama menyebabkan sulitnya untuk mengamati dan menganalisis keragaman
yang terjadi pada keturunannya. Hal ini dapat diatasi dengan mengevaluasi
karakter morfologi pada beberapa populasi manggis, menganalisis karakter biji
dan ditanam pada lokasi yang sama, kegiatan ini dapat dilakukan dengan marka
molekuler.
Marka Random amplified polymorphic DNA (RAPD) merupakan metode
yang menggunakan oglionukleotida tunggal pendek (primer), sepanjang 10-12
basa, untuk membentuk fragmen-fragmen DNA. Metode RAPD memanfaatkan
PCR untuk mengamplifikasi sekuen DNA yang komplementer terhadap primer.
Sekuen DNA yang komplementer dengan primer akan terhibridisasi secara acak
(random), selanjutnya dilakukan perbanyakan (amplified) terhadap sekuen-sekuen
DNA komplementer tersebut. Tahap selanjutnya yaitu melakukan elektroforesis
pada agarose atau polyacrilamide gel untuk memisahkan fragmen DNA
berdasarkan ukurannya. Kemudian dilakukan pewarnaan dengan ethidium
bromide dan fragmen-fragmen DNA akan terlihat jika disinari dengan sinar UV.
Metode RAPD dapat menghasilkan beragam pita pada individu dengan primer
tunggal. Variasi band yang terlihat umumnya disebut random amplified
polymorphic DNA (RAPD) bands. Polimorphisme akan terlihat dan selanjutnya
bisa digunakan sebagai marka genetik. Pemanfaatan metode RAPD antara lain
untuk deteksi polimorphisme sekuens DNA, pemetaan genetik berbagai populasi,
(filogenetik). Metode RAPD mempunyai keunggulan dan juga kekurangan.
Keunggulan metode RAPD yaitu waktu yang dibutuhkan singkat, mudah
dilaksanakan, lebih murah, dan primer yang diperlukan sudah banyak
dikomersilkan sehingga mudah diperoleh. Metode ini dapat digunakan untuk
menganalisis banyak organisme, karena primer yang digunakan bersifat universal
yang berarti primer dapat digunakan tanpa perlu mengetahui informasi sekuen
DNA terlebih dahulu (Weising et al. 1994)
Salah satu keuntungan pemakaian analisis keragaman genetik tanaman
dengan menggunakan teknik molekuler yang memanfaatkan teknologi amplifikasi
PCR adalah kuantitas DNA yang diperlukan hanya sedikit. Disamping itu, dalam
pelaksanaan teknik RAPD tingkat kemurnian DNA yang dibutuhkan tidak perlu
terlalu tinggi, atau dengan kata lain teknik amplifikasi PCR relatif toleran
terhadap tingkat kemurnian DNA. Walaupun demikian, dalam suatu teknik isolasi
DNA masih diperlukan suatu tahapan untuk meminimalkan senyawa-senyawa
kontaminan yang dapat mengganggu reaksi PCR seperti polisakarida dan
metabolit sekunder. Hal ini disebabkan keberadaan polisakarida dan metabolit
sekunder dalam sel tanaman sering menyulitkan dalam isolasi asam nukleat.
Adanya polisakarida dan senyawa metabolit sekunder dalam sel tanaman sering
menyulitkan dalam proses isolasi asam nukleat. Struktur polisakarida yang mirip
dengan asam nukleat akan menyebabkan polisakarida tersebut akan mengendap
bersama dengan asam nukleat (Wilkins dan Smart, 1996).
Dalam program pemuliaan tanaman, diperlukan identifikasi baik karakter
morfologi maupun molekuler untuk menguji keragaman genotip klon-klon yang
yang sebanding dengan RFLP dalam hal analisis kekerabatan antar genotif dan
mampu menghasilkan jumlah karakter yang tidak terbatas sehingga sangat
membantu dalam analisis keragaman genetik tanaman yang tidak diketahui latar
belakang genomnya. Analisis RAPD hanya memerlukan sejumlah kecil DNA
sehingga sangat sesuai untuk species tanaman berkayu. RAPD memerlukan biaya
lebih rendah dibandingkan biaya untuk uji kekerabatan berdasarkan analisis DNA
yang lain. Pemakaian marka molekuler RAPD banyak digunakan untuk menyusun
kekerabatan beberapa individu dalam spesies maupun kekerabatan antar spesies.
Penggunaan kekerabatan ini dapat dijadikan rujukan dalam pemuliaan persilangan
untuk mendapatkan keragaman yang tinggi dari hasil suatu persilangan. Teknik
RAPD menggunakan primer acak maupun spesifik telah terbukti dapat digunakan
sebagai penanda molekuler untuk berbagai karakter agronomis penting
(Maftuchah, 2001).
Dengan teknik RAPD didapatkan variasi genetik antar populasi manggis
Jawa dan Sumatera. Besarnya variasi genetik tersebut sangat ditentukan oleh jenis
primer yang digunakan (Mansyah, 2002).
Sompong (2004) dengan menggunakan teknik RAPD untuk
mengidentifikasi kesamaan genetik pada mikropropagasi. Mereka melakukan
perbanyakan somaklonal dengan menghasilkan nodular kalus yang berasal dari
daun manggis. Delapan pola pita berhasil diamplifikasi dan menunjukkan tidak
terdapat polimorfis pada somaklon. Hal ini memperlihatkan bahwa teknik RAPD
dapat dipakai untuk melihat ada tidaknya polimorfisme walaupun pada
masing-masing individu tersebut terdapat keragaman morfologi.
BAHAN DAN METODE Tempat dan Waktu
Penelitian ini dilaksanakan di Laboratorium Terpadu Fakultas Kedokteran
Universitas Sumatera Utara. Dimulai pada bulan April 2014 hingga Oktober 2014.
Bahan dan Alat
Bahan yang digunakan pada penelitian ini adalah daun muda tanaman
manggis yang berasal dari kabupaten Tapanuli Selatan, Simalungun, Deli
Serdang, Serdang Bedagai dan Langkat. Nitrogen cair (N2), 0.1 gr, buffer CTAB,
buffer TAE, buffer TE, Chloroform Isoamilakohol 24 :1 (KIAA), NaCl, NaOH,
Sodium asetat (CH3COONa3H2O), Na-EDTA, HCl p.a. alkohol 100% dan 70 %,
Isopropanol dingin, aquadest, β-mercaptoetanol , Agarose (promega V3121),
primer oligonukleotida, master mix (promega M7122), DNA leader Amresco 1 kb
(K181-500 µl), kertas tissue.
Alat yang digunakan dalam penelitian ini adalah GPS, gunting, timbangan
digital, hot plate (Biosan), mortar, centrifuge (Eppendorf 5415), vortex, frezer,
tabung 2.0 ml dan 1.5 ml, mikropipet ukuran 1-50µl, 100-500 µl, 200-1000 µl
merek Biologix, pinset, sarung tangan, karet, tip pipet (warna putih, kuning,biru),
autoclave, kamera, penangas air (water bath Biosan), oven, pH meter, pengaduk
magnetik, alat-alat gelas (gelas ukur, gelas beker, Erlenmeyer, dll),
electrophoresis (Power PAC 3000, Biorad), PCR (Thermal Cycler) Applied
Metode Penelitian
Pengambilan Sampel Daun
Daun manggis yang digunakan adalah daun dari populasi alam di daerah
kabupaten Tapanuli Selatan : Napa (TS1), Sipenggeng (TS2), Huraba 1 (TS2),
Pangarongan (TS4), Simasom (TS5). Kabupaten Simalungun : Sirama-1 (Sim1),
Sirama-2 (Sim2), Petani Timur (Sim3). Kabupaten Deli Serdang : Pancur Batu
(DS1), Tiang Layar (DS2), Rambung Baru (DS3), Bingkawan (DS4), Sembahe
(DS5). Kabupaten Serdang Bedagai : Celawan-1(Srg1), Celawan-2 (Srg2), Besar
Terjun (Srg3), Meteran (Srg4), Firdaus (Srg5). Kabupaten Langkat : Stabat Lama
(Lkt1), Stabat Banyumas (Lkt2), Pertumbukan (Lkt3), Stabat Baru (Lkt4), Stabat
Barat-1(Lkt5), Stabat Barat-2 (Lkt6), Stabat Kota (Lkt7), Hulu Berayun (Lkt8),
Namo Cengkeh (Lkt9), Tanjung Keliling (Lkt10), Namo Datok (Lkt11), Sukatani
(Lkt12) dipilih yang masih muda /lembut berwarna hijau muda. Lalu dicuci
bersih, dilap dengan memakai tissue dan kemudian dibawa ke Laboratorium
Terpadu Fakultas Kedokteran Universitas Sumatera Utara.
Isolasi dan Pemurnian DNA
Daun manggis ditimbang 0,1 - 0,2 gram. Daun dipotong halus dengan
gunting secara melintang. Isolasi DNA genomic dilakukan dengan metode CTAB,
Orozco-Castillo et al. (1994) yang dimodifikasi dengan penambahan β
-merkaptoetanol dan nitrogen cair pada saat ekstraksi (Toruan dan Hutabarat,
1997). Daun digerus dalam mortar dan diberi nitrogen cair (N2) hingga daun
benar-benar lumat. Daun dipindahkan ke dalam tabung mikro 2 ml, diberi buffer
dipanaskan pada waterbath selama 60 menit dengan suhu 65 º C. Masing – masing
tabung diberi tanda sesuai dengan kode sampel yang digunakan.Tabung
diinkubasi dan diberikan larutan Chloroform Isoamilalkohol (KIAA) 1 ml ke
dalam tabung. Kemudian tabung dikocok lagi hingga homogen. Tabung
disentrifugasi selama 15 menit dengan kecepatan 13.000 rpm.
Bila sentrifugasi berhasil maka supernatan akan terpisah berdasarkan berat
jenisnya. Kemudian larutan fase atas dipindahkan ke tabung mikro lain lalu
diberikan larutan KIAA 1ml dan diberi perlakuan yang sama. Supernatan
dipindahkan ke tabung mikro 2 ml (jika warna supernatant masih coklat dapat
diberikan larutan KIAA kembali dan ditambahkan isopropanol dingin dan sodium
asetat (CH3COONa3H2O). Tabung dikocok dan diperhatikan apakah ada
benang-benang halus putih yang muncul. Bila benang-benang – benang-benang halus putih sudah tampak
jelas, tabung dapat disimpan pada suhu 4º C selama 1 malam. Keesokan harinya
cairan isopropanol dibuang dan benang – benang halus dalam tabung ditinggalkan
dan dikering-anginkan. Kemudian ke dalam tabung ditambahkan buffer TE,
ditambah etanol dingin 100% dan Sodium asetat (CH3COONa3H2O), lalu di spin
manual agar terbentuk suspense antara pellet dengan buffer TE (Orozco-Castillo
et al. 1994) lalu disimpan pada suhu 4ºC selama 2-3 jam. Tabung disentrifugasi
kembali selama 20 menit pada kecepatan 13.000 rpm. Lalu dicuci dengan etanol
70%. Selanjutnya fase atas dibuang, tabung dikering-anginkan kemudian
ditambah 100 µl buffer TE dan pellet DNA disuspensikan ke dalam buffer. Stok
DNA yang diperoleh dapat disimpan pada suhu ± 20ºC bila tidak digunakan
Uji Kualitas DNA
Uji kualitas DNA dilakukan dengan elektroforesis metode standard dengan
memasukkan 5 µl DNA stok manggis ditambah 2 µl loading dye.
Sebelum dilakukan elektroforesis disiapkan gel agarose konsentrasi 0. 8
% (b/v). Agarose ditimbang sebanyak 0.28 g, kemudian dilarutkan ke dalam 35
ml - 1 x buffer TAE . Larutan tersebut dimasukkan ke dalam erlenmeyer dan
diberi tanda. Tabung tersebut dipanaskan dan diaduk dengan pengaduk magnetic
hingga larutan menjadi bening dan dibiarkan mendidih selam 25 menit. Lalu
ditambahkan Ethibium bromide (etbr) sebanyak 1 µl. Setelah larutan agak dingin
(suhu ± 60º C), larutan dimasukkan dalam cetakan agar yang telah dipasang sisir
pembuat lubang dan dibiarkan memadat selama ± 40 menit. Gel yang telah
memadat dimasukkan ke dalam alat elektroforesis dan diberi larutan TAE 1 x ± 30
ml (hingga terendam). Sampel DNA yang telah disiapkan dan telah diberi label
dimasukkan ke dalam sumur pada gel. Setelah semua sumur gel berisi selanjutnya
dilakukan elektroforesis. Running elektoforesis dilakukan pada kondisi 100 volt
selama 90 menit. Visualisasi DNA yang dilakukan dengan Gel Doc.
Kualitas DNA dinyatakan baik apabila hasil elektroforesis menunjukkan
pola pita yang terang dan fokus. Artinya DNA yang dihasilkan cukup solid, utuh
dan mempunyai konsentrasi tinggi.
Uji Kuantitas DNA
Pengujian kuantitas DNA dilakukan dengan metode spektofotometri pada
isolasi dan pemurnian. Sebanyak 3 ul stok DNA diteteskan pada spektrofotometri
dan dapat diperoleh kemurnian dan konsentrasi DNA sampel
Amplifikasi/ Genotyping
Amplifikasi mengikuti prosedur analisis RAPD (Random Amplified
Polymorphic DNA), sesuai prosedur William et al. (1990). Amplifikasi dilakukan
dengan menggunakan primer polimorfik . Primer RAPD yang digunakan berasal
dari Sigma Aldrich.
Sebelum running PCR dilakukan pembuatan master mix yang terdiri dari
Go Green Taq untuk 31 tube x 12.5 µl dan ddh2O sebanyak 31 tube x 9.5 µl.
Kemudian dilakukan pengenceran primer yaitu tube berisi primer disentrifugasi
selama 5 detik setelah itu ditambahkan ddH2O sesuai molar (misalnya OPC-07 =
1238 µl). Primer dimasukkan 2 µl per tube PCR dan DNA sampel masing-masing
1 µl. Setelah itu tabung PCR yang berisi stok DNA dan campuran master mix
dimasukkan ke dalam blok sampel di mesin PCR dengan annealing 36 ºC. Reaksi
amplifikasi gen dilakukan di mesin PCR dari produk Applied Biosystems yang
didesain waktu, suhu, jumlah siklus, termal 45 kali (3 jam 51 menit) yang telah
digunakan pada tanaman kelapa sawit (Setiyo, 2001). Suhu denaturasi awal 94ºC
selama 2 menit, sebanyak 1 siklus. Denaturasi 94ºC selama 1 menit sebanyak 45
siklus. Suhu aneling 36ºC selama 1 menit sebanyak 45 siklus. Ekstension pada
suhu 72ºC selama 1 menit sebanyak 45 siklus, serta ekstension akhir 72ºC selama
10 menit sebanyak 1 sikus dan kondisi akhir PCR pada 4ºC.
Setelah reaksi PCR selesai DNA hasil amplifikasi disimpan dalam suhu 4º
Elektroforesis hasil PCR
Sebelum dilakukan elektroforesis, disiapkan gel agarose konsentrasi 1 %
(b/v) dan ditambahkan larutan TAE. Larutan tersebut dimasukkan ke dalam
Erlenmeyer, kemudian dipanaskan dan diaduk dengan pengaduk magnetic hingga
larutan menjadi bening. Kemudian didinginkan dengan dialirkan dengan air
mengalir. Sebanyak 1µl Ethidium bromide ditambahkan kemudian larutan
dipanaskan dan didinginkan dengan cara yang sama. Dan ditunggu hingga suhu ±
60º C. Dimasukkan dalam cetakan agar yang telah dipasang sisir pembuat lubang
(well-forming combs) dan dibiarkan memadat selama ± 40 menit atau sampai gel
mengeras. Sisir pembuat lubang dilepas secara perlahan dan gel agarose siap
digunakan untuk elektroforesis.
Untuk elektroforesis tray yang berisi gel agarose diletakkan di dalam tank
elektroforesis dan larutan buffer TAE 1 x dituang ke dalam tank tersebut ± 670 ml
(hingga terendam) hingga 1 mm di atas permukaan gel atau sampai batas yang
telah ditentukan. Sampel DNA yang telah diamplifikasi yang berada dalam
tube-tune PCR diambil sebanyak 8 ul lalu dimasukkan ke dalam sumur pada gel.
Marker / Ladder 1 Kb diberi loading dye (pewarnaan) sebanyak 2 µl dan dan
marker sebanyak 5 µl kemudian dicampur dengan mikropipet dan setelah rata
masing – masing dimasukkan ke dalam sumur berisi gel.
Setelah semua sampel DNA dimasukkan ke dalam sumur (well), tank
elektroforesis ditutup dan dihubungkan dengan arus listrik. Kemudian proses
elektroforesis siap dijalankan. Running elektroforesis dilakukan pada kondisi 100
volt selama 90 menit. Setelah running elektroforesis selesai, arus listrik dimatikan
Visualisasi DNA yang telah dielektroforesis dilakukan dengan UV transluminator
dengan cara meletakkan gel pada UV transluminator dan jika pita/band DNA
kelihatan dengan jelas maka dapat didokumentasikan.
Analisis Data
Penentuan Skoring Marka RAPD
Untuk menentukan keragaman genetik, produk PCR – RAPD dilakukan
scoring berdasarkan muncul tidaknya pita DNA. Pita yang muncul pada gel
diasumsikan sebagai pita RAPD. Keragaman pita RAPD ditentukan dari
perbedaan migrasi pita pada masing – masing individu sampel. Berdasarkan ada
atau tidaknya pita, profil pita diterjemahkan ke dalam data biner. Pita yang
muncul diberi kode 1 (ada) dan 0 (tidak ada).
Penentuan Pasangan Asam Basa
Ukuran fragmen basa (pasangan basa) adalah base pair/ bp. Ukuran produk
PCR ditentukan dengan log jarak menggunakan program regresi linier. Fragmen
DNA standard (DNA landder) digunakan sebagai absis (x) dan log jarak migrasi
sebagai ordinat (y). Dari persamaan ini ditentukan ukuran pasangan basa dari
fragmen produk PCR berdasarkan log jarak dari fragmen tersebut.
Matriks ketidaksamaan (dissimilarity) tiap kombinasi pasangan dihitung
berdasarkan Dissimilarity Index Simple Matching pada bootstraps 1000 sesuai
rumus :
d
ij =1
−
1dengan dij ketidaksamaan antara i dan j, L jumlah lokus, π merupakan
tingkat ploidi dan ml merupakan jumlah alel yang umum antara i dan j untuk
lokus l. Matriks jarak atau ketidaksamaan genetik untuk semua kombinasi
pasangan individu dapat dilakukan dengan dua tipe analisis deskriptif dari
keragaman yaitu : (1) Principal Coordinates Analysis (PCoA) yaitu suatu jenis
analisis factorial pada tabel ketidaksamaan untuk mendapatkan group origin
utama dan (2) Neighbour – Joining Tree (NJtree) untuk memperoleh gambaran
variasi molekuler. Perhitungan dan analisis deskriptif ini menggunakan software
DARwin 5.05 (Perrier dan Jacquemound-Collet 2009).
Nilai Polimorfisme Informasi Conten (PIC) dilakukan menurut
Roldan-Ruiz et al. (2000).
PIC
= 2
fi
(1-
fi
)
Dengan fi adalah frekuensi dari pita yang teramplikasi (pita yang muncul)
dan (1-fi) adalah frekuensi dari pita yang tidak teramplikasi (pita yang tidak
HASIL DAN PEMBAHASAN Hasil
Uji Kualitas DNA
Kualitas DNA dari hasil running elektroforesis 30 aksesi manggis populasi
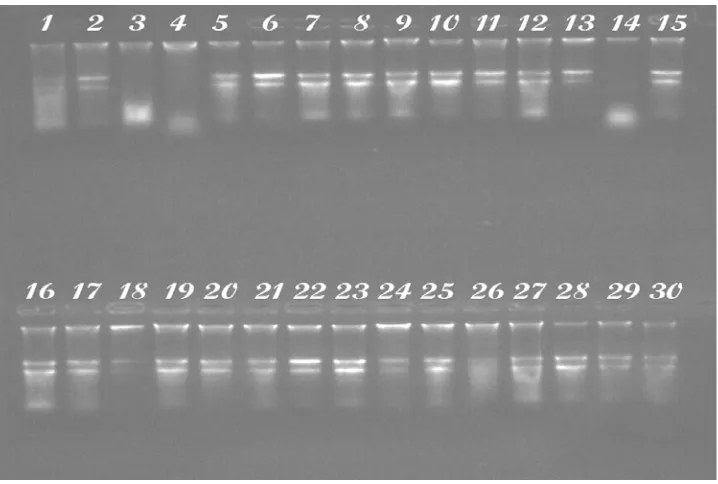
[image:46.595.117.476.248.490.2]Sumatera Utara yang digunakan dapat dilihat pada gambar berikut :
Gambar 3. Hasil elektroforesis 30 DNA sampel manggis populasi Sumatera Utara, 0.8 % agarose
Keterangan : (M) = Marker 1kb, (1) TS1, (2)TS2, (3)TS3, (4)TS5, (5)TS5, (6) Sim1, (7) Sim2, (8) Sim3, (9)DS1, (10)DS2, (11)DS3, (12)DS4, (13)DS5, (14)Srg1, (15)Srg2, (16)Srg3, (17)Srg4, (18)Srg5, (19)Lkt1, (20)Lkt2, (21)Lkt3, (22)Lkt4, (23)Lkt5, (24)Lkt6, (25)Lkt7, (26)Lkt8, (27)Lkt9, (28)Lkt10, (29)Lkt11, (30)Lkt12.
Kualitas DNA pada 0.8% gel agarose (Gambar 3) menunjukkan adanya
pola pita DNA yang terang dan jelas pada 30 sampel aksesi manggis populasi
Uji Kuantitas DNA
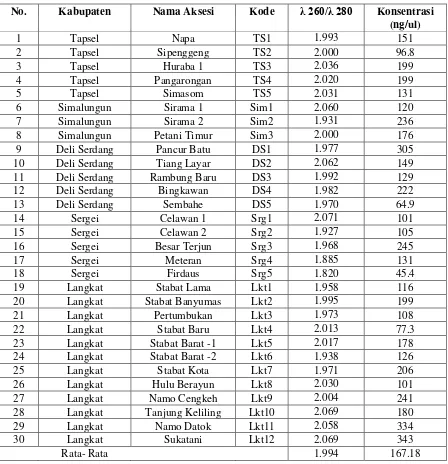
Tabel 2 . Hasil uji kuantitas dan konsentrasi DNA manggis populasi Sumatera Utara dengan spektrofotometer
No. Kabupaten Nama Aksesi Kode λ 260/λ 280 Konsentrasi
(ng/ul)
1 Tapsel Napa TS1 1.993 151
2 Tapsel Sipenggeng TS2 2.000 96.8
3 Tapsel Huraba 1 TS3 2.036 199
4 Tapsel Pangarongan TS4 2.020 199
5 Tapsel Simasom TS5 2.031 131
6 Simalungun Sirama 1 Sim1 2.060 120
7 Simalungun Sirama 2 Sim2 1.931 236
8 Simalungun Petani Timur Sim3 2.000 176
9 Deli Serdang Pancur Batu DS1 1.977 305
10 Deli Serdang Tiang Layar DS2 2.062 149
11 Deli Serdang Rambung Baru DS3 1.992 129
12 Deli Serdang Bingkawan DS4 1.982 222
13 Deli Serdang Sembahe DS5 1.970 64.9
14 Sergei Celawan 1 Srg1 2.071 101
15 Sergei Celawan 2 Srg2 1.927 105
16 Sergei Besar Terjun Srg3 1.968 245
17 Sergei Meteran Srg4 1.885 131
18 Sergei Firdaus Srg5 1.820 45.4
19 Langkat Stabat Lama Lkt1 1.958 116
20 Langkat Stabat Banyumas Lkt2 1.995 199
21 Langkat Pertumbukan Lkt3 1.973 108
22 Langkat Stabat Baru Lkt4 2.013 77.3
23 Langkat Stabat Barat -1 Lkt5 2.017 178
24 Langkat Stabat Barat -2 Lkt6 1.938 126
25 Langkat Stabat Kota Lkt7 1.971 206
26 Langkat Hulu Berayun Lkt8 2.030 101
27 Langkat Namo Cengkeh Lkt9 2.004 241
28 Langkat Tanjung Keliling Lkt10 2.069 180
29 Langkat Namo Datok Lkt11 2.058 334
30 Langkat Sukatani Lkt12 2.069 343
[image:47.595.107.555.167.631.2]Hasil PCR Dengan Marka RAPD
[image:48.595.116.479.125.250.2]1. Primer OPD-20
Gambar 4. Hasil pola pita DNA sampel dengan primer OPD-20
Keterangan : (M) = Marker 1kb, (1) TS1, (2)TS2, (3)TS3, (4)TS5, (5)TS5, (6) Sim1, (7) Sim2, (8) Sim3, (9)DS1, (10)DS2, (11)DS3, (12)DS4, (13)DS5, (14)Srg1, (15)Srg2, (16)Srg3, (17)Srg4, (18)Srg5, (19)Lkt1, (20)Lkt2, (21)Lkt3, (22)Lkt4, (23)Lkt5, (24)Lkt6, (25)Lkt7, (26)Lkt8, (27)Lkt9, (28)Lkt10, (29)Lkt11, (30)Lkt12.
Hasil amplifikasi dengan primer OPD-20 pada 30 aksesi populasi manggis
Sumatera Utara diperoleh 241 pita DNA (Gambar 4). Pola pita terendah berada
pada 146 bp yang hanya dimiliki oleh DS1, DS4, Lkt1, Lkt5, Lkt7, Lkt8 dan Lkt9.
Pola pita tertinggi berada pada 1350 bp yang dimiliki oleh TS2
2. Primer OPN-03
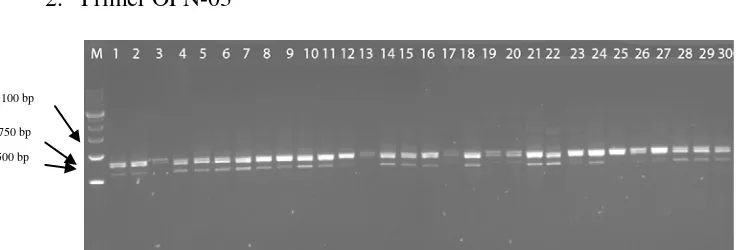
Gambar 5. Hasil pola pita DNA sampel dengan primer OPN-03
Keterangan : (M) = Marker 1kb, (1) TS1, (2)TS2, (3)TS3, (4)TS5, (5)TS5, (6) Sim1, (7) Sim2, (8) Sim3, (9)DS1, (10)DS2, (11)DS3, (12)DS4, (13)DS5, (14)Srg1, (15)Srg2, (16)Srg3, (17)Srg4, (18)Srg5, (19)Lkt1, (20)Lkt2, (21)Lkt3, (22)Lkt4, (23)Lkt5, (24)Lkt6, (25)Lkt7, (26)Lkt8, (27)Lkt9, (28)Lkt10, (29)Lkt11, (30)Lkt12
Amplifikasi PCR dengan primer OPN-03 pada 30 DNA sampel
menghasilkan 88 pita (Gambar 5). Pola pita berkisar antara 1.100 -750 bp .
500 bp 750 bp 1100 bp
1350 bp 1000 bp
[image:48.595.109.479.459.584.2]3. Primer OPH-06
Gambar 6. Hasil pola pita DNA sampel dengan primer OPH-06
Keterangan : (M) = Marker 1kb, (1) TS1, (2)TS2, (3)TS3, (4)TS5, (5)TS5, (6) Sim1, (7) Sim2, (8) Sim3, (9)DS1, (10)DS2, (11)DS3, (12)DS4, (13)DS5, (14)Srg1, (15)Srg2, (16)Srg3, (17)Srg4, (18)Srg5, (19)Lkt1, (20)Lkt2, (21)Lkt3, (22)Lkt4, (23)Lkt5, (24)Lkt6, (25)Lkt7, (26)Lkt8, (27)Lkt9, (28)Lkt10, (29)Lkt11, (30)Lkt12.
Hasil amplifikasi dengan primer OPH-06 pada 30 aksesi populasi manggis
Sumatera Utara diperoleh 127 pita DNA (Gambar 6). Pita DNA tertinggi
dihasilkan oleh TS2 pada 1.465 bp, dan terendah TS1 pada 260 bp. Pola pita
berkisar antara 1400 bp dan 970 bp
4. Primer OPC-07
Gambar 7. Hasil pola pita DNA sampel dengan primer OPC-07
Keterangan : (M) = Marker 1kb, (1) TS1, (2)TS2, (3)TS3, (4)TS5, (5)TS5, (6) Sim1, (7) Sim2, (8) Sim3, (9)DS1, (10)DS2, (11)DS3, (12)DS4, (13)DS5, (14)Srg1, (15)Srg2, (16)Srg3, (17)Srg4, (18)Srg5, (19)Lkt1, (20)Lkt2, (21)Lkt3, (22)Lkt4, (23)Lkt5, (24)Lkt6, (25)Lkt7, (26)Lkt8, (27)Lkt9, (28)Lkt10, (29)Lkt11, (30)Lkt12.
Amplifikasi PCR dengan primer OPC-07 pada 30 DNA sampel
menghasilkan 54 pita (Gambar 7). Masing-masing aksesi menghasilkan pita
sebanyak 1-3 pola pita yang berkisar antara 2.023 bp – 1100 bp.
260 bp
500 bp
1000bp bp 1465bp bp
750 bp
500 bp 1100 bp
[image:49.595.109.476.428.556.2]5. Primer OPC-12
Gambar 8. Hasil pola pita DNA sampel dengan primer OPC-12
Keterangan : (M) = Marker 1kb, (1) TS1, (2)TS2, (3)TS3, (4)TS5, (5)TS5, (6) Sim1, (7) Sim2, (8) Sim3, (9)DS1, (10)DS2, (11)DS3, (12)DS4, (13)DS5, (14)Srg1, (15)Srg2, (16)Srg3, (17)Srg4, (18)Srg5, (19)Lkt1, (20)Lkt2, (21)Lkt3, (22)Lkt4, (23)Lkt5, (24)Lkt6, (25)Lkt7, (26)Lkt8, (27)Lkt9, (28)Lkt10, (29)Lkt11, (30)Lkt12.
Amplifikasi PCR dengan primer OPC-12 pada 30 DNA sampel
menghasilkan 34 pita (Gambar 8). Pola pita berkisar antara 1.150 bp – 616 bp.
6. Primer OPD-03
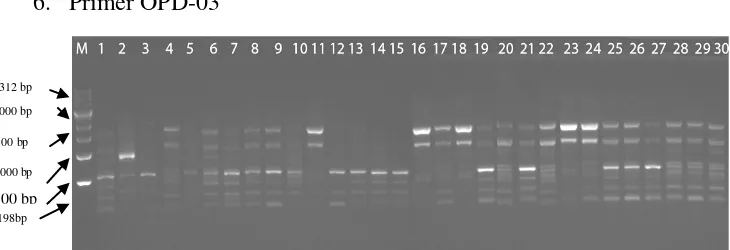
Gambar 9. Hasil pola pita DNA sampel dengan primer OPD-03
Keterangan : (M) = Marker 1kb, (1) TS1, (2)TS2, (3)TS3, (4)TS5, (5)TS5, (6) Sim1, (7) Sim2, (8) Sim3, (9)DS1, (10)DS2, (11)DS3, (12)DS4, (13)DS5, (14)Srg1, (15)Srg2, (16)Srg3, (17)Srg4, (18)Srg5, (19)Lkt1, (20)Lkt2, (21)Lkt3, (22)Lkt4, (23)Lkt5, (24)Lkt6, (25)Lkt7, (26)Lkt8, (27)Lkt9, (28)Lkt10, (29)Lkt11, (30)Lkt12.
Amplifikasi PCR dengan primer OPD–03 pada 30 DNA sampel
menghasilkan 186 pita (Gambar 9). Masing-masing aksesi menghasilkan pita
sebanyak 3-9 pola pita yang berkisar antara 4.312 bp – 198 bp.
500 bp 1150 bp
616 bp
500 bp
198bp 4312 bp
1000 bp 1500 bp
[image:50.595.115.480.372.497.2]7. Primer OPD-13
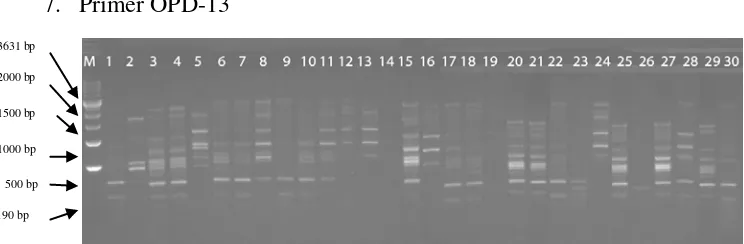
Gambar 10. Hasil pola pita DNA sampel dengan primer OPD-13
Keterangan : (M) = Marker 1kb, (1) TS1, (2)TS2, (3)TS3, (4)TS5, (5)TS5, (6) Sim1, (7) Sim2, (8) Sim3, (9)DS1, (10)DS2, (11)DS3, (12)DS4, (13)DS5, (14)Srg1, (15)Srg2, (16)Srg3, (17)Srg4, (18)Srg5, (19)Lkt1, (20)Lkt2, (21)Lkt3, (22)Lkt4, (23)Lkt5, (24)Lkt6, (25)Lkt7, (26)Lkt8, (27)Lkt9, (28)Lkt10, (29)Lkt11, (30)Lkt12.
Amplifikasi PCR dengan primer OPD–13 pada 30 DNA sampel
menghasilkan 182 pita (Gambar 10). Masing-masing aksesi menghasilkan pita
sebanyak 1-9 pola pita yang berkisar antara 3.631 bp – 190 bp.
8. Primer OPD-16
Gambar 11 : Hasil pola pita DNA sampel dengan primer OPD-16
Keterangan : (M) = Marker 1kb, (1) TS1, (2)TS2, (3)TS3, (4)TS5, (5)TS5, (6) Sim1, (7) Sim2, (8) Sim3, (9)DS1, (10)DS2, (11)DS3, (12)DS4, (13)DS5, (14)Srg1, (15)Srg2, (16)Srg3, (17)Srg4, (18)Srg5, (19)Lkt1, (20)Lkt2, (21)Lkt3, (22)Lkt4, (23)Lkt5, (24)Lkt6, (25)Lkt7, (26)Lkt8, (27)Lkt9, (28)Lkt10, (29)Lkt11, (30)Lkt12.
Amplifikasi PCR dengan primer OPD–16 pada 30 DNA sampel
menghasilkan 96 pita (Gambar 11). Masing-masing aksesi menghasilkan pita
sebanyak 1-5 pola pita yang berkisar antara 1.530 bp – 325 bp.
500 bp 1000 bp
190 bp 3631 bp
1500 bp 2000 bp
325 bp 1530 bp
500 bp 750 bp
[image:51.595.89.485.422.551.2]9. Primer OPI-20
Gambar 12 : Hasil pola pita DNA sampel dengan primer OPI-20
Keterangan : (M) = Marker 1kb, (1) TS1, (2)TS2, (3)TS3, (4)TS5, (5)TS5, (6) Sim1, (7) Sim2, (8) Sim3, (9)DS1, (10)DS2, (11)DS3, (12)DS4, (13)DS5, (14)Srg1, (15)Srg2, (16)Srg3, (17)Srg4, (18)Srg5, (19)Lkt1, (20)Lkt2, (21)Lkt3, (22)Lkt4, (23)Lkt5, (24)Lkt6, (25)Lkt7, (26)Lkt8, (27)Lkt9, (28)Lkt10, (29)Lkt11, (30)Lkt12.
Amplifikasi PCR dengan primer OPI-20 pada 30 DNA sampel
menghasilkan 126 pita (Gambar 12). Pola pita berkisar antara 1.396 bp – 338 bp.
10.Primer OPH-09
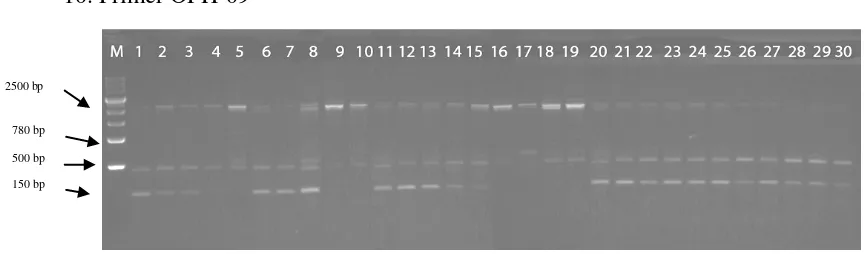
Gambar 13 : Hasil pola pita DNA sampel dengan primer OPH-09
Keterangan : (M) = Marker 1kb, (1) TS1, (2)TS2, (3)TS3, (4)TS5, (5)TS5, (6) Sim1, (7) Sim2, (8) Sim3, (9)DS1, (10)DS2, (11)DS3, (12)DS4, (13)DS5, (14)Srg1, (15)Srg2, (16)Srg3, (17)Srg4, (18)Srg5, (19)Lkt1, (20)Lkt2, (21)Lkt3, (22)Lkt4, (23)Lkt5, (24)Lkt6, (25)Lkt7, (26)Lkt8, (27)Lkt9, (28)Lkt10, (29)Lkt11, (30)Lkt12.
Amplifikasi PCR dengan primer OPH-09 pada 30 DNA sampel
menghasilkan 96 pita (Gambar 13). Pola pita berkisar antara 2.610 bp – 135 bp.
500 bp 1000 bp 1396 bp
800 bp
338 bp
[image:52.595.100.534.385.512.2]Persentase amplifikasi setiap primer berada pada selang 50% sampai
100% diantara 30 aksesi manggis yang dianalisis dengan rata-rata 83.43% (Tabel
3). Dari Tabel. 3 dapat dilihat bahwa pita DNA dengan ukuran basa tertinggi
yaitu 4.312 bp pada primer OPD-03 dan terendah sebesar 135 bp pada primer
OPH-09. Persentase pita polimorfik terendah terdapat pada primer OPH-09
sebesar 50%, dan yang tertinggi terdapat pada primer OPC-07, OPD-03, OPD-13,
dan OPI-20 sebesar 100%. Persentase polimorfisme secara umum memiliki nilai
tinggi dengan rataan 83.43%. Total pola pita yang dihasilkan sebanyak 80 pola
pita dengan jumlah total pita polimorfis sebanyak 70 pola pita dengan 10 primer
RAPD. Primer OPD-13 menghasilkan pita polimorfis tertinggi sebanyak 16 pola
pita pada kisaran 190 - 3631 bp sedangkan primer OPH-09 menghasilkan pita
polimorfis terendah yaitu hanya 2 pola pita pada kisaran 135 – 2610 bp.
Nilai Information Polimorfisme Content (PIC) tinggi pada 30 aksesi
manggis dengan rata – rata 0.447. Nilai PIC terendah pada primer OPD-20 dan
OPN-03 sebesar 0.39. Primer OPD-13 yang amplifikasi pita polimorfis tertinggi
sebanyak 16 pita, memiliki nilai PIC sebesar 0.47. Pada dominat marker nilai
maksimum PIC adalah sebesar 0.5. Nilai PIC secara umum tinggi sebesar 0.447
menunjukkan bahwa 10 primer polimorfis yang digunakan sesuai untuk aksesi