DocumentToPDF trial version, to remove this mark, please register this software.
ABSTRAK
EVA Silvia, Sifat Fisiko Kimia dan Aktivitas Antioksidan Virgin Coconut Oil
(VCO) Hasil Fermentasi Rhizopus orizae {di bawah bimbingan Drs. Dede
Sukandar, M.Si dan Sandra Hermanto, M.Si}
Telah dilakukan penelitian sifat fisiko kimia dan aktivitas antioksidan virgin
coconut oil (VCO) hasil fermentasi Rhizopus orizae dengan metode DPPH.
Pembuatan minyak kelapa murni (VCO) dilakukan pada sampel kelapa dari daerah Pandeglang secara fermentasi dengan inokulum Rhizopus orizae dengan variasi inokulum 1%, 2%, 5%, 7%, 10% dan 12% (b/v). Uji sifat fisiko kimia meliputi; kadar air, indeks bias, densitas, kadar asam lemak bebas, bilangan iod, bilangan penyabunan, bilangan peroksida dan dianalisis komposisi minyak VCO dengan GCMS. Hasil penelitian menunjukkan bahwa konsentrasi inokulum yang digunakan berpengaruh nyata terhadap volume VCO yang dihasilkan dengan nilai signifikan 0,024 pada konsentrasi 2%. Berdasarkan hasil analisis sifat fisiko kimia VCO yang diperoleh telah sesuai dengan standar yang dipersyaratkan, yaitu standar CODEX 19-1991 rev.2-1999. Uji aktivitas antioksidan menggunakan metode DPPH menunjukkan bahwa minyak VCO mempunyai aktivitas antioksidan sebesar 6.35 % pada konsentrasi 1000 ppm. Kandungan asam lemak VCO hasil analisis GCMS telah sesuai dengan standar CODEX 19-1991 rev.2- 1999, dengan komposisi asam laurat sebesar 49,48 %.
ABSTRACT
Eva Silvia, Physical Chemical Properties and Antioxidant Activity of Virgin Coconut Oil (VCO) Obtained from Rhizopus orizae Fermentation {Guided by Drs. Dede Sukandar, M.Si and Sandra Hermanto, M.Si}
The research of physical chemical properties and antioxidant activity of VCO obtained from Rhizopus orizae fermentation had been done by DPPH method. Production of VCO had been carried out from coconut sample obtained from pandeglang region from fermentation by Rhizopus orizae in variation of inoculum as follow 1%, 2%, 5%, 7%, 10% and 12%. Physical chemical test consist of density, refractive index, water content, free fatty acid, iodine value, peroxide value and the composition of fatty acid determined by GCMS. The result showed that variation of inoculum had significanly 0,024 infulenced the yielded of VCO producted. Based on this result, quality of VCO still include in standard of CODEX 19-1991 rev.2-1999. Antioxidant activity of VCO was very low, only 6,3% at 1000 ppm. The composition of fatty acid based on GCMS resulted had been same with standard of CODEX which lauric acid composotion equal to 49,48%.
Keyword: Antioxidant, DPPH, VCO, Fermentation, Rhizopus orizae
DocumentToPDF trial version, to remove this mark, please register this software.
BAB I PENDAHULUAN
1.1 Latar Belakang
Sejak zaman dahulu masyarakat Indonesia sudah mengenal dan memakai tumbuhan berkhasiat obat sebagai salah satu upaya penanggulangan masalah kesehatan yang dihadapi. Hal ini telah dilakukan jauh sebelum pelayanan kesehatan formal dengan obat-obatan modern menyentuh masyarakat. Pengetahuan tentang tumbuhan obat merupakan warisan budaya bangsa turun temurun (Yuharmen, 2002).
Kemajuan teknologi dan ilmu pengetahuan ternyata tidak mampu begitu saja menghilangkan arti pengobatan tradisional. Apalagi keadaan perekonomian Indonesia saat ini yang mengakibatkan harga obat-obatan modern menjadi mahal. Oleh karena itu salah satu pengobatan alternatif yang dilakukan adalah meningkatkan penggunaan tumbuhan berkhasiat obat di kalangan masyarakat. Agar peranan obat tradisional dalam pelayanan kesehatan masyarakat dapat ditingkatkan, perlu dilakukan upaya pengenalan, penelitian, pengujian dan pengembangan khasiat dan keamanan suatu tumbuhan obat (Yuharmen, 2002).
dimanfaatkan sebagai bahan baku farmasi, kosmetik, dan pangan (Kastanya, 2009).
Hasil penelitian dr Condrado Dayrit asal Filipina menunjukkan bahwa asam laurat dan asam kaprat yang terkandung di dalam VCO mampu membunuh virus. Di dalam tubuh, asam laurat diubah menjadi monolaurin sedangkan asam kaprat berubah menjadi monokaprin. Senyawa ini termasuk senyawa monogliserida yang bersifat sebagai antivirus, antibakteri, antibiotik dan antiprotozoa (Sutomo,2006).
Saat ini telah berkembang pengolahan VCO tanpa pemanasan dengan menggunakan minyak pancing sebagai starter. Dengan cara ini harus disediakan dahulu minyak pancing. Petani yang baru pertama kali mengolah VCO biasanya sulit memperoleh minyak pancing. Oleh karena itu, perlu dicari cara lain yang lebih mudah untuk memecahkan emulsi santan/krim melalui proses fermentasi tanpa menggunakan minyak pancing (Kastanya, 2009).
Ragi tape (Saccharomyces cereviseae) yang biasanya digunakan dalam pembuatan tape, berpeluang digunakan dalam pengolahan VCO karena ragi tape mengandung mikroflora seperti khamir yang dapat menghasilkan lipase untuk memecah emulsi santan. Dengan demikian, selama proses fermentasi akan terjadi pemutusan ikatan kimia. Metode enzimatik merupakan proses pemisahan minyak dalam santan tanpa pemanasan. Ikatan protein minyak yang berada pada emulsi santan bisa juga dipecah dengan bantuan enzim. Di sini, yang dirusak yaitu proteinnya, bukan lemaknya.
DocumentToPDF trial version, to remove this mark, please register this software.
kadar air 0,05% dan asam lemak bebas 0,01%, dengan aroma khas kelapa dan berwarna bening. Mutu VCO yang dihasilkan memenuhi standar APCC. Untuk pengolahan VCO dengan bantuan ragi tape disarankan menggunakan konsentrasi
starter 20% agar diperoleh rendemen tinggi dan mutu VCO memenuhi standar
(Kastanya, 2009).
Dalam rangka pengembangan dan pemanfaatan obat tradisional yang telah digunakan secara luas oleh masyarakat, maka perlu dilakukan penelitian untuk mengetahui potensi VCO sebagai suatu produk tanaman berkhasiat yang dihasilkan melalui proses fermentasi ragi tempe (Rhizopus orizae) serta uji potensial sifat fisiko kimia dan aktivitas antioksidannya guna mendukung upaya pengembangan sumber antioksidan alami.
1.2 Rumusan Masalah
Berdasarkan uraian di atas, dapat dirumuskan permasalahan sebagai berikut:
1. Apakah konsentrasi ragi tempe (Rhizopus orizae) yang digunakan dalam fermentasi berpengaruh secara nyata terhadap volume minyak kelapa murni (VCO) yang dihasilkan?
2. Bagaimanakah sifat fisiko kimia VCO yang dihasilkan melalui proses fermentasi Rhizopus orizae?
1.3 Hipotesis
Hipotesis dalam penelitian ini meliputi:
1. Perbedaan konsentrasi Rhizopus orizae tidak berpengaruh secara nyata terhadap volume VCO yang dihasilkan (H0)
Perbedaan konsentrasi Rhizopus orizae berpengaruh secara nyata terhadap volume VCO yang dihasilkan (Ha)
2. Sifat fisiko kimia VCO yang dihasilkan melalui fermentasi sesuai dengan standar mutu Codex tentang Vegetable Oil
3. Minyak kelapa murni (VCO) yang dihasilkan melalui proses fermentasi ragi tempe memiliki aktivitas antioksidan.
1.4 Tujuan Penelitian
Tujuan dari penelitian ini adalah
1. Mengetahui pengaruh variasi konsentrasi optimum ragi tempe terhadap volume VCO yang dihasilkan
2. Mengetahui sifat fisiko kimia VCO hasil fermentasi Rhizopus orizae
3. Mengetahui aktivitas antioksidan VCO hasil fermentasi Rhizopus orizae
1.5 Manfaat Penelitian
Memberikan informasi baru bagi produsen dan masyarakat mengenai khasiat minyak kelapa murni (VCO) sebagai antioksidan alami.
DocumentToPDF trial version, to remove this mark, please register this software.
BAB II
TINJAUAN PUSTAKA
2.1 Kelapa
Pohon kelapa dalam bahasa latin disebut Cocos nucifera L berasal dari famili palmae ordo arecales dan kelas monocotyledone. Tanaman ini dapat tumbuh di daerah tropis pada ketinggian 0-500 meter di atas permukaan laut dan suhu udara berkisar antara 19-29oC. Buah kelapa biasanya dipanen pada umur 11- 12 bulan. Pemanenan biasanya bervariasi sesuai dengan kebutuhan. Kelapa yang sudah besar dan subur dapat menghasilkan 2-10 buah kelapa setiap tangkainya
(Sentra Informasi IPTEK, 2005).
Taksonomi tumbuhan kelapa (Cocos nucifera L) menurut Sentra Informasi IPTEK (2005) adalah sebagai berikut:
Klasifikasi
Divisi: Spermatophyta Subdivisi: Angiospermae Kelas: Monocotyledoneae Bangsa: Palmales
Suku: Palmae Marga: Cocos
Jenis: Cocos nucifera L Gambar 1. Cocos nucifera L
Menurut Sentra Informasi IPTEK (2005) nama Lokal kelapa antara lain:
coconut (Inggris), cocotier (Perancis); kelapa, nyiur (Indonesia), kambil,
Komposisi Buah Muda Buah Setengah Tua Buah Tua kelapa, dan bahan makanan lainnya. Daging buah merupakan sumber protein yang penting dan mudah dicerna. Semakin tua umur buah kelapa maka semakin tinggi kandungan lemaknya.
Gambar 2. Buah Kelapa Tua
Tabel 1. Komposisi Daging Buah kelapa Berdasarkan Tingkat Kematangannya dalam 100 gram
Sumber: Sutarmi dan Rozaline, 2005
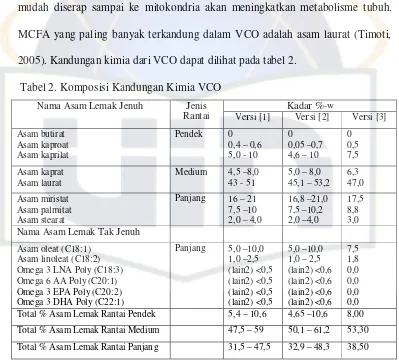
Kadar %-w Nama Asam Lemak Jenuh Jenis
Rantai Versi [1] Versi [2] Versi [3] Asam butirat Total % Asam Lemak Rantai Pendek 5,4 – 10,6 4,65 –10,6 8,00 Total % Asam Lemak Rantai Medium 47,5 – 59 50,1 – 61,2 53,30 Total % Asam Lemak Rantai Panjang 31,5 – 47,5 32,9 – 48,3 38,50
DocumentToPDF trial version, to remove this mark, please register this software.
2.2 Minyak Kelapa Murni (VCO)
Virgin Coconut Oil (VCO) adalah minyak yang dihasilkan dari buah
kelapa segar. Berbeda dengan minyak kelapa biasa, VCO dihasilkan tidak melalui penambahan bahan kimia ataupun proses yang melibatkan panas yang tinggi. Selain warna dan rasa yang berbeda, VCO memiliki asam lemak yang tidak terhidrogenasi seperti pada minyak kelapa biasa. VCO banyak mengandung asam lemak rantai menengah (Medium Chain Fatty Acid / MCFA). Sifat MCFA yang mudah diserap sampai ke mitokondria akan meningkatkan metabolisme tubuh. MCFA yang paling banyak terkandung dalam VCO adalah asam laurat (Timoti, 2005). Kandungan kimia dari VCO dapat dilihat pada tabel 2.
Tabel 2. Komposisi Kandungan Kimia VCO
Keterangan:
[1] Kokonut Pacific (HTTP://WWW.KOKONUTPACIFIC.COM.AU/)
[2]CODEX STAN 210-1999 (Named Vegetable Oils, Rev. 1-2001;
Tabel 3. Standar Mutu VCO
Persyaratan Karakteristik
Versi [1] Versi [2] Versi [3] Kadar Air (%)
Bilangan Iod (mg iod/gr sampel)
Bilangan Penyabunan (mg KOH/gr sampel) Bilangan Peroksida (meq/kg sampel)
[3] Standar Industri Indonesia dalam Palungkun, R. 2001
Minyak kelapa dihasilkan melalui proses pengempaan kopra, pemanasan santan kelapa dan bioproses santan kelapa. Bioproses santan kelapa sudah dimulai dari penggunaan kultur murni sampai penggunaan enzim, namun sampai saat ini penggunaannya masih tidak populer di masyarakat, salah satu hambatannya adalah penanganan jasad renik yang dianggap rumit atau harga enzim yang tinggi. Inokulum tempe yang terdapat di pasaran, berpotensi sebagai perombak santan kelapa yang aman dan mudah digunakan pada proses pembuatan minyak kelapa secara fermentasi tanpa harus menggunakan bahan kimia dan panas yang tinggi (Pusat Penelitian Kimia-LIPI, 2005).
DocumentToPDF trial version, to remove this mark, please register this software.
inokulum, serta diinkubasi selama 6 jam. Pada akhir akan diperoleh beberapa fraksi yaitu : minyak galendo (fraksi protein yang juga mengandung air dan minyak), dan fraksi air. Akan tetapi dalam praktek fraksi galendo ini terbagi dua yaitu, galendo yang sedikit air (mengapung diatas minyak), dan galendo yang kaya air (diperbatasan antara minyak dan air) (Pusat Penelitian Kimia-LIPI, 2005).
Minyak dikeluarkan dengan dekantasi sampai batas galendo atas bertemu dengan galendo bawah. Gabungan galendo ini kemudian diambil dengan cara skimming, dekantasi, atau setrifugasi untuk kemudian dihangatkan dan difiltrasi untuk memperoleh minyak yang masih terkandung (Pusat Penelitian Kimia-LIPI, 2005).
2.3 Penggolongan Asam Lemak
Asam lemak bersama-sama dengan gliserol, merupakan penyusun utama minyak nabati atau lemak dan merupakan bahan baku untuk semua lipida pada makhluk hidup. Asam ini mudah dijumpai dalam minyak masak (goreng), margarin, atau lemak hewan dan menentukan nilai gizinya. Secara alami, asam lemak bisa berbentuk bebas (karena lemak yang terhidrolisis) maupun terikat sebagai gliserida (Amiyela, 2008).
2.3.1 Asam Lemak Jenuh
Asam lemak jenuh bersifat lebih stabil (tidak mudah bereaksi) daripada asam lemak tak jenuh. Ikatan ganda pada asam lemak tak jenuh mudah bereaksi dengan oksigen (mudah teroksidasi). Karena itu, dikenal istilah bilangan oksidasi bagi asam lemak (Nuwen, 2008).
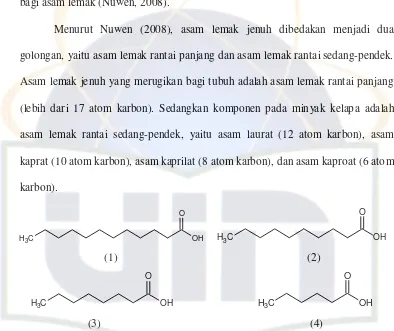
Menurut Nuwen (2008), asam lemak jenuh dibedakan menjadi dua golongan, yaitu asam lemak rantai panjang dan asam lemak rantai sedang-pendek. Asam lemak jenuh yang merugikan bagi tubuh adalah asam lemak rantai panjang (lebih dari 17 atom karbon). Sedangkan komponen pada minyak kelapa adalah asam lemak rantai sedang-pendek, yaitu asam laurat (12 atom karbon), asam kaprat (10 atom karbon), asam kaprilat (8 atom karbon), dan asam kaproat (6 atom karbon).
O O
H3C OH H3C OH
(1) (2)
O O
H3C OH H3C OH
(3) (4)
Gambar 3. Asam Lemak Rantai Sedang: (1) Asam Laurat, (2) Asam Kaprat, (3) Asam Kaprilat, dan (4) Asam Kaproat
DocumentToPDF trial version, to remove this mark, please register this software.
timbunan jaringan lemak yang akan menjadi kolesterol. Selain itu di dalam tubuh asam laurat akan diubah menjadi monolaurat, yaitu senyawa monogliserida yang bersifat antimikroba (Purnomo, 2006).
Asam laurat (lauric acid) terdiri dari 12 atom karbon, yang diikat jenuh oleh atom hidrogen dan tidak ada ikatan ganda. Asam lemak ini tergolong asam lemak rantai sedang (medium, MCFA) dan banyak ditemukan dalam air susu ibu dan minyak kelapa (Budiarso, 2004).
2.3.2 Asam Lemak Tak Jenuh
Keberadaan ikatan ganda pada asam lemak tak jenuh menjadikannya memiliki dua bentuk: cis dan trans. Semua asam lemak nabati alami hanya memiliki bentuk cis (dilambangkan dengan “Z”, singkatan dari bahasa jerman zusammen). Asam lemak bentuk trans (trans fatty acid, dilambangkan dengan “E”, singkatan dari bahasa Jerman entgegen) hanya diproduksi oleh sisa metabolisme hewan atau dibuat secara sintetis. Akibat polarisasi atom H, asam lemak cis memiliki rantai yang melengkung. Asam lemak trans karena atom H- nya berseberangan tidak mengalami efek polarisasi yang kuat dan rantainya tetap relatif lurus (Nuwen, 2008).
(5) (6)
Gambar 4. Asam Lemak: (5) Cis dan (6) Trans
ganda juga menentukan daya reaksinya. Semakin dekat dengan ujung metil, ikatan ganda semakin mudah bereaksi. Karena itu, asam lemak omega-3 dan omega 6 (asam lemak esensial) lebih bernilai gizi dibandingkan dengan asam lemak lainnya. Beberapa minyak nabati (misalnya a»-linolenat) dan minyak ikan laut banyak mengandung asam lemak esensial.
O
H3C OH
(7)
O
H3C OH
(8)
Gambar 5. Asam Lemak Esensial: (7) Omega 3 (Asam a.-linolenat) dan (8) Omega 6 (Asam Linoleat)
Asam lemak tak jenuh tunggal, asam oleat (oleic acid) terdiri dari 18 atom karbon di mana 1 pasang karbon atom diganti oleh satu ikatan ganda dan asam lemak ini tergolong dalam asam lemak rantai panjang (LCFA) serta kebanyakan ditemukan dalam minyak sayur seperti kedelai dan canola (Budiarso, 2004).
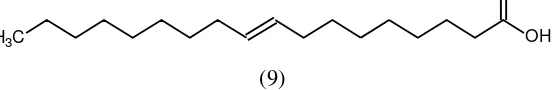
Asam lemak tak jenuh ganda, asam linoleat (lenoleic acid) terdiri dari 18 atom karbon dengan 2 ikatan ganda (majemuk) dan tergolong dalam asam lemak rantai panjang (LCFA) serta banyak ditemukan pada minyak sayur seperti kedelai, jagung dan canola. (Budiarso, 2004)
O
H3C OH
(9)
DocumentToPDF trial version, to remove this mark, please register this software.
2.4 Ragi Tempe (Rhizopus orizae)
Kapang tumbuh secara karakteristik dengan perpanjangan seperti rantai bercabang. Pertumbuhan berlangsung dari ujung miselium (pertumbuhan apikal) serta pertumbuhan septa antar sel. Distribusi umur dan morfologi kapang keduanya sangat penting bagi kinetika proses fermentasi. Waktu penggandaan kapang secara tipikal adalah 4-8 jam walaupun berbagai laporan menyatakan waktu penggandaan 60-90 menit (Judoamidjojo, 1990).
Ragi tempe (Rhizopus orizae) yang berwarna putih kapas, merupakan kapang yang dapat mengurai protein dalam kedelai menjadi asam amino, sehingga lebih mudah dicerna tubuh. Sedikitnya terdapat empat genus Rhizopus. R.
oligosporus merupakan genus utama, kemudian R. oryzae merupakan genus
lainnya yang digunakan pada pembuatan tempe Indonesia (Karmini, 1996). Klasifikasi R. orizae menurut Judoamidjojo (1990) adalah sebagai berikut:
Kingdom : Fungi Phylum : Zygomycota Order : Mucorales Family : Mucoraceae Genus : Rhizopus
Gambar 7. Rhizopus orizae
2.5 Antioksidan
tanpa terganggu sama sekali dan dapat memutus reaksi berantai dari radikal bebas (Kumalaningsih, 2007).
Suatu senyawa untuk dapat digunakan sebagai antioksidan harus mempunyai sifat-sifat : tidak toksik, efektif pada konsentrasi rendah (0,01-0,02%), dapat terkonsentrasi pada permukaan/lapisan lemak (bersifat lipofilik) dan harus dapat tahan pada kondisi pengo lahan pangan umumnya (Nugrohob, 2007).
Antioksidan sangat beragam jenisnya. Berdasarkan fungsinya antioksidan dapat digolongkan sebagai berikut :
2.5.1 Antioksidan Primer
Antioksidan primer adalah senyawa yang dapat menghentikan reaksi berantai pembentukan radikal yang melepaskan hidrogen. Zat-zat yang termasuk golongan ini dapat berasal dari alam dan dapat pula buatan (sintetis). Antioksidan alam antara lain : tokoferol, lesitin, sesamol, dan asam askrobat (Nugrohob,
DocumentToPDF trial version, to remove this mark, please register this software.
Antioksidan buatan adalah senyawa-senyawa fenol. Diantara beberapa contoh antioksidan sintetik yang diizinkan untuk makanan, ada lima antioksidan yang penggunaanya meluas dan menyebar diseluruh dunia, yaitu Butil Hidroksi Anisol (BHA), Butil Hidroksi Toluen (BHT), propel galat, Tersier Butil Hidroksi Kuinon (TBHQ) dan Tokoferol. Antioksidan tersebut merupakan antioksidan alami yang telah diproduksi secara sintetis untuk tujuan komersil (Buck, 1991).
OH
Gambar 9. Antioksidan Sintetik: (14) Butil Hidroksil Anisol (BHA), (15) Butil Hidroksi Toluen (BHT), (16) Propil Galat (17) Tersier Butil Hidroksi Kuinon (TBHQ)
2.5.2 Antioksidan Sekunder
Antioksidan sekunder adalah suatu senyawa yang dapat mencegah kerja prooksidan yaitu faktor-faktor yang mempercepat terjadinya reaksi oksidasi terutama logam-logam seperti: Fe, Cu, Pb, Mn (Ardiansyah, 2007).
Antioksidan (AH) yang mempunyai fungsi utama tersebut sering disebut sebagai antioksidan primer. Senyawa ini dapat memberikan atom hidrogen secara cepat ke radikal lipid (R*, ROO*) atau mengubahnya ke bentuk lebih stabil, sementara turunan radikal antioksidan (A*) tersebut memiliki keadaan lebih stabil dibanding radikal lipida (Ardiansyah, 2007).
Penambahan antioksidan (AH) primer dengan konsentrasi rendah pada lipida dapat menghambat atau mencegah reaksi autooksidasi lemak dan minyak. Penambahan tersebut dapat menghalangi reaksi oksidasi pada tahap inisiasi maupun propagasi (Gambar 10). Radikal-radikal antioksidan (A*) yang terbentuk pada reaksi tersebut relatif stabil dan tidak mempunyai cukup energi untuk dapat bereaksi dengan molekul lipida lain membentuk radikal lipida baru (Gordon, 1990).
Inisiasi : R* + AH ---> RH + A*
Propagasi : ROO* + AH ---> ROOH + A*
Gambar 10. Reaksi Penghambatan Antioksidan Primer Terhadap Radikal Lipida
Fungsi kedua merupakan fungsi sekunder antioksidan, yaitu memperlambat laju autooksidasi dengan berbagai mekanisme di luar mekanisme pemutusan rantai autooksidasi dengan pengubahan radikal lipida ke bentuk lebih stabil (Gordon, 1990).
DocumentToPDF trial version, to remove this mark, please register this software.
jumlah konsentrasi pada laju oksidasi tergantung pada struktur antioksidan, kondisi dan sampel yang akan diuji (Ardiansyah, 2007).
AH + O2 ---> A* + HOO*
AH + ROOH ---> RO* + H2O + A*
Gambar 11. Antioksidan Bertindak Sebagai Prooksidan pada Konsentrasi Tinggi
2.6 DPPH (Dipenil Pikril Hidrazil)
DPPH adalah suatu reagen yang bersifat radikal, bereaksi dengan antioksidan secara spesifik. DPPH berbentuk kristal prisma, berwarna ungu kegelapan dengan sifat yang mudah larut dalam pelarut polar seperti metanol dan etanol.
O2N
N N*
O2N
NO2
+
AH N NH NO2
+
A*O2N O2N
Gambar 12. Mekanisme Reaksi DPPH dengan Antioksidan
2.7 Sifat Fisiko Kimia 2.7.1 Kadar Air
mengakibatkan mudahnya bakteri, kapang, dan khamir untuk berkembang biak, sehingga akan terjadi perubahan pada bahan pangan (Winarno, 1989).
2.7.2 Massa Jenis (Densitas)
Massa jenis merupakan pengukuran massa setiap satuan volume benda. Semakin tinggi massa jenis suatu benda, maka semakin besar pula massa setiap volumenya. Uji berat jenis merupakan salah satu teknik uji kemurnian yang cukup akurat. Archimedes menguji kemurnian emas mahkota raja berdasarkan prinsip uji berat jenis ini. Setiap zat murni mempunyai berat jenis yang spesifik yang dapat digunakan sebagai dasar pengujian bahan.
Massa jenis rata-rata setiap benda merupakan total massa dibagi dengan total volumenya. Sebuah benda yang memiliki massa jenis lebih tinggi (misalnya besi) akan memiliki volume yang lebih rendah daripada benda bermassa sama yang memiliki massa jenis lebih rendah (misalnya air). Satuan SI massa jenis adalah kilogram per meter kubik (kg·m-3)
Rumus untuk menentukan massa jenis adalah
= m/v
dimana;
?å= massa jenis,
m = massa,
V = volume.
2.7.3 Indeks Bias
DocumentToPDF trial version, to remove this mark, please register this software.
elektromagnetik dari atom-atom di dalam molekul cairan. Pengujian indeks bias dapat digunakan untuk menentukan kemurnian dan dapat menentukan dengan cepat terjadinya hidrogenasi katalisis (catalytic hydrogenation). Semakin panjang rantai karbon dan semakin banyak ikatan rangkap, indeks bias bertambah besar. Indeks bias juga dipengaruhi oleh faktor-faktor seperti: kadar asam lemak bebas, proses oksidasi dan suhu (Ketaren, 1986).
Secara matematis, indeks bias dapat ditulis:
n
=
c
/
cm
dimana; n = indeks bias
c = cepat rambat cahaya di ruang hampa (3x108 m/s) cm = cepat rambat cahaya di suatu medium
atau:
n = ?
1Ï / ?Ï
2= sin i /sin r
dimana;
?‘
1 = panjang gelombang 1?‘
2 = panjang gelombang 2i = sudut datang r = sudut bias
2.7.4 Bilangan Asam
menunjukkan banyaknya asam lemak bebas yang ada dalam minyak akibat reaksi hidrolisis akibat reaksi kimia, pemanasan, proses fisika atau reaksi enzimatis. Semakin tinggi bilangan asam maka semakin banyak minyak yang telah terhidrolisis (Rismana, 2005).
2.7.5 Bilangan Iod
Bilangan iod adalah jumlah (gram) iod yang dapat diikat oleh 100 gram lemak. Ikatan rangkap yang terdapat pada asam lemak tidak jenuh akan bereaksi dengan iod atau senyawa-senyawa iod. Gliserida dengan tingkat ketidakjenuhan yang tinggi akan mengikat iod dalam jumlah yang lebih besar (Ketaren, 1986).
I2 akan mengadisi ikatan rangkap asam lemak tidak jenuh bebas maupun
dalam bentuk ester. Bilangan iod tergantung pada jumlah asam lemak tidak jenuh dalam lemak. Lemak yang akan diperiksa dilarutkan dalam kloroform kemudian ditambah larutan iodin berlebih. Sisa iodin yang tidak bereaksi dititrasi dengan tiosulfat.
I2 + 2 Na2S2O3 2NaI + Na2S4O6
Sedangkan semakin banyak ikatan rangkap dalam suatu minyak, maka minyak tersebut akan semakin mudah rusak, karena sifatnya yang mudah teroksidasi oksigen dalam udara, senyawa kimia atau proses pemanasan (Rismana, 2005).
2.7.6 Bilangan Penyabunan
DocumentToPDF trial version, to remove this mark, please register this software.
molekul kecil maka bilangan penyabunannya besar dan sebaliknya (Rismana, 2005).
Apabila sejumlah contoh minyak atau lemak disabunkan dengan larutan KOH berlebih dalam alkohol maka KOH akan bereaksi dengan trigliserida, yaitu tiga molekul KOH bereaksi dengan satu molekul minyak atau lemak. Larutan alkali yang tertinggal ditentukan dengan titrasi menggunakan asam, sehingga jumlah alkali yang turut bereaksi dapat diketahui (Ketaren, 1986).
O
Trigliserida Gliserol Sabun Kalium
Gambar 13. Reaksi Penyabunan 2.7.7 Bilangan Peroksida
Bilangan peroksida didefiniskan sebagai jumlah meq peroksida dalam setiap 1000 g (1 kg) minyak atau lemak. Bilangan peroksida ini menunjukkan tingkat kerusakan lemak atau minyak. Asam lemak tidak jenuh dapat mengikat oksigen pada ikatan rangkapnya sehingga membentuk peroksida. Peroksida ini dapat ditentukan dengan metode iodometri (Ketaren, 1986).
O2
H3C CH CH CH3
O O
H3C CH CH CH3 + 2HI H3C CH2 CH2 CH3 + H2O2 + I2
I2 + 2 Na2S2O3 2NaI + Na2S4O6
2.8 GCMS
Kromatografi gas spektroskopi massa adalah teknik analisis yang menggabungkan dua metode analisis yaitu Kromatografi Gas dan Spektroskopi Massa. Kromatografi gas merupakan metode analisis dimana sampel terpisahkan secara fisik menjadi bentuk molekul-molekul yang lebih kecil (hasil pemisahan dapat dilihat berupa kromatogram). Sedangkan spektroskopi massa adalah metode analisis dimana sampel yang akan dianalisis diubah menjadi ion-ionnya, dan massa dari ion-ion tersebut dapat diukur (hasil deteksi dapat dilihat berupa spektrum massa) (Lingga, 2004).
Pada GC hanya terjadi pemisahan untuk mendapatkan komponen yang diinginkan, sedangkan bila dilengkapi dengan MS (berfungsi sebagai detektor) akan dapat mengidentifikasi komponen tersebut, karena bisa mendapat spektrum bobot molekul pada suatu komponen yang dapat dibandingkan langsung dengan
Library (reference) pada software. Sampel-sampel yang dapat dianalisis dengan
menggunakan GCMS, harus memenuhi beberapa syarat, diantaranya: (Lingga, 2004).
1) Dapat diuapkan pada hingga suhu 4000C
2) Secara termal stabil (tidak terdekomposisi pada suhu 4000C)
DocumentToPDF trial version, to remove this mark, please register this software.
Gambar 15. Skema GC-MS
Proses pemisahan pada GC terjadi di dalam kolom (kapiler) melibatkan dua fase, yaitu fase diam dan fase gerak. Dimana fase diam adalah zat yang ada di
dalam kolom, dan fase gerak adalah gas pembawa (Helium atau Hidrogen) dengan kemurnian tinggi yaitu 9.995%.
Proses pemisahan terjadi karena terdapat perbedaan kecepatan alir tiap molekul di dalam kolom. Perbedaan tersebut dapat di sebabkan oleh perbedaan afinitas antar molekul dengan fase diam yang ada di dalam kolom (Lingga, 2004). Proses pendeteksian sampel pada MS, pertama sampel yang berasal dari GC diubah menjadi ion-ion gasnya terlebih dulu. Kemudian ion-ion tersebut dilewatkan melalui suatu penganalisis massa (Mass Analyzer) yang berfungsi secara selektif untuk memisahkan ion dengan satuan massa atom yang berbeda. Terakhir ion-ion tersebut dideteksi oleh Electron Multiplier Detector (lebih peka dari detektor biasa) (Lingga, 2004).
Bagian-bagian dari instrumentasi kromatografi gas menurut Lingga (2004) adalah sebagai berikut:
2) Injektor (Sample Injector) sebagai tempat injeksi sampel. Adapun fungsinya adalah: menguapkan sampel, mencampur sampel dengan gas pembawa, dan menyalurkan campuran gas tersebut ke dalam kolom.
3) Kolom (Column) Sebagai tempat terjadinya pemisahan molekul-molekul dalam sampel. Umumnya GC menggunakan kolom kapiler (capillary column). Sedangkan bagian-bagian spektrometer massa menurut Lingga (2004) adalah:
1) GCMS Interface memiliki fungsi untuk mengirimkan sampel dari GC ke MS dengan meminimalkan kehilangan sampel saat pengiriman. Untuk GCMS QP2010, menggunakan interface sambungan langsung (direct interface). Artinya kolom langsung masuk ke dalam alat MS. Model interface seperti ini memiliki kelebihan dalam penyesuaian suhu yang lebih cepat, dari dingin ke panas atau sebaliknya
2) Sumber ion (ion source), memiliki fungsi untuk mengionkan sampel yang berbentuk gas sebelum dianalisis di penganalisis massa
3) Pompa vakum (vacuum pump), dua tipe vakum yang dimiliki GCMS QP2010 yaitu: a) pompa vakum tinggi untuk mengurangi dan mempertahankan tekanan pada MS saat analisis. b) pompa vakum rendah untuk mengurangi tekanan udara luar di dalam MS.
DocumentToPDF trial version, to remove this mark, please register this software.
Gambar 16. Sistematika Kerja Quadrupole dalam MS
5) Detektor, ion-ion yang keluar dari penganalisis massa dideteksi dan jumlahnya diukur oleh detektor. Dalam GCMS QP2010 menggunakan Electron
Multiplier Detector. Kelebihannya adalah sensitivitas yang lebih baik dari
detektor biasa.
Setelah data terdeteksi, lalu data dikirim ke sistem pengolah data (pada personal komputer) untuk diolah sesuai dengan tujuan analisa (Lingga, 2004). 2.9 Spektrofotometer UV-Vis
Spektrometer absorbsi adalah sebuah instrumen untuk mengukur absorbsi/penyerapan cahaya dengan energi (panjang gelombang) tertentu oleh suatu atom/molekul. Spektrofotometer dikembangkan beberapa puluh tahun lalu untuk keperluan para fisikawan dan kimiawan dalam mempelajari struktur molekul dan mengembangkan dengan teori molekul. Kini, spektrofotometer juga banyak digunakan untuk berbagai seperti studi bahan alam, lingkungan ataupun untuk mengontrol suatu proses kimiawi dalam industri (Edogawa, 2006).
Kromofor-kromofor organik seperti karbonil, alken, azo, nitrat dan karboksil mampu menyerap sinar ultraviolet dan sinar tampak. Panjang gelombang maksimalnya dapat berubah sesuai dengan pelarut yang digunakan. Auksokrom adalah gugus fungsional yang mempunyai elekron bebas, seperti hidroksil, metoksi dan amina. Terikatnya gugus auksokrom pada gugus kromofor akan mengakibatkan pergeseran pita absorpsi menuju ke panjang gelombang yang lebih besar (bathokromik) yang disertai dengan peningkatan intensitas (hyperkromik).
Spektrofotometer UV-Vis merupakan instrumentasi analisis untuk penentuan konsentrasi senyawa-senyawa yang dapat menyerap radiasi pada daerah ultraviolet (200 – 400 nm) atau daerah sinar tampak (400 – 800 nm). Analisis ini dapat digunakan dengan penentuan absorbansi dari larutan sampel yang diukur (Edogawa, 2006).
Prinsip penentuan spektrofotometer UV-Vis adalah aplikasi dari Hukum Lambert-Beer, menurut Edogawa (2006) yaitu:
Hukum Lambert menyatakan bahwa proporsi berkas cahaya datang yang diserap oleh suatu bahan/medium tidak bergantung pada intensitas berkas cahaya yang datang. Hukum Lambert ini tentunya hanya berlaku jika di dalam bahan/medium tersebut tidak ada reaksi kimia ataupun proses fisis yang dapat dipicu atau diimbaskan oleh berkas cahaya yang keluar setelah melewat i bahan/medium tersebut dapat dituliskan dalam bentuk sederhana sebagai berikut:
DocumentToPDF trial version, to remove this mark, please register this software.
Dimana I adalah intensitas berkas cahaya keluar, I0 adalah intensitas berkas
cahaya masuk/datang, dan T adalah transmitansi. Jika transmisi dinyatakan dalam prosentase, maka
%T = (I/I
0) x 100 (dalam satuan %)
Hukum Beer menyatakan bahwa absorbansi cahaya berbanding lurus dengan konsentrasi dan ketebalan bahan/medium, yakni
A = c l
dengan ialah absorbtivitas molar (molar absortivity), c ialah konsentrasi larutan dalam mol perliter (mol/L), dan l ialah panjang wadah sample yang dilintasi
cahaya, dinyatakan dalam sentimeter (cm)
Kombinasi dari kedua hukum tersebut (Hukum Beer-Lambert) dapat dituliskan sebagai berikut:
atau
%T = (I/I
0) x 100 = exp ( -ï c l)
A = log (I/I
0) = c l
Gambar 17. Skema Absorbansi pada Spektrofotometer UV-Vis
Gambar 18.Diagram Sederhana dari Spektrofotometer UV-Vis
a. Suatu sumber energi cahaya yang berkesinambungan yang meliputi daerah spektrum dimana instrumen itu dirancang untuk beroperasi.
b. Suatu monokromator, yakni suatu piranti untuk mengisolasi pita sempit panjang-panjang gelombang dari spektrum lebar yang dipancarkan oleh sumber cahaya.
c. Suatu wadah untuk sampel (kuvet).
d. Suatu detektor, yang berupa transduser yang mengubah energi cahaya menjadi suatu isyarat listrik.
e. Suatu pengganda (amplifier) dan rangkaian yang berkaitan yang membuat isyarat listrik itu memadai untuk dibaca.
f. Suatu sistem baca (piranti pembaca) yang memperagakan besarnya isyarat listrik, menyatakan dalam bentuk % Transmitan (% T) maupun Adsorbansi (A)
DocumentToPDF trial version, to remove this mark, please register this software.
a) Serapan oleh pelarut
Hal ini dapat diatasi dengan penggunaan blangko, yaitu larutan yang berisi matrik selain komponen yang akan dianalisis.
b) Serapan oleh kuvet
Kuvet yang biasa digunakan adalah dari bahan gelas atau kuarsa. Dibandingkan dengan kuvet dari bahan gelas, kuvet kuarsa memberikan kualitas yang lebih baik, namun tentu saja harganya jauh lebih mahal. Serapan oleh kuvet ini diatasi dengan penggunaan jenis, ukuran, dan bahan kuvet yang sama untuk tempat blangko dan sampel.
BAB III
METODOLOGI PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Pangan, Pusat Laboratorium Terpadu UIN Syarif Hidayatullah Jakarta yang terletak di Jl. Ir. H. Juanda No. 95, Ciputat, Tangerang 15142 selama 8 bulan yaitu dari bulan 22 April sampai 20 November 2008.
3.2 Alat dan Bahan Penelitian 3.2.1 Alat Penelitian
Alat yang digunakan pada penelitian ini meliputi seperangkat alat gelas,
botol semprot, kertas saring, wadah, inkubator, pipet mikro ukuran (200 l, 500
l,1000 l), tabung reaksi, oven, seperangkat alat titrasi, Sentrifugase High
Surval, timbangan analitik, Piknometer, Refraktometer Abbe, penganas air, spektrofotometer UV-Vis Lamda 25 Perkin Elmer, GCMS QP2010 Shimadzu dengan kolom RTX-1MS.
3.2.2 Bahan Penelitian
Buah kelapa yang berasal dari Pandeglang-Banten, inokulum tempe (Rhizopus orizae) dari pasar ciputat, metanol, DPPH, n-hexane, vitamin E, BF3
dalam metanol (14% b/v), benzen, larutan Wijs, etanol, KOH, KI, asam asetat, NaOH, HCl, natrium tiosulfat, kloroform, kanji, fenolftalein.
3.3 Desain Penelitian
Desain penelitian aktivitas antioksidan minyak kelapa murni (VCO) disajikan pada gambar 20 di bawah ini:
DocumentToPDF trial version, to remove this mark, please register this software.
kelapa
Santan
VCO
Fermentasi ragi tempe 1%, 2 %, 5%, 7 %,
10 %, 12% (b/v)
Uji Sifat Fisiko Kimia Uji Aktivitas Antioksidan
Karakterisasi Asam Lemak
- Kadar air - Berat jenis - Indeks bias
- Asam lemak bebas - Bil. iod
- Bil. penyabunan - Bil. peroksida
Metode DPPH GCMS
3.4 Cara Kerja
3.4.1 Pembuatan Santan dari Buah Kelapa
Kelapa dikupas kulit dan cangkangnya kemudian diparut dan diberi air
dengan suhu 350C dengan perbandingan 1:1 (berat), lalu disaring dan didiamkan selama 30 menit agar santan kental terpisah dari air. Santan kental inilah yang akan difermentasikan dengan Rhizopus orizae.
3.4.2. Fermentasi Santan dengan Rhizopus orizae
Dimasukkan 100 mL santan kental ke dalam masing-masing wadah tertutup dan ditambahkan dengan variasi konsentrasi ragi 1%, 2 %, 5 %, 7 %, 10 % dan 12 % (b/v). Dibiarkan selama 24 jam lalu dilihat hasil yang diperoleh. Terdapat tiga lapisan yaitu minyak, blondo dan air. Minyak yang terdapat dilapisan atas kemudian diambil dengan menggunakan sendok makan, minyak yang dihasilkan disaring dengan kertas saring agar minyak terbebas dari air dan zat pengotor lainnya, kemudian diukur volumenya dengan menggunakan gelas ukur sehingga diperoleh volume dari VCO. Dilakukan pengulangan sebanyak tiga kali (triplo).
3.4.3 Uji Sifat Fisiko Kimia 1. Kadar Air (SNI 01-3555-1998)
DocumentToPDF trial version, to remove this mark, please register this software.
1050C selama satu jam dan didinginkan dalam desikator selama 30 menit lalu ditimbang dan dilakukan duplo.
Kadar Air = m1 – m2 x 100%
m1
m1 = bobot cuplikan
m2 = bobot cuplikan setelah pengeringan
2. Indeks Bias (Apriyantono, 1989)
Beberapa tetes minyak diteteskan pada prisma refraktometer Abbe, yang sudah distabilkan pada suhu tertentu, dan dibiarkan selama 1 – 2 menit untuk mencapai suhu refraktometer, lalu dilakukan pembacaan indeks bias. Sebelum dan sesudah digunakan prisma refraktometer dibersihkan dengan alkohol.
R = R’ – K (T’ – T) R = indeks bias pada suhu standar
R’ = indeks bias pada suhu pembacaan K = 0.000385 untuk minyak
T’ = suhu pembacaan T = suhu standar
3. Berat Jenis (Apriyantono, 1989)
Piknometer dibersihkan dan dikeringkan lalu ditimbang. Isi piknometer dengan akuades bersuhu 20 – 300C. Pengisian dilakukan sampai air dalam botol direndam dalam bak air yang bersuhu 250C selama 30 menit. Botol diangkat dari bak dan dikeringkan dengan kertas pengisap, kemudian ditimbang botol dengan isinya.
4. Asam Lemak Bebas (SNI 01-3555-1998)
Sebanyak 2 gram sampel ditimbang ke dalam erlenmeyer 250 ml. ditambahkan 50 ml etanol 95 %, 5 tetes indikator PP dan dititer dengan larutan standar NaOH 0.1 N hingga warna merah muda tetap (tidak berubah selama 15 detik). Dilakukan duplo dan dihitung kadar asam lemak bebas dalam sampel.
Kadar asam lemak bebas = M x V x T 10 m M = bobot molekul asam lemak (untuk minyak kelapa M = 200) V = volume NaOH yang diperlukan dalam peniteran (ml) T = normalitas NaOH
m = bobot sampel (gram)
5. Bilangan Iod (SNI 01-3555-1998)
Ditimbang 1 gram sampel ke dalam erlenmeyer 250 ml dan ditambahkan 15 ml kloroform untuk melarutkan lemak. Ditambahkan 25 ml larutan Wijs, erlenmeyer tersebut ditutup rapat dan disimpan selama 1 jam dalam ruang gelap. Ditambahkan 10 ml larutan KI 20% dan 100 ml air suling. Ditutup erlenmeyer dengan segera, dikocok dan dititer dengan larutan natrium tiosulfat 0.1 N dan larutan kanji sebagai indikator. Dilakukan duplo dan dilakukan penetapan blanko. Kemudian dihitung bilangan iod dalam sampel.
Bilangan iod = 12.69 x T x (V3 – V4)
m T = normalitas larutan standart natrium tiosulfat 0.1 N
DocumentToPDF trial version, to remove this mark, please register this software.
V4 = volume larutan tio 0.1 N yang diperlukan pada peniteran sampel (ml)
m = bobot sampel (gram)
6. Bilangan Penyabunan (SNI 01-3555-1998)
2 gram sampel ditimbang ke dalam labu erlenmeyer 250 ml, ditambahkan 25 ml KOH alkohol 0.5 dan beberapa batu didih. Dihubungkan erlenmeyer dengan pendingin tegak dan dididihkan di atas pemanas listrik selama 1 jam. Ditambahkan 0.5 – 1 ml fenolftalein ke dalam larutan tersebut dan titer dengan asam klorida 0.5 N sampai warna indikator berubah menjadi tidak berwarna. Dilakukan duplo dan dilakukan penetapan blanko. Kemudian dihitung bilangan penyabunan dalam sampel.
Bilangan penyabunan = 56.1 x T x (V0 – V1)
m
V0 = volume HCl 0.5 N yang diperlukan dalam peniteran blanko (ml)
V1 = volume HCl 0.5 N yang diperlukan dalam peniteran sampel (ml)
T = normalitas HCl 0.5 N m = bobot sampel (gram)
7. Bilangan Peroksida (SNI 01-3555-1998)
dengan larutan kanji sebagai indikator. Dilakukan duplo dan dilakukan penetapan blanko. Kemudian dihitung bilangan peroksida dalam sampel.
Bilangan peroksida = (V1 – V0) x T x 1000
m
V0 = volume natrium tiosulfat yang diperlukan dalam peniteran blanko (ml) V1
= volume natrium tiosulfat yang diperlukan dalam peniteran sampel (ml) T = normalitas larutan standar natrium tiosulfat yang digunakan
m = bobot sampel (gram)
3.4.4 Uji Aktivitas Antioksidan Metode DPPH
Sampel dilarutkan dalam n-hexan dengan konsentrasi 250, 500, 750 dan 1000 ppm dan sebagai kontrol positif, vitamin E dibuat dengan konsentrasi 500
ppm. Sebanyak 2250 l sampel dimasukkan ke dalam tabung reaksi dan
ditambahkan 2250 l vitamin E, kocok. Kemudian ditambahkan 500 l larutan
DPPH 0.05 mM lalu kocok. Sebagai kontrol positif, vitamin E dimasukkan ke
dalam tabung reaksi sebanyak 4500 l dan ditambahkan DPPH sebanyak 500 l
lalu kocok. Selanjutnya serapan diukur pada panjang gelombang 509 nm. % Hambatan = A blanko - Asampel x 100%
Ablanko
3.4.5 Karakterisasi VCO dengan GCMS
Agar asam lemak penyusun suatu minyak dapat diukur dengan kromatografi gas, diubah lebih dahulu menjadi senyawa yang mudah berubah menjadi gas yaitu dalam bentuk ester asam lemak (Winarno, 1989).
a) Esterifikasi Asam Lemak dengan metanol-BF3 (Apriyantono, 1989)
DocumentToPDF trial version, to remove this mark, please register this software.
tersebut dikocok, kemudian dipanaskan dalam air mendidih selama 3 menit. Untuk menghentikan reaksi, ke dalam campuran ditambahkan 1 ml air destilat dimana campuran akan terpisah menjadi dua lapisan. Lapisan atas mengandung ester-ester metil yang larut dalam benzen, sedangkan lapisan bawah adalah campuran metanol, air dan katalis asam. Botol disentrifusa untuk memisahkan kedua lapisan tersebut dan selanjutnya lapisan benzen dipindahkan ke dalam botol kecil lainnya. Sampel siap untuk dianalisis dengan GCMS.
b) Analisis Asam Lemak dengan GCMS (Apriyantono, 1989)
Asam lemak dari minyak dilakukan menggunakan gas kromatografi (GC) setelah melalui proses esterifikasi terlebih dahulu. GCMS yang digunakan adalah merk Shimadzu tipe QP 2010, dengan menggunakan kondisi operasional sebagai berikut:
Gas : Helium
Kolom : RTX-1MS, Fase diam : Polymetil siloxant
Suhu : Injektor: 2800C, Oven: 800C – 2800C, 200C/menit, Interface: 3000C
Kontrol mode : Split
Column flow : 1.14 ml/min Split ratio : 200
Mode ionisasi : Electron Impact Solven delay : 3 menit
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Fermentasi dengan Rhizopus orizae
Dalam pembuatan minyak kelapa murni melalui proses ekstraksi komponen minyak dari santan digunakan panas minimum, dikarenakan pada suhu 35°C asam kaproat akan mulai terurai, dan pada suhu di atas 60°C asam-asam lemak yang lain, seperti kaproat dan kaprilat menguap. Dasar inilah yang digunakan untuk memilih air hangat (suam-suam kuku, dengan suhu antara 350C sampai 40°C) sebagai air perasan santan. Selanjutnya, air perasan santan di fermentasi dengan Rhizopus orizae dengan variasi inokulum 1%, 2%, 5%, 7%, 10% dan 12% (b/v).
Volume minyak kelapa murni (VCO) yang dihasilkan melalui proses fermentasi dapat di lihat pada tabel 4.
Tabel 4.Volume Minyak Kelapa Murni
DocumentToPDF trial version, to remove this mark, please register this software.
Hasil analisa statistik rancangan acak lengkap dengan menggunakan SPSS menunjukkan bahwa perbedaan konsentrasi Rhizopus orizae berpengaruh secara nyata terhadap volume VCO yang dihasilkan dengan nilai F hitung > F tabel dan Ho ditolak, artinya konsentrasi ragi memberikan pengaruh yang berbeda terhadap volume VCO yang dihasilkan, dengan probabilitas sebesar 0,024 ( < 0,05) sehingga Ho ditolak. (lampiran 5)
4.2 Sifat Fisiko Kimia
Analisis mutu produk minyak kelapa murni hasil fermentasi dilakukan terhadap beberapa parameter, meliputi: kadar air, indeks bias, densitas, kadar asam lemak bebas, bilangan iod, bilangan penyabunan dan bilangan peroksida.
4.2.1 Kadar Air
Banyak konsumen VCO muntah karena ketengikan, tengik ini terjadi karena hidrolisis akibat tingginya kadar air di dalam VCO. Hal ini ternyata disebabkan karena tingginya kandungan air, seperti yang telah diketahui bahwa berat jenis minyak lebih ringan dari berat jenis air (Sutarmi dan Rosaline, 2005). Hasil analisis kadar air dapat dilihat pada tabel 5.
Tabel 5. Hasil Analisis Kadar Air dalam VCO
Ulangan Kadar Air % Kadar Air Rata-rata %
Standar CODEX 19-1991 rev.2-1999
1 2
0.0940
0.0838 0.0889 Maks. 0,1 – 0,5 %
berasal dari udara adalah penyebab utama terjadinya ketengikan, hal ini disebabkan hidrolisis lemak dalam media air menghasilkan gliserol dan asam- asam lemak bebas tak jenuh yang teroksidasi lebih lanjut sehingga menjadi senyawa aldehid yang berbau tengik (Alam Syah, 2005).
4.2.2 Indeks Bias
Nilai indeks bias suatu jenis minyak dipengaruhi oleh suhu. Pada suhu yang lebih tinggi indeks bias semakin kecil. Hasil uji indeks bias pada suhu 260C dan 400C dapat dilihat pada tabel 6.
Tabel 6. Hasil Analisis Indeks Bias VCO
Ulangan Indek Bias
1.454 1.454 1,448 1,448 – 1,451
Indeks bias dari minyak yang dihasilkan sebesar 1,448. Pengujian indeks bias dapat digunakan untuk menentukan kemurnian minyak dan dapat menentukan dengan cepat terjadinya hidrogenasi katalisis (catalytic
hydrogenation). Semakin panjang rantai karbon dan semakin banyak ikatan
rangkap, indeks bias bertambah besar. Indeks bias yang diperoleh dari sampel termasuk dalam standar mutu Codex.
4.2.3 Massa Jenis ( Densitas)
Densitas atau massa jenis adalah perbandingan berat dari volume sampel
DocumentToPDF trial version, to remove this mark, please register this software.
Tabel 7. Hasil Analisis Berat Jenis VCO
Ulangan Massa Jenis Rata-rata Standar CODEX 19-1991 rev.2-1999
1 2
0.9214
0.9213 0.921 0,908 – 0,921
Berat jenis yang didapat sesuai dengan standar mutu Codex yaitu sebesar 0,908 – 0,921 untuk VCO dan berat jenis dari minyak yang dihasilkan sebesar 0,921.
4.2.4 Asam Lemak Bebas
Asam lemak bebas terdapat di dalam minyak atau lemak sejak bahan mulai dipanen dan jumlahnya akan terus bertambah selama proses pengolahan dan penyimpanan. Keberadaan asam lemak bebas biasanya dijadikan indikator awal terjadinya kerusakan minyak (Alam Syah, 2005). Hasil analisis kadar asam lemak bebas dapat dilihat pada tabel 8.
Tabel 8. Hasil Analisis Kadar Asam Lemak Bebas dalam VCO
4.2.5 Bilangan Iod
Bilangan iod dinyatakan sebagai jumlah gram iod yang diserap oleh 100 gram minyak atau lemak. Asam lemak bebas yang tidak jenuh dalam minyak dan lemak mampu menyerap sejumlah iod dan membentuk senyawa yang jenuh. Besarnya jumlah iod yang diserap menunjukkan banyaknya ikatan rangkap atau ikatan tidak jenuh. Hasil analisis bilangan iod VCO dapat dilihat pada tabel 9. Tabel 9. Hasil Analisis Bilangan Iod VCO
Ulangan Bilangan Iod Bilangan Iod Rata-rata Standar CODEX 19-1991 rev.2-1999
I II
8,4903
8,2208 8,3555 mg iod/g sampel 6.3 – 10.6 mg iod/g sampel
Data analisis menunjukkan, minyak VCO mempunyai bilangan iod yaitu 8,3555 mg iod/g sampel. Angka ini sesuai dengan standar codex 6,3 – 10,6 mg iod/g sampel, hal ini terjadi dikarenakan komponen asam lemak jenuh (ikatan tunggal) yang banyak terdapat dalam minyak dan sedikitnya asam lemak tak jenuh (ikatan rangkap). Semakin besar bilangan iod, maka semakin banyak ikatan rangkap yang ada dalam asam lemak suatu minyak. Sedangkan semakin banyak ikatan rangkap dalam suatu minyak, maka minyak tersebut akan semakin mudah rusak, karena sifatnya yang mudah teroksidasi oksigen dalam udara, senyawa kimia atau proses pemanasan.
4.2.6 Bilangan Penyabunan
DocumentToPDF trial version, to remove this mark, please register this software.
minyak atau lemak. Hasil analisis bilangan penyabunan VCO dapat dilihat pada tabel 10.
Tabel 10. Hasil Analisis Bilangan Penyabunan VCO
Ulangan Bilangan
387,90 388,65 mg KOH/g 248 – 265 mg KOH/g
Data analisis bilangan penyabunan minyak VCO adalah sebesar 388,65 mg KOH/gram contoh, angka ini relatif lebih besar dari standar untuk angka penyabunan minyak kelapa yaitu 255 – 265 mg KOH/gram contoh. Besarnya bilangan penyabunan bergantung dari massa molekul minyak. Minyak yang memiliki berat molekul rendah akan mempunyai bilangan penyabunan yang lebih tinggi. Hal ini diduga erat kaitannya dengan kandungan asam lemak dari minyak VCO yang terdiri dari 95% berupa asam lemak rantai sedang.
4.2.7 Bilangan Peroksida
Bilangan peroksida adalah nilai terpenting untuk menentukan derajat kerusakan pada minyak atau lemak. Asam lemak tidak jenuh dapat mengikat oksigen pada ikatan rangkapnya sehingga membentuk peroksida. Hasil analisis bilangan peroksida VCO dapat dilihat pada tabel 11.
Tabel 11. Hasil Analisis Bilangan Peroksida VCO
Ulangan Bilangan Peroksida Bilangan Peroksida Rata-rata
0,04 0,04 meq/kg minyak 3 meq/kg minyak
terjadi kontak antara sejumlah oksigen dengan ikatan rangkap pada minyak atau lemak. Senyawa peroksida merupakan produk yang terbentuk pada awal proses oksidasi, yang sifatnya tidak stabil dan mudah terdekomposisi. Hasil analisis bilangan peroksida sebesar 0,04 meq/kg minyak menunjukkan bahwa tingkat kerusakan oksidasi minyak kelapa murni masih relatif rendah, hal ini dikarenakan asam lemak tak jenuh yang terdapat dalam VCO relatif kecil yaitu sebesar 5%. 4.3 Aktivitas Antioksidan Metode DPPH
Aktivitas antioksidan diukur dengan metode DPPH, dengan standar vitamin E sebagai pembanding pada konsentrasi 500 ppm. Hasil analisis dapat dilihat pada tabel 12.
Tabel 12. Hasil Analisis Aktivitas Antioksidan VCO Metode DPPH
% Hambatan
Blanko
Vitamin E
Sampel + Vitamin E
-
21.16
27.51
DocumentToPDF trial version, to remove this mark, please register this software.
memiliki aktivitas penghambatan radikal bebas lebih kuat dibandingkan ekstraknya serta optimasi metode yang kurang tepat untuk senyawa nonpolar. 4.4 Hasil Analisis Komposisi Asam Lemak dengan GCMS
BAB V PENUTUP
5.1 Kesimpulan
1. Hasil uji statistik menunjukkan bahwa perbedaan konsentrasi Rhizopus orizae
berpengaruh secara nyata terhadap volume VCO yang dihasilkan (signifikansi 0,024) pada konsentrasi 2%.
2. Analisis sifat fisiko kimia Virgin Coconut Oil hasil fermentasi menunjukkan sebagian besar parameter masih termasuk ke dalam Standar Codex meliputi; kadar air, indek bias, densitas, kadar asam lemak bebas, bilangan iod dan bilangan peroksida, semua termasuk dalam standar mutu Codex, kecuali bilangan penyabunan sebesar 388,65 mg KOH/ g sampel.
3. Minyak kelapa murni (VCO) yang dihasilkan melalui fermentasi Rhizopus
orizae memiliki aktivitas antioksidan sebesar 6.35% pada konsentrasi 1000
ppm.
5.2 Saran
Diperlukan adanya penelitian lebih lanjut guna diperolehnya aktivitas antioksidan yang lebih besar serta metode yang lebih sesuai untuk senyawa nonpolar.