I. PENDAHULULUAN
A. Latar Belakang
Pesatnya perkembangan industri berdampak pada peningkatan kebutuhan pasar akan suatu katalisator, baik katalisator sintetik maupun biokatalisator. Kesadaran masyarakat terhadap masalah lingkungan yang semakin tinggi, serta adanya tekanan dari para ahli dan pecinta lingkungan menjadikan teknologi enzim sebagai salah satu alternatif untuk menggantikan berbagai proses kimiawi dalam bidang industri (Falch, 1991). Enzim adalah protein yang diproduksi oleh sel hidup dan digunakan sebagai katalisator reaksi biokimia yang khas (Shahib, 2005). Beberapa kelebihan yang dimiliki enzim yaitu mengkatalisis reaksi yang bersifat spesifik sehingga meminimalkan reaksi samping dan bekerja pada kondisi yang ramah. Keunggulan enzim sebagai biokatalisator ini menyebabkan enzim menjadi pilihan bila dibanding dengan katalis kimia lainnya yang bersifat toksik dan mencemari lingkungan (Virdianingsih, 2002).
Protease merupakan enzim penting dan memiliki nilai ekonomi yang tinggi. Hal ini dapat dilihat dari jumlah penjualan enzim protease yang mencapai 60% dari total penjualan enzim dunia yang mencapai 1 milyar dollar AS pertahun (Sumanthaet al.,2006), selain itu protease memilki aplikasi yang sangat luas baik dibidang industri pangan maupun non pangan
diantaranya seperti industri deterjen, kulit, tekstil, makanan, hidrolisat protein, pengolahan susu, farmasi dan limbah (Moon and Paulekar, 1993).
pada aktivitas dan kestabilan enzim. Pada suhu tinggi enzim akan mengalami denaturasi yang membuat enzim menjadi inaktif. Sedangkan penggunaan suhu tinggi sangat diperlukan untuk meningkatkan laju reaksi dan mengurangi masalah-masalah viskositas (Ahern and Klibanov, 2001) sehingga diperlukan enzim yang stabil pada suhu tinggi dalam proses tersebut.
Menurut Suhartono (1989) terdapat beberapa cara untuk meningkatkan kestabilan enzim diantaranya teknik amobilisasi, modifikasi kimia, rekayasa molekuler dan penambahan aditif. Penggunaan aditif sebagai penstabil merupakan metode yang paling sederhana yang dapat digunakan untuk meningkatkan aktivitas dan stabilitas enzim.
Aktivitas enzim berhubungan langsung dengan perubahan struktur tertier dari molekul protein enzim. Pada keadaan suhu, pH, dan konsetrasi ion normal, struktur tersier protein distabilkan oleh empat jenis interaksi. lnteraksi tersebut adalah ikatan hidrogen, interaksi hidrofobik, gaya tarik ionik, dan jembatan kovalen (Monsan and Combess, 1984).
Enzim protease dapat diproduksi dari berbagai mikroorganisme, diantaranya adalah
actinomycetes(Alina, 2003). Actinomycetesadalah suatu kelompok mikroorganisme yang morfologinya merupakan bentuk peralihan antara bakteri dan jamur.Actinomycetes
berpotensi menghasilkan senyawa metabolit sekunder, enzim selulase, enzim protease dan enzim kitinase (Margaveyet al.,2004) .Actinomycetesyang akan digunakan untuk produksi enzime protease yaitu jenis ANL4 2b-3 yang didapatkan dari isolat lumpur tanah yang yang berada di Pantai Ringgung Teluk Lampung pada kedalaman 2 cm. Berdasarkan hasil penelitian pendahuluan yang telah dilakukan oleh Andini (2010), telah diuji kemampuan proteolitiknya pada Media Salt Medium dengan pertumbuhan optimum pada suhu 37oC, pH 7dan waktu inkubasi 120 jam. Enzim protease dari bakteri ini juga berhasil diisolasi dan ditentukan karakterisasinya yaitu optimum pada suhu 50oC, pH 7 dan waktu inkubasi 60 menit. Pada penelitian ini telah dipelajari mengenai pengaruh penambahan gliserol dan sorbitol terhadap aktivitas enzim protease
B. Tujuan Penelitian
Tujuan dari penelitian ini adalah :
1. Mempelajari pengaruh gliserol dan sorbitol terhadap aktivitas enzim protease dari ActinomycetesANL4 2b-3.
2. Mengetahui kemampuan dari gliserol dan sorbitol dalam mempertahankan aktivitas enzim protease dariActinomycetesANL4 2b-3.
C. Manfaat Penelitian
I. TINJAUAN PUSTAKA
A. Actinomycetes
Actinomycetesmerupakan mikroorganisme tanah yang umum dijumpai pada berbagai jenis tanah. Populasinya berada pada urutan kedua setelah bakteri bahkan kadang kadang hampir sama (Alexander, 1961).Actinomyceteshidup sebagai saprofit dan aktif mendekomposisi bahan organik sehingga dapat meningkatkan kesuburan tanah (Nonomura and Ohara, 1969a) . Pada umumnyaActinomycetestidak toleran terhadap asam dan jumlahnya menurun pada keadaan lingkungan dengan pH dibawah 5.0 (Jiang and Xu, 1985). Rentang pH yang paling cocok untukActinomycetesadalah antara 6,5-8.0. Temperatur yang cocok untuk
pertumbuhanActinomycetesadalah 25-30oC, tetapi pada suhu 55-65oCActinomycetesmasih dapat hidup dalam jumlah cukup besar khususnya genusThermoactinomycetesdan
Streptomyces(Rao, 1998).
Actinomycetesmerupakan kelompok mikroba bersifat gram positif (Lay dan Hastowo, 1992). Pernyataan tersebut sesuai dengan Alexander (1961) yang mengatakan bahwaactinomycetes memiliki dinding sel yang terdiri dari polimer-polimer gula, asam amino dan asam gula seperti dinding sel bakteri gram positif.
bakteri (Sutedjo dan Kartasapoetra, 1991) sertaactinomycetesmemilki kesamaan dengan bakteri pada struktur sel dan ukuran irisan yang melintang (Foth, 1991).
B. Enzim
Enzim adalah suatu katalisator protein atau dalam bentuk gabungan dengan molekul asam nukleat yang berfungsi mempercepat reaksi kimia dalam makhluk hidup atau dalam sistem biologi (Shahib, 2005). Enzim merupakan katalis biologi, yang mampu meningkatkan laju reaksi dengan cara selektif dan efisien yang mendasar pada hukum termodinamika dan kinetika. Sifat-sifat katalitik khas dari enzim ialah sebagai berikut (Page, 1989 ):
1. Enzim mampu meningkatkan laju reaksi pada kondisi biasa (fisiologi) dari tekanan, suhu dan pH.
2. Enzim berfungsi dengan selektifitas tinggi terhadap substrat (substansi yang mengalami perubahan kimia setelah bercampur dengan enzim) dan jenis reaksi yang dikatalisis. 3. Enzim memberikan peningkatan laju reaksi yang tinggi dibanding dengan katalis biasa.
Enzim memilki beberapa keunggulan diantaranya ialah memiliki produktivitas dan
spesifisitas yang tinggi tanpa pembentukan senyawa samping, sehingga mengurangi biaya purifikasi dan efek kerusakan terhadap lingkungan (Chaplin and Bucke, 1990).
Berikut ini faktor-faktor yang mempengaruhi kerja enzim :
1) Konsentrasi enzim
Konsentrasi enzim secara langsung mempengaruhi kecepatan laju reaksi enzimatik dimana laju reaksi meningkat dengan bertambahnya konsentrasi enzim (Poedjiadi, 1994). Laju reaksi tersebut meningkat secara linier selama konsentrasi enzim jauh lebih sedikit dari pada
konsentrasi substrat. Hal ini biasanya terjadi pada kondisi fisiologis (Page, 1989).
2) Konsentrasi substrat
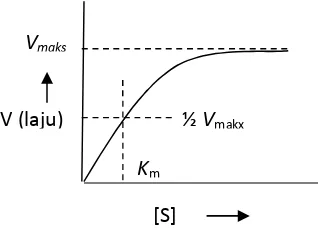
Pada konsentrasi enzim tetap dan konsentrasi enzim bervariasi terdapat hubungan antara aktivitas enzim dengan konsentrasi substrat. Pada konsentrasi substrat yang terlalu rendah aktivitas katalitiknya pun rendah. Dengan meningkatnya konsentrasi substrat aktivitas enzim meningkat secara linier, kemudian secara logaritmatik dan akhirnya mencapai harga
[image:7.595.177.336.514.629.2]maksimum dimana penambahan konsentrasi substrat lebih lanjut tidak mempengaruhi laju reaksi enzim. Gejala ini disebut kinetika penjenuhan (Page, 1989). Hubungan antara konsentrasi substrat dengan laju reaksi enzim ditunjukkan dalam Gambar 1.
Gambar 1. Hubungan konsentrasi substrat dengan laju reaksi enzim (Shahib, 2005)
3) Inhibitor
½Vmakx Km
[S] V (laju)
Inhibisi atau hambatan reaksi enzim adalah penurunan kecepatan reaksi enzimatik akibat adanya suatu senyawa kimia tertentu dalam larutan enzim substrat (Mara, 1999). Molekul atau ion yang dapat menghambat reaksi tersebut dinamakan inhibitor (Poedjiadi, 1994). Pada umumnya cara kerja inhibitor adalah dengan menyerang sisi aktif enzim sehingga enzim tidak dapat lagi berikatan dengan substrat sehingga fungsi katalitiknya terganggu (Winarno, 1989).
4) Suhu
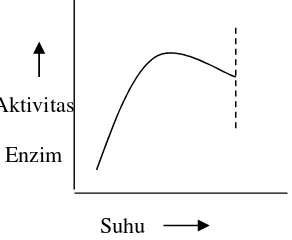
Suhu optimum merupakan suhu pada saat enzim memiliki aktivitas maksimum. Hubungan antara aktivitas enzim dengan suhu ditunjukkan dalam Gambar 2. Dalam gambar
[image:8.595.200.346.504.624.2]diterangkan bahwa suhu dapat meningkatkan laju reaksi enzimatik sampai batas tertentu. Suhu yang terlalu tinggi (jauh dari suhu optimum suatu enzim) akan menyebabkan enzim terdenaturasi (Poedjiadi, 1994). Hal ini disebabkan karena terbukanya lipatan molekul enzim, sehingga interaksi hidrofobik menurun dan akhirnya akan membentuk agregat. Pada suhu tinggi substrat juga dapat mengalami perubahan konformasi sehingga gugus reaktifnya rusak atau mengalami hambatan dalam memasuki sisi aktif enzim (Suhartono, 1989).
Gambar 2. Hubungan suhu dengan aktivitas enzim (Shahib, 2005)
5) pH
Struktur ion enzim bergantung pada pH lingkungan. Enzim dapat berbentuk ion positif dan negatif (Zwitter ion). Dengan demikian perubahan pH akan mempengaruhi efektivitas bagian
Suhu Aktivitas
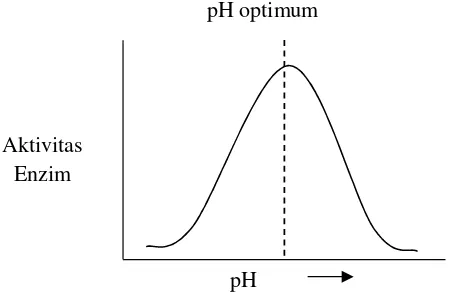
aktif enzim dalam membentuk kompleks enzim-substrat. Selain itu, pH yang tinggi dapat menyebabkan terjadinya proses denaturasi dan ini akan mengakibatkan menurunnya aktivitas enzim. Secara umum pengaruh pH terhadap aktivitas enzim ditunjukkan pada Gambar 3. Pada beberapa enzim memiliki aktivitas maksimum pada kisaran pH antara 4,5-8,0 (Winarno, 1989)
Gambar 3. Hubungan pH dengan aktivitas (Shahib, 2005)
6). Kofaktor logam.
Kofaktor adalah suatu faktor yang membantu keaktifan enzim. Ikatan antara kofaktor dan enzim dapat sangat kuat dan ada pula yang tidak terikat dengan kuat (Poedjiadi, 1994).
7). Pelarut organik.
Penggunaan pelarut dalam reaksi enzimatik memberikan keuntungan antara lain ialah kelarutan substrat-organik dan enzim lebih tinggi dibandingkan dengan air serta meningkatkan kestabilan enzim dengan pelarut (Kwon and Rhee, 1986).
Enzim bekerja berdasarkan teori kunci gembok, menurut teori ini terjadinya reaksi antara substrat dengan enzim karena adanya kesesuaian bentuk ruang antara substrat dengan situs aktif dari enzim, sehingga sisi aktif enzim cenderung kaku. Substrat berperan sebagai kunci masuk ke dalam situs aktif, sehingga terjadi kompleks enzim-substrat. Pada saat ikatan
pH optimum
pH Aktivitas
kompleks enzim-substrat terputus, produk hasil reaksi akan dilepas dan enzim akan kembali pada konfigurasi semula. Berbeda dengan Teori kunci gembok, menurut Teori kecocokan induksi reaksi antara enzim dengan substrat berlangsung karena adanya induksi substrat terhadap situs aktif enzim sedemikian rupa sehingga keduanya merupakan struktur yang komplemen atau saling melengkapi. Menurut teori ini sisi aktif tidak bersifat kaku, tetapi lebih fleksibel (Yandriano, 2006).
C. Protease
Protease adalah enzim yang dapat menghidrolisis protein menjadi senyawa-senyawa yang lebih sederhana seperti peptida kecil dan asam amino. Berdasarkan CIUEB (Commision on Enzym of the International Union of Biochemistry) protease merupakan enzim kelas 3, hidrolase dan subkelas 3,4 peptida hidrolase atau peptidase (Beynom and Bond, 1989). Berdasarkan cara pemotongan ikatan peptida , enzim protease dapat dibedakan menjadi eksopeptidase dan endopeptidase. Eksopeptidase terdiri atas karboksil eksopeptidase yang memotong peptida dari arah gugus karboksil terminal dan amino eksopeptidase dari gugus amino terminal, sedangkan endopeptidase memecah ikatan peptida dari dalam. Menurut Harley (1960) dalam Winarno (1989) endopeptidase dapat dibedakan berdasarkan gugus reaktif pada sisi aktif yang terlibat dalam katalisis, menjadi:
1. Protease serin merupakan enzim protease yang memilki residu serin dalam sisi aktifnya. Contohnya adalah enzim tripsin dan subtilisin. Enzim protease golongan ini dihambat kuat oleh senyawa diisopropil fluorophosphat (DFP).
3. Protease Metal yaitu protease yang keaktifannya bergantung pada adanya logam per mol enzim. Metal tersebut terdiri dari Mg, Zn, Co, Fe, Hg, Ni dan sebagainya. Enzim ini dihambat oleh EDTA yang dapat mengkhelat metal sehingga keaktifan enzim hilang.
4. Protease Asam yaitu enzim yang keaktifannya disebabkan adanya dua gugus karbonil pada sisi aktifnya. Protease asam memotong substrat protein pada asam amino
aromatik atau asam amino berukuran besar. Keaktifannya dapat dihambat oleh p-bromofenasilbromida.
D. Stabilitas Enzim
Stabilitas enzim dapat diartikan sebagai kestabilan aktivitas enzim selama penyimpanan dan penggunaan enzim tersebut, serta kestabilan terhadap berbagai senyawa yang bersifat
merusak enzim seperti pelarut tertentu (asam atau basa) dan oleh pengaruh suhu dan pH yang ekstrim (Wiseman, 1978 dalam Junita, 2002).
Ada dua cara yang dapat ditempuh untuk mendapatkan enzim yang mempunyai stabilitas tinggi, yaitu menggunakan enzim yang memiliki stabilitas ekstrim alami dan mengusahakan peningkatan stabilitas enzim yang secara alami tidak/kurang stabil (Junita, 2002). Untuk meningkatkan stabilitas enzim yang secara alami tidak/kurang stabil, salah satunya adalah dengan penambahan senyawa aditif.
a. Stabilitas termal enzim
Dalam industri, pada proses reaksinya biasanya menggunakan suhu yang tinggi. Penggunaan suhu yang tinggi bertujuan untuk mengurangi tingkat kontaminasi dan masalah-masalah viskositas serta meningkatkan laju reaksi. Namun, suhu yang tinggi ini merupakan masalah utama dalam stabilitas enzim, karena enzim umumnya tidak stabil pada suhu tinggi.
Penggunaan enzim dalam industri umumnya dilakukan pada suhu relatif rendah, misalnya pada suhu 50-60°C (untuk glukoamilase dan glukosa isomerase) atau lebih rendah.
Penggunaan enzim pada suhu yang lebih tinggi hingga 85-100°C hanya dijumpai pada
proses hidrolisis pati dengan menggunakan α-amilase bakterial. Oleh sebab itu, diperlukan enzim dengan stabilitas termal pada rentang suhu yang tinggi.
Proses inaktivasi enzim pada suhu tinggi berlangsung dalam dua tahap, yaitu :
1) Adanya pembukaan partial (partial unfolding) struktur sekunder, tersier dan atau kuartener molekul enzim.
2) Perubahan struktur primer enzim karena adanya kerusakan asam amino-asam amino tertentu oleh panas (Ahern and Klibanov, 1987).
Air memegang peranan penting pada kedua tahap di atas. Oleh karena itu, dengan menggunakan air seperti pada kondisi mikroakueus, reaksi inaktivasi oleh panas dapat diperlambat dan stabilitas termal enzim akan meningkat.
Stabilitas termal enzim akan jauh lebih tinggi dalam kondisi kering dibandingkan dalam kondisi basah. Adanya air sebagai pelumas membuat konformasi suatu molekul enzim menjadi sangat fleksibel, sehingga bila air dihilangkan molekul enzim akan menjadi lebih kaku (Virdianingsih, 2002).
Semua reaksi enzim dipengaruhi oleh pH medium tempat reaksi terjadi (Suhartono, 1989). Stabilitas enzim dipengaruhi oleh banyak faktor seperti suhu, pH, pelarut, kofaktor dan kehadiran surfaktan (Eijsinket al.,2005). Dari faktor-faktor tersebut, pH memegang peranan penting. Diperkirakan perubahan keaktifan pH lingkungan
disebabkan terjadinya perubahan ionisasi enzim, substrat atau kompleks enzim substrat. Enzim menunjukkan aktivitas maksimum pada kisaran pH optimum enzim dengan stabilitas yang tinggi (Winarno, 1989).
Pada reaksi enzimatik, sebagian besar enzim akan kehilangan aktivitas katalitiknya secara cepat danirreversiblepada pH yang jauh dari rentang pH optimum untuk reaksi
enzimatik. Inaktivasi ini terjadi karenaunfoldingmolekul protein sebagai hasil dari perubahan kesetimbangan elektrostatik dan ikatan hidrogen (Kazanet al.,1997).
E. Senyawa Poliol (Polihidroksi Alkohol)
Polihidrat alkohol atau biasa disebut dengan poliol adalah senyawa organik rantai lurus yang hanya memiliki hidroksil sebagai gugus fungsionalnya. Senyawa ini dinilai lebih stabil, baik dari suhu maupun struktur kimiawinya daripada gula konvensional. Harga senyawa ini tentu lebih mahal, namun diimbangi dengan penampilan yang cantik pada produk akhir. Contoh senyawa polihidrat alkohol yang sering dijumpai dalam produk pangan adalah gliserin, sorbitol, mannitol, dan propilen glikol.
a. Gliserol
tripospat dehidrogenase dalam sitoplasma sel eukariot selama glikolisis. Gliserol merupakan komponen penting dalam trigliserida dan komponen lipid.
Dalam bentuk murni merupakan senyawa yang tidak berbau, tidak berwarna, higroskopis dan berupa cairan kental yang berasa manis dengan titik leleh 180C, titik didih 2900C, densitas sebesar 1,261 g/cm3, massa molekulnya 92,0982 g/mol, dengan nama IUPAC propane-1,2,3-triol (Hart, 2003).
Struktur gliserol dapat dilihat pada Gambar 4.
b. Sorbitol
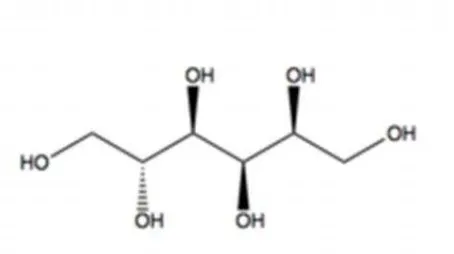
Sorbitol juga dikenal dengan glusitol. Sorbitol memiliki berat molekul 182,17 g/mol, densitas sebesar 0,68 g/cm3, titik didih 2960C dan titik leleh 950C. Sorbitol banyak ditemukan pada buah-buahan dan biji-bijian dari genusSorbus.Sorbitol digunakan sebagai bahan campuran sirup obat batuk, selain itu sorbitol digunakan sebagai gula pengganti pada makanan dan minuman rendah kalori. Struktur dari sorbitol dapat dilihat pada Gambar 5.
Gambar 5. Struktur Sorbitol
F. Isolasi dan Pemurnian Enzim
Enzim dapat diisolasi secara ekstraseluler dan intraseluler. Enzim ekstraseluler merupakan enzim yang bekerja di luar sel, sedangkan enzim intraseluler merupakan enzim yang bekerja di dalam sel. Ekstraksi enzim ekstraseluler lebih mudah dibandingkan ekstraksi dari
intraseluler, karena tidak memerlukan pemecahan sel, dan enzim yang dikeluarkan dari sel mudah dipisahkan dari pengotor lain serta tidak banyak bercampur dengan bahan-bahan sel lain (Pelczar and Chan,1986).
a. Sentrifugasi
Sentrifugasi merupakan tahap awal pemurnian enzim dengan memisahkan enzim ekstraseluler dari sisa-sisa sel. Sentrifugasi dilakukan pada suhu rendah (dibawah suhu kamar) untuk menjaga kehilangan aktivitas enzim (Suhartono, 1989) selain itu
Prinsip sentrifugasi berdasarkan pada kenyataan bahwa setiap partikel yang berputar pada laju sudut yang konstan akan memperoleh gaya keluar (F). Besar gaya ini bergantung pada laju sudutω(radian/detik) dan radius pertukarannya (sentimeter).
F =ω2r
Gaya F dipengaruhi oleh gaya gravitasi bumi, karena itu dinyatakan sebagai gaya sentrifugal relatif (RCF dengan satuan g (gramavitasi)).
RCF = 980
2
r
ω
Dalam praktiknya, alat sentrifugasi dioperasikan dengan laju rpm. Oleh sebab itu, harga rpm dikonversikan kedalam bentuk radian menggunakan persamaan:
ω =
30 rpm π
RCF = (πrpm)2r x 2 30 980
RCF = (1.119x10-5)(rpm)2r
(Cooper, 1997 dalam Sariningsih, 2000).
b. Fraksinansi Garam amonium sulfat
kekuatan ion ini meningkatkan kadar air yang terikat pada ion, dan jika interaksi antar ion kuat, kelarutannya menurun akibatnya interaksi antar protein lebih kuat dan kelarutannya menurun (Agoestin dan Munir, 1997).
Senyawa elektrolit yang sering digunakan untuk mengendapkan protein ialah amonium sulfat. Kelebihan amonium sulfat dengan dibandingkan dengan senyawa-senyawa elektrolit lain ialah memiliki kelarutan yang tinggi, tidak mempengaruhi aktivitas enzim, mempunyai daya pengendap yang efektif, efek penstabil terhadap kebanyakan enzim, dapat digunakan pada berbagai pH dan harganya murah (Scopes, 1982).
c. Dialisis
Dialisis merupakan metode yang digunakan untuk memisahkan garam dari larutan protein berdasarkan pada sifat semipermeabel membran. Secara umum, proses dialisis
berlangsung sebagai berikut: Larutan protein atau enzim dimasukkan ke dalam kantung dialisis yang terbuat dari membran semipermeabel (selofan). Jika kantung yang berisi larutan protein atau enzim dimasukkan ke dalam larutan buffer, maka molekul kecil yang ada di dalam larutan protein atau enzim seperti garam anorganik akan keluar melewati pori-pori membran, sedangkan molekul protein atau enzim yang berukuran besar tetap tertahan dalam kantung dialisis. Keluarnya molekul menyebabkan distribusi ion-ion yang ada di dalam dan di luar kantung dialisis tidak seimbang. Untuk memperkecil pengaruh ini digunakan larutan buffer dengan konsentrasi rendah di luar kantung dialisis
(Lehninger, 1982). Setelah tercapai keseimbangan, larutan di luar kantung dialisis diganti dengan larutan yang baru agar konsentrasi ion-ion di dalam kantung dialisis dapat
dikurangi.
suhu dan viskositas larutan. Meskipun suhu tinggi dapat meningkatkan laju difusi, namun sebagian besar protein dan enzim stabil pada suhu 4-8°C sehingga dialisis harus dilakukan di dalam ruang dingin (Pohl, 1990).
d. Penentuan kadar protein dengan metode Lowry
Penentuan kadar protein bertujuan untuk mengetahui bahwa protein enzim masih terdapat pada tiap fraksi pemurnian (tidak hilang dalam proses pemurnian) dengan aktivitas yang atau tetap baik. Salah satu metode untuk menentukan kadar protein adalah metode Lowry. Metode ini bekerja pada kondisi alkali dan ion tembaga (II) akan membentuk kompleks dengan protein. Ketika reagenfolin-ciocalteauditambahkan, maka akan mengikat protein. Ikatan ini secara perlahan akan mereduksi reagenfolinmenjadi heteromolibdenum dan merubah warna dari kuning menjadi biru.
Pada metode ini, pengujian kadar protein didasarkan pada pembentukan kompleks Cu2+ dengan ikatan peptida yang akan tereduksi menjadi Cu+pada kondisi basa. Cu+dan rantai samping tirosin, triftofan, dan sistein akan bereaksi dengan reagenfolin-ciocalteau. Reagen bereaksi dengan menghasilkan produk tidak stabil yang tereduksi secara lambat menjadi molibdenum atautungesteen blue. Protein akan menghasilkan intensitas warna yang berbeda tergantung pada kandungan triftofan dan tirosinnya.
1
I. METODOLOGI PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan April - Juli 2012 di Laboratorium Biokimia, Laboratorium Instrumentasi Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
B. Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini antara lain alat-alat gelas, jarum ose, pembakar spiritus, pipet Ependroff, pengaduk magnet, pH Universal, sentrifuga, autoklaf , lemari pendingin,shaker incubator(orbit environ shaker), cold plate, waterbath, laminar air flow,dan spektrofotometerUV-Vis.
Bahan-bahan yang digunakan dalam penelitian ini antara lainmalt extract,pepton, yeast extract, larutan kasein, susu skim, air laut steril, akuades, alkohol, kantung selofan, glukosa, Na2CO3, NaOH ,TCA, (NH4)2SO4, reagenfolin ciocelteau, Na/K tartarat, NaCl, NaH2PO4, Na2HPO4, BSA (Bovine Serum Albumin), gliserol dan sorbitol. Bakteri penghasil enzim protease yang digunakan yaitu
ActinomycetesANL4 2b-3.
C. Prosedur Penelitian
1. Pembuatan Media dan Larutan Pereaksi
2
1). Media ISP-2 (International Streptomyces Project) untuk Peremajaan ActinomycetesANL4 2b-3
Media ISP-2 terdiri dari 4 gramyeast ekstract, 10 grammalt extract, 4 gram dextrose, dan 24 gram agar dilarutkan dalam 1L air laut steril lalu disterilisasi selama 15 menit 121oC, 1 atm. Setelah media sedikit dingin ditambahkan sikloheksamida 25µg/mL dannalidixic acid25µg/mL (Margavey,et al.,2004). 2). Pembuatan Media Inokulum dan Fermentasi untuk Produksi Enzim
Media cair dibuat dengan komposisiyeast extract0,5%, glukosa 0,1%, susu skim 0,5%, 1% NaCl 0,5 M dilarutkan dalam 100 mL akuades, kemudian disterilisasi selama 15 menit pada suhu 121˚C dan tekanan 2 atm.
b. Pembuatan Pereaksi Untuk Pengukuran aktivitas Protease Metode Kunitz
1). Buffer Phospat pH 7
Stok A : 0,2 M NaH2PO4(15,601 g NaH2PO4.2H2O dilarutkan dalam labu ukur 1L dengan akuades.
Sok B : 0,2 M Na2HPO4(17,799 g NaH2PO4.2H2O dilarutkan dalam labu ukur 1L akuades.
Buffer phospat pH 7 dibuat dengan mencampurkan 38,9 mL stok A dan 61,1 mL stok B.
2). Larutan Kasein
1 gram larutan kasein dilarutkan dalam labu ukur 100 mL dengan buffer phospat pH 7 pada penangas air (80-90oC) pH akhir 7,2 .
3
5 gram TCA dilarutkan dalam labu ukur 100 mL lalu diencerkan dengan akuades hingga garis batas.
4). Larutan Standar Tirosin
Larutan standar tirosin dibuat dengan kadar 0, 20, 40, 60, 80, 100, 120 ppm.
c. Pembuatan Pereaksi Untuk Pengukuran kadar protein Metode Lowry Pereaksi A : 2 gram Na2CO3dilarutkan dalam 100 mL NaOH 0,1 N. Pereaksi B : 5 mL larutan CuSO4.5H2O 1% ditambahkan ke dalam 5 mL
larutan Na(K) tartarat 1%.
Peraksi C : 2 mL pereaksi B ditambahkan 100 mL pereaksi A. Pereaksi D : reagenfolin ciocelteaudiencerkan dengan akuades 1 : 1. Larutan standar : larutan BSA (Bovine Serum Albumin) dengan kadar 0, 20, 40,
60, 80, 100, 120, 140 ppm.
2. Penyiapan Inokulum
4
0,1%, susu skim 0,5%, 1% NaCl 0,5 M, kemudian diinkubasi pada suhu 37oC, pH 7.0 dan waktu inkubasi 120 jam. Biakan ini disebut starter atau inokulum.
3. Isolasi dan Pemurnian Enzim
Media yang digunakan untuk isolasi enzim sama dengan media pada penyiapan inokulum, media tersebut disterilisasi selama 15 menit 121oC, 1 atm. Selanjutnya biakanactinomycetesdiinokulasikan dan diinkubasi pada suhu 37oC, pH 7.0 dan waktu inkubasi 120 jam. Untuk memisahkan larutan enzim dari konstituen seluler lainnya dilakukan sentrifugasi pada 3500 rpm selama 20 menit. Filtrat yang diperoleh disebut ekstrak kasar enzim, terhadap ekstrak kasar enzim tersebut dilakukan penentuan kadar protein dengan metode Lowry dan uji aktivitas enzim menggunakan metode Kunitz.
a. Pengendapan dengan amonium sulfat [(NH4)2SO4]
Ekstrak kasar enzim yang diperoleh diendapkan dengan garam amonium sulfat pada berbagai derajat kejenuhan yaitu (0-15)%; (15-30)%; (30-45)%; (45-60); (60-75)% ; dan ( 75-90)%. Skema proses pengendapan protein enzim dengan penambahan amonium sulfat ditunjukkan pada Gambar 6.
5
dan diuji aktivitasnya dengan metode Kunitz, serta diukur kadar proteinnya dengan metode Lowry. Selanjutnya, filtrat yang didapat dari fraksi 0-15% digunakan untuk diendapkan kembali dengan fraksi kejenuhan 15-30% dengan prosedur yang sama (Kazanet al.,1997).
Gambar 6. Skema pengendapan protein enzim dengan amonium sulfat
b. Dialisis
6
Selama dialisis, dilakukan pergantian buffer selama 4-6 jam agar konsentrasi ion-ion di dalam kantung dialisis dapat dikurangi. Proses ini dilakukan secara terus menerus sampai ion-ion di dalam kantung dialisis dapat diabaikan. Untuk
mengetahui bahwa sudah tidak ada lagi ion-ion garam dalam kantung, maka diuji dengan menambahkan larutan Ba(OH)2atau BaCl2, bila masih ada ion sulfat dalam kantung, maka akan terbentuk endapan putih BaSO4. Semakin banyak endapan yang terbentuk, maka semakin banyak ion sulfat yang ada dalam
kantung. Selanjutnya dilakukan uji aktivitas dengan metode Kunitz, serta diukur kadar proteinnya dengan metode Lowry.
4. Pembuatan Campuran Enzim dan Senyawa Aditif
Campuran enzim dan senyawa aditif dibuat dengan menambahkan senyawa aditif (gliserol dan sorbitol) ke dalam larutan enzim dengan perbandingan 1:1. Konsentrasi senyawa aditif yang digunakan yaitu masing-masing 0,5M, 1M dan 1,5M baik untuk gliserol maupun sorbitol.
5. Karakterisasi Enzim Sebelum dan Setelah Penambahan Senyawa Aditif a. Penentuan pH Optimum Enzim Protease
Untuk mengetahui pH optimum dari campuran masing-masing enzim dan senyawa aditif (gliserol dan sorbitol) dilakukan pengukuran aktivitas enzim menggunakan metode Kunitz dengan variasi pH yang digunakan yaitu 5, 5,5, 6, 6,5, 7, 7,5, 8, 8,5 dan 9.
7
Untuk mengetahui suhu optimum dari campuran masing-masing enzim dan senyawa aditif (gliserol dan sorbitol) dilakukan pengukuran aktivitas enzim dengan metode Kunitz dengan variasi temperatur yang digunakan adalah 45, 50, 55, 60, 65, 70 dan 75oC.
c. Penentuan Waktu Inkubasi Maksimum
Untuk mengetahui waktu inkubasi optimum dari campuran msing-masing enzim dan senyawa aditif (gliserol dan sorbitol), dilakukan pengukuran aktivitas enzim menggunakan metode Kunitz dengan variasi waktu inkubasi 50, 55, 60, 65, 70, 75 dan 80 menit.
d. Uji stabilitas enzim
Penentuan stabilitas enzim dilakukan dengan mengukur aktivitas sisa enzim setelah diinkubasi selama suhu dan pH tertentu (suhu dan pH optimum). Caranya yaitu dengan mengukur aktivitas enzim setelah proses pemanasan selama waktu tertentu sesuai dengan pengukuran aktivitas enzim. Aktivitas awal enzim (tanpa perlakuan) di beri nilai 100% (Virdianingsihet al.,2002)
Aktivitas sisa =
( ) x 100%
8
Uji aktivitas protease dilakukan pada tiap tahap isolasi, tiap tahap pemurnian dan pada saat karakterisasi enzim hasil isolasi dan pemurnian. Penentuan kadar protein dilakukan pada tiap tahap isolasi dan pada tiap tahap pemurnian.
a. Pengujian Aktivitas Protease Metode Kunitz
Analisis aktivitas dilakukan menurut metode Kunitz menggunakan substrat kasein (Soedigdo, 1998). Pengukuran didasarkan pada jumlah peptida yang terlarut dalam TCA (asam trikloroasetat). Prosedur pengujian adalah sebagai berikut : 1 mL larutan kasein dimasukkan dalam tabung reaksi kemudian ditambah 1 mL larutan enzim. Kemudian diinkubasi pada 35oC selama 30 menit. Setelah 30 menit, tabung reaksi dikeluarkan lalu ditambah 3 mL larutan TCA , larutan diaduk dan didiamkan selama 30 menit pada suhu kamar agar pengendapan sempurna. Endapan yang terbentuk dipisahkan dengan sentrifugasi. Absorbsi filtrat diukur pada panjang gelombang 280 nm. Pada pengujian aktivitas untuk uji stabilitas termal, 1mL kasein dan 1mL larutan enzim diinkubasi pada suhu 50oC selama 60 menit yang merupakan suhu dan waktu inkubasi optimum yang diperoleh pada karakterisasi enzim protease. Kontrol dibuat dengan menambahkan larutan TCA sebelum enzim lalu diinkubasi. Aktivitas enzim dihitung berdasarkan jumlah asam amino (peptida sederhana) yang terbentuk dengan menggunakan kurva standar tirosin. Aktivitas 1 unit tirosin ditetapkan sebagai jumlah enzim yang dibutuhkan untuk menguraikan 1µmol tirosin dari kasein di dalam 1 mL volume reaksi per menit.
9