PERNYATAAN MENGENAI DISERTASI DAN SUMBER INFORMASI
SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa disertasi yang berjudul Inhibisi Tirosinase Daun Nangka (Artocarpus heterophyllus) dalam Menurunkan Produksi Melanin pada Kultur Mouse Melanoma B-16 Cell adalah benar karya saya dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2017
RINGKASAN
RAENDI RAYENDRA, Inhibisi Tirosinase Daun Nangka (Artocarpus heterophyllus) dalam Menurunkan Produksi Melanin pada Kultur Mouse Melanoma B-16 Cell, Dibimbing oleh IETJE WIENTARSIH, BAMBANG PONTJO PRIOSOERYANTO, dan HENDRA GUNAWAN
Tanaman obat adalah sumber kekayaan biologis untuk pembuatan obat pada sistem pengobatan tradisional, pengobatan modern, suplemen makanan, dan bahan kimia pembuatan obat sintetis. Ekstrak tanaman sudah digunakan secara luas sebagai formulasi cosmeceutical untuk mendukung kesehatan tekstur dan integritas kulit, rambut, dan kuku. Banyak kepercayaan dalam masyarakat apabila suatu produk aman di makan maka produk tersebut juga aman untuk digunakan secara topikal.
Berbagai penelitian dilakukan untuk menemukan bahan pemutih kulit baru yang berasal dari alam untuk menghambat biosintesis melanin pada kulit manusia. Pada penelitian ini digunakan daun nangka (Artocarpus heterophyllus) yang secara turun-temurun bagian daun mature telah dipakai sebagai masker untuk pemutih kulit di pulau Sumatra. Tujuan dari penelitian ini adalah untuk menentukan potensi bahan pemutih kulit yang berasal dari daun nangka.
Metode untuk penapisan bahan pemutih kulit dilakukan berdasarkan uji fitokimia, potensi inhibisi tirosinase menggunakan mushroom tyrosinase, dan kultur mouse melanoma B-16 cell untuk mengukur produksi melanin. Hasil uji fitokimia menunjukkan adanya metabolit flavonoid dengan potensi kuat dari ekstrak etanol 96% daun nangka muda. Metode untuk penapisan bahan pemutih adalah berdasarkan uji potensi inhibisi tirosinase menggunakan mushroom tyrosinase. Hasil penelitian menunjukkan ekstrak etanol 96% daun nangka muda mempunyai inhibisi tirosinase paling baik pada monofenolase (29,9 µg/mL-1) dan difenolase (167,3 µg/mL-1) jika dibandingkan dengan ekstrak etanol 96% daun nangka mature (monofenolase 214,2 µg/mL-1 dan difenolase 358,1 µg/mL-1). Fraksi etil asetat daun nangka muda juga menunjukkan potensi inhibisi tirosinase yang baik (monofenolase 81,8 µg/mL-1). Pada IC50 monofenolase ekstrak etanol 96% daun nangka muda tidak terdapat perbedaan bermakna terhadap kontrol positif asam kojik.
Metode penapisan bahan pemutih adalah dengan mengukur penurunan produksi melanin pada kultur mouse melanoma B-16 cell. Hasil uji aktivitas tirosinase pada kultur mouse melanoma B-16 cell saja menunjukkan hasil terbaik penurunan produksi melanin adalah pada ekstrak etanol 96% daun nangka muda dosis 1,5 ppm (81,4%). Pada kultur yang ditambahkan dengan alpha melanocyte stimulating hormone (α-MSH) penurunan produksi melanin terbaik terjadi pada fraksi n-hexan dosis 3 ppm (80,78%) dengan kontrol α-MSH (141,60%).
Sebagai kesimpulan, daun nangka muda merupakan inhibitor tirosinase yang dapat menurunkan produksi melanin, tanpa toksisitas pada kultur mouse melanoma B-16 cell, sehingga mempunyai potensi sebagai bahan pemutih kulit yang baik.
SUMMARY
RAENDI RAYENDRA, Tyrosinase Inhibitor of Jackfruit Leaves (Artocarpus heterophyllus) in Decreasing of Melanin Production on Mouse Melanoma B-16 Cell Cultures, Supervised by IETJE WIENTARSIH, BAMBANG PONTJO PRIOSOERYANTO, and HENDRA GUNAWAN.
Medicinal plants are the richest bio-resource of drugs in traditional system of medicine, modern medicine, food supplements, and chemical entities for synthetic drugs. Botanical extracts that support the health, texture, and integrity of the skin, hair, and nails are widely used in cosmeceutical formulations. Many people believe that if the product can be safely ingested, it will also be safe for topical application.
Numerous researches have been carried out to find new sources of skin lightening agents from nature to inhibit the biosynthesis of melanin in the human skin. In this study, we used jackfruit leaves (Artocarpus heterophyllus) that have been used as a traditional skin lightening mask for generations in Sumatra. The aim of this study was to determine the potential effect of young jackfruit leaves as skin lightening agents.
The methods for screening of skin lightening agent was based on phytochemistry test, tyrosinase inhibitor potency using mushroom tyrosinase, and the mouse melanoma B-16 cell cultures were used to measure the melanin production. The phytochemistry examinations showed that there were potent flavonoid metabolites of young jackfruit leaves in 96% ethanol extract. The methods for screening of lightening agent were based on tyrosinase inhibitor potency test using mushroom tyrosinase. The results revealed that the young jackfruit leaves in 96% ethanol extract were the most potent as tyrosinase inhibitor (monophenolase 29,9 µg/mL-1 and diphenolase 167,3 µg/mL-1) compared to the mature jackfruit leaves in ethanol extract (monophenolase 214,2 µg/mL-1 and diphenolase 358,1 µg/mL-1). Furthermore, young jackfruit leaves in ethyl acetate fraction also showed potent tyrosinase inhibitor in (monophenolase 81,8 µg/mL-1). Their IC50 values for young jackfruit leaves 96% ethanol extract monophenolase were not significantly different with kojic acid as positive control.
The method for screening of lightening agent was based on measurement of decreasing the melanin production on mouse melanoma B-16 cell cultures. The tyrosinase activity test in 96% ethanol extract of young jackfruit leaves on mouse melanoma B-16 cell cultures showed the best decrease in the amount of melanin in the dosage 1.5 ppm (81,4%). In the cell culture which was added alpha melanocyte
stimulating hormone (α-MSH) showed the best decrease on n-hexane fraction in the dosage of 3 ppm (80,78%) with the control α-MSH 141.60%.
In conclusion, young jackfruit leaves are tyrosinase inhibitor that can reduce the melanin production without toxicity on mouse melanoma B-16 cell cultures. Therefore, it have a good potency as skin lightening agent.
© Hak Cipta Milik IPB, Tahun 2017
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
INHIBISI TIROSINASE DAUN NANGKA (Artocarpus heterophyllus) DALAM MENURUNKAN PRODUKSI MELANIN
PADA KULTUR MOUSE MELANOMA B-16 CELL
RAENDI RAYENDRA
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada Program Studi Ilmu Biomedis Hewan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Penguji luar komisi pada:
Ujian Tertutup:
1. Prof Dr Tony S. Djajakusumah, dr, SpKK (K), FINSDV, FAADV 2. Dr drh Wiwin Winarsih, MSi, APVet
Sidang Promosi:
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT yang telah memberikan petunjuk dan karunia-Nya sehingga penulisan disertasi ini dapat diselesaikan. Topik penelitian yang dipilih diharapkan dapat dijadikan alternatif untuk digunakan sebagai bahan obat pemutih kulit yang aman. Pada kesempatan ini Penulis ingin menyampaikan terima kasih dan penghargaan kepada:
1. Prof Dr Dra Ietje Wientarsih, Apt, MSc sebagai ketua komisi pembimbing, Prof drh Bambang Pontjo Priosoeryanto, PhD, AP.Vet dan dr. Hendra Gunawan, SpKK(K), PhD, FINS-DV sebagai anggota komisi pembimbing yang banyak memberikan arahan dan bimbingan sampai penulisan disertasi selesai.
2. Prof Dr Tony S. Djajakusumah SpKK(K) FINSDV, FAADV dan Dr drh Wiwin Winarsih AP.Vet, MSc, sebagai penguji luar komisi dalam ujian tertutup dan terbuka yang banyak memberikan saran dalam penulisan disertasi.
3. Dekan Fakultas Kedokteran Hewan IPB dan Dekan Sekolah Pascasarjana IPB yang telah memberikan fasilitas selama penulis melaksanakan pendidikan. 4. Kepala Pusat Penelitian Biofarmaka IPB dan Kepala Pusat Studi Satwa Primata
yang telah memberikan fasilitas dan membantu dalam penelitian ini.
5. Staf pengajar Bagian Patologi FKH IPB: Prof Dr drh Ekowati Handharyani, MSi, APVet, Dr drh Sri Estuningsih, MSi, APVet, Dr drh Eva Harlina, MSi, APVet, Prof drh Agus Setiyono, MS, PhD, APVet, Dr drh Dewi Ratih, APVet, drh Vetnizah Juniantito, PhD, APVet, drh Mawar Subangkit, MSi, (Alm) drh Hernomoadi Huminto, MS, APVet, terimakasih atas waktu dan bimbingan ilmu yang diberikan pada penulis.
6. Dr drh Diah Iskandriati selaku Kepala UPT Laboratorium PSSP LPPM IPB dan Silmi Mariya SSi, MSi selaku Koordinator Laboratorium Mikrobiologi dan Imunologi yang telah banyak meluangkan waktu untuk membantu penulis dalam menyelesaikan penelitian di Laboratorium Pusat Studi Satwa Primata.
7. Kedua orang tua, Ayahanda H. Indratjaya, SH dan Ibunda Hj. Yamalia, terima kasih atas semua doa yang tiada hentinya dipanjatkan dengan tulus, pengorbanan, jerih payah, dan usaha dalam membesarkan, mendidik, dan mengizinkan penulis untuk berkarir dan melanjutkan studi.
8. Istri tercinta Siti Rahmah Fitria dan putra-putri kami tersayang Sherryl Raeffy Rayendra, Muhammad Raffy Satrya Rayendra, Rainer Muhammad Athar Rayendra, dan Raevand Muhammad Arsha Rayendra atas kasih sayang, pengertian, dan dukungan kalian dalam hari-hari yang penuh keceriaan.
9. Bapak dan Ibu mertua, saudara-saudaraku tercinta, serta seluruh keluarga besar, terima kasih atas dukungan dan doa yang telah dipanjatkan.
10.Dr Lina Noviyanti Sutardi Apt MSi dkk. yang telah banyak membantu persiapan penelitian di Laboratorium Farmasi IPB.
Akhir kata penulis berharap semoga karya ilmiah ini bermanfaat dan dapat berkontribusi dalam pemanfaatan tanaman obat dalam bidang Ilmu Kesehatan Kulit. Semoga Allah SWT selalu melimpahkan berkah-Nya kepada kita semua.
Bogor, Januari 2017
DAFTAR ISI
Melanosit pada Kulit sebagai Elemen Unit Melanin Epidermal 11
Melanin dan Melanogenesis 12
3 METODE
Tempat dan Waktu Penelitian 16
Bahan Tanaman, Reagen, dan Sel yang digunakan 16
Persiapan Ekstraksi dan Fraksinasi 16
Penapisan Fitokimia 16
Uji Bioaktivitas 17
Persiapan Uji pada Kultur Mouse Melanoma B-16 Cell 18 Uji Micro Culture Tetrazolium Technique (MTT) 18 Aktivitas Inhibisi Biosintesis Melanin oleh Isolat dalam Kultur Mouse
Melanoma B-16 Cell 18
Aktivitas Inhibisi Biosintesis Melanin oleh Isolat dalam Kultur Mouse
Melanoma B-16 Cell dengan α-MSH 19
Perhitungan Jumlah Melanin pada Mouse Melanoma B-16 Cell 19
Analisis Data 19
Respons Penurunan Produksi Melanin pada Mouse Melanoma B-16 Cell 25 Respons Penurunan Produksi Melanin pada Mouse Melanoma B-16 Cell
5 SIMPULAN DAN SARAN
Simpulan 29
Saran 29
DAFTAR PUSTAKA 30
LAMPIRAN 36
DAFTAR TABEL
1 Rendemen ekstrak dan fraksi tanaman uji 20
2 Hasil penapisan fitokimia 21
3 IC50 aktivitas monofenolase dan difenolase 22
DAFTAR GAMBAR
1 Melasama tipe centro-fasial, campuran epidermal-dermal 10 2 Peningkatan konsentrasi melanin epidermal-dermal dengan pewarnaan
Fontana Masson 11
3 Sel melanosit mempunyai dendrit 11
4 Skema struktur epidermis dan letak melanosit 12 5 Proses melanogenesis dalam melanosom di epidermis 13 6 Tiga jalur sinyal yang berkaitan dengan regulasi melanogenesis 15 7 Grafik uji toksisitas MTTdari ekstrak etanol 96%, fraksi n-heksan, dan
fraksi etil asetat daun nangka muda 23
8 Grafik uji toksisitas MTT dari fraksi etil asetat daun nangka muda 23 9 Sel melanosit pada uji MTT ekstrak etanol 96% menggunakan inverted
microscope. 24
10 Grafik persentase sel melanin pada kultur mouse melanoma B-16 cell 25
11 Gambaran endapan sel melanoma pada perlakuan ekstrak etanol 96%
daun nangka muda 26
12 Grafik persentase melanin pada kultur mouse melanoma B-16 cell yang
ditambah dengan α-MSH 27
13 Gambaran sel melanoma secara visual pada pelat 6 sumur. 27 14 Perlakuan pada fraksi n-heksan + α-MSH 200 µM pelat 6 sumur 28
DAFTAR LAMPIRAN
1 Hasil identifikasi/determinasi tumbuhan 36
DAFTAR SINGKATAN
AC : Adenylate Cyclase
ACTH : Adrenocorticotropic Hormone
Α-MSH : Alpha Stimulating Hormone ATP : Adenosine Triphosphate
β-FGF : Beta Fibroblast Growth Factor cAMP : Cyclic adenosine monophosphate CO2 : Carbon dioxide
CREB : cAMP Response Element Binding
DOPA : 2-Amino-3-(3,4-dioxocyclohexa-1-5-dien-1-yl)propanoic acid DMEM : Dulbecco’s Modified Eagle Medium
DMSO : Dimethylsulfoxide FBS : Fetal Bovine Serum
GM-CSF : Granulocyte Macrophage- Colony Stimulating Factor GPCR : G-Protein-Coupled Receptor
IBMX : Isobutylmethylxanthine IC : Inhibition Concentration MC1R : Melanocortin 1 Receptor
MITF : Microphtalmia Transcription Factor MTT : Micro Culture Tetrazolium Technique PAR-2 : Protease Activator Protein-2
PBS : Phosphate Buffer Saline PKA : Protein Kinase A POMC : Proopiomelanocortin ppm : Parts per million SCF : Stem Cell Factor TYR : Tyrosinase
TRP1 : Tyrosinase Related Protein 1 TRP2 : Tyrosinase Related Protein 2 UV : Ultraviolet
1.
PENDAHULUAN
Latar Belakang
Indonesia kaya akan sumber bahan obat alam yang telah digunakan oleh sebagian besar masyarakat Indonesia secara turun-temurun. Bahan obat alam dapat dirasakan langsung oleh masyarakat karena kemudahan dalam memperolehnya dan bahan obatnya dapat ditanam di pekarangan sendiri, murah dan dapat diramu sendiri dirumah. Obat herbal didefinisikan sebagai bahan baku atau sediaan yang berasal dari tumbuhan yang memiliki efek terapi yang bermanfaat bagi kesehatan manusia. Komposisi obat herbal dapat berupa bahan mentah atau bahan yang telah mengalami proses lebih lanjut yang berasal dari satu jenis tumbuhan atau lebih (WHO 2005). Sediaan herbal diproduksi melalui proses fisika seperti ekstraksi, fraksinasi, purifikasi, dan pemekatan atau melalui proses biologi (WHO 2001).
Tanaman obat adalah sumber biologis pembuatan obat pada sistem pengobatan tradisional, pengobatan modern, suplemen makanan, dan bahan kimia untuk pembuatan obat sintetis. World Health Organization telah mendorong, merekomendasikan, dan mempromosikan obat tradisional atau herbal dalam program kesehatan nasional karena obat ini mudah didapat dengan harga murah, aman, dan masyarakat telah percaya terhadap penggunaan obat tradisional (Pandey dan Tripathi 2014).
Catatan tentang penggunaan tanaman obat telah ada sejak zaman Cina dan India kuno. Pada zaman tersebut terdapat catatan berupa resep tentang sejumlah tanaman dan asal obat. Pada zaman modern produk natural yang berasal dari alam telah diisolasi untuk menemukan dan mengembangkan obat. Penelitian tentang hasil analisis metabolit sekunder juga telah berkembang dengan pesat sejak 2-3 dekade terakhir. Penggunaan teknik analisis modern seperti kromatografi, elektroforesis, teknik isotop, dan enzimologi telah sukses menemukan struktur formula dan jalur mekanisme biosintesis (Kabera dkk. 2014).
Cosmeceutical adalah sektor yang berkembang pesat pada industri kosmetik. Ekstrak tanaman sudah digunakan secara luas sebagai formulasi cosmeceutical untuk mendukung kesehatan tekstur dan integritas kulit, rambut, dan kuku. Penelitian produk perawatan kulit banyak dilakukan untuk menemukan bahan dari alam dan tumbuhan. Bahan alam dipahami aman karena apabila aman dimakan maka aman juga untuk aplikasi topikal (Alison dan Mary 2009).
Pada penelitian ini digunakan daun nangka (Artocarpus heterophyllus) yang secara turun-temurun bagian daun berwarna hijau tua dipakai sebagai masker untuk pemutih kulit di Pulau Sumatra. Arung dkk. telah melakukan penapisan terhadap kayu nangka dan menemukan sembilan flavonoid dan stilbene, berupa zat aktif artocarpanone dan artocarpin yang menunjukkan aktivitas penghambatan sintesis melanin pada mouse melanoma B-16 cell normal maupun kultur sel yang telah ditambahkan α-MSH dan forskolin sebagai bahan yang menginduksi melanogenesis (Arung dkk. 2006a; 2006b; 2008).
agrikultur, obat tradisional, dan industri. Spesies Artocarpus memiliki sifat farmakologi seperti: antiinflamasi, inhibisi tirosinase, antitumor, antidiabetik, antibakteri, antiviral, antiplatelet, dan aktivitas antioksidan (Ko dkk. 2013).
Flavonoid merupakan polifenol alami yang dapat ditemukan dalam daun, kulit batang dan bunga (Solano dkk. 2006, Picardo dan Carrera 2007, Kim dan Uyama 2005). Senyawa ini merupakan senyawa polar, umumnya cukup larut dalam etanol, metanol, etilasetat, butanol, aseton, dimetilsulfoksida, dimetilformamida, dan air yang dapat digunakan untuk mengekstrak flavonoid dari jaringan tumbuhan (Rijke 2005). Senyawa ini mempunyai kemampuan sebagai bahan hipopigmentasi yang secara langsung menghambat aktivitas tirosinase pada jalur melanogenesis bagian distal (Solano dkk. 2006). Kim dan Uyama (2005) melakukan analisis
struktur flavonoid yang memiliki kelompok α-keto menunjukkan kemampuan inhibisi tirosinase yang sama kuat dengan kelompok dihydroxyphenyl DOPA. Kandungan senyawa fenolik telah banyak diuji sebagai penghambat sintesis melanin dan sebagai pelindung sinar matahari. Ekstrak herbal alami dengan kandungan senyawa aktif seperti fenol, flavonoid, coumarins banyak mendapat perhatian karena diduga sebagai bahan pemutih. (Kim dan Uyama 2005, Seo dkk. 2003).
Bahan pemutih lainnya seperti hidroquinon adalah salah satu inhibitor yang sangat efektif pada proses melanogenesis secara in vitro dan in vivo, meskipun mempunyai efek samping sitotoksik pada melanosit. Efek samping yang ditimbulkan antara lain hipopigmentasi yang dapat menyebabkan vitiligo (O’Donoghue 2006, Manini dkk. 2009). Efek samping lain yang sering terjadi adalah pengelupasan kulit, kemerahan, dan rasa panas. Berdasarkan efek samping yang ditimbulkan maka hidroquinon tidak boleh ditambahkan ke dalam kosmetik yang tujuannya untuk mencegah kulit gelap (Yang dkk. 2011).
Penilaian keamanan adalah hal utama yang harus dipertimbangkan dalam mengembangkan produk obat, makanan sehat, dan kosmetik. Pada industri kosmetik, evaluasi sitotoksisitas in vitro dan iritasi kulit in vivo adalah indeks utama untuk keamanan kulit sebelum obat atau kosmetik diaplikasikan (Yang dkk. 2011, Kim dkk. 2011)
Uji inhibisi tirosinase in vitro telah banyak dilakukan, namun hanya beberapa yang mempunyai efek induksi pada uji klinis. Jarak antara penelitian in vitro dan in vivo diperlukan strategi inovatif untuk validasi manfaat dan keamanannya. Keberhasilan pengobatan memerlukan kombinasi dua bahan atau lebih yang bekerja pada mekanisme berbeda untuk menghasilkan efek sinergis. Parameter yang berkaitan dengan tirosinase inhibitor perlu di uji efektivitasnya dalam menghambat sintesis melanin serta tidak toksik terhadap sel melanosit. Kultur sel merupakan bahan yang baik untuk uji efek hambatan sintesis melanin invitro, termasuk mouse melanoma B-16 Cell (Solano dkk. 2006).
Viabilitas sel dinilai menggunakan uji Micro Culture Tetrazolium Technique (MTT) secara perhitungan kuantitatif jumlah sel hidup melalui penentuan jumlah kristal formazan yang dihasilkan melalui aktivitas metabolik perlakuan dibandingkan kontrol sel. Metode berbasis enzim seperti MTT dapat mengurangi warna reagen dan dehydrogenase pada sel hidup yang ditentukan dengan metode colorometric. Metode ini sangat baik karena mudah digunakan, aman, bisa dihasilkan ulang, dan secara luas`digunakan untuk uji sel hidup dan sitotoksisitas. Uji MTT diketahui sebagai metode yang sangat baik untuk mengetahui aktivitas mitochondrial dehydrogenase pada sel hidup. Senyawa MTT memasuki sel sampai mitokondria menghasilkan kristal formazan berwarna ungu yang tidak larut dalam air, dengan menggunakan larutan organik maka warna ungu formazan akan dilepaskan dan diukur secara spektrofotometri. Berkurangnya MTT hanya terjadi pada tingkatan aktivitas metabolik sel aktif yang dihitung sebagai sel hidup (Berridge dkk. 2005).
Perumusan Masalah
Bagaimanakah potensi daun nangka (Artocarpus heterophyllus) sebagai inhibitor tirosinase dalam menurunkan produksi melanin pada kultur mouse melanoma B-16 cell?
Tujuan Penelitian
Tujuan umum penelitian ini adalah mengkaji potensi daun nangka sebagai bahan alternatif bahan pemutih kulit yang mempunyai aktivitas inhibisi tirosinase. Tujuan khusus penelitian ini adalah
1. Melakukan penapisan fitokimia untuk mengetahui senyawa yang dikandung oleh daun nangka.
2. Mengevaluasi potensi inhibisi tirosinase dari daun nangka muda dan daun nangka mature.
3. Menentukan dosis non toksis ekstrak etanol 96%, fraksi n-heksan, dan fraksi etil asetat terhadap sel melanosit pada kultur mouse melanoma B-16 cell. 4. Menentukan dosis terbaik yang dapat digunakan untuk menurunkan produksi
melanin pada kultur mouse melanoma B-16 cell.
Penelitian ini diharapkan dapat bermanfaat sebagai dasar ilmiah penggunaan daun nangka sebagai alternatif bahan pemutih kulit pada penelitian in vivo.
Kebaruan (Novelty) Penelitian
menurunkan persentase produksi melanin pada kultur mouse melanoma B-16 cell tanpa terjadi efek toksik terhadap sel melanosit
Ruang Lingkup Penelitian
Penelitian ini mencakup beberapa tahap penelitian, yaitu pembuatan simplisia, ekstrak etanol 96%, fraksi n-heksan, dan fraksi etil asetat; penapisan fitokimia; uji potensi inhibisi tirosinase menggunakan mushroom tyrosinase; uji toksisitas MTT dan mengukur persentase penurunan produksi melanin pada kultur mouse melanoma B-16 cell.
Hipotesis
H0: Tidak terdapat pengaruh pemberian berbagai dosis perlakuan daun nangka terhadap penurunan produksi melanin pada kultur mouse melanoma B-16 cell. H1: Terdapat pengaruh pemberian berbagai dosis perlakuan daun nangka terhadap
2.
TINJAUAN PUSTAKA
2.1. Tanaman Nangka dan Kegunaannya
Tanaman obat dapat dikelompokkan menjadi tiga kategori, yaitu jamu, obat herbal terstandar, dan fitofarmaka. Jamu adalah ramuan tradisional yang belum teruji secara klinis hanya dibuktikan berdasarkan data empiris, meskipun sudah banyak digunakan. Obat herbal terstandar adalah tanaman obat yang sudah lulus uji pra klinik, sedangkan fitofarmaka adalah obat herbal yang sudah lulus uji klinis (Nurkhasanah 2006). Hanya sedikit jumlah fitofarmaka yang sudah mengalami pengujian pada manusia atau uji klinis.Sementara standar pengobatan yang berlaku bagi dokter adalah bahwa obat tersebut harus sudah diuji klinis (Winarto 2007, Nurkhasanah 2006) dan dengan dosis serta jangka waktu pemakaian yang jelas (Winarto 2007).
Nangka adalah pohon tanaman buah yang termasuk dalam suku Moraceae yang berasal dari India, Indonesia, Afrika Tengah, Florida, Brazil, Australia, dan Kepulauan Pasifik (Shanmugapriya dkk. 2011). Taksonomi nangka (Artocarpus heterophyllus), kingdom: Plantae, subkingdom: Tracheobionta, divisi: Magnoliophyta, kelas: Magnoliopsida, subkelas: Hamamelidae, ordo: Urticales, famili: Moraceae, genus: Artocarpus, spesies: Artocarpus heterophyllus Lam. Tanaman ini merupakan sumber utama dari morin dihydromorin, cynomacurin, artocarpin, isoartocarpin, cyloartocarpin, artocarpesin, artocarpetin, norartocarpetin, cycloartinone, betulinic acid, artocarpanone, dan heterophylol. Kandungan ini berguna untuk mengobati demam, luka, penyakit kulit, kejang, diuretik, konstipasi, kelainan mata, gigitan ular dan sebagainya. Daun dan buah dapat digunakan untuk makanan ternak babi dan kambing (Prakash dkk. 2009), serta pucuk daun dapat dimasak dan dikonsumsi sebagai sayur.(Craig 2006). Bagian dari tanaman nangka seperti batang, akar, daun dan buah mempunyai kandungan obat. Secara spesifik daun nangka juga mengandung sapogenins, cycloartenone,
cycloartenol, β-sitosterol, dan tanin. Karakteristik daun nangka berwarna hijau muda, hijau tua sampai kecokelatan, mengkilat, berbulu, kasar, kaku, ukurannya dapat mencapai 16 cm, bentuknya lonjong, dan berlobus dalam pada pucuk dan daun muda (Prakash dkk. 2009).
hambatan pertumbuhan bakteri pada konsentrasi 10.000 ppm. Senyawa flavonoid yang diduga berperan pada aktivitas antibakteri ini adalah golongan dihidroflavonolol dan flavon.
2.2. Bahan Pemutih
Pemutih kulit di negara barat digunakan untuk mencegah dan mengobati hiperpigmentasi irregular, seperti melasma, freckles, atau bercak penuaan. Pada orang Asia, untuk memutihkan kulit secara luas banyak menggunakan obat herbal tradisional (Solano dkk. 2006). Saat ini banyak diketahui zat yang dapat mengurangi tingkat pigmentasi pada kulit. Kebanyakan mempunyai efek aktivitas sebagai inhibisi tirosinase yang berguna untuk mengurangi produksi melanin. Beberapa bahan inhibisi tirosinase yang digunakan saat ini adalah asam kojik, arbutin dan berbagai ekstrak tanaman herbal (Gilbro dan Olsson 2011).
Banyak bahan pemutih kulit bersumber dari tumbuhan di alam yang sudah digunakan dalam produk kosmetik. Hidroquinon diisolasi dari Cystoseria jabokae dan Crystoseria adriatica yang efektif digunakan sebagai bahan depigmentasi untuk pigmentasi berlebih pada kulit, Arbutin merupakan glikosilasi hidroquinon, asam kojik hasil dari metabolik jamur, serta asam azaleat diisolasi dari pitirosporum ovale. Produk ini dikembangkan pada sekitar tahun 1990. Penelitian terhadap bahan pemutih untuk hiperpigmentasi telah dilakukan secara luas, namun terdapat keterbatasan dalam hal sifat yang sangat iritatif, tingginya toksisitas, stabilitas yang rendah, penetrasi kulit yang buruk, dan aktivitas kurang memadai. Hal ini menyebabkan permintaan yang besar untuk bahan pemutih baru (Choi dan Young-Chul 2011).
Hidrokuinon masih dianggap sebagai baku emas untuk pengobatan topikal tradisional dalam mengobati hiperpigmentasi (Zhu dan Gao 2008). Cara kerjanya adalah menghambat perubahan dopa menjadi melanin melalui aktivitas enzim tirosinase. Hidrokuinon secara luas digunakan sebagai bahan pemutih yang efektif namun harus mendapat perhatian keamanan karena sering terjadi iritasi kulit, dermatitis kontak alergi dan iritan, dan peningkatan insidens okronosis, (Nico dkk. 2009, Lynde dkk. 2006). Penelitian efek toksisitas menunjukkan hidrokuinon mampu menyebabkan renal adenoma dan fetotoksik pada hewan, namun komplikasi ini belum pernah dilaporkan terjadi pada manusia (Lynde dkk. 2006).
Asam askorbat sering digunakan sebagai antioksidan karena kapasitasnya menekan proses o-dopaquinone menjadi dopa sehingga menghambat pembentukan melanin. Kandungan ester askorbat seperti magnesium ascorbyl-2-phosphate harus disintesis untuk meningkatkan stabilitas, penyerapan kulit, dan efek hipopigmentasi (Kameyama dkk. 1996). Aplikasi krim harian yang mengandung derivat asam askorbat 10%, mempunyai efek sebagai pemutih pada pasen melasma. Iontoforesis asam askorbat menunjukkan strategi depigmentasi yang efektif pada penelitian randomized, double blind, placebo control trial (Huh dkk. 2003).
Pemutihan warna kulit dapat dicapai melalui penghambatan dengan langkah berbeda dalam jalur melanogenesis. Keterkaitan bahan pemutih dengan mekanisme berbeda merupakan strategi yang sangat berguna untuk meningkatkan efikasi klinis, mengurangi lamanya pengobatan, dan menurunkan risiko efek samping. Salah satu contoh kombinasi formulasi yang paling sering digunakan adalah formulasi
Kligman’s (Menter 2004).
2.3. Simplisia dan Ekstrak Tanaman
Simplisia adalah bahan alamiah berupa tanaman utuh, bagian tanaman atau eksudat tanaman yang digunakan sebagai obat dan belum mengalami pengolahan atau mengalami pengolahan secara sederhana serta belum merupakan zat murni kecuali dinyatakan lain, berupa bahan yang telah dikerimgkan. Teknologi pembuatan obat tradisional mengalami banyak perubahan sejalan dengan meningkatnya permintaan pembuktian khasiat dan keamanan secara ilmiah. Hal ini diharapkan dapat lebh meningkatkan kepercayaan terhadap manfaat obat bahan alam tersebut. Obat tradisional saat ini banyak digunakan dalam bentuk ekstrak, karena tanaman obat tidak praktis jika digunakan dalam bentuk simplisia (Badan POM RI 2010).
Metode ekstraksi secara pharmaceutical adalah memisahkan bagian aktif obat dari jaringan tanaman dari komponen inaktif dengan menggunakan pelarut selektif. Selama ekstraksi pelarut menyatu ke dalam material tanaman padat dan melarutkan kandungan aktif dengan polaritas yang sama (Pandey dan Tripathi 2014). Metode ekstraksi dipilih berdasarkan beberapa faktor seperti sifat dari bahan mentah obat, daya penyesuaian dengan tiap macam metode ekstraksi dan kepentingan dalam memperoleh ekstrak yang sempurna atau mendekati sempurna. Adanya gula yang terikat pada flavonoid cenderung menyebabkan flavonoid lebih mudah larut dalam air, dengan demikian campuran pelarut seperti etanol, etil asetat, metanol, butanol, dimetilsulfoksida, dan air merupakan pelarut yang lebih baik untuk glikosida. Senyawa ini mengandung sistem aromatik yang terkonjugasi sehingga menunjukkan pita serapan kuat pada daerah spektrum sinar ultraviolet dan spektrum sinar tampak (Harborne 1996).
(proses difusi). Peristiwa tersebut berulang sampai terjadi keseimbangan konsentrasi antara larutan di luar sel dan di dalam sel (Tiwari dkk. 2011).
Pelarut adalah zat yang digunakan sebagai media untuk melarutkan zat lain. Kesuksesan penentuan senyawa biologis aktif dari bahan tumbuhan sangat bergantung pada jenis pelarut yang digunakan dalam prosedur ekstraksi. Sifat pelarut yang baik untuk ekstraksi yaitu toksisitas dari pelarut yang rendah, mudah menguap pada suhu yang rendah, dapat mengekstraksi komponen senyawa dengan cepat, dapat mengawetkan dan tidak menyebabkan ekstrak terdisosiasi Pemilihan pelarut juga akan tergantung dari senyawa yang ditargetkan. Faktor-faktor yang mempengaruhi pemilihan pelarut adalah jumlah senyawa yang akan di ekstraksi, laju ekstraksi, keragaman senyawa yang akan di ekstraksi, kemudahan dalam penanganan ekstrak untuk perlakuan berikutnya, toksisitas pelarut, serta potensial bahaya kesehatan dari pelarut.(Tiwari dkk. 2011).
Akumulasi fitokimia berbeda pada setiap bagian tanaman seperti pada akar, batang, daun, bunga, buah, dan biji. Senyawa fitokimia terutama molekul pigmen biasanya terkonsentrasi pada lapisan luar dari berbagai jaringan tumbuhan. Kadar fitokimia setiap tanaman berbeda-beda tergantung dari varietas, proses, pematangan, dan kondisi pertumbuhan (Saxena dkk. 2013). Tujuan tumbuhan memproduksi bahan kimia ini adalah untuk melindungi diri sendiri, namun peneltian saat ini menunjukkan banyak senyawa fitokimia dapat melindungi manusia dari berbagai macam penyakit (Narasinga 2003). Fitokimia bukan metabolit primer atau nutrisi utama seperti asam nukleat, asam amino, karbohidrat, atau lemak yang dibutuhkan oleh tubuh manusia untuk menopang hidup, tetapi mempunyai kepentingan untuk mencegah atau melawan beberapa penyakit yang sering terjadi di masyarakat. Sumber pengetahuan menyebutkan bahwa metabolit sekunder bukan merupakan hal utama yang diperlukan untuk tumbuh kembang dan reproduksi, tetapi kegunaannya dapat melindungi tumbuhan dari pengaruh buruk lingkungan sekitarnya. Hal ini menyebabkan banyak penelitian dilakukan untuk menemukan keuntungan efek kesehatan dari senyawa fitokimia. Survei literatur mengindikasikan bahwa fenolik merupakan jumlah dan struktur terbanyak pada unsur tanaman (Saxena dkk. 2013). Tiga kelompok utama paling penting dari kelompok fenolik adalah flavonoid, asam fenolik, dan polifenol (Walton dkk. 2003).
Flavonoid merupakan polifenol alami yang berasal dari tumbuhan dan dapat ditemukan pada daun, kulit batang, dan bunga. Kandungan polifenol ini diketahui mempunyai efek antiinflamasi, anti virus, antioksidan, dan antikarsinogenik (Solano dkk. 2006, Picardo dkk. 2007, Kim dan Uyama 2005). Senyawa ini juga mempunyai kemampuan sebagai bahan hipopigmentasi yang secara langsung menghambat aktivitas enzim tirosinase bagian distal pada jalur melanogenesis (Solano dkk. 2006). Flavonoid termasuk dalam golongan senyawa fenolik dengan struktur kimia C6-C3-C6 (Maslarova dan Yanishlieva 2001), mempunyai sejumlah gugus hidroksil, atau suatu gula. Flavonoid merupakan senyawa polar yang larut dalam pelarut polar seperti etanol, metanol, butanol, aseton, dimetilsulfoksida, dimetilformamida, air, etil asetat atau campuran dari pelarut tersebut dapat digunakan untuk mengekstrak flavonoid dari jaringan tumbuhan (Rijke 2005). Pengambilan bahan aktif dari suatu tanaman, dapat dilakukan dengan ekstraksi. Dalam proses ekstraksi ini, bahan aktif akan terlarut oleh zat penyari yang sesuai sifat kepolarannya.
Bagian dari derivat hidroxystilbene adalah resveratrol dan isomer lainnya, seperti oxyresveratrol, gnetol, dan methoxylated atau derivat glucosylated (piceid-glucoside, rhapontigenin, dan rhaponticin). Fungsi oxyresveratrol dan gnetol sebagai inhibisi tirosinase lebih efisien dibandingkan dengan resveratrol (Ohguchi dkk. 2003a). Kelompok hydroxyl penting sebagai penghambat, tetapi struktur trans-olefin dari kerangka stilbene seperti trans-resveratrol lebih kuat dibandingkan dengan isomer cis (Ohguchi dkk. 2003b). Penelitian Lin dkk. (2002), mengindikasikan bahwa resveratrol juga dapat menekan MITF dan aktivasi promoter tirosinase pada kultur mouse melanoma B-16 cell. Data di atas tidak sesuai dengan penelitian Kim dkk. (2002) yang melaporkan bahwa resveratrol hanya menghambat aktivitas tirosinase tanpa menurunkan jumlah enzim tirosinase. Efek MITF yang dilaporkan dalam penelitian Lin dkk. (2002) tetap dapat dianggap memperkuat data bahwa resveratrol menghambat secara langsung sintesis melanin.
2.4. Melasma
Pajanan kronis radiasi sinar ultraviolet pada kulit mamalia menginduksi sejumlah respons biologis, termasuk eritema, edema, sunburn, hiperpigmentasi, photoaging dan pembentukan kanker kulit. Jumlah total melanosit pada kulit manusia menurun seiring bertambahnya usia dan kulit menua biasanya menunjukkan pigmentasi ireguler yang sering kali berhubungan dengan hiperpigmentasi. Solar lentigo dianggap sebagai penanda kulit menua dan menjadi dasar bahwa heterogenitas warna kulit pada area pajanan UV distribusi sel pigmennya tidak sama, sehingga hal ini dijadikan kemajuan pengembangan kosmetik dan obat pemutih (Gilbro dan Olsson 2011).
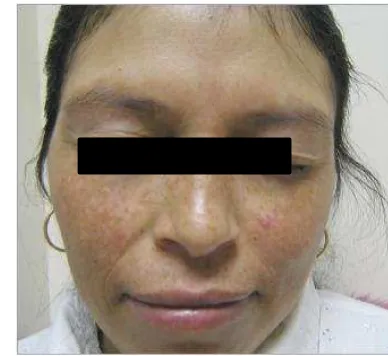
Melasma adalah suatu kelainan pigmentasi dapatan yang terutama terjadi pada wanita (lebih dari 90% kasus) pada semua ras terutama pada tipe kulit III-V. Kelainan ini sangat sering terjadi pada wanita usia reproduktif namun jarang terjadi pada wanita sebelum pubertas. Gambaran kelainan kulit berupa bercak kecoklatan, batas ireguler, simetris pada wajah, dan sering menyatu dalam bentuk retikuler. Terdapat tiga bentuk melasma, yaitu: centrofacial (dahi, hidung, dagu dan di atas bibir 63%), Malar (dagu dan pipi 21%), dan mandibular (ramus mandibular/pipi bawah 16%). Dada atas dan punggung lengan bisa terkena pula. Gambaran klinis dibagi menjadi: epidermal, dermal dan campuran (Fitzpatrick dan Ortonne 2003).
Penyebab melasma belum sepenuhnya diketahui namun faktor predisposisi genetik, pajanan sinar ultraviolet dan pajanan hormon estrogen diduga mempengaruhi terjadinya melasma. Estrogen menyebabkan kejadian melasma sering terjadi pada masa kehamilan, penggunaan kontrasepsi oral dan hormone replacement therapy pada wanita pascamenopause (Lynde dkk. 2006). Berikut ini adalah penjelasan beberapa mekanisme terjadinya melasma:
Sinar Ultraviolet
Pajanan sinar UV merupakan faktor pencetus utama dan dapat memperberat melasma yang telah timbul (Kang dan Ortonne 2010). Sinar UV akan meningkatkan aktivitas tirosinase, elongasi dan percabangan dendrit melanosit, serta bertambahnya jumlah dan ukuran melanosom. Terjadi induksi dan pembentukan sitokin-sitokin yang berhubungan dengan melanogenesis seperti interleukin-1 (IL-1), endotelin-1,
α-MSH, endotelin-1, dan β-fibroblast growth factor (β-FGF) (Yamaguchi dkk. 2007). Meningkatnya sintesis α-MSH dan ACTH akan menyebabkan proliferasi melanosit, serta peningkatan sintesis melanin melalui aktivitas tirosinase dan tyrosinase related protein-1 (TRP-1) (Kang dan Ortonne 2009). Ekspresi endotelin-1 akan meningkatkan ekspresi melanocortin 1 receptor (MC1R), sehingga aktivitas tirosinase dan produksi melanin meningkat (Yamaguchi dkk. 2007, Bolognia dan Orlow 2012). Peningkatan β-FGF akan menyebabkan peningkatan produksi pigmen di dalam melanosit (Bolognia dan Orlow 2012). Inflamasi pada dermis akibat paparan sinar UV diduga berhubungan dengan aktivasi fibroblas sehingga terjadi up regulation stem cell factor (SCF) pada dermis yang menyebabkan meningkatnya melanogenesis (Kang dan Ortonne 2010). Sinar UV juga akan menginduksi aktivitas serta ekspresi protease activator protein-2 (PAR-2), yaitu suatu protein transmembran pada keratinosit yang berfungsi dalam peningkatan aktivitas fagositosis keratinosit terhadap melanosom (Park dan Yaar 2012).
Hormon
Melasma ditemui pada 10%-15% wanita hamil, serta 10-25% wanita yang menggunakan pil kontrasepsi (Kang dan Ortonne 2009). Mekanisme kerja hormon dalam mencetuskan melasma belum diketahui secara pasti (Sheth dan Pandya 2011). Melalui kultur sel, diketahui melanosit manusia mengekspresikan reseptor estrogen, yang ekspresinya meningkat pada kulit dengan lesi melasma (Kang dan Ortonne 2009). Estrogen diketahui dapat menstimulasi melanogenesis pada melanosit yang dikultur dengan meningkatkan aktivitas tirosinase (Anstey 2010). Estradiol akan meningkatkan kadar enzim melanogenik, terutama TRP-2 pada melanosit manusia (Kang dan Ortonne 2009).
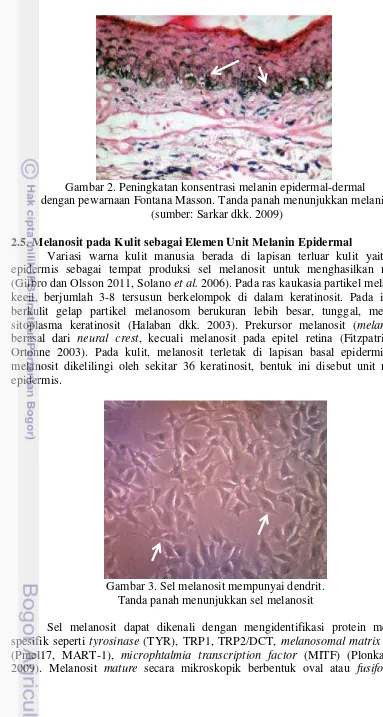
Gambar 2. Peningkatan konsentrasi melanin epidermal-dermal dengan pewarnaan Fontana Masson. Tanda panah menunjukkan melanin
(sumber: Sarkar dkk. 2009)
2.5. Melanosit pada Kulit sebagai Elemen Unit Melanin Epidermal
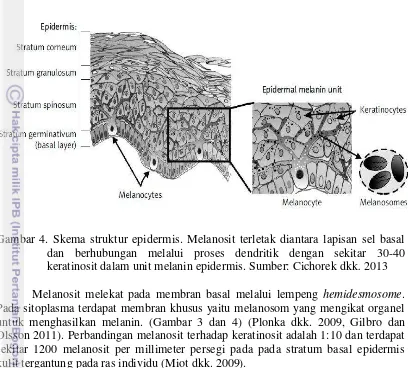
Variasi warna kulit manusia berada di lapisan terluar kulit yaitu pada epidermis sebagai tempat produksi sel melanosit untuk menghasilkan melanin (Gilbro dan Olsson 2011, Solano et al. 2006). Pada ras kaukasia partikel melanosom kecil, berjumlah 3-8 tersusun berkelompok di dalam keratinosit. Pada individu berkulit gelap partikel melanosom berukuran lebih besar, tunggal, memenuhi sitoplasma keratinosit (Halaban dkk. 2003). Prekursor melanosit (melanoblast) berasal dari neural crest, kecuali melanosit pada epitel retina (Fitzpatrick dan Ortonne 2003). Pada kulit, melanosit terletak di lapisan basal epidermis. Satu melanosit dikelilingi oleh sekitar 36 keratinosit, bentuk ini disebut unit melanin epidermis.
Gambar 3. Sel melanosit mempunyai dendrit. Tanda panah menunjukkan sel melanosit
dendrit yang terletak di antara keratinosit pada sel basal dan diantara sel matriks rambut. Sel tersebut lebih kecil dibanding keratinosit, tidak mempunyai desmosom dan tonofibril tetapi mempunyai dendrit, serta sitoplasma sel ini lebih bening (Gambar 3).
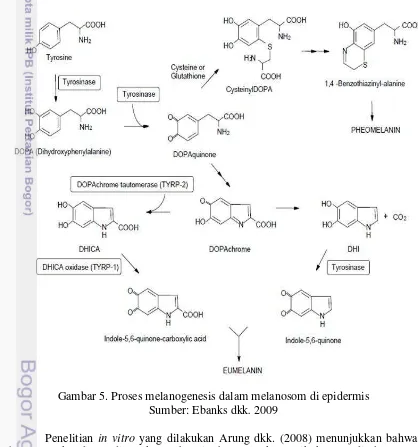
Gambar 4. Skema struktur epidermis. Melanosit terletak diantara lapisan sel basal dan berhubungan melalui proses dendritik dengan sekitar 30-40 keratinosit dalam unit melanin epidermis. Sumber: Cichorek dkk. 2013
Melanosit melekat pada membran basal melalui lempeng hemidesmosome. Pada sitoplasma terdapat membran khusus yaitu melanosom yang mengikat organel untuk menghasilkan melanin. (Gambar 3 dan 4) (Plonka dkk. 2009, Gilbro dan Olsson 2011). Perbandingan melanosit terhadap keratinosit adalah 1:10 dan terdapat sekitar 1200 melanosit per millimeter persegi pada pada stratum basal epidermis kulit tergantung pada ras individu (Miot dkk. 2009).
2.6. Melanin dan Melanogenesis
bergabung dengan cysteine dan gluthatione. DOPA quinone bergabung dengan cystein (dengan penambahan gugus sulfhidril) membentuk cysteiny DOPA. DOPA quinone berikatan dengan gluthatione untuk membentuk gluthatione-dopa yang tidak berwarna (Nico dkk. 2009) atau merah kekuningan seperti sulfur (Chang 2012). Residu histidin berada di bagian dalam (katalitik) tirosinase dan membatasi ion cooper yang dibutuhkan untuk aktifitas tirosinase. Proses Melanogenesis terjadi di dalam melanosom (Chang 2012). Beberapa enzim lain seperti TRP-1 dan dopachrome tautomerase (TRP-2) juga memainkan peranan penting dalam proses melanogenesis in vivo (Nico dkk. 2009).
Katalisis oleh enzim tirosinase merupakan tahap pertama produksi melanin yakni saat terjadi hidroksilasi dari L-tyrosinase menjadi L-dihydroxyphenilalanine (L-DOPA) dan mempercepat oksidasi o-diphenol yang berhubungan dengan quinone menjadi L-dopaquinon. Meskipun L-tyrosin dibentuk oleh melanin, tetapi hanya bisa dikirim terhadap melanosom melalui difusi (Gilbro dan Olsson 2011). Proses melanogenesis dalam melanosom di epidermis dapat dilihat pada Gambar 5.
Gambar 5. Proses melanogenesis dalam melanosom di epidermis Sumber: Ebanks dkk. 2009
mengandung artocarpin. Dalam penelitian tersebut artocarpin menunjukkan aktivitas penghambatan biosintesis melanin pada sel melanoma B16 normal serta menekan melanin dalam aktivasi sel melanoma B16 oleh α-MSH dan forskolin sebagai bahan yang menginduksi melanogenesis. Tengamnuay dkk. (2006) mengatakan bahwa ekstrak kayu Artocarpus lakocha Roxb dengan zat aktif oxyresveratrol, pada penelitian in vitro mendapatkan aktivitas tyrosinase inhibitor dan pada penelitian in vivo didapatkan efikasi penurunan jumlah melanin.
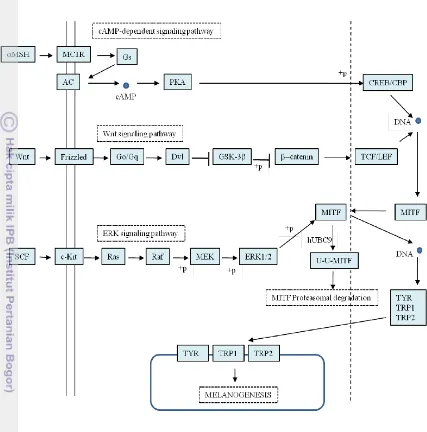
Melanogenesis dapat distimulasi oleh radiasi ultraviolet dan �-MSH. Proses ini meningkatkan ekspresi tirosinase dan jumlah melanin melalui ikatan terhadap melanocortin 1 receptor (MC1R). Aktivasi MC1R dan kandungan kimiawi forskolin dan isobutylmethylxanthine (IBMX) juga dapat menstimulasi melanogenesis melalui aktivasi cAMP pada jalur melanosit spesifik, dan cAMP akan meningkatkan enzim yang mengatur sinyal melanogenik melalui protein kinase A (PKA), yang menginduksi ekspresi microphthalmia-associated transcription factor (MITF) (Bertolotto dkk. 1998, Le dkk. 2008).
Melanogenesis diregulasi pada tingkat subseluler oleh gene expression encoded melalui melanogenesis-related enzymes antara lain tyrosinase, TRP1 dan TRP2 yang regulasinya melalui jalur intraseluler. Jalur sinyal ini diawali oleh beragam hormon, interleukin, interferon, growth factor serta prostaglandin dan yang menentukan bukan hanya jumlah tetapi juga kualitas sintesis melanin. Hormon berperan sebagai sinyal kompleks yang memberikan respon terhadap paparan UV atau stimulasi lingkungan lainnya. Terdapat tiga jalur sinyal yang paling sering berperan pada regulasi melanogenesis. Seluruh jalur sinyal melibatkan MITF yang merupakan faktor transkripsi dengan struktural domain basic helix-loop-helix leucine zipper. MITF merupakan regulator utama melanogenesis dalam melanosit melalui penempelan pada M box daerah promoter dan regulasi ekspresi gen tirosinase, TRP-1 serta TRP-2. Up-regulation aktivitas MITF mengaktivasi ekspresi melanogenesis-related enzymes yang menstimulasi melanogenesis. Sebaliknya down-regulation aktivitas MITF akan menekan ekspresi enzim sehingga menghambat melanogenesis (Chang 2012).
Alpha melanocyte-stimulating hormone adalah peptida yang berasal dari proopiomelanocortin (POMC), meregulasi melanogenesis melalui jalur cyclic adenosine monophosphate (c-AMP)-dependent. Saat melekat pada reseptornya yaitu melanocortin receptor 1 (MC1R) di membran melanosit, hormon akan mengaktivasi adenylate cyclase (AC) untuk membentuk cAMP sebagai pesan intraseluler kedua melalui aktivasi tipe G-protein-coupled receptor (GPCR). cAMP mengaktivasi protein kinase A (PKA), yang kemudian mengaktivasi ekspresi gen MITF melalui fosforilasi Camp response element-binding protein (CREB). MITF secara efisien mengaktivasi melanogenesis-related enzymes dan menstimulasi melanogenesis. Saat
α-MSH melekat pada MC1R, terjadi peningkatan melanogenesis 100 kali. Serupa
dengan α-MSH bahwa peptida yang berasal dari POMC lainnya seperti β-MSH dan adrenocorticotropic hormone (ACTH) juga menstimulasi melanogenesis melalui jalur yang sama (Chang 2012). Bertolotto dkk. (1996) melaporkan bahwa aktivitas
2007). Adapun tiga jalur sinyal tersering yang berkaitan dengan regulasi melanogenesis, dapat dilihat lebih jelas pada Gambar 6.
3.
METODE
3.1. Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan dalam beberapa tahap. Tahap pertama adalah pembuatan ekstraksi dan fraksinasi serta penapisan fitokimia yang dilakukan di Laboratorium Farmasi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor pada bulan Februari 2015 sampai bulan April 2015. Tahap kedua adalah uji bioaktivitas inhibisi tirosinase dengan menggunakan enzim mushroom tyrosinase yang dilakukan di Pusat Penelitian Biofarmaka IPB bulan Juni 2015 sampai bulan Agustus 2015. Tahap ketiga yaitu persiapan kultur mouse melanoma B-16 cell, uji toksisitas menggunakan metode MTT, dan penilaian persentase penurunan produksi melanin pada kultur mouse melanoma B-16 cell dilaksanakan di Laboratorium Pusat Studi Satwa Primata Institut Pertanian Bogor dari bulan Juni 2016 sampai bulan Oktober 2016.
3.2. Bahan Tanaman, Reagen, dan Sel yang digunakan
Bahan baku yang digunakan adalah daun nangka yang diambil dari kebun di Kota Bogor Jawa Barat, kemudian dideterminasi di Herbarium Bogoriensis. Daun nangka berasal dari spesies Artocarpus heterophyllus Lam dengan suku Moraceae. Daun nangka dibagi dalam dua kelompok yaitu daun nangka muda yaitu kelompok daun berwarna hijau muda (daun ke-4 sampai daun ke-6 setelah pucuk) dan daun nangka mature yaitu daun yang berwarna hijau tua (daun ke-7 sampai daun belum berwarna cokelat).
Bahan dan reagen untuk kultur Sel: mouse melanoma B-16 cell line (ATCC/USA), Dulbecco’s Modified Eagle Medium (D-MEM, Gibco/USA), Fetal Bovine Serum 10% (FBS, Hyclone/USA), penisilin-streptomisin 1% (Invitrogen/USA), phosphate buffer saline (PBS, Gibco/USA), trypsin 0,25% (Gibco/USA), dimethylsulfoxide (DMSO, Sigma/USA), 3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazolium bromide (MTT, Sigma/USA), asam kojik (Sigma/USA), vitamin C (Ethica®).
3.3. Persiapan Ekstraksi dan Fraksinasi
Ekstraksi simplisia daun nangka muda dan daun nangka mature dengan menggunakan metode maserasi sederhana selama 3x24 jam. Seluruh daun yang telah dikeringkan kemudian dibuat menjadi serbuk kasar masing-masing sebanyak 900 gr dan diekstraksi menggunakan pelarut etanol 96%. Perbandingan sampel dan pelarut yang digunakan adalah 1:10. Ekstrak yang diperoleh dipekatkan dengan rotary evaporator pada suhu 40°C dan 50 rpm sampai diperoleh ekstrak kental daun nangka muda dan daun nangka mature.
Ekstrak etanol 96% dipartisi dengan n-heksan, lapisan n-heksan dipekatkan. Lapisan air kemudian dipartisi dengan etil asetat. Lapisan etil asetat dan lapisan air yang diperoleh dipekatkan, sehingga diperoleh fraksi n-heksan, fraksi etil asetat dan fraksi air.
3.4. Penapisan Fitokimia
metode Reji dan Rexin (2013). Penapisan fitokimia akan dilakukan pada ekstrak etanol 96% daun nangka muda dan mature, fraksi n-heksan daun nangka muda, serta fraksi etil asetat daun nangka muda. Bahan penelitian disaring menggunakan kertas saring Whattman no. 42 (125mm).
Alkaloid
Serbuk simplisia dan ekstrak tanaman (0,5 g) ditambahkan 5 ml larutan 1% HCl, kemudian disaring. Filtrat dibagi menjadi dua bagian. Bagian pertama ditambahkan dengan beberapa tetes pereaksi Draggendorf (pelarut potassium bismuth iodide), sehingga menghasilkan endapan merah dan bagian kedua ditambahkan pereaksi Wagner (pelarut iodine dalam potassium iodide) yang akan menghasilkan endapan cokelat/kemerahan. Pembentukan endapan menunjukkan adanya alkaloid pada sampel (Pandey dan Tripathi 2014).
Flavonoid
Sebanyak 0,5 g ekstrak dilarutkan dalam 2 ml larutan NaOH. Larutan kemudian ditambah H2SO4 pekat, terbentuknya larutan berwarna kuning menunjukkan adanya senyawa flavonoid pada sampel.
Tanin
Sebanyak 0,5 g ekstrak dilarutkan dalam 10 ml air. Larutan disaring dan pada filtrat ditambahkan sedikit larutan besi klorida 5%. Adanya warna hijau menunjukkan bahwa pada sampel terdapat senyawa tanin.
Antraquinone
Sebanyak 5 g ekstrak dilarutkan dalam 2 ml kloroform, kemudian dikocok dan disaring. Filtrat kemudian dikocok dengan larutan amonia 100% dengan volume yang sama. Warna merah yang terbentuk pada lapisan amonia (lapisan bawah) menunjukkan adanya senyawa antrakuinon bebas dalam sampel.
Steroid
Sebanyak 5 g sampel dilarutkan dalam 2 ml kloroform. Sulfuric acid ditambahkan secara perlahan sehingga terbentuk lapisan pada larutan. Adanya cincin warna biru diantara lapisan menunjukkan adanya senyawa steroid pada sampel.
Terpenoid
Sebanyak 5 ml ekstrak dicampurkan ke dalam 2 ml kloroform dan 3 ml H2SO4 pekat. Adanya warna coklat kemerahan menunjukkan bahwa pada sampel mengandung senyawa terpenoid.
3.5. Uji Bioaktivitas
Bahan dan asam kojik (sigma, USA) sebagai kontrol positif dilakukan uji pada rentang konsentrasi 7,8125 hingga 2.000 µg mL-1. Pada 96-sumur pelat, setiap 70 µL sediaan larutan ditambahkan dengan 30 µL enzim tirosinase (sigma, 333 Units mL-1 dalam phosphate buffer) dalam triplicate, kemudian dilakukan inkubasi pada suhu ruangan selama lima menit. Selanjutnya ditambahakan 110 µL substrat (2 mM L-tyrosine atau 2 mM L-DOPA) ke dalam setiap sumur, dan diinkubasi kembali selama 30 menit pada temperatur ruangan. Densitas optikal sumur diukur pada panjang gelombang 492 nm dengan multi-well plate reader. Konsentrasi ekstrak etanol 96% daun nangka muda, mature serta fraksi n-heksan dan fraksi etil asetat daun nangka muda pada inhibition concentration (IC50) ditentukan untuk setiap bahan uji.
3.6. Persiapan Uji pada Kultur Mouse Melanoma B-16 Cell
Penelitian kultur mouse melanoma B-16 cell dilakukan di Laboratorium Pusat Studi Satwa Primata IPB. Pada sel yang telah tumbuh konfluen harus dilakukan subkultur. Media sel dibuang kemudian ditambahkan PBS sebanyak 10 mL untuk membersihkan botol kultur dari sisa media, lalu PBS dibuang. Trypsin (0.25%) ditambahkan ke dalam botol kultur sebanyak 5 mL, dan selanjutnya diinkubasi pada suhu 37oC selama 5 menit. Sel yang telah lepas dari substratnya dimasukkan ke dalam tabung 15 mL kemudian disentrifus 500g selama 5 menit dan supernatannya dibuang. Perhitungan sel menggunakan hemositometer kemudian disiapkan sel sesuai dengan kepentingan untuk uji. Sel diinkubasi kembali di dalam inkubator CO2 dengan konsentrasi 5%.
3.7. Uji Micro Culture Tetrazolium Technique (MTT)
Sel lestari yang telah ditumbuhkan pada botol kultur T25 disubkultur. Kultur dimulai dalam pelat 96 sumur kultur jaringan dengan 5000 sel/sumur. Inkubasi pelat dilakukan di kelembaban atmosfer 5% CO2 pada suhu 370C selama 24 jam. Senyawa bioaktif pada masing-masing konsentrasi ditambahkan sebanyak 100µL/sumur, sel tanpa perlakuan disertakan sebagai kontrol. Sel selanjutnya diinkubasi kembali selama 48 jam. Senyawa MTT ditambahkan dan diinkubasi selama empat jam pada suhu 37oC dan CO2 5%. Supernatan sel dibuang, kristal formazan yang terbentuk dilarutkan dengan etanol 70%. Pembacaan densitas optik (OD) dilakukan menggunakan microplate reader pada panjang gelombang 565 nm. Dosis perlakuan yang digunakan pada uji MTT dimulai dari dosis 800 ppm yang diturunkan hingga dosis 6,25 ppm.
3.8. Aktivitas Inhibisi Biosintesis Melanin oleh Isolat dalam Kultur Mouse Melanoma B-16 Cell
3.9. Aktivitas Inhibisi Biosintesis Melanin oleh Isolat dalam Kultur Mouse Melanoma B-16 Cell dengan α-MSH
Kultur konfluen melanoma B-16 cell dibilas dalam phosphate-buffered saline (PBS) dan dilepaskan dari plastik menggunakan trypsin 0.25%. Sel diletakkan dalam pelat enam sumur pada densitas 1×105 sel/sumur dan diinkubasi selama 24 jam. Setelah 24 jam media diganti dengan 900 μl media baru, kemudian ditambahkan 2 μl
DMSO sebagai kontrol, α-MSH 200 μM serta sampel uji dengan konsentrasi 3, 1,5, dan 0,75 ppm. Sel diinkubasi kembali selama 48 jam, dan media diganti dengan media baru yang mengandung masing-masing sampel. Setelah 24 jam, pada sel yang masih melekat dilakukan uji.
3.10. Perhitungan Jumlah Melanin pada Mouse Melanoma B-16 Cell
Kandungan melanin pada sel setelah perlakuan dilakukan dengan cara membuang dan membersihkan sel menggunakan PBS, endapan sel dilarutkan dalam 1 ml lautan 1N NaOH. Ekstrak etanol 96%, fraksi n-heksan, dan fraksi etil asetat daun nangka muda di uji menggunakan micro plate reader (Bio-Rad, Japan) pada panjang gelombang 450 nm untuk menentukan kandungan melanin. Hasil dari sel
yang ditambahkan α-MSH ataupun tidak, di analisis sebagai persentase hasil penurunan produksi melanin yang dibandingkan dengan kontrol.
Metode perhitungan persentase melanin pada kultur mouse melanoma B-16 cell adalah sebagi berikut:
Densitas Optik Perlakuan Densitas Optik Kontrol
3.11.Analisis Data
Analisis data yang digunakan pada penelitian ini adalah analisis deskriptif yang digunakan untuk menganalisa data dengan cara mendeskripsikan atau menggambarkan data yang telah terkumpul sebagaimana adanya tanpa bermaksud membuat kesimpulan yang berlaku untuk umum atau generalisasi. Analysis of variance (ANOVA) merupakan salah satu teknik analisis multivariate yang berfungsi untuk membedakan rerata lebih dari dua kelompok data dengan cara membandingkan variasinya. Model ANOVA one-way Yij = µ + τi + εij dengan hipotesis H0: µ1 = µ2 = µ3 = µ4…..= µn dan H1: µ1≠ µ2≠ µ3 ≠ µ4….. ≠ µn. Jika H0 diterima berarti semua perlakuan yang dicobakan memberikan pengaruh yang sama, tetapi jika H1 yang diterima berarti paling sedikit terdapat sepasang nilai tengah perlakuan yang berbeda. Untuk mengetahui pasangan perlakuan mana yang mempunyai nilai tengah yang berbeda, maka perlu dilakukan pengujian lanjutan untuk mengetahui perbedaan diantara nilai tengah perlakuan. Pengujian tersebut diistilahkan dengan uji lanjutan atau dapat juga disebut sebagai uji pembanding berganda. Uji jarak ganda Duncan atau uji DMRT (Duncan Multiple Range Test) untuk mengetahui perlakuan terbaik berdasarkan peringkatnya. Uji ini dilakukan karena adanya perbedaan nyata pada analisis varian. Uji ini juga dilakukan untuk mengetahui adanya perbedaan dari pemberian perlakuan yang dilakukan pada uji ANOVA.
4.
HASIL DAN PEMBAHASAN
4.1.Ekstraksi dan Fraksinasi
Pada penelitian ini, ekstraksi terhadap daun tanaman nangka menghasilkan ekstrak simplisia daun nangka mature 123,45 gr (13,72%), daun nangka muda 112,32 gr (12,48%), fraksi n-heksan 7,69 gr (6,84%), dan fraksi etil asetat 18,72 gr (16,67%). (Tabel 1)
Metode ekstraksi yang digunakan dalam penelitian ini yaitu maserasi. Metode ini awalnya digunakan dalam teknik pembuatan wine yang kemudian diadopsi secara luas untuk penelitian tanaman obat. Maserasi merupakan metode terbaik yang cocok digunakan untuk uji bahan obat yang tidak stabil terhadap suhu. Pemilihan pelarut etanol karena mempunyai aktivitas antibakteri yang lebih tinggi dibandingkan dengan pelarut air. Etanol lebih mudah menembus membran sel untuk mengekstrak bahan intraseluler dari bahan tumbuhan (Tiwari dkk. 2011). Ekstrak etanol 96% daun nangka muda dan mature serta fraksi etil asetat daun nangka muda telah memenuhi persyaratan farmakope Herbal Indonesia, yaitu tidak kurang dari 10%. Fraksi n-heksan daun nangka muda mempunyai nilai rendemen dibawah 10% karena kandungan air yang tinggi pada bahan baku. Apabila kadar air dalam bahan tinggi dapat mendorong enzim melakukan aktivitas mengubah kandungan kimia yang ada dalam bahan menjadi produk lain yang mungkin tidak lagi memiliki efek farmakologi seperti senyawa aslinya. Beberapa enzim perusak kandungan kimia yang telah lama dikenal antara lain hidrolase, oksidase, dan polimerase (Pramono 2005).
Pemilihan etanol 96% sebagai bahan pelarut karena kandungan air yang sedikit, titik didih tinggi, dan mudah menguap sehingga dapat menghasilkan ekstrak yang kental atau murni dan dapat mempermudah dalam proses identifikasi selanjutnya. Etanol 96% sebagai pelarut yang tidak berwarna akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif, sehingga zat aktif akan larut.
4.2.Penapisan Fitokimia
produksi melanin pada kultur mouse melanoma B-16 cell. Banyak kandungan senyawa fenolik telah diuji sebagai penghambat sintesis melanin dan sebagai pelindung sinar matahari. Ekstrak herbal alami dengan kandungan senyawa aktif seperti fenol, flavonoid, coumarins banyak mendapat perhatian karena diduga sebagai bahan pemutih. (Kim dan Uyama 2005; Seo dkk. 2003).
Sesuai dengan penelitian yang dilakukan Izreen dan Fadzelly (2013) terhadap daun teh ditemukan aktivitas antioksidan yang lebih tinggi pada daun teh muda dibandingkan dengan daun teh mature. Komponen polifenol akan berkurang seiring dengan peningkatan stadium maturitas dari daun teh. Kecenderungan ini berkontribusi pada perubahan morfologi daun sesuai umur dan transportasi kandungan kimia yang unik di dalam tanaman (Farhoost dkk. 2007).
Penelitian yang dilakukan Watanabe dkk. (2016) menjelaskan bahwa pada tumbuhan, mineral berjalan melalui sistem xylem dan vascular phloem. Elemen utama mengalami re-translokasi dari daun mature ke daun muda melalui phloem yang menyebabkan translokasi fotosintesis untuk meningkatkan efisiensi penggunaan mineral dalam perkembangan organ. Koffi dkk. (2010) menunjukkan bahwa etanol merupakan pelarut yang efisien untuk ekstrak polifenol.
Pada beberapa kelompok penelitian, flavonoid sering ditemukan dalam polifenol tumbuhan. Lebih dari 4000 polifenol diidentifikasi dan secara luas terdapat pada daun, kulit batang, dan bunga. Seluruh flavonoid memiliki cincin fenolik dan pyran atau oxine yang termasuk dalam derivat benzoc-pyran. Flavonoid diklasifikasikan dalam enam kelompok besar, yaitu: flavanols, flavones, flavonols, flavanones, isoflavones dan anthocyanidins, yang dibedakan berdasarkan konjugasi cincin dan posisi dari hydroxyl, methoxy, dan glycosidic (Kim dan Uyama 2005). Bahan tanaman yang mengandung flavonoid mempunyai fungsi sebagai antikanker, antiinflamasi, dan perlindungan terhadap ultraviolet (Solano dkk. 2006).
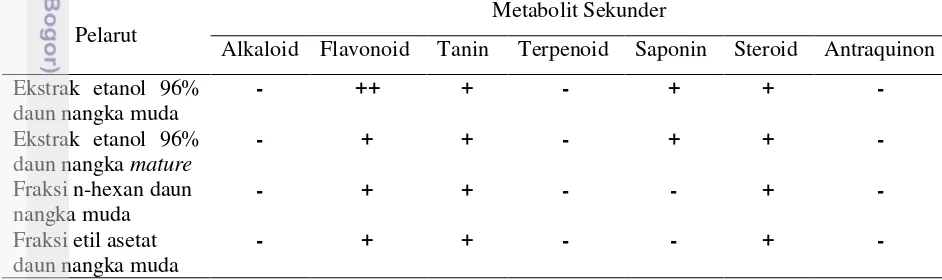
Tabel 2. Hasil penapisan fitokimia
Pelarut
Metabolit Sekunder
Alkaloid Flavonoid Tanin Terpenoid Saponin Steroid Antraquinon
Ekstrak etanol 96%
reaksi tersebut menggunakan oksigen molekuler (Soler dkk. 1999). Tirosinase jamur adalah enzim sitosolik yang memiliki heterogenitas yang tinggi dibandingkan dengan copper yang mengandung phenoloxidase lain seperti laccase dan penelitian lain juga menunjukkan keanekaragaman berat molekul (Van Gelder dkk. 1997).
Hasil uji potensi inhibisi tirosinase pada monofenolase dan difenolase dari ekstrak etanol 96% daun nangka muda dan daun nangka mature didapatkan hasil bahwa ekstrak etanol 96% daun nangka muda mempunyai potensi lebih baik pada monofenolase (IC50: 29,9 µg mL-1) dan difenolase (IC50: 167,3 µg mL-1) dibandingkan dengan ekstrak etanol 96% daun nangka mature monofenolase (IC50: 214,2 µg mL-1) dan difenolase (IC50: 358,1 µg mL-1). Aktivitas ekstrak daun nangka muda tidak berbeda dengan kontrol positif asam kojik monofenolase (IC50: 28,2 µg mL-1) dan difenolase (IC50: 85,0 µg mL-1). Uji potensi inhibisi tirosinase dari fraksi etil asetat daun nangka muda didapatkan hasil monofenolase (IC50: 81,8 µg mL-1) dan difenolase (IC50: 1557,7 µg mL-1) sedangkan fraksi n-heksan daun nangka muda dengan monofenolase dan difenolase (IC50: >2000 µg mL-1). (Tabel 3)
Penelitian yang dilakukan Arung dkk. (2006) dengan melakukan isolasi flavonoid dari bahan berupa kayu nangka, didapatkan zat aktif berupa artocarpanone yang memiliki potensi cukup baik sebagai inhibisi melanin IC50 sebesar 89,1 µM dibandingkan dengan kontrol positif asam kojik yang lebih dari 3521 µM. Penelitian Arung dkk. (2008) mengisolasi zat aktif berupa artocarpin yang dapat menghambat biosintesis melanin pada kultur mouse melanoma B-16 cell meskipun diinduksi oleh α-MSH atau forskolin.
Tabel 3. IC50 Aktivitas monofenolase dan difenolase
4.4.Uji Toksisitas
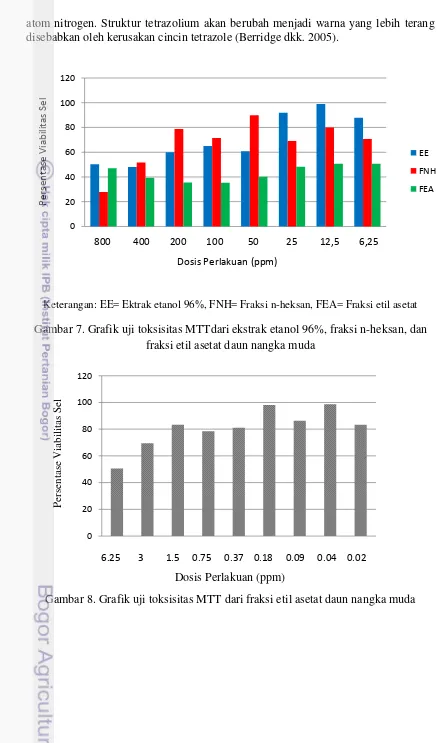
Uji toksisitas dengan menggunakan metode MTT menunjukkan hasil bahwa mulai konsentrasi dosis 200ppm pada ekstrak etanol 96% daun nangka muda (59,91%) dan fraksi n-heksan daun nangka muda (78,76%) tidak toksis terhadap sel melanosit dengan kecenderungan semakin tidak toksis pada konsentrasi dosis yang lebih rendah, namun demikian pada fraksi etil asetat sampai dengan konsentrasi dosis 6,25ppm viabilitas sel hanya 50,53% oleh karena itu dilanjutkan uji MTT dengan konsentrasi dosis yang lebih rendah, dengan membuat awalan dosis 3ppm (69,34%) (Gambar 7 dan 8). Adapun gambaran sel melanosit pada uji MTT ekstrak etanol 96% menggunakan inverted microscope dapat dilihat pada Gambar 9.
Penurunan MTT berhubungan dengan mitokondria, sitoplasma dan membran non-mitokondrial termasuk kompartemen endosom/lisosom, serta membran plasma. Garam tetrazolium yang tidak berwarna dalam larutan air berubah menjadi warna ungu terang dikenal dengan kristal formazan. Perubahan warna ini dijadikan dasar dalam redoks histokimia dan aplikasi biokimia. Sifat kimia dan biokimia yang unik dari garam tetrazolium berupa empat cincin inti tetrazole yang mengandung empat
Pelarut IC50 (µg mL
-1)
Monofenolase Difenolase Ekstrak etanol 96% daun nangka muda 29,9 167,3 Ekstrak etanol 96% daun nangka mature 214,2 358,1 Fraksi n-heksan daun nangka muda >2000 >2000 Fraksi etil asetat daun nangka muda 81,8 1557,7
atom nitrogen. Struktur tetrazolium akan berubah menjadi warna yang lebih terang disebabkan oleh kerusakan cincin tetrazole (Berridge dkk. 2005).
Keterangan: EE= Ektrak etanol 96%, FNH= Fraksi n-heksan, FEA= Fraksi etil asetat
Gambar 7. Grafik uji toksisitas MTTdari ekstrak etanol 96%, fraksi n-heksan, dan fraksi etil asetat daun nangka muda
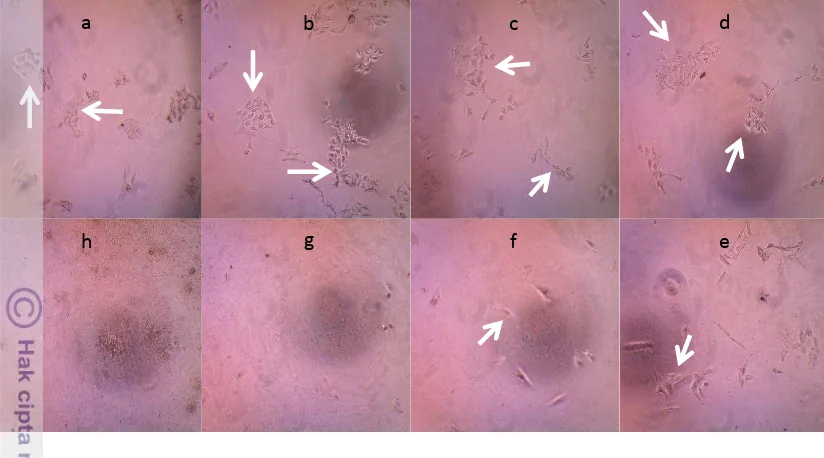
Gambar 9. Sel melanosit pada uji MTT ekstrak etanol 96% menggunakan inverted microscope. Konsentrasi dosis (a) 6,25 ppm, (b) 12,5 ppm, (c) 25 ppm, (d) 50 ppm, (e) 100 ppm, (f) 200 ppm, (g) 400 ppm, dan (h) 800 ppm. Pada konsentrasi dosis 200 ppm mulai tampak gambaran sel melanosit lebih jelas.
Kandungan zat aktif pemutih harus dapat menurunkan jumlah melanin pada mouse melanoma B-16 cell dengan sitotoksisitas yang rendah (Ko dkk. 2013). Penelitian in vitro menggunakan mouse melanoma B-16 cell yang dilakukan Arung dkk. (2006), menunjukkan bahwa artocarpanone yang diisolasi dari ekstrak kayu nangka lebih kuat dalam menurunkan produksi melanin pada kultur sel dibandingkan dengan kontrol positif arbutin dan asam kojik. Pada penelitian ini digunakan arbutin dan asam kojik sebagai kontrol positif karena keduanya sering digunakan pada produk kosmetik. Artocarpanone mempunyai efek sitotoksik yang rendah pada proliferasi sel yakni sekitar 10%. Berdasarkan hal tersebut maka artocarpanone dapat dijadikan kandidat untuk penggunaan praktis di masa mendatang karena keamanannya dapat dipertanggungjawabkan.
Penelitian terhadap zat aktif norartocarpetin yang diisolasi dari Artocarpus communis sebagai inhibisi melanogenesis dengan dosis 5 µM – 40 µM untuk menentukan jumlah sel hidup menggunakan uji MTT tidak menunjukkan efek penurunan sel hidup setelah perlakuan 48 jam (Ko dkk. 2013). Penelitian yang dilakukan Vad dkk. (2014), mengenai efikasi asam asetilsalisilat sebagai bahan antimelanoma pada kultur melanoma B-16 cell menggunakan uji MTT untuk mengukur viabilitas sel melanoma menemukan indikasi bahwa IC50 (48 jam) konsentrasi dosis 100µM menyebabkan penurunan gluthatione (GSH) dose-time dependent dan meningkatkan pembentukan reactive oxygen species (ROS).
Penelitian Arung dkk. (2008) mengenai efek sitotoksisitas artocarpin pada kultur mouse melanoma B-16 cell menunjukkan bahwa rantai isoprenoid yang menempel pada flavonoid (prenylated flavonoid) menjadi alasan utama yang menyebabkan efek sitotoksisitas pada sel. Hal ini juga sesuai dengan penelitian yang
a b c d
e f
dilakukan Baron dan Ibrahim (1996) terhadap posisi rantai isoprenoid pada jamur yang menyebabkan efek sitotoksik.
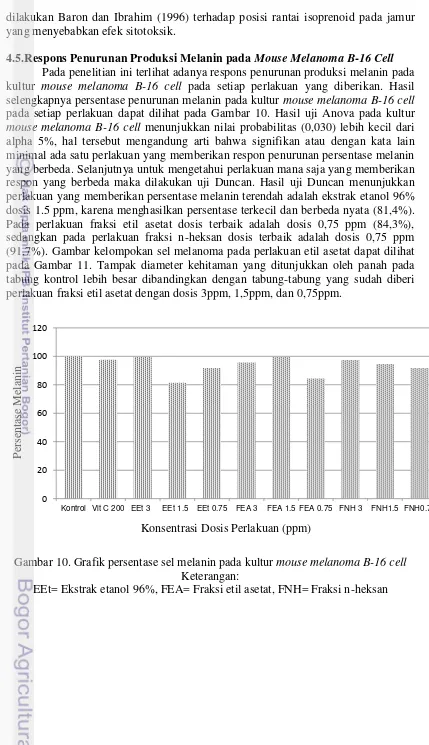
4.5.Respons Penurunan Produksi Melanin pada Mouse Melanoma B-16 Cell Pada penelitian ini terlihat adanya respons penurunan produksi melanin pada kultur mouse melanoma B-16 cell pada setiap perlakuan yang diberikan. Hasil selengkapnya persentase penurunan melanin pada kultur mouse melanoma B-16 cell pada setiap perlakuan dapat dilihat pada Gambar 10. Hasil uji Anova pada kultur mouse melanoma B-16 cell menunjukkan nilai probabilitas (0,030) lebih kecil dari alpha 5%, hal tersebut mengandung arti bahwa signifikan atau dengan kata lain minimal ada satu perlakuan yang memberikan respon penurunan persentase melanin yang berbeda. Selanjutnya untuk mengetahui perlakuan mana saja yang memberikan respon yang berbeda maka dilakukan uji Duncan. Hasil uji Duncan menunjukkan perlakuan yang memberikan persentase melanin terendah adalah ekstrak etanol 96% dosis 1.5 ppm, karena menghasilkan persentase terkecil dan berbeda nyata (81,4%). Pada perlakuan fraksi etil asetat dosis terbaik adalah dosis 0,75 ppm (84,3%), sedangkan pada perlakuan fraksi n-heksan dosis terbaik adalah dosis 0,75 ppm (91,7%). Gambar kelompokan sel melanoma pada perlakuan etil asetat dapat dilihat pada Gambar 11. Tampak diameter kehitaman yang ditunjukkan oleh panah pada tabung kontrol lebih besar dibandingkan dengan tabung-tabung yang sudah diberi perlakuan fraksi etil asetat dengan dosis 3ppm, 1,5ppm, dan 0,75ppm.
Gambar 10. Grafik persentase sel melanin pada kultur mouse melanoma B-16 cell Keterangan:
EEt= Ekstrak etanol 96%, FEA= Fraksi etil asetat, FNH= Fraksi n-heksan 0
20 40 60 80 100 120
Kontrol Vit C 200 EEt 3 EEt 1.5 EEt 0.75 FEA 3 FEA 1.5 FEA 0.75 FNH 3 FNH1.5 FNH0.75
P
erse
ntase
Mela
nin