EFEKTIVITAS PEMBERIAN SILASE DAN PROBIOTIK TERHADAP EKOLOGI RUMEN SAPI PERANAKAN ONGOL MENGGUNAKAN
ANALISIS TERMINAL RESTRICTION FRAGMENT LENGTH POLYMORPHISM (T-RFLP)
RONI RIDWAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis EFEKTIVITAS PEMBERIAN SILASE DAN PROBIOTIK TERHADAP EKOLOGI RUMEN SAPI PERANAKAN ONGOL MENGGUNAKAN ANALISIS TERMINAL
RESTRICTION FRAGMENT LENGTH POLYMORPHISM
(T-RFLP) adalah karya saya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2009
ABSTRACT
RONI RIDWAN. Effectivity of Silage and Probiotic on Rumen Ecology of Peranakan Ongole Cattle by Terminal Restriction Fragment Length Polymorphism (T-RFLP) Analysis. Under direction of SRI BUDIARTI and ACHMAD DINOTO.
Silages and Probiotics additives were used for improvement of cattle productivity. Key of effectivity of silage and probiotics was changed observation direct or indirect roles on rumen ecology. The objective of this study was to examine the effects of silage and probiotics on ruminal ecosystems in vivo using molecular approach. Terminal-restriction fragment length polymorphism (T-RFLP) analysis was used to detect changes of ecology communities based on 16S ribosomal deoxyribonucleic acid (16S rDNA).
Two rumen canulated PO cattle were fed several diet ie; (R0) basal diet dry matter basis (Pennisetu m purpureum 70% and commercial concentrate 30%), (R1) silage (basal diet fermented using Lactobacillus plantarum BTCC570), (R2) silage + probiotics (Leuconostoc sp. BTCC531), (R3) Basal diet + probiotics (Leuconostoc sp. BTCC531). Digesta samples were colected 3 h after feeding for cellulolytic activities (DNS method), pH, parsial volatile fatty acids measurements (Gas Chromatography method), and T-RFLP analysis. T-RFLP analysis was performed using the 16S rDNA amplified from each sample. The lengths of the terminal restriction fragments were analysed after digestion with HhaI, HaeIII and MspI.
Result showed that effectivities of silage and probiotics given together of index Smith and Wilson evenness applied to T-RFLP ecology data (Evar) 0.89±0.04 was the highest. It was significantly (p <0.05) increased rumen metabolism product (%mM) such propionic acid (19.44), valeric acid (0.76), isobutyric acid (2.21), isovaleric acid (1.77) compared with basal diet. T-RFLP analysis has a potency to be used for comparisons of complex bacterial communities, especialy to detect changes in community structure in respons to diferent variabels and showed rumen bacteria diversity in the rumen.
RINGKASAN
RONI RIDWAN. Efektivitas Pemberian Silase dan Probiotik terhadap Ekologi Rumen Sapi Ongol menggunakan Analisis Terminal Restriction
Fragment Length Polymorphism (T-RFLP). Dibimbing oleh SRI BUDIARTI
dan ACHMAD DINOTO.
Pemberian silase dan probiotik digunakan untuk meningkatkan produktivitas ternak sapi. Efektivitas silase dan probiotik dapat diketahui dengan mengamati perubahan yang terjadi di ekosistem rumen baik secara langsung maupun tidak langsung setelah pemberian silase dan probiotik. Teknik terminal-restriction fragment length polymorphism (T-RFLP) digunakan untuk melihat perubahan ekologi suatu komunitas pada habitat tertentu dengan menggunakan metode berbasis 16S
ribosomal deoxyribonucleic acid (16S rDNA).
Penelitian ini bertujuan untuk mengetahui 1) efektifitas pemberian silase dan probiotik pada sapi peranakan ongol terhadap ekosistem rumen, 2) profil populasi bakteri rumen, dan 3) aktivitas rumen meliputi pH, aktivitas selulolitik, dan VFA parsial. Penelitian ini diharapkan dapat bermanfaat untuk memberikan gambaran efisiensi pakan dan probiotik pada ekosistem rumen yang selanjutnya dapat digunakan sebagai salah satu metode skrining pemberian probiotik tahap kedua secara in vivo.
Penelitian ini menggunakan dua ekor sapi peranakan ongol fistula pada bagian rumen. Sebanyak empat perlakukan pemberian pakan dilakukan secara serial pada kedua sapi tersebut meliputi: 20kg bahan segar (BK 31,65%) pakan dasar mengandung (90% Pennisetum purpureu m
dan 10% konsentrat pakan produksi PT. Indofeed (R0), 20kg bahan segar silase (pakan dasar yang difermentasikan dengan Lactobacillus plantarum
T-RFLP. Enzim restriksi yang digunakan dalam analisis T-RFLP adalah HhaI, HaeIII dan MspI.
Data yang diperoleh pada parameter pH, VFA, dan aktivitas enzim selulase dari substrat rumen dianalisis dengan menggunakan sidik ragam berdasarkan rancangan percobaan tukar ganti dan dilanjutkan dengan uji Tukey pada taraf nyata 5% untuk melihat perbedaan yang nyata diantara perlakuan. Analisis indeks keragaman Evar dihitung dengan merata-ratakan data gabungan kedua sapi dari periode pengambilan sampel setiap perlakuan.
Hasil penelitian ini menunjukan bahwa pemberian silase dan probiotik efektif diberikan secara bersamaan dengan memperlihatkan indeks diversitas Smith and Wilson evenness (Evar 0,89±0,04) paling tinggi diantara perlakuan lainnya. Sinergisme antara perlakuan dengan peningkatan keragaman bakteri rumen dalam profil aktivitas rumen, secara nyata (p<0,05) meningkatkan produksi (%mM) asam propionat (19,44), asam isobutirat (2,21), asam valerat (0,76) dan asam isovalerat (1,77) dibandingkan dengan pakan dasar. Pemberian silase dan probiotik secara terpisah memberikan pengaruh terhadap penurunan keragaman bakteri rumen. Profil aktivitas rumen dari pemberian silase secara nyata (p<0,05) meningkatkan pH (7,36), asam isobutirat (1,66%mM), dan penurunan asam butirat (5,34%mM), sedangkan pemberian probiotik memberikan pengaruh nyata (p<0,05) terhadap penurunan pH (6,30) dan ada kecenderungan dapat meningkatkan produksi (%mM) asam propionat (17,58), asam isobutirat (1,50), dan asam valerat (0,33).
© Hak Cipta milik Institut Pertanian Bog or, tahun 2009
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sum ber. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
FEKTIVITAS PEMBERIAN SILASE DAN PROBIOTIK
TERHADAP EKOLOGI RUMEN SAPI PERANAKAN ONGOL
MENGGUNAKAN ANALISIS TERMINAL RESTRICTION
FRAGMENT LENGTH POLYMORPHISM (T-RFLP)
RONI RIDWAN
Tesis
Sebagai salah satu syarat memperoleh gelar Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Efektivitas Pemberian Silase dan Probiotik Terhadap Ekologi Rumen Sapi Peranakan Ongol Menggunakan Analisis
Terminal Restriction Fragment Length Polymorphism (T-RFLP) Nama : Roni Ridwan
NRP : P052060051
Disetujui Komisi Pembimbing
Dr. Sri Budiarti Dr. Achmad Dinoto
Ketua Anggota
Diketahui
Ketua Program Studi Bioteknologi Dekan Sekolah Pascasarjana
Dr. Ir. Muhammad Jusuf, DEA Prof. Dr. Ir. Khairil Anwar Notodiputro, M.S.
PRAKATA
Alhamdulillahhirobbil’alamiin, puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga tesis dengan judul Efektivitas Pemberian Silase dan Probiotik Terhadap Ekologi Rumen Sapi Peranakan Ongol Menggunakan Analisis Terminal Restriction Fragment Length Polymorphism (T-RFLP) ini dapat diselesaikan. Penelitian yang dilaksanakan sejak bulan April-Oktober 2008 dengan harapan dapat bermanfaat dalam memberikan gambaran efisiensi pakan dan probiotik pada ekologi rumen yang selanjutnya dapat digunakan sebagai salah satu metode skrining pemberian probiotik tahap kedua secara in vivo.
Terima kasih penulis sampaikan kepada Ibu Dr. Sri Budiarti dan Bapak Dr. Achmad Dinoto selaku pembimbing Ketua dan Anggota, yang telah banyak meluangkan waktunya untuk memberikan bimbingan, arahan, dan kepada Bapak Dr. Ir. Komang G. Wiryawan selaku dosen penguji luar komisi yang telah memberi masukan, saran, dan perbaikan penulisan tesis ini. Kepada Ibu Dr. Yantyati Widyastuti yang telah banyak membantu dalam memfasilitasi penelitian sehingga penulis dapat menyelesaikan studi ini saya sampaikan banyak terima kasih. Penulis juga menyampaikan ucapan terima kasih kepada Kepala Pusat Penelitian Bioteknologi-LIPI Bapak Prof. Dr. Ir. Bambang Prasetya beserta jajarannya atas ijin dan kesempatan penulis dapat menempuh studi di Sekolah Pascasarjana IPB. Tidak lupa juga penulis sampaikan terima kasih kepada project NITE-I Jepang yang telah memberi bantuan bahan penelitian. Terima kasih kepada Dr. drh Harry dan tim bedah Fakultas Kedokteran Hewan-IPB yang telah membantu dalam proses operasi fistula pada sapi penelitian ini. Kepada teman-teman kelompok penelitian mikrobiologi industri, staf laboratorium di Puslit Bioteknologi dan Biologi LIPI, teman-teman BTK 2006 terima kasih atas segala bantuan teknis dan dukungannya, serta semua pihak yang telah berpartisipasi dalam terselesaikannya tulisan ini.
Rasa hormat dan penghargaan yang tulus, penulis sampaikan ucapan terima kasih kepada kedua orang tua di Cianjur dan di Sumedang, istriku Tika Sundari, serta kedua anakku Kania Dewi Shiyam dan Muhamad Aqil Arrasyid atas doa, dukungan dan waktunya.
Penulis berharap tesis ini dapat bermanfaat bagi peneliti dan
masyarakat.
RIWAYAT HIDUP
Penulis dilahirkan di Cianjur pada tanggal 16 Juli 1975 dari pasangan Alm. Endang Suanda dan Hj. Rohayati Fatimah.
EFEKTIVITAS PEMBERIAN SILASE DAN PROBIOTIK TERHADAP EKOLOGI RUMEN SAPI PERANAKAN ONGOL MENGGUNAKAN
ANALISIS TERMINAL RESTRICTION FRAGMENT LENGTH POLYMORPHISM (T-RFLP)
RONI RIDWAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis EFEKTIVITAS PEMBERIAN SILASE DAN PROBIOTIK TERHADAP EKOLOGI RUMEN SAPI PERANAKAN ONGOL MENGGUNAKAN ANALISIS TERMINAL
RESTRICTION FRAGMENT LENGTH POLYMORPHISM
(T-RFLP) adalah karya saya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2009
ABSTRACT
RONI RIDWAN. Effectivity of Silage and Probiotic on Rumen Ecology of Peranakan Ongole Cattle by Terminal Restriction Fragment Length Polymorphism (T-RFLP) Analysis. Under direction of SRI BUDIARTI and ACHMAD DINOTO.
Silages and Probiotics additives were used for improvement of cattle productivity. Key of effectivity of silage and probiotics was changed observation direct or indirect roles on rumen ecology. The objective of this study was to examine the effects of silage and probiotics on ruminal ecosystems in vivo using molecular approach. Terminal-restriction fragment length polymorphism (T-RFLP) analysis was used to detect changes of ecology communities based on 16S ribosomal deoxyribonucleic acid (16S rDNA).
Two rumen canulated PO cattle were fed several diet ie; (R0) basal diet dry matter basis (Pennisetu m purpureum 70% and commercial concentrate 30%), (R1) silage (basal diet fermented using Lactobacillus plantarum BTCC570), (R2) silage + probiotics (Leuconostoc sp. BTCC531), (R3) Basal diet + probiotics (Leuconostoc sp. BTCC531). Digesta samples were colected 3 h after feeding for cellulolytic activities (DNS method), pH, parsial volatile fatty acids measurements (Gas Chromatography method), and T-RFLP analysis. T-RFLP analysis was performed using the 16S rDNA amplified from each sample. The lengths of the terminal restriction fragments were analysed after digestion with HhaI, HaeIII and MspI.
Result showed that effectivities of silage and probiotics given together of index Smith and Wilson evenness applied to T-RFLP ecology data (Evar) 0.89±0.04 was the highest. It was significantly (p <0.05) increased rumen metabolism product (%mM) such propionic acid (19.44), valeric acid (0.76), isobutyric acid (2.21), isovaleric acid (1.77) compared with basal diet. T-RFLP analysis has a potency to be used for comparisons of complex bacterial communities, especialy to detect changes in community structure in respons to diferent variabels and showed rumen bacteria diversity in the rumen.
RINGKASAN
RONI RIDWAN. Efektivitas Pemberian Silase dan Probiotik terhadap Ekologi Rumen Sapi Ongol menggunakan Analisis Terminal Restriction
Fragment Length Polymorphism (T-RFLP). Dibimbing oleh SRI BUDIARTI
dan ACHMAD DINOTO.
Pemberian silase dan probiotik digunakan untuk meningkatkan produktivitas ternak sapi. Efektivitas silase dan probiotik dapat diketahui dengan mengamati perubahan yang terjadi di ekosistem rumen baik secara langsung maupun tidak langsung setelah pemberian silase dan probiotik. Teknik terminal-restriction fragment length polymorphism (T-RFLP) digunakan untuk melihat perubahan ekologi suatu komunitas pada habitat tertentu dengan menggunakan metode berbasis 16S
ribosomal deoxyribonucleic acid (16S rDNA).
Penelitian ini bertujuan untuk mengetahui 1) efektifitas pemberian silase dan probiotik pada sapi peranakan ongol terhadap ekosistem rumen, 2) profil populasi bakteri rumen, dan 3) aktivitas rumen meliputi pH, aktivitas selulolitik, dan VFA parsial. Penelitian ini diharapkan dapat bermanfaat untuk memberikan gambaran efisiensi pakan dan probiotik pada ekosistem rumen yang selanjutnya dapat digunakan sebagai salah satu metode skrining pemberian probiotik tahap kedua secara in vivo.
Penelitian ini menggunakan dua ekor sapi peranakan ongol fistula pada bagian rumen. Sebanyak empat perlakukan pemberian pakan dilakukan secara serial pada kedua sapi tersebut meliputi: 20kg bahan segar (BK 31,65%) pakan dasar mengandung (90% Pennisetum purpureu m
dan 10% konsentrat pakan produksi PT. Indofeed (R0), 20kg bahan segar silase (pakan dasar yang difermentasikan dengan Lactobacillus plantarum
T-RFLP. Enzim restriksi yang digunakan dalam analisis T-RFLP adalah HhaI, HaeIII dan MspI.
Data yang diperoleh pada parameter pH, VFA, dan aktivitas enzim selulase dari substrat rumen dianalisis dengan menggunakan sidik ragam berdasarkan rancangan percobaan tukar ganti dan dilanjutkan dengan uji Tukey pada taraf nyata 5% untuk melihat perbedaan yang nyata diantara perlakuan. Analisis indeks keragaman Evar dihitung dengan merata-ratakan data gabungan kedua sapi dari periode pengambilan sampel setiap perlakuan.
Hasil penelitian ini menunjukan bahwa pemberian silase dan probiotik efektif diberikan secara bersamaan dengan memperlihatkan indeks diversitas Smith and Wilson evenness (Evar 0,89±0,04) paling tinggi diantara perlakuan lainnya. Sinergisme antara perlakuan dengan peningkatan keragaman bakteri rumen dalam profil aktivitas rumen, secara nyata (p<0,05) meningkatkan produksi (%mM) asam propionat (19,44), asam isobutirat (2,21), asam valerat (0,76) dan asam isovalerat (1,77) dibandingkan dengan pakan dasar. Pemberian silase dan probiotik secara terpisah memberikan pengaruh terhadap penurunan keragaman bakteri rumen. Profil aktivitas rumen dari pemberian silase secara nyata (p<0,05) meningkatkan pH (7,36), asam isobutirat (1,66%mM), dan penurunan asam butirat (5,34%mM), sedangkan pemberian probiotik memberikan pengaruh nyata (p<0,05) terhadap penurunan pH (6,30) dan ada kecenderungan dapat meningkatkan produksi (%mM) asam propionat (17,58), asam isobutirat (1,50), dan asam valerat (0,33).
© Hak Cipta milik Institut Pertanian Bog or, tahun 2009
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sum ber. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
FEKTIVITAS PEMBERIAN SILASE DAN PROBIOTIK
TERHADAP EKOLOGI RUMEN SAPI PERANAKAN ONGOL
MENGGUNAKAN ANALISIS TERMINAL RESTRICTION
FRAGMENT LENGTH POLYMORPHISM (T-RFLP)
RONI RIDWAN
Tesis
Sebagai salah satu syarat memperoleh gelar Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Efektivitas Pemberian Silase dan Probiotik Terhadap Ekologi Rumen Sapi Peranakan Ongol Menggunakan Analisis
Terminal Restriction Fragment Length Polymorphism (T-RFLP) Nama : Roni Ridwan
NRP : P052060051
Disetujui Komisi Pembimbing
Dr. Sri Budiarti Dr. Achmad Dinoto
Ketua Anggota
Diketahui
Ketua Program Studi Bioteknologi Dekan Sekolah Pascasarjana
Dr. Ir. Muhammad Jusuf, DEA Prof. Dr. Ir. Khairil Anwar Notodiputro, M.S.
PRAKATA
Alhamdulillahhirobbil’alamiin, puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga tesis dengan judul Efektivitas Pemberian Silase dan Probiotik Terhadap Ekologi Rumen Sapi Peranakan Ongol Menggunakan Analisis Terminal Restriction Fragment Length Polymorphism (T-RFLP) ini dapat diselesaikan. Penelitian yang dilaksanakan sejak bulan April-Oktober 2008 dengan harapan dapat bermanfaat dalam memberikan gambaran efisiensi pakan dan probiotik pada ekologi rumen yang selanjutnya dapat digunakan sebagai salah satu metode skrining pemberian probiotik tahap kedua secara in vivo.
Terima kasih penulis sampaikan kepada Ibu Dr. Sri Budiarti dan Bapak Dr. Achmad Dinoto selaku pembimbing Ketua dan Anggota, yang telah banyak meluangkan waktunya untuk memberikan bimbingan, arahan, dan kepada Bapak Dr. Ir. Komang G. Wiryawan selaku dosen penguji luar komisi yang telah memberi masukan, saran, dan perbaikan penulisan tesis ini. Kepada Ibu Dr. Yantyati Widyastuti yang telah banyak membantu dalam memfasilitasi penelitian sehingga penulis dapat menyelesaikan studi ini saya sampaikan banyak terima kasih. Penulis juga menyampaikan ucapan terima kasih kepada Kepala Pusat Penelitian Bioteknologi-LIPI Bapak Prof. Dr. Ir. Bambang Prasetya beserta jajarannya atas ijin dan kesempatan penulis dapat menempuh studi di Sekolah Pascasarjana IPB. Tidak lupa juga penulis sampaikan terima kasih kepada project NITE-I Jepang yang telah memberi bantuan bahan penelitian. Terima kasih kepada Dr. drh Harry dan tim bedah Fakultas Kedokteran Hewan-IPB yang telah membantu dalam proses operasi fistula pada sapi penelitian ini. Kepada teman-teman kelompok penelitian mikrobiologi industri, staf laboratorium di Puslit Bioteknologi dan Biologi LIPI, teman-teman BTK 2006 terima kasih atas segala bantuan teknis dan dukungannya, serta semua pihak yang telah berpartisipasi dalam terselesaikannya tulisan ini.
Rasa hormat dan penghargaan yang tulus, penulis sampaikan ucapan terima kasih kepada kedua orang tua di Cianjur dan di Sumedang, istriku Tika Sundari, serta kedua anakku Kania Dewi Shiyam dan Muhamad Aqil Arrasyid atas doa, dukungan dan waktunya.
Penulis berharap tesis ini dapat bermanfaat bagi peneliti dan
masyarakat.
RIWAYAT HIDUP
Penulis dilahirkan di Cianjur pada tanggal 16 Juli 1975 dari pasangan Alm. Endang Suanda dan Hj. Rohayati Fatimah.
DAFTAR ISI
Halaman
DAFTAR TABEL ... v
DAFTAR GAMBAR... vi
DAFTAR LAMPIRAN... vii
PENDAHULUAN Latar Belakang... 1
Tujuan dan Manfaat... 2
Hipotesis... 3
TINJAUAN PUSTAKA Ekologi Rumen... 4
Silase... 6
Probiotik... 8
Teknik Molekuler (T-RFLP)... 10
BAHAN DAN METODE Waktu dan Tempat Penelitian... 14
Alat dan Bahan... 14
Metode Penelitian... 14
Penumbuhan Isolat... 14
Pembuatan Silase... 15
Pembuatan Probiotik... 15
Pembuatan Lubang Fistula... 16
Perlakuan Percobaan... 17
Pengambilan Sampel Percobaan... 18
Ekstraksi DNA Genom Bakteri Rumen ... 18
Analisis T-RFLP... 18
Analisis Data Ekologi... 20
Pengukuran pH Rumen... 20
Analisis VFA Parsial... 20
Aktivitas Enzim Selulase... 21
Analisis Data... 21
HASIL DAN PEMBAHASAN Silase dan Probiotik... 22
Ekstaksi DNA dan Amplifikasi PCR... 24
DAFTAR TABEL
Halaman
DAFTAR GAMBAR
Halaman
1 Alur analisis T-RFLP... 12 2 Sapi PO fistula pada bagian rumen... 17 3 Alur perlakuan percobaan dan periode pengambil sampel.... 17 4 Silase pakan dasar... 22 5 Probiotik bubuk hasil freeze drying dan kapsul probiotik... 24 6 Hasil amplifikasi dengan PCR dari semua
perlakuan... 25 7 Data hasil genescaning dengan ABI PRISM 3100 Appiled
Biosystem... 27 8 Dendogram kedekatan bakteri rumen pada kedua sapi
berdasarkan pengelompokan pola T-RF dari tiga enzim restriksi HaeIII, HhaI, dan MspI menggunakan analisis
UPGMA... 29 9 Tampilan program T-RFLP v1.0 Beta1 untuk identifikasi
T-RF peak secara online... 32 10 Tampilan program T-RFLP v1.0 Beta1 dalam identifikasi
T-RF yang dihasilkan oleh tiga enzim restriksi HaeIII, HhaI,
dan MspI secara online... 33 11 Elektroferogram genescan oleh enzim restriksi HaeIII pada
sapi A dan sapi B... 34 12 Nilai pH isi rumen pada kedua sapi dari seluruh
perlakuan... 39 13 Aktivitas enzim selulolitik pada kedua sapi dari seluruh
DAFTAR LAMPIRAN
Halaman
1 Analisis sidik ragam aktivitas selulase... 53 2 Analisis sidik ragam pH isi rumen... 54 3 Analisis sidik ragam produksi asam asetat... 56 4 Analisis sidik ragam produksi asam propionat... 57 5 Analisis sidik ragam produksi asam butirat... 58 6 Analisis sidik ragam asam isobutirat... 59 7 Analisis sidik ragam produksi asam valerat... 60 8 Analisis sidik ragam produksi asam isovalerat... 61 9 Hasil genescaning sampel R0 pada sapi A dari ketiga
enzim restriksi... 62 10 Hasil genescaning sampel R1 pada sapi A dari ketiga
enzim restriksi... 66 11 Hasil genescaning sampel R2 pada sapi A dari ketiga
enzim restriksi... 70 12 Hasil genescaning sampel R3 pada sapi A dari ketiga
enzim restriksi... 75 13 Hasil genescaning sampel R0 pada sapi B dari ketiga
enzim restriksi... 79 14 Hasil genescaning sampel R1 pada sapi B dari ketiga
enzim restriksi... 83 15 Hasil genescaning sampel R2 pada sapi B dari ketiga
enzim restriksi... 86 16 Hasil genescaning sampel R3 pada sapi B dari ketiga
PENDAHULUAN
Latar Belakang
Upaya peningkatan produktivitas ternak sapi pada saat ini banyak dilakukan oleh berbagai kalangan untuk memenuhi kebutuhan nasional, menurunkan angka impor (sapi induk 6.200 ekor, sapi siap digemukan 265.700 ekor dan daging sapi 25.949,2 ton yang setara dengan 96.108 ekor sapi siap dipotong (Deptan 2007)) dan menuju swasembada daging. Sapi peranakan ongol (PO) termasuk tipe sapi potong yang produktivitasnya masih rendah dengan pertambahan bobot badan (PBB) sekitar 0,6-1,0kg/hari.
Untuk mengoptimumkan produktivitas ternak dan menjaga kesehatan ternak dari infeksi saluran pencernaan, pakan harus tersedia secara kontinyu selama pemeliharaan dan pakan harus diformulasikan
secara lengkap dengan penambahan beberapa unsur mineral mikro,
mineral makro, vitamin dan senyawa aditif lainnya seperti probiotik (Astuti
et al. 2007).
Ketersediaan pakan yang kontinyu dapat diatasi dengan silase yaitu
hijauan segar yang difermentasikan oleh bakteri asam laktat (BAL). Organisme ini menjamin kecepatan dan efisiensi fermentasi silase dengan
memanfaatkan karbohidrat yang larut dalam air. Nilai pH yang rendah dan kandungan asam laktat yang tinggi sebagai produk fermentasi berperan sebagai pengawet alami, sehingga silase dapat disimpan lama (McDonald
Probiotik banyak dilaporkan dapat memperbaiki produktivitas ternak
sapi, diantaranya mengurangi penggunaan antibiotik, mengurangi stress,
meningkatkan produksi susu pada sapi perah, meningkatkan efesiensi
pakan dan PBB pada sapi potong, penurunan risiko asidosis dan
menurunkan kandungan E. coli O157:H7 dari feses (Krehbiel et al. 2003).
Efektivitas silase dan probiotik dapat diketahui dengan mengamati
perubahan yang terjadi di rumen baik secara langsung maupun tidak
langsung setelah pemberian silase dan probiotik. Habitat pada ekosistem
mikroba rumen merupakan konsorsium komplek dari mikroba yang
berhubungan secara simbiotik dengan inang, bekerja sinergi untuk
biokonversi pakan lignoselulosa menjadi volatile fatty acids (VFA)
(Kamra 2005).
Teknik berbasis 16S ribosomal ribonucleic acid (16S rRNA) banyak dipilih dalam berbagai penelitian molekuler karena memenuhi persyaratan sebagai penanda genetik universal, objektif, dan merupakan daerah yang konservatif bervariasi. Teknik terminal-restriction fragment length
polymorphism (T-RFLP) digunakan untuk melihat ekologi suatu komunitas
pada habitat tertentu dengan metode sederhana dalam waktu yang cepat mampu memperlihatkan keyakinan pengamatan dari dinamika populasi
bakteri (Kaplan et al. 2001), meningkatkan keyakinan kemampuan skrining
pada jumlah yang banyak dan kemungkinan dapat digunakan untuk
skrining tahap kedua dari aktivitas probiotik (Krause et al. 2003).
Tujuan dan Manfaat
untuk memberikan gambaran efisiensi pakan dan probiotik pada ekosistem rumen yang selanjutnya dapat digunakan sebagai salah satu metode skrining pemberian probiotik tahap kedua secara in vivo.
Hipotesis
TINJAUAN PUSTAKA
Ekologi Rumen
Peningkatan produktivitas ternak sapi dapat dilakukan dengan berbagai cara salah satunya melalui modifikasi pakan. Pakan merupakan faktor penting dalam mensuplai fungsi dan efisiensi kerja rumen. Rumen memegang peranan cukup besar dalam memanfaatkan pakan yang dikonsumsi untuk menghasilkan sumber energi utama yaitu VFA. Ruminansia mempunyai pencernaan khusus yang berbeda dengan ternak non ruminansia seperti unggas, babi, kuda, dan manusia. Pencernaan ruminansia terbagi menjadi 4 bagian yaitu rumen, retikulum, omasum, dan abomasum. Bagian pencernaan yang utama adalah rumen mengandung volume cairan sekitar 60 sampai 100 liter atau sekitar 20% dari bobot badan. Nilai pH di dalam rumen berkisar antara 6-7 dan diatur oleh produksi saliva melalui mekanisme pengunyahan.
Rumen merupakan organ yang menarik untuk dikaji dan diteliti, terkait fungsinya sebagai tempat fermentasi utama pakan yang dikonsumsi oleh ruminansia. Habitat rumen dihuni oleh sekitar 1010-12 cfu/ml bakteri, 105-6/ml protozoa dan sebagian kecil fungi anaerob (Ogimoto et al. 1981, Fuler 1992). Ekosistem mikroba rumen merupakan konsorsium komplek dari beragam kelompok yang bekerja secara
simbiotik dengan inang dan bekerja secara sinergi untuk biokonversi
pakan. Keberadaan bakteri di dalam rumen terbagi menjadi tiga, yaitu menempel pada dinding rumen, menempel pada partikel pakan, dan berada dalam cairan rumen.
Keberadaan mikroba rumen yang mayoritas merupakan Gram negatif
dan bakteri Gram positif tergantung pada peningkatan sumber energi
pada oksigen dan akan mati pada keadaan terbuka dari oksigen. Bakteri
rumen dapat toleran dengan adanya asam organik tanpa mempengaruhi
kegiatan metabolismenya. Secara garis besar diversitas bakteri rumen
digolongkan ke dalam kemampuan menggunakan substrat dan hasil akhir
dari fermentasinya. Bakteri rumen aktif dalam memanfaatkan karbohidrat
seperti selulosa (Ruminococcus albus, Fibrobacter succinegenes,
Eubacterium cellulosolvens), hemiselulosa (Butyrivibrio fibrisolvens), pati
(Streptococcus bovis), gula atau dextrin (Succinivibrio dextrinosolvens,
Lactobacillus sp.), dan pektin (Trepone ma saccharophilu m dan Lachnospira
m ultiparus). Sebagian lainnya aktif dalam memanfaatkan nitrogen, seperti
degradasi protein (Ruminibacter amylophilus, clostridium sp.) dan hidrolisis
urea (Megasphaera elsdenii). Kelompok bakteri pengguna asam
(Succiniclasticum ruminis), bakteri lipolitik, asetogenik, pendegradasi
antinutrisi (tanin dan mimosin), metanogen, dan mycoplasma juga
melengkapi komunitas mikroba dalam ekosistem rumen (Hungate 1966, Ogimoto et al. 1981, Hobson et al.1997, Kamra et al. 2005).
diproduksi dalam rumen menyumbang 60-80% dari kebutuhan energi ternak ruminansia (Sutardi 2001).
Efisiensi kecernaan serat dalam ruminansia sangat penting untuk
memenuhi kebutuhan energi. Bakteri yang berperan penting dalam
degradasi dan pemanfaatan serat adalah Fibrobacter succinogenes,
Ruminococcus albus, Ruminococcus flavefaciens, dan Butyrivibrio
fibrisolvens. Dari keempat spesies tersebut, Fibrobacter dan Ruminococcus
merupakan organisme selulolitik dengan aktivitas paling tinggi.
Peningkatkan aktivitas selulolitik pada ruminansia dapat dilakukan baik
melalui manipulasi genetik atau manipulasi ekologi (Krause et. al. 1999,
Weimer 1996). Keyserlingk et al. (1998) melaporkan aktivitas degradasi di
dalam rumen melalui model “kantong nilon” yang melintas di sepanjang
saluran pencernaan. Sekitar 20 % asam amino pada pakan dalam kantong
nilon menghilang sepanjang saluran pencernaan pasca prainkubasi di
rumen selama 12 jam.
Silase
Prinsip pembuatan silase adalah fermentasi hijauan segar oleh BAL secara fakultatif anaerob. BAL menggunakan karbohidrat mudah terlarut dalam air untuk menghasilkan asam laktat yang dapat menurunkan pH pada silase, sehingga dapat berperan sebagai zat pengawet alami (McDonald et al. 1991, Ennahar et al. 2003). Muck (1996) menyatakan tujuan utama penggunaan inokulum BAL sebagai aditif pembuatan silase
adalah untuk menjamin kecepatan dan efisiensi fermentasi silase.
Fermentasi silase dibantu oleh BAL seperti Lactobacillus plantarum
(McDonald et al. 1991).
Peranan lain dari inokulum BAL diduga sebagai probiotik. Hal ini didukung oleh fenomena keberadaan inokulum BAL yang masih dapat bertahan hidup pada bagian cairan rumen ternak secara in vitro (Weinberg
et al. 2003, 2004) dan kemampuan silase pakan ternak untuk
meningkatkan produksi susu dan PBB ternak sapi secara in vivo. Broberg et al. (2007) melaporkan bahwa metabolit asam p-hydrocoumaric, asam
hydroferulic, dan asam p-coumaric dijumpai pada silase rumput yang
diberikan penambahan inokulum strain BAL. Ekstrak silase telah diuji
aktivitas antibakterinya pada bakteri indikator M. luteus (Gram positif) dan
Pseudomonas aeruginosa (Gram negatif). Meskipun isolat murni diketahui
memiliki aktivitas antimikroba yang lebih tinggi, beberapa produk silase
juga memperlihatkan aktivitas antibakteri sekitar 2-8mm zona
penghambatan atas pertumbuhan bakteri uji (Gollop et al. 2005).
Penelitian mengenai pengurangan panjang potongan rumput bahan
silase dari 19mm ke 10mm tidak berpengaruh pada pH rumen, total VFA,
hasil susu, dan komposisi susu, tetapi meningkatkan konsumsi bahan
kering (BK) dari 19.4 ke 20.1 kg/hari pada level pemberian konsentrat
yang tinggi 16.9-17.7 kg/hari. Sedangkan pemberian level konsentrat yang
(Einarson et al. 2004). Pemberian silase rumput memperlihatkan pengaruh
yang nyata dan memberikan hasil lebih tinggi dari pada silase jagung
terhadap kualitas daging (warna daging lebih stabil) dan kandungan
α-tocopherol lebih tinggi sekitar 3.84 µg/g daging (Sullivan et al. 2002). Poduksi gas sebagai parameter kinetika fermentasi rumen dari perlakuan
silase memperlihatkan bahwa populasi mikroba rumen mampu
beradaptasi dengan adanya silase rumput (Cone et al. 1999).
Probiotik
Untuk memaksimumkan pasokan nutrien kepada ternak, digunakan bahan pakan aditif berupa probiotik, vitamin, mineral makro dan mineral mikro yang dapat meningkatkan produktivitas dan kualitas serta menjaga kesehatan ternak. Fuller (1992) mendefinisikan probiotik adalah suplemen pakan berupa mikroba hidup, yang memberi pengaruh menguntungkan bagi ternak inang dengan cara meningkatkan keseimbangan mikroorganisme dalam saluran pencernaan.
Probiotik merupakan pakan aditif berupa mikroba hidup yang dapat
memberikan efek positif terhadap ternak melalui peningkatan fungsi
mikroba di dalam rumen. Beberapa probiotik dari golongan bakteri asam
laktat yang sudah umum digunakan adalah berasal dari genus
Bifidobacterium, Lactobacillus, Streptococcus, Leuconostoc, dan Pediococcus.
Pertumbuhan yang optimum merupakan salah satu bukti dari
penggunaan probiotik di dalam suplemen pakan ternak sebagai subtitusi
atau pengganti agen subterapeutik seperti antibiotik ternak. Salah satu
persyaratan untuk memilih bakteri probiotik adalah meningkatkan
penggunaan nutrisi oleh enzim yang dihasilkan dalam saluran pencernaan
dan mampu mengkonversi beberapa komponen dari pakan menjadi
nutrien yang lebih mudah dimanfaatkan untuk keperluan ternak inang.
Probiotik harus dapat toleran terhadap garam ampedu dan pada bagian
sistem pencernaan lainnya seperti keasaman lambung.
Syarat lainnya, produk probiotik harus dapat bertahan dalam masa
proses preparasi, masa penyimpanan, dan harus sampai pada organ yang
ditargetkan. Penelitian telah menduga kemungkinan selektif probiotik
sebagai pakan yang menghasilkan beberapa perubahan dalam ternak yaitu
penurunan resiko acidosis, peningkatan efesiensi pakan, PBB (sekitar 2,5
%), produksi susu (0,75-2kg), menurunkan kandungan E. coli O157:H7 feses
dari infeksi, dan memperbaiki respon imun dalam keadaan stress (Krehbiel
et al. 2003).
Fungsi spesifik dari probiotik dapat berbeda-beda tergantung pada
ternak inang dan yang paling penting adalah dari karakteristik probiotik
(Gilliland, 2004). Resistensi terhadap antimikroba pada saluran pencernaan
adalah kriteria penting untuk menyeleksi organisme sebagai probiotik. Jika
dibandingkan dengan lactobacilli, strain yang biasa digunakan untuk
probiotik, bifidobacteria nampak lebih lemah pada antibiotik. Dalam
penelitian terbaru, dilaporkan bahwa strain probiotik lactobacillus resisten
pada tetracycline (29,5%), chloramphenicol (8,5%) dan erythromycin (12%).
Gen resistensi antibiotik dalam banyak strain bakteri asam laktat dapat
mentransfer dari plasmid dengan transposon konjugasi pada dan dari BAL,
Telah diuji struktur dan ekspresi dari dua bakteriosin rumen butyrivibriocin
AR10 dan butyrivibriocin OR79A dari Butyrivibrio fibrisolvens yang mana
memperlihatkan dua struktur famili yang berbeda dari bakteriosin yang
umum dihasilkan oleh BAL (Teather et al. 1999).
Pemberian probiotik Leuconostoc sp. BTCC531 yang telah dilakukan oleh peneliti sebelumnya secara in vitro memberikan pengaruh nyata pada peningkatan populasi BAL, total bakteri rumen, proporsi asam valerat dan kecernaan neutral detergent insoluble fiber (NDF) (Wajizah 1999), memperbaiki pola fermentasi rumen (Ridwan et al. 2005, Astuti et al. 2007). Sedangkan secara in vivo, penambahan strain ini dilaporkan dapat meningkatkan PBB sapi PO sampai 1.13kg/hari (Ridwan et al. tidak dipublikasikan). Penambahan Zn organik diketahui dapat meningkatkan efisiensi penyerapan BK, populasi BAL, populasi bakteri pengguna asam laktat dan mempengaruhi produksi VFA asam propionat. (Suwito 2001, Djawa 2001). Walaupun peneliti sebelumnya telah memperlihatkan beberapa pengaruh terhadap parameter yang diamati dari penggunaan silase dan probiotik, namun pengaruh terhadap diversitas bakteri dalam ekologi rumen secara in vivo belum dapat diperlihatkan. Oleh karena itu untuk melihat efektifitasnya perlu dilakukan suatu penelitian lanjutan yang dapat memperlihatkan hubungan ekologi bakteri rumen dengan produk yang dihasilkan.
Teknik Molekuler T-RFLP
Teknik isolasi secara kultur dipelopori oleh Robert E. Hungate dalam mempelajari rumen dan mikrobiologi anaerob serta telah berhasil
mengembangkan teknik anaerob roll tube yang digunakan untuk kultur
bakteri anaerobik (Chung et al. 1999). Penelitian pada ekologi saluran
dan keragaman), aktivitasnya (biasanya ditentukan secara in vitro), tetapi
idealnya aktivitas secara in vivo dapat diukur, dan hubungan
masing-masing organisme dengan ternak sebagai tempat tinggalnya secara
interaksi sinergis dan kompetitif (Hungate 1966). Untuk melihat diversitas mikroba saluran pencernaan khususnya rumen dengan menggunakan metode yang dapat kultur, persentase keberhasilannya kecil, masih banyak mikroba yang tidak dapat dikulturkan dan tidak dapat diungkap keberadaannya.
Pada saat ini, penemuan dari metode berdasarkan kultur telah
ditambahkan dengan teknik ekologi molekuler yang berdasarkan
16S-rRNA. Teknik ini dapat mengkarakterisasi mikrobiota dan membagi skema
klasifikasi untuk memprediksikan hubungan filogenetiknya (Zoetendal et al.
2004). Teknik T-RFLP dalam menentukan komposisi total komunitas dari
mikroorganisme yang tidak dapat dikulturkan dan belum diketahui
identitasnya dapat memanfaatkan sekuen 16S rRNA dari DNA total
komunitas (Ferrero et al. 2004). Evaluasi sistematik model analisis T-RFLP
memperoleh hasil yang tinggi, sehingga membuat sebagian atraktif dalam
mempelajari struktur dinamika dari komunitas mikroba (Osborn et al.
2000). Teknik T-RFLP dapat meningkatkan keyakinan kemampuan skrining
dalam jumlah banyak pada tahap kedua dari aktivitas pemberian probiotik
secara in vivo (Krause et al. 2003).
T-RFLP merupakan suatu teknik molekuler yang dapat menduga adanya perbedaan genetika antar galur mikroorganisme dan memberikan pengertian yang mendalam tentang struktur dan fungsi suatu komunitas mikroba (Yogiara 2004). Komunitas mikroba dalam saluran pencernaan adalah sangat komplek dan terdiri dari grup mikroba yang berbeda-beda
seperti bakteri, protozoa, jamur anaerobik dan bakteriofage, bakteri
adalah mengkonversi makanan ke dalam absorpsi dan kecernaan
komponen yang lebih mudah. Oleh karena itu aplikasi teknik molekuler,
khususnya keragaman sequen 16S-rRNA, menjadi populer karena dapat
meneliti secara langsung jalannya kultivasi dalam ekosistem mikroba
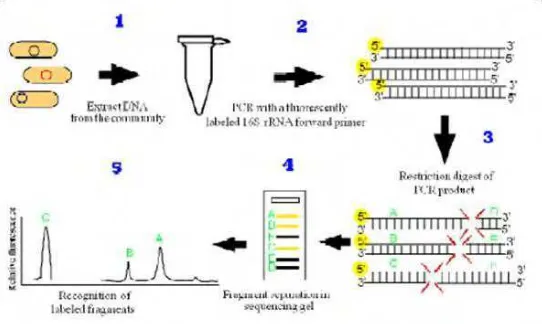
[image:37.595.176.447.230.392.2]termasuk saluran pencernaan (Zoetendal et al. 2008).
Gambar 1. Alur analisis T-RFLP (Gruntzig et al. 2002)
Teknik molekuler T-RFLP adalah suatu teknik pemotongan nukleotida
hasil dari amplifikasi PCR dengan enzim restriksi endonuclease. Pada
proses amplifikasi dengan PCR digunakan primer yang telah dilakukan
pelabelan di ujung 5’ dengan 6-carboxylfluoresens untuk mengamplifikasi daerah spesifik dari gen bakteri yang mengkodekan 16S rRNA dari total DNA komunitas (Gambar 1). Selanjutnya dilakukan analisis potongan sekuen dengan menggunakan genetic analyzer. Alat ini dapat membaca potongan nukleotida yang berflouresen pada ujung 5’ dan ditangkap oleh sensor (Liu et al. 1997, Kaplan et al. 2001). Selanjutnya dilakukan pemasukan data scaner pada program untuk melihat kedekatan situs restriksinya dengan mikroorganisme yang telah ada pada database.
Keragaman ekologi bakteri suatu komunitas dari data scaning dapat
and Wilson evenness (Evar). Persamaan ini dibandingkan dengan
persamaan lainnya untuk analisis indeks ekologi lebih mendekati pada
kenyataan dan mempunyai korelasi yang tinggi (Blackwood et al. 2007).
Perkembangan masa yang akan datang memungkinkan dapat langsung
dilakukan kultivasi bakteri yang sebelumnya tidak dapat dikulturkan dan
menggunakan strategi yang cukup handal untuk melihat lebih jauh
diversitas yang sebenarnya dari fungsi populasi mikroba. Produktivitas
ternak ruminansia seharusnya menjadi meningkat lebih efisien ketika
ekologi mikroba rumen dan nutrisi dipelajari secara terpadu dan
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan April-Oktober 2008 di Laboratorium Mikrobiologi Pusat Peneitian Bioteknologi dan Pusat Penelitian Biologi Lembaga Ilmu Pengetahuan Indonesia.
Alat dan Bahan. Alat-alat yang digunakan dalam penelitian adalah pH meter, spektrofotometer, laminar air flow, sentrifugator, inkubator, timbangan analitik, PCR, squencer ABI PRISM 3100 (Applied Biosystem), elektroforesis, pipet mikro, water bath, consentrator vakum, freeze drying. Bahan yang digunakan dalam penelitian adalah isolat Lactobacillus plantarum BTCC570, Leuconostoc sp. BTCC 531, sapi PO fistula pada bagian rumen, rumput gajah, konsentrat produksi PT. Indofeed, silase pakan dasar, kapsul probiotik Leuconoctoc sp. BTCC531, primer 6FAM-46F (Sigma) yang dilabel dengan 6-carboxylfluoresens, primer 1080R, enzim restriksi HaeIII,
HhaI, dan MspI (Takara Bio Inc.), bahan-bahan untuk PCR dan bahan kimia standar p.a.
Metode Penelitian
Penelitian dilakukan dengan beberapa tahapan yaitu 1) Persiapan percobaan meliputi; penumbuhan isolat, pembuatan silase, pembuatan probiotik, pembuatan lubang fistula pada kedua sapi PO, 2) perlakuan percobaan, 3) pengambilan sampel percobaan, 4) analisis sampel percobaan, dan 5) analisis data.
Penumbuhan Isolat. Isolat L. plantarum BTCC570 dan Leuconostoc
Sharpe (MRS) (deMan et al. 1960) pada suhu inkubasi sekitar 30-32oC selama 18 jam. Isolat L. plantarum BTCC570 digunakan sebagai stok dalam pembuatan inokulum silase dan Leuconostoc sp.BTCC531 digunakan sebagai probiotik yang dikemas dalam kapsul dan disimpan di dalam refrigerator sampai digunakan saat percobaan. Untuk keperluan produksi maka diambil sekitar 2 ose yang ditransfer ke dalam medium prekultur MRS cair yang bervolume 5% dari medium produksi (v/v).
Pembuatan Silase. Silase dibuat dari campuran 90% bahan segar
Pennisetum purpureum (rumput gajah) yang sebelumnya telah
dipotong-potong sekitar 3cm oleh mesin pemotong dengan 10% w/w konsentrat pakan produksi PT. Indofeed yang dalam 1kg mengandung 140g protein kasar (PK), 40g lemak (L), 80g serat kasar (SK), dan 100g abu. Konsentrat tersebut memiliki protein dapat dicerna 11% dan total digestable nutrient
(TDN) 68%. Setelah dicampur merata, kemudian ditambahkan 0.1% (v/w) inokulum silase L. plantarum BTCC570 dengan kepadatan populasi awal 1010cfu/ml ke dalam bahan silase. Bahan silase ditempatkan ke dalam silo tong plastik biru (diameter 50cm dan tinggi 120cm) sambil dilakukan pemadatan sampai penuh sekitar 75kg bahan silase/silo.
Selanjutnya dilakukan penutupan dengan ditambahkan alas plastik, dan disegel. Silase diinkubasikan selama 21-30 hari pada suhu ruang. Kualitas silase yang sudah dipanen ditentukan dengan analisis proksimat, pH, dan kepadatan populasi BAL silase (Cappuccino et al. 2001).
kekeruhan dari medium asal dan diukur absorbansinya (OD600)
menggunakan spektrofotometer. Selanjutnya dipindahkan prekultur ke dalam medium produksi, dan diinkubasikan dalam inkubator selama 18 jam pada suhu 30-32oC. Kemudian dilakukan sentrifugasi dengan kecepatan 10.000 rpm selama 10 menit pada suhu 4-10oC. Endapan hasil sentrifugasi (biomassa sel bakteri probiotik) dicampurkan ke dalam 100ml larutan skim milk steril 10-20% w/v secara merata. Kemudian dibekukan dalam freezer -80oC selama satu malam.
Campuran biomasa dengan carrier selanjutnya dilakukan pengeringbekuan dengan menggunakan freeze-drying selama 48 jam pada suhu -50oC sampai -80oC dalam keadaan vakum. Proses
freeze drying
selesai dengan ditandai biomasa campuran yang awalnya basah menjadi kering dengan kandungan BK sekitar 95%. Probiotik kering dihaluskan menjadi probiotik bubuk dengan menggunakan blender yang telah dilakuan sterilisasi. Kualitas probiotik dilihat dari kepadatan populasi
Leuconostoc sp. BTCC531 dalam medium MRS agar (Cappuccino et al.
2001). Bubuk probiotik kering kemudian dikemas ke dalam kapsul 0,4g/kapsul.
Gambar 2. Sapi PO fistula pada bagian rumen
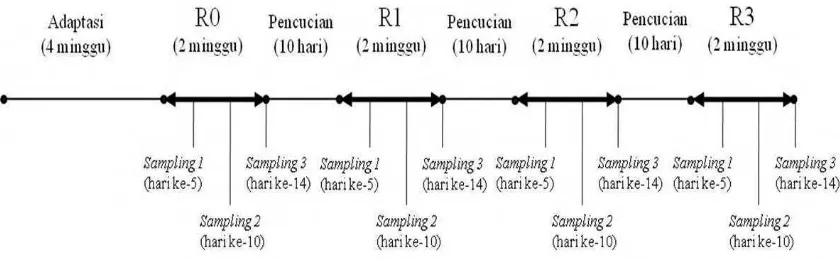
Perlakuan Percobaan. Penelitian ini menggunakan dua ekor sapi PO yang telah diadaptasikan selama satu bulan pasca operasi pembuatan fistula sebagai ulangan. Sebanyak empat perlakukan pemberian pakan dilakukan secara serial pada kedua sapi tersebut meliputi: 20kg bahan segar (BK 31,65%) pakan dasar mengandung (90% rumput gajah dan 10% konsentrat pakan produksi PT. Indofeed (R0), 20kg bahan segar silase (BK 32,72%) (R1), 20kg silase ditambah 1 butir kapsul probiotik/ekor/hari (R2) dan 20kg pakan dasar ditambah 1 butir kapsul probiotik/ekor/hari (R3). Waktu setiap perlakuan pemberian pakan adalah dua minggu dan waktu pencucian rumen setiap perlakuan adalah 10 hari menggunakan pakan dasar (R0).
[image:42.595.114.534.581.711.2]Pengambilan Sampel Percobaan. Sampel isi rumen diambil dari setiap perlakuan melalui lubang fistula sebanyak 3 kali, yaitu pada hari 5, ke-10 dan ke-14 (Gambar 3). Pengambilan sampel dilakukan 3 jam setelah pemberian pakan. Sebanyak 200gram substrat rumen dari setiap perlakuan diambil menggunakan pinset besar dan ditempatkan pada 4 tabung steril (corning tube). Sampel disimpan pada suhu –20oC untuk keperluan analisis berikutnya meliputi pengukuran nilai pH dengan pH meter, VFA parsial dengan metode kromatografi gas, aktivitas enzim karboksimetilselulase dengan metode DNS (Ghose 1987, Wang 2000) dan analisis populasi mikroba rumen dengan metode T-RFLP.
Ekstraksi DNA Genom Bakteri Rumen. Sampel isi rumen dari setiap perlakuan dari masing-masing perlakuan dilakukan ekstraksi DNA genom dengan menggunakan kit dari Qiagen-Jepang. Persiapan sampel ekstraksi DNA genom bakteri, sekitar 10 gram substrat rumen 9-10% BK dilakukan pemerasan dengan saringan kain kasa steril. Sebanyak 3-5ml cairan rumen hasil pemerasan divortek selama 2 menit dan dengan segera disimpan dalam es. Kemudian sebanyak 200µl cairan rumen dicuci 2 kali dengan 1x
phospat buffer saline 800µl menggunakan sentrifuge 10.000rpm selama 2
menit. Endapan yang didapatkan selanjutnya dilakukan ekstrak DNA genom bakteri dengan kit DNeasy Blood and Tissue dari Qiagen Jepang sesuai dengan prosedur kerja yang disaranankan oleh perusahaan tersebut.
dalam amplifikasi PCR. Kondisi reaksi PCR, campuran reaksi 50µl ; DNA template kurang dari 1µg (2µl), primer 6FAM-46F (5’-GCYTAACACATGCAAGTCGA-3’) 0,4µM (10pqmol; 2µl) yang dilabel dengan 6-carboxylfluoresens, 1080R (5’-CCCAACATCTCACGAC-3’) 0.4µM (10pqmol; 2µl), Premix Taq®25µl (Takara Bio Inc, Otsu Japan, yang terdiri dari; 25mM TAPS, 50mM KCl, 2 mM MgCl2, 1 mM 2-Mercaptoethanol, 200
µM (masing-masing mengandung dATP, dGTP, dTTP), 100 µM (α 32 P)-dCTP, aktivasi 0,25mg/ml DNA sperma salmon, Takara ExTaqTM 1,25 Unit/25 µl, dNTP mixture 2x cons @ 0.4 mM, dan ExTaq buffer 2x cons 4 mM Mg2+), dan H2O 19 µl. Kondisi PCR, pradenaturasi pada suhu 94oC
selama 2 menit; sebanyak 30 siklus pada suhu 94oC selama 2 menit,
48,5oC selama 1 menit dan 72oC selama 1 menit; selanjutnya tahap terakhir pada suhu 72oC selama 10 menit. Produk PCR dilihat keberhasilannya dengan gel elektroforesis pada 1,2% agarosa. Selanjutnya produk PCR dilakukan pemurnian dengan menggunakan SUPREC PCR (Takara Bio Inc, Otsu Japan).
Analisis Data Ekologi. Data yang didapatkan dari genescan dilakukan normalisasi mengikuti Sait et al. (2003) dengan batasan nilai 5% area puncak T-RF relatif. Untuk melihat kedekatan bakteri yang didapatkan dihitung berdasarkan pendekatan koefisien similaritas (Cs), dimana ;
Cs=2j/(a + b),
j; jumlah populasi organisme yang ada di dua sampel
a; total populasi di sampel a
b; total populasi disampel b.
Penentuan keragaman filotipe ekologi dari bakteri rumen (S) ditentukan oleh perbedaan jumlah T-RF yang didapatkan. Keragaman populasi bakteri rumen ditentukan dengan indeks keragaman Smith and Wilson evenness (Evar), dimana pi (relatif area) merupakan perbandingan area puncak T-RF tertentu terhadap jumlah total area puncak T-RF (Blackwood et al. 2007). Perhitungan indeks keragaman Evar mengikuti persamaan berikut :
Evar=1 - 2 arctan ∑ ln(pi) - ∑ ln (pi)/S S
Pengukuran pH Rumen. Substrat rumen dari setiap perlakuan dilakukan pengukuran pH dengan menggunakan pH meter. Analisis dilakukan langsung setelah pengambilan sampel isi rumen dilakukan.
Analisis VFA Parsial. Sebanyak 5ml sampel cairan rumen (hasil pemerasan substrat rumen) ditambahkan 1ml pengendap protein (Metaphosphoric acid, 12,5g; air steril 50ml), kemudian dilakukan sentifugasi dengan kecepatan 10.000 rpm selama 10 menit. Selanjutnya 1ul supernatan diinjeksikan ke dalam GC (Gas Chomatography). Konsentrasi VFA parsial yang diukur adalah asam asetat, asam propionat, asam butirat, asam
2
i=1 π
s s
valerat, asam isobutirat, dan asam isovalerat. Perhitungan VFA parsial substrat rumen masing-masing perlakuan dihitung berdasarkan rumus: Konsentrasi VFA parsial (mM) = Luas area sampel x FP x Konsentrasi
Luas area standar
BM sampel FP = Faktor pengenceran
BM = Berat Molekul
Aktivitas Enzim Selulase. Analisis aktivitas enzim yang diukur adalah aktivitas selulase sampel menggunakan karboksimetilselulase (CMC). Aktivitas enzim tersebut digunakan dalam melihat hubungan populasi bakteri tertentu dengan aktivitas enzim selulase yang dihasilkan pada saat pengambilan sampel dari masing-masing perlakuan dengan menggunakan metode pengukuran dengan DNS (Ghose 1987, Wang et al. 2000).
HASIL DAN PEMBAHASAN
Silase dan Probiotik
Hasil penelitian menunjukkan bahwa rumput gajah segar yang digunakan mempunyai nilai BK sebesar 31,65%, selain digunakan sebagai pakan dasar juga dimanfaatkan sebagai bahan dasar hijauan pembuatan silase. Silase telah berhasil dibuat dengan karaktersitik sebagai berikut; tekstur lembut, tidak berjamur, aroma khas asam laktat, pH 3,99, BK 32,78% dan total populasi BAL sekitar 1,1 x 106 cfu/g silase (Gambar 4).
Gambar 4. Silase pakan dasar
[image:47.595.211.413.306.481.2]Hasil analisis kandungan bahan pakan dilakukan di Laboratorium INTP Fakultas Peternakan IPB dalam 100% BK disajikan dalam Tabel 1 dibawah ini.
Tabel 1. Kandungan kimia bahan pakan dalam 100% BK
Sampel Abu PK SK LK Beta-N Ca P GE
(%) kal/g
Konsentrat 10,65 18,24 18,45 3,89 48,77 1,08 0,65 4380 Rumput 10,66 8,44 39,95 0,93 40,01 0,21 0,22 2930 Silase 8,04 14,04 36,62 2,06 39,24 0,48 0,47 3515 Keterangan: PK; protein kasar, SK; serat kasar, LK; lemak kasar, Beta-N; bahan ekstrak tanpa N, Ca;
Pada Tabel 1. terlihat adanya peningkatan PK silase sebesar 66,35% dari rumput gajah. Peningkatan tersebut disebabkan karena adanya sumbangan dari penambahan konsentrat 10% dan protein mikroba dari BAL. Persentase PK yang dihasilkan oleh silase ini lebih tinggi jika dibandingkan dengan silase yang dilaporkan oleh Kleinschmit et al. (2005) dan lebih kecil dengan hasil silase yang dilaporkan oleh Bhandari et al.
(2007). BAL cukup besar menyumbangkan protein asal sel yang dikandung sekitar 1,1 x 106 CFU/g silase segar. Untuk melihat lebih jauh kecernaan dari bahan, maka dilakukan analisis fraksi serat dengan metode VanSoest. Analisis ini membantu dalam gambaran kecernaan bahan secara kimia dari tingkat kelarutan bahan dalam neutral detergent insoluble fiber (NDF) dan
[image:48.595.105.516.411.508.2]acid detergent insoluble fiber (ADF). Hasil analisis VanSoest bahan disajikan dalam Tabel 2. di bawah ini.
Tabel 2. Hasil analisis VanSoest dari bahan pakan
Sampel BK NDF ADF Hemiselulosa Selulosa Lignin Silika
(%) Rumput 92,02 67,65 62,64 5,10 40,03 19,34 3,19
Silase 87,08 50,41 45,59 4,82 31,90 10,30 0,34 Keterangan: BK; bahan kering, NDF; neutral detergent insoluble fiber, ADF; acid detergent insoluble
fiber
Nilai NDF mencerminkan persentase dinding sel dan ADF merupakan persentase lignoselulosa dari suatu bahan. Pada Tabel 2. terlihat bahwa silase memiliki nilai NDF lebih rendah dari rumput segar yang dijadikan bahan dasar pembuatan silase. Nilai NDF ini masih lebih tinggi apabila dibandingkan dengan silase yang dilaporkan oleh Vlaeminck et al. (2006) yang menghasilkan nilai NDF 61,9% dan lebih rendah memiliki nilai ADF
sebesar 37%. Tinggi rendahnya nilai NDF dan ADF mencerminkan adanya
korelasi kecernaan yang baik di dalam percobaan in vivo (Tillman et al.
Gambar 5. Probiotik bubuk hasil freeze drying dan kapsul probiotik
Probiotik cair yang telah dibuat memiliki kepadatan populasi sebesar 7,5 x 1011 cfu/ml dengan nilai OD600 sebesar 1,7. Probiotik tersebut
selanjutnya dibuat probiotik bubuk menggunakan metode kering-beku (freeze-drying) (Gambar 5a) dihasilkan kepadatan populasi sebesar 1,67 x 1013 cfu/gram dengan kandungan BK sebesar 95% (Gambar 5b). Probiotik dalam bentuk kering-beku ini selanjutnya dikemas dalam kapsul warna merah putih dan disimpan di refrigerator selama 3 bulan masa penelitian (Gambar 5c). Viabilitas probiotik sampai akhir penelitian masih berada dalam keadaan baik, belum terjadi penurunn yang derastis.
Ekstraksi DNA dan Amplifikasi PCR
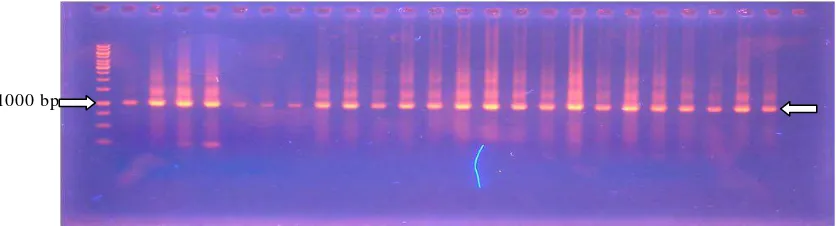
DNA genom bakteri rumen yang berasal dari substrat rumen dengan menggunakan kit Qiagen-Jepang berbasis membran berhasil diekstrak. Konsentrasi DNA hasil ekstraksi isi rumen sapi dengan volume total 100 µl berkisar antara 31,71-128,40 ng/µl dan memiliki kemurnian DNA vs RNA yang diukur pada panjang gelombang 260nm dan 230nm sebesar 1,05-1,26 serta DNA vs protein (260/280nm) sebesar 0,98-1,20. Amplifikasi PCR dari 50 µl campuran reaksi telah berhasil dilakukan dengan ukuran 1000-1100bp sesuai dengan primer yang digunakan yaitu 6FAM-46F dan 1080R (Gambar 6). Ukuran tersebut dikonfirmasi dengan 1 kb
1000 bp
[image:50.595.88.506.252.365.2]leader dari Fermentas. Konsentrasi amplikon berkisar antara 53,00-116,40 ng/µl dengan kemurnian DNA vs RNA (260/230nm) dan DNA vs protein (260/280nm) masing-masing sebesar 1,82-2,57 dan 1,17-1,92. Produk PCR ini telah cukup baik untuk dilanjutkan pada proses selanjutnya karena masuk kedalam kisaran kemurnian 1,8-2 pada perbandingan absorbansi 260/230nm.
Gambar 6. Hasil amplifikasi dengan PCR dari semua perlakuan
Analisis T-RFLP
Hasil genescan dari gabungan DNA amplikon pada periode pengambilan sampel setiap perlakuan telah berhasil dilihat berdasarkan ukuran yang telah terpotong-potong oleh masing-masing enzim restriksi. Proses amplifikasi PCR menggunakan primer terlabel di ujung 5’ dengan 6-carboxylfluoresens mengamplifikasi daerah spesifik gen bakteri yang mengkodekan 16S rDNA dari total DNA komunitas. Selanjutnya automatics
genetic analyzer hanya membaca potongan nukleotida yang berflouresen
pada ujung 5’ dan ditangkap oleh sensor pada saat melawati kapiler (Liu et al. 1997, Kaplan et al. 2001).
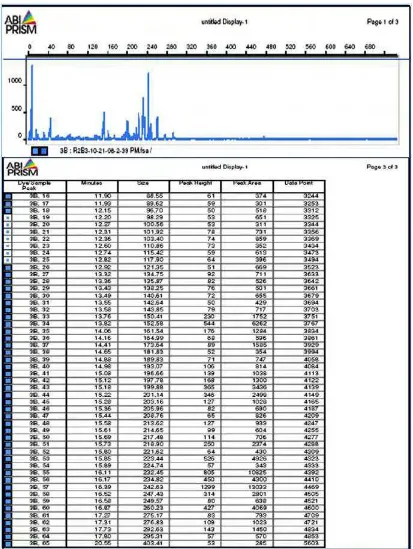
Data genescan yang didapatkan terdiri dari ukuran Terminal
Restriction Fragment (T-FR) dalam satuan bp menunjukkan kumpulan
berdasarkan area (peak area) (Gambar 7). Oleh karena jumlah DNA yang dilewatkan pada kapiler tidak dapat dikontrol dengan akurat, jumlah semua total T-RF baik area maupun intensitas fluoresens bervariasi diantara T-RF dalam suatu komunitas, sehingga perlu dilakukan normalisasi (Kaplan et al. 2001). Osborne et al. (2006) menyatakan bahwa untuk meminimalkan variasi, bias dan meyakinkan ukuran T-RF yang didapatkan perlu dilakukan normalisasi pada batasan tertentu.
Normalisasi yang dilakukan pada setiap sampel dengan menggunakan metode berdasarkan persentase area relatif yaitu perbandingan antara peak area yang terdeteksi dengan total peak area
Koefisien Similaritas (Cs)
Ukuran T-RF yang telah dinormalisasi selanjutnya dilihat kedekatan organisme diantara perlakuan yang diberikan dengan pendekatan
koefisien similaritas (Cs), sehingga profil T-RFLP dapat digambarkan
(Sait et al. 2003). Hasil perhitungan disajikan pada Tabel 3 dibawah ini.
Tabel 3. Koefisien similaritas (Cs)
perlakuan Sapi A Sapi B Rataan R2-R3 0,44 0,63 0,53 ± 0,13
R0-R3 0,29 0,75 0,52± 0,33
R0-R1 0,27 0,63 0,45 ± 0,25 R1-R3 0,24 0,65 0,44 ± 0,29 R1-R2 0,32 0,57 0,44 ± 0,29 R0-R2 0,26 0,60 0,43 ± 0,24
Pada Tabel 3. terlihat bahwa perlakuan R2 dengan R3 dan R0 dengan
R3 memiliki nilai Cs yang paling tinggi. Tingginya nilai Cs pada perlakuan
tersebut memiliki kemiripan struktur organisme yang ada di dalam rumen.
Sedangkan nilai Cs yang kecil memperlihatkan adanya perbedaan diantara
organisme yang ditemukan di dalam rumen yang dipengaruhi oleh
perlakuan. Perlakuan R0 dan R2 memperlihatkan nilai Cs kecil sehingga
populasi bakteri pada perlakuan R2 memiliki perbedaan yang cukup jauh
dengan keadaan awalnya yaitu perlakuan R0.
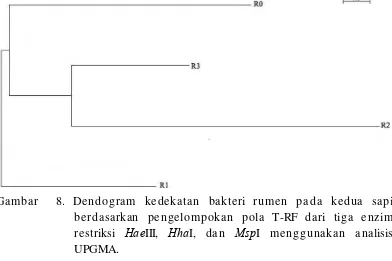
Kedekatan organisme di dalam rumen dapat dilihat juga dari
dendogram menggunakan aplikasi clustalX2 melalui pengelompokan pola
T-RF berdasarkan UPGMA. Pada prinsipnya pengklasteran UPGMA hampir
sama dengan nilai Cs yaitu perlakuan R2 memiliki perbedaan organisme
kedekatan organisme yang ada di dalam rumen (Gambar 8). Perlakuan R2
mampu merubah komunitas yang sebelumnya dominan menjadi menurun
dan memunculkan populasi baru. Populasi baru tersebut memberikan
peranan dalam ekologi rumen sehingga populasi yang lama belum tentu
[image:54.595.117.509.211.472.2]cocok dengan suasana yang baru.
Gambar 8. Dendogram kedekatan bakteri rumen pada kedua sapi berdasarkan pengelompokan pola T-RF dari tiga enzim restriksi HaeIII, HhaI, dan MspI menggunakan analisis UPGMA.
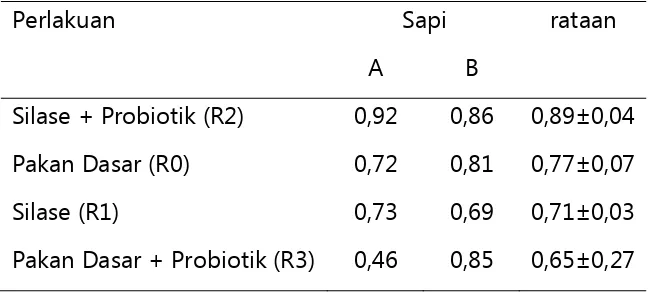
Indeks Keragaman Smith and Wilson evenness (Evar)
Untuk meyakinkan kedekatan dan perbedaan diantara bakteri rumen
setiap perlakuan dilihat dari keragaman indeks diversitas. Hal ini didukung
oleh data dari perlakuan R2 yang memiliki keragaman yang tinggi,
sehingga bakteri yang ada di dalam rumen memiliki perbedaan dengan
perlakuan awal R0. Keragaman ekologi bakteri suatu komunitas dari data
scaning dapat diketahui dengan melihat diversity indexs atau indeks
diversitas (keragaman) menggunakan persamaan Smith and Wilson
evenness (Evar). Persamaan ini dibandingkan dengan persamaan lainnya
dalam analisis indeks ekologi lebih mendekati pada kenyataan dan
Keragaman pelotif yang dihasilkan oleh ketiga enzim yang digunakan memberikan variasi komunitas yang menarik pada seluruh perlakuan yang diberikan pada kedua sapi. Pemberian R0, R1, R2, dan R3 pada kedua sapi PO memperlihatkan keragaman bakteri rumen yang cukup menarik dengan memiliki jumlah populasi area dengan intensitas yang berbeda-beda sekitar 28, 29, 26 dan 25 T-RFs dari semua enzim yang digunakan dalam penelitian.
Tabel 4. Indeks diversitas Smith and Wilson evenness (Evar)
Perlakuan Sapi rataan
A B
Silase + Probiotik (R2) 0,92 0,86 0,89±0,04 Pakan Dasar (R0) 0,72 0,81 0,77±0,07
Silase (R1) 0,73 0,69 0,71±0,03
Pakan Dasar + Probiotik (R3) 0,46 0,85 0,65±0,27
Keragaman mikroorganisme rumen tergantung dari pakan, kondisi sapi, dan sinergisme dengan mikroba lainnya. Pada pemberian R0 keragaman yang didapatkan masih cukup tinggi, hal ini diperlihatkan data Evar yang dimiliki R0 lebih tinggi dibandingkan dengan R3 (Tabel 4), sedangkan untuk pemberian R1 dan R3 memperlihatkan adanya kecenderungan menurunkan keragaman, tetapi jika dikombinasikan diantara keduanya (R2) ada kecenderungan memberikan dampak yang sinergis yaitu nilai Evar meningkat paling tinggi dibandingkan dengan semua perlakuan.
secara tidak langsung, yaitu ketidak hadiran bakteri tertentu memberikan bakteri lain untuk memanfaatkan metabolit yang dihasilkan dan berperan aktif dalam metabolisme di rumen. Mungkin saja keberadaan isolat bakteri pada saat pemberian hanya bertahan tidak lama karena lingkungan yang cukup komplek yang ada di rumen. Meskipun kehadirannya tidak lama, namun sepertinya telah menghasilkan suatu produk metabolit atau suasana yang cukup sesuai sehingga bakteri rumen yang lain mulai terlihat komunitasnya. Analisis T-RFLP ini menunjukkan suatu analisis yang unik dapat memperlihatkan keberadaan suatu komunitas dengan atraktif,
dinamis, dan sinergis.
Kedekatan T-RF (bp) dengan Organisme dalam RDP II
Untuk mengetahui nama populasi bakteri rumen dari kedekatan dan keragaman yang dimiliki setiap perlakuan selanjutnya ukuran T-RFnya disejajarkan dengan database genebank pada Ribosomal Data Project (RDP) II di homepage http://rdp8.cme.msu.edu/html/TAP-Java2.html. Proses pensejajaran dengan database RDP II secara online dengan program Java diperlukan dua software pendukung yang harus di instal terlebih dahulu yaitu JDK dan JRE. Setelah proses instal selesai, program T-RFLP v1.0 Beta1 akan ditampilkan di alamat website http://rdp8.cme.msu.edu/html/TAP-Java2.html (Gambar 9).
Gambar 9. Tampilan program T-RFLP v1.0 Beta1 untuk identifikasi T-RF peak secara online.
Gambar 10.Tampilan program T-RFLP v1.0 Beta1 dalam identifikasi T-RF yang dihasilkan oleh tiga enzim restriksi HaeIII, HhaI, dan MspI secara online
keterangan, = meningkat, = menurun
Gambar 11. Elektroferogram genescan T-RF menggunakan enzim restriksi HaeIIIpadasapi A dan sapi B. A
B Clostridium purinolyticum
128
Metabacterium polyspora
Cytophaga fucicola str NN015860 /str sw17
185
Clone WCHBI-82
Clone EH-7/ str.rj5
Clone12-102 193
262
Ruminococcus productus/Clostridiu m Sp.
Epulopiscium sp/Epulopiscium fishelsoni str Red. Sea A2
Ruminococcus hansenii ATCC Arcobacter cryaerophilus CCUG17801
Arcobacter butzleri CCUG10373 (CloneT31/CloneT55/Clone T95)
267 Clone WCHBI-82
Clostridium purinolyticum
Eubacterium cellulosolvens ATCC43171(T)/ Syntropho monas saporans Eubacterium ptautii DSM 4000(T)/ Clostridium fusiformis str CM973
Ruminococcus hansenii ATCC
Perlakuan R1, R2, dan R3 pada sapi A secara umum menekan keberadaan Clostridium purinolyticum ATCC 33906(T) yang pada awalnya ada pada perlakuan R0. Akan tetapi pada sapi B pemberian R1 dan R2 saja yang menurunkan keberadaannya (Gambar 10). Keberadaan Epulopiscium
sp. Str morphotype A2/Epulopiscium fishelsoni str Red.SeaA2/Bifidobacterium longu m ATCC15707(T) pada kedua sapi mengalami penurunan dengan diberikannya perlakuan R1, akan tetapi dengan perlakuan R3 hanya terjadi penurunan populasi di sapi B. Pemberian R1 pada sapi A memperlihatkan munculnya populasi bakteri
Metabacteriu m polyspora yang sebelumnya tidak ada. Bakteri ini kembali tertekan dan akhirnya tidak muncul ketika sapi A mendapatkan perlakuan R3. Hal ini tidak terjadi pada sapi B meskipun perlakuan yang diberikan sama dengan sapi A.
Tabel 5. Kedekatan ukuran T-RF (bp) dengan data base pada RDP II
Populasi T-RF dan Organisme Prediksi Observasi Kesesuaian ukuran T-RF (HaeIII, HhaI, MspI) (HaeIII, HhaI, MspI) Bifidobacterium angulatum str.Type strain ATCC27535(T) 46, 335, 43 46,338, ND
Clone EH-7 152, 59, NA 152, 59,55
str.rj5 152, 159, 93 152, 161, 95
Clone WCHBI-82 161, 331, 250 161, 331, 256
Clone12-102 181, 64, 59 181, 65, 57
Eubacterium cellulosolvens ATCC43171(T) 201, 152, 184 201, 150, 184
Syntrophomonas saporans 201, 341, 259 201, 339, 258
Clone vc2.1 Bac43 201, 23, 259 201, ND, 258
Eubacterium ptautii DSM 4000(T) 201, 350, 260 201, 349, 258 Clostridium fusiformis str CM973 201, 1052, 184 201, ND, 184 Arcobacter cryaerophilus CCUG17801
Arcobacter butzleri CCUG10373/(CloneT31/CloneT55/Clone T95)
224, 64, 436 223, 67, 436
Ruminococcus productus ATCC27340/Clostridium Sp.StrDR6A 233, 150, 182 233, 150, 184 Ruminococcus hansenii ATCC 27752(T) 235, 151, 259 235, 150, 258 Cytophaga fucicola str NN015860/ str sw17 242, 56, 51 243, 59, 51 Epulopiscium sp. Str morphotype A2/Epulopiscium fishelsoni str Red. Sea A2 247, 334, 244 247, 331, 241 Bifidobacterium longum ATCC15707(T) 247, 334, 96 247, 331, 94
Metabacterium polyspora 251, 517, 248 251, ND, 248
Penurunan populasi bakteri yang dominan menyebabkan adanya populasi bakteri tertentu mulai terlihat keberadaanya meskipun masih rendah. Begitu pula dengan adanya peningkatan populasi bakteri tertentu menyebabkan tersuksesinya beberapa populasi yang sebelumnya ada. Hal ini terjadi pada perlakuan R1,R2, dan R3 dari kedua sapi.
Perlakuan R1 pada sapi A, CloneT31/CloneT55/CloneT95/Arcobacter
cryaerophilus CCUG17801/Arcobacter butzleri CCUG10373 tersuksesi
dengan kehadiran bakteri dominan Metabacterium polyspora.
Metabacteriu m polyspora termasuk bakteri gram positif, hidup dalam
kondisi anaerob, diisolasi dari saluran pencernaan babi (Esther et al. 1998). Clone WCHBI-82 dan Clone12-102 mulai terlihat populasinya setelah terjadi penurunan Ruminococcus hansenii ATCC 27752(T) dan Clostridium purinolyticu m ATCC33906(T). Clostridium purinolyticu m termasuk bakteri proteolitik anaerob, gram negatif, tumbuh pada kisaran pH 6,5-9 (Durre et al. 1981).
Clone EH-7/str.rj5 mulai muncul dan peningkatan populasi
Cytophaga fucicola str NN015860, str sw17 setelah terjadi penurunan
populasi Clone WCHBI-82/Clone12-102, Epulopiscium sp. Str morphotype A2/Epulopiscium fishelsoni str Red. Sea A2/Bifidobacterium longu m
ATCC15707(T) dan Clostridium purinolyticu m ATCC33906(T). Cytophaga fucicola merupakan bakteri aerob, gram negatif, dan dapat menghidrolisis
substrat selulosa. Organisme ini pada awalnya berhasil diisolasi dari air laut
Pada Tabel 5. didapatkan beberapa organisme seperti
Bifidobacterium angulatu m yang kebetulan memiliki kedekatan dengan T-RF observasi. Hampir semuanya organisme tersebut termasuk bakteri anaerob, dapat tumbuh pada suhu 35-43oC, berasal dari habitat saluran
pencernaan ternak ruminansia dan nonruminansia kecuali Cytophaga.
Organisme ini merupakan bakteri aerob, diisolasi dari air laut, dan dapat
menghidrolisis substrat selulosa (Johansen et al. 1999). Sejauh ini
Bifidobacterium angulatu m dilaporkan sebagai organisme penghuni
saluran pencernaan pada manusia (Dinoto et al. 2006b). Perlu diklarifikasi mengenai keberadaan organisme yang sebelumnya tidak ditemukan dalam rumen menggunakan metode PCR dengan primer spesifik atau dengan pendekatan pustaka klon.
Aktivitas Rumen
Kecukupan sumber energi untuk ternak terpenuhi, sehingga fungsi-fungsi organ tubuh ternak tidak terganggu, dan selama penelitian sapi diketahui dalam kondisi sehat. Konsumsi rataan sapi dalam 100% BK pada perlakuan R0, R1, R2, dan R3 secara berturut-turut adalah 6,42; 4,46; 5,03; dan 6,93Kg. Hal ini mengindikasikan bahwa pemberian probiotik dapat meningkatkan konsumsi BK. Sebaliknya pemberian silase berdampak pada penurunan konsumsi BK. Uniknya, apabila pakan ditambahkan probiotik ada kecenderungan terjadinya peningkatkan konsumsi BK.
dengan uji lanjut Tukey pada taraf nyata 5% dari masing-masing perlakuan disajikan pada Tabel 6, Gambar 12. dan Gambar 13. di bawah ini.
[image:64.595.150.479.262.449.2]Pada Gambar 11. menunjukkan bahwa perlakuan R1 berbeda nyata (p<0,05) paling tinggi 9,69% terhadap kondisi pH rumen, sedangkan untuk perlakuan