POTENSI BAKTERI ENDOFIT SEBAGAI AGENS
PENGENDALI PENYAKIT BUSUK CABANG
(
Septobasidium
sp.) PADA LADA
MULIANI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Potensi Bakteri Endofit sebagai Agens Pengendali Penyakit Busuk Cabang (Septobasidium sp.) pada Lada adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2016
Muliani
RINGKASAN
MULIANI. Potensi Bakteri Endofit sebagai Agens Pengendali Penyakit Busuk Cabang (Septobasidium sp.) pada Lada. Dibimbing oleh BONNY PW SOEKARNO dan ABDUL MUNIF.
Penyakit busuk cabang lada yang disebabkan oleh Septobasidum sp. tergolong penyakit baru dan berpotensi merusak pertanaman lada di Kalimantan Barat. Gejala penyakit busuk cabang Septobasidium sp. pada tanaman lada tergantung pada stadia patogen. Gejala stadia awal respon tanaman tidak menunjukan gangguan pada daun atau cabang tetap segar dan hijau, stadia lanjut bagian tanaman yang terinfeksi terutama daun atau cabang akan rontok secara bertahap sampai tanaman mati. Penyakit busuk cabang lada ditandai dengan adanya rizomorf/miselium berwarna coklat kemerahan yang menginfeksi pada bagian cabang. Miselium dapat menyebar ke seluruh cabang dan mengakibatkan kematian jaringan tanaman lada. Penyakit ini juga sering disebut penyakit ganggang pirang, mati ranting, penyakit capit udang, penyakit hawar lembut (Serawak Malaysia), felt fungi, dan velvet blight. Penelitian ini bertujuan mendapatkan bakteri endofit asal lada yang potensial sebagai agens pengendali hayati penyakit busuk cabang dan pemacu pertumbuhan pada tanaman lada.
Penelitian dilaksanakan dari bulan Agustus 2013 sampai bulan April 2015 di Laboratorium Mikologi, Laboratorium Nematologi Tumbuhan Departemen Proteksi Tanaman Institut Pertanian Bogor, Laboratorium Penyakit Tanaman Fakultas Pertanian Universitas Tanjungpura Pontianak, dan Laboratorium Biologi & Kesehatan Tanah Balai Penelitian Tanah Bogor, serta kebun petani di Kecamatan Galing Kabupaten Sambas. Penelitian meliputi tahap in vitro dan in vivo. Tahap in vitro meliputi eksplorasi, uji reaksi hipersensitif, karakterisasi fisiologi dan uji antibiosis bakteri endofit. Eksplorasi bakteri endofit berasal dari contoh akar, cabang, dan daun dari tanaman lada sehat (tidak bergejala) di antar tanaman sehat, tanaman lada sehat di antara tanaman lada sakit, dan lada liar (lada hutan). Isolasi bakteri endofit dari akar batang dan daun dilakukan dengan cara sterilisasi permukaan menggunakan larutan NaOCL 10% dan alkohol 70%. Isolat bakteri yang didapat dimurnikan dan diindentifikasi berdasarkan tipe morfologi koloni bakteri kemudian dilakukan uji reaksi hipersensitif. Tahapan selanjutnya isolat bakteri endofit tersebut dilakukan karakterisasi aktivitas enzim kitinolitik, produksi IAA, penambat nitrogen, pelarut fosfat, pelarut kalium dan produksi senyawa fluorescent. Isolat bakteri endofit diuji antibiosis terhadap Septobasidium
sp. dengan metode kultur ganda media PDA. Tahap in vivo meliputi uji kemampuan penghambatan isolat bakteri endofit terhadap Septobasidium sp. pada lada secara langsung, uji pemacu pertumbuhan tanaman, dan uji pemacu ketahanan tanaman menggunakan rancangan acak lengkap (RAL). Metode inokulasi bakteri endofit dengan cara perendaman bibit lada dalam suspensi bakteri endofit.
hipersensitif di daun tembakau, sehingga 23 isolat bakteri endofit yang yang bersifat non patogenik digunakan pada uji selanjutnya. Hasil karakterisasi dari 23 isolat bakteri tersebut, 20 isolat mampu memproduksi IAA, 3 isolat dapat menambat nitrogen, 10 isolat dapat melarutkan fospat, 6 isolat mempunyai aktifitas kitinolitik, 4 isolat mempunyai senyawa fluorescent dan semua isolat bakteri endofit tersebut tidak mampu melarutkan kalium. Hasil uji antibiosis terhadap Septobasidium sp. menunjukkan bahwa 8 isolat, yaitu isolat bakteri SHA3, SHC9, SKA1, SKA3, SKA4, SKD8, SKD10 dan LHD8 mampu menghambat pertumbuhan Septobasidium sp. antara 30.44-78.89% pada media PDA. Hasil penelitian in vivo, hasil uji di lapangan menunjukkan bahwa isolat SHC9, SKA3, SKD8, SKD10 dan LHD8 berpengaruh nyata terhadap penekanan hifa Septobasidium sp. pada tanaman lada dan berpengaruh nyata meningkatkan pertumbuhan tanaman lada.
Hasil penelitian yang diperoleh diharapkan dapat menjadi sumber informasi mengenai potensi bakteri endofit asal tanaman lada sebagai agens pengendali penyakit busuk cabang, agens pemacu pertumbuhan dan agens pamacu ketahanan tanaman lada.
SUMMARY
MULIANI. Potential of Endophytic Bacteria as Control Agents for Rot Disease Branch (Septobasidium sp.) on Pepper. Supervised by BONNY PW SOEKARNO and ABDUL MUNIF.
Pepper branch rot disease caused by Septobasidum sp. is relatively new disease which potentially damages pepper plantation in West Borneo. The symptoms of the disease depend on the stadia of pepper plant pathogens. The symptoms of early stage response do not show any interference to leaves and branches; therefore, they remain fresh and green. Further stadia, however, show certain infections on leaves and branches that lead them to fall off until the plant dies gradually. The disease is indicated by the presence of rizomorf or reddish brown mycelium that infects the branch. The mycelium spread to the entire branches and cause the pepper plant to die. The disease is also frequently called „blonde algae (ganggang pirang) disease‟, „dead twigs (mati ranting)‟, „pincers of
shrimp (capit udang) disease‟, soft blight (hawar lembut) disease (in Sarawak, Malaysia)‟, felt fungi, and velvet blight.
This study aims to obtain endophyticbacteria which originate from pepper plant as a potential biological control against branch rot and as plant growth promoting bacteria on pepper. The research was conducted from August 2013 to April 2015 in a farmer‟s pepper plantation in Galing, Sambas District of West Kalimantan. The samples were tested using three different laboratories–Mycology Laboratory, Nematologi Laboratory of Plant Protection Department of Bogor Agricultural University, Plant Disease Laboratory of Tanjungpura University, and Biology and Soil Laboratory of Indonesian Soil Research Institute in Bogor. The research applies in vitro and in vivo steps. In vitro phases include exploration, pathogenicity test, physiology characterization, and endophytic antibiosis test. Exploration of endophytic bacteria from samples of roots, branches, and leaves of healthy pepper (asymptomatic) were taken from among group of healthy plants, from among sick pepper and from wild pepper. Isolation of endophytic bacteria from of roots, stems, and leaves was done by sterilizing using solution of NaOCl 10% and 70% alcohol. The isolated bacteria are then refined and identified based on the type of colony morphology and then are diagnosed through hypersensitivity reactions test. The endophytic bacteria are then characterized based on their enzyme chitinolytic activity, IAA production, nitrogen fixation, phosphate and potassium solubilization, and production of fluorescent pigments. Then, the bacteria are antibiotic sensitivity tested toward Septobasidium sp. using PDA media dual culture method. In vivo phases include tests of inhibition capabilities of endophytic bacteria directly toward Septobasidium sp. and also test of growth and resistance enhancer using complete randomized design. In addition, endophytic bacteria inoculation method applied pepper seedlings immersion into endophytic bacteria suspension.
experiment. The characterization test of the 23 isolates resulted 20 isolates which were able to produce IAA, 3 isolates with nitrogenfixation, 10 with solubilization phosphate activities, 6 with chitinolytic activities, 4 with fluorescent pigments. All of the isolates are not able to produce potassium solubilization activities. Results of antibiosis test against Septobasidium sp. showed 8 isolates (SHA3, SHC9, SKA1, SKA3, SKA4, SKD8, SKD10 and LHD8) which are able to inhibit the growth of Septobasidium sp. between 30.44-78.89% on PDA. In vivo showed that isolates SHC9, SKA3, SKD8, SKD10 and LHD8 significantly reduced the growth of hyphae of Septobasidium sp. and significantly increase the growth of pepper plants.
The results obtained are expected to be a source of information about the potential of endophytic bacteria as controlagents for rot branch disease of plant origin pepper, growth promotingagentand resistanceagent pepper plant.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
POTENSI BAKTERI ENDOFIT SEBAGAI AGENS
PENGENDALI PENYAKIT BUSUK CABANG
(
Septobasidium
sp.) PADA LADA
MULIANI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PRAKATA
Puji syukur penulis ucapkan ke khadirat Allah SWT atas rahmat dan karunia-Nya sehingga Tesis ini yang berjudul “Potensi Bakteri Endofit sebagai Agens Pengendali Penyakit Busuk Cabang (Septobasidium sp.) pada Lada” dapat diselesaikan.
Penulis menyampaikan penghargaan dan terima kasih kepada Dr Ir Bonny PW Soekarno MS selaku ketua komisi pembimbing dan Dr Ir Abdul Munif MscAgr selaku anggota komisi pembimbing atas bimbingan, saran, dan arahannya selama proses penelitian hingga penulisan tesis ini.
Terima kasih penulis disampaikan kepada Departemen Proteksi Tanaman Fakultas Pertanian IPB, teman-teman angkatan 2012 dan di Forum Wacana Entomologi-Fitopatologi atas semua bantuan, do‟a dan dorongannya kepada penulis. Rasa hormat dan terima kasih yang mendalam penulis haturkan kepada Ayahanda dan Ibunda atas kasih sayang dan do‟anya selama ini untuk kesuksesan penulis, Penulis mendo‟akan semoga Allah SWT melimpahkan rahmat dan karunia-Nya kepada kita semua.
Akhirnya, penulis berharap semoga tesis ini memberikan manfaat bagi pengembangan ilmu pengetahuan terutama dibidang Fitopatologi.
Bogor, Februari 2016
DAFTAR ISI
Penyakit Busuk Cabang Lada 5
Bakteri Endofit sebagai Agens Pengendali Hayati 6 Bakteri Endofit sebagai Agens Penginduksi Ketahanan Tanaman 9 Bakteri Endofit sebagai Agens Pemacu Pertumbuhan Tanaman 10 3 BAHAN DAN METODE
Tempat dan Waktu Penelitian 12
Pengambilan Tanaman Contoh 12
Isolasi Septobasidium sp. 12
Eksplorasi Bakteri Endofit pada Lada 12
Uji Reaksi Hipersensitif 13
Karakterisasi Fisiologi Bakteri Endofit 14 Uji Kemampuan Antibiosis Bakteri Endofit pada Septobasidium sp. 15 Uji Kemampuan Bakteri Endofit sebagai Penghambat
Septobasidium sp. pada lada
15 Uji Kemampuan Bakteri Endofit sebagai Pemacu Pertumbuhan
Tanaman
16
Uji Kemampuan Bakteri Endofit sebagai Pemacu Ketahanan Tanaman 16 4 HASIL DAN PEMBAHASAN
Eksplorasi Bakteri Endofit pada Lada 18
Karakterisasi Fisiologi Bakteri Endofit 19
Kemampuan Antibiosis Bakteri Endofit terhadap Septobasidium sp. 21 Kemampuan Bakteri Endofit terhadap Penghambatan
Septobasidium sp. pada lada
23
DAFTAR TABEL
1 Kerapatan populasi bakteri dan jumlah isolat bakteri endofit dari tanaman lada
18
2 Keragaman bakteri endofit 19
3 Karakterisasi fisiologi isolat bakteri endofit asal tanaman lada 20 4 Kemampuan antibiosis bakteri endofit terhadap Septobasidium sp.
secara in vitro
22 5 Pengaruh penghambatan bakteri endofit terhadap hifa Septobasidium sp.
pada lada
23 6 Pengaruh perlakuan isolat bakteri endofit terhadap pertambahan jumlah
tunas tanaman lada
24
7 Pengaruh perlakuan isolat bakteri endofit terhadap pertambahan tinggi tanaman lada
25 8 Kejadian penyakit Septobasidium sp. pada tanaman lada 25 9 Pengaruh bakteri endofit terhadap aktivitas peroksidase (POD) pada
tanaman lada 3 bulan setelah inokulasi
26
DAFTAR GAMBAR
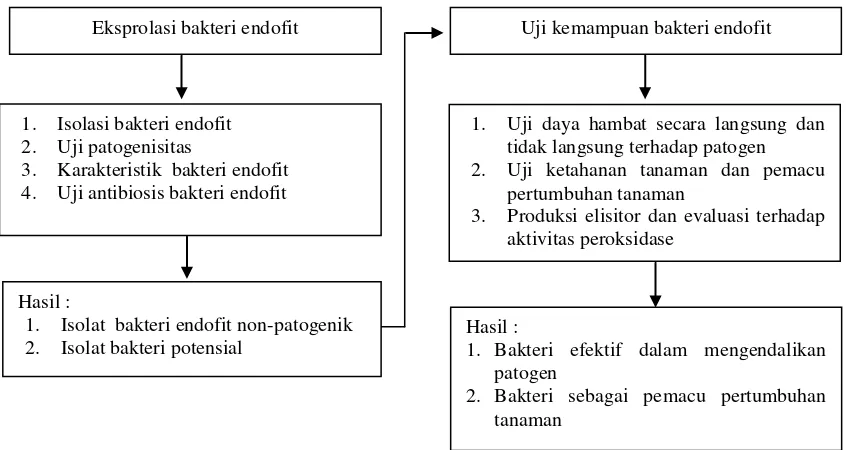
1 Diagram alir penelitian “Potensi bakteri endofit untuk mengendalikan penyakit busuk cabang (Septobasidium sp.) pada lada”
4 2 Gejala dan tanda penyakit busuk cabang Septobasidium sp. pada lada 5 3 Skema uji antibiosis bakteri endofit terhadap Septobasidium sp. 15 4 Daya hambat isolat bakteri endofit terhadap Septobasidium sp. 22
DAFTAR LAMPIRAN
1 Data isolat bakteri endofit lada: jumlah koloni, kerapatan populasi bakteri, frekuensi kemunculan isolat, dan indeks keragaman
37 2 Uji reaksi hipersensitif dan ciri-ciri mofologi bakteri endofit lada 38 3 Daya hambat isolat bakteri endofit terhadap Septobasidium sp. pada
lada
39
4 Pengaruh isolat bakteri endofit terhadap pertumbuhan tanaman lada 40 5 Analisis keragaman penghambatan isolat bakteri terhadap
Septobasidium sp. pada lada
41
6 Analisis keragaman pengaruh isolat bakteri pertambahan tunas lada 41 7 Analisis keragaman pengaruh isolat bakteri terhadap pertambahan
panjang lada
42
8 Analisis keragaman pengaruh bakteri endofit terhadap aktivitas peroksidase (POD) pada tanaman lada 3 bulan setelah inokulasi
1
1 PENDAHULUAN
Latar Belakang
Lada (Piper nigrum L.) merupakan salah satu komoditas ekspor di sektor perkebunan yang dapat memberikan kontribusi devisa bagi Indonesia. Dua produk lada Indonesia yang paling dikenal di pasar dunia adalah lada hitam (black pepper) dan lada putih (white pepper). Bentuk pengusahaan lada di Indonesia adalah berupa perkebunan rakyat dan perkebunan swasta.
Produksi nasional lada setiap tahun mencapai 91 039 ton pada tahun 2013 dengan luas areal tanam 171 920 ha, sedangkan pada tahun 2014 produksi menjadi 91 908 ton dengan luas areal 172 034 ha, dengan rata-rata produktivitas nasional 0.8 ton/ha. Daerah sentra produksi lada utama di Indonesia adalah Provinsi Lampung, Bangka Belitung, Kalimantan Barat, Kalimantan Timur, Bengkulu dan Sulawesi Selatan (Dirjenbun 2014). Produksi lada di Kalimantan Barat menurun setiap tahun seiring dengan menurunnya luas areal tanam. Tahun 2009 dengan produksi total mencapai 4 620 ton dengan luas areal tanaman 9 629 ha, sedangkan pada tahun 2013 total produksi 3 470 ton dengan luas areal tanam 7 107 ha. Tahun 2014 produksi menurun menjadi 3 416 ton dan luas areal tanam 7 229 ha, dengan jumlah petani 20 475 kepala keluarga (Disbun Kalbar 2014).
Penurunan produksi dan luas areal tanaman lada salah satunya disebabkan oleh serangan hama dan penyakit. Salah satu penyakit penting adalah penyakit busuk cabang lada yang disebabkan oleh Septobasidium sp. yang menyerang tanaman lada di Kalimantan Barat (Suswanto 2009). Tahun 2010 luas serangan
Septobasidium sp. mencapai 997.98 ha terdiri atas serangan ringan 794.7 ha dan serangan berat 203.28 ha dari luas areal pengamatan 8 514 ha di 5 kabupaten dari 13 Kabupaten di Kalimantan Barat (BPTP Kalbar 2012). Serangan tertinggi terjadi pada tanaman lada di Kabupaten Bengkayang dengan keparahan penyakit sampai 100% (Rianto 2014). Kerugian akibat penyakit hawar beludru setiap bulan di Kabupaten Bengkayang diperkirakan dapat mencapai Rp 237 juta (BPTP Kalbar 2012).
Penyakit busuk cabang lada atau hawar beludru (velvet blight) pertama kali ditemukan pada tanaman lada di India dan sudah tersebar di India, Malaysia dan Indonesia (Sarma et al. 2011; IPC 2016). Penyakit ini sudah dilaporkan pada pertanaman lada di Bangka, Kalimantan Timur dan Kalimantan Barat (Sarma et al. 2011). Di Kalimantan Barat penyakit busuk cabang lada tergolong penyakit baru dan minor yang berpotensi merusak pertanaman lada (Suswanto dan Rianto 2014). Petani lada sering menyebut penyakit ini dengan sebutan penyakit ganggang pirang, mati ranting, penyakit capit udang (Sambas, Kalimantan Barat), penyakit hawar lembut (Serawak, Malaysia) (Suswanto 2009). Tahun 2004 saat awal penyakit busuk cabang atau hawar beludru umumnya dijumpai pada kebun lada yang tidak terawat (Suswanto dan Rianto 2014).
2
pada bagian cabang. Miselium dapat menyebar ke seluruh cabang dan mengakibatkan kematian jaringan tanaman lada (Suswanto dan Rianto 2014). Miselium akan membentuk 3 lapisan yaitu lapisan pertama berupa jalinan miselia yang melekat pada permukaan jaringan tanaman. Lapisan kedua berupa talus yang tumbuh vertikal seperti pilar sehingga menciptakan ruang antara lapisan bawah dan atas. Lapisan ketiga berupa jalinan himenium yang terbentuk di bagian ujung pilar sehingga memberi kesan sebagai atap penutup (dome) (Gomez dan Horovitz 2001; Henk 2005). Perkembangan penyakit akan berlangsung cepat pada saat musim hujan, sedangkan pada musim kemarau perkembangan penyakit relatif lambat (Rianto 2014; Rianto et al. 2015).
Kerugian yang disebabkan oleh penyakit busuk cabang lada dapat menyebabkan batang/cabang mengering sehingga buah tidak berkembang lebih lanjut. Buah lada yang terserang tidak dapat dijadikan lada putih. Selain itu serangan pada tandan buah menyebabkan buah keriput. Perkembangan penyakit yang cepat ini disebabkan oleh faktor tanaman dan lingkungan yang mendukungnya (Rianto 2014). Sampai sekarang petani lada di Kalimantan Barat belum menemukan cara pengendalian penyakit busuk cabang lada secara tepat, baik secara kimiawi maupun pengendalian secara kultur teknis. Banyak petani mengunakan fungisida yang mengandung belerang (Cu) fungisida tidak mampu menekan perkembangan penyakit busuk cabang dan mengakibatkan tanaman menjadi gugur akibat keracunan Cu yang tinggi.
Penggunanan agens pengendali hayati bakteri endofit untuk mengendalikan penyakit busuk cabang lada belum banyak dilaporakan. Bakteri endofit
Arthrobacter spp., Bacillus megaterium, B. cereus, Enterobacter sp.
Pseudomonas putida, P. aeruginosa, Curtobacterium luteum, Micrococcus spp., dan Serratia spp. pada tanaman lada mempunyai kemampuan menekan pertumbuhan penyakit busuk pangkal batang lada (BPB) yang disebabkan oleh
Phytophthora capsici (Aravind et al. 2009a; Aravind et al. 2009b). Bakteri endofit dilaporkan mengendalikan penyakit batang dan penyakit akar yang disebabkan
Fusarium oxysporum dan nematoda secara in vitro dan in vivo (Munif dan Harni 2011; Harni dan Munif 2012; Edward et al. 2013). Berdasarkan hasil laporan tersebut diduga bakteri endofit asal lada dapat menekan pertumbuhan penyakit busuk cabang Septobasidium sp.
Kado (1992) mendefinisikan bakteri endofit sebagai bakteri yang hidup di dalam jaringan tumbuhan tanpa menimbulkan kerugian dan tanaman memperoleh manfaat atas keberadaannya. Menurut Hallmann et al. (1997), bakteri endofit dapat diisolasi dari jaringan tanaman yang telah dilakukan sterilisasi permukaan atau diekstraksi dari dalam tanaman, dan bakteri ini tidak merugikan tanaman. Bakteriendofit adalah bakteri yang hidup pada di dalam jaringan tanaman sehat tanpa menimbulkan gejala penyakit pada inang (Carroll 1991). Kriteria untuk mengenali bakteri endofit juga telah dipublikasikan oleh Reinhold-Hurek dan Hurek (1998) yaitu bakteri endofit diisolasi dari jaringan tanaman yang permukaannya telah disterilisasi dan adanya bukti mikroskopik untuk memvisualisasikan tanda keberadaan bakteri di dalam jaringan tanaman.
3
melarutkan fosfor (P), mendegradasi besi (Fe) sebagai siderofor dan mensinteis fitohormon seperti IAA (Indole-3-aceticacid) (Furnkranz et al. 2009).
Eksplorasi bakteri endofit sebagai agens hayati yang potensial sangat penting dilakukan. Bakteri endofit sudah banyak dilaporkan sebagai agens pengendali hayati, meningkatkan pertumbuhan tanaman dan menginduksi ketahanan terhadap patogen (Hallmann et al. 1997; Jasim et al. 2013). Belum banyak laporan penggunaan bakteri endofit untuk mengendalikan penyakit busuk
Septobasidium sp. pada tanaman lada. Sementara itu, penyakit busuk cabang lada merupakan penyakit penting pada tanaman lada di Kalimantan Barat yang dapat mengurangi produktivitas tanaman lada sehingga diperlukan menyusun strategi pengendalian penyakit.
Tujuan Penelitian
Penelitian ini bertujuan mendapatkan bakteri endofit asal lada yang potensial sebagai agens pengendali hayati penyakit busuk cabang dan sebagai pemacu pertumbuhan tanaman lada.
Hipotesis
Diduga bakteri endofit mampu menekan dan mengendalikan penyakit busuk cabang pada lada, dapat memacu pertumbuhan tanaman dan memacu ketahanan tanaman lada secara in vitro dan in vivo.
Manfaat Penelitian
Hasil penelitian yang diperoleh diharapkan dapat menjadi sumber informasi mengenai potensi bakteri endofit asal tanaman lada sebagai agens pengendali penyakit busuk cabang, agens pemacu pertumbuhan dan agens pamacu ketahanan tanaman lada.
Ruang Lingkup Penelitian
4
Gambar 1 Diagram alir penelitian “Potensi bakteri endofit untuk mengendalikan penyakit busuk cabang (Septobasidium sp.) pada lada”
Eksprolasi bakteri endofit Uji kemampuan bakteri endofit
1. Isolasi bakteri endofit 2. Uji patogenisitas
3. Karakteristik bakteri endofit 4. Uji antibiosis bakteri endofit
1. Uji daya hambat secara langsung dan tidak langsung terhadap patogen
2. Uji ketahanan tanaman dan pemacu
pertumbuhan tanaman
3. Produksi elisitor dan evaluasi terhadap aktivitas peroksidase
Hasil :
1. Isolat bakteri endofit non-patogenik 2. Isolat bakteri potensial
Hasil :
1. Bakteri efektif dalam mengendalikan
patogen
2. Bakteri sebagai pemacu pertumbuhan
5
2 TINJAUAN PUSTAKA
Penyakit Busuk Cabang Lada
Penyakit busuk cabang lada merupakan penyakit yang menimbulkan kerugian besar pada tanaman lada di Kalimantan Barat. Penyakit busuk cabang lada dapat menyerang semua stadia tanaman lada baik tanaman menghasilkan dan tanaman belum menghasilkan atau saat masa pembibitan. Penyebab penyakit ini adalah Septobasidum sp. dengan tanda penyakit di lapangan pada tanaman sakit berupa lapisan miselium yang menyelimuti bagian batang, cabang, daun maupun buah lada (Gambar 2). Infeksi patogen lebih sering terjadi pada ruas batang (node) yang menghasilkan akar samping (sulur panjat) dibandingkan dengan batang tanpa akar samping (Suswanto 2009).
Gambar 2 Gejala dan tanda penyakit busuk cabang Septobasidium sp. pada lada. A, Miselium Septobasidium sp. sudah membungkus pada cabang; B, Gejala stadia awal Septobasidium sp. pada ranting.
Perkembangan penyakit busuk cabang Septibasidium sp. akan berlangsung cepat jika terjadi pada musim hujan, sedangkan pada musim kemarau perkembangan penyakit relatif lambat. Miselium berkembang setelah terjadinya hujan akan terlihat pertumbuhan rizomorf yang keluar dari himenium yang telah mengalami keretakan (Rianto et al. 2015).
Miselium membentuk 3 lapis yang terbentuk pada jaringan tanaman disebut basidiomata. Basidiomata terdiri lapisan pertama berupa jalinan miselia yang melekat pada permukaan jaringan tanaman yang berwarna coklat kemerahan. Lapisan kedua berupa talus yang tumbuh vertikal seperti pilar sehingga menciptakan ruang antara lapisan bawah dan atas. Lapisan ketiga berupa jalinan himenium yang terbentuk di bagian ujung pilar sehingga memberi kesan sebagai atap penutup, dimana himenium akan menghasilkan basidium yang berbentuk 4 sekat (Gomez dan Horovitz 2001; Henk 2005; Lu dan Gou 2009). Mekanisme kematian tanaman akibat infeksi patogen Septobasidum sp. pada lada bersifat parasit fakultatif yaitu cendawan bertahan dalam kurun waktu lama sebagai saprofit dan hanya dalam kondisi tertentu bersifat parasitik (Suswanto 2009).
Kalimantan Barat memiliki iklim hujan tropis yang memiliki bulan basah mencapai 9 bulan dengan ciri utama antara bulan basah dan kering sulit dibedakan. Kejadian penyakit busuk cabang terutama antara bulan
6
Februari yang merupakan periode pertumbuhan miselium Septobasidium sp. Serangan yang sudah meluas ini berkaitan erat dengan kondisi tanaman dan juga cuaca yang mendukung perkembangan patogen (Suswanto 2009). Kelembaban udara juga berperan dalam menentukan infeksi, keparahan dan insidensi penyakit busuk cabang atau hawar beludru di lapangan dengan 86% kelembaban udara merupakan kondisi ideal untuk mendukung perkembangan penyakit. Kelembaban udara di sekitar pohon dipengaruhi oleh angin, penyinaran dan juga suhu. Suhu selain mempengaruhi perkecambahan spora juga bisa menentukan lama periode basah. Semakin tinggi suhu akan mengurangi lama periode basah (Rianto 2014).
Septobasidium sp. hidup bersimbiosis dengan serangga kutu sisik Unaspis
sp. meskipun belum diketahui hubungan antara keduanya (Couch 1930).
Septobasidium sp. mampu tumbuh pada kisaran pH 3-6, pertumbuhan optimum pada pH 5.5, suhu optimum perkembangan miselia Septobasidium sp. pada suhu 30.2oC, viabilitas tubuh buah atau miselium mampu bertahan selama 90 hari saat di simpan didalam tanah (Rianto 2014).
Septobasidium sp. termasuk dalam divisi: Basidiomycota, kelas:
Pucciniomycetes, ordo: Septobasidiales, famili Septobasidiaceae, genus:
Septobasidium (Alexopoulos dan Mims 1979).Septobasidium sp. yang memiliki ciri basidium bersekat melintang dan probasidium berdinding tebal sehingga jamur ini memiliki ketahanan yang baik terhadap kondisi lingkungan ekstrim (Lu dan Guo 2009). Menurut Gomez dan Horovitz (2001) ciri-ciri morfologi miselium
Septobasidium sp. bersekat warna hialin-kecoklatan, modifikasi miselium berupa haustorium berbentuk gelendong, miselium akan membentuk probasidium bulat-oval dan basidium dengan basidiospora yang dapat bertunas meski masih menempel pada basidium. Ciri lain miselium Septobasidium sp. tidak membentuk sel kait (clamp connection). Beberapa spesies telah dilaporkan sebagai patogen tumbuhan seperti S. pilosum, S. bogoriense, S. theae, S. pseudopedicilatum yang menyerang mangga, teh, lada dan jeruk (Couch 1930).
Bakteri Endofit sebagai Agens Pengendali Hayati
Bakteri endofit merupakan bakteri yang hidup dalam jaringan tanaman tanpa menimbulkan gejala penyakit pada tanaman tersebut dan dapat diisolasi dari jaringan (Hallmann et al. 1997). Bakteri ini dapat hidup pada bagian tanaman seperti akar, batang, daun, dan buah dan jaringan tanaman yang dikolonisasi bakteri endofit memperoleh nutrisi dan perlindungan dari tanaman inangnya (Bacon dan Hinton 2006).
Bakteri endofit banyak diteliti sebagai agens pengendali hayati penyakit tanaman. Peranan bakteri endofit pada tanaman sebagai agens pengendali penyakit telah dilaporakan beberapa peneliti. Aravind et al. (2009a) melaporkan bahwa aplikasi bakteri endofit Arthrobacter spp., B. megaterium, B. cereus, Enterobacter sp. P. putida, P. aeruginosa, C. luteum, Micrococcus spp., dan
7
disebabkan oleh F. oxysporum. Belum ada laporan penggunaan agens hayati untuk mengendalikan penyakti busuk cabang lada yang disebabkan oleh
Septobasidium sp. Banyak spesies dari bakteri endofit yang bersifat antagonis di antaranya B. subtilis, Ralstonia solanacearum, P. fluorescens, P. putida,
Agrobacterium radiobacter, A. tumifaciens, Erwinia herbicola, dan Serratia marcescens (Hallmann et al. 1997).
Bakteri endofit Gram positif dan Gram negatif telah diisolasi dari beberapa jenis jaringan berbagai jenis tumbuhan. Populasi bakteri endofit melimpah dan beragam. Bakteri endofit masuk ke dalam jaringan tanaman terutama melalui zona akar, bagian tanaman, seperti bunga, batang, dan kotiledon. Bakteri endofit dapat bersifat obligat ataupun fakultatif dalam mengkolonisasi inangnya. Meskipun bakteri ini memiliki kisaran inang yang luas, namun ada beberapa bakteri endofit yang hanya dapat berasosiasi dengan inang dari famili tertentu. Simbiosis antara tanaman dengan bakteri endofit bersifat netral, mutualisme, atau komensialisme (Bacon dan Hinton 2006).
Bakteri endofit merupakan agens hayati yang banyak dikembangkan saat ini untuk pengendalian berbagai penyakit tanaman. Bakteri endofit dilaporkan menghasilkan antibiotik dan enzim pendegradasi yang dapat menghambat perkembangan patogen secara in vitro (Hallmann 2001; Long et al. 2003; Sessitsch et al. 2004), meningkatkan ketahanan tanaman terhadap patogen dengan menginduksi reaksi ketahanan tanaman (Benhamou et al. 1996; Kloepper dan Ryu 2006; Harish et al. 2008), dan memacu pertumbuhan tanaman (Sessitsch et al. 2004; Sturz et al. 2010).
Bakteri endofit dapat ditemukan di dalam jaringan akar, batang, umbi, daun, benih, dan buah tanaman (Hallmann et al. 1997). Pada banyak tanaman, akar mempunyai jumlah endofit lebih banyak dibandingkan dengan jaringan diatas permukaan (Rosenblueth dan Romero 2004). Kerapatan populasi bakteri endofit pada akar adalah 105, batang 104, dan daun sekitar 103 cfu g-1 (Hallmann et al. 1997). Bakteri endofit umumnya berada dalam ruang interseluler dan pembuluh xilem (Reinhold-Hurek dan Hurek 1998). Compant et al. (2005) melaporkan bahwa strain Bulkholderia sp. ditemukan dalam pembuluh xilem dan ruang
substomatal pada tanaman Vitis vinifera. Belum diketahui apakah pembuluh xilem hanya sebagai tempat transportasi bakteri endofit ke bagian lain dari jaringan tanaman atau melakukan perbanyakan diri dalam pembuluh xilem (Hallmann et al. 1997).
Mekanisme bakteri endofit sebagai agens pengendali hayati di antaranya memproduksi bahan campuran antimikrob, kompetisi ruang dan nutrisi, kompetisi mikronutrisi seperti zat besi dan produksi siderofor sehingga tanaman inang menjadi resisten (Bacon dan Hinton 2006). Disamping itu, beberapa bakteri endofit juga menghasilkan senyawa antibiotik seperti phenazines, pyrolnitrin, pycocyanin, phloroglucianol dan enzim ekstraseluler serta asam pseudomonat. Keanekaragaman spesies bakteri endofit merefleksikan banyaknya mekanisme yang mungkin terjadi untuk melawan patogen, yang memungkinkan patogen memproduksi senyawa antibiotik untuk melawan bakteri endofit tersebut (Hallmann dan Breg 2006).
8
karena enzim ini dapat mendegradasi dinding sel patogen yang terdiri atas kitin seperti dinding sel cendawan, nematoda, dan serangga. Enzim protease yang dihasilkan oleh bakteri selain berperan dalam mendegradasi dinding sel patogen, juga digunakan untuk melakukan penetrasi secara aktif ke dalam jaringan tanaman. Benhamou et al. (1996) melaporkan enzim selulase dan pektinase yang dihasilkan P. fluorescens dapat digunakan oleh bakteri tersebut untuk mengkolonisasi daerah interseluler jaringan korteks akar, sehingga terjadi penghambatan invasi patogen. Supramana et al. (2008) menyatakan bahwa P. putida dapat menekan perkembangan penyakit tanaman dengan persaingan ruang dan nutrisi (unsur karbon), merangsang pertumbuhan tanaman dan menginduksi ketahanan tanaman. Huili et al. (2009) melaporkan bahwa Bacillus sp. strain CHM1 dapat menghambat pertumbuhan miselium F. oxysporum dan Rhizoctonia solani dalam uji in vitro. Satu agens biokontrol mungkin memiliki lebih dari satu mekanisme.
Keberhasilan pengembangan agens hayati untuk mengendalikan patogen tanaman adalah tergantung dalam pemilihan jenis dan sumber agens hayati yang akan dikembangkan. Pada umumnya jenis agens hayati yang dikembangkan adalah mikrob alami, baik yang hidup sebagai saprofit di dalam tanah, air dan bahan organik, maupun yang hidup di dalam jaringan tanaman (endofit) yang bersifat menghambat pertumbuhan dan berkompetisi dalam ruang dan nutrisi dengan patogen sasaran, atau bersifat menginduksi ketahanan tanaman. Tahap pertama dalam pengembangan agens hayati adalah seleksi agens hayati non-patogen. Seleksi dilakukan dengan mengisolasi calon agens hayati dari populasi alaminya, seperti kelompok mikrob saprofit atau non patogen dari tanah atau dari bagian tanaman (Baker dan Cook 2007).
Bakteri endofit mengolonisasi relung hidup yang sama dengan patogen tetapi tidak menimbulkan kerusakan pada inangnya (Sigee 1993). Bakteri ini dapat berperan sebagai agens pengendali hayati jika bakteri endofit telah berasosiasi dengan tanaman sebelum patogen menyerang tanaman tersebut (Bacon dan Hinton 2006). Cara kerja bakteri endofit sebagai agens pengendali hayati antara lain memproduksi bahan campuran antimikrob, kompetisi ruang dan nutrisi, kompetisi mikro nutrisi seperti zat besi dan produksi siderofor, serta dapat menyebabkan tanaman inang menjadi resisten (van Loon 1997).
9
Beberapa bakteri endofit dilaporkan mampu sebagai agens pengendali hayati penyakit tanaman. Wei et al. (1991) melaporkan bahwa P. fluorescens
strain 68-4 yang diaplikasikan pada benih mentimun mampu mengolonisasi bagian dalam jaringan tanaman dan meningkatkan ketahanan secara sistemik terhadap penyakit antraknosa. Bakteri S. marcescens 90-166 dilaporkan dapat menghasilkan asam salisilat yang digunakan untuk menginduksi ketahanan secara sistemik pada tanaman tembakau yang diinfeksi oleh P. syringae pv. tabaci (Press
et al. 1997).
Bakteri Endofit sebagai Agens Penginduksi Ketahanan Tanaman
Induksi ketahanan tanaman adalah fenomena terjadinya peningkatan ketahanan tanaman terhadap infeksi patogen akibat rangsangan. Ketahanan ini merupakan perlindungan tanaman yang didasari pada mekanisme ketahanan yang dirangsang oleh perubahan metabolik. Induksi ketahanan tanaman terhadap nematoda dapat melalui peningkatan asam salisilat, peroksidase, fitoaleksin,
pathogenesis related protein (PR) dan senyawa fenolik (Tian et al. 2007). Mekanisme pengendalian yang lain adalah kompetisi tempat dan makanan dengan patogen (Sikora et al. 2007).
Tanaman mempertahankan diri terhadap infeksi patogen dalam bentuk struktur anatomis dan sistem fisiologis yang diaktifkan oleh suatu sinyal (induksi ketahanan). Pertahanan dalam bentuk sistem fisiologis ini bersifat laten dan hanya terjadi apabila ada penginduksi yang tepat (van Loon 1997), seperti infeksi patogen non kompatibel atau terserapnya senyawa bioaktif (Sequeira et al. 1977).
Induksi ketahanan tanaman merupakan aktivitas pertahanan tanaman untuk melindungi diri dari patogen atau hama melalui pengaktifan mekanisme ketahanan tanaman (Ouchi 1983). Mekanisme pertahanan tanaman terjadi akibat perlakuan agens penginduksi ketahanan dan infeksi challenge. Agens penginduksi akan diterima dan dikenali oleh reseptor tanaman yang berada diluar dan/atau pada membran sel. Agens penginduksi ketahanan bisa berperan sebagai sinyal itu sendiri atau hanya memacu sintesis sinyal tertentu yang ditransduksikan ke bagian tanaman lain. Sinyal tersebut diproduksi di satu bagian tanaman dan berperan di bagian lain. Transduksi sinyal dapat ditransfer secara intraseluler dan interseluler sehingga menyebabkan perlindungan sistemik. Beberapa sinyal yang terlibat dalam induksi ketahanan adalah asam salisilat (SA), asam jasmonat, sistemin, 2,6 dichloro-isonicotinic (Steiner dan Schönbeck 1995).
Pengaktifan reaksi ketahanan ditandai dengan adanya perubahan aktivitas gen tanaman yang diindikasikan oleh suatu metilasi DNA genom setelah aplikasi agens penginduksi tertentu. Dalam ketahanan terinduksi terjadi peningkatan aktivitas enzim dalam lintasan produksi metabolit tertentu seperti kitinase, β -1,3-glukanase, peroksidase dan pathogenesisrelated (PR). Sintesis protein-protein ini tampaknya diregulasi pada level mRNA (Park dan Kloepper 2000).
10
langsung antara bakteri penginduksi dengan patogen pada tempat infeksi. Menurut Sticher et al. (1997), beberapa hal yang membedakan antara mekanisme ISR dengan antagonisme, antara lain: tidak ada pengaruh toksik dari stimulan terhadap patogen, sifat induksi ketahanan menurun bila inhibitor (aktinomisin D) diaplikasikan, dan tidak ada korelasi dengan produksi metabolit toksik dari stimulan.
Mulya et al. (1996) melaporkan adanya kelompok bakteri yang mempunyai habitat pada rizosfer tanaman atau disebut dengan rizobakteri yang dapat mengolonisasi jaringan dan menginduksi ketahanan tanaman. Bakteri P. fluorescens PfG32R dapat hidup dalam jaringan daun tembakau dan menginduksi aktivitas enzim fenilalanin amoniliase. Kemampuan hidup dan menginduksi enzim tersebut diduga ada kaitannya dengan keberadaan gen yang memiliki homologi dengan gen asal patogen yang mengode hipersensitivitas danpatogenesitas, yaitu gen hrp. Rizobakteri diaplikasikan melalui pencampuran dengan tanah steril, perendaman akar bibit tanaman atau pelapisan biji (Kloeper dan Ryu 2006).
Faktor-faktor yang menentukan induksi ketahanan oleh rizobakteri meliputi produksi asam salisilat, siderofor, dan lipopolisakarida (LPS). Asam salisilat salah satu faktor penentu dalam induksi ketahanan tanaman tembakau terhadap tobacco mosaik virus (TMV) atau ketahanan kacang buncis terhadap Botrytis cinerea
(Sticher et al. 1997).
Lui et al (1995) menyatakan bahwa sebagai model analisis mekanisme induksi ketahanan tanaman sebagai agens pengendalian hayati dapat dilakukan dengan menyiramkan bakteri atau campuran bakteri ke tanah steril, pencelupan bakteri pada akar bibit tanaman, perendaman benih (coating) dengan suspensi bakteri sebelum disemaikan dan kemudian tanaman diinfeksi dengan patogen. Induksi ketahanan pada tanaman dapat diamati melalui indikator-indikator terjadinya proses induksi tersebut, seperti aktivitas enzim-enzim yang berhubungan dengan ketahanan tanaman dan senyawa-senyawa yang dapat berperan sebagai elicitor induksi ketahanan tanaman.
Bakteri Endofit sebagai Agens Pemacu Pertumbuhan Tanaman
Bakteri endofit dilaporkan juga dapat meningkatkan pertumbuhan tanaman (plant growth-promoting). Bakteri endofit yang mengolonisasi jaringan internal tanaman terlindungi dari stres lingkungan dan kompetisi dengan mikrob lain (Hallmann et al. 1997). Backman dan Sikora (2008) melaporkan bahwa keberadaan bakteri endofit di dalam jaringan tanaman selain berperan dalam perbaikan pertumbuhan tanaman (plant growth promotion), juga karena kemampuannya menghasilkan zat pemacu tumbuh, memfiksasi nitrogen, memobilisasi fosfat, dan berperan dalam kesehatan tanaman (plant health promotion).
11
Selain itu juga bakteri dapat mensintesis fitohormon seperti Indole-3-aceticacid (IAA), sitokinin dan menurunkan level etilen pada tanaman (Furnkranz et al. 2009).
Bakteri endofit juga dapat berperan sebagai pemacu pertumbuhan tanaman seperti kelompok plant growth promoting rhizobacteria (PGPR) yang dapat meningkatkan ketahanan tanaman inang terhadap serangan hama dan patogen (Ramamoorthy et al. 2001; Ryan et al. 2007). Hal ini dimungkinkan karena beberapa PGPR dapat masuk ke bagian dalam dari akar tanaman dan berasosiasi dengan bakteri endofit (Kloepper dan Ryu 2006). Beberapa bakteri endofit dilaporkan mampu sebagai agens pengendalian hayati penyakit tanaman. S. marcescens 90-166 dilaporkan dapat menghasilkan asam salisilat yang digunakan untuk menginduksi ketahanan secara sistemik pada tanaman tembakau yang diinfeksi oleh P. syringae pv. tabaci (Press et al. 1997). Dasteger et al. (2011) menyatakan bahwa bakteri endofit dari tanaman lada seperti S. nematodiphla
dapat memacu pertumbuhan tanaman lada. Jasim et al. (2013) melaporkan bakteri endofit dari tanaman lada Klebsiella sp. (PnB 10) dan Enterobacter sp. (PnB 11) mampu memacu pertumbuhan tanaman lada.
Ting et al. (2008) melaporkan bahwa isolat bakteri endofit Serratia
UPM39B3 dan cendawan endofit F. oxysporum UPM31P1 mampu meningkatkan pertumbuhan bibit pisang. Kemampuan PGPR untuk menjadi endofit dalam tanaman inangnya menjadi indikasi bahwa secara alami endofit mampu menginduksi respon ketahanan tanaman sama seperti induksi oleh PGPR. Kelebihan lain dari PGPR di antaranya: menambah fiksasi nitrogen di tanaman kacang-kacangan; memacu pertumbuhan bakteri fiksasi nitrogen bebas; meningkatkan ketersediaan nutrisi lain seperti fosfat, belerang, besi dan tembaga; memproduksi hormon tanaman; menambah bakteri dan cendawan yang menguntungkan, mengontrol hama dan penyakit tumbuhan dengan memproduksi siderofor, kitinase, selulase, antibiotik, sianida (Soesanto 2008). Bakteri endofit memacu pertumbuhan tanaman melalui sejumlah mekanisme, yaitu: aktivitas pelarutan fosfat, produksi auksin dan produksi siderofor (Verma et al. 2001; Lee
12
3 METODOLOGI PENELITIAN
Tempat dan Waktu Penelitian
Penelitian dilaksanakan dari bulan Agustus 2013 sampai bulan April 2015 di Laboratorium Mikologi, Laboratorium Nematologi Tumbuhan Departemen Proteksi Tanaman Institut Pertanian Bogor, Laboratorium Penyakit Tanaman Fakultas Pertanian Universitas Tanjungpura Pontianak, dan Laboratorium Biologi & Kesehatan Tanah Balai Penelitian Tanah Bogor, serta kebun petani di Kecamatan Galing Kabupaten Sambas.
Pengambilan Tanaman Contoh
Tanaman contoh sebagai sumber bakteri endofit diambil dari sentra tanaman lada di Kabupaten Sambas. Tanaman contoh diambil adalah tanaman yang sehat tidak tampak gejala dan tanda penyakit, hal ini mengindikasikan adanya mekanisme bakteri endofit di dalam jaringan tanaman. Tanaman sehat dipilih dari tanaman sehat (tidak bergejala) di antara tanaman sehat, tanaman sehat di antara tanaman sakit (bergejala) dan tanaman lada hutan. Tanaman tersebut masing-masing diambil pada bagian akar, cabang dan daun.
Isolasi Septobasidium sp.
Isolat Septobasidium sp. diperoleh dari koleksi Laboratorium Penyakit Tanaman Fakutas Pertanian Universitas Tanjungpura Pontianak. Isolat
Septobasidium sp. diperbanyak di media kentang dexstrose agar (1000 mL, akuades, 20 g agar, 20 g dexstrose).
Eksplorasi Bakteri Endofit pada Lada
Bakteri endofit diisolasi dari akar, batang dan cabang lada. Metode isolasi adalah dengan teknik sterilisasi permukaan mengikuti metode dari Edward et al. (2013). Bagian-bagian tanaman lada disterilisasi permukaan secara berurutan dengan cara bagian tanaman direndam di dalam NaOCl 3% selama 3 menit, lalu direndam dengan alkohol 70% selama 1 menit, dan kemudian dicuci sebanyak 3 kali dengan akuades steril. Keefektifan sterilisasi permukaan dapat dilihat dengan cara membiakkan 100 µ L akuades bekas pencucian akar yang ketiga pada media TSA 50% dan diinkubasi pada suhu ruang selama 24-48 jam.
13
bersisi 45 mL akuades steril, kemudian dilakukan pengenceran secara berseri sampai 10-3. Sebanyak 100 µ L dari pengenceran 10-1-10-3 diinokulasikan pada media TSA 50%, kemudian masing-masing pengenceran diinokulasikan pada 3 cawan petri.
Pengamatan terhadap pertumbuhan bakteri endofit dilakukan setelah masa inkubasi 24-48 jam. Pengamatan dilakukan terhadap jumlah koloni bakteri yang tumbuh dan tipe morfologi koloni (Cappucino dan Sherman 2013). Tipe morfologi koloni bakteri yang diamati yaitu: warna koloni, bentuk koloni (circular, irreguler, filamentous, rizoid), Elavasi (risaid, canvax, Flat, umbulate, craterifom), tepian koloni (entri, undelate, filiform, curled, lobate). Masing-masing koloni menunjukkan perbedaan morfologi dimurnikan kembali pada media TSA 100%. Isolat yang telah dimurnikan diuji patogenisitas.
Isolat-isolat bakteri endofit dari satu tanaman contoh yang didapat kemudian dikelompokkan menjadi satu contoh, kemudian dihitung frekuensi kemunculan isolat dalam masing-masing komunitas untuk menentukan isolat yang dominan frekuensi kemunculan isolat bakteri ditentukan berdasarkan jumlah koloni tunggal isolat bakteri pada media isolasi, yang menggunakan rumus :
Fi (x) = Frekuensi isolat (ke-i) dalam komounitas (x) Ni (x) = Jumlah koloni isolat (ke-i) dalam komunitas (x) N = Jumlah total koloni dalam komunitas (x)
Indeks keanekaragaman dianalisis berdasarkan Krebs (1978) H’ = -Σ Pi ln Pi
Keterangan: H’ = Indeks keragaman Shannon-Wiener
Pi = Proporsi jumlah individu di bandingkan jumlah seluruh habitat.
Uji Reaksi Hipersensitif (HR)
Uji reaksi hipersensitif dilakukan untuk mengetahui patogenisitas bakteri endofit berdasarkan reaksi pertahanan tanaman yang diwujudkan dalam gejala reaksi hipersensitivitas pada tanaman tembakau (Zou et al. 2006). Isolat bakteri endofit dibiakkan pada 5 ml media TSB 100% kemudian digoyang selama 48 jam. Suspensi bakteri endofit diambil sebanyak 2 ml dengan menggunakan syringe
14
Karakterisasi Fisiologi Bakteri Endofit
Karakterisasi fisiologis dilakukan terhadap isolat bakteri endofit yang menunjukkan potensi pengendalian terhadap penyakit busuk cabang dan pemacu pertumbuhan tanaman lada. Karakter bakteri endofit yang diuji yaitu : produksi IAA, aktivitas kitinolitik, penambat nitrogen, pelarut fosfat, pelarut kalium dan produksi senyawa flourescent.
Aktivitas kitinolitik: Tujuan uji akivitas kitinolitik untuk mengetahui kemampuan isolat bakteri endofit menghasilkan enzim kitnase. Aktivitas kitinolitik diuji pada media koloidal kitin agar dengan komposisi : 0.2% kolidal kitin, 0.2% Na2HPO4, 0.1% KH2PO4, 0.05% NaCl, 0.1% NH4Cl, 0.05% MgSO4
7H2O, 0.05% CaCl2 2H2O, 0.05% yeast extract dan 2% agar, pada pH 6.2
disterilkan, kemudian dituang dalam cawan petri setelah agar beku biakan bakteri digoreskan pada permukaan agar dan diinkubasi pada suhu kamar selama 4 hari. Aktivitas kitinolitik diindikasikan dengan adanya zona bening di sekitar goresan biakan bakteri (Shu dan Lockwood 1975).
Produksi IAA: Tujuan produksi IAA untuk melihat isolat bakteri endofit dapat menghasilkan hormon IAA. Bakteri endofit penghasil IAA dilakukan dengan menggunakan media TSB ditambahkan L-triptofan. Isolat bakteri endofit di inkubasi pada media TSB ditambahkan L-Triptofan selama 48 jam, kemudian isolat bakteri endofit ditetes dengan larutan Kovac’s Indol Regent dalam keadaan gelap tunggu sampai 15 menit. Isolat bakteri yang mampu memproduksi IAA ditunjukkan dengan perubahan warna merah pada media (Bric et al. 1991).
Penambat Nitrogen: Tujuan uji penambat nitrogen untuk mengetahui isolat bakteri endofit yang dapat menambat nitrogen. Pengujian bakteri penambat nitrogen dilakukan dengan menggunakan medium Nitrogen Free dengan komposisi (perliter) : 5 g K2HPO4, 0.5 g MgSO4·7H2O, 0.2 g CaCl2, 0.02 g NaCl,
0.1 g FeSO4·7H2O, 0.5 g NaMoO4·2H2O, 2 mg MnSO4·H2O, 10 mg 0.5%
bromothymol blue dalam 0.2 N KOH - 2 mL, 1.64% FeEDTA dalam larutan 4 mL, agar 2 g, 1000 mL akuades, pada pH 6.8 kemudian bakteri digoreskan pada permukaan agar dan diinkubasi pada suhu kamar selama 4 hari. Aktivitas penambat nitrogen diindikasikan dengan adanya zona bening di sekitar goresan biakan bakteri (Ghevariya dan Desai 2014).
Pelarut Fosfat: Tujuan uji pelarut fosfat untuk mengetahui isolat bakteri endofit yang dapat melarutkan fosfat. Pengujian bakteri pelarut fosfat dilakukan dengan mengunakan media Pikovskaya dengan komposisi (perliter) : 10 g glukosa, 2.5 g Ca3 (PO4), 5 g MgCl2·6H2O, 0.25 g MgSO4·7H2O, 0.2 g KCl, 0.1 g
(NH4)2SO4, 0.025 g Bromo phenol blue. Setelah dilakukan inkubasi selama 24
jam pada suhu ruang dilakukan pengamatan aktivitas fospat yang ditandai dengan terbentuknya zona bening pada media pikovskaya (Ghevariya dan Desai 2014).
Pelarut Kalium: Tujuan uji pelarut kalium untuk mengetahui isolat bakteri endofit yang dapat melarutkan kalium. Pengujian bakteri pelarut kalium dilakukan dengan menggunakan media Aleksandrov dengan komposisi (perliter) : 5 g glukosa, 0.5 g estrak yeast, 0.5 g MgSo4.7H2O, 0.006 g FeCl3, 0.1 g CaCO3, 2 g
CaPo4, 30 g agar, pada pH 4.5, kemudian bakteri digoreskan pada permukaan agar
15
Produksi Senyawa Fluorescent: Tujuan uji produksi senyawa fluorescent
untuk mengetahui isolat bakteri endofit dapat menghasilkan senyawa fluorescent. Produksi senyawa fluorescent dari bakteri endofit diuji dengan media King’B dengan komposisi 20 g pepton, 1.5 g K2HPO4, 1.5 g MgSO4, 15 mL gliserol, 15 g
agar dan 1000 mL akuades. Bakteri endofit digoreskan pada media dan diinkubasi selama 2 hari. Produksi senyawa fluorescent dapat dilihat dengan meletakkan cawan petri di bawah cahaya ultra violet (360 nm) (Schaad et al. 2001).
Uji Antibiosis Bakteri Endofit pada Septobasidium sp.
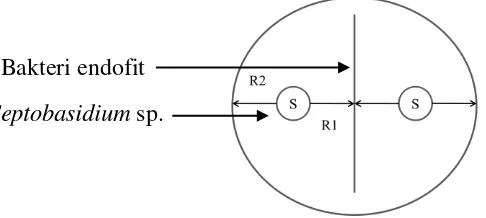
Uji antibiosis dilakukan dengan teknik kultur ganda dengan mengacu Edward et al. (2013) yang telah dimodifikasi terhadap Septobasidium sp. pada media PDA. Bakteri endofit uji digoreskan melintang pada pusat media selanjutnya isolat Septobasidium sp. yang berumur 7 hari dengan diameter 0.6 cm diletakkan di antara goresan bakteri uji antara tepi cawan petri dengan jarak 2.25 cm (Gambar 2). Pengamatan dilakukan terhadap zona hambatan (zona bening) yang dihasilkan. Zona hambat dihitung menggunakan rumus:
Zona hambat = –
R1 jarak jari-jari miselium Septobasidium sp. hingga tepi bakteri dan R2 jarak jari-jari miselium Septobasidium sp. hingga tepi cawan. Lebar zona penghambatan adalah lebar zona antara kedua ujung koloni cendawan, diukur pada hari ke-3 setelah kedua koloni cendawan ditumbuhkan pada cawan petri.
Gambar 3 Skema uji antibiosis bakteri endofit terhadap Septobasidium sp.
Uji Bakteri Endofit sebagai Penghambat Septobasidium sp. pada Lada
Percobaan bakteri endofit sebagai penghambat Septobasidium sp. pada tanaman lada menggunakan rancangan acak lengkap (RAL) dengan 6 perlakuan dan 3 ulangan. Perlakuan terdiri atas isolat bakteri endofit yang potensial yaitu isolat SHC9, SKA3, SKD8, SKD10, LHD8 dan Kontrol (akuades steril). Data yang diperoleh dianalisis secara statistika dengan analisis ragam dan dilanjutkan dengan uji lanjutan Duncan’s New Multiple Range Test (DNMRT) pada taraf nyata 95%.
Bibit lada yang digunakan adalah bibit yang sudah menunjukkan gejala dan tanda penyakit busuk cabang lada dari hasil perbanyakan petani lada di Kabupaten
Bakteri endofit
16
Sambas, Provinsi Kalimantan Barat yang mempunyai keseragaman. Akar bibit lada dibersihkan dari kotoran media pembibitan dengan air mengalir, kemudian dikeringanginkan. Bibit direndam dalam 2 liter suspensi endofit (konsentrasi 108– 109 cfu mL-1) selama 2 jam, kemudian ditanam dalam pot plastik ukuran 20 cm yang berisi media tanah humus steril dan pupuk kandang steril. Masing-masing isolat bakteri endofit diintroduksikan pada masing-masing ulangan, metode ini mengacu pada Zakry et al. (2010). Perhitungan daya hambat (DH) = [Kontrol-Perlakuan/Kontrol]x100%. Pengamatan terhadap panjang hifa/meselium
Septobasidium sp.
Uji Kemampuan Bakteri Endofit sebagai Pemacu Pertumbuhan Tanaman
Percobaan kemampuan bakteri endofit sebagai pemacu perumbuhan tanaman menggunakan rancangan acak lengkap (RAK) dengan 6 perlakuan dan 4 ulangan. Perlakuan terdiri atas isolat bakteri endofit yang potensial yaitu isolat SHC9, SKA3, SKD8, SKD10, LHD8 dan Kontrol (akuades steril). Data yang diperoleh dianalisis secara statistika dengan analisis ragam dan dilanjutkan dengan uji lanjutan Duncan’s New Multiple Range Test (DNMRT) pada taraf nyata 95%. Percobaan ini mengikuti metode Zakry et al. (2010) yang telah dijelaskan pada pengujian diatas. Bibit lada yang digunakan adalah bibit varitas Bengkayang yang sehat (tidak bergejala). Pengamatan terhadap pertambahan tinggi tanaman dan pertambahan jumlah tunas baru.
Uji Kemampuan Bakteri Endofit sebagai Pemacu Ketahanan Tanaman
Percobaan kemapuan bakteri endofit sebagai pemacu ketahanan tanaman menggunakan rancangan acak kelompok (RAL) dengan 6 perlakuan 4 ulangan. Perlakuan terdiri atas isolat bakteri endofit yang potensial yaitu isolat SHC9, SKA3, SKD8, SKD10, LHD8 dan Kontrol (akuades steril). Data yang diperoleh dianalisis secara statistika dengan analisis ragam dan dilanjutkan dengan uji lanjutan Duncan’s New Multiple Range Test (DNMRT) pada taraf nyata 95%. Percobaan ini mengikuti metode Zakry et al. (2010) yang telah dijelaskan pada pengujian diatas. Bibit lada yang digunakan adalah bibit varitas Bengkayang yang sehat (tidak bergejala). Kemudian tanaman tersebut dipelihara selama 3 bulan untuk menumbuhkan tunas baru, kemudian tanaman tersebut disimpan pada kebun yang terinfeksi oleh patogen (Septobasidium sp.) mengacu pada metode Aravind et al. (2009a). Pengamatan dilakukan dengan melihat infeksi oleh patogen pada bibit tersebut. Uji potensi ketahanan dari bakteri endofit dilakukan dengan metode split-root system (Hasky-Gunther et al.1998).
17
Pengamatan aktivitas enzim dilakukan dengan memasukkan sediaan enzim sebanyak 0.2 mL yang sudah diencerkan 1:3 dengan buffer fosfat 0.01 M, pH 6 dimasukkan ke dalam tabung reaksi berdiameter 1 cm yang berisi 5 mL larutan pirogalol 0.5 M dan 0.5 ml H2O2 1%. Suspensi larutan dihomogenkan selama
5-10 detik dan nilai absorbansinya dihitung pada panjang gelombang 420 nm dengan interval waktu setiap 30 detik selama 150 detik. Apabila nilai absorban terlalu tinggi dapat dilakukan pengenceran terhadap sediaan enzim dengan buffer
18
4 HASIL DAN PEMBAHASAN
Eksplorasi Bakteri Endofit pada Lada
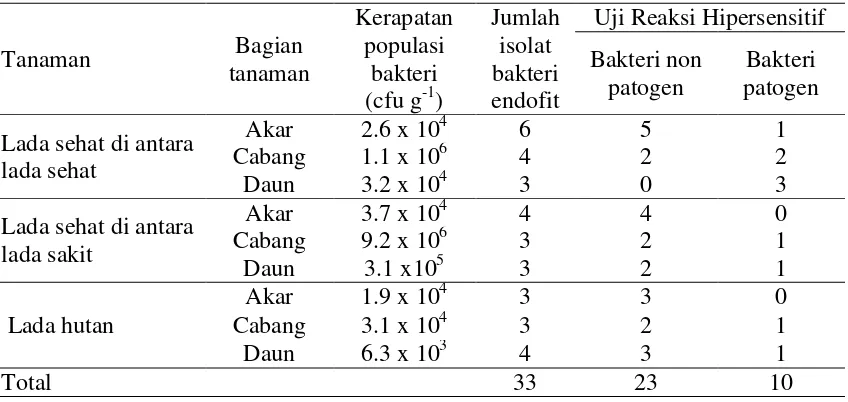
Hasil isolasi bakteri endofit dari akar, cabang dan daun tanaman lada diperoleh 33 isolat bakteri endofit, terdiri atas 13 isolat dari tanaman lada yang sehat, 10 isolat dari tanaman sehat di antara tanaman yang sakit dan 10 isolat dari tanaman lada hutan (Tabel 1).
Tabel 1 Kerapatan populasi bakteri dan jumlah isolat bakteri endofit dari tanaman lada
Populasi bakteri endofit dari masing-masing tanaman contoh berkisar antara 6.3 x 103–9.2 x 106 cfu g-1. Kelimpahan bakteri endofit dari tanaman lada sehat di antara lada sakit lebih besar dibandingkan dengan tanaman lada sehat di antara lada sehat, kisaran populasi sebesar 9.6 x 106 cfu g-1 dan 1.2 x 106 cfu g-1, sedangkan dari lada hutan populasi endofit 5.6 x 104 cfu g-1. Hasil uji patogenisitas dari 33 isolat terdapat 10 isolat yang menunjukkan reaksi positif dan 23 isolat menunjukkan reaksi negatif sehingga dapat digunakan untuk penelitian selanjutnya.
19
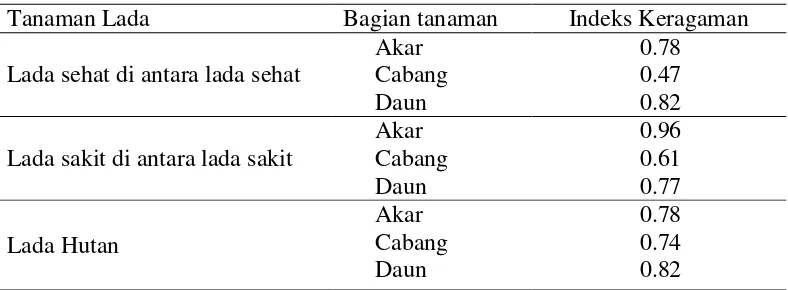
Tabel 2 Keragaman bakteri endofit
Tanaman Lada Bagian tanaman Indeks Keragaman
Lada sehat di antara lada sehat
Akar 0.78
Cabang 0.47
Daun 0.82
Lada sakit di antara lada sakit
Akar 0.96
Analisis frekuensi kemunculan masing-masing isolat bakteri endofit dalam satu contoh menujukan beberapa isolat dominan (Lampiran 1) berkisar 0.3–88 % dari isolat yang ada dari contoh yang diisolasi. Isolat bakteri dominan pada tanaman lada menunjukkan perbedaan morfologi koloni, menunjukkan bahwa isolat tertentu memiliki jumlah populasi yang lebih banyak dibandingkan dengan dengan jumlah isolat lainnya.
Isolasi bakteri endofit lada pada bagian akar, batang dan daun dari 1 tanaman lada varitas Panniyur-v oleh Aravind et al. (2009a) diperoleh 39 isolat bakteri endofit, dalam penelitian ini diperoleh 33 isolat bakteri endofit jadi tidak berbeda dari penelitian sebelumnya. Perbedaan populasi bakteri endofit terjadi karena aktivitas agens hayati di dalam jaringan tanaman yang dipengaruhi oleh faktor biotik dan abiotik. Beberapa penelitian juga melaporkan bahwa pengaruh jenis tanaman, tipe jaringan baik akar, cabang dan daun serta umur tanaman, habitat serta amandemen tanah merupakan faktor yang dapat memengaruhi populasi bakteri endofit (Garbeva et al. 2004; Hallmann dan Breg 2006). Keragaman populasi ini juga dapat dipengaruhi oleh faktor lingkungan (hujan dan suhu) dan teknik budidaya lada. Cara budidaya tanaman lada, seperti pemupukan yang berlebih dan penggunaan pestisida yang tidak tepat sasaran, waktu, dosis dan konsentrasi, jenis pestisida, dan cara aplikasi dapat menjadi salah satu faktor yang menyebabkan terjadinya perbedaan keragaman dan kerapatan populasi mikrob di dalam akar dan tanah (Harni 2010).
Karakterisasi Fisiologi Bakteri Endofit
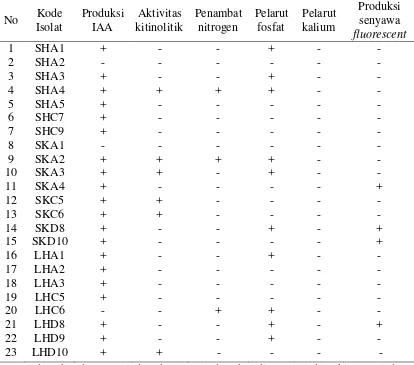
Hasil analisis karakter fisiologi bakteri endofit menunjukkan bahwa beberapa isolat menunjukkan hasil yang bervariasi. Sebanyak 23 isolat bakteri yang dianalisis menunjukkan keunggulan sebagai penghasil enzim kitinolitik, IAA, penambat nitrogen, pelarut fosfat, penambat kalium dan senyawa fluorescent
(Tabel 5).
20
cendawan patogen Helminthosporium maydis dan Pyricularia oryzae. Menurut Harni dan Amaria (2012) bakteri kitinolitik mampu menghambat perkembangan
P. capsici. Hallmann et al (1997) menjelaskan enzim seperti kitinase, protease dan selulase serta senyawa sekunder lainnya sangat berperan terhadap induksi ketahanan tanaman. Bakteri P. stutzeri menghasilkan enzim ekstraseluler kitinase dan β-1,3-glukanase yang dapat mendegradasi lapisan kitin dan glukan pada dinding sel miselium cendawan (Compant et al. 2005).
Tabel 3 Karakteristik fisiologi isolat bakteri endofit asal tanaman lada
No Kode hutan, A: akar, C: cabang, D: daun, (-) reaksi negatif dan (+) reaksi positif.
Hasil analisis IAA menunjukkan bahwa hampir semua isolat bateri endofit memproduksi IAA kecuali isolat SHA2, SKA1, dan LHC6. IAA merupakan salah satu karakteristik bakteri yang dapat memacu pertumbuhan tanaman (Shabab et al.
21
tumbuh, seperti IAA (Wedhastri 2002; Dasteger et al. 2011; Jasim et al. 2013). Bacon dan Hinton (2007) menjelaskan bahwa bakteri endofit dapat menghasilkan hormon pertumbuhan seperti etilen, auksin dan sitokinin. Beberapa hasil penelitian menunjukkan bakteri P. fluorescens menghasilkan fitohormon seperti IAA yang dapat memacu perakaran jagung (Benizri et al. 1998; Khan dan Doty 2009).
Analisis isolat bakteri endofit yang dapat menambat nitrogen pada isolat SHA4, SKA2 dan LHC6. Hasil penelitian Khan dan Doty (2009) fungsi nitrogen pada tanaman dapat meningkatkan pertumbuhan tanaman, meningkatkan kadar protein dalam tanaman, melebarkan daun, menjadikan daun lebih hijau. Bakteri S. nematodiphla, Klebsiella sp. (PnB 10) dan Enterobacter sp. (PnB 11) mampu menyediakan nitrogen pada tanaman lada (Dasteger et al. 2011; Jasim et al.
2013). Bakteri penambat nitrogen di antaranya Pseudomanas spp.,
Enterobacteriaceae, Bacillus, Azotobacter, Azospirillum dan Herbaspirillum telah terbukti mampu menambat nitrogen dari perakaran (James dan Oliveres 1997).
Berdasarkan analisis pada media Pikovskaya menunjukkan isolat bakteri endofit SHA1, SHA3, SHA4, SKA2, SKA3, SKD8, LHD1, LHC6, LHD8 dan LHD9 dapat melarutkan fosfat. Tilak et al. (2005) menjelaskan Pseudomonas, Bacillus, Mycobaterium, Serratia spp. merupakan kelompok bakteri yang dapat melarutkan fosfat dan meningkatkan pertumbuhan tanaman. Bakteri endofit
Klebsiella sp. (PnB 10) dan Enterobacter sp. (PnB 11) dari tanaman lada dapat melarutkan fosfat (Jasim et al. 2013).
Uji fluorescent merupakan salah satu uji yang memberikan kemudahan untuk dapat membedakan bakteri Pseudomonas sp. kelompok fluorescent dengan kelompok bakteri lainnya. Ciri khas P. fluorescens adalah berpendar di bawah sinar ultraviolet. Fluoresensi ini dihasilkan oleh pigmen fluorescent berupa senyawa fluoresein atau pioverdin yang akan terbentuk apabila bakteri tumbuh pada media yang kurang unsur besi seperti media King’s B. Kelompok bakteri penghasil pigmen flourescent merupakan kelompok bakteri Pseudomonas yang menghasilkan pigmen flourescent (Schaad et al. 2001).
Kemampuan Antibiosis Bakteri Endofit terhadap Septobasidium sp.
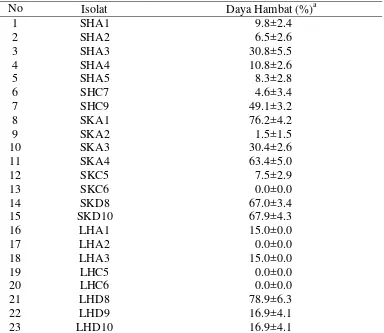
Hasil uji kemampuan antibiosis isolat bakteri endofit terhadap
Septobasidium sp. mempunyai daya hambat yang bervariasi dengan kisaran 0.00– 78.89% (Tabel 4). Nilai persentase kemampuan daya hambat dari 23 isolat bakteri endofit yang dilakukan uji antibosis, sebanyak 8 isolat bakteri endofit menunjukkan antibiosis lebih dari 30% terhadap Septobasidum sp.
Beberapa hasil penelitian menunjukkan bahwa bakteri endofit Arthrobacter
22
mempunyai kemampuan dalam menghambat perkembangan Septobasidium sp. namun dengan tingkat kemampuan daya hambat yang berbeda (Gambar 4).
Tabel 4 Kemampuan antibiosis bakteri endofit terhadap Septobasidum sp. secara
in vitro
No Isolat Daya Hambat (%)a
1 SHA1 9.8±2.4
2 SHA2 6.5±2.6
3 SHA3 30.8±5.5
4 SHA4 10.8±2.6
5 SHA5 8.3±2.8
6 SHC7 4.6±3.4
7 SHC9 49.1±3.2
8 SKA1 76.2±4.2
9 SKA2 1.5±1.5
10 SKA3 30.4±2.6
11 SKA4 63.4±5.0
12 SKC5 7.5±2.9
13 SKC6 0.0±0.0
14 SKD8 67.0±3.4
15 SKD10 67.9±4.3
16 LHA1 15.0±0.0
17 LHA2 0.0±0.0
18 LHA3 15.0±0.0
19 LHC5 0.0±0.0
20 LHC6 0.0±0.0
21 LHD8 78.9±6.3
22 LHD9 16.9±4.1
23 LHD10 16.9±4.1
Keterangan: a, pengukuran dilakukan pada hari ke-3.
Gambar 4 Daya hambat isolat bakteri endofit terhadap Septobasidium sp. s,
Septobasidium sp.; be, bakteri endofit; A, isolat LHD8; B, isolat SKD10; C,isolat SKD8.
s s s s s s
be be be
23
Kemampuan Bakteri Endofit terhadap Penghambatan Septobasidium sp. pada Lada
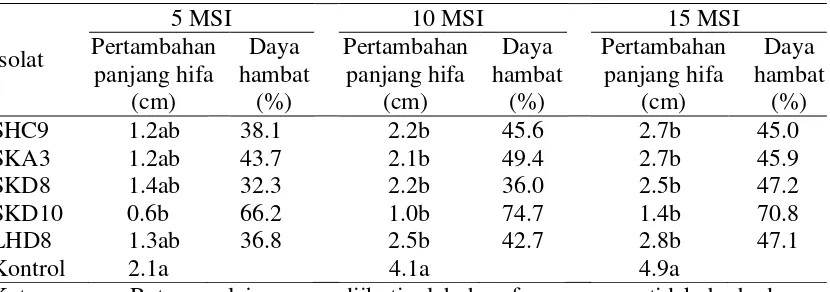
Berdasarkan hasil penelitian pengaruh bakteri endofit pada 5 minggu setelah inokulasi tidak berpengaruh nyata terhadap penghambatan hifa Setobasidium sp., namun pada 10 minggu setelah inokulasi berpengaruh sangat nyata terhadap penghambatan hifa Septobasidium sp. isolat SHC9, SKA3, SKD10 dan LHD8 dibandingkan kontrol (Tabel 5). Isolat SKD10 mempunyai aktivitas penghambatan yang tinggi terhadap perkembangan Septobasidium sp. sebesar 70.78%.
Tabel 5 Pengaruh penghambatan bakteri endofit terhadap hifa Septobasidium sp. pada lada nyata berdasarkan uji jarak berganda Duncan pada taraf nyata 95%. MSI : minggu setelah inokulasi
Bakteri endofit mempunyai mekanisme tersendiri dan mempunyai lebih dari satu mekanisme penghambatan. Bakteri endofit asal lada dapat menghambat pertumbuhan patogen tular tanah seperti P. capsici pada lada karena memiliki mekanisme bersifat antibiosis, aktivitas mikroparasitisme dan menghasilkan selulase, kitinase dan siderofor (Harni dan Amaria 2012). Bakteri yang mempunyai kemampuan menghasilkan enzim ekstraseluler kitinase dan β -1,3-glukanase dapat melisis senyawa kitin dan glukan pada dinding sel cendawan (El-Katatny et al. 2000). Bakteri kitinolitik dilaporkan memiliki potensi sebagai pengendali hayati misalnya P. syringae, Burkholderia cepasia, B. subtilis, A. radiobacter, Enterobacter cloacae dan Streptomyces griseoviridis, Actinomycetes
(Tahtamouni et al. 2006).
Kemampuan antibiosis bakteri endofit asal lada B. megaterium, B. cereus, Bacillus sp., dan Enterobacter sp. dapat menghambat 41–43% miselia dan perkembangan spora F. oxysporum secara in vitro (Edward et al. 2013). Menurut Aravind et al. (2009b) bakteri endofit asal tanaman lada yaitu P. Aeruginosa, P. putida, dan B. megaterium secara in vitro mempunyai kemampuan antibiosis 84% terhadap miselium P. capsici dan secara in vivo dapat menghambat 70% zoospora
P. capsici.
Kemampuan kolonisasi akar oleh bakteri endofit dipengaruhi oleh faktor intrinsik dari mikrob dan cara aplikasi (Raajimakers et al. 1995). Ketika kolonisasi bakteri endofit terjadi pada akar tanaman, bakteri memberikan respon
24
ketahanan terhadap perkembangan patogen (Bakker et al. 2007). Faktor yang penting adalah kemampuan kolonisasi bakteri endofit pada tanaman sebagai agens pengendalian hayati penyakit tanaman.
Kemampuan Bakteri Endofit sebagai Pemacu Pertumbuhan Tanaman
Isolat SKA3 dan SKD10 merupakan isolat yang dapat meningkatkan pertambahan tunas lada pada minggu ke-10 dan 15 dibandingkan dengan isolat SHC9, SKD8 dan LHD10 pada tabel 6.
Tabel 6 Pengaruh perlakuan isolat bakteri endofit terhadap pertambahan jumlah tunas tanaman lada
Isolat Pertambahan jumlah tunas
5 MSI 10 MSI 15 MSI nyata berdasarkan uji jarak berganda Duncan pada taraf nyata 95%. MSI: minggu setelah inokulasi
Isolat bakteri menunjukkan bahwa keberadaan bakteri endofit dalam jaringan tanaman dalam jumlah tertentu tidak mengganggu proses fisiologis tanaman lada. Menurut Bacon dan Hinton (2007) respon antara bakteri endofit dan inang yang tidak memberikan pengaruh fisologis (netralisme) atau menguntungkan tanaman inang (komensalisme) serta dapat menguntungkan tanaman inang (mutualisme).
Menurt Hallmann (2001) mikrob endofit dalam peningkatan pertumbuhan tanaman berperan sebagai pelarut nutrisi (pelarut fosfat), fiksasi nitrogen, dan produksi hormon pertumbuhan. Bacon dan Hinton (2007) menyatakan ketersedian nutrisi tanaman seperti nitrogen, fosfat, dan mineral lainnya serta hormon petumbuhan seperti etilen auksin dan sitokinin dihasilkan oleh bakteri endofit. Kelompok bakteri endofit yang dapat mengikat nitrogen antara lain Azospirillum, Azotobacter, Acetobacter diazotrophicus, Azoarcus, kelompok pelarut fosfat
Pseudomonas, Bacillus, Mycobaterium, Serratia spp. (Tilak et al. 2005).
Peningkatan hormon IAA (indol-3- acetic acid) pada tanaman juga mampu dipacu oleh adanya aktivitas bakteri endofit pada jaringan tanaman (Eliza 2004). Selain itu bakteri yang bersifat pemacu pertumbuhan tanaman juga mempunyai enzim ketahanan pada patogen berupa enzim peroksidase dan asam salisilat (Hallmann 2001).