PROPOSAL
PENELITIAN LABORATORIUM
DANA ITS TAHUN 2020
PENGARUH PENAMBAHAN SURFAKTAN TWEEN 80 PADA
PRODUKSI BIOLISTRIK DAN DEGRADASI LIMBAH CAIR
PERIKANAN MENGGUNAKAN TEKNOLOGI MICROBIAL FUEL
CELLS SINGLE CHAMBER (MFC-SC)
Tim Peneliti:
Dr. Eng. R. Darmawan, ST., MT. (Departemen Teknik Kimia/FTI-RS/ITS)
Dr. Ir. Sri Rachmania Juliastuti, M.Eng (Departemen Teknik Kimia/FTI-RS/ITS)
Atha Pahlevi Putra (Departemen Teknik Kimia/FTI-RS/ITS)
Ali Fikri (Departemen Teknik Kimia/FTI-RS/ITS)
DIREKTORAT RISET DAN PENGABDIAN KEPADA MASYARAKAT
INSTITUT TEKNOLOGI SEPULUH NOPEMBER
SURABAYA
20201
HALAMAN PENGESAHAN
PROPOSAL PENELITIAN LABORATORIUM DANA ITS TAHUN 2020
1. Judul Penelitian : Pengaruh Penambahan Surfaktan Tween 80 Pada Produksi Biolistrik Dan Degradasi Limbah Cair Perikanan Menggunakan Teknologi Microbial Fuel Cells Single Chamber (MFC-SC)
2. Ketua Tim
a. Nama : Dr. Eng. R. Darmawan, ST., MT.
b. NIP : 1978050662009121001
c. Pangkat / Golongan : Penata Muda Tk I/ IIIB d. Jabatan Fungsional : Asisten Ahli
e. Departemen : Teknik Kimia
f. Fakultas : Fakultas Teknologi Industri dan Rekayasa Sistem g. Laboratorium : Teknologi Pengolahan Limbah
h. Alamat Kantor : Departemen Teknik Kimia
i. Telp/HP/Fax : 031-5946240/ 082311459899/031-5999282
3. Jumlah anggota : 1 orang
4. Jumlah mahasiswa yang terlibat : 2 orang 5. Sumber dan jumlah dana penelitian yang diusulkan
a. Dana ITS 2020 Rp. 50.000.000,00
b. Sumber lain Rp. - Jumlah Rp. 50.000.000,00
Mengetahui, Surabaya, 5 Maret 2020
Kepala Laboratorium Pengolahan Ketua Tim Peneliti Limbah Industri
Dr. Ir. Sri Rachmania Juliastuti, M.Eng Dr.Eng. R.Darmawan, ST., MT. NIP. 195907301986032001 NIP. 1978050662009121001
Mengesahkan, Menyetujui,
Direktur DRPM ITS Kepala Pusat Energi Berkelanjutan
Agus Muhamad Hatta S.T, M.Si, Ph.D. Prof. Dr. Ir. Tri Widjaja, M.Eng.
2
DAFTAR ISI
HALAMAN SAMPUL ... 1 DAFTAR ISI... 2 DAFTAR TABEL ... 4 DAFTAR GAMBAR ... 5 DAFTAR LAMPIRAN ... 6 BAB I RINGKASAN ... 7BAB II LATAR BELAKANG II.1 Latar Belakang ... 9
II.2 Rumusan Masalah ... 11
II.3 Tujuan Penelitian ... 11
II.4 Relevansi ... 12
II.5 Target Luaran ... 12
BAB III TINJAUAN PUSTAKA III.1 Fuel Cell ... 13
III.2 Microbial Fuel Cells (MFCs) ... 14
III.2.1 Prinsip Kerja ... 16
III.2.2 Jenis-jenis MFCs ... 18
III.2.3 Substrat Pada MFCs ... 19
III.3 Limbah Cair Industri Perikanan ... 20
III.4 Bakteri yang Digunakan dalam MFCs ... 21
III.5 Elektroda Carbon Cloth Termodifikasi ... 23
III.6 Surfaktan ... 24
III.6.1 Efek Penambahan Surfaktan terhadap Performa MFCs ... 26
III.7 Karakteristik Lumpur Lapindo ... 27
III.8 Dedak Padi ... 28
III.9 Teknologi Analisa Komunitas Mikroba ... 29
III.9.1 Isolasi DNA ... 29
III.9.2 Skuensing DNA... 29
III.9.3 Bioinformatika ... 30
III.10 Penelitian terdahulu ... 30
BAB IV METODE IV.1 Variabel Percobaan ... 32
3
IV.1.1 Pengukuran Potensial Listrik ... 32
IV.2 Bahan Penelitian ... 33
IV.2.1 Bahan Pembuatan Elektroda ... 33
IV.2.1 Bahan Pembuatan NaCl 0,3 M ... 33
IV.2.1 Bahan Ekstraksi DNA menggunakan FastDNA® SPIN Kit for Soil ... 33
IV.3 Peralatan yang Digunakan ... 34
IV.4 Metode Percobaan ... 34
IV.4.1 Tahap Persiapan Penelitia ... 34
IV.4.2 Tahap Perispan Chamber dan Penanaman Elektroda ... 35
IV.4.3 Tahap Pengukuran dan Analisa... 36
IV.4.3.1 Tahap Pengukuran Potensial Listrik ... 36
IV.4.3.1 Analisa Jumlah Bakteri ... 37
IV.4.3.1 Tahap Analisa Pertumbuhan Komunitas Mikroba pada MFCs ... 37
BAB V ORGANISASI TIM, JADWAL DAN ANGGARAN BIAYA V.1 Organisasi Tim Peneliti ... 38
V.2 Jadwal ... 39
V.3 Anggaran Biaya ... 40
BAB VI DAFTAR PUSTAKA ... 43
4
DAFTAR TABEL
Tabel III.1 Karakteristik Jenis-Jenis Fuel Cell ... 14
Tabel III.2 Perbandingan Kondisi Operasi Fuel Cells dan MFCs... 15
Tabel III.3 Penggunaan Berbagai Jenis Substrat dan Mikroorganisme pada MFCs ... 19
Tabel III.4 Baku Mutu Air Limbah Bagi Usaha Pengolahan Ikan ... 21
Tabel III.5 Bakteri yang Digunakan pada MFCs ... 22
Tabel III.6 Karakteristik Lumpur Lapindo ... 27
5
DAFTAR GAMBAR
Gambar III.1 Skema Cara Kerja Microbial Fuel Cell ... 16
Gambar III.2 Mekanisme Transfer Elektron Melalui Membran Luar Sel ... 17
Gambar III.3 Mekanisme Transfer Elektron Melalui Membran Luar Sel ... 17
Gambar III.4 Mekanisme Transfer Elektron Menggunakan Bacterial Nanowise ... 18
Gambar III.5 Cara Kerja Surfaktan Dalam Larutan ... 24
Gambar III.6 Capaian dan Rencana Penelitian Terkait dengan Teknologi MFCs ... 30
Gambar IV.1 Rangkaian Peralatan single Chamber MFCs ... 33
6
DAFTAR LAMPIRAN
Tabel III.1 Karakteristik jenis-jenis Fuel Cell ... 12
Tabel III.2 Perbandingan Kondisi Operasi Fuel Cells dan MFCs... 12
Tabel III.3 Penggunaan Berbagai Jenis Substrat dan Mikroorganisme pada MFCs ... 12
Tabel III.4 Baku Mutu Air Limbah Bagi Usaha Pengolahan Ikan ... 12
Tabel III.5 Bakteri yang Digunakan pada MFCs ... 12
Tabel III.6 Karakteristik Lumpur Lapindo ... 12
7
BAB I RINGKASAN
Pemanfaatan sumber daya fosil yang sering digunakan dalam memenuhi kebutuhan listrik untuk berbagai proses kegiatan semakin berkurang, jika digunakan terus menerus karena tidak dapat diperbaharui sehingga perlu dilakukan eksplorasi lebih lanjut untuk menopangi kebutuhan konsumsi energi. Ketergantungan terhadap bahan bakar fosil setidaknya memiliki tiga ancaman serius, yakni menipisnya cadangan minyak bumi, ketidakstabilan harga, dan polusi gas rumah kaca akibat pembakaran bahan bakar fosil. Oleh karena itu diperlukan suatu teknologi alternatif untuk mengatasi kebutuhan peningkatan energi. Suatu sistem yang bersifat ramah lingkungan, karena tidak menimbulkan pencemaran lingkungan, bahkan dapat digunakan untuk mengatasi pencemaran lingkungan dengan memanfaatkan limbah (Aulia, 2016). Microbial Fuel Cells (MFC) adalah suatu teknologi alternatif pengolahan air limbah secara anaerob atau disebut dengan sel elektrokimia berbasis mikroba (Ibrahim 2017), yang berpotensi menghasilkan energi listrik dari sumber bahan organik sebagai substrat karna fuel cell ini dapat mengubah reaksi kimia menjadi listrik melalui reaksi katalitik mikroorganisme (Guo dkk, 2012). MFC juga mampu mengolah air limbah yang mengandung bahan pencemar organik tinggi seperti COD maupun BOD. Bahan pencemar organik ataupun kontaminan organik yang terdapat didalam air limbah dapat dimanfaatkan sebagai sumber karbon oleh mikroorganisme dan dapat mengurangi parameter pencemar air limbah (Ekowati, 2013). Limbah cair perikanan mengandung banyak muatan ion positif dan negatif yang dapat dimanfaatkan sebagai penghasil energi listrik. Limbah cair perikanan mengandung bahan organik tinggi yang ditandai dengan tingginya biological
oxygen demand (BOD), total suspensed solids (TSS), dan total kjeldahl nitrogen (Ibrahim et al. 2009). Jumlah limbah cair yang dihasilkan dari industri perikanan sangat tinggi, yaitu
sekitar 20 ton setiap ton produk yang dihasilkan. Jika limbah cair ini dibuang ke lingkungan akan menimbulkan bau, eutrofikasi perairan dan pendangkalan (Ibrahim et al. 2009), sehingga apabila teknologi MFC dipadukan kedalam sistem pengolahan limbah cair, selain akan menurunkan beban polusi dalam limbah juga sekaligus menghasilkan energi listrik yang berkelanjutan (sustainable) karena limbah mengandung beban organik yang dapat dimanfaatkan sebagai substrat.
Salah satu hambatan utama bagi bakteri untuk mentransmisikan elektron secara eksogen ke anoda adalah bahwa sebagian besar membran dan dinding sel mikroorganisme
8
mengandung bahan nonkonduktif, seperti lipid atau peptidoglikan (Lovley, 2006; Wen et al.,2011). Ada beberapa penelitian yang melaporkan bahwa kehadiran surfaktan menghasilkan perubahan dalam struktur membran sel untuk membentuk saluran transmembran, mempengaruhi membran sel dengan mengurangi resistansi, meningkatkan permeabilitas dan degradasi substrat dan dengan mempercepat pengangkutan zat (Van Hamme et al., 2006; Singh et al., 2007). Penambahan surfaktan kedalam suatu larutan akan menyebabkan peningkatan jumlah pembawa muatan yang mengakibatkan konduktifitas listrik bertambah (Achmad 2016). Sehingga dlakukan variasi penambahan konsentrasi surfaktan terhadap daya hantar listrik yang dihasilkan pada sistem MFCs. Sehingga, dalam penelitian ini akan dianalisa pengaruh jenis elektroda termodifikasi, penambahan surfaktan Tween 80 terhadap efektivitas MFC dan peningkatan listrik yang dihasilkan serta mengetahui seberapa besar limbah cair perikanan yang terdegradasi. Analisa microbial community akan dilakukan untuk mengetahui komposisi bakteri yang ada di dalam sampel.
9
BAB II LATAR BELAKANG
II.1 Latar Belakang
Hangatnya isu terkait pengurangan emisi CO2 telah mampu mengalihkan perhatian teknologi khususnya proses produksi energi dari energi konvensional/fosil ke energi yang berasal dari sumber yang dapat diperbaharui seperti biomassa. Hidrogen dan listrik dapat menjadi komponen penting dalam upaya penurunan emisi CO2 jika kedua komponen tersebut dapat diproduksi dari sumber bukan fosil, seperti fuel cell. Tidak hanya hidrogen, sekarang diketahui bahwa listrik juga dapat diproduksi secara langsung dari degradasi bahan organik seperti glukosa dan asetat, dari limbah cair domestik, limbah cair perikanan, bahkan dari sedimen laut dalam suatu rangkaian Microbial Fuel Cell (MFC). (Aulia,2016).
Pemanfaatan sumber daya fosil yang sering digunakan dalam memenuhi kebutuhan listrik untuk berbagai proses kegiatan semakin berkurang, jika digu nakan terus menerus karena tidak dapat diperbaharui sehingga perlu dilakukan eksplorasi lebih lanjut untuk menopangi kebutuhan konsumsi energi. Ketergantungan terhadap bahan bakar fosil setidaknya memiliki tiga ancaman serius, yakni menipisnya cadangan minyak bumi, ketidakstabilan harga, dan polusi gas rumah kaca akibat pembakaran bahan bakar fosil (Aulia, 2016). Maka dari itu diperlukan suatu teknologi alternatif untuk mengatasi kebutuhan peningkatan energi. Suatu sistem yang bersifat ramah lingkungan, karena tidak menimbulkan pencemaran lingkungan, bahkan dapat digunakan untuk mengatasi pencemaran lingkungan dengan memanfaatkan limbah (Aulia, 2016).
Microbial Fuel Cells (MFC) adalah suatu teknologi alternatif pengolahan air limbah
secara anaerob atau disebut dengan sel elektrokimia berbasis mikroba (Ibrahim 2017), yang berpotensi menghasilkan energi listrik dari sumber bahan organik sebagai substrat karna fuel
cell ini dapat mengubah reaksi kimia menjadi listrik melalui reaksi katalitik mikroorganisme
(Guo dkk, 2012). MFC juga mampu mengolah air limbah yang mengandung bahan pencemar organik tinggi seperti COD maupun BOD. Bahan pencemar organik ataupun kontaminan organik yang terdapat didalam air limbah dapat dimanfaatkan sebagai sumber karbon oleh mikroorganisme dan dapat mengurangi parameter pencemar air limbah (Ekowati, 2013).
Limbah cair perikanan mengandung banyak muatan ion positif dan negatif yang dapat dimanfaatkan sebagai penghasil energi listrik. Limbah cair perikanan mengandung bahan organik tinggi yang ditandai dengan tingginya biological oxygen demand (BOD), total
10
yang dihasilkan dari industri perikanan sangat tinggi, yaitu sekitar 20 ton setiap ton produk yang dihasilkan. Jika limbah cair ini dibuang ke lingkungan akan menimbulkan bau, eutrofikasi perairan dan pendangkalan (Ibrahim et al. 2009), sehingga apabila teknologi MFC dipadukan kedalam sistem pengolahan limbah cair, selain akan menurunkan beban polusi dalam limbah juga sekaligus menghasilkan energi listrik yang berkelanjutan (sustainable) karena limbah mengandung beban organik yang dapat dimanfaatkan sebagai substrat.
Sistem MFC terdiri dari ruang katoda dan anoda. Bakteri hidup pada ruangan anoda akan mendegradasi substrat berupa senyawa organik. Proses degradasi ini dikenal sebagai reaksi oksidasi yang membebaskan CO2, elektron dan proton atau ion (H+) (Dena Z,2018). Elektron-elektron yang terakumulasi di anoda menyebabkan timbulnya beda potensial antara anoda dan katoda. Ketika anoda dan katoda disambungkan ke beban melalui rangkaian eksternal, maka elektron-elektron ini akan menghasilkan listrik (Dena Z,2018).
Namun, untuk bisa menghasilkan listrik, MFCs membutuhkan culture source sebagai sumber mikroba. Salah satu komponen yang potensial adalah Lumpur Lapindo. Banjir Lumpur Panas Sidoarjo atau Lumpur Lapindo merupakan peristiwa menyemburnya lumpur panas di lokasi pengeboran PT Lapindo Brantas di Desa Renokenongo, Kecamatan Porong, Kabupaten Sidoarjo, Jawa Timur, sejak tanggal 27 Mei 2006. Lumpur Lapindo di Sidoarjo tersusun atas 70% air dan 30% padatan (Usman dkk, 2006). Kadar garam (salinitas) lumpur sangat tinggi (38-40 %), sehingga bersifat asin (Arisandi, 2006). Berdasarkan hasil penelitian pada parameter kimia lumpur lapindo, diketahui bahwa nilai pH berkisar 6,6-7, kapasitas tukar kation (KTK) sebesar 3,89-35,42 (Me/100g), kadar air sebesar 40,41-60,73% dan kandungan total karbon organik sebesar 54,75-55,47% (Juniawan, 2013).
Elektroda juga merupakan komponen yang sangat berpengaruh terhadap berjalannya proses reduksi dan oksidasi pada sistem MFC (David, 2014). Luas permukaan anoda berpengaruh terhadap aktivitas bakteri dan transfer elektron (David, 2014). Dalam penelitian ini, elektroda yang berupa carbon cloth akan dimodifikasi sehingga terdapat penambahan luas area. Dedak padi mengandung silika yang tinggi (Agung, 2013), sehingga mampu dimanfaatkan untuk meningkatkan area kontak pada elektroda. Silika akan menempel pada
carbon cloth sehingga terbentuk partikel-partikel tambahan yang mengakibatkan listrik yang
dihasilkan akan bertambah (Agung 2013).
Salah satu hambatan utama bagi bakteri untuk mentransmisikan elektron secara eksogen ke anoda adalah bahwa sebagian besar membran dan dinding sel mikroorganisme mengandung bahan nonkonduktif, seperti lipid atau peptidoglikan (Lovley, 2006; Wen et al.,2011). Ada beberapa penelitian yang melaporkan bahwa kehadiran surfaktan
11
menghasilkan perubahan dalam struktur membran sel untuk membentuk saluran transmembran, mempengaruhi membran sel dengan mengurangi resistansi, meningkatkan permeabilitas dan degradasi substrat dan dengan mempercepat pengangkutan zat (Van Hamme et al., 2006; Singh et al., 2007). Penambahan surfaktan kedalam suatu larutan akan menyebabkan peningkatan jumlah pembawa muatan yang mengakibatkan konduktifitas listrik bertambah (Achmad 2016). Sehingga dlakukan variasi penambahan konsentrasi surfaktan terhadap daya hantar listrik yang dihasilkan pada sistem MFCs.
Selain itu pada lumpur Lapindo belum di ketahui secara jelas mikroorganisme (bakteri) apa saja yang berperan dalam produksi listrik. Padahal dalam sistem MFC, mikroorganisame merupakan salah satu komponen utama penghasil listrik (Ready dkk, 2010), penelitian terkait mikroorganisme (bakteri) apa saja yang berperan dalam MFC dengan menggunakan culture
source berupa lumpur lapindo sangat penting untuk dilakukan.
Sehingga, dalam penelitian ini akan dianalisa pengaruh jenis elektroda termodifikasi, penambahan surfaktan Tween 80 terhadap efektivitas MFC dan peningkatan listrik yang dihasilkan serta mengetahui seberapa besar limbah cair perikanan yang terdegradasi, kemudian dilakukan juga analisa komunitas mikroorganisme yang ada pada lumpur Lapindo.
II.2. Rumusan Masalah
Rumusan masalah dalam penilitian ini adalah sebagai berikut:
1. Bagaimana pengaruh jenis carbon cloth 3F dan 5F sebagai elektroda termodifikasi dengan menggunakan rangkaian alat Microbial Fuel Cells (MFC) dalam menghasilkan biolistrik serta degradasi limbah cair perikananBagaimana pengaruh penambahan surfaktan dalam menghasilkan biolistrik dan degradasi limbah cair perikanan serta terhadap pertumbuhan
2. komunitas mikroba pada lumpur lapindo dan limbah cair perikananmenggunakan MFC. 3. Bagaimana pengaruh variasi substrat lumpur, lumpur + limbah cair perikanan (3:1),
lumpur + limbah cair perikanan (1:1) dan lumpur + limbah cair perikanan (1:3) terhadap biolistrik yang dihasilkan didalam MFC.
II.3. Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Mengetahui pengaruh jenis carbon cloth 3F dan 5F sebagai elektroda yang termodifikasi dengan menggunakan rangkaian alat Microbial Fuel Cells (MFCs) dalam menghasilkan biolistrik dan degradasi limbah cair perikanan
12
2. Mengetahui pengaruh penambahan surfaktan terhadap produksi listrik dan degradasi limbah cair perikanan serta pertumbuhan komunitas mikroba pada lumpur lapindo dan limbah cair perikanan menggunakan MFCs.
3. Mengetahui pengaruh variasi substrat lumpur, lumpur + limbah cair perikanan (3:1), lumpur + limbah cair perikanan (1:1), lumpur + limbah cair perikanan (1:3) terhadap biolistrik yang dihasilkan didalam MFC.
I1.4 Relevansi
Penelitian ini diharapkan bisa memberikan data terkait dengan pemanfaatan lumpur khususnya lumpur lapindo, Sidoarjo untuk menghasilkan energi listrik dengan bantuan mikroorganisme dengan teknologi microbial fuel cells (MFCs). Selain itu, dari penelitian ini juga memberikan data terkait pengaruh jenis elektroda termodifikasi serta penambahan surfaktan juga diperlukan untuk pengembangan biokatalis guna menghasilkan listrik. Hasil penelitian ini akan sangat membantu dalam pengembangan pemanfaatan lumpur lapindo sebagai sumber alternatif untuk menghasilkan listrik, selain sebagai jawaban untuk mengubah musibah menjadi berkah. Penelitian dengan menggunakan teknologi microbial fuel cells
Single Chamber (MFC-SC) ini mempunyai potensi yang besar untuk dikembangkan sebagai
jawaban dan solusi atas musibah ‘Lapindo’ dan untuk memenuhi pengembangan energi baru terbarukan yaitu dengan membuat baterai yang berbahan komponen organik atau Bio-Battery di masa depan. Hasil penelitian ini juga diharapkan dapat menjadi salah satu solusi pengolahan limbah cair industri perikanan.
I1.5 Target Luaran
Target luaran penelitian ini adalah sebuah publikasi jurnal internasional terindex
Scopus Q2, dengan judul:
Effect of Addition of Tween 80 Surfactant on Biolistric Production and
Degradation of Fisheries Liquid Waste Using Single Chamber Microbial Fuel Cell (SC-MFC) Technology.
13
BAB III TINJAUAN PUSTAKA
III.1 Fuel Cell
Fuel cell merupakan teknologi elektrokimia yang secara kontinyu mengkonversi energi
kimia menjadi energi listrik selama terdapat bahan bakar dan pengoksidan (Shukla dkk. 2004). Fuel cell tersusun atas anoda, katoda dan elektrolit. Anoda berperan sebagai tempat terjadinya pemecahan hidrogen (H2) menjadi proton dan elektron (listrik). Katoda berperan sebagai tempat terjadinya reaksi penggabungan proton, elektron dan oksigen untuk membentuk air. Elektrolit adalah media untuk mengalirkan proton.
Fuel cell bekerja berdasarkan prinsip pembakaran listrik-kimiawi, cell ini akan
memproduksi energi listrik arus searah. Fuel cell ini terdiri dari elektrolit yang memisahkan katoda dari anoda, elektrolit hanya dapat menghantar ion saja, sedangkan elektron tidak dapat melewati elektrolit, jadi elektrolit ini bukan penghantar listrik dan juga menghindarkan terjadinya reaksi kimia. Pada anoda akan dialirkan secara berkesinambungan bahan bakar dan pada katode dialirkan oksigen, pengaliran ini dilakukan secara terpisah. Karena pengaruh katalisator pada elektroda, maka molekul-molekul dari gas yang dialirkan akan berubah menjadi ion. Reaksi pada anoda menghasilkan elektron yang bebas, sedang pada katoda elektron yang bebas akan diikat.
Elektron-elektron bebas yang terjadi harus dialirkan keluar melalui penghantar menuju ke katoda, agar proses listrik-kimiawi dapat berlangsung. Reaksi kimia :
2H2 + O2 2H2O ... (1) Pada anoda hidrogen di oksidasi menjadi proton:
2H2 4H+ + 4e-... (2) Setiap molekul H2 terpecah menjadi dua atom H+(proton), sedang setiap atom hidrogen melepaskan elektronnya. Proton ini akan bergerak menuju katoda melewati membran. Elektron yang terbentuk akan menghasilkan arus listrik kalau dihubungkan dengan penghantar listrik menuju katoda. Pada katoda oksigen dirubah
O2 + 4H+ + 4e- 2H2O...(3) Molekul oksigen akan bergabung dengan empat elektron, menjadi ion oksigen yang bermuatan negatif untuk selanjutnya bergabung lagi dengan proton yang mengalir dari anoda. Setiap ion oksigen akan melepaskan kedua muatan negatifnya dan bergabung dengan dua proton, sehingga terjadi oksidasi menjadi air.
14 Jenis-jenis Fuel Cell :
Jenis dari pada fuel cell ditentukan oleh material yang digunakan sebagai elektrolit yang mampu menghantar proton. Pada saat ini ada 8 jenis fuel cell yaitu:
a. Alkaline (AFC)
b. Proton exchange membrane, juga disebut proton elektrolyt membrane (PEM) c. Phosphoric Acid (PAFC)
d. Molten carbonate (MCFC) e. Solid oxide (SOFC)
f. Direct methanol fuel cells (DMFC) g. Regenerative fuel cells
h. Microbial fuel cell (MFCs)
(Suhada, 2001)
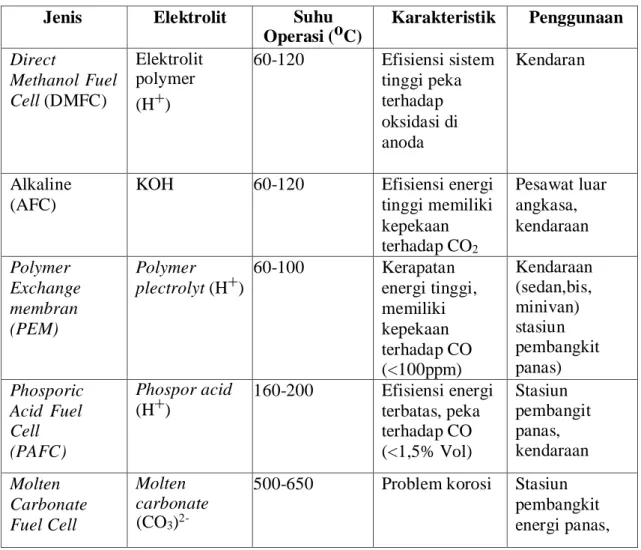
Dapat diketahui bahwa masing-masing jenis fuel cell memiliki karakteristik yang berbeda-beda. Tabel III.1 menunjukkan perbandingan dari karakteristik jenis-jenis fuel cel.
Tabel III.1 Karakteristik jenis-jenis Fuel Cell Jenis Elektrolit Suhu
Operasi (oC) Karakteristik Penggunaan Direct Methanol Fuel Cell (DMFC) Elektrolit polymer (H+) 60-120 Efisiensi sistem tinggi peka terhadap oksidasi di anoda Kendaran Alkaline (AFC)
KOH 60-120 Efisiensi energi
tinggi memiliki kepekaan terhadap CO2 Pesawat luar angkasa, kendaraan Polymer Exchange membran (PEM) Polymer plectrolyt (H+) 60-100 Kerapatan energi tinggi, memiliki kepekaan terhadap CO (<100ppm) Kendaraan (sedan,bis, minivan) stasiun pembangkit panas) Phosporic Acid Fuel Cell (PAFC) Phospor acid (H+) 160-200 Efisiensi energi terbatas, peka terhadap CO (<1,5% Vol) Stasiun pembangit panas, kendaraan Molten Carbonate Fuel Cell Molten carbonate (CO3)
2-500-650 Problem korosi Stasiun pembangkit energi panas,
15 III.2. Microbial Fuel Cells (MFCs)
Microbial Fuel Cells (MFCs) merupakan alat untuk mengkonversi energi kimia
menjadi energi listrik dengan bantuan energi katalitik dan mikroorganisme (Allan dan Benneto 1993). Berbagai mikroorganisme dapat berperan dalam MFCs, mulai dari yang bersifat aerob, anerob fakultatif dan anaerob obligat (Kim dkk, 2007). Bagian utama dari rangkaian MFC adalah anoda, katoda, dan peralatan elektronik (Logan dkk, 2006). Kelebihan dari MFC adalah dapat menghasilkan listrik dari sampah organik dan biomassa terbaharui. Bakteri berperan sebagai katalis dan mampu beradaptasi dengan baik terhadap bahan organik berbeda yang terdapat pada limbah sehingga menghasilkan elektron (Lovley, 2006). Hal ini memberikan keuntungan teknologi biologi dan teknologi elektrokimia, yang dapat mendegradasi dengan mudah bahan organik yang terjadi di anoda sehingga dihasilan proton dan elektron yang akan ditransfer menuju penerima elektron di katoda sehingga dihasilkan listrik (Logan dan Elimelech, 2012 dalam Wu dkk., 2018).
Katalis yang digunakan didalam MFCs dapat digantikan oleh pertumbuhan mikroorganisme berbeda dengan fuel cell biasanya berupa platina sehingga memiliki investasi yang lebih mahal,(Novitasari, 2011). Perbandingan antara fuel cell biasa dengan MFCs dapat dilihat pada tabel berikut.
Tabel III.2 Perbandingan kondisi sistem Fuel Cell dengan MFCs (Idham, 2009) Kondisi Operasi Fuel Cell biasa Microbial Fuel Cell
Katalis Logam mulia Mikroorganisme/enzim
Ph Larutan asam (pH<1) Larutan netral (pH 7 – 9)
Temperatur >200OC 22 – 25OC
Elektrolit Asam fosfat Larutan fosfat
Kapasitas Tinggi Rendah
Efisiensi 40 – 60% >40%
Tipe Bahan Bakar Gas alam Karbohidrat dan hidrokarbon
Solid oxcide Fuel Cell (SOFC) Lapisan keramik (O2) 800-1000 Efisiensi sistem, tinggi, temperatur diturunkan Pembangkit energi listrik
16 III.2.1Prinsip Kerja
Prinsip kerja MFC mirip dengan hidrogen fuel cell, yaitu proton dari ruang anoda menuju ruang katoda melalui membran elektrolit dan aliran elektron yang bergerak ke arah yang sama melalui kabel konduksi. Elektron merupakan partikel subatomik yang bermuatan negatif dimana elektron ini digunakan untuk menghasilkan listrik. Elektron dihasilkan dari metabolisme secara natural yang terjadi di mikroorganisme (Hoogers 2002).
Gambar III.1 Skema cara kerja Microbial Fuel Cells (MFCs)
Dalam sistem MFCs terjadi metabolisme substrat organik oleh mikroorganisme dan terjadi transfer elektron ke permukaan elektroda secara ekstraseluler. Mikroba mengoksidasi subtrat pada anoda untuk menghasilkan elektron dan proton, serta karbondioksida dikeluarkan sebagai hasil dari produk oksidasi. Setelah melewati proton exchange membrane (PEM) atau jembatan garam, proton masuk ke chamber katoda, dimana mereka menggabungkan dengan oksigen menjadi air (H2O) (Reddy dkk., 2010). Mikroba di chamber anoda memaksa elektron dan proton saat proses disimilasi dengan mengoksidasi substrat -substrat organik. Di dalam sistem MFCs, terdapat reaksi oksidasi dan reduksi di anoda dan katoda jika menggunakan substrat berupa glukosa adalah sebagai berikut ;
Reaksi anoda : C6H12O6 + 6H2O →6CO2 + 24H+ + 24e -Reaksi katoda : 6O2 + 24e- + 24H+ → 12H2O
(Chandrasekhar dan Venkata Mohan, 2014) Jika menggunakan substrat berupa asetat adalah sebagai berikut :
Reaksi anoda : C2H4O2 + 2H2O 2CO2 + 8H+ + 8e- Reaksi katoda : 2O2 + 8H++ 8e- 4H2O
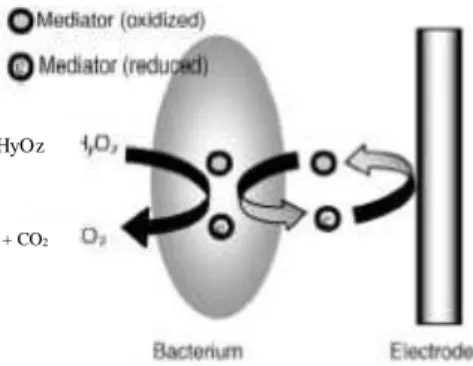
Ada beberapa mekanisme yang melibatkan transfer elektron dari bakteri ke anoda (Liu, 2008), sebagai berikut :
i. Transfer elektron langsung melalui protein membran luar sel
17
luar sel mikroba. Dalam hal ini diperlukan kontak langsung sitokrom dengan elektroda untuk mekanisme transfer elektron. Contoh mikroba yang menggunakan mekanisme ini adalah
Geobacter sulfurreducens dan Shewanella putrefaciens. Mekanisme transfer electron
langsung melalui protein membrane luar sel ditunjukkkan pada Gambar III.2
.
Gambar III.2. Mekanisme transfer elektron melalui membran luar sel (Liu, 2008) j. Transfer elektron dengan mediator
Transfer elektron yang efisien dapat dicapai dengan menambahkan mediator seperti
neutral red dan methylene blue, yang mampu melewati membran sel, menerima elektron
dari pembawa elektron intraselluler, meninggalkan sel dalam bentuk tereduksi dan kemudian mengeluarkan elektron ke permukaan elektroda. Salah satu mikroba yang memerlukan mediator adalah Escherichia coli. Namun untuk limbah, mekanisme ini tidak sesuai karena akan memakan biaya dan kemungkinan adanya racun dari beberapa mediator. Mekanisme transfer elektron dengan mediator ditunjukkan dalam Gambar III.3.
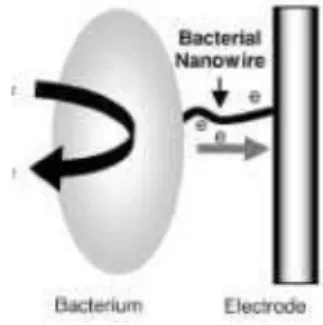
Gambar III.3. Mekanisme transfer elektron melalui membran luar sel (Liu, 2008) k. Transfer elektron melalui bacterial nanowires
Penelitian akhir-akhir ini menunjukkan bahwa struktur seperti pili yang disebut
nanowires yang tumbuh pada membran sel bakteri bisa terlibat langsung dalam transfer
CxHyOz
H+ + CO 2
CxHyOz
18
elektron ekstraseluler dan memungkinkan reduksi langsung dari sebuah aseptor elektron yang jauh. Nanowires ini telah teridentifikasi pada G. sulfurreducens PCA, Shewanella oneidensis MR-1, Synechocystis PCC6803, dan Pelotomaculum thermopropionicum. Mekanisme transfer electron melalui bacterial nanowires ditunjukkan dalam Gambar III.4.
Gambar III.4. Mekanisme transfer elektron menggunakan Bacterial Nanowires (Liu,2008)
III.2.2 Jenis-Jenis MFCs
Dalam perkembangannya, sistem MFCs dapat dibedakan menjadi a. Single Chamber MFCs
Single Chamber MFCs merupakan sistem MFCs dengan menggunakan satu chamber
dengan elektroda didalamnya. Di dasar chamber terdapat anoda sedangkan letak katoda terdapat di permukaan chamber. Single chamber adalah MFCs yang sangat sederhana dan ekonomis (Ringeisen dkk, 2006).
b. Double Chamber MFCs
Double Chamber MFCs merupakan jenis MFCs dengan menggunakan dua chamber
katoda dan anoda. Chamber katoda menggunakan larutan elektrolit aseptor elektron sedangkan chamber anoda digunakan sebagai pembiakan mikroba untuk menghasilkan elektron (Ringeisen dkk, 2006).
c. Soil Based MFCs
Soil Based MFCs atau sel bahan bakar berbasis tanah adalah sistem MFCs dengan
memanfaatkan tanah sebagai media tumbuhnya mikroba. Anoda ditanam di dalam tanah dengan kedalaman tertentu dan katoda berada dipermukaan tanah (Xubojun dkk, 2015). d. Phototrophic Biofilm PBMFCs
Phototrophic Biofilm PBMFCs adalah sistem MFCs dengan menggunakan fototrofik
anoda biofilm yang mengandung mikroorganisme fotosintetik seperti chlorophyta
candyanophyta. Mikroorganisme tersebut melakukan fotosintesis dengan menghasilkan
CxHyOz
H+ + CO 2
19
metabolit organik dan menyumbang elektron. Sub-kategori fototrofik MFC yang murni menggunakan bahan fotosintesis oksigen pada anoda biasanya disebutkan pada sistem fotovoltik biologis.
III.2.3 Substrat pada MFCs
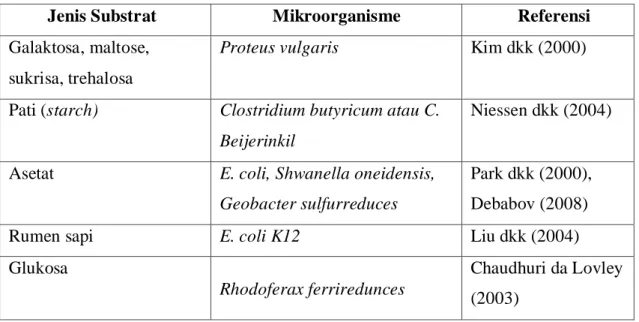
Dalam microbial fuel cell, berbagai bentuk bahan organik dapat digunakan sebagai substrat diantaranya glukosa, pati, asam lemak, asam amino dan protein, serta air limbah dari manusia dan hewan (Idham, 2009). Tabel berikut menunjukkan percobaan microbial fuel cell pada berbagai jenis substrat.
Tabel III.3 Penggunaan berbagai jenis substrat dan mikroorganisme pada Microbial
Fuel Cell (MFCs)
Jenis Substrat Mikroorganisme Referensi
Galaktosa, maltose, sukrisa, trehalosa
Proteus vulgaris Kim dkk (2000)
Pati (starch) Clostridium butyricum atau C. Beijerinkil
Niessen dkk (2004)
Asetat E. coli, Shwanella oneidensis, Geobacter sulfurreduces
Park dkk (2000), Debabov (2008)
Rumen sapi E. coli K12 Liu dkk (2004)
Glukosa
Rhodoferax ferriredunces
Chaudhuri da Lovley (2003)
. Substrat yang umumnya digunakan dalam sistem MFC termasuk asetat, butirat (Liu dkk., 2005), glukosa (Zhang dkk., 2006), propionate (Chae dkk., 2009), sistein (Logan et dkk., 2005), etanol (Kim dkk., 2007) dan air limbah organik lainnya. Substrat tidak hanya mempengaruhi komunitas bakteri dan spesies dominan di anoda, tetapi juga mempengaruhi kinerja MFC elektrokimia seperti Coulombic efisiensi (CE) dan kerapatan daya (PD), (Chae dkk., 2009).
Menurut (Chae dkk., 2009), performa kinerja MFC menggunakan berbagai jenis substrat seperti glukosa menunjukkan coloumbic efficiency terendah (15%), diikuti oleh propionat (36%), butirat (43%) dan asetat (72,3%). Glukosa menunjukkan CE yang lebih rendah dibandingkan dengan substrat molekul lain, karena sifatnya yang dapat difermentasi, sehingga fermentasi atau metanogenesis bisa menjadi metabolisme yang dominan dan ini
20
tidak bisa menghasilkan listrik, karena sebagian besar elektron yang tersedia dalam bahan bakar organik tetap masuk produk fermentasi yang tidak siap bereaksi dengan elektroda (Lovley, 2006). Asetat menunjukkan CE tertinggi, karena menurut penelitian lain (Liu et al., 2005; Jung dan Regan, 2007), itu adalah substrat yang disukai untuk pembangkit listrik di MFC, karena tidak ada produk akhir fermentasi yang diproduksi. Asetat sangat mudah digunakan oleh mikroorganisme untuk menghasilkan energi karena memiliki rantai karbon yang paling rendah, (Du et al, 2007) sedikit menghasilkan biomassa, CH4 dan H2 yang menjadi penghambat dalam produksi couloumbic efficiency (Lee dkk., 2007). Kinerja keseluruhan MFC sangat tergantung pada ketersediaan mikroorganisme digunakan sebagai biokatalis, spesies mikroba, jenis substrat, reaktor konfigurasi, waktu operasi, ukuran reaktor, pH, suhu, akseptor elektron, luas permukaan elektroda, bahan elektroda, dll. (Liu et al., 2011; Ren dkk., 2011; dkk., 2006).
III.3. Limbah Cair Industri Perikanan
Limbah industri perikanan dapat didefinisikan sebagai apa saja yang tersisa dan terbuang dari suatu kegiatan penangkapan, penanganan, dan pengolahan hasil perikanan. Tipe limbah utama yang ditemukan dari limbah cair pengolahan ikan adalah darah, kotoran, jeroan, sirip, kepala ikan, cangkang, kulit dan sisa daging. Secara umum, tipe limbah cair industri pengolahan ikan dapat dibagi dalam dua kategori yaitu volum banyak-persentase limbah rendah dan volum sedikit-persentase limbah tinggi. Kategori volum banyak-persentase limbah rendah terdiri dari air yang digunakan untuk pembongkaran, transportasi, penanganan ikan dan air pencucian. Proses pada pembuatan tepung ikan menghasilkan jenis limbah kategori volum sedikit-persentase limbah tinggi (Colicd dkk., 2007). Limbah cair industri perikanan mengandung bahan organik yang tinggi. Tingkat pencemaran limbah cair industri pengolahan perikanan sangat tergantung pada tipe proses pengolahan dan spesies ikan yang diolah (Ibrahim 2005). Terdapat 3 tipe utama aktivitas pengolahan ikan, yaitu industri pengalengan dan pembekuan ikan, industri minyak dan tepung ikan, dan industri pengasinan ikan (Priambodo 2011). Karakteristik limbah cair perikanan dapat dilihat melalui parameter pH, jumlah padatan terlarut, suhu, bau, BOD, COD, dan konsentrasi nitrogen serta fosfor (FAO 1996). Limbah cair industri pengolahan ikan memiliki karakteristik jumlah bahan organik terlarut dan tersuspensi yang tinggi jika dilihat dari nilai BOD dan COD. Lemak dan minyak juga ditemukan dalam jumlah yang tinggi. Terkadang padatan tersuspensi dan nutrien seperti nitrogen dan fosfor juga ditemukan dalam jumlah tinggi. Limbah cair industri pengolahan ikan juga mengandung sodium klorida dalam konsentrasi tinggi dari
21
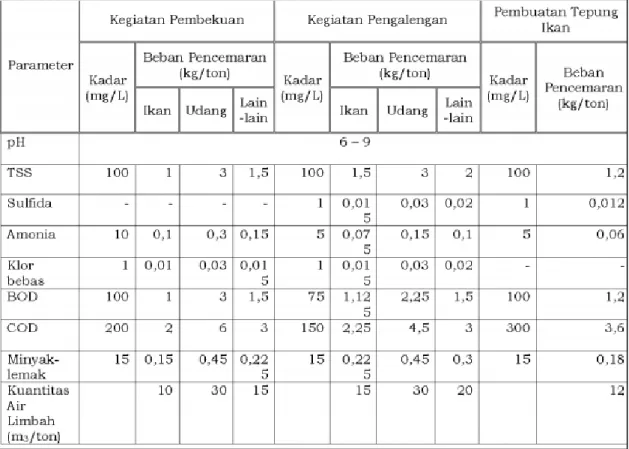
proses pembongkaran kapal, air pengolahan, dan larutan asin (Colic dkk. 2007). Baku mutu limbah cair industri pengolahan ikan dapat dilihat pada Tabel III.4
Tabel III.4 Baku mutu air limbah bagi usaha/kegiatan pengolahan perikanan
Sumber : Permen LH RI No 5. Tahun 2014
Baku mutu air limbah adalah ukuran batas atau kadar unsur pencemar dan/atau jumlah unsur pencemar yang ditenggang keberadaannya dalam air limbah yang akan dibuang a tau dilepas ke dalam sumber air dari suatu usaha dan/atau kegiatan (Kementerian Negara Lingkungan Hidup 2007).
III.4. Bakteri electricigens yang digunakan dalam MFCs
Mikroba memainkan peran penting dalam ruang anoda serta dihasilkannya elektron. Ruang anoda yang anaerob merupakan salah satu bagian utama MFCs. Semua kondisi esensial untuk mendegradasi biomassa diperlukan pada ruang anoda, yang diisi dengan substrat, mediator (opsional), mikrob, dan elektoda sebagai aseptor elektron. Kelompok mikrob yang umumnya digunakan dalam MFC adalah kelompok bakteri electricigens ataupun kelompok bakteri fermentatif. Electricigens adalah mikroorganisme yang mampu mengoksidasi senyawa organik sepenuhnya menjadi karbon dioksida dengan menggunakan
22
elektroda sebagai akseptor elektron dan energi yang dihasilkan digunakan untuk pertumbuhan (Lovley, 2006).
Namun demikian, kelompok bakteri electricigens lebih efektif digunakan dalam MFC dibandingkan kelompok bakteri fermentatif (Lovley 2006). Kelompok bakteri electricigens adalah kelompok bakteri yang memperoleh energi pertumbuhannya melalui oksidasi sempurna senyawa-senyawa organik menjadi CO2, dan mampu melakukan transfer elektron langsung pada elektroda anoda MFC. Salah satu keuntungan menggunakan electricigen adalah efisiensi coulombic yang tinggi. Kelebihan lain dari electricigen adalah keberlanjutan jangka panjang dari sel bahan bakar yang menahannya. Beberapa electricigen adalah
Desulfuromonas acetoxidans dan Geobacter metallireducens (Bond dkk., 2002), Rhodoferax ferrireducens (Finneran dkk., 2003) dan Geothrix fermentans (Bond dan Lovley, 2005).
Mikroorganisme ini ada di berbagai habitat alami seperti lumpur limbah, air limbah, sedimen air, lumpur anaerob, sedimen laut, tanah sawah, kompos dan tanah terendam.
Banyak mikroorganisme yang memiliki kemampuan untuk mentransfer elektron beserta substratnya yang dihasilkan dari metabolisme kandungan organik ke anoda seperti yang ditunjukkan pada Tabel III.5.
Tabel III.5. Bakteri yang digunakan di MFCs
Mikroba Referensi
Escherichia coli
Sivasankar dkk., n.d
Shewanella oneidensis
Alcaligenes faecalis, Enterococcus Geobacter sulfurreducens
Rhodoferax ferrireducens Glucose Clostridial isolate
Arcobacter butzleri
Sivasankar dan Mylsamy, 2018
Aeromonas hydrophila Aeromonas jandaei
Klebsiella pneumoniae L17 Klebsiella oxytoca ADR13
23
Corynebacterium humireducens sp. nov. Citrobacter sp.
Cupriavidus basilensis Pseudomonas sp. C27
Ochrobactrum anthropi YZ-1
Geothermobacter sp. Kashe dkk., 2003
Marinobacter sp. Omo, 2016
Geobacter metallireducens Bond dan lovely, 2005
Shewanella putrefaciens Park dan Zeikus, 2002 III.5 Elektroda carbon cloth modifikasi
Elektroda harus bersifat konduktif, biocompatible (sesuai dengan makhluk hidup) dan secara kimia stabil di dalam larutan bioreaktor. Material elektroda yang paling bermanfaaat adalah karbon dalam bentuk lempeng grafit (padat, batang, atau granula), dalam bentuk material fiber atau berserat dan dalam bentuk glass carbon. Karena stabilitas kimia dan konduktivitasnya, bahan anoda berbasis karbon banyak digunakan termasuk grafit, carbon
paper, carbon cloth, carbon nanotube, carbon brush, activated carbon, activated carbon fiber, and carbon mesh (Zhu, 2011). Carbon cloth sering diterapkan dalam sel bahan bakar
hidrogen, sekarang digunakan dalam MFCs sebagai elektroda plat datar (Zhou, 2011). Dalam penggunaan MFCs, carbon cloth memiliki ukuran ketebalan yang bervariasi (1 mm, 2 mm, 3 mm, 4mm, 5mm dst.). Dalam penelitian ini dilakukan varias ketebalan elektroda yaitu ketebalan 3mm dan ketebalan 5mm.
Konduktivitas dan biokompatibilitas bahan berbasis karbon masih memiliki ruang untuk ditingkatkan. Banyak upaya telah dilakukan untuk memodifikasi permukaannya untuk memungkinkan bahan anoda yang lebih efisien untuk pembangkit listrik. (Zhu, 2011). Berdasarkan percobaan yang dilakukan oleh Zhu (2011) membuktikan bahwa modifikasi permukaan anoda dapat meningkatkan power density sebesar sebesar 25% dan 58% dibandingkan anoda tanpa modifikasi. Salah satu bahan yang dapat digunakan dalam modifikasi elektroda adalah dedak padi (rice bran) yang dapat memberikan porositas dan luas permukaan pada elektroda. Kumar dkk.,(2013). Menurut Sadeqzadeh, dkk (2012) luas permukaan elektroda yang besar akan menangkap elektron yang lebih banyak
24
dipermukaannya dan menyediakan ruang bagi mikroorganisme bergerak secara efektif dipermukaan elektroda khususnya anoda sehingga dapat dihasilkan energi listrik yang lebih besar.
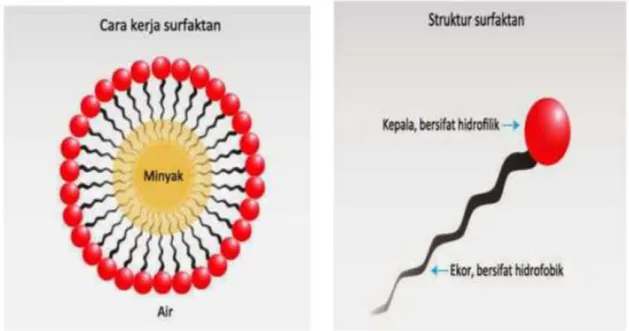
III.6 Surfaktan
Surfaktan (surface active agent) merupakan molekul-molekul yang mengandung gugus hidrofilik (suka air) dan gugus lipofilik (suka minyak/lemak) pada molekul yang sama (Sheat dan Foster, 1997). Sehingga dapat mempersatukan campuran yang terdiri dari air dan minyak. Surfaktan adalah bahan aktif permukaan. Aktifitas surfaktan diperoleh karena sifat ganda dari molekulnya. Molekul surfaktan yang suka akan air (hidrofilik) merupakan bagian polar dan molekul yang suka akan minyak/lemak (lipofilik) merupakan bagian non polar. Bagian polar molekul surfaktan dapat bermuatan positif, negatif atau netral. Umumnya bagian non polar (lipofilik) merupakan rantai alkil yang panjang, sedangkan bagian yang polar (hidrofilik) mengandung gugus hidroksil (Gambar III.5).
Gambar III.5. Cara kerja surfaktan didalam larutan
Sifat rangkap ini yang menyebabkan surfaktan dapat diadsorbsi pada antar muka udara-air, minyak-udara-air, dan zat padat-udara-air, membentuk lapisan tunggal dimana gugus hidrofilik berada pada fase air dan rantai hidrokarbon ke udara, dalam kontak dengan zat padat ataupun terendam dalam fase minyak. Surfaktan (surface active agent) adalah zat yang ditambahkan pada cairan untuk meningkatkan sifat penyebaran dengan menurunkan tegangan permukaan cairan. Kemampuan surfaktan dalam menurukan tegangan dikarenakan surfaktan memiliki struktur molekul amphiphatic yaitu mempunyai struktur molekul yang terdiri dari gugus
25
hidrofilik dan gugus hidrofobik. Sifat-sifat surfaktan yaitu dapat menurunkan tegangan permukaan, tegangan antar muka, meningkatkan kestabilan partikel yang terdispensi dan mengontrol jenis formulasinya baik oil in water (o/w) atau water in oil (w/o). Selain itu surfaktan akan terserap ke dalam permukaan partikel minyak atau air sebagai penghalang yang akan mengurangi atau menghambat penggabungan (coalescence) dari partikel yang terdispensi (Rieger, 1985).
Penambahan surfaktan dalam larutan akan menyebabkan turunnya tegangan permukaan larutan suatu cairan dan diantarmuka fasa baik cair-gas maunpun cair-cair (Swasono, 2012). Setelah mencapai konsentrasi tertentu, tegangan permukaan akan konstan walaupun konsentrasi surfaktan ditingkatkan. Bila surfaktan ditambah melebihi konsentrasi ini maka surfaktan mengagregasi membentuk misel.
Konsentrasi terbentuknya misel ini disebut critical micelle consentration (CMC). Tegangan permukaan akan menurun hingga CMC tercapai. Setelah CMC tercapai, tegangan permukaan akan konstan yang menunjukkan bahwa antarmuka menjadi jenuh dan terbentuk misel yang berada dalam keseimbangan dinamis dengan monomernya (Supriningsih, 2010).
Klasifikasi surfaktan berdasarkan muatannya yaitu:
1. Surfaktan anionik yaitu surfaktan yang bagian alkilnya terikat pada suatu anion.
Karakteristiknya yang hidrofilik disebabkan karena adanya gugus anionik yang cukup besar, biasanya gugus sulfat atau surfonat. Contohnya adalah garam alkana sulfonat, garam olefin sulfonat, garam sulfonat asam lemak rantai
panjang.
2. Surfaktan kationik yaitu surfaktan yang bagian alkilnya terikat pada suatu kation. Surfaktan ini memecah dalam media air, dengan bagian kepala bertindak sebagai pembawa sifat aktif permukaan. Contohnya adalah garam alkil trimethil ammonium, garam dialkil-dimethil ammonium dan garam alkil dimethil benzil ammonium.
3. Surfaktan nonionik yaitu surfaktan yang bagian alkilnya tidak bermuatan.
Contohnya : ester gliserin asam lemak, ester sorbitan asam lemak, ester sukrosa asam lemak, polietilena alkil amina, glukamina, alkil poliglukosida, monoalkanol amina, dialkanol amina, tween 80 dan alkil amina oksida.
4. Surfaktan amfoter yaitu surfaktan yang bagian alkilnya mempunyai muatan positif dan negatif. Contohnya surfaktan yang mengandung asam amino, betain, fosfobetain.
Kehadiran gugus hidrofobik dan hidrofilik yang berada dalam satu molekul, menyebabkan pembagian surfaktan cenderung berada pada antarmuka antara fasa yang berbeda derajat polaritas dan ikatan hidrogen seperti minyak/air atau udara/air. Pembentukan
26
film pada antar muka ini mampu menurunkan energi antarmuka dan menyebabkan sifat-sifat khas pada molekul surfaktan.
Karakteristik utama surfaktan adalah pada aktivitas permukaannya. Surfaktan mampu meningkatkan kemampuan menurunkan tegangan permukaan dan antarmuka suatu cairan, meningkatkan kemampuan pembentukan emulsi minyak dalam air, mengubah kecepatan agregasi partikel terdispersi yaitu dengan menghambat dan mereduksi flokulasi dan penggabungan (coalescence) partikel yang terdispersi, sehingga kestabilan partikel yang terdispersi makin meningkat.
Surfaktan pada umumnya disintesis dari turunan minyak bumi, seperti linier alkilbensen sulfonat (LAS), alkil sulfonat (AS), alkil etoksilat (AE) dan alkil etoksilat sulfat (AES). Surfaktan dari turunan minyak bumi dan gas alam ini dapat menimbulkan pencemaran terhadap lingkungan, karena surfaktan ini setelah digunakan akan menjadi limbah yang sukar terdegradasi. Disamping itu, minyak bumi yang digunakan merupakan sumber bahan baku yang tidak dapat diperbaharui. Masalah inilah yang menyebabkan banyak pihak mencari alternatif surfaktan yang mudah terdegradasi dan berasal dari bahan baku yang diperbaharui. Alternatif tersebut antara lain penggunaan minyak nabati sebagai bahan baku pembuatan surfaktan. Salah satu jenis surfaktan berbahan baku minyak kelapa sawit yang ramah terhadap lingkungan adalah surfaktan jenis anionik yaitu MES.
Pada penelitian ini surfaktan jenis nonionik surfaktan digunakan polysorbate 80 (Tween® 80). Polisorbat 80 atau yang biasa dikenal dengan Tween® 80, C64H124O26 adalah surfaktan nonionik kental yang larut dalam air, mengandung kelompok kepala hidrofilik polioksietilena sorbitan dan ekornya disusun oleh monooleat atau yang biasa dikenal dengan asam oleat, kelompok alkil hidrofobik (Shen dkk., 2011) Berat molekulnya adalah 1310 g mol-1 dan CMC-nya dalam air murni 15,72 mg L-1 (Chou dkk., 2005). Surfaktan ini bertindak sebagai pengemulsi, terutama digunakan dalam industri makanan, terutama dalam pembuatan es krim dan dalam banyak campuran penstabil / pengemulsi komersial (Goff, 1997).
III.6.1 Efek Penambahan Surfaktan Terhadap Performa MFCs
Salah satu hambatan utama bagi bakteri untuk mengirimkan elektron secara eksogen ke anoda adalah bahwa sebagian besar membran dan dinding sel mikroorganisme mengandung bahan nonkonduktif, seperti lipid atau peptidoglikan (Lovley, 2006; Wen dkk, 2011). Ada beberapa penelitian yang melaporkan bahwa kehadiran surfaktan menghasilkan perubahan dalam struktur membran sel untuk membentuk saluran trans-membran,
27
mempengaruhi membran sel dengan mengurangi resistansi, meningkatkan permeabilitas dan degradasi substrat dan dengan mempercepat transportasi zat (Van Hamme dkk, 2006; Singh dkk., 2007).
Wen dkk., 2011 meneliti efek surfaktan terhadap kinerja MFC. Wen dkk., (2011) membuktikan bahwa penggunaan surfaktan nonionik Tween 80 dalam MFC katoda udara meningkatkan produksi daya secara signifikan dari 21,5 W m-3 tanpa surfaktan menjadi 187 W m-3 setelah penambahan surfaktan. Dalam studi lain menggunakan beberapa surfaktan nonionik, Tween 80 mencapai nilai kepadatan sel tertinggi dan laju pertumbuhan spesifik maksimum (Van Hamme dkk., 2006).
Sifat menakjubkan surfaktan dan pengaruhnya terhadap membran sel menjadikannya kelompok bahan kimia yang menarik untuk dipelajari dalam MFC untuk mengevaluasi efeknya terhadap laju transfer elektron dari sel ke anoda dan sebagai konsekuensi dalam daya yang dihasilkan oleh MFC (Wen dkk., 2011).
III.7 Karakteristik Lumpur Lapindo
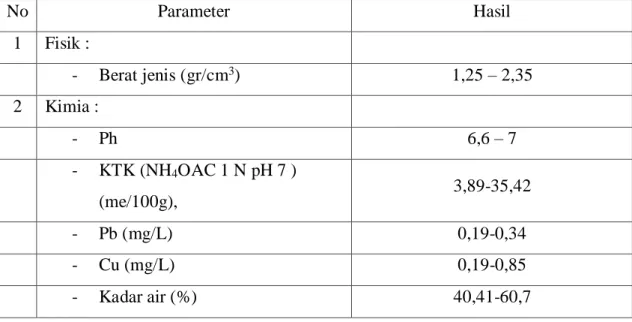
Banjir Lumpur Panas Sidoarjo atau lumpur lapindo merupakan peristiwa menyemburnya lumpur panas di lokasi pengeboran PT Lapindo Brantas di Desa Renokenongo, Kecamatan Porong, Kabupaten Sidoarjo, Jawa Timur, sejak tanggal 27 Mei 2006. Kadar garam (salinitas) lumpur sangat tinggi (38-40 %), sehingga bersifat asin (Juniawan, 2013).
Berdasarkan analisis karakteristik dari lumpur lapindo, diperoleh hasil menurut parameter fisik dan kimia yang ditunjukkan pada Tabel II.6.
Tabel III.6. Karakteristik lumpur lapindo (Juniawan, 2013)
No Parameter Hasil 1 Fisik : - Berat jenis (gr/cm3) 1,25 – 2,35 2 Kimia : - Ph 6,6 – 7 - KTK (NH4OAC 1 N pH 7 ) (me/100g), 3,89-35,42 - Pb (mg/L) 0,19-0,34 - Cu (mg/L) 0,19-0,85 - Kadar air (%) 40,41-60,7
28
- C-Organik total (%) 54,75-55,47
III.8 Dedak Padi (Rice Bran)
Dedak padi merupakan hasil sampingan/limbah dari proses penggilingan padi. sumber alami yang baik dari banyak nutrisi penting tetapi memiliki beberapa keterbatasan dalam aplikasi. Proses pengolahan gabah menjadi beras akan menghasilkan dedak padi kira-kira sebanyak 10% pecahan-pecahan beras atau menir sebanyak 17%, tepung beras 3%, sekam 20% dan berasnya sendiri 50%. Persentase tersebut sangat bervariasi tergantung pada varietas dan umur padi, derajat penggilingan serta penyosohannya (Grist, 1972). Nutrien yang terdapat di dedak padi yang berkualitas baik antara lain komposisi kimia bededak padi cukup tinggi: protein 11,3-14,4%, lemak 15,0- 19,7%, serat kasar 7,0-11,4%, karbohidrat 34,1-52,3% dan abu 6,6-9,9% (Lubis dkk., 2002 dalam Muis, 2012).
Kandungan nutrisi dalam dedak masih sangat melimpah, selain dijadikan pakan ternak. Dedak juga dapat di manfaatkan sebagai MFCs (Shu Takahashi , Morio Miyahara, 2016). Dedak padi memiliki komposisi utama aleuron, lapisan selaput dan subaleuron dan kuman serta sumber yang kaya vitamin, mineral, asam lemak esensial, serat makanan dan sterol lainnya. Kandungan silika berkisar antara 0,34-0,71% serta komposisi nutrisi dari dedak beras yang stabil dianalisis yang mengandung 6,54-9,48% kelembaban, abu 7,24-10,63%, protein 12,26-14,01%, lemak 23,53-27,86%, serat 2,5-10,10%, karbohidrat 42,19-45,74% dan 456,54486. 00 Kkal / 100g energi. Fraksi dari dedak padi mengandung 8 - 14 mg / 100 g Fe, 425 - 940 mg / 100 g Mg, 4,65 - 6,68 mg / 100 g Zn dan 35 - 62 mg / 100 g Ca. Kandungan vitamin B1 (Thiamin), B3 (Niacin) dan B6 (Pyridoxine) masing-masing berkisar antara 14 - 24, 275 - 430 dan 25 - 42 ppm dari dedak padi. Hasil menunjukkan bahwa dedak padi yang mengandung sejumlah nutrisi penting untuk manfaat kesehatan dan berguna dalam banyak aplikasi makanan seperti suplemen makanan dan ekstraksi minyak nabati. Berdasarkan hal di atas, dedak padi dapat dikatakan sebagai bahan fermentasi yang baik dalam kondisi aerob dan anaerob. Karena nutrisi yang terkandung cukup dalam rice bran, memungkinkan mikroorganisme tumbuh untuk pembangkit listrik yang baik sebagaimana dipelajari oleh Takahashi dkk. (2016). Selain itu dedak padi mengandung silika yang tinggi (Agung, 2013), sehingga mampu dimanfaatkan untuk meningkatkan area kontak anoda
29
III.9 Teknologi analisa komunitas mikroba
Analisa komunitas mikroba memerlukan beberapa tahapan utama yang terdiri dari isolasi Deoxyribo Nucleic Acid (DNA), sekuensing DNA dan analisa menggunakan software Bioinformatika.
III.9.1 Isolasi Deoxyribo Nucleic Acid (DNA)
Isolasi Deoxyribo Nucleic Acid (DNA) diperlukan dalam berbagai macam proses, salah satunya adalah proses dalam tahap awal analisa komunitas mikroba dalam suatu sampel penelitian. Secara umum, tahap isolasi DNA menurut Yuwono (2006); Soedjadi (2008); Maftuchah (2014) dalam Nurhayati (2017) dimulai dari pengambilan sampel, pelisisan membran dan/atau dinding sel, ekstraksi DNA, presipitasi DNA, pemurnian DNA, dan pengawetan DNA. Saat ini isolasi DNA secara teknis menjadi lebih mudah dengan munculnya berbagai teknik ekstraksi dan purifikasi dalam bentuk kit. Isolasi DNA merupakan teknik ekstraksi dan atau purifikasi DNA dari suatu sel sebagai tahap awal suatu analisis genetik.
Secara kimiawi penghancuran sel dilakukan dengan memanfaatkan senyawa kimia seperti EDTA (Ethylen Diamnine Tetra Acetic), SDS (Sodium Dodecyl Sulphat),
Ammonium-Choride- Potassium (ACK). Kotoran akibat lisis sel dipisahkan dengan cara sentrifugasi.
Kemudian molekul nukleotida (DNA dan RNA) yang telah dipisahkan dibersihkan dari protein yang masih ada dengan fenol. Dalam proses ini sebagian kecil RNA juga dapat dibersihkan. Sedangkan kloroform digunakan untuk membersihkan sisa -sisa protein dan polisakarida dari larutan. Enzim RNAase digunakan untuk menghancurkan RNA sehingga DNA dapat diisolasi secara utuh. Pemurnian atau purifikasi DNA dapat dilakukan dengan mencampur larutan DNA tersebut dengan NaCl yang berfungsi memekatkan, memisahkan DNA dari larutan, dan mengendapkan DNA pada saat dicampur dengan etanol. Proses sentrifugasi dengan kecepatan tinggi akan mengendapkan tepung berwarna putih (DNA) dan menempel di dasar microtube (Nurhayati, 2017).
III.9.2 Sekuensing DNA
Sekuensing DNA atau pengurutan basa DNA merupakan teknik kunci dalam perkembangan ilmu pengetahuan, di antaranya genetika, bioteknologi, biologi molekuler, dan genomika (Franca dkk., 2002 dalam Tasma, 2015). Sekuensing DNA bertujuan untuk menentukan urutan basa nitrogen (adenin, guanin, sitosin, dan timin) suatu sampel DNA (Tasma, 2015). Dengan diketahuinya urutan basa nitrogen, maka dapat dilakukan identifikasi jenis mikroba dalam suatu sampel. Sehingga sekuensing DNA merupakan proses yang sangat penting dalam analisa komunitas mikroba.
30
Salah satu teknologi sekuensing kapasitas tinggi untuk sekuensing genom total adalah Next Generation Sequencing (NGS), platform yang menyediakan miliaran basa (sekitar 300–600 Gbp) informasi genetik dalam satu kali menjalankan alat (Pattersson dkk., 2009 dalam Tasma dkk., 2015). Teknik sekuensing ini juga menghasilkan data sekuen yang cukup akurat dengan akurasi data sekuen yang dihasilkan dapat mencapai 99,99% (Zhang dkk., 2011 dalam Tasma dkk., 2015). Berbeda dengan teknologi Sanger, sekuensing dengan NGS menghasilkan data sekuen yang berukuran relatif pendek (50–150 bp), namun kuantitas data sekuen yang dihasilkan sangat besar (Tasma dkk., 2015).
III.9.3 Bioinformatika
Bioinformatika merupakan cabang bioteknologi yang menggunakan komputer untuk menganalisis dan mengelola data DNA maupun protein (Thieman dan Palladino, 2013 dalam Ningrum, 2017). Sehingga dengan memanfaatkan teknologi bioinformatika, dapat dilakukan analisa komunitas mikroba pada sampel penelitian, melalui urutan basa nitrogen suatu mikroba yang telah diperoleh dari hasil sekuensing. Menurut Narita dkk., (2012), analisis dalam bioinformatika difokuskan pada tiga jenis dataset, yaitu urutan genom, struktur makromolekul dan percobaan genomik fungsional. Tetapi analisis bioinformatika juga diterapkan pada berbagai data lain, seperti pohon taksonomi, data tentang hubungan jalur metabolik, teks artikel ilmiah dan statistik. Berbagai macam teknik yang digunakan termasuk pencocokan sekuen, struktur protein 3D, konstruksi pohon filogenetik, prediksi dan klasifikasi struktur protein, prediksi struktur RNA, prediksi fungsi protein, dan ekspresi kluster data.
III.10 Penelitian Sebelumnya
Berikut penelitian sebelumnya yang digunakan sebagai penunjang penilitian ini.
31
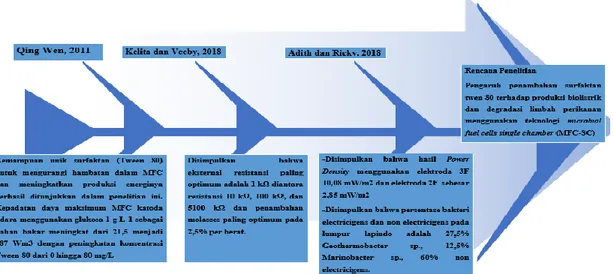
Tabel III.7. Penelitian Terdahulu Nama Peneliti Hasil Penelitian
Qing Wen, 2011 Kemampuan unik surfaktan (Tween 80) untuk mengurangi hambatan dalam MFC dan meningkatkan produksi energinya berhasil ditunjukkan dalam penelitian ini. Kepadatan daya maksimum MFC katoda udara menggunakan glukosa 1 g L-1 sebagai bahan bakar meningkat dari 21,5 menjadi 187 Wm3 dengan peningkatan konsentrasi Tween 80 dari 0 hingga 80 mg/L
Kelita dan Vebby, 2018 Disimpulkan bahwa eksternal resistansi paling optimum adalah 1 kΩ diantara resistansi 10 kΩ, 100 kΩ, dan 5100 kΩ dan penambahan molasses paling optimum pada 2,5% per berat.
Adith dan Ricky, 2018 -Disimpulkan bahwa Elektroda 3F memberikan hasil yang lebih baik dari pada elektroda 2F, dengan hasil terbaik pada elektroda 3F berupa lumpur sebesar 10,08 mW/m2, sedangkan hasil terbaik pada elektroda 2F sebesar 2,85 mW/m2 untuk variabel lumpur
-Disimpulkan bahwa persentase bakteri electricigens dan non
electricigens pada lumpur lapindo adalah 27,5%
Geothermobacter sp., 12,5% Marinobacter sp., 60% non electricigens.
32
BAB IV METODE
Kondisi operasi yang digunakan: 1. Berat total reaktor : 1 kg
2. Suhu : 30 oC (suhu kamar) 3. Tekanan : 1 atm
4. pH : 7 – 8
5. Ukuran Elektroda : 2 x 5 cm (10 cm2) 6. Ketinggian penanaman : - Anoda : 3 cm
- Katoda diatas permukaan IV.1 Variabel Percobaan
IV.1.1 Pengukuran Potensial Listrik Variabel penelitian terdiri dari: 1. Jenis carbon cloth
- Carbon cloth 3F termodifikasi - Carbon cloth 5F termodifikasi 2. Konsentrasi surfaktan tipe tween 80
- Tanpa surfaktan - 100 ppm
3. Jenis medium Lumpur -Lapindo 100%
-Lumpur lapindo + limbah cair perikanan (3:1) -Lumpur lapindo + limbah cair perikanan ( 1:1) -Lumpur lapindo + limbah cair perikanan ( 1:3) 4. Waktu penanaman
33
Gambar IV.1. Rangkaian Alat MFCs IV.2 Bahan Penelitian
Bahan yang digunakan untuk penelitian terdiri dari lumpur lapindo dan limbah cair industri perikanan.,serta bahan-bahan berikut ini :
IV.2.1 Bahan Pembuatan Elektroda
1. Carbon cloth 2. Ti-Wire
3. Rice bran ( Dedak padi) 4. Carbon powder
IV.2.2 Bahan Pembuatan NaCl 0,3 M
1. Aquadest 2. NaCl
IV.2.3 Bahan Ekstraksi DNA menggunakan FastDNA® SPIN Kit for Soil
1. Lysing Matrix E
2. Sodium Phosphate Buffer 3. MT Buffer
4. Larutan Protein Precipitation Solution (PPS)
5. Binding Matrix
34 7. Catch Tubes
8. Concentrated SEWS-M
9. DES (DNase/ Pyrogen-Free Water)
IV.3 Peralatan yang Digunakan 1. Chamber 2. Solder 3. Beaker glass 4. Spatula 5. Water bath 6. Autoklaf 7. Alat Multimeter
IV.4 Metode Percobaan
Pada penelitian ini memiliki prosedur penelitian yang terdiri dari tahap persiapan, tahap penanaman elektroda di dalam chamber, tahap pengukuran potensial listrik, perhitungan jumlah bakteri dan tahap analisa.
IV.4.1 Tahap Persiapan Penelitian
a. Persiapan Pembuatan Surfaktan Tween 80 - Konsentrasi 100 ppm
b. Persiapan Pembuatan Larutan Nacl 0.3 M
NaCl dilarutkan 17.55 gr ke dalam 1000 ml aquadest. c. Persiapan Elektroda
Katoda Ti-wire diukur 25 cm sebanyak 16 buah. Anoda Ti-wire diukur 30 cm sebanyak 16 buah.
Carbon cloth dipotong 2 cm x 5 cm sebanyak 32 buah. Ti-wire dan carbon cloth disatukan dengan menganyam.
d. Tahap Persiapan Resistor
35
e. Tahap Persiapan Lumpur dan Substrat Limbah Cair Perikanan 1. Lumpur lapindo 100%
2. Lumpur lapindo + limbah cair perikanan (3:1) - Lumpur lapindo ditimbang 750 gram
- Limbah cair ikan ditimbang 250 gram - Lapindo dicampur dengan Limbah cair ikan 3. Lumpur lapindo + limbah cair perikanan (1:1) - Lumpur lapindo ditimbang 500 gram
- Limbah cair ikan ditimbang 500 gram - Lapindo dicampur dengan limbah cair ikan 4. Lumpur lapindo + limbah cair perikanan (1:3) - Lumpur lapindo ditimbang 250 gram
- Limbah cair ikan ditimbang 750 gram - Lapindo dicampur dengan limbah cair ikan
f. Tahap Persiapan Elektroda Modifikasi Carbon Cloth - Carbon cloth dipotong 2 cm x 5 cm sebanyak 32 buah
- Menyambung Ti-wire dengan carbon cloth - Dedak padi ditimbang 8 gram
- Carbon Powder ditimbang 0,125 gram
- Melarutkan dedak dengan air
- Mengambil air larutan dedak sebanyak 25 ml - Air larutan dedak dicampur dengan carbon powder - Mengaplikasikan campuran larutan pada carbon cloth - Mengeringkan elektroda
IV.4.2 Tahap Persiapan Chamber dan Penanaman Elektroda a. Tahap Persiapan Chamber (1)
- Carbon cloth 3F/5F modifikasi dicelupkan pada larutan NaCl 0,3 M
- Lumpur lapindo 100%.
- Anoda modifikasi dipasang pada chamber dengan ketinggian 3 cm dari dasar chamber. - Katoda dipasang pada ketinggian dimana carbon cloth menyentuh permukaan
36
- Penambahan surfaktan 100 ppm.dan tanpa surfaktan pada chamber b. Tahap Persiapan Chamber (2)
Carbon cloth 3F/5F modifikasi dicelupkan pada larutan NaCl 0,3 M
- Lumpur lapindo + limbah cair perikanan ( 3:1)
- Anoda modifikasi dipasang pada chamber dengan ketinggian 3 cm dari dasar chamber. - Katoda dipasang pada ketinggian dimana carbon cloth menyentuh permukaan
lumpur.
- Penambahan surfaktan 100 ppm dan tanpa surfaktan pada chamber c. Tahap Persiapan Chamber (3)
- Carbon cloth 3F/5F modifikasi dicelupkan pada larutan NaCl 0,3 M
- Lumpur lapindo + limbah cair perikanan (1 :1)
- Anoda modifikasi dipasang pada chamber dengan ketinggian 3 cm dari dasar chamber - Katoda dipasang pada ketinggian dimana carbon cloth menyentuh permukaan lumpur.
- Penambahan surfaktan 100 ppm dan tanpa surfaktan pada chamber d.Tahap Persiapan Chamber (4)
- Carbon cloth 3F/5F modifikasi dicelupkan pada larutan NaCl 0,3 M
- Lumpur lapindo + limbah cair perikanan (1 :1)
- Anoda modifikasi dipasang pada chamber dengan ketinggian 3 cm dari dasar chamber - Katoda dipasang pada ketinggian dimana carbon cloth menyentuh permukaan lumpur.
- Penambahan surfaktan 100 ppm dan tanpa surfaktan pada chamber IV.4.3 Tahap Pengukuran dan Analisa
Pada tahap analisa ini dilakukan dengan mengukur dan menghitung parameter- parameter sebagai berikut :
IV.4.3.1 Tahap Pengukuran Potensial Listrik
1. Mempersiapkan alat Multimeter untuk mengukur tegangan (V) dan arus listrik (I). 2. Eksternal Resistor dihubungkan pada alat Multimeter dan katoda/anoda dengan
37
3. Setelah semua rangkaian terhubung dengan alat pengukur, maka proses pengukuran bisa dimulai
4. Pengukuran dilakukan setiap 1 minggu sekali selama 6 minggu
Hasil pengukuran didapatkan saat angka pada alat ukur stabil. . Dari data kuat arus dan tegangan, dapat diperoleh nilai power density (mW/m2) yaitu daya per satuan luas permukaan elektroda. Power density dapat dihitung menggunakan persamaan berikut (Momoh dkk., 2010)
Dimana I sebagai kuat arus, V sebagai beda potensial dan A adalah luas permukaan elektroda.
IV.4.3.2 Analisa Jumlah Bakteri
1. Sampel tanah sebanyak 1 gram ditimbang.
2. Sampel diencerkan di dalam tabung reaksi dengan penambahan aquadest hingga 10 ml dengan faktor pengenceran 107
3. Sampel diambil 1 tetes untuk diteteskan diatas permukaan haemocytometer. Lalu, diamati menggunakan mikroskop dengan pembesaran 400x.
Gambar IV.2 Alat Analisa dan Pengukuran :
(a) Soil Tester ;(b) TDS meter ;(c) Mikroskop dan Haemacytometer
IV.4.3.3 Tahap Analisa Pertumbuhan Komunitas Mikroba pada MFCs 1. Ekstraksi DNA dilakukan sesuai protokol FastDNA® SPIN Kit for Soil.
2. Sekuensing dari DNA yang telah di ekstraksi dilakukan dengan menggunakan metode NGS (Next Generation Sequencing).
3. Hasil sekuensing diolah dengan software bioinformatic untuk memperoleh persebaran komunitas mikroba berdasarkan genus
39
BAB V ORGANISASI TIM, JADWAL DAN ANGGARAN BIAYA
V.1 Organisasi Tim Peneliti
Tim ini terdiri dari seorang ketua, Dr.Eng. R.Darmawan, ST., MT. dan 1 (satu) orang anggota yaitu Dr. Ir. Sri Rachmania Juliastuti, M.Eng. serta dua orang mahasiswa. Untuk mempermudah dan memperlancar dalam menjalankan penelitian ini, ketua peneliti membuat pembagian tugas dalam organisasi tim sebagai berikut :
a. Ketua tim peneliti bertanggungjawab dan bertugas untuk mengatur, merancang dan mengembangkan ide penelitian serta mengontrol jalannya penelitian. Selain itu, pengembangan metode – metode percobaan, penentuan material bahan untuk elektrode, lokasi dan lama sampling pengukuran juga merupakan tugas dari ketua tim peneliti. b. Anggota 1, Dr. Ir. Sri Rachmania Juliastuti, M.Eng. bertugas untuk memberikan
masukkan terkait dengan pemanfaatan lumpur sebagai sumber alternatif untuk menghasilkan energi listrik.
Pada penelitian ini melibatkan 2 (dua) mahasiswa program S1 Teknik Kimia, yaitu dengan tema skripsi Pengaruh Penambahan Surfaktan Tween 80 pada Peningkatan Power Density dan Degradasi Limbah Cair Perikanan dalam Reaktor Single Chamber Microbial Fuel Cells (MFCs) dengan Menggunakan Lumpur Lapindo sebagai Culture Source dan Analisa Komunitas Mikroba. Selain itu mahasiswa yang terlibat akan mengajukan Program Kreativitas Mahasiswa Penelitian (PKMP) dengan judul Pemanfaatan Lumpur Lapindo sebagai Culture Source guna Menghasilkan Biolistrik menggunakan
Microbial Fuel Cells (MFCs) dan Analisa Komunitas Mikroba. Mahasiswa bertanggungjawab dan bertugas dalam penelitian ini sebagai berikut:
1. Mempersiapkan elektroda yang akan digunakan dalam eksperimen yaitu dengan melakukan modifikasi elektroda dengan menggunakan dedak padi untuk memperbesar
surface area.
2. Melakukan eksperimen dengan meletakkan elektrode di dalam lumpur, kemudian mengukur potensial listriknya serta mengukur data-data pendukung lainnya seperti pH. Selain itu, mahasiswa juga bertanggungjawab untuk menghitung jumlah bakteri di setiap sampel.
3. Mencatat setiap aktifitas percobaan dalam Logbook Penelitian dan melaporkan hasil eksperimen kepada ketua setiap satu atau dua minggu sekali.
40 V.2 Jadwal
Dalam pelaksanaan penelitian ini dibuat jadwal sebagai berikut :
No Kegiatan Tahun 2020
Mar Apr Mei Jun Juli Agst Sep Okt Nov
1 Studi literatur lanjutan
2 Persiapan bahan dan
peralatan
3 Preparasi elektroda
4 Perendaman elektrode di
lumpur
5 Pengukuran potensial listrik
6 Pengukuran data-data
7 Penghitungan jumlah
mikroba di lokasi sampel
8 Pembuatan laporan kemajuan
9 Analisa hasil eksperimen
10 Pembuatan draft seminar
internasional
11 Pelaksanaan seminar
internasional
12 Mempersiapkan dan submit manuscript ke jurnal
internasional