METODE PENELITIAN
Waktu dan Tempat
Penelitian inidilakukanpada tanggal 29 April 2017 sampai dengan 13 Mei 2017 diLaboratorium Stasiun Karantina Ikan, Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas I Medan II.
Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah peralatan bedah, cawan Petri, laminarairflow, pipet tetes, gelas ukur, tabung reaksi, beakerglass, rak tabung reaksi, ayakan, inkubator, jarum ose, blender, refrigerator, oven, timbangan analitik, mikroskop, magneticstirrer, autoclave, hotplatestirrer, spatula, bunsen, mikropipet, jarum suntik, termometer, pH meter, kamera digital, alat tulis, akuarium berukuran 50x30x30 cm sebanyak 12 unit, aerator, kertas milimeter, plastik 10 kg, ember, baskom, sprayer, dan bulu ayam,
Rancangan Penelitian
Penelitian dilakukan dengan metode Rancangan Acak Lengkap (RAL) secara langsung konsentrasi ekstrak daun S. alba terhadap pertumbuhan bakteri A. hydrophila. Untuk mengetahui pengaruh daya hambat ekstrak daun S. alba
terhadap pertumbuhan bakteri, maka digunakan rancangan percobaan acak lengkap dengan 4 perlakuan dengan ulangan 3 kali. Perlakuan tersebut menggunakan dosis yang berbeda yaitu:
1 P0 : Tanpa penambahan ekstrak (kontrol) 2 P1 : Penambahan ekstrak S. alba1% 3 P2 : Penambahan ekstrak S. alba 2% 4 P3 : Penambahan ekstrak S. alba 3%
Prosedur Penelitian
Persiapan dan Ekstraksi S. alba
Daun tumbuhan S. albadiambil dari kawasan Paluh Kurau Kecamatan Hamparan Perak Kabupaten Deli Serdang Provinsi Sumatera Utara sebanyak 10 kg. Daun S. alba dicuci dengan air mengalir dan dipotong kecil-kecil kemudian dikeringkan anginkan selama 7 hari, untuk mengurangi penguapan yang mengikutkan senyawa yang terkandung di dalammya (Pradana, dkk., 2014).
Proses pengeringan ini bertujuan menurunkan kadar air sehingga tidak mudah ditumbuhi kapang dan bakteri serta menghilangkan aktivitas enzim yang dapat menguraikan lebih lanjut kandungan zat aktif yang terdapat dikulit batang tumbuhan tersebut (Gunawan dan Sri, 2004).
Serbuk selanjutnya diayak menggunakan ayakan hingga diperoleh serbuk yang halus dan seragam. Serbuk hasil ayakan sebanyak 1,5 kg dapat dilihat di Lampiran 1. Pellet dan serbuk di semprotkan dengan air sesuai dengan dosis masing-masing. Air berfungsi sebagai perekat terhadap pellet. Kemudian pellet tersebut di jemur di bawah matahari agar bersatu eksrak degan pellet kemudian berikan pada ikan sesuai dengan dosis masing-masing.
Persiapan Pakan dan Penambahan Dosis Ekstrak
Pakan yang digunakan selama penelitian berupa pakan buatan pelet tipe FF-999. Kandungan nutrisi pakan pelet FF-999 dapat dilihat pada Tabel 1. Pakan dicampur dengan ekstrak S. alba sesuai dengan perlakuan dan dosis masing-masing. Setelah itu disemprotkan dengan air supaya pakan dengan ekstrak S.alba bersatu dan pakan tidak hancur, maka diaduk menggunakan bulu ayam dapat dilihat pada lampiran 1. Ikan diberikan makan 3x sehari pada waktu 08.00, 12.00, 14.00 WIB dengan takaran 1 gr sekali makan.
Tabel 1. Kandungan nutrisi pakan pellet FF-999
Keterangan Gizi Nilai (%)
Protein 35
Lemak 2
Serat kasar 3
Abu kasar 13
Persiapan Wadah Pemeliharaan
Wadah pemeliharaan dalam penelitian ini adalah akuarium berjumlah 12 unit yang berukuran 50x30x30 cm dengan volume akuarium 45 liter dapat dilihat di Lampiran 2. Sebelum digunakan, akuarium dicuci dengan detergen sebanyak 2 kali, kemudian dibilas dengan air bersih, selanjutnya ditiriskan sampai kering. Akuarium yang sudah bersih dan kering, disusun dan di beri tanda P0, P1, P2, P3 secara acak untuk menandai perlakuan dan ulangan dalam penelitian. Akuarium yang sudah di beri tanda dan di susun secara acak di beri air bersih dengan ketinggian air 20 cm per akuarium dan di aerasi selama satu hari (24 jam).
Akuarium selang aerasi sebelum digunakan terlebih dahulu di desinfeksi di dalam larutan Kalium permanganat (KMnO4) 2,5 mg/L selama 24 jam
(Mangunwardoyo, dkk., 2010). Persiapan Ikan Uji
Ikan uji yang digunakan adalah ikan nila ukuran panjang ±5-8cm dengan bobot ±12 g berjumlah 60 ekor. Sebelum ikan uji dimasukkan ke dalam wadah, terlebih dahulu ikan di aklimatisasi selama satu hari (24 jam) dapat dilihat di lampiran 2. Setelah ikan di adaptasi, ikan dimasukkan ke dalam aquarium sebanyak 5 ekor per akurium.
Tahap Pengidentifikasian Bakteri
Adapun langkah-langkah untuk identifikasi bakteri adalah sebagai berikut: 1. Sterilisasi Alat dan Bahan
Alat-alat yang akan disterilisasi dicuci terlebih dahulu dengan menggunakan detergen setelah itu dikeringkan. Sebelum dimasukkan kedalam autoclaf, cawan petri dibungkus dengan kertas sampul dan tabung reaksi ditutup dengan kapas, kemudian dibungkus dengan kertas dan diikat. Alat dimasukkan kedalam autoklaf, kemudian autoclaf dihidupkan dengan suhu 121°C selama 15 menit. Setelah selesai autoclaf dibuka dan semua alat dipindahkan pada oven. 2. Pembuatan Media Pertumbuhan
Media pertumbuhan untuk bakteri A. hydrophila dibuat dengan menggunakan bubuk TSA (TripticSoyAgar) sebannyak 24 g yang dilarutkan dengan 600 ml akuades didalam erlenmeyer ukuran 1 liter. Batang magneticstirrer dimasukkan kedalam larutan media agar media teraduk sempurna saat pemanasan di atas hotplate. Erlenmeyer kemudian ditutup rapat dengan kapas yang dibungkus aluminium foil. Setelah media mendidih dan berubah menjadi bening, media dibagi kedalam 2 erlenmeyer yang berukuran 500 ml dan di tutup rapat menggunakan kapas yang dibungkus dengan aluminium foil. Selanjutnya media TSA disterilkan didalam autoklaf selama 15 menit pada suhu 1210C dan tekanan 1 atm. Setelah media disterilkan, media selanjutnya didiamkan sebentar didalam Laminarairflow sampai hangat-hangat kuku untuk kemudian dituang kedalam
3. Peremajaan Bakteri
Bakteri A. hydrophila diremajakan masing-masing pada media TSA dengan cara menggoreskan jarum ose yang mengandung bakteri A. hydrophila pada 1 cawan petri yang berisi media TSA. Penggoresan dilakukan secara aseptis yaitu membakar jarum ose dengan api bunsen sampai berpijar sebelum dan sesudah penggoresan, selalu dekat dengan api bunsen selama penggoresan berlangsung dengan mengatur jarak jarum ose yang mengandung bakteri dengan api bunsen agar bakteri yang akan diremajakan tidak mati. Setelah itu media yang berisi bakteri tersebut diinkubasi selama 24-48 jam pada suhu 370C.
4. Pembuatan Suspensi Bakteri dan Konsentrasi Uji
Setelah bakteri tumbuh saat peremajaan, bakteri siap untuk dilakukan uji antibakteri. Tahap pertama yang dilakukan adalah pembuatan suspensi bakteri dengan cara mengmabil biakan menggunakan jarum ose dan disuspensikan dengan cara dimasukkan ke dalam tabung berisi 3 ml larutan NaCl 0,9%. Suspensi yang terbentuk disetarakan dengan larutan Mc. Farland 0,5 yang ekuivalen dengan suspensi sel bakteri dengan konsentrasi 1 x 108 cfu/ml.
5. Persiapan Peralatan Uji
dimasukkan kedalam 20 cm air di dalam akuarium 50x30x30 cm, dan setelah itu diberikan pakan buatan pellet tipe FF-999 sesuai dengan dosis masing-masing. Setelah itu dibiarkan selama 24 jam atau sampai tampak gejala klinis pada ikan. 6. Pengambilan Sampel
Ikan yang mati kemudian dibedah dengan menggunakan pisau bedah steril. Isolasi bakteri kembali dilakukan dari organ ginjal pada ikan. Organ ini merupakan tempat perkembangbiakan A. hydrophila dan mudah dibedakan dari organ pencernaan lainnya. Dapat dilihat pada Lampiran 3.
Uji Biokimia A. hydrophila
Pewarnaan Gram
a. Disiapkan gelas objek yang telah dibersihkan dari lemak dengan alkohol 70 % dan diberi label.
b. Diteteskan 1 tetes akuades steril pada permukaan gelas objek.
c. Diambil isolat dengan jarum ose steril, campur dengan akuades dan diulas merata pada permukaan gelas objek.
d. Difiksasikan dengan melewatkan preparat di atas api (jarak 15 cm) beberapa kali sampai terlihat kering.
e. Diteteskan larutan Crystal violet pada preparat sampai merata dan diamkan selama 1 menit.
f. Dicuci dengan air mengalir.
g. Diteteskan larutan Iodine lugol pada preparat sampai merata, dan diamkan selama 1 menit.
i. Diteteskan larutan alkohol aseton pada preparat sampai merata dan diamkan maksimal 30 detik.
j. Dicuci preparat dengan air mengalir dan dikeringanginkan.
k. Diteteskan larutan safranin pada preparat sampai merata dan diamkan selama 2 menit.
l. Dicuci preparat dengan air mengalir dan dikeringanginkan. m. Diamati preparat menggunakan mikroskop.
n. Sifat bakteri Gram negatif ditandai dengan sel bakteri berwarna merah/pink,
bentuk batang. Uji Mortalitas
a. Diambil isolat dengan jarum ose lurus, dan inokulasikan dengan menusukkan pada media semi solid (SIM agar, MIO agar).
b. Dinkubasikan pada suhu 25°C-28°C selama 18 jam-24 jam.
c. Reaksi positif ditandai oleh adanya pertumbuhan bakteri yang menyebar dan tidak terlihat bekas tusukan.
Uji Oksidase
a. Dibasahi kertas saring dengan pereaksi oksidasi.
b. Diambil 1 loop isolat bakteri, goreskan pada kertas saring yang sudah diberi reagen oksidasi.
c. Reaksi oksidasi positif ditandai munculnya warna biru keunguan pada goresan.
Uji Oksidatif-fermentatif
a. Disiapkan 2 tabung berisi media O/F.
Xij = µ + σi + εij
c. Diinokulasikan isolat bakteri ke dalam tabung yang berisi media O/F dengan cara ditusukkan.
d. Satu tabung diisi dengan parafin cair steril hingga ketinggian 1 cm di atas
permukaan media O/F, sedangkan tabung lainnya tanpa parafin cair.
e. Reaksi fermentatif ditandai perubahan warna media pada tabung yang diisi parafin cair dari hijau menjadi kuning.
Uji Rimmler-Shotts (RS)
a. Diambil isolat bakteri dengan jarum ose sterildan goreskan pada media RS. b. Diinkubasikan pada suhu 37°C selama 18 jam-24 jam.
c. Diamati koloni yang tumbuh, apabila berwarna kuning tanpa warna hitam di tengah koloni berarti positif Aeromonas hydrophila. (Lampiran 4)
Analisis Data
Data yang diperoleh dari hasil pengamatan selama penelitian akan menggunakan Analisis Sidik Ragam (ANOVA) dengan uji F pada selang kepercayaan 95%, digunakan untuk menentukan apakah perlakuan yang dilakukan berpengaruh nyata terhadap kelangsungan hidup. Apabila berpengaruh nyata, untuk melihat perbedaan antar perlakuan akan diuji lanjut dengan menggunakan uji Beda Nyata Terkecil (BNT).
1. Rancangan Percobaan
Gasperz (1991) model linear yang digunakan dari Rancangan Acak Lengkap adalah sebagai berikut:
Keterangan:
µ : Rata-rata umum
σi : Pengaruh perlakuan ke-i
εij : Pengaruh faktor random pada perlakuan ke-i dan ulangan ke-j
2. Kelangsungan Hidup
Kelangsungan hidup merupakan persentase dari jumlah ikan yang hidup dan jumlah ikan yang ditebar selama pemeliharaan dihitung menggunakan rumus (Effendie, 1979).
Keterangan:
SR : Kelangsungan hidup ikan (%)
Nt : Jumlah ikan yang ditebar pada akhir penelitian (ekor)
HASIL DAN PEMBAHASAN
Hasil
Uji Biokimia Bakteri Aeromonashydrophila
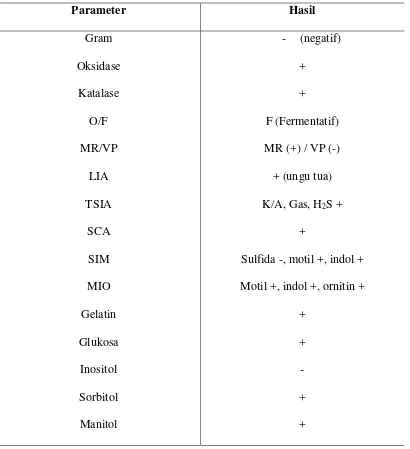
Dari hasil uji biokimia pada masing-masing hewan uji, diketahui bahwa bakteri yang diidentifikasi adalah bakteri A. hydrophila. Hasil uji biokimia bakteri A.hydrophila dapat dilihat pada Tabel 2.
Tabel 2. Hasil Uji Biokimia Bakteri A.hydrophila.
Parameter Hasil
Gram - (negatif)
Oksidase +
Katalase +
O/F F (Fermentatif)
MR/VP MR (+) / VP (-)
LIA + (ungu tua)
TSIA K/A, Gas, H2S +
SCA +
SIM Sulfida -, motil +, indol +
MIO Motil +, indol +, ornitin +
Gelatin +
Glukosa +
Inositol -
Sorbitol +
]Keterangan:
0/F : Oksidasi/Fermentatif TSIA : TripleSugarIron Agar SIM : SulfidaIndolMotility MIO : MotilitasIndolOrnitin SCA : SimonsCitrateAgar LIA : LysinIronAgar
Perkembangan Gejala Klinis
Hasil pengamatan menunjykan bahwa perlakuan P0 dan P3 menunjukan gejala klinis yang sangat siknipikan kemudian diikuti oleh perlakuan P2, sedangkn pada perlakuan P1 tindak menunjukkan gejala klinis terhadap penyerangan A. hydrophila
Dari hasil pengamatan di ketahui bahwa gejala klinis terhadap infeksi A. hydrophila sudah terlihat pada hari pertama sampai akhir penelitian. Gejala klinis dari infeksi A. hydrophila yang diamati selama penelitian adalahmula-mula kulit tampak pucat, danbeberapa jam kemudian terjadipembengkakkan, sirip patah-patah (geripis), serta keseimbangantubuh ikan terganggu, sehingga ikansering berenang lemah ke permukaan airdan cenderung menyendiri.
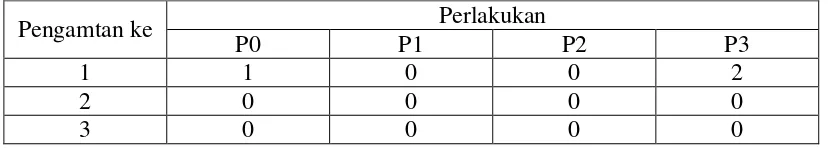
Untuk mengetahui jumlah ikan yang diserang A. hydrophila berdasarkan gejala kilinis selama penelitian dapat dilihat pada tabel 3 di bawah ini :
Tabel 3. Infeksi A. hydrophila pada perlakuan selama penelitian .
Pengamtan ke Perlakukan
P0 P1 P2 P3
1 1 0 0 2
2 0 0 0 0
4 2 0 1 0
Sumber : data Primer
Pengujian LD50dari Perlakuan
Dari hasil pengujian LD50 ekstrak daun S. alba terhadap bakteri A.
hydrophila memperlihatkan jumlah kematian yang ikan Nila pada beberapa pada
perlakuan dapat dilihat pada Tabel 4.
Tabel 4. Hasil Uji Toksisitas LD50 ekstrak daun S. albadari masing-masing
Mortalitas
Selain menunjukan gejala klinis ikan yang terserang oleh bakter A. hydrophilajuga ada yang mati, kematian ini disebabkan oleh penyerangan dari
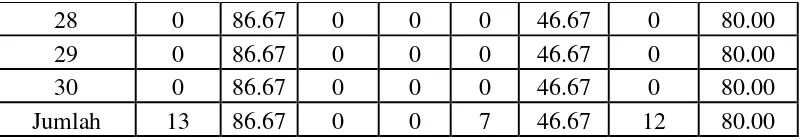
bakteri A. hydrophila. Untuk mengetahui mortalitas dari masing-masing perlakuan dapat dilihat pada table di bawah ini.
Tabel 5. Mortalitas ikan uji selama penelitian
28 0 86.67 0 0 0 46.67 0 80.00
29 0 86.67 0 0 0 46.67 0 80.00
30 0 86.67 0 0 0 46.67 0 80.00
Jumlah 13 86.67 0 0 7 46.67 12 80.00
Kelangsungan Hidup
Kelangsungan hidup berbanding terbalik dengaN mortalitas.Selama penelitian berlangsung ikan uji mengalami kematian. Untuk mengetahui kelangsungan hidup ikan uji selama penelitian dapat dilihat pada tabel di bawah ini.
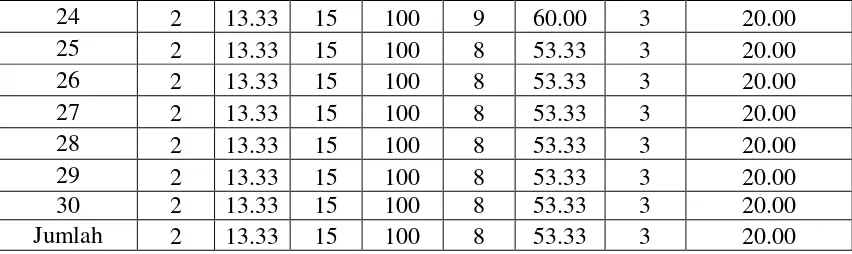
Tabel 6. Kelangsungan Hidup Ikan Nila selama penelitian
24 2 13.33 15 100 9 60.00 3 20.00
Sedangkan untuik menngetahui seberapa jauh pengaruh dari perlakuan terhadap kelangsungan hidup ikan dapat dilihat pada table di bawah ini. Tabel ini yang akan digunakan untuk analisis data ANOVA.
Tabel 7. Kelangsungan hidup dari masing-masing perlakuan dan ulangan Perlakuan Ulangan N0
(Ekor)
Pembahasan
Uji Biokimia Bakteri A. hydrophila
Bakteri yang menginfeksi dari Ikan Nila adalah murni dari A. hydrophila. Hal ini dikarenakan bakteri uji yang dipakai adalah bakteri yang memang dikembangkan dari pemurnian A. hydrophila jadi yang tumbuh semata-mata bakteri A. hydrophila. Untuk menguji kemurnian bakteri tersebut telah dilakukan ujia biokimia.
Uji biokimia merupakan cara yang dilakukan untuk mengidentifikasi kemurnian dari suatu biakan bakteri. Kemurnian hasil isolasi dapat dilihat melalui sifat-sifat fisiologisnya dari bakteri yang dimilki. Uji biokimia yang dilakukan menggunakan biakan murni bakteriA. hydrophila.
Pengujian biokimia pada bakteri A. hydrophilamenggunakan metode yang dipakai oleh Holt, dkk (1994). Metode yang dipakai menggunakan 11 parameter MIO, SIM, Oksidase, Katalase, LIA, Mr/VP, dan gula-gula (glukosa, inositol, sorbitol dan manitol
Tujuan dilakukannya uji motilitas adalah untuk mengetahui gerak dari suatu bakteri yang diuji dengan menggunakan media MIO dan SIM. Pada media SIM selain untuk melihat motilitas juga untuk mengetahui pembentukan H2S.
Adanya penyebaran warna putih seperti akar disekitar inokulasi, menunjukkan adanya pergerakan dari bakteri yang diinokulasikan, yang berarti bakteri memiliki flagel.
campuran (metilenglikon) dari proses fermentasi glukosa yang terkandung dalam media MR. Uji VP digunakan untuk mengetahui pembentukan asetil metal karbinol dari hasil fermentasi glukosa.
Tujuan pengujian TSIA adalah untuk mengetahui kemampuan bakteri untuk memfermentasikan karbohidrat. Pada media TSIA berisi 3 macam karbohidrat yaitu glukosa, laktosa dan sukrosa. Indikatornya adalah phenolred yang menyebabkan perubahan warna dari merah oren menjadi kuning dalam suasana asam. Glukosa berada di dasar media sedangkan laktosa dan sukrosa berada pada bagian lereng/kemiringan. Bakteri hanya memfermentasikan glukosa bila pada dasar (butt) media berwarna kuning maka bersifat asam dan lereng (slant) berwarna kuning maka bersifat asam.
Uji gula-gula digunakan untuk mengetahui apakah bakteri memfermentasikan masing-masing gula diatas membentuk asam. Tidak terjadi perubahan warna merah menjadi kuning, artinya bakteri tidak memfermentasikan gula dan sebaliknya.
Dari hasil uji dan metode yang dipakai untuk mengidentifikasi pemurnian bakteri maka parameter yang di uji menunjukan bahwa bakteri yang digunakan untuk menginfeksi ikan uji adalah murni dari bakteri A. hydrophila. Hal ini sesuai dengan criteria yang disampaikan oleh Tantudkk(2013).
Gejala Klinis
ikan terganggu, sehingga ikansering berenang lemah ke permukaan airdan cenderung menyendiri.
Gejala ini sesuai dengan pendapat Olga (2013) yang menyatakan bahwa ada kemiripan gejala-gejala penyakitdalam penelitian ini dengan gejala infeksi A. hydrophila pada penelitiannya yaitu infeksi A. hydrophila dapat dilihat dari gejala
ekstrenal seperti munculnya bercak-bercak putih pada tubuh ikan, mukus di seluruh tubuh berkurang, perut mengembung bengkak dan berwarna putih kekuningan. Sirip dada memutih dan terdapat bercak-bercak merah. Sirip punggung geripis, daerah bekas suntikan luka dan mengembung. Gerakan tubuh melemah, berenang kurang aktif, mengapung di permukaan air atau berenang di dasar.
Sedangkan untuk membuktikan dengan pasti infeksi A. hydrophilamaka dilakukan pengamatan terhadap perubahan patologi eksternal dan internal pada setiap ekor ikan yang matian. Untuk membuktikan bagian internal maka diambil organ ginjal guna dilakukan isolasi dan identifikasi bakteri. Hal ini sesuai dengan pendapat Mangunwardoyo, dkk (2010) untuk isolasi dan identifikasi bakteri A. hydrophiladiambil dari ginjal dan luka dari infeksi bakteri. Hasil uji biokimia
didukung oleh Holt, dkk (1994) bahwa hasil isolasi tersebut akan menghasilkan warna dan bentuk koloni, serta morfologi bakteri yang sama dengan karakter A. hydrophila. Hasil uji biokimia mengidentifikasi bahwa menunjukkan bakteri
pendapat Olga (2013) yang menyatakan bahwa gejala internal yang timbul akibat infeksi A.hydrophila antara lain adanya cairan kuning di rongga perut, ginjal berwarna merah pucat dan lembek, hati merah kecoklatan, jantung, insang, usus pucat, lambung mengembung berisi air, otot menjadi lembek dan mudah rusak.
Pengujian LD50dari Perlakuan
Pengujian LD50 ekstrak daun S. alba terhadap bakteri A. hydrophila
memperlihatkan mortalitas 50% berada pada antar perlakuan.Perlakuan yang paling banyak mematikan ikan uji adalah perlakuan P0 kemudian di ikuti oleh perlakan P3, P2 dan yang terkecil pada perlakuan P1.
Semakin tinggi konsentrasi ekstrak daun daun S. alba, maka semakin tinggi mortalitas ikan uji.Hal ini terjadi karena ekstrak daun S. alba mengandung senyawa aktif sebagai antimikroba yang bersifat flavonoid, fenol, saponin, dan tannin. Dari pengamatan di simpulkan bahwa jumlah ekstrak daunS. albayang terlalu tinggi dapat menjadi bahan pencemar bagi ikan.
Dari pengamatan tersebut terlihat bahwa jumlah ekstrak daunS. albayang tinggi dapat mematikan ikan uji, hal ini sesuai dengan pendapatPutri, dkk (2016) yang menyatakan bahwa flavanoid secara umum bertindak sebagai antioksidan, fenol sebagai antibakteri, saponin sebagai menghemolisis darah, dan senyawa tanin merupakan senyawa organik yang aktif menghambat pertumbuhan mikroba, jika kosentrasi ini terlalu tinggi akan berbahaya terhadap pertumbuhan ikan.
sebagai antimikroba dan dalam larutan yang sangat kental saponin sangat beracun untuk ikan. Perlu diketahui bahwa tumbuhan yang mengandung saponin telah lama digunakan sebagai racun untuk membubuh ikan di tambak.
Uji toksisitas terhadap bakteri A. hydrophila dengan ekstrak daun S. albapada perlakuan kosentrasi 0% (P0), kosentrasi 1% (P1), kosentrasi 2% (P2)
dan Kosentasri 3% (P3) dengan 3 kali ulangan, maka diketahui mortalitas dari masing-masing perlakuan adalah perlakuan P0 = 13 ekor, perlakuan P1 = 0, perlakuan P2 = 7 ekor dan perlakuan P3 = 12 ekor.
Hasil analisis mortalitas (persen kematian) dikonversikan ke nilai probit dengan menghitung/persamaan regresi linier maka untuk mendapatkan nilai LD50.
Nilai LD50 yang diperoleh dari ekstrak daun S. alba adalah 2,608 gr/kg.
Penambahan ekstrak daun S. albasebanyak 2,608 gr dalam 1 kg pakan ikan dapat mematikan 50% populasi ikan uji.
Mortalitas
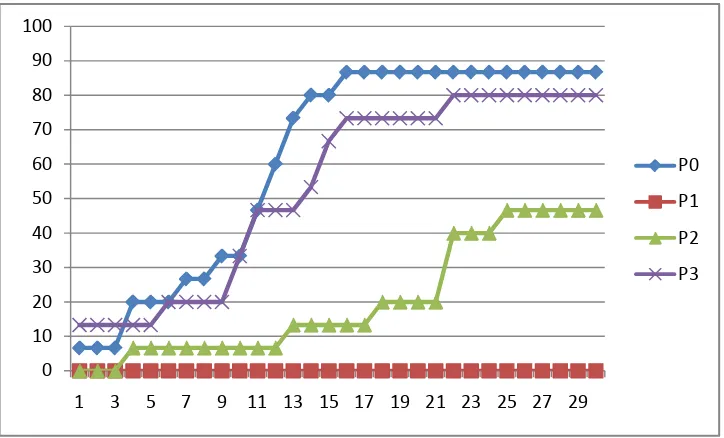
Gambar 5. Mortalitas ikan uji selama pengamatan
Dari gambar terlihat bahwa mortalitas yang tinggi terjadi pada perlakuan P0 dan P3. Kematian pada perlakuan P0 tanpaknya banyak disebabkan oleh pengaruh infeksi dari bakteri ini A. hydrophila sedangkan pada perlakuan P3 kematian ikan kemungkinan disebabkan oleh tingginya kadar saponin di dalam darah ikan. Karena daunS. albamengandung saponin. Saponin merupakan racun bagi ikan berdarah merah.
Pendapat ini didukung oleh Robinson (1995), ekstrak daun S. alba mengandung unsureflavonoid, fenol, saponin, dan tannin.Fungsi dari ekstraknya dapat membunuh bakteri A. hydrophila , selain dapat membunuh bakteri juga dapat membunuh ikan, karena ekstraknya mengandung saponin yang dapat meracuni ikan berdarah merah.
Jika diamati terlihat kematian yang tertinggi terjadi pada hari ke enam sampai hari ke delapan belas, kematian pada perlakuan P0 (kontrol) diasumsikan memang disebabkan oleh infeksi penyakit,sedangkan perlakuan P3 kematian disebabkan oleh keracunan saponin. Asumsi ini dukung oleh pengamatan pada
perlakuan P2,di perlakuan ini terlihat kamatian ikan sangat berlahan ini membuktikan bahwa perlakuan dengan dosis ekstrakS. albayang tinggi dapat meracuni ikan, jika dosisnya sesuai maka dapat menghambat pertumbuhan bakteri A. hydrophila.
Asumsi ini di ajukan karena ciri-ciri kematian ikan pada perlakuan P0 dengan P4 berbeda.Ciri-ciri kematian pada perlakuan P0 adalahmunculnya bercak-bercak putih pada tubuh ikan, mukus di seluruh tubuh berkurang, perut mengembung bengkak dan berwarna putih kekuningan. Sirip dada memutih dan terdapat bercak-bercak merah. Sirip punggung geripis, daerah bekas suntikan luka dan mengembung. Gerakan tubuh melemah, berenang kurang aktif, mengapung di permukaan air atau berenang di dasar. Sedangkan ciri-ciri kemmatian pada perlakuan P3 adalah otot lembek danmudah pecah, saluran pencernaankosong berisi cairan, hati merahkecoklatan, ginjal merah dengan tepikehitaman, adanya cairan kuning di rongga perut, ginjal berwarna merah pucat dan lembek, hati merah kecoklatan, jantung, insang, usus pucat, lambung mengembung berisi air.
Gejala-gejala klinis hanya ditimbulkan oleh ikan uji akibat infeksi A. hydrophila antara lain nafsu makan berkurang, gerakan ikan yang lamban, timbul borok pada sisik, mata menonjol, insang pucat dan terjadi pendarahan pada tutup insang. Selain itu patogen A. hydrophila menyerap nutrisi dan merusak jaringan organ tubuh juga mengeluarkan toksin yang disebarkanke seluruh tubuh melalui aliran darah sehingga menyebabkan hemolisis dan pecahnya pembuluh darahIrianto, dkk (2006).
mortalitas ikan (F hit 17,667 > F tab 4,066181). Analisis ANOVA dapat dilihat pada Lampiran 5.
Pada perlakuan P1 terlihat tidak ada ikan yang mati, ini berarti bahwa perlakuan P1 dengan dosisS. albasebesar 1 gr adalah perlakuan yang efektif untuk membunuh bakteri A. hydrophila, sedangkan kematian pada perlakuan P2 dan P3 disebabkan oleh keracunan ikan.
Jadi dapat disimpulkan bahwa hipotesis H0ditolak sehingga hipotesis H1 diterima. Dosis ekstrakS. albayang tepat dapat membunuh bakteri A. hydrophila dan apabila dosis berlebihan maka dapat meracuni ikan.Untuk itu perlu penelitian lanjutan tentang dosis yang tepat untuk menghambat pertumbuhan bakteri A. hydrophila.
Kelangsungan Hidup
Tingkat kelangsungan hidup berbanding terbalik dengan mortalitas, pada perlakuan terlihat bahwa pemberian ekstrak S. albayang semakin banyak dapat mengakibatkan tingkat kelangsungan hidup semakin rendah, begitu juga jika perlakuan tidak diberi ekstrak S. alba maka kelangsungan juga akan rendah.
Hal ini dapat dilihat pada masing-masing perlakuan yaitu kelangsungan hidup yang tertinggi terdapat pada perlakuan P1 mencapai 100%, kemudian di ikuti perlakuan P2 hanya 53,33%, perlakuan P3 hanya 20% dan yang sedikit pada perlakuan kontrol tanpa ekstrakS. albaikan uji hanya hidup sebanyak 13,33%.
selera makan meningkat, daya tahan tubuh ikan terhadap pengaruh lingkungan sekitarnya akan semakin baik sehingga mortalitas ikan kecil.
KESIMPULAN DAN SARAN
Kesimpulan
1. Ekstrak daun S. alba dapat menghambat pertumbuhan bakteri A.
hydrophila karena dalam tumbuhan mangroveS. alba tersebut memiliki
kandungan senyawa metabolit sekunderditemukan disuatu organism diantaranya adalah alkaloid, terpenoid,steroid, saponin,tannin.
2. Dosis ekstrak yang aman digunakan dalam menghambat bakteri A. hydrophila adalah 1% dari konsentrasi LD50yang di dapatkan yaitu 2,608
gr/kg Saran