BAB 2
TINJAUAN PUSTAKA 2.1.Tumbuhan Kareumbi
2.1.1. Morfologi Tumbuhan Kareumbi
Tumbuhan Kareumbi (Homalanthus populneus (Geiseler) Pax) tingginya bisa mencapai 12 m
dengan diameter 12 cm setinggi dada. Pucuk daun sekitar 14 mm, berwarna merah. Urat daun
sederhana, menyirip atau tiga, bagian bawah berwarna agak keputihan. Bunga sekitar 1,5
mm, berwarna kekuningan. Buah sekitar 5 mm, berwarna hijau.
Tumbuhan kareumbi tumbuh pada daerah seperti semak belukar, pinggiran jalan, tepi
hutan hujan tropis, lereng curam, tepi sungai, tempat berbatu di ketinggian sampai 3000
meter. Manfaat tumbuhan ini yaitu akar digunakan secara lokal sebagai obat melawan roh
jahat, daunnya digunakan untuk melawan diare, sedangkan buahnya diaplikasikan untuk
mengobati luka. Kulit dan daunnya juga membentuk bahan pewarna hitam. Daunnya
digunakan sebagai bahan racun ikan.
Penyebarannyan tumbuhan kareumbi yaitu Thailand, Semenanjung Malaysia,
Sumatera, Jawa, Kepulauan Sunda Kecil, Borneo (Sarawak, Brunei, Sabah, Barat, Selatan
dan Timur-Kalimantan), Filipina, Sulawesi, dan Maluku.
2.1.2. Sistematika Tumbuhan Kareumbi
Kingdom : Plantae
Divisi : Magnoliophyta
Class : Magnoliopsida
Ordo : Euphorbiales
Famili : Euphorbiaceae
Genus : Homalanthus
Spesies : Homalanthus populneus (Geiseler) Pax
2.2.Senyawa Bahan Alam
Bahan alam didefinisikan sebagai senyawa organik dengan bobot molekul antara 100 hingga
2000. Bahan alam telah menjadi dasar pengobatan, dan bahkan sekarang, banyak senyawa
yang penting bagi farmasi dan kedokteran diperoleh dari sumber alam. (Heinrich,2010)
Pada hakekatnya kimia bahan alam merupakan pengetahuan yang telah dikenal sejak
peradaban manusia tumbuh. Contoh yang dapat segera diketahui adalah pembuatan bahan
makanan, pewarnaan benda, obat-obatan atau stimulan, dan sebagainya (Sastrohamidjojo,
1996).
Sejak kira-kira pertengahan abad ke 18, telah dapat dipisahkan beberapa senyawa
organik dari mahluk hidup serta hasil produksinya. Seorang ahli kimia Jerman, Karl Eilhelm
Scheele (1742-1786) sangat terkenal dengan keahliannya dalam bidang ini, beliau telah
berhasil memisahkan beberapa senyawa sederhana. Biogenesis dari produk alami, meskipun
pada mulanya berkaitan dengan kimia organik dan biokimia, menjadi berlainan karena
mempunyai tujuan yang berlainan. Kimia organik terutama mempelajari struktur, sifat-sifat
kimia dan fisika, serta cara sintesisnya, baik secara alami ataupun in vitro dari zat-zat kimia
tetapi cenderung untuk mengabaikan sifat-sifat khusus dari bahan alam, misalnya tentang
cara pembentukan dan peran biologisnya. Biokimia, berusaha menjawab
pertanyaan-pertanyaan yang paling banyak diajukan terutama tentang metabolisme primer, dan
mengabaikan proses-proses sekunder misalnya tentang pembentukan alkaloid, terpena dan
lain-lain (Manitto, 1981).
2.3.Senyawa Metaboli Sekunder
Banyak senyawa kimia tanaman yang telah diisolasi dan diublikasikan sebelum diketahui
strukturnya. Pengelompokan senyawa kimia tanaman berdasarkan sifat khas yang dimilikinya
(antara lain warna, rasa, bau, pH, dan kelarutan) meruakan hal penting sehingga sampai
sekarang masih banyak dipakai. Berikut ini contoh pengelompokan senyawa kimia yaitu:
Minyak Atsiri. Baunya khas dan dapat dipisahkan dari senyawa kimia tanaman lainnya,
karena sukar larut dalam air dan dapat menguap bersama uap air.
ekstraksi cair-cair antara fase air dan pelarut organik. Pertemuan dua sifat basa dan kerja
farmakologis, pada umumnya dimiliki oleh senyawa kimia yang mengandung N.
Zat Pahit. Berpedoman pada rasa pahit adalah suatu metode yang mudah untuk memisahkan senyawa kimia tanaman, perlu waktu yang cukup hingga seluruh zat pahit dalam sari menjadi
zat yang dapat dikristalkan. Tidak jarang zat pahit yang ditemukan secara bersamaan.
Zat Warna. Jumlah zat warna dari tanaman diperkirakan ± 2000 jenis, 130 diantaranya merupakan bahan perdangan yang penting; jumlah zat warna yang sekarang benar-benar
dipakai (misalnya pewarna makanan) sangat kecil; contohnya bisein, safran, dan kuersetin.
Pigmen tanaman mempunyai struktur kimia yang berlainan, begitu juga sifat fisika, kelarutan,
warna, fluoresensi, dan sebagainya.
Tanin. Tanin ditandai oleh sifatnya yang dapat menciutkan dan mengendapkan protein dari larutan dengan membentuk senyawa yang tidak larut.
Glikosida. Sari tanaman pada umunya mengandung senyawa bersifat alkohol atau fenol yang cuku larut sampai larut baik dalam air; tetapi gugus hidroksi dari alkohol atau fenol tidak
bebas, kebanyakan terikat pada satu atau lebih gula. Dan sifat kimia suatu senyawa yang baru
diisolsi sering tidak dikenali lagi, setelah dihidrolisis mejadi bagian gula dan bagian bukan
gula. Karena itu senyawa ini dimasukkan kedalam golongan “glikosida”. Glikosida
membentuk kelompok senyawa kimia nitrogen.
Resin. Resin adalah hasil ekskresi tanaman, yang secara kimia merupakan campuran asam organik, ester dan alkohol yang amorf atau sukar dikristalkan. Sifat selanjutnya adalah tidak
larutnya resin dalam air, kelarutannya yang baik dalam pelarut organik, dan meleleh pada
suhu yang relatif rendah.(Sirait, 2000)
2.3.1. Pengolongan Berdasarkan Biogenetis
Saat ini telah dikenal dengan sangat tepat sekitar 8000 senyawa kimia tanaman. Beberapa
struktur tertentu mempunyai kemiripan, struktur kimia senyawa alam yang berbeda hanya
dalam susunannya. Empat elemen dasar yang terpenting adalah Inti-C2 (elemen asetat),
Penggolangan biogenetis senyawa kimia tanaman dengan membandingkan struktur,
proses biosintesis, biokimia dinamis, dan fisiologi metabolisme tanaman. Penggolongan
biogenetis metabolit sekunder bermolekul kecil, yaitu :
1. Poliasetat (asetogenin)
2. Isoprenoida
3. Fenilpropana
4. Senyawa kimia tanaman mengandung N (alkaloid, amin, dan glikosida sianogen)
5. Senyawa dengan prinsip bentuk campuran
a. Tanpa N dalam molekul (misalnya Flavonoida)
b. Dengan N dalam molekul (misalnya alkaloid). (Sirait,2000)
2.4.Senyawa Flavonoida
Flavonoida adalah golongan terbesar dari bahan alam yang mana tersebar luas pada tanaman
tingkat tinggi tetapi juga ditemukan pada beberapa tanaman tingkat rendah termasuk alga.
Flavonoida terdapat pada bagian yang berbeda pada tanaman antara lain akar, kulit batang,
daun, bunga, buah dan biji (Connolly, 1986).
Senyawa-senyawa flavonoida adalah senyawa-senyawa polifenol yang mempunyai 15
atom karbon, terdiri dari dua cincin benzena yang dihubungkan menjadi satu oleh rantai linier
yang terdiri dari tiga atom karbon (Manito, 1981).
Flavonoida ditemukan mempunyai banyak aktivitas biologis termasuk : antimikrobial,
penghambat adhesi-mitokondria, antiulcer, antiarthritic, estrogenik, reseptor pengikatan
estrogen, intiangiogenic, anti kanker, penghambat protein kinase, penghambat pembentukan
prostaglandin, penahanan sel DNA dan penghambat topoisomerase (Bhat, 2005).
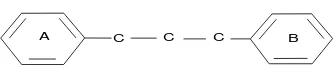
2.4.1. Struktur Dasar Senyawa Flavonoida
Senyawa flovonoida adalah senyawa yang mengandung C15 terdiri atas dua inti fenolat yang
dihubungkan dengan tiga satuan karbon. Struktur dasar flavonoida dapat digambarkan
Gambar 2.1. Senyawa Flanonoida (Sastrohamidjojo, 1996)
2.4.2. Klasifikasi Senyawa Flavonoida
Dalam tumbuhan flavonoida terdapat dalam berbagai bentuk struktur. Semuanya
mengandung 15 atom karbon, yaitu dua cicin aromatik yang dihubungkan oleh tiga atom
karbon yang dapat atau tak dapat membentuk cicin ketiga. Semua golongan flavonoida saling
berkaitan karena alur biosintesis yang sama yaitu melalui alur sikimat dan alur aseat malonat.
Menurut Markham (1988) klasifikasi flavonoida terdiri dari :
1. Flavonoida O-Glikosida
Flavonoida biasanya terdapat sebagai Flavonoida-Oglikosida, pada senyawa tersebut satu
gugus hidroksil falvonoida (atau lebih) berikatan pada satu gugus gula (atau lebih) dengan
ikatan hemiasetal yang tidak tahan asam.
2. Flavonoida C-Glikosida
Gula juga dapat juga terikat pada atom karbon flavonoida dan dalam hal ini gula tersebut
terikat langsung pada inti benzen dengan satu ikatan karbon-karbon yang tahan asam.
Glikosida yang demikian disebut C-glikosida. Gula yang terikat pada atom C hanya terikat
pada atom C6 dan C8 dalam inti flavonoida.
3. Flavonoida Sulfat
Golongan flavonoida lain yang mudah larut dalam air yang mungkin ditemukan hanya
flavonoida sulfat. Senyawa ini mengandung satu ion sulfat, atau lebih, yang terikat pada
hidroksil fenol atau gula. Secara teknis senyawa ini sebenarnya bisulfat karena terdapat
sebagai garam, yaitu flavon-O-SO3K.
4. Biflavonoida
Seperti yang ditunjukkan oleh namanya, biflavonoida adalah flavonoida dimer. Flavonoida
yang bisanya terlibat ialah flavon dan flavanon dan ikatan antara flavonoida berupa ikatan C C C
karbon-karbon atau ikatan eter. Momomer flavonoida yang digabungkan menjadi
biflavonoida dapat berjenis sama atau berbeda, dan letak ikatanya berbeda-beda.
5. Aglikon Flavonoida yang Aktif-Optik
Sejumlah aglikon flavonoida mempunyai atom karbon asimetrik dan dengan demikian
menunjukkan keaktifan optik ( yaitu memutar cahaya terpolarisasi datar). Yang termasuk
dalam golongan flavonoida ini ialah flavonon, dihidroflavonol, katekin, pterokarpan,
rotenoid, dan beberapa biflavonoida.
Dalam tumbuhan, flavonoida terdapat dalam berbagai bentuk struktur. Menurut Robinson
(1995), flavonoid dapat dikelompokkan berdasarkan tahanan oksidasi dan keragaman lain
pada rantai C3 antara lain :
1. Flavon
Flavon berbeda dengan flavonol karena pada flavon tak terdapat penyulihan 3-hidroksi. Hal
ini mempengaruhi serapan UV-nya, gerakan kromatografinya, serta reaksi warnanya, dan
karena itu flavon dapat dibedakan dari flavonol. Flavon terdapat juga sebagai glikosida tetapi
lebih sedikit daripada jenis glikosida pada flavonol. Jenis yang paling umum ialah
7-glukosida, contohnya luteolin 7-glukosida.
Gambar 2.2. Flavon
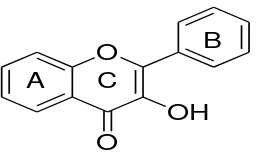
2. Flavonol
Flavonol sangat tersebar luas di dalam tumbuhan, baik sebagai kopigmen antosianin dalam
daun bunga maupun dalam daun tumbuhan tinggi. Dalam tumbuhan terdapat banyak sekali
glikosida flavonol. Sampai saat ini yang paling umum adalah kuersetin 3-rutinosida yang
dikenal sebagai rutin.
O
O
A C
Gambar 2.3. Flavonol
3. Isoflavon
Isoflavon merupakan senyawa yang tidak begitu mencolok, tetapi senyawa ini penting
sebagai fitoaleksin (senyawa pelindung) dalam tumbuhan untuk pertahanan terhadap
penyakit. Isoflavon menunjukkan aktivitas sebagai estrogenik, insektisida, dan antifungi.
Beberapa diantaranya berguna untuk racun tikus.
Gambar 2.4. Isoflavon
4. Flavanon
Flavanon adalah senyawa tanwarna yang tak dapat dideteksi pada pemeriksaan kromatografi
kecuali bila menggunakan penyemprot kromogen. Uji warna yang penting dalam larutan
alkohol ialah reduksi dengan serbuk Mg dan HCl pekat. Diantara flavonoida hanya flavon
yang menghasilkan warna merah ceri kuat.
Gambar 2.5. Flavanon O
O
A C
B
O
O
A C
B O
O
OH
A C
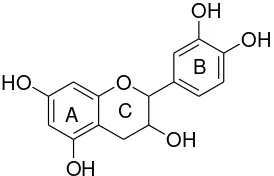
5. Flavanonol
Flavanonol (atau dihidroflavonol) barangkali merupakan flavonoid yang paling kurang
dikenal, dan tidak dapat diketahui apakah senyawa ini terdapat sebagai glikosida. Senyawa
ini stabil dalam asam klorida panas tetapi terurai oleh udara (Harborne, 1987).
Gambar 2.6. Flavanonol
6. Antosianin
Antosianin adalah pigmen daun bunga merah sampai biru yang biasa, banyaknya sampai 30%
bobot kering dalam beberapa bunga. Antosianin terdapat juga dalam bagian lain tumbuhan
tinggi kecuali fungus. Antosianin selalu terdapat dalam bentuk glikosida.
Gambar 2.7. Antosianin
7. Katekin dan Proantosianidin
Katekin dan proantosianidin adalah dua golongan senyawa yang mempunyai banyak
kesamaan. Semuanya senyawa tanpa warna, terdapat pada seluruh dunia tumbuhan tetapi
terutama dalam tumbuhan berkayu.
Gambar 2.8. Katekin dan Proantosianidin O
O
OH
A C
B
O
OH A C
B
+
O
OH HO
OH
OH OH
A C
8. Leukoantosianidin
Leukoantosianidin merupakan monomer flavan 3,4-diol, leukoantosianidin jarang terdapat
sebagai glikosida, namun beberapa bentuk glikosida yang dikenal adalah apiferol, dan
peltoginol.
Gambar 2.9. Leukoantosianidin
9. Kalkon
Khalkon adalah pigmen fenol kuning yang berwarna coklat tua dengan sinar UV bila
dikromatografi kertas. Aglikon khalkon dapat dibedakan dari glikosidanya karena hanya
pigmen dalam bentuk glikosida yang dapat bergerak pada kromatografi kertas dalam
pengembang air (Harborne, 1987).
Gambar 2.10. Kalkon
10. Auron
Seperti kalkon, senyawa ini tampak pada kromatogram kertas berupa bercak kuning. Dengan
sinar UV akan tampak berbeda, warna auron berubah menjadi merah jingga bila diuapi
ammonia.
Gambar 2.11. Auron O
OH
HO OH
OH OH
A C
B HO
A
O
B
O
O
CH
2.4.3. Sifat Kelarutan Flavonoida
Aglikon flavonoida adalah polifenol dan karena itu mempunyai sifat kimia senyawa fenol,
yaitu bersifat agak asam sehingga dapat larut dalam basa. Karena mempunyai sejumlah gugus
hidroksil yang tak tersubtituen, atau suatu gula, falvonoida merupakan senyawa polar maka
umumnya flavonoida larutdalam pelarut polar seperti etanol (EtOH), metanol (MeOH),
butanol (BuOH), aseton, dimetilsulfoksida (DMSO), dimetilformamida (DMF), air, dan
lain-lain. Adanya gula yang terikat pada flavonoida cenderung menyebabkan flavonoida lebih
muda larut dalam air dan dengan demikian campuran pelarut diatas dengan air merupakkan
pelarut yang lebih baik untuk glikosida. Sebaliknya, aglikon yang kurang polar seperti
isoflavon, flavanon, dan flavon serta flavonol yang termetoksilasi cenderung lebih mudah
larut dalam pelarut seperti eter dan kloroform. (Markham, 1988)
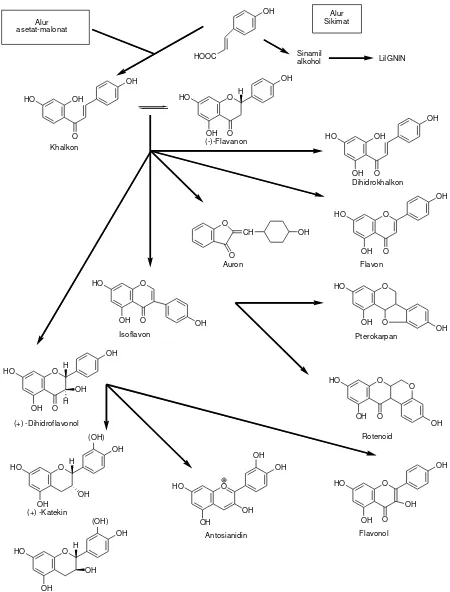
2.4.4. Biosintesis Flavonoida
Biosintesis senyawa flavonoida diperoleh dengan mereaksikan fragmen C6-C3 turunan asam
sikimat seperti asam p-hidroksisinamat dengan enam atom karbon. Hidrolisis pada cicin A
HOOC
Gambar 2.12. Biosintesa hubungan antara jenis monomer flavonoida dari alur asetat-malonat
2.5.Teknik Pemisahan 2.5.1. Ekstraksi
Ekstraksi adalah suatu proses pemisahan dari bahan padat maupun cair dengan bantuan
pelarut. Pelarut yang digunakan harus dapat mengekstraksi senyawa yang diinginkan tanpa
melarutkan material lainnya. (Bintang, 2010)
Metode ekstrasi yang paling sederhana adalah ekstraksi dingin, dengan cara ini bahan
kering hasil gilingan diektraksi pada suhu kamar secara berturut-turut dengan pelarut yang
kepolaranya yang makin tinggi: pertama heksana, kemudian kloroform, etil asetat, aseton,
metanol, dan akhirnya air. Metode ekstraksi ini yang mudah karena ekstrak tidak dipanaskan
sehingga kemungkinan kecil bahan alam menjadi terurai. (Heinrich, 2010)
Ragam ekstraksi yang tepat sudah tentu bergantung pada tekstur dan kandungan air
dalam tumbuhan yang diekstraksi dan pada jenis senyawa yang diisolasi. Alkohol adalah
pelarut serbaguna yang baik untuk ekstrasi pendahuluan. (Harborne, 1987).
2.5.2. Partisi
Metode pemisahan yang mungkin paling sederhana adalah partisi, yang banyak digunakan
sebagai tahap awal pemurnian ekstrak. Partisi menggunakan dua pelarut yang tak bercampur
yang ditambahkan kedalam ekstrak tesebut; hal ini dapat dilakukan secara terus-menerus
dengan menggunakan pelarut tak bercampur yang kepolarannya meningkat. Metode ini
merupakan pemisahan yang mudah dan menghandalkan kelarutan bahan alam dan bukan
interaksi fisik dengan medium lain. Partisi dapat memberikan pemisahan yang sangat baik,
terutama untuk senyawa-senyawa yang memiliki kelarutan yang sangat berbeda.(Heinrich,
2010)
2.5.3. Adsorben
Adsorben yang paling umum digunakan ialah silika gel dan alumina. Perlu diketahui bahwa
silika gel bersifat asam, sedangkan alumina bersifat basa. Oleh karena itu senyawa yang
bersifat asam harus dipisahkan oleh silika gel, sedangkan yang bersifat basa harus dipisahkan
dengan alumina sebagai adsorben.Urutan adsorben dari yang mempunyai kemampuan
adsorbsi besar ke yang kecil yaitu alumina, arang, silika gel, magnesia, kalium karbonat,
sukrosa, serbuk pati, dan serbuk selulosa. (Adnan, 1997)
Berikut ini merupakan beberapa jenis adsorben yang sering digunakan untuk
1. Selulose
Selulose digunakan untuk memisahkan glikosida yang satu dari glikosida yang lain,
atau memisahkan glikosida dari aglikon, serta untuk memisahkan aglikon yang
kurang polar.
2. Silika
Silika digunakan untuk memisahkan aglikon yang kurang polar, misalnya isoflavon,
flavanon, metil flavon, dan flavonol.
3. Poliamida
Poliamida digunakan untuk memisahkan semua flavonoida, juga untuk memisahkan
glukosida.
4. Gel Sephadex (deret G)
Gel sephadex digunakan untuk memisahkan campuran, terutama berdasarkan pada
ukuran molekul; molekul besar terelusi lebih dahulu. Gel sephadex untuk
memisahkan poliglikosida yang berbeda bobot molekulnya.
5. Gel Sephadex (LH-20)
Sephadex LH-20 dirancang khusus untuk digunakan memakai pelarut organik, dan
dapat digunakan dua cara. Sephadex LH-20 digunakan untuk pemurnian akhir aglikon
flavonoida dan glikosida yang telah diisolasi dari kertas, selulose, silika, atau
poliamida.(Markham, 1988)
Ada beberapa jenis silika gel, yaitu:
a. Silika gel G
Silika gel G adalah silika gel yang mengandung 13% kalsium sulfat sebagai zat
perekat. Jenis silika ini biasanya mengandung ion logam, terutama ion besi.
b. Silika gel H
Perbedaan silika gel G dan silika gel H ialah, bahwa silika gel H tidak mengandung
perekat kalsium sufat. Silika gel H dipakai untuk pemisahan yang bersifat spesifik,
terutama lipida netral.
c. Silika gel PF
Jenis silika gel ini ditemukan belakangan, yang dibuat sedemikian rupa sehingga
senyawa-senyawa organik yang terikat pada plat ini dapat mengadakan fluoresensi.
Oleh karena itu visualisasinya dapat dikerjakan dengan menempatkan plat yang telah
dikembangkan didalam ruangan gelap atau dengan sinar ultra violet yang
2.5.4. Kromatografi
Kromatografi adalah suatu teknik pemisahan yang pertama kali dipakai untuk memisahkan
zat-zat warna tanaman. Hal ini tersimpul dari istilah yang dipakai-kroma adalah zat warna.
Pemisahan dengan teknik ini dijalankan dengan mengadakan manipulasi atas dasar perbedaan
sifat-sifat fisik dari zat-zat yang menyusun suatu campuran.(Adnan, 1997)
Kromatografi adalah teknik pemisahan fisik suatu campuran zat-zat kimia yang
berdasarkan pada perbedaan migrasi dari masing-masing komponen campuran yang terpisah
pada fase diam dibawah pengaruh pergerakan fase yang bergerak. (Mulja, 1995)
Kromatografi merupakan metode pemisahan yang memerlukan waktu yang relatif
singkat dan tidak membutuhkan alat yang rumit tidak dibandingkan dengan metode
pemisahan lainnya. Pada prinsipnya, teknik ini untuk memisahkan suatu persenyawaan
dengan struktur yang sama atau berbeda sedikit, dengan adsorpsi secara selektif pada
absorban yang berbeda. Dikenal dua fase pada kromatografi, yaitu fase gerak dan fase diam.
Fase gerak dapat berupa cairan atau gas, sedangkan fase diam dapat berupa padatan atau
cairan. (Heinrich, 2010)
Berbagai metode kromatografi memberikan cara pemisahan paling kuat
dilaboratorium kimia. Metode kromatografi, karena pemanfaatannya yang leluasa, dipakai
secara luas untuk pemisahan analitik dan preparatif. Hampir setiap campuran kimia, mulai
dari bobot molekul yang rendah sampai tinggi, dapat dipisahkan menjadi
komponen-komponennya dengan beberapa metode kromatografi. (Gritter, 1991).
Pemisahan dan pemurnian kandungan tumbuhan terutama dilakukan dengan
menggunakan salah satu dari teknik kromatografi atau gabungan teknik tesebut.
Teknik-teknik kromatografi itu yaitu: kromatografi kertas (KKt), kromatografi lapis tipis (KLT),
kromatografi gas cair (KGC), dan kromatografi cair kinerja tinggi (KCKT). Pemilihan teknik
kromatografi sebagian besar bergantung pada sifat kelarutan dan keatsirian senyawa yang
akan dipisahkan. Semua teknik tersebut dapat dinggunakan pada skala mikro maupun makro.
(Harborne,1987)
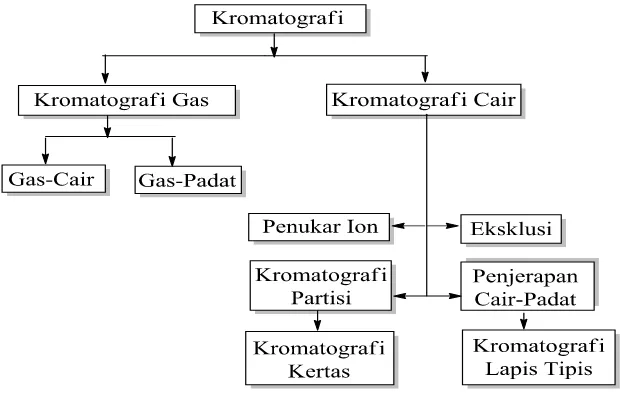
Kromatografi telah mengalami banyak perkembangan dan berikut merupakan gambar
Gambar 2.13. Cabang Kromatografi (Jhonson, 1991)
2.5.4.1.Kromatografi Kolom
Pemisahan senyawa dengan kromatografi kolom merupakan salah satu teknik pemisahan
biokimia yang banyak dipakai. Hal yang perlu diperhatiakn adalah penyediaan kolom,
operasi kolom, serta pemilihan pelarut yang tepat sebelum melakukan kromatografi. Kolom
kromatografi biasnya terbuat dari gelas. Panjang kolom biasanya disesuaikan dengan jumlah
komponen yang akan dianalisi dalam suatu senyawa, sedangkan lebar kolom sesuaikan
dengan jumlah senyawa yang akan dianalisis.Merode pemisahan kromatografi kolom
didasarkan pada perbedaan distribusi molekul-molekul komponen diantara fase gerak dan
fase diam bedasarkan perbedaan tingkat kepolaran.(Bintang, 2010).
Kromatografi kolom kalsik merupakan yang tertua dari cara kromatografi, dan seperti
yang dipraktekkan secara tradisional, merupakan bentuk kromatografi cair. Fase diam, baik
bahan yang jerap (KCP) atau film zat cair pada penyangga (KCC), ditempatkan dalam tabung
kaca berbentuk silinder, pada bagian bawah tertup dengan katup atau keran, dan fase gerak
dibiarkan mengalir kebawah melaluinya karena gaya berat, hasil dari kromatografi ini berupa
fraksi.(Gritter, 1991)
Kromatografi kolom-terbuka biasa dipakai secara luas karena caranya yang sederhana.
Kekurangan kromatogarfi kolom-terbuka ialah pemisahan yang lambat, penyerapan yang
tidak bolak-balik, dan tidak dapat jika partikel terlalu kecil. Sehingga utnyuk mengatasi
kekurangan itu dicoba cara kromatografi preparatif, kromatografi kilat, kromatografi
Kromatografi kolom pemisahan skala besar digunakan untuk isolasi flavonoida ke skala
industri. Pada dasarnya, cara inim meliputi penempatan campuran flavonoida dia atas kolom
yang berisi serbuk penjerap, dilanjutkan dengan elusi beruntun setiap komponen memakai
pelarut yang cocok. (Markham,1988).
Efisiensi kolom dalam kromatografi secara umum berkaitan dengan lamanya waktu
komponen atau molekul yang dianalisis berada dalam kolom yang dikenal sebagai waktu
tambat dan berkaitan pula dengan jumlah pelat teori. (Mulja, 1995)
Kromatografi kolom sekarang banyak ditinggalkan, karena metode pemisahan
kromatografi kolom ini memerlukan bahan kimia yang cukup banyak sebagai fase diam dan
fase gerak, tegantung pada ukuran kolom gelas yang digunakan untuk kromatografi kolom.
Selain itu, kromatografi kolom kurang efektif dari segi waktu karena memerlukan waktu
yang relatif lama. Fase diam yang telah digunakan tidak dapat dipakai ulang untuk
pemisahan campuran yang lain karena sulit meregenerasi fase diam.(Bintang, 2010).
2.5.4.2.Kromatografi Lapis Tipis
Cara pemisahan dengan adsorbsi pada lapisan tipis adsorben yang sekarang dikenal dengan
kromatografi lapis tipis (thin layer chromatography atau TLC) sebenarnya telah dipakai sejak
tahun 1938 oleh Ismailov dan Shraiber. Kini TLC dapat digunakan untuk memisahkan
berbagai senyawa seperti ion-ion anorganik, kompleks senyawa-senyawa organik dengan
anorganik, dan senyawa-senyawa organik baik yang terdapat dialam dan senyawa-senyawa
organik sintetik.
Kromatografi lapis tipis adalah metode kromatografi cair yang paling sederhana dan
pemakaian pelarut dan cuplikan yang jumlahnya sedikit, kemungkinan penotolan cuplikan
berganda dan tersedianya berbagai metode. KLT dapat dipakai dengan dua tujuan. Pertama,
dipakai selayaknya sebagai metode untuk mencapai hasil kualitatif, kuantitatif, atau
preparatif. Kedua, dipakai untuk menjajaki sistem pelarut dan sistem penyangga yang akan
dipakai dalam kromatografi kolom atau kromatografi cair kinerja tinggi.
Kelebiahan penggunaan kromatografi lapis tipis dibandingkan dengan kromatografi
kertas ialah kerena dapat dihasilkannya pemisahan yang lebih sempurna, kepekaan yang lebih
tinggi, dan dapat dilaksanakan dengan lebih cepat. Berbagai macam kromatografi lapis tipis
yaitu TLC Preparatif, TLC Kuantitatif, dan TLC dengan argentasi. (Adnan, 1997)
KLT mempunyai kelebihan lainnya, yaitu:
2. Berbagai macam teknik untuk optimasi pemisahan seperti pengembagan 2 dimensi,
pengembangan bertingkat, dan pembaceman penjerap dapat dilakukan pada KLT
3. Proses kromatografi dapat diikuti dengan mudah dan dapat dihentikan kapan saja.
4. Semua komponen dalam sampel dapat dideteksi.
Penjerrap yang paling sering digunakan pada KLT adalah silika dan serbuk selulosa,
sementara mekanisme sorpsi-desorpsi yang utama pada KLT adalah partisi dan absorbsi.
Fase gerak pada KLT dapat dipilih dari pustaka, tetapi lebih sering dengan mencoba-coba
karena waktu yang diperlukan hanya sebentar. Sistem yang paling sederhana ialah dengan
menggunakan campuran 2 pelarut organik karena daya elusi campuran kedua pelarut ini
dapat mudah diatur sedemikian rupa sehingga pemisahan dapat terjadi secara optimal.
Berikut beberapa petunujuk dalam memilih fase gerak:
Fase gerak harus mempunyai kemurnian yang sangat tinggi karena KLT
merupakan teknik yang sensitif.
Daya elusi fase gerak harus diatur sedemikian rupa sehingga harga Rf solut
terletak antara 0,2-0,8 untuk memaksimalkan pemisahan.
Untuk pemisahan dengan menggunakan fase diam polar seperti silika gel,
polaritas fase gerak akan menetukan kecepatan migrasi solut yang berarti juga
mentukan nilai Rf. Penambahan pelarut yang bersifat sedikit polar seperti dietil
eter kedalam pelarut non polar seperti metil benzen akan meningkatkan harga Rf
secara signifikan.
Solut ionik dan solut polar lebih baik digunakan campuran pelarut sebagai fase
geraknya seperti campuran air dan metanol dengan perbandingan
tertentu.(Rohman, 2009)
Nilai Rf dipengaruhi oleh ketebalan lapisan, sebagian besar prosedur pemisahan untuk
analisis kualitatif menggunakan ketebalan lapisan 250 µm, dan untuk analisis preparatif
digunakan ketebalan sampai 5 mm. Hal yang harus diperhatikan adalah atmosfer ruang
pemisahan harus jenuh dengan pelarut, karena menentukan besar kecilnya nilai Rf.
Menurut Markham (1988), KLT berguna untuk tujuan berikut:
Mencari pelarut untuk kromtografi kolom.
Analisis fraksi yang diperoleh dari kromatografi kolom. Perkembangan reaksi seperti hidrolisis atau metilasi. Identifikasi flavonoida secara kromatografi.
2.5.4.3.Kromatografi Lapis Tipis Preparatif
Salah satu metode pemisahan yang memerlukan pembiayaan paling murah dan memakai
peralatan paling dasar ialah kromatografi lapis tipis preparatif (KLTP). KLTP dapat
memisahkan bahan dalam jumlah gram, sebagian besar pemakaian hanya dalam jumlah
miligram.
Ukuran plat kromatografi biasanya 20 x 20 cm atau 20 x 40 cm. Penjerap yang paling
umum adalah silika gel dan dipakai untuk pemisahan campuran senyawa lipofil maupun
campuran senyawa hidrofil. Pelarut yang baik ialah pelarut atsiri (n-heksan, diklorometana,
dan etil asetat), jika pelarut yang digunakan kurang atsiri maka terjadi pelebaran pita. .
(Hostettmann, 1995)
Pada KLTP preparatif, cuplikan yang akan dipisahkan ditotolkan berupa garis pada
salah satu sisi pelat lapisan besar dan dikembangkan secara tegak lurus pada garis cuplikan
sehingga campuran akan terpisah menjadi beberapa pita. Pita ditampakkan dengan cara yang
tidak merusak jika senyawa itu tanpa warna, dan penjerap yang mengandung pita dikerok dari
pelat kaca (Gritter, 1991). Konsentrasi cuplikan harus sekitar 5-10%. Penotolan dapat
dilakukan dengan pipet tetapi lebih baik dengan penotolan otomatis (camag dan desaga).
Untuk pita yang terlalu lebar, dapat dilakukan pemekatan dengan cara pengembangan
memakai pelarut polar sampai kira-kira 2 cm diatas tempat penotolan. Kemudian plat
dikeringkan dan dielusi dengan pelarut yang diinginkan.
Pilihan pelarut ditentukan berdasarkan pemeriksaan pendahuluan memakai KLT
analitik . fase gerak dalam berbagai perbandingan sangat sering dipakai pada pemisahan
secara KLTP: n-heksan-etil asetat, n-heksan-aseton, dan kloroform-metanol. Penambahan
sedikit asam asetat atau dietil amina berguna untuk memisahkan, berturut-turut, senyawa
asam dan senyawa basa. Kebanyakan penjerap KLTP mengandung indikator fluoresensi yang
membantu mendeteksi kedudukan pita yang terpisah sepanjangn senyawa yang dipisahkan
menyerap sinar UV. Pita yang kedudukannya telah diketahui dikerok dari plat dengan
spatulan atau pengerok. (Hostettmann, 1995).
2.6.Teknik Spektroskopi
2.6.1. Spektorskopi Ultraviolet (UV-Vis)
Absorpsi sinar tampak (VIS) atau ultraviolet (UV) oleh suatu molekul dapat menyebabkan
terjadinya eksitasi molekul tersebut dari tingkat energi dasar ke tingkat eksitasi. Absorbsi
sehingga panjang gelombang absorban maksimum dapat dikorelasikan dengan absorban UV
dan VIS untuk penentuan kuantitatif senyawa-senyawa yang mengandung gugus penyerap.
Metode spektroskopi VIS berdasarkan atas absorban sinar tampak oleh suatu larutan
berwarna. Oleh karena itu, metode ini dikenal juga sebagai metode kalorimetri. Hanya larutan
senyawa berwarna saja yang dapat ditentukan dengan metode ini. Senyawa yang tidak
berwarna dapat dibuat berwarna dengan mereaksikannya dengan pereaksi yang menghasilkan
senyawa berwarna. Contohnya ion Fe3+ dengan CNS- menghasilkan larutan berwarna
merah.(Bintang, 2010).
Spektrofotometri UV-Vis adalah anggota teknik analisis spektroskopik yang memakai
sumber radiasi elektromagnetik ultra violet dekat dan sinar tampak dengan memakai
instrumen spektrofotometer. Spektrofotometri UV-Vis melibatkan energi elektronik yang
cukup besar pada molekul yang dianalisis, sehingga spektrofotometri UV-Vis lebih banyak
dipakai untuk analisis kuantitatif dibandingkan kualitatif.
Spektrofotometri UV-Vis dapat melakukan penentuan terhadap sampel yang berupa
larutan, gas atau uap. Untuk sampel yang berupa larutan perlu diperhatikan beberapa
persyaratan pelarut yang dipakai, antar lain:
- Pelarut yang dipakai tidak mengandung sistem ikatan rangkap terkonjugasi pada
struktur molekulnya dan tidak berwarna.
- Tidak terjadi interaksi dengan molekul senyawa yang dianalisis.
- Kemurniannya harus tinggi atau derajat untuk analisis.(Mulja, 1995)
Spektroskopi UV-Vis adalah pengukuran panjang gelombang intensitas sinar ultraviolet
dan cahaya tampak yang diabsorbsi oleh sampel. Spektroskopi UV-Vis biasanya digunakan
untuk molekul dan ion anorganik atau kompleks didalam larutan. (Dachriyanus, 2004).
Spektrofotometer dapat digunakan untuk mengukur besarnya energi yang diabsorpsi atau
diteruskan. Jika radiasi monokromatik melewati larutan yang mengandung zat yang dapat
menyerap, radiasi ini akan dipantulkan, diabsorpsi oleh zat, dan sisanya ditransmisikan.
Spektrum secara dipengaruhi oleh berapapa faktor, yaitu sebagai berikut:
1. Jenis pelarut, jenis pelarut polar atau nonpolar.
2. pH larutan.
3. Kosentrasi larutan. Jika konsentrasi larutan tinggi, polimerisasi akan terjadi.
4. Tebal larutan atau tebal kuvet. Jika digunakan kuvet dengan ketebalan berbeda,
spektrum serepan yang dihasilkan akan berbeda.
5. Lebar celah. Makin lebar celah, makin lebar pula serapan. Akibatnya, cahaya makin
Pada umumnya pelarut yang sering dipakai dalam analisis spektrofotometri UV-Vis
adalah air, etanol, sikloheksana dan isopropanol. Namun demikian perlu diperhatikan
absorbsi pelarut yang dipakai didaerah UV-Vis. Hal lain yang perlu diperhatikan dalam
masalah pemilihan perlarut adalah polaritas pelarut yang dipakai, karena akan sangat
berpengaruh terhadap pergeseran spektrum molekul yang dianalisis. (Mulja, 1995)
Spektrofotometer UV-Vis pada umumnya digunakan untuk:
1. Menentukan jenis kromofor, ikatan rangkap yang terkonyungasi dan auksokrom dari
suatu senyawa organik.
2. Menjelaskan informasi dari struktur bedasarkan panjang gelombang maksimum suatu
senyawa.
3. Mampu menganalisis senyawa organik secara kuantitatif dengan menggunakan
hukum Lambert-Beer. (Dachriyanus, 2004).
2.6.2. Spektroskopi Infra Merah (FT-IR)
Instrumen spektrum inframerah dibagi kedalam tiga radiasi, yaitu inframerah dekat,
inframerah pertengahan, dan inframerah jauh. Aplikasi spektroskopi inframerah sangat luas,
baik untuk analisis kuantitatif maupu kulitatif. Kegunaan yang paling penting adalah untuk
identifikasi senyawa organik, karena spektrumnya sangat kompleks, yaitu terdiri dari banyak
puncak. Spektrum inframerah dari senyawa organik mempunyai sifat fisik yang khas, artinya
kemungkinannya kecil sekali dua senyawa mempunyai spektrum yang sama. Selain
penggunaan spektroskopi inframerah untuk mempelajari makro molekul dan membran
biologis, teknik ini juga digunakan dalam biokimia untuk meneliti struktur molekul murni
intermediet, seperti obat-obatan. (Bintang, 2010)
Cahaya tampak terdiri dari beberapa range frekuensi elektromagnetik yang berbeda
dimana setiap frekuensi bisa dilihat sebagai warna yang berbeda. Radiasi infra merah juga
mengandung beberapa range frekuensi tetapi tidak dapat dilihat oleh mata.
Pengukuran pada spektrum infra merah dilakukan pada daerah cahaya infra merah
tengah (mid-infrared) yaitu pada panjang gelombang 2,5 - 50 µm atau bilangan gelombang
4000 - 200 cm-1. Pita absorbsi infra merah sangat khas dan spesifik untuk setiap tipe ikatan
kimia atau gugus fungsi. Metode ini sangat berguna untuk mengidentifikasi senyawa organik
dan organometalik. Sebagai sumber cahaya yang umum digunakan adalah lampu tungsten,
dan Narnst glowbars.
Spektofotometer infra merah pada umumnya digunakan untuk:
2. Mengetahui informasi struktur suatu senyawa organik dengan membandingkan daerah
sidik jarinya.
Beberapa syarat yang harus dipenuhi dalam mengintrepretasikan spektrum:
1. Spektrum harus tajam dan jelas serta memiliki intensitas yang tepat.
2. Spektrum harus berasal dari senyawa murni.
3. Spektrofotometer harus dikalibrasi sehingga akan menghasilkan pita atau serapan
pada bilangan gelombang yang tepat.
4. Metoda penyiapan smapel harus dinyatakan. Jika digunakan pelarut maka jenis
pelarut, konsentrasi, dan tebal sel harus diketahui.
Karateristik frekuensi vibrasi IR sangat dipengaruhi oleh perubahan yang sangat kecil
pada molekul sehingga sangat sukar untuk menetukan struktur bedasarkan data IR saja.
Spektrum IR sangat berguna untuk mengidentifikasi suatu senyawa dengan
membandingkannya dengan spektrum senyawa standart terutama pada daerah sidik jari.
Secara praktikal, spektrum IR hanya dapat digunakan untuk menentukan gugus
fungsi.(Dachriyanus, 2004).
Faktor-faktor yang berpengaruh pada frekuensi vibrasi adalah sebagai berikut:
1. Penggandengan Vibrasi
Ikatan-ikatan C-H pada gugs metilen saling mengalami penggandengan sehingga
mempunyai dua pita vibrasi ulur, yaitu simetris dan asimetris. Frekuensi kedua pita ini
berbeda.
2. Ikatan hidrogen
Ikatan hidrogen pada gugus karbonil akan memperpanjang ikatan C=O, misalnya
dalam asam salisilat. Akibatnya, kekuatan ikatan C=O berkurang sehingga pita vibrasi
muncul pada frekuensi yang lebih rendah.
3. Efek induksi
Unsur yang bersifat elektornegatif cenderung menarik elektron ke antara atom karbon
dan oksigen dalam ikatan C=O sehingga ikatan tersebut menjadi lebih kuat.
Akibatnya, pita vibrasi ikatan C=O muncul pada frekuensi yang lebih tinggi.
4. Efek resonansi
Adanya ikatan C=C yang bertetangga dengan gugus karbonil menyebabkan terjadinya
delokalisasi elektron pada ikatan C=O dan ikatan rangkap. Akibatnya, ikatan C=O
akan lebih bersifat sebagai ikatan tunggal dan kekuatan ikatannya melemah sehingga
pita vibrasi akan muncul pada frekuensi yang lebih rendah.
Cicin berkeanggotaan enam yang memilki gugus karbonil tidak begitu tegang
sehingga pita vibrasi ikatan C=O muncul seperti ikatan C=O dalam keton normal.
6. Efek medan
Keberadaan dua gugus dalam satu molekul sering kali saling mempengaruhi frekuensi
vibrasi masing-masing gugus tersebut karena terjadi interaksi ruang, yang dapat
bersifat elektrostatik dan atau sterik. (Harmita, 2009)
2.6.3. Spektroskopi Resonansi Magnetik Inti Proton (1H-NMR)
Resonansi magnet inti masuk kedalam spektroskopi absorpsi seperti halnya spektroskopi
inframerah atau spektroskopi UV. Spektroskopi NMR didasarkan pada pengukuran absorpsi
radiasi elektromagnetik pada daerah frekuensi radio 0,1-100 MHz atau panjang gelombang
3-3000 m, oleh partikel (inti atom) yang berputar didalam medan magnet. Penggunaan utama
NMR adalah untuk mempelajari tingkat molekular dari molekul organik sederhana. Informasi
struktural ini berguna untuk mempelajari kerja biologis antibiotik seperti gramisidin dan
valinomisin.(Bintang, 2010).
Spektroskopi resonansi magnet proton dapat digunakan untuk menentukan jenis
lingkungan atom yang berbeda yang ada dalam molekul, jumlah atom hidrogen pada
masing-masing jenis lingkungan hidrogen, dan jumlah atom hidrogen pada atom karbon tetangga.
Sinyal-sinyal resonansi muncul karena proton-proton dalam molekul berada dalam
lingkungan kimia yang berlainan. Sinyal-sinyal resonansi tersebut letaknya terpisah karena
adanya pergesaran kimia (chemical shift).
Tidak semua sinyal berpola sederhana (berupa garis tunggal atau singlet), beberpa
sinyal mengikuti pola pemecahan (splitting) yang karatersitik, seperti doublet, triplet, dan
kuartet. Pemecahan disebabkan oleh penggandengan spin-spin (spin-spin coupling), yaitu
interaksi magnetik suatu inti dengan inti yang lain.
Jenis lingkungan kimia proton dapat diketahui dari geseran kimia. Dengan inti-inti
yang saling berintegrasi, dapat diketahui jumlah relatif proton yang ada. Hubungan posisi
yang antara inti-inti yang saling berintegrasi dapat diketahui dari penggandengan spin-spin
karena besarnya interaksi, yang disebut konstanta penggandengan atau coupling constant (J),
bergantung pada jumlah dan jenis ikatan yang memisahkan inti-inti tersebut.
Fenomena 1H-NMR terjadi jika inti yang searah dengan medan magnet eksternal
dibuat mengabsorpsi energi (berupa radiasi elektromagnetik) sehingga orientasi spinnya
berubah. Dalam suatu molekul, tiap proton berada dalam lingkungan kimia yang sedikit
jumlahnya sedikit berdeda. Dengan demikian, proton-proton tersebut akan beresonansi pada
frekuensi yang sedikit berbeda. Harga freakuensi absolut masing-masing proton yang berbeda
sangat sulit diukur hingga presisi yang sedemikian kecil. Dalam 1H-NMR, yang diukur
adalah perbedaan antara frekuensi resonansi suatu jenis proton dan frekuensi resonansi proton
senyawa pembanding.(Harmita, 2009)
Inti atom-atom tertentu akan mempunyai spin, yang berputar dan menghasilkan momen
magnetik sepanjang aksis spin. Jika inti yang berputar ini diletakkan didalam medan magnet,
maka sesuai dengan kalkulasi kuantum mekanik, momen magnetiknya akan searah (paralel;
mempunyai energi yang rendah) atau berlawanan arah (antiparalel, mempunyai energi yang
tinggi) dengan arah medan magnet yang diberikan.
Spektrometer resonansi magnet inti proton pada umumnya digunakan untuk:
1. Mentukan jumlah proton yang memiliki lingkungan kimia yang sama pada suatu
senyawa organik.
2. Mengetahui informasi mengenai struktur suatu senyawa organik. (Dachriyanus,
2004).
2.7.Bakteri
Bakteri merupakan penghasil bermacam-macam zat organik dan obat-obatan antibiotik.
Mikroorganisme memang peranan penting dalam menganalisis sistem enzim dan dalam
mengalisis komposisi suatu makanan. Bakteri merupakan organisme yang sangat kecil
(berukuran mikroskopis). Bakteri rata-rata berukuran lebar 0,5 – 1 mikron dan panjang hingga 10 mikron (1 mikron - mm). Untuk melihat bakteri dengan jelas, tubuhnya perlu
diisi dengan zat warna, pewarna ini disebut pengecatan bakteri (Irianto, 2006).
Kelompok mikroorganisme yang paling penting dan beraneka ragam, yang
berhubungan dengan makanan dan manusia adalah bakteri. Adanya bakteri dalam bahan
pangan dapat mengakibatkan pembusukan yang tidak diinginkan atau menimbulkan penyakit
yang ditularkan melalui makanan. Bakteri adalah mikroorganisme bersel tunggal yang tidak
terlihat oleh mata (Buckle, 2007).
Berdasarkan perbedaan respons terhadap prosedur pewarnaan gram dan strktur
dinding bakteri, bakteri diklasifikasikan menjadi bakteri gram negatif dan bakteri gram