Abstrak—Lipid mikroalga adalah minyak masa depan untuk produksi biodiesel yang berkelanjutan. Salah satu keputusan penting dalam memperoleh minyak dari mikroalga adalah pemilihan spesies. Oleh karena itu pada penelitian ini dilakukan isolasi dan karakterisasi mikroalga dari Wonorejo melalui seleksi terhadap kandungan lipid secara kualitatif untuk mengetahui jenis mikroalga yang berpotensi sebagai bahan baku biodiesel. Pengambilan sampel mikroalga dilakukan di 3 stasiun muara Wonorejo. Parameter perairan yang diukur yaitu suhu, DO, pH, salinitas, kecerahan, kandungan ammonia, nitrit, nitrat dan fosfat. Isolasi mikroalga dilakukan dengan menggunakan metode pengenceran bertingkat dan streak plate. Analisis kualitatif kandungan lipid dilakukan dengan pewarnaan Nile red dan diamati dibawah mikroskop fluorescence dengan panjang gelombang 450-490 nm. Hasil penelitian menunjukkan bahwa kelimpahan total mikroalga di muara Wonorejo berkisar antara 1355,53-1605,10 ind/l. Hasil isolasi didapatkan sebanyak 5 genus yaitu Nitzschia, Navicula, Oscillatoria, Chlorococcum dan
Nannochloropsis. Mikroalga Chlorococcum memiliki kandungan lipid yang paling tinggi serta berpotensi untuk dikembangkan lebih lanjut sebagai bahan baku biodiesel.
Kata Kunci—biodiesel, isolasi, mikroalga, kandungan lipid.
I. PENDAHULUAN
NERGI telah menjadi kebutuhan yang mutlak dan harus dipenuhi. Semua sarana dan prasarana penunjang kehidupan manusia digerakkan oleh energi. Kebutuhan energi di Indonesia selama ini cenderung dipenuhi dari bahan bakar fosil yang semakin lama semakin menipis dan tidak dapat diperbarui [1]. Kesadaran akan cadangan bahan bakar fosil yang semakin menipis menyebabkan pengembangan bahan bakar alternatif terbarukan terus dilakukan, salah satunya adalah bahan bakar biodiesel [2].
Mikroalga merupakan salah satu organisme yang dapat dinilai ideal dan potensial untuk dijadikan sebagai bahan baku produksi biodiesel [3], [4], [5]. Keuntungan pengembangan mikroalga sebagai penghasil biodiesel karena kemampuannya untuk mensintesis lipid sangat tinggi dengan kandungan lipid dalam biomassa kering spesies mikroalga tertentu dapat mencapai di atas 50%-80% dengan pertumbuhan yang sangat cepat [6], [7]. Lipid inilah yang merupakan senyawa dasar
pembentukan bahan bakar biodiesel. Rujukan [2] menyatakan bahwa biodiesel merupakan senyawa alkil ester yang didapat dari proses transesterifikasi senyawa hidrokarbon yang bisa didapat dari hewan, tumbuhan atau triasilgliserol (TAG) alga.
Rujukan [8] menyatakan mikroalga di alam dapat mengakumulasi lipid pada keadaantertentu. Mikroalga ketika berada pada kondisi yang tidak optimal akan mengubah jalur biosintesis lipid mereka menuju pembentukan dan akumulasi lipid netral (20%-50% berat kering), terutama dalam bentuk triasilgliserol (TAG) [9]. Mikroalgamengakumulasi total lipid dalam jumlahbanyak sampai menemukan lingkungantumbuh yang baik [2].
Terdapat beberapa jenis mikroalga yang telah diketahui mempunyai kandungan minyak alami yang tinggi, seperti
Botryococcus braunii, Chlorella sp., Schizochytrium sp., dan
Nannochloropsis sp. [10]. Pertumbuhan dan produktivitas lipid dari mikroalga dipengaruhi oleh beberapa faktor, diantaranya yaitu: cahaya (kualitas, kuantitas), temperatur, konsentrasi nutrisi, pH dan salinitas [2].
Penelitian mengenai potensi mikroalga telah banyak dilakukan, namun penelitian terhadap potensi mikroalga alam terutama dari perairan Wonorejo sebagai bahan baku penghasil biodiesel masih sangat kurang. Sehingga dalam penelitian ini akan dilakukan isolasi dan seleksi terhadap kandungan lipid secara kualitatif untuk mengetahui jenis mikroalga yang ditemukan di perairan Wonorejo yang berpotensi sebagai bahan baku biodiesel.
II. URAIANPENELITIAN
A. Pengambilan Sampel Mikroalga
Sampling mikroalga, identifikasi dan analisis kandungan lipid mikroalga secara kualitatif dilakukan pada bulan Februari – Juni 2015. Pengambilan sampel mikroalga dilakukan di 3 stasiun muara Wonorejo, Surabaya. Isolasi dan identifikasi mikroalga dilakukan di Laboratorium Botani Jurusan Biologi ITS. Uji kualitatif kandungan lipid dilakukan di Laboratorium Histopatologi Anatomi RSKI Unair.
Wonorejo, Surabaya
A.
Azzahidah dan D. Ermavitalini
Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Teknologi
Sepuluh Nopember (ITS)
Jl. Arief Rahman Hakim, Surabaya 60111 Indonesia
: [email protected]
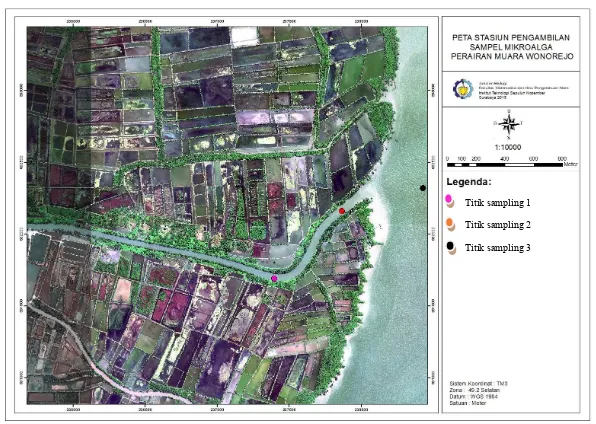
Gambar 1. peta lokasi pengambilan sampel mikroalga di muara Wonorejo.
B. Pengambilan dan Perhitungan Kelimpahan Mikroalga
Pengambilan sampel mikroalga dilakukan dengan menggunakan plankton net yang memiliki mesh size 45 µm dengan diameter mulut jaring 31 cm dan panjang jaring 100 cm. Sampel mikroalga yang tersaring dimasukkan ke dalam botol sampel dengan volume 30 ml dan di simpan dalam cool box untuk dilakukan identifikasi, isolasi dan analisis kandungan lipid di laboratorium. Sampel mikroalga yang dilakukan perhitungan kelimpahan dimasukkan ke dalam botol sampel berbeda dan diawetkan dengan menggunakan formalin 4%. Perhitungan kelimpahan dengan menggunakan sedgwick rafter pada semua bidang dengan 2 kali pengulangan. Mikroalga yang teramati selanjutnya dihitung dengan hand tally counter. Kelimpahan mikroalga dihitung dengan rumus [11]:
N = T/L x P/p x V/v x 1/w Keterangan :
N = kelimpahan (ind/l); T = luas gelas penutup (mm2); L = luas lapang pandang (mm2); P = jumlah mikroalga yang tercacah; p = jumlah lapang
pandang yang diamati; V = volume sampel yang tersaring (ml); v = volume mikroalga dalam Sedgwick rafter; w = volume sampel mikroalga yang disaring (ml).
C. Pengukuran Faktor Fisika dan Kimia Perairan Muara Wonorejo
Parameter fisika perairan yang diukur untuk setiap titik sampling yaitu: suhu menggunakan termometer, pH menggunakan pH meter, kecerahan perairan menggunakan
secchi disk, salinitas menggunakan hand refractometer (ATC FG-217), dan oksigen terlarut menggunakan DO meter (Lutron DO-5510).
Parameter kimia yang diukur yaitu kandungan amonia (NH4+), nitrit (NO2-), nitrat (NO3-), dan fosfat (PO42-). Pengukuran parameter kimia dilakukan dengan mengambil sampel air pada kedalaman sampai 50 cm dari permukaan perairan sebanyak 1200 ml pada setiap titik sampling. Sampel air yang telah diambil selanjutnya di masukkan ke dalam cool box dan kemudian di bawa ke Laboratorium Balai Standarisasi Industri Surabaya untuk dianalisis.
D. Isolasi, Purifikasi dan Identifikasi Mikroalga
Isolasi mikroalga dilakukan dengan metode pengenceran bertingkat dan streak plate dalam medium cair dan padat dengan air yang berasal dari perairan Wonorejo pada setiap stasiun pengambilan sampel. Sampel mikroalga sebanyak 10 ml yang telah didapatkan terlebih dahulu dilakukan pengenceran bertingkat dalam 10-1 sampai 10-4. Kemudian sebanyak 2 tetes mikroalga diteteskan pada media agar dan diratakan keseluruh permukaan media dengan menggunakan
Drygalski. Kultur mikroalga selanjutnya diinkubasi selama 7 – 14 hari. Koloni isolat mikroalga yang tumbuh pada media agar kemudian dimurnikan dengan teknik gores 16 (strak plate) sampai diperoleh koloni monospesies mikroalga. Isolat mikroalga diinkubasi pada suhu 25-27°C di bawah cahaya lampu dengan fotoperiode 12:12 siklus terang dan gelap selama 7 – 14 hari.
Koloni mikroalga yang tumbuh terpisah pada media agar diamati di bawah mikroskop dan diidentifikasi dengan acuan menggunakan buku identifikasi [12] ”Freshwater Algae: Identification and Use as Bioindicators”.
E. Analisis Kualitatif Kandungan Lipid Mikroalga
Analisis kualitatif kandungan lipid dilakukan dengan pewarnaan Nile red. Isolat mikroalga diwarnai dengan mensuspensikan sel mikroalga yantumbuh pada media padat ke 0,5 ml larutan Nile red (0,1 mg Nile red/ml aseton) dan diinkubasi selama 10 menit pada suhu ruang. Selanjutnya dilakukan pembilasan dengan aquades dan diambil 1 tetes sel mikroalga yang terwarnai dan diletakkan diatas gelas objek untuk diamati di bawah mikroskop fluorescence (Olympus fsx 100 bioimagine navigator) pada panjang gelombang 450 – 490 nm [13], [14].
Titik sampling 1
Titik sampling 2
Cyanophyceae, Coscinodiscophyceae, Flagilariophyceae,
Eustigmatophyceae, Chlorophyceae dan Bacillariophyceae
(Gambar 2). Komposisi mikroalga lebih beragam pada stasiun 1 yang terdiri dari 7 kelas mikroalga dengan 12 genus yaitu 1 genus dari kelas Zygnemophyceae, 2 genus dari kelas
Cyanophyceae, 1 genus dari kelas Coscinodiscophyceae, 3 genus dari kelas Flagilariophyceae, 1 genus dari kelas
Eustigmatophyceae, 1 genus dari kelas Chlorophyceae dan 3 genus dari kelas Bacillariophyceae. Pada stasiun 2 terdapat 5 kelas dengan 8 genus. Stasiun 3 memiliki komposisi mikroalga yang lebih beragam dibandingkan dengan stasiun 2. Pada stasiun 3 terdapat 5 kelas dengan 10 genus.
Gambar 2. Komposisi dan jumlah berdasarkan jenis dari setiap kelas mikroalga di semua stasiun pengamatan.
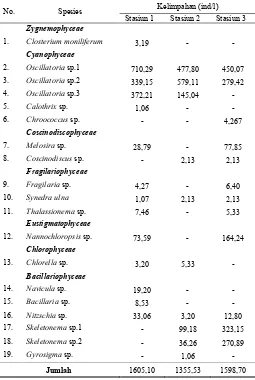
Komposisi jenis mikroalga yang ditemukan selama pengamatan didominasi oleh kelas Cyanophyceae dan
Bacillariophyceae. Dari ketiga stasiun pengamatan, komposisi kelas Cyanophyceae ditemukan sebanyak 74,40% yang didominasi oleh genus Oscillatoria, kemudian kelas
Bacillariophyceae ditemukan sebanyak 17,59%. Kelompok mikroalga yang paling sedikit ditemukan di perairan muara Wonorejo adalah kelas Zygnemophyceae dengan komposisi jenis sebanyak 0,06%. Kelas Cyanophyceae memiliki komposisi jenis yang lebih besar dan kelimpahan yang tinggi seperti ditunjukkan pada Tabel 1 karena kelas ini memiliki toleransi yang tinggi untuk tetap tumbuh dengan kondisi konsentrasi nutrien yang berubah-ubah karena kemampuannya dalam menyimpan fosfor. Kelimpahannya di perairan juga semakin tinggi karena bukan merupakan jenis fitoplankton yang disukai untuk dikonsumsi oleh zooplankton [15]. Genus mikroalga yang memiliki nilai kelimpahan dan jumlah yang paling besar di muara Wonorejo adalah
Oscillatoria dari kelas Cyanophyceae dan Skeletonema dari kelas Bacillariophyceae. Keberadaan genus Oscillatoria selalu ditemukan dari stasiun ke 1 sampai ke 3 dengan nilai kelimpahan yang tinggi dibandingkan genus Skeletonema
yang hanya di temukan di stasiun 2 dan 3.
Cyanophyceae
2. Oscillatoria sp.1 710,29 477,80 450,07 3. Oscillatoria sp.2 339,15 579,11 279,42 4. Oscillatoria sp.3 372,21 145,04 -
5. Calothrix sp. 1,06 - -
6. Chroococcus sp. - - 4,267
Coscinodiscophyceae
7. Melosira sp. 28,79 - 77,85 8. Coscinodiscus sp. - 2,13 2,13
Fragilariophyceae
9. Fragilaria sp. 4,27 - 6,40 10. Synedra ulna 1,07 2,13 2,13 11. Thalassionema sp. 7,46 - 5,33
Eustigmatophyceae
12. Nannochloropsis sp. 73,59 - 164,24
Chlorophyceae
13. Chlorella sp. 3,20 5,33 -
Bacillariophyceae
14. Navicula sp. 19,20 - -
15. Bacillaria sp. 8,53 - -
16. Nitzschia sp. 33,06 3,20 12,80 17. Skeletonema sp.1 - 99,18 323,15
18. Skeletonema sp.2 - 36,26 270,89
19. Gyrosigma sp. - 1,06 -
Jumlah 1605,10 1355,53 1598,70
mikroalga yang hanya bisa bertahan pada batas-batas salinitas yang kecil (stenohaline). Variasi tersebut juga menyebabkan fitoplankton (mikroalga) membelah dengan laju yang bervariasi, akibatnya produktivitas primer berbeda dari satu wilayah geografi dengan wilayah geografi yang lainnya [19]. Hasil pengukuran kelimpahan juga menunjukkan bahwa stasiun 1 memiliki nilai kelimpahan paling besar dibandingkan stasiun 2 dan stasiun 3 dengan nilai kelimpahan mikroalga sebesar 1605,10 ind/l. Tingginya kelimpahan mikroalga pada stasiun 1 dibandingkan lokasi lainnya didukung oleh kondisi kualitas perairan yang cukup baik dengan nilai kandungan nitrat (NO3-N) yang lebih besar dibandingkan stasiun 2 dan 3 yaitu sebesar 0,179 mg/l. Rujukan [20] menyatakan bahwa dinamika kelimpahan dan struktur komunitas fitoplankton (mikroalga) terutama dipengaruhi oleh faktor fisika dan kimia, khususnya ketersediaan unsur hara (nutrien) serta kemampuan fitoplankton untuk memanfaatkannya. Di perairan estuari faktor pembatas utama (limiting factor) dalam pertumbuhan mikroalga adalah nitrogen [21].
Pada stasiun 2 kelimpahan mikroalga menurun menjadi 1355,53 ind/l, sedangkan pada stasiun 3 yang terletak di bagian mulut muara yang berhubungan dengan laut bebas kelimpahan mikroalga meningkat menjadi 1598,70 ind/l. Pada stasiun 3 memiliki kandungan oksigen terlarut (DO) yang lebih tinggi dibandingkan stasiun 2. Kandungan oksigen terlarut (DO) yang lebih tinggi tersebut diduga menyebabkan kelimpahan mikroalga di stasiun 3 lebih besar dibandingkan di stasiun 2. Hal ini diperkuat oleh pendapat [22] yang mengatakan bahwa sumber utama oksigen dalam perairan adalah dari proses fotosintesis. Semakin subur suatu perairan akan semakin banyak fitoplankton yang hidup di dalamnya dan akhirnya akan meningkatkan pasokan oksigen terlarut dalam air. Adanya kandungan oksigen terlarut yang rendah disebabkan karena aktifitas respirasi yang lebih tinggi daripada fotosintesis.
B. Parameter Fisika dan Kimia Perairan Muara Wonorejo
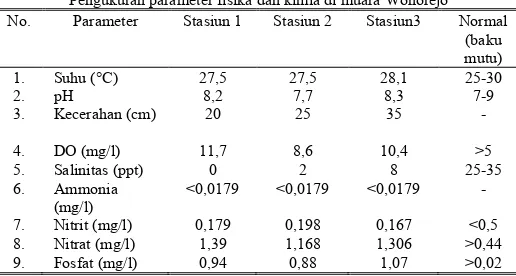
Parameter fisika dan kimia perairan merupakan faktor pendukung dalam kehidupan mikroalga. Hasil pengukuran parameter fisika dan kimia pada penelitian ini disajikan dalam Tabel 2.
Tabel 2.
Pengukuran parameter fisika dan kimia di muara Wonorejo No. Parameter Stasiun 1 Stasiun 2 Stasiun3 Normal
Berdasarkan hasil pengamatan parameter fisika dan kimia di muara Wonorejo menunjukkan bahwa sebaran horizontal suhu dan pH permukaan air memiliki penyebaran yang cenderung homogen yaitu antara stasiun 1 dan stasiun 2 memiliki suhu
perairan yang sama sebesar 27,5°C dan stasiun 3 memiliki suhu perairan sebesar 28,1°C. pada stasiun 1 dan stasiun 3 memiliki pH sebesar 8,2 dan 8,3 sedangkan pada stasiun 2 memiliki pH sebesar 7,7. Kondisi ini merupakan kisaran suhu dan pH optimal bagi kehidupan mikroalga sehingga tidak berpengaruh dalam membedakan tinggi rendahnya kelimpahan mikroalga.
Berdasarkan pengukuran salinitas terhadap setiap stasiun pengamatan menunjukka bahwa nilai salinitas perairan di setiap stasiun berbeda-beda. Stasiun 1 memiliki salinitas 0‰, stasiun memiliki salinitas sebesar 2‰ dan stasiun 3 memiliki salinitas 8‰. Perbedaan salinitas tersebut terjadi karena adanya fluktuasi kondisi lingkungan. Menurut rujukan [23], sebaran salinitas di perairan di pengaruhi oleh pola sirkulasi, penguapan, curah hujan dan aliran sungai. Kisaran salinitas yang berubah-ubah dapat mempengaruhi dan menghambat pertumbuhan dari mikroalga.
Hasil analisis menunjukkan konsentrasi nitrat di muara Wonorejo berkisar antara 1,39 – 1,168 mg/l. Secara umum kandungan nitrat di setiap stasiun masih mencukupi untuk pertumbuhan mikroalga. Nitrat akan menjadi pembatas apabila kurang dari 0,44 mg/l [24]. Hasil pengamatan juga menunjukkan kandungan fosfat yang mencukupi untuk pertumbuhan mikroalga yaitu berkisar antara 1,07 – 0,88 mg/l. Menurut [24], fosfat akan menjadi pembatas bagi kehidupan fitoplankton (mikroalga) jika kurang dari 0,02 mg/l.
C. Analisis Kualitatif Kandungan Lipid Mikroalga
Pada penelitian ini analisis kualitatif yang digunakan adalah dengan pewarnaan Nile red yaitu pewarnaan intraseluler lipid untuk mengevaluasi kandungan lipid dari sel mikroalga [25]. Pewarnaan dengan Nile red dilakukan terhadap setiap isolat mikroalga yang berhasil terisolasi di setiap stasiun pengamatan. Pada stasiun 1 terdapat 4 genus mikroalga yaitu
Nitzschia, Navicula, Nannochloropsis dan Oscillatoria. Pada stasiun 2 terdapat sebanyak 2 genus mikroalga yaitu Nitzschia
dan Oscillatoria. Pada stasiun 3 terdapat sebanyak 3 genus yaitu Nannochloropsis, Oscillatoria dan Chlorococcum.
Tetesan lipid intraselular (lipid netral) yang diwarnai dengan pewarna Nile red diamati di bawah mikroskop
Sel memiliki pendaran orange
terang
Tidak ada pendaran
Tidak ada pendaran
Tidak ada pendaran
Stasiun 2
Nitzschia
Sel memiliki pendaran orange terang
Oscillatoria
Sel memiliki pendaran orange terang Stasiun 3
Nannochloropsis
Sel memiliki pendaran kuning
Chlorococcum
Sel memiliki pendaran kuning mengkilat
Oscillatoria
Tidak ada pendaran
Tabel 4.
Pengamatan kandungan lipid mikroalga
No. Genus
Pendaran warna kuning tetes lipid dalam sitoplasma
- + ++ +++
Stasiun 1
1. Nitzschia √
2. Navicula √
3. Oscillatoria √ 4. Nannochloropsis √ Stasiun 2
1. Nitzschia √
2. Oscillatoria √
Stasiun 3
1. Nannochloropsis √
2. Chlorococcum √
3. Oscillatoria √ Keterangan :
- : Tidak ada pendaran = tidak mengakumulasi lipid
+: Pendaran lemah = pendaran warna dalam sel yang ditampilkan di bawah mikroskop fluorescence adalah dominan orange terang yang berarti akumulasi lipid rendah
++: Pendaran sedang = pendaran warna dalam sel yang ditampilkan di bawah mikroskop fluorescence adalah kuning yang berarti akumulasi lipid sedang
+++ : Pendaran kuat = pendaran warna dalam sel yang ditampilkan di bawah mikroskop fluorescence adalah dominan kuning mengkilat yang berarti akumulasi lipid tinggi.
Pada tabel di atas menunjukkan bahwa di antara ketiga stasiun pengamatan, isolat mikroalga di stasiun 3 memiliki kecenderungan akumulasi lipid yang tinggi dibandingkan dengan stasiun 1 dan stasiun 2. Kecenderungan akumulasi lipid yang paling rendah adalah dari stasiun 1. Adanya akumulasi lipid di dalam sel mikroalga tersebut diduga terjadi akibat dari pengaruh kondisi lingkungan. Pengaruh kondisi lingkungan ini disebabkan karena setiap isolat mikroalga sebelum dilakukan analisis kandungan lipidnya dikultur pada
Lipid yang umumnya diakumulasi oleh mikroalga adalah dalam bentuk triasilgliserol (TAG) karena TAG merupakan komponen utama cadangan energi di dalam sel [7]. Kondisi lingkungan lingkungan yang tidak menguntungkan akan memicu akumulasi lipid di dalam sel mikroalga. Hal ini di buktikan dari pernyataan rujukan [9] dan [28] bahwa salah satu metodologi utama untuk meningkatkan akumulasi lipid adalah stress unsur hara. Ketika kekurangan nitrogen, beberapa mikroalga hijau mengakumulasi lipid dengan kadar yang tinggi sebagai triasilgliserol dan kekurangan fosfat serta sulfur menginduksi konversi membran fosfolipid ke lipid netral.
Pada penelitian ini, isolat Chlorococcum dari stasiun 3 diketahui memiliki kandungan lipid yang tinggi dibandingkan dengan isolat mikroalga yang lain dari ketiga lokasi penelitian di muara Wonorejo. Tingginya akumulasi lipid di dalam sel
Chlorococcum diduga terjadi akibat dari pengaruh kondisi lingkungan salah satunya yaitu faktor salinitas di stasiun 3. Pada stasiun 3 memiliki salinitas 8‰, salinitas tersebut tergolong salinitas yang tinggi untuk pertumbuhan
Chlorococcum. Hal ini sesuai dengan pernyataan [29], bahwa
Chlorococcum dapat tumbuh pada salinitas antara 0 – 2‰. Seperti yang dilaporkan oleh [30] bahwa berbeda dengan kandungan lipid total, pertumbuhan biomassa Chlorococcum
sp. akan menurun dengan peningkatan salinitas. Peningkatan salinitas dapat menstimulasi kadar lipid yang dihasilkan mikroalga [31]. Lipid tersebut digunakan sebagai cadangan makanan dan energi untuk bertahan pada kondisi yang tidak menguntungkan [9].
Dari hasil pengamatan terhadap kandungan lipid secara kualitatif terlihat spesies Oscillatoria tidak memiliki produktivitas lipid yang tinggi. Rendahnya akumulasi lipid pada Oscillatoria kemungkinan disebabkan karena spesies tersebut mampu tumbuh optimal di ketiga stasiun pengamatan. Hal ini dibuktikan dari besarnya nilai kelimpahan Oscillatoria
sp. dibandingkan dengan spesies lain di ketiga stasiun. Walaupun kondisi lingkungan pertumbuhannya berbeda,
Oscillatoria sp. tetap mampu mendominasi di setiap stasiun pengamatan. Hal ini terjadi karena Oscillatoria sp. memiliki kemampuan bertahan pada kondisi lingkungan yang tidak sesuai sehingga tidak terjadi akumulasi lipid terutama lipid netral. Rujukan [32] menyatakan bahwa Oscillatoria sp. diketahui memiliki kemampuan bertahan untuk terhadap perubahan kondisi lingkungan karena selnya memiliki sel pembungkus yang berlapis dan selubung. Selubung akan terbentuk pada kondisi lingkungan sub optimal.
IV. KESIMPULAN
Kesimpulan yang diperoleh dari penelitian ini yaitu terdapat 5 genus mikroalga yang berhasil diisolasi dari muara Wonorejo yaitu Nitzschia, Navicula, Oscillatoria,
Chlorococcum dan Nannochloropsis. Mikroalga Nitzschia dan
Nannochloropsis memiliki akumulasi lipid yang sedang. Mikroalga Chlorococcum yang berasal dari muara Wonorejo merupakan mikroalga dengan kandungan lipid tinggi serta berpotensi untuk dikembangkan lebih lanjut sebagai bahan baku biodiesel.
UCAPAN TERIMA KASIH
Penulis mengucapkan terimakasih kepada ibu Dini Ermavitalini, S.Si, M.Si selaku dosen pembimbing selama masa penyelesaian tugas akhir ini, ibu Dr. Awik Puji Dyah N. selaku dosen penguji dan koordinator tugas akhir dan ibu Ir. Sri Nurhatika, MP. yang telah banyak memberikan saran dalam penyelesaian tugas akhir ini. Serta ucapan terima kasih ditujukan kepada kedua orang tua yang selalu mendukung dan mendoakan. Terakhir untuk teman-teman seperjuangan Biologi ITS 2011 yang telah membantu banyak hal dalam menyelesaikan tugas akhir ini.
DAFTAR PUSTAKA
[1] S. Amini and R. Susilowati, “Produksi Biodiesel dari Mikroalga Botryococcus braunii,” Squalen, Vol. 5 (2010) 71-77.
[2] T. Mata. M., A. M. Antonio, and N. S. Caetano, “Microalgae for Biodiesel Production and Other Applications: A Review,” Renewable and Sustainable Energy, Vol. 14 (2010) 217-232.
[3] Q. Li, W. Du, and D. Liu, “Perspectives of Microbial Oils for Biodiesel Production,” Appl. Microbiol. Biotechnol, Vol. 80 (2008) 749–756. [4] R. Raja, S. Hemaiswarya, N. A. Kumar, S. Sridhar, and R. A.
Rengasamy, “Perspective on The Biotechnological Potential of Microalgae,” Critical Reviews in Microbiology, Vol. 34 (2008) 77–88. [5] L. Gouveia, and A. C. Oliveira, “Microalgae as A Raw Material for
Biodiesel Production,” J. Microbiol. Biotechnol., Vol. 36 (2009) 269-274.
[6] Hossain, A. Salleh, A. N. Boyce, P. Chowdhury, and M. Naqiuddin, “Biodiesel Fuel Production From Algae as Renewable Energy,” American Journal of Biochemistry and Biotechnology, Vol. 4 (2008) 250–254.
[7] H. Hu and K. Gao, “Response of Growth and Fatty Acid Compositions of Nannochloropsis sp. to Environmental Factors Under Elevated CO2
Concentration,” Biotechnol Lett, Vol. 28 (2006) 987-992.
[8] P. M. Shcenk, R. Skye, H. Thomas, E. Stephens, U. C. Marx, J. H. Mussgnug, C. Posten, O. Kruse, and B. Hankamer, “Second Generation Biofuel : High Efficiency Microalgae for Biodesel Production,” Bioenergy, Vol. 1 (2008) 20-43.
[9] Q. Hu, M. Sommerfeld, E. Jarvis, M. Ghirardi, M. Posewitz, Seibert, and A. I. Darzins, “Microalgal Triacylglycerols as Feedstock for Biofuel Production: Perspectives and Advances,” Plant. J., Vol. 54 (2008) 621-639.
[10] Y. Chisti, “Biodiesel from microalgae,” Biotechnol Adv., Vol. 25 (2007) 294-306.
[11] APHA, “Standard Methods for The Examination of Water and Waste-Water, 14th ed,” Washington: American Public Health Association
(1975).
[12] E. G. Bellinger and D. C. Sigee, “Freshwater Algae: Identification and Use as Bioindicators,” USA: Willey-Blackwell Inc. (2010).
[13] T. Matsunaga, M. Matsumoto, Y. Maeda, H. Sugiyama, R. Sato, and T. Tanaka, “Characterization of Marine Microalgae, Scenedesmus sp. strain JPCCGA0024 toward Biofuel Production,” Biotechnol. Let., Vol. 31 (2009) 1367-1372.
[14] S. Elumalai, V. Prakasam, and R. Selvarajan, “Optimization of Abiotic Conditions Suitable for The Production of Biodiesel from Chlorella vulgaris,” Indian Journal of Sci. and Tech.,Vol. 4 (2011) 91-97. [15] M. R. A. Putri and S. E. Purnamaningtyas, “Variasi Kelimpahan
Fitoplankton di Area Keramba Jaring Apung (KJA) Waduk Jatiluhur, Jawa Barat,” Jurnal Widyariset, Vol. 16 (2013) 349-360.
[16] M. Zahidin, “Kajian Kualitas Air Di Muara Sungai Pekalongan Ditinjau dari Indeks Keanekaragaman Makrobenthos dan Indeks Saprobitas Plankton (Tesis),” Tesis, Program Pascasarjana, Universitas Diponegoro, Semarang (2008).
[17] T. A. Barus, “Pengatar Limnologi,” Medan: Universitas Sumatra Utara (2002).
[18] A. H. Chowdhury and A. Mamun, “Physiochemical Conditions and Plankton Population of Two Fishponds in Khulna,” J. zool. Rajshahi Univ., 25 (2006) 41-44.
[19] A. Nontji, “Laut Nusantara,” Jakarta: Penerbit Djambatan (2002). [20] E. P. Odum, “Fundamentals of Ecology,” 5th ed, Philadelphia: W. B.
Saunders Company (2005).
[21] M. N. Campbell, “Biodisel: Algae as Renewable Source for Liquid Fuel,” Guelph Engineering Journal, Vol. 1 (2008) 2-7.
[22] H. Effendi, “Telaah Kualitas Air bagi Pengelolaan Sumberdaya dan Lingkungan Perairan,” Yogyakarta : Kanisius (2003).
[23] P. Sze, “A Biology of Algae,” USA: WNC Brown Publ (1995). [24] J. Basmi, “Perkembangan Komunitas Fitoplankton Sebagai Indikator
Perubahan Tingkat Kesuburan Kualitas Perairan (Tidak Dipublikasikan),” Bogor: Program Studi Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor (1988).
[25] A. L. Ahmad, N. H. M. Yasin, C. J. C. Derek, and J. K. Lim, “Microalgae as A Sustainable Energy Source for Biodiesel Production: A Review,” Renewable and Sustainable Energy Reviews, Vol. 15 (2011) 584- 593.
[26] K. R. Carman, D. Thistle, S. C. Ertman, and M. Foy, “Nile Red as A Probe for Lipid Storage Product in Benthic Copepods.,” J. Mar Ecol, Vol. 74 (1991) 307-311.
[27] Y. Y. Pan, S. T. Wang, L. T. Chuang, Y. W. Chang, C. N. Nathan, and Chen, “Isolation of Thermo-Tolerant and High Lipid Content Green Microalgae: Oil Accumulation is Predominantly Controlled by Photosystem Efficiency during Stress Treatments in Desmodesmus,” Bioresource Technology, Vol. 102 (2011) 10510-10517.
[28] J. L. Moseley, D. Gonzales-Ballester, W. Pootakham, S. Bailey, and Grossman, A. R. “Genetic Interaction between Regulator of Chlamydomonas phosphorus and Sulfur Deprivation Responses,” Genetics, 181 (2008) 889-905.
[29] Y. Jiang, F. Chen, and S. Z. Liang, “Production Potential of Docosahexaenoic Acid by The Heterotrophic Marine Dinoflagellate Crypthecodinium cohnii,” Process Biochemistry, Vol. 34 (1999) 633– 637.
[30] T. U. Harwati, “Cultivation of Microalgae: Lipid Production, Evaluation of Antioxidant Capacity and Modeling of Growth and Lipid Production (Dissertasion),” Ph.D. Dissertation, Dept. Lebenswissenschaften. Eng, Universität Carolo, Wilhelmina (2013).
[31] R. Vazquez-Duhalt and B. Q. Arredondo-Vega, “Haloadaptation of Green Alga Botryococcus braunii (Race A),”Phytochemistry, Vol. 30 (1991) 2929-2925.