# Ko re spo nd e nsi: Pro gram Pascasarjana Ilm u Akuakult ur, Dep arte m e n Budid aya Pe rairan, FPIK, IPB. Jl. Rasam ala, Kam pus IPB Dram aga, Bogo r 16680, Ind o ne sia. Te l.: + (0251) 8627076
Tersedia online di: ht t p://ej ournal-balit bang.kkp.go.id/index.php/j ra
IDENTIFIKASI IKAN CUPANG (
Betta imbellis
) TRANSGENIK
FOUNDER
M EM BAWA GEN
PENYANDI HORM ON PERTUM BUHAN
Eni Kusrini*)#, Alimuddin**), M uhamm ad Zairin Jr.**), dan Dinar Tri Sulistyowati**)
*) Program Pascasarjana Ilmu Akuakult ur, Departemen Budidaya Perairan, FPIK, Institut Pert anian Bogor Balai Penelitian dan Pengembangan Budidaya Ikan Hias
**) De part emen Budidaya Perairan, Fakultas Perikanan dan Ilmu Ke laut an, Institut Pert anian Bogor
ABSTRAK
Penelitian dilakukan untuk mengidentifikasi keberhasilan introduksi gen penyandi hormon pertumbuhan (Growt h Hormone, GH) pada induk F-0 ikan Bet t a imbellis. Ikan transgenik F-0 dibuat dengan menggunakan metode transfeksi. Identifikasi dilakukan menggunakan metode RT-PCR. RNA total diekstraksi dari embrio
pooled sample hasil persilangan induk transgenik dan non-transgenik. Berdasarkan analisis ekspresi gen pada embrio juga menunjukkan adanya aktivitas ekspresi gen GH pada semua perlakuan dibandingkan dengan kont rol (embrio hasil persilangan non-t ransgenik x non-transgenik). Jumlah individu induk F-0 yang membawa gen GH eksogen berdasarkan analisis PCR dengan DNA t emplat e dari sirip ekor adalah se banyak 16%. Individu posit if me mbawa ge n GH e ksoge n t e rse but dibe sarkan le bih lanjut unt uk memproduksi Bet t a imbellis transgenik F-1. Kandidat ikan transgenik jantan F-0 dikawinkan dengan ikan non-t ransge nik bet ina, sedangkan t ransgenik F-0 be tina dikawinkan de ngan non-transge nik jant an. Sebanyak 30-50 butir embrio hasil pemijahan F-0 digabung, kemudian DNA genom diekstrak. Sebagian embrio digunakan untuk ekstraksi RNA total untuk analisis ekspresi mRNA GH eksogen. Hasil analisis PCR menunjukkan bahwa semua sampel embrio dari induk transgenik F-0 dapat terdeteksi gen GH eksogen, sedangkan untuk kontrol (non-transgenik) tidak terdeteksi. Ekspresi mRNA juga terdeteksi pada embrio F-1. Dengan demikian, metode transfeksi embrio Bet t a imbellis efektif digunakan untuk menghasilkan ikan
transgenik, dan sangat berpotensi menghasilkan individu F-1 Bet t a imbellis dengan pertumbuhan lebih ce pat.
KATA KUNCI: Betta imbellis; hormon pertumbuhan; identifikasi induk F-0
ABSTRACT: Identification of transgenic founder betta fish (Bet t a imbelis) carried growth hormone gene. By: Eni Kusrini, Alimuddin, M uhammad Zairin Jr., and Dinar Tri Sulistyowati
The st udy was conduct ed t o ident ify t he successful int roduct ion of t he growt h hormone gene (Growt h Hormone, GH) on t he F-0 Betta imbellis broodst ock. The F-0 t ransgenic fish was made t hrough t ransfect ion met hods. Ident ificat ion was done using RT-PCR met hod. Total RNA was ext ract ed from pooled embr yos sample. Based on t he analysis of gene expression in embryos also showed act ivit y GH gene expression in all t reat ment s compared t o t he cont rol (non-t ransgenic x non-(non-t ransgenic). The number of individuals F-0 which carried exogenous GH gene by PCR analysis of (non-t he DNA t emplat e of t he t ail fin was as much as 16%. Posit ive individuals carried t he exogenous GH gene raised furt her t o produce t ransgenic F-1 B. imbellis. Candidat e of t ransgenic F-0 males fish were mated with non-transgenic female fish, whereas t he transgenic F-0 females were mat ed with non-transgenic males. The 30-50 embryos obtained were combined, t hen t heir genomic DNA were ext ract ed. Some of t he embryos was used for t he ext ract ion of t ot al RNA for analysis of mRNA expression of GH exogenous. The PCR analysis showed t hat all samples of embryos from t he t ransgenic F-0 broodst ock could be det ect ed, whereas for t he cont rol (non-t ransgenic) was not det ect ed. mRNA expression was also det ect ed in embryos of F-1. The average weight of t he F-0 broodst ocks were 1.55 g and a t ot al lengt h was 12.97 cm. Thus, t he t ransfect ion met hods t hrough bet t a embryos peaceful effect ively generat ed t ransgenic fish, and pot ent ially produced fast growt h of individuals F-1 Betta imbellis.
PENDAHULUAN
Pada ikan dan vertebrata lainnya, pertumbuhan
d iko n t ro l a n t a ra la in o le h ke b e ra d a a n h o rm o n
pertumbuhan. Transfer gen
growt h hormone(GH) telah
diaplikasikan pada beberapa spesies ikan budidaya dan
t e rbukt i ma mpu me ningkat kan pe rt umbuhannya.
Keberhasilan penelitian transfer gen telah dilakukan
terhadap ikan-ikan konsumsi dengan menggunakan
gen hormon pertumbuhan di antaranya adalah ikan
salmon t ransgenik dengan menggunakan promoter
m et h al l ot h i on ei nd a n g e n p e n ya n d i h o rm o n
pertumbuhan yang diisolasi dari ikan salmon, ikan nila
transgenik menggunakan promoter
-aktin medaka
dan gen GH dari ikan nila (Yaskowiak
et al., 2006),
serta ikan mud loach transgenik menggunakan pro
-moter
-aktin dan GH dari ikan mud loach (Nam
et al., 2001).
Ho rmo n pe rt umbuhan m e rupakan bagian dari
ho rmo n yang disirkulasika n u nt u k m e ns t im ula si
p e rt u m b u h a n t u b u h . Pa d a a wa l p r o d u ks i ik a n
transgenik digunakan gen GH dari manusia atau tikus
yang disambungkan dengan promoter
metalotionein-1 dari t ikus (Macle an
et al., 198 7). Pada sa at ini
b e rk e m b a n g p ro d u k s i ik a n t r a n s ge n ik d e n g a n
menggunakan gen GH yang berasal dari ikan (Du
et al., 1992). Hasil-hasil penelitian yang telah dilakukan
bahwa ikan mas, ikan salmon, no rthe rn pike , ikan
loach, ikan trout, dan ikan lele dapat ditransformasi
dengan berbagai hormon pertumbuhan dengan pro
-moter yang berbeda untuk memproduksi ikan dengan
p e n in g ka t a n p e rt u m b u h a n le b ih d a r i 1 0 0 %
d ib an d in gkan ko n t ro l (Ha cke t t , 1 99 3 ). Ge n GH
merupakan salah satu gen target yang paling banyak
digunakan dalam t ransgenik ikan. Transfe r gen GH
telah diaplikasikan pada ikan salmon sehingga dapat
tumbuh lebih cepat dari ikan normal (Devlin
et al.,
1994), ikan mud loach dengan kecepatan tumbuh 32
kali lebih cepat (Nam
et al., 2001), dan ikan nila dengan
pertumbuhan 2-7 kali lebih cepat (Kobayashi
et al.,
2007).
Peningkatan laju pertumbuhan ikan merupakan salah
satu motivasi awal pada rekayasa genetika ikan yang
d id a sa rka n p a da p e n e lit ia n b a h wa t iku s se ca ra
signifikan dapat ditingkatkan setelah diintroduksi gen
hormon pertumbuhan tikus tanah (sekuen heterolog)
yang disambungkan dengan promoter
met allot hionein(MT) t ikus ke dalam ge no m t ikus (Palmit e r
et al.,
menunjukkan bahwa transgenik GH yang berasal dari
s p e s ie s ya n g ke k e ra b a t a n n ya d e k a t e fe kt if
me ningkat kan pe rt umbuhan he wan inang, t e t api
ap abila me nggu nakan s e kue ns ge n GH h o mo lo g
dengan promoternya yang sama dari spesies yang sama
ke mungkinan t idak t e rlalu e fe kt if kare n a adanya
potensi pengaturan umpan balik negatif (Nam
et al.,
2008).
Tin g ka t e ks p re s i t ra n s g e n p a d a o rg a n is m e
transgenik yang stabil dipengaruhi oleh banyak faktor,
te rutama promo te r yang me nge ndalikan transge n,
jumlah kopi transgen dalam ge no m, dan int eraksi
antara transgen dan sekuens yang mengapit transgen
(Rahman
et al., 2000). Selanjut nya dikatakan o le h
Rahman
et al. (2000) yang mengintroduksi gen reporter
lacZ dengan promoter
-aktin ikan mas pada ikan nila
menunjukkan adanya pola
mosaicdari ekspresi
lacZ
pada jaringan somatik berbeda antar garis keturunan,
tetapi konsisten dalam satu garis keturunan. Analisis
ekspresi gen reporter pada jaringan yang didasarkan
pada ekspresi gen
lacZ pada ikan transgenik st abil
menunjukkan intensitas yang bervariasi pada organ
d a n ja rin ga n ya n g b e rb e d a d a n ka d a n g-ka d a n g
bervariasi pada sel-sel yang berbeda dalam jaringan
yang sama pada ge nerasi t ransge nik pe rt ama dan
kedua.
BAHAN DAN M ETODE
Pemeliharaan Calon Induk dan Pem ijahan Ikan Transgenik F-0
Calon induk ikan transgenik F-0 yang membawa
gen GH eksogen pada sirip dipelihara sampai mencapai
umur 7-9 bulan (matang gonad). Pakan yang diberikan
untuk pembesaran dan pematangan gonad induk-induk
F-0 berupa
bloodworm(larva chironomus beku) dan
t ubifexyang dibe rikan secara berse ling se hari dan
secara
ad libit um.
Pemijahan berpasangan 1:1 dilakukan secara alami
di dalam wadah berupa baskom. Induk yang digunakan
masing-masing be rjumlah tiga ekor de ngan jant an
rataan panjang 5,48 ± 0,13 cm dan bobot 2,56 ±
0,23 g; sedangkan betina rataan panjang 4,98 ± 0,33
cm dan bobot 2,44 ± 0,60 g. Persilangan dilakukan
secara resiprokal yaitu menggunakan induk transgenik
dengan induk non-transgenik masing-masing dengan
tiga ulangan induk yang berbeda. Perlakuan A (induk
jantan transgenik x betina transgenik); perlakuan B
(induk jantan t ransge nik x be tina non-transge nik);
perlakuan C (induk jant an non-t ransgenik x betina
t ran sge nik); dan pe rlaku an D (induk jant an no
n-t ransge nik x ben-t ina no n-n-t ransge nik). Pe ngambilan
sampel berupa embrio hasil pemijahan masing-masing
pasangan induk secara
pooledsample (50 butir).
Analisis DNA Genom
DNA genom diekstraksi dari 50 sampel (butir telur)
u n t u k u ji k o n fir m a s i m a s u kn ya g e n h o r m o n
pertumbuhan ke embrio dan larva
B. imbellis. Ekstraksi
DNA dilakukkan menggunakan
GeneJET Genomic DNA Purificat ion Kitse suai prosedur manual. DNA hasil
ekstraksi dilarutkan menggunakan 100 µL
elution buffer,
dan disimpan dalam
freezerhingga akan digunakan
dalam proses PCR.
Amplifikasi PCR dilakukan menggunakan
maxima hot st art green PCR mast er mix2x (Thermo science).
Komposisi reaksi PCR adalah 12,5 µL master mix, 1
µL primer
PhGH d e n g a n ko n s e n t ra s i 2 0 p m o l
(F3
PhGH: 5’TCT TTA GTC AAG GCG CGA CAT TCG
AGA-3’, dan R3
PhGH: 5’-CGA TAA GCA CGC CGA TGC
CCA TTT TCA-3’; (Dewi
et al., 2012), 2 µL DNA (berapa
konsentrasinya 200 ng/µL), dan
nuclease free wat ersampai volume total menjadi 25 µL. Program
amplifikasi PCR adalah: pradenaturasi 94°C selama lima
me nit; de nat urasi 94°C selama 30 detik,
annealing58°C selama 30 detik, dan ekstensi 72°C selama 30
de tik sebanyak 35 siklus; dan e kste nsi akhir 72°C
selama tiga menit.
Gen
-aktin digunakan sebagai kontrol internal
loadingDNA. Primer yang digunakan adalah primer
F : 5’- TAT GAA GGT TAT GCT CTG CCC -3’, dan primer
b-aktin R : 5’- CAT ACC CAG GAA AGA TGG CTG-3’
(Alimuddin, tidak dipublikasikan). Amplifikasi PCR
dilakukan dengan program: pradenaturasi 94°C selama
t ig a m e n it ; d e n a t u ra s i 9 4 °C s e la m a 3 0 d e t ik ,
annealing62°C selama 30 detik dan e kst ensi 72°C
selama 30 detik sebanyak 35 siklus; dan ekstensi akhir
72°C selama tiga menit.
Pro d u k a m p lifik a s i PCR d is e p a ra s i d e n ga n
e le k t r o fo r e s is m e n gg u n a k a n g e l a g a ro s a 1 %.
Dokumentasi dilakukan menggunakan gel doc UV
transiluminator. Target amplifikasi untuk
PhGH adalah
334 bp, dan
-aktin adalah 300 bp.
Analisis Ekspresi mRNA Gen GH Eksogen
Isolasi RNA total diekstraksi dari 50 sampel (butir
telur) dilakukan me ngikuti prosedur
Tri Reagent KitAGA-3’, 1 µL primer CcBA-PhGH-R : 3’- CGA TAA GCA
Se b a g a i p a r a m e t e r p e n d u k u n g d ila k u k a n
pengukuran pertumbuhan induk-induk F-0 yang positif
membawa gen GH yang diintroduksikan. Pertumbuhan
diukur setiap bulan selama tujuh bulan masing-masing
p o p u la s i s e b a n ya k 3 0 e ko r. Ad a p u n p a ra m e t e r
pendukung lainnya adalah kualit as air yang diukur
setiap bulan meliputi parameter fisik dan kimia.
HASIL DAN BAHASAN
Induk-induk transgenik dan non-transgenik yang
digunakan untuk pemijahan guna menghasilkan telur
diseleksi terlebih dahulu dan dilakukan pengukuran
bobot dan panjangnya. Induk F-0 yang digunakan telah
mencapai umur 7-9 bulan.
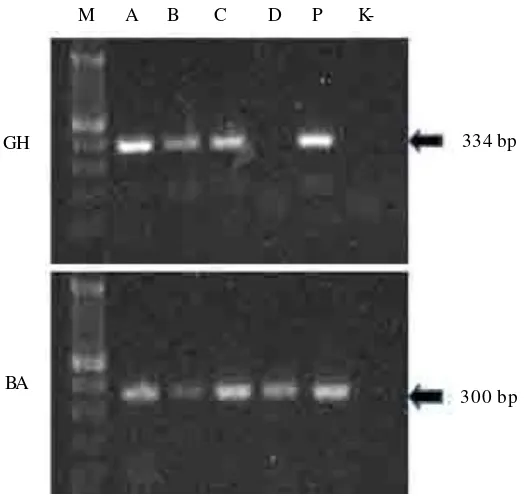
Hasil dari PCR dengan templat DNA dari embrio
ditampilkan pada Gambar 2A. Berdasarkan hasil PCR
didapatkan bahwa semua pasangan induk yang diambil
s a m p e l u n t u k in d u k t r a n s g e n ik x t r a n s g e n ik
(p e m ijah a n A) da n t ran s ge nik x n o n -t ra n s ge n ik
(pemijahan B dan C) semua positif membawa gen GH
dalam tubuhnya dengan indikasi keberadaan fragmen
DNA pada posisi sekitar 334 bp, yang tidak didapatkan
pada embrio kontrol (pemijahan D).
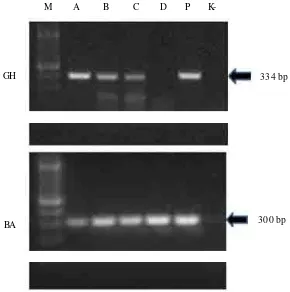
Analis is e kspre s i ge n PhGH pada e mbrio ikan
B. imbellisjuga dilakukan untuk
pooled sampledterhadap
semua perlakuan. Dari empat perlakuan persilangan
diperoleh hasil pada perlakuan A, B, dan C semua
positif yang berarti menunjukkan bahwa gen PhGH
terekspresi pada gonad F-0 (Gambar 3A). Hal tersebut
juga m e nunjukkan b ahwa
-akt in ikan mas yang
digunakan mampu mengendalikan ekspresi gen PhGH
terhadap ikan cupang alam
B. imbellis. Hasil ekspresi
juga menunjukkan potensi yang tinggi dihasilkan ikan
transgenik F-1. Selanjutnya, keberhasilan deteksi gen
GH e ksogen pada embrio F-1 menunjukkan bahwa
pembuat an ikan
bet t atransge nik dapat dilakukan
menggunakan metode transfeksi dengan
X-t reme Gene.
Hal ini merupakan pertama kali dilaporkan. Selain itu,
hasil yang dipe ro le h pad a pe ne lit ian ini me n jadi
ko n fir m a s i u la n g ke b e rh a s ila n t ra n s fe ks i ya n g
dilaporkan oleh Prasetio
et al. (2013) menggunakan
gen GFP (
Green Flourescent Prot ein) sebagai reporter.
Kontrol internal dilakukan PCR dengan beta aktin
u n ive rs a l d a n m e n u n ju kk a n h a s il ya n g p o s it if
terdeteksi pada 300 bp pada semua perlakuan bak
A, B, C, d an D, s e d a ngka n s e b aga i pe m ba nd in g
digunakan kontrol positif dari plasmid dan kontrol
ne gat if air se b agai
t em plat e. Hasil e le kt ro fo re s is
kontrol internal beta aktin tersebut ditampilkan pada
Gambar 1.
Pada penelitian identifikasi induk ini belum dapat
d ih it un g p e rse n t a s e ke be rha s ila n in d ividu yan g
membawa ge n yang diintroduksikan, karena untuk
analisis per individu diperlukan potongan organ sirip
untuk diisolasi. Untuk keperluan analisis per individu
masih menunggu benih dapat dipotong siripnya dan
perlu dilakukan pemijahan berikutnya unt uk dapat
dihitung persentase yang lebih akurat per pemijahan
per pasang induk. Pada pe nelitian terdahulu untuk
B. imbellisyang diint ro duksi ge n GFP didapat kan
individu positif F-1 sebesar 20%-33,33% (Kusrini
et al.,
2012). Ke be rhasilan me t o de t ransfe ksi
w ild bet t amenunjukkan nilai yang lebih rendah jika dibandingkan
penelitian Sarmasik
et al. (2001a; 2001b) terhadap ikan
Poeciliopsis lucida. Be rdasarkan pe ne lit ian terse but,
Sarmasik
et al. (2001a; 2001b) melaporkan bahwa
keberhasilan pewarisan transgen pada keturunan hasil
persilangan individu F-0 transgenik x non-transgenik
adalah sebesar 45%-70%. Hal tersebut kemungkinan
bahan
reagenyang digunakan berbeda dan kondisi telur
juga berbeda. Pada penelitian Sarmasik
et al. (2001a;
2001b) menggunakan me to de
ret r ovir al vect ordan
ukuran telur ikan yang lebih kecil se hingga korion
lebih tipis.
Tingkat ke berhasilan pe warisan transge n pada
ke t uruna n ind ividu F-0
B. im belli st ran sge nik ini
adalah sebesar 3%-19%. Menurut penelitian Sun
et al.
(2005), terhadap udang vaname (
Lit openaeus vannamei)
yang me mbandingkan meto de antara mikroinjeksi,
t ransfe ks i, dan e le kt ro po rasi; m e t o d e t ran sfe ksi
menunjukkan hasil yang le bih efektif dibandingkan
mikroinjeksi dan elektroporasi. Di lain pihak, dengan
metode transfeksi terhadap ikan zebra dengan bahan
dasar lemak FuGene6 menghasilkan sint asan 58%.
Me t o de t ransfe ksi me nggunakan larut an X-t re me
Gene, daya tetas telur
Bet t a imbellisdapat mencapai
80%, jauh lebih besar dibandingkan dengan ikan zebra
tersebut. Berdasarkan pertimbangan tersebut, metode
transfer gen yang dapat dikembangkan pada embrio
ikan yang berukuran kecil khususnya ikan hias yang
pemijahannya secara alami terutama adalah metode
transfeksi menggunakan larutan X-treme Gene.
tiap-t ia p p e r la k u a n . Ha s il p e n e litiap-t ia n tiap-t e r s e b u tiap-t
me mperlihatkan bahwa dengan t ransfeksi gen GH,
ekspresi gen relatif lebih tinggi dibandingkan dengan
kontrol (tanpa transfeksi).
Menurut Lyenger
et al. (1996), bahwa pada awal
pe rke mba ngan e mbrio , ge n yang dit rans fe r akan
direplikasi tanpa mengalami integrasi ke dalam genom
re sip ie n . Le b ih la nju t d ije la s kan b ah wa s e t e la h
mengalami beberapa pembelahan sel, sebagian gen
asing t e rse b ut t e rint e grasi se cara a cak ke dalam
genom resipien di salah satu
blast omersehingga akan
t erdapat dua macam se l yait u sel yang membawa
t ransge n dan se l yang t idak me mbawa t ransge n.
Menurut Chou
et al. (2001), ketika fragmen DNA yang
terdiri atas suatu gen target atau gen penanda ho
-molog maupun heterolog ditransfer, maka akan sangat
u mu m m e n e mu kan ke jad ia n m o sa ik. Se la in it u ,
menurut Alimuddin
et al. (2003), selain terintegrasi
ke dalam genom, ada sebagian dari gen asing berada
dalam suatu posisi ekstrakromosomal. Lebih lanjut
dijelaskan bahwa gen asing yang terinte grasi akan
stabil di dalam genom, sementara dalam bentuk ekstra
kromosomal akan terdegradasi oleh
endogeneus nu-clease. Berdasarkan hasil penelitian ini memperlihatkan
bahwa gen yang telah disisipkan tersebut terekspresi,
walaupun kemungkinan tidak semua mengekspresikan
transgen untuk seluruh populasi F-1 apabila dianalisis
per individu, mengingat pada tahap ide ntifikasi ini
masih merupakan
pooled sampled. Selain itu, dapat juga
memperlihatkan bahwa gen GH yang disisipkan dapat
dit ransmisikan pada keturunannya, sehingga induk
F-0 tersebut merupakan
germline t rasmit t er. Rahman &
Maclean (1999) melakukan penyisipan gen GH ikan
salmon-gen anti beku
ocean pout(OPAFPcsGH), laju
Gambar 1. Hasil PCR menggunakan primer spesifik gen penyandi hormon pertumbuhan
ikan patin (GH) dan
-aktin (BA) dengan templat DNA yang diekstraksi dari
kumpulan embrio ikan
bet t aketurunan pertama
Figure 1. Result of PCR by specific primer gene marker from pangasius wit h t empelat e DNA t hat was ext ract ed from polled embryos of first generat ion of bet t a fish Ke terangan: M= marka 100 bp (Vivant is); A= em brio dari pem ijahan transge nik x t ransge nik
F-0; B= pem ijahan jantan transgenik F-0 x bet ina no n-transgenik; C= pem ijahan jantan no t ransgenik x be tina t ransgenik F-0; D= pe mijahan no transgenik x no n-transgenik; P= kont rol positif plasmid; K= kont rol negatif NFW. Angka d i sebelah kanan gam bar (334 bp dan 300 bp) masing-masing adalah ukuran pro duk PCR unt uk ge n GH ikan pat in dan aktin ikan bet ta
Not e: M = marka 100 bp (Vi vant is); A= spaw ning of F-0 t r ansgenic x t r ansgeni c; B=
spawning of 0 t ransgeni c male x non-t ransgenic; C= spawni ng of non-t ransgenic x F-0 t ransgenic female; D= spawni ng of non-t ransgenic x non-t ransgenic; P= posit i ve cont rol plasmid; K= negat i ve cont rol NFW. 3 34 bp= fragment size of GH pangasi us
gen; 300 bp= fr agment size f -act in uni versal
GH
BA
334 bp
K-germline t ransmision
dari F-0 ke F-1 hanya kurang dari
10%, namun laju t ransmisi t ransgen dari F-1— F-2
adalah sekitar 50% (sesuai dengan hukum Mendel).
Berdasarkan hasil penelitian Kobayashi
et al. (2007)
yang juga menggunakan gen mBP-
t iGHpada generasi
pert ama ditransmisikan se besar 5,71% dan 14,3%.
Setiap individu yang terintegrasi gen asing ke dalam
ge no m akan dit ransmisikan ke pada ke turunannya.
Untuk mengaplikasikan teknik ini pada akuakult ur
maka pro duksi massal ikan transge nik dipe rlukan
(Yoshizaki
et al., 2001). Pada penelitian ini diperoleh
hasil bahwa individu ikan
Bet t a imbellis founder(induk)
m e m b a wa g e n ya n g t e la h d is is ip k a n k e p a d a
ket urunannya sebesar 16% pada ge ne rasi pe rt ama
(Kusrini
et al., 2014). Hasil tersebut untuk F-0 cukup
t in ggi a p a b ila d ib a n d in gka n d e n ga n p e n e lit ia n
se be lumnya meskipun menggunakan meto de yang
berbeda-beda. Hasil penelitian sebelumnya pada ikan
nila transge nik dengan konst ruksi gen yang sama
membe rikan hasil transmisi pada generasi pe rtama
sebesar 5,7%-14,3%. Pada ikan
mud loachlaju transmisi
transgen pada generasi pertama bervariasi berkisar
antara 2%-33% (Nam
et al., 2001). Menurut Alimuddin
et al. (2005), laju transmisi transgen pada generasi
pertama bervariasi antara 4,2%-44,1%.
Sebagai parameter pendukung dalam pembesaran
sampai pematangan gonad induk-induk F-0 diamati
Gambar 2. Hasil RT-PCR menggunakan primer spesifik gen penyandi hormon pertumbuhan
ikan patin (GH) dan
-aktin (BA) dengan
t emplat ecDNA dari kumpulan embrio
ikan betta keturunan pertama
Figure 2. Result s of RT-PCR by specific primer growt h hormone of pangasius as marker gene and
-akt in wit h t empelat e cDNA from polled embryos for first generat ion of bet t a fish Ke terangan: M= marka 100 bp (Vivantis); A= e mbrio d ari pem ijahan transgenik x transgenik F-0;B= pem ijahan jantan transgenik F-0 x bet ina no n-transgenik; C= pemijahan jant an no t ransgenik x be tina t ransgenik F-0; D= pe mijahan no transgenik x no n-transgenik; P = kontro l po sit if plasmid ; K= ko ntrol negatif NFW. Angka d i se belah kanan gam bar (334 bp dan 300 bp) masing-masing adalah ukuran pro duk PCR unt uk ge n GH ikan pat in dan -aktin ikan bet ta
Not e: M = mar ka 100 bp (Vi vant is); A= spawning of F-0 t ransgenic x t ransgenic; B= spawni ng
of F-0 t r ansgeni c male x non-t ransgenic; C= spawni ng of non-t ransgenic x F-0 t ransgenic femal e; D= spaw ning of non-t r ansgenic x non-t ransgenic; P= posit i ve cont rol plasmi d;
K= negat i ve cont rol NFW.33 4 bp= fragment size of GH pangasi us gen; 30 0 bp=
fr agment size f -act in uni versal
M A B C D P
K-GH
BA
334 bp
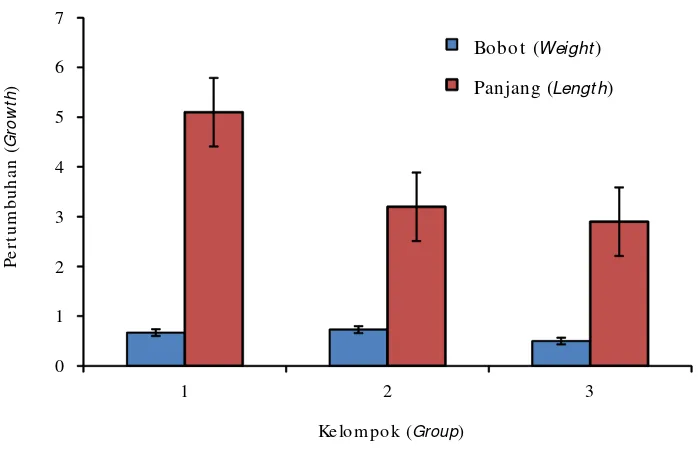
pu la p e rt u mb uh an s e cara be rkala. Ada pu n ha sil
pengamatan panjang dan bobot induk-induk F-0 yang
digunakan untuk koleksi telur dan larva ditampilkan
pada Gambar 3. Berdasarkan hasil pengamatan selama
tujuh bulan induk-induk F-0 yang positif membawa
gen GH diperoleh pertumbuhan panjang dan bobot
yang berbeda antara perlakuan dengan kontrol.
Induk-induk F-0 yang positif membawa gen merupakan hasil
introduksi embrionya dan telah berumur tujuh bulan
ke atas. Transfeksi embrio F-0 yang telah dilakukan
o le h Kusrini
et al. (2016) me nggunakan be rbagai
konsentrasi DNA yaitu dari 0,25 µL; 0,50 µL; dan 0,75
µL dengan konsentrasi transfast 0,75 µL.
Berdasarkan hasil penelit ian t entang pe rbedaan
konsentrasi DNA, telah didapatkan konsentrasi 0,25
µL dan transfast 0,75 µL memberikan pertumbuhan
panjang yang paling baik. Ole h karena it u, untuk
produksi individu F-1 selanjutnya menggunakan
induk-induk F-0 yang telah membawa gen GH hasil introduksi
0,25 µL DNA dan 0,75 µL transfast. Induk-induk
B.imbelis
transgenik F-0 memiliki panjang dan bo bot
yang bervariasi. Data pertumbuhan untuk induk-induk
F-0 ini tidak dapat dianalisis secara statistik karena
jumlah individu per perlakuan per ulangan tidak sama
sehingga penampilan hasil secara deskriptif.
Be rdasa rkan pe n e lit ian ini, be b e rap a in dividu
transgenik menunjukkan laju pertambahan panjang
yang pesat, namun untuk pertambahan bobot relatif
sama antar ulangan. Pada ikan
B. imbellis, transfer gen
PhGH yang berasal dari spesies yang sangat berbeda
memberikan ekspre si yang sama ant ar pe rlakuan.
Keberhasilan transfer ge n PhGH eksogen ke dalam
resipien dan efeknya pada pertumbuhan, penggunaan
konsentrasi DNA 25 µL dan transfast 0,75 µL optimal
untuk memperoduksi ikan
B. imbellistransgenik. Hal
ini sangat pe rlu e valuasi selanjutnya yait u tingkat
t ransmisi dan laju pe rt ubuhan individu F-1 untuk
memberikan informasi yang lebih lengkap.
Fa k t o r ya n g t id a k k a la h p e n t in g t e r h a d a p
pertumbuhan induk ikan cupang F-0 hasil transgenik
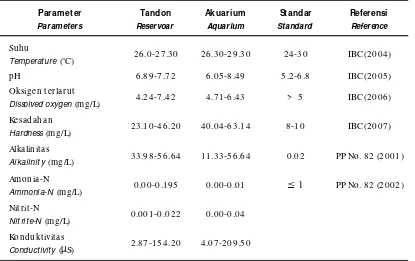
adalah faktor lingkungan yaitu kualitas air. Pengamatan
parameter kualitas air dilakukan setiap bulan untuk
me mant au fluktuasi lingkungan yang berpe ngaruh
terhadap pertumbuhan ikan yang digunakan untuk
memproduksi benih selanjutnya. Parameter kualitas
air yang diukur meliputi suhu, pH, oksigen terlarut,
ke sadahan, alkalinit as, amonia, dan ko ndukt ivitas.
Adapun data pengamatan kalitas air ditampilkan pada
Tabel 1. Kualitas air selama pemeliharaan masih berada
pada kisaran yang optimal untuk pemeliharaan ikan
cupang karena nilai yang dihasilkan di atas standar
baku mutu sesuai PP No. 82 untuk kegiatan budidaya
ikan air tawar. Kesadahan pada tendon dan akuarium
sangat tinggi, jauh di atas standar. Tetapi hal tersebut
t id a k t e rla lu m e m e n ga ru h i p e rke m b a n ga n d a n
kehidupan ikan cupang.
Gambar 3. Pertumbuhan induk-induk F-0 pada umur tujuh bulan yang digunakan
untuk koleksi embrio yang terdiri atas tiga kelompok
Figure 3. Growt h of F-0 broodst ock at seven mont hs old, t hat was use for embry-onic collect ion, consist ed of t hree groups
0 1 2 3 4 5 6 7
1 2 3
P
e
rt
u
m
b
u
h
an
(
G
ro
w
th
)
Kelo mpo k (Group)
KESIM PULAN
Berdasarkan hasil identifikasi dapat disimpulkan
ikan transgenik F-0
germline transmitterdapat dihasilkan
me ngguna kan me t o de t ra nsfe ksi. Pro mo t e r ccBA
dapat mengendalikan ekspresi mRNA gen GH eksogen
pada ikan bet t a. Ke be rhasilan t ransfe r ge n PhGH
e ks o ge n k e d a la m re s ip ie n d a n e fe kn ya p a d a
p e rt u mb u ha n, d a n in du k-ind uk F-0 ya ng po sit if
selanjut nya dapat digunakan unt uk me mpro duksi
benih F-1 transgenik GH.
UCAPAN TERIM A KASIH
Penulis mengucapkan t e rima kasih ke pada tim
pe ne lit i dan te knisi ge net ika Balai Pe ne lit ian dan
Pe n ge mb anga n Bud idaya Ikan Hias a t as bant uan
selama penelitian. Pe nelit ian ini dibiayai oleh DIPA
tahun anggaran 2015.
DAFTAR ACUAN
Alim u d d in , Yo s h iz a ki, G., Ca r m a n , O., &
Sumantadinata, K. (2003). Aplikasi transfer gen
dalam akuakultur.
J. Akua. Indonesia, 2(1), 41-50.
Alimu dd in , Yo s hiz aki, G., Kiro n, V., Sa t o h , S., &
Takeuchi, T. (2005). Enhancement of EPA and DHA
biosynthesis by over-expression of masu salmon
Ä6-desaturase-like gene in zebrafish.
Trans. Res.,
14, 159-165.
De w i, R.R.S.P.S., Alim u d d in , Su d ra d ja t , A.O., &
Somantadinata, K. (2012) Efektivitas transfer dan
e k s p r e s i g e n Ph GH p a d a ik a n p a t in s ia m
(
Pa ng asi a nod on h yp oph t h al m u s).
Ju r n al Ri set Akuakult ur, 7(2), 171-180.
Chou, C.Y., Horng, L.S., & Tsai, H.J. (2001). Uniform
GFP-e xp re ss io n in t rans ge nic me daka
Or yzi as lat ipesat the F0 generation.
Transgenic Research,
10: 303-315.
Devlin, R.H., Yesaki, T.Y., Biagy, C.A., Donaldson, E.M.,
Swanson, P., & Chan, W.K. (1994). Extraordinary
salmon growth.
Nat ure, 371, 209-210.
Du, S.J., Gong, Z., Fletcher, G.L., Shears, M.A., King,
M.J., Idler, D.R., & Hew, C.L. (1992). Growth
en-hancement in transgenic Atlantic salmon by the
use of an “all fish” chimeric growth hormone gene
construct.
Biol. Tech., 10, 176-180.
Ha cke t t , P.B. (1 9 9 3 ). Th e m o le cu la r b io lo gy o f
transgenic fish. (p. 207-240).
InHochachka, P.W.,
& Mommsen, T.P. (Eds.).
Biochemist r y and M olecu-lar Biology of Fishes. Elsevier Science. Amsterdam,
Vol. 2.
Kobayashi, S., Alimuddin, Morita T., Miwa, M., Lu, J.,
Endo, M., Takeuchi, T., & Yo shizaki, G. (2007).
Transgenic nile tilapia (
Oreochromis nilot icus) over
expressing growth hormone show reduced
am-monia excretion.
Aquacult ure, 270, 427-435.
Tabel 1. Kualitas air selama pemeliharaan
Table 1. Wat er qualit y during rearing periods
Param et er Parameters
Tandon Reservoar
Akuarium Aquarium
St andar Standard
Referensi Reference
Suh u
Temperat ure (°C) 26 .0 -2 7.30 26.3 0-29 .3 0 24 -3 0 IBC (20 04 )
p H 6 .8 9-7 .7 2 6.0 5-8.49 5 .2 -6 .8 IBC (20 05 )
Oksig en terlarut
Dissolved oxygen (mg/L) 4 .2 4-7 .4 2 4.7 1-6.43 > 5 IBC (20 06 ) Kesad ahan
Hardness (mg/L) 23 .1 0-4 6.20 40.0 4-63 .1 4 8 -10 IBC (20 07 )
Alkalin itas
Alkalinit y (mg/L) 33 .9 8-5 6.64 11.3 3-56 .6 4 0.02 PP No . 8 2 (2 00 1) Amon ia-N
Ammonia-N (mg/L) 0.00 -0 .195 0.0 0-0.01
≤ 1
PP No . 8 2 (2 00 2)Nitrit-N
Nit rit e-N (mg/L) 0.00 1-0 .0 22 0.0 0-0.04 Kon du ktivitas