BAB 2
TINJAUAN PUSTAKA
2.1 Peranan Komoditi Kelapa Sawit Pada Perkembangan Ekonomi Indonesia
Kelapa sawit merupakan salah satu komoditas unggulan yang memberikan kontribusi penting pada pembangunan ekonomi Indonesia, khususnya pada pengembangan agroindustri. Luas perkebunan kelapa sawit di Indonesia pada tahun 2005 mencapai 3,67 juta Ha dengan produksi CPO sebanyak 14 juta ton. Meningkatnya konsumsi CPO dipasar dunia menyebabkan pengembangan lahan kelapa sawit di Indonesia semakin bertambah, sehingga pada tahun 2010 diprediksikan luas perkebunan kelapa sawit akan mencapai 7,03 juta Ha dengan produksi CPO sebanyak 27,9 juta ton yang mengungguli Malaysia dengan luas lahan kelapa sawit 4,54 juta Ha dengan produksi CPO sebanyak 19,6 juta ton (Gunstone, F. 2007).
Peningkatan produksi bahan mentah berupa minyak mentah kelapa sawit telah membuka peluang pula untuk pengembangan industri hilir. Dengan demikian nilai tambah akan diperoleh sekaligus akan menambah lapangan kerja baru. Hal ini tercermin dengan meningkatnya pemakaian industri dalam negeri yang dalam tahun 1993 misalnya mencapai dua ton. Keperluan industri ini baik untuk minyak goreng, minyak olahan dan barang jadi lain akan terus meningkat sesuai pertambahan penduduk dan meningkatnya pendapatan (Naibaho, P.M. 1996).
Pengembangan produk turunan minyak sawit penting untuk dilakukan mengingat peningkatan nilai tambah yang dapat diperoleh. Produk olahan dari CPO dapat dikelompokkan menjadi dua, yaitu produk pangan dan non pangan. Produk pangan terutama minyak goreng dan margarin. Produk non pangan terutama oleokimia seperti ester, asam lemak, surfaktan, gliserin, alkohol asam lemak, senyawa
amida, senyawa amina dan turunan-turunan lainnya. Industri penghasil oleokimia termasuk industri kimia agro ( agrobased chemical industry) yaitu industri yang mengolah bahan baku yang dapat diperbaharui (renewable), merupakan industri yang bersifat resources – based industries dan mempunyai peranan penting dalam upaya pemenuhan kebutuhan pokok masyarakat luas, seperti kosmetika, produk farmasi dan produk konsumsi lainnya. Selain itu industri tersebut berperan pula dalam pemerataan dan pertumbuhan ekonomi serta pemberdayaan ekonomi rakyat ( Lembaga Riset Perkebunan Indonesia, 2007 ).
2.2 Oleokimia
Oleokimia merupakan produk kimia yang berasal dari minyak atau lemak, baik nabati maupun hewani. Pembuatannya dilakukan dengan cara memutus struktur trigliserida dari minyak atau lemak tersebut menjadi asam lemak dan gliserin, atau memodifikasi gugus fungsi karboksilat dan hidroksilnya, baik secara fisika maupun biologi.
Oleokimia dibagi menjadi, yaitu oleokimia dasar dan turunannya atau produk hilirnya. Oleokimia dasar terdiri atas asam lemak, metilester asam lemak, alkohol asam lemak, senyawa amina asam lemak, dan gliserol. Selanjutnya, produk-produk turunnannya antara lain adalah sabun, deterjen, sampo, pelembut, kosmetik, bahan tambahan untuk industri plastik, karet, dan pelumas.
Pada tahun 2000, total produksi oleokimia dasar indonesia mencapai 349.882ton, terdiri atas fatty acid 68,7%, fatty alcohol 19,6%, fatty methylester 1,1%, dan gliserol 10,6%. Fatty amine sampai saat ini belum diproduksi di Indonesia. Apabila dibandingkan tahun 1999, total produksi oleokimia dasar Indonesia mengalami peningkatan 9,5% (Lembaga Riset Perkebunan Indonesia, 2007).
2.3 Asam Karboksilat
Asam karboksilat adalah senyawa – senyawa organik yang memiliki ciri – ciri dengan adanya suatu gugus karboksil, dengan rumus R-C(=O)OH, biasanya dituliskan dengan
R–COOH atau R–CO2H. anion karboksilat R-COO- biasanya diberi nama dengan akhiran –ate, sebagai contoh asam asetat menjadi ion asetat. Tatanama menurut IUPAC, asam karboksilat berakhiran –oat atau –at, contohnya; asam oktadekanoat. Asam karboksilat merupakan asam Bronsted – Lowry sebagai donor proton. Anion dan garam dari asam karboksilat disebut dengan karboksilat. Bentuk yang paling sederhana dari asam karboksilat adalah asam alkanoat, R-COOH, dimana R merupakan suatu atom hidrogen atau suatu gugus alkil
(Morrison, R. T. dan Boyd, R. N. 1992 ).
Asam karboksilat lebih bersifat asam dibandingkan dengan alkohol karena hasil dari reaksi ionisasi, resonansi ion karboksilat. Stabilisasi basa konjugasi meningkatkan konstanta kesetimbangan. Disosiasi asam dari etanol dan asam asetat menghasilkan basa konjugasi yang memiliki muatan negatif pada atom oksigen. Masing-masing atom oksigen pada ion asetat memiliki satu setengah muatan negatif, dimana pada ion etoksida, muatan negatif dipusatkan pada satu atom oksigen. Asam asetat jauh lebih asam daripada etanol karena ion asetat beresonansi dengan stabil.
R C O O R C O O Resonansi ion karboksilat
Keasaman asam karboksilat juga bagian dari efek induktif. Bahwa gugus karbonil mempolarisasi ikatan O-H dengan menyerang elektron melalui ikatan sigma. Densitas elektron dari ikatan O-H melemahkannya dan kemudian meningkatkan keasaman dari ionisasi atom hidrogen (Quelette, R. J. 1994).
Salah satu asam karboksilat yang banyak terdapat dalam minyak kelapa sawit adalah asam oleat. Rata-rata komposisi asam lemak minyak kelapa sawit dapat dilihat dari tabel berikut:
Asam Lemak Minyak Kelapa Sawit (%)
Minyak Inti Sawit (%) Asam Kaprilat - 3 – 4 Asam Kaproat - 3 – 7 Asam Laurat - 46 – 52 Asam Miristat 1,1 - 2,5 14 – 17 Asam Palmitat 40 – 46 6,5 – 9 Asam Stearat 3,6 - 4,7 1 - 2,5 Asam Oleat 39 – 45 13 – 19 Asam Linolenat 7 – 11 0,5 – 2
Tabel Komposisi asam lemak minyak kelapa sawit (Ketaren, S. 1986).
2.3.1. Pembuatan Asam Karboksilat
Beberapa asam karboksilat dapat dibuat deangan metode berikut ini: a. Oksidasi alkohol primer dan alkil benzena.
b. Adisi karbon dioksida pada pereaksi Grignard. c. Hidrolisis nitril.
Okdidasi Akohol Primer dan Alkil Benzena
Oksidasi alkohol akan melibatkan satu atau lebih atom hidrogen (hidrogen-α) dari karbon yang mengikat gugus hidroksil. Produk yang dihasilkan bergantung dari adanya atom hidrogen-α, sehingga membentuk alkohol primer, sekunder, atau tersier.
R-CH2-OH R-COOH
KMnO4
Adisi Karbon dioksida Pada Pereaksi Grignard
Pada reaksi sintesis asam karboksilat dengan menggunakan pereaksi Grignard, gas CO2 dialirkan kedalam larutan eter berisi pereaksi Grignard dan es kering (CO2 padat) yang sekaligus berfungsi sebagai pendingin reaksi.
R-X Mg R-MgX CO2 R-COOMgX H R-COOH +
R = Alkil atau Aril
+ MgX
Hidrolisis Nitril
Asam karboksilat dapat dibuat dari nitril dengan mereaksikannya dengan larutan asam atau basa panas. Nitril mudah dibuat dengan melalui reaksi SN2 dari primer dan sekunder alkil halida dengan CN-, kemudian menghidrolisis nitril menjadi asam karboksilat dari alkil halida (McMurry, J. 1998).
RCH2-Br Na +CN -SN2
RCH2-CN H3O RCH2-COOH + NH3 +
2.4 Oksidasi Asam Lemak
Asam lemak dapat dioksidasi dengan menggunakan beberapa jenis oksidator, seperti asam nitrat, KMnO4, asam kromat, ozon, dan senyawa peroksida. Oksidasi asam lemak jenuh oleh KMnO4, hasilnya bergantung pada kondisi reaksi yang berlangsung. Asam oleat dalam larutan alkali dingin akan teroksidasi dengan cepat oleh larutan permanganat, sehingga menghasilkan asam dihidroksi stearat.
H3C-(CH2)7-CH=CH-(CH2)7-COOH H3C-(CH2)7-CH-CH-(CH2)7-COOH
HO OH
On
H2O
Serbuk KMnO4 yang didihkan dengan aseton akan memutuskan rantai karbon pada ikatan rangkap, dengan menghasilkan asam (Ketaren, S. 1986).
Asam oleat adalah asam lemak tidak jenuh rantai panjang yang memiliki beberapa pusat aktif, seperti ikatan π dan gugus karboksilat (-COOH) sehingga dapat mengalami beberapa reaksi kimia untuk ditransformasikan menjadi turunannya. Asam oleat dapat dioksidasi menjadi asam azelat dan asam pelargonat sebagai hasil samping (Kadesch, R.G. 1979).
H3C-(CH2)7-CH=CH-(CH2)7-COOH H3C-(CH2)7-CH-C-(CH2)7-COOH
HO O
H3C-(CH2)7-CH-C-(CH2)7-COOH
HO O
H3C-(CH2)7-COOH +HOOC-(CH2)7-COOH O
Asam Pelargonat Asam Azelat
2.4.1 Asam Pelargonat
Asam pelargonat (asam nonanoat), dengan rumus molekul CH3-(CH2)7-COOH, ditemukan dalam asam oleat yang berbau tengik, mentega dan beberapa hasil alam yang mengandung asam lemak berantai panjang. Bau tengik yang terjadi kemungkinan berasal dari pemutusan ikatan rangkap asam lemak jenuh.
Asam pelargonat berbentuk cairan pada suhu kamar dengan titik lebur 120C-130C. Memiliki titih didih 2540C pada 760mmHg. Senyawa ini memiliki bau yang khas. Tidak larut dalam air, larut dalam pelarut-pelarut organik seperti eter dan alkohol. Kegunaan asam pelargonat adalah sebagai bahan pelumas dan bahan kosmetik (Lorier, S. E. T. 1998).
2.5 Amida
Amida adalah turunan ammonia atau amina dari asam organik. Senyawanya mungkin sederhana, bersubstituen satu atau dua, misalnya:
R C OH O Asam karboksilat R C NH2 O Amida sederhana R C NH O
Amida bersubstituen satu R
R C N
O
Amida bersubstituen dua R
Keelektronegatifan oksigen dalam ikatan amida menarik pasangan elektron bebas pada nitrogen amida ke arah oksigen. Karena elektron demikian itu tak tersedia untuk menerima proton, maka nitrogen amida sangat kurang sifat basanya dibanding nitrogen amina. Amida biasanya tidak menerima proton dalam larutan asam. Tetapi amida berikatan hidrogen dengan sesamanya dan dengan air:
R-C-N H H O O C-N H H R
Ikatan hidrogen pada amida
R-C-N H H O O H H
Ikatan hidrogen dengan air
(Willbraham, A.C dan Michael, S.M. 1992)
Seperti asam karboksilat, amida memiliki titik cair dan titik didih yang tinggi karena adanya ikatan hidrogen. Senyawa ini juga sangat istemewa karena nitrogennya mampu melepaskan elektron dan mampu membentuk sebuah ikatan π dengan karbonil (Bresnick, S.M.D. 1996)
2.5.1 Pembuatan Senyawa Amida
Senyawa amida dapat disintesis melalui beberapa cara antara lain :
a. Reaksi antara asam dengan amoniak yang menghasilkan garam ammonium yang kemudian didehidrasi melalui pemanasan atau destilasi.
+ H2O
CH3CO2NH4 CH
3CONH2 H2O
CH3COOH + NH3
Senyawa asetamida dapat diperoleh dengan destilasi fraksinasi ammonium asetat. Asam asetat biasanya ditambahkan sebelum pemanasan untuk menekan hidrolisis ammonium asetat. Asam asetat dan air dapat dihilangkan dengan cara destilasi lambat.
b. Pemanasan asam dengan urea.
CH3COOH + NH2CONH2 CH3CONH2 + CO2 + NH3
Reaksi ini terjadi pada 120 oC, asam karbamat yang terbentuk terdekomposisi menjadi karbondioksida dan ammoniak. Garam ammonium juga bereaksi dengan urea pada temperatur di atas 120 oC yang akan menghasilkan amida.
c. Reaksi antara ammoniak pekat dengan ester
Proses ini disebut dengan ammonolisis ester. Jika amida yang terbentuk larut dalam air, maka dapat diisolasi secara destilasi. Contohnya
CH3COOC2H5 + NH3 CH3CONH2 + C2H5OH
d. Hidrolisis dari senyawa nitril
Senyawa nitril dilarutkan dalam natrium hidroksida dengan konsentrasi 30 – 40% pada suhu 40oC selama beberapa jam ( Vogel, A.I. 1989 ).
C N H2O + C O H2N OH
Selain dari keempat cara diatas, senyawa amida dapat juga diperoleh dengan mereaksikan asam karboksilat dengan ammoniak encer sehingga terbentuk garam ammonium yang kemudian dipanaskan sampai terjadi dehidrasi untuk menghasilkan amida ( Solomon, T.W. dan Fryhle, B.C. 1994 ).
2.5.2 Kegunaan Senyawa Amida
Beberapa kegunaan senyawa amida berdasarkan kelarutan dan titik lebur daripada amida asam lemak adalah, oktadekanamida dan dokosenamida sebagai zat aditif antislip dan antiblok pada film polietilena. Senyawa amida jenuh rantai panjang
dipakai sebagai intermediet dalam produksi tekstil tahan air tipe Zelan atau Velan. Amida asam lemak dapat ditambahkan dalam bahan pembungkus makanan dengan peraturan FDA, memperbaiki sifat – sifat dari tinta yaitu membantu slip, mengurangi block dan tack, menambah sifat – sifat mekanik dari karet.
Kemampuan amida asam lemak dalam pelarut hidrokarbon untuk melekat pada permukaan logam sehingga sangat baik dipakai sebagai bahan aditif pada pelumas. Amida asam lemak dapat meningkatkan karakteristik pemakaian pelumas (lubricant) dan tanpa meninggalkan karbon yang terdeposit pada permukaan logam, sebagai surfaktan dalam bentuk detergen cair.( Reck, R. A. 1985).
Amida sederhana dapat juga diubah menjadi amida bersubstituen satu dan bersubstituen dua. Misalnya pelargonamida dapat diubah menjadi vanilly pelargonamida yang digunakan sebagai biodegradable pesticide, dan tertiary diamides seperti N,N' -2,2,5,5-tetramethylhexamethylene-N,N'-dimethylpelargonamide
yang digunakan sebagai cairan penghantar panas dan pemlastis.
O NH O OH vanilly pelargonamide R-C-N-CH2-C-(CH2)n-C-CH2-N-C-R O O CH3 CH3 CH3 CH3 CH3 CH3 N,N' -2,2,5,5-tetramethylhexamethylene-N,N'-dimethylpelargonamide Dimana: n = 0-10 R= -(CH2)7-CH3 (Thompson, R. M. 1975; Veech, R. L. 1997).
2.6. Katalis
Katalis adalah suatu zat yang meningkatkan kecepatan reaksi untuk mencapai kesetimbangan pada reaksi kimia tetapi tidak habis bereaksi. Peranan katalis adalah menurunkan energi bebas pengaktifan. Katalis membentuk interaksi dengan pereaksi untuk mencapai suatu kompleks teraktifkan (Cotton, F. A. dan Wilkinson, G. 1989).
Katalis dibagi menjadi dua yaitu katalis homogen dan katalis heterogen. Katalis homogen adalah katalis yang sefasa dengan pereaksi dalam reaksi yang dikatalisisnya. Sedangkan katalis heterogen adalah katalis yang ada dalam fase yang berbeda dengan pereaksi dalam reaksi yang dikatalisisnya (Syukri, S. 1999).
2.6.1 Katalis Homogen
Cara kerja katalis homogen umumnya melibatkan pembentukan senyawa-senyawa
komples antara yang bersifat tidak stabil dalam tahap-tahap reaksi. Katalis dengan reaktan membentuk kompleks antara yang mengakibatkan reaktan dalam kompleks menjadi aktif membentuk produk baru dengan disertai pelepasan kembali katalisatornya. Oleh karena itu, unsur-unsur transisi sangat berperan dalam reaksi katalitik karena sifatnya mudah membentuk senyawa kompleks, misalnya pada banyak reaksi organik dipakai Pd(II) dan Pt(II) (Sugiyarto, K.H. 2003).
Keuntungan dari katalisis homogen bila dibandingkan dengan katalisis heterogen, katalis homogen mudah dikarakterisasi, misalnya secara spektroskopi. Mekanisme reaksi dapat dibuat untuk memprediksi reaksi. Selain itu, katalis mudah terdispersi secara efektif sehingga semua molekul katalis dapat berinteraksi dengan reaktan. Kerugian dari katalis homogen, sulit memisahkan katalis dari produk dan biaya yang mahal. Selain itu dapat terjadi korosi dan hilangnya katalis pada perolehan kembali katalis ( Gates, B.C, dkk 1979 ).
2.6.2 Katalis Heterogen
Katalisator heterogen dalam bentuk padatan banyak dipakai dalam bidang industri untuk reaksi-reaksi fase gas yang biasanya berlangsung pada temperatur relatif tinggi. Karena logam-logam transisi mempunyai titik leleh yang sangat tinggi dan kuat, maka dapat memenuhi sebagai katalisator.
Salah satu keuntungan pemakaian katalis heterogen yaitu bahwa produk reaksi berlangsung terpisah dari fase katalisnya, hingga tidak memerlukan tahap pemisahan khusus. Biasanya, reaktan dilewatkan pada lorong katalis melalui satu ujung dan keluar menjadi produk pada ujung lain. Katalisator padatan ini dapat berupa logam murni, paduan maupun senyawa oksidanya. Fase padat dimaksudkan memberikan bentuk pori-pori yang sesuai selain permukaan yang luas untuk media terjadinya reaksi secara efektif (Sugiyarto, K. H. 2003).
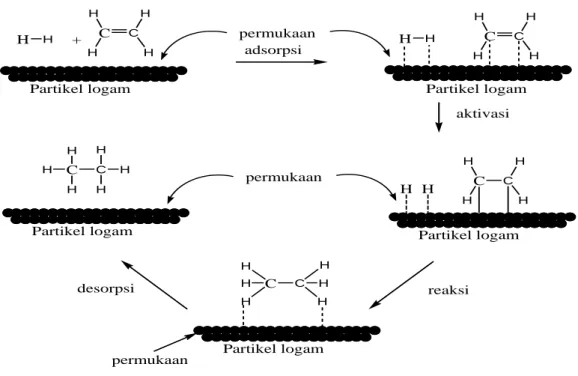
2.6.2.1 Proses Katalisis Heterogen
Proses katalisis heterogen sedikitnya dapat melalui empat tahap : a. Adsorpsi reaktan pada permukaan katalis,
b. Aktifasi penyerapan reaktan, c. Reaksi reaktan yang terserap, dan
H H + C C H H H H adsorpsi permukaan H H C C H H H H
Partikel logam Partikel logam
Partikel logam Partikel logam
Partikel logam C C H H H H H H aktivasi H H C C H H H H permukaan C C H H H H H H reaksi desorpsi permukaan C2H4 + H2 C2H6
Gambar 2.1 Reaksi katalitik H2 dan C2H4 pada permukaan logam.
Keterangan gambar : Reaksi :
Kedua molekul diadsorpsi oleh gaya tarik yang lemah. Aktivasi berlangsung ketika elektron – elektron yang terikat pada molekul tertata ulang untuk membentuk ikatan dengan atom – atom logam. Kelanjutan reaksi dari aktivasi atom, molekul – molekul C2H6 yang teradsorbsi lemah akan melepaskan diri dari permukaan
( Holtzclaw, F.H. dan Robinson, W.R. 1988 ).
2.7 Logam Transisi Sebagai Katalis
Unsur transisi sering didefenisikan sebagai kelompok unsur yang mempunyai kulit-kulit d dan f yang terisi sebagian. Namun untuk maksud yang praktis akan dipandang sebagai unsur transisi adalah unsur yang memiliki kulit-kulit d dan f yang terisi sebagian juga dalam senyawaan penting yang manapun. Unsur transisi semuanya adalah logam, kebanyakan berupa logam keras yang menghantar panas dan listrik yang baik. Mereka membentuk banyak senyawaan berwarna dan parmagnetik, karena kulit-kulitnya yang terisi sebagian (Cotton, F.A. dan Wilkinson, G. 1989).
Ion-ion logam transisi lebih kecil ukurannya daripada ion-ion logam kelompok
s dalam periode yang sama. Hal ini menghasilkan rasio muatan perjari-jari yang lebih besar bagi logam-logam transisi. Atas dasar ini relatif terhadap logam kelompok s
diperoleh sifat-sifat logam transisi sebagai berikut:
• Oksidasi-oksidasi dan hidroksida logam-logam transisi (M2+, M3+) kurang bersifat basa dan lebih sukar larut.
• Garam-garam logam transisi kurang bersifat ionik dan juga kurang stabil terhadap pemanasan.
• Garam-garam dan ion-ion loga transisi dalam air lebih mudah terhidrat dan juga lebih mudah terhidrolisis menghasilkan sifat sedikit asam. • Ion-ion logam transisi lebih mudah tereduksi (Sugiyarto,K. H. 2003). Salah satu kegunaan yang penting dari unsur – unsur transisi dalam reaksi katalitik adalah untuk mengatomisasi molekul – molekul diatomik dan menyalurkan atom – atom tersebut pada reaktan yang lain dan reaksi intermediet. Gas H2, O2, N2 dan CO adalah molekul diatomik yang penting. Kekuatan ikatan H, O, N dan C pada permukaan logam – logam transisi memberikan gaya dorong termodinamik untuk atomisasi dan juga untuk pelepasan atom dalam reaksi dengan molekul – molekul yang lain. Permukaan logam juga memiliki sifat – sifat yang unik lainnya yang dapat mengkatalisis serangkaian reaksi kompleks yang dimulai dengan disosiasi adsorpsi yang diikuti dengan penataan ulang kompleks melalui formasi dan pemutusan ikatan, yang terakhir proses adsorpsi dari produk ( Hegedus, L.L. 1987 ).