BAB I BAB I
PENDAHULUAN PENDAHULUAN
1.
1.11 LALATATAR BER BELALAKAKANGNG
Kalium Nitrat adalah suatu senyawa garam nitrat dari kalium dengan rumus Kalium Nitrat adalah suatu senyawa garam nitrat dari kalium dengan rumus molekul KNO
molekul KNO33. Garam . Garam kalium nitrat dapat dibuat dengan cara kalium nitrat dapat dibuat dengan cara mereakmereaksikan kaliumsikan kalium
klorida, KCl yang ditemukan dalam mineral silvi, dengan natrium nitrat NaNO klorida, KCl yang ditemukan dalam mineral silvi, dengan natrium nitrat NaNO33..
Jikalau larutan jenuh masing-masing reaksi tersebut saling dicampurkan, maka akan Jikalau larutan jenuh masing-masing reaksi tersebut saling dicampurkan, maka akan terbentuk garam natrium klorida, NaCl dan KNO
terbentuk garam natrium klorida, NaCl dan KNO33 karena larutan NaCl di dalamkarena larutan NaCl di dalam
pelarut air sangat kecil, maka garam tersebut akan mengalami pengendapan, dan pelarut air sangat kecil, maka garam tersebut akan mengalami pengendapan, dan
me
melallalui ui pepenynyariaringngan an lalarutrutan an KNKNOO33 dapadapat t didipipisasahkhkan an dadari ri NaNaClCl. . DeDengnganan
mendinginkan filtrat tersebut secara perlahan, maka KNO
mendinginkan filtrat tersebut secara perlahan, maka KNO33(aq) akan mengalami(aq) akan mengalami
proses kristalisasi, dan untuk memenuhi KNO
proses kristalisasi, dan untuk memenuhi KNO33yang dihasilkan perlu kristalisas.yang dihasilkan perlu kristalisas.
Ban
Banyak yak seksekali ali reakreaksi si yang yang digdigunakunakan an daladalam m analanalisis isis anoanorgarganik nik analanalisisisis ku
kualalititatatif if memelilibabatktkan an pepembmbenentutukkkkan an enendadapapan. n. EnEndadapapan n adadalalah ah zazat t yyanangg memisahkan diri sebagai suatu fase padat keluar dari larutan. Endapan mengkin memisahkan diri sebagai suatu fase padat keluar dari larutan. Endapan mengkin berupa kristal (kristalin) atau koloid, dan dapat dikeluarkan dari larutan dengan berupa kristal (kristalin) atau koloid, dan dapat dikeluarkan dari larutan dengan penyar
penyaringan atau ingan atau pemupemusingan (centrifuge). Endapan terbentuk jika singan (centrifuge). Endapan terbentuk jika larutan menjadilarutan menjadi terlalu jenuh dengan zat yang bersangkutan. Kelarutan bergantung pada berbagai terlalu jenuh dengan zat yang bersangkutan. Kelarutan bergantung pada berbagai kond
kondisi, seperti isi, seperti suhu, tekanansuhu, tekanan, , konsekonsentrasi bahan-bahantrasi bahan-bahan n lain dalam lain dalam larutan itu, larutan itu, dandan pada komposisi pelarutnya.
pada komposisi pelarutnya.
Semua nitrat larut dalam air. Nitrat dari merkurium dan bismut menghasilkan Semua nitrat larut dalam air. Nitrat dari merkurium dan bismut menghasilkan garam basa setelah diolah dengan air garam-garam ini larut dalam asam nitrit encer. garam basa setelah diolah dengan air garam-garam ini larut dalam asam nitrit encer. Reaksi ini dapat dipelajari dengan larutan kalium nitrat, KNO
Reaksi ini dapat dipelajari dengan larutan kalium nitrat, KNO33..
1.2
1.2 RUMUSAN MASALAHRUMUSAN MASALAH
Berdasarkan uraian tersebut permasalahan dalam praktikum ini adalah : Berdasarkan uraian tersebut permasalahan dalam praktikum ini adalah : 1.
1. BagaimBagaimana prinsana prinsip dasar peip dasar pembuatmbuatan Kalium an Kalium Nitrat (KNNitrat (KNOO33) ) ??
2.
2. BagaimBagaimana cara memisahkana cara memisahkan 4 garam berdasan 4 garam berdasarkan kelaruarkan kelarutannya pada sutannya pada suhuhu tertentu ?
tertentu ? 1
Penulisan makalah ini bertujuan untuk :
1. Memisahkan 4 garam berdasarkan kelarutannya pada suhu tertentu. 2. Membuat kalium nitrat.
1.4 MANFAAT
Memberikan pengetahuan kepada pembaca tentang prinsip dasar pembuatan kalium nitrat serta cara memisahkan 4 garam berdasarkan kelarutannya pada suhu tertentu.
KAJIAN PUSTAKA
A. Pengenalan Kalium Nitrat
Garam nitrat terdapat di Chili terutama dalam bentuk natrium nitrat. Natrium nitrat bersifat higroskopis. Oleh karena itu, untuk berbagai keperluan natrium nitrat yang lebih murah itu diubah menjadi garam kalium. Kalium nitrat dapat dibuat dari KCl yang terdapat dalam mineral silvit dan NaNO3. Jika larutan
jenuh dari masing-masing pereaksi dicampur, NaCl yang kurang melarut akan mengendap, sesuai persamaan reaksi:
KCl (aq) + NaNO3(aq) → NaCl (s) + KNO3(aq)
Jika cairan didinginkan, maka KNO3 akan mengendap. Endapan ini
dipisahkan kemudian dimurnikan dengan cara rekristalisasi. Nama umum untuk KNO3 adalah sendawa, sedangkan untuk NaNO3 disebut sendawa Chili. Kalium
nitrat mengkristal dalam bentuk prisma rombik, tetapi jika larutannya diuapkan maka perlahan-lahan pada kaca arloji akan mengkristal dalam bentuk rombohedral isomorf dengan natrium nitrat dan kalsit. KNO3 meleleh pada 336oC dan pada suhu
tinggi menghasilkan oksigen, seperti pada persamaan: 2KNO3→ 2KNO2+ O2
Leburan garam ini adalah oksidator kuat. Belerang, arang, dan posfor dapat terbakar dalam leburan ini menghasilkan kalium nitrat, karbonat, dan posfat.
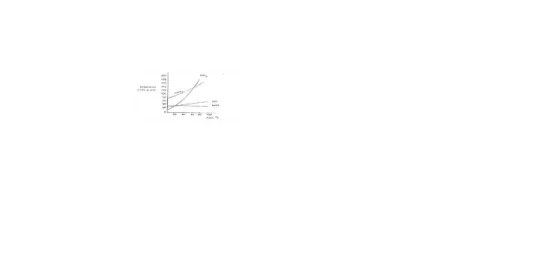
Diagram kelarutan dan suhu untuk garam NaCl, KCl, NaNO3, dan KNO3.
(Mahdian dan Parham saadi, 2011)
Banyak sekali reaksi yang digunakan dalam analisis anorganik analisis kualitatif melibatkan pembentukkan endapan. Endapan adalah zat yang
memisahkan diri sebagai suatu fase padat keluar dari larutan. Endapan mengkin berupa kristal (kristalin) atau koloid, dan dapat dikeluarkan dari larutan dengan penyaringan atau pemusingan (centrifuge). Endapan terbentuk jika larutan menjadi terlalu jenuh dengan zat yang bersangkutan. Kelarutan bergantung pada berbagai kondisi, seperti suhu, tekanan, konsentrasi bahan-bahan lain dalam larutan itu, dan pada komposisi pelarutnya (Vogel, 1979).
Semua nitrat larut dalam air. Nitrat dari merkurium dan bismut menghasilkan garam basa setelah diolah dengan air garam-garam ini larut dalam asam nitrit encer. Reaksi ini dapat dipelajari dengan larutan kalium nitrat, KNO3
(Vogel, 1979).
Kalium nitrat merupakan sumber alami mineral nitrogen. Senyawa ini tergolong senyawa nitrat dengan rumus kimia KNO3. kalium nitrat Merupakan komponen bubuk hitam teroksidasi (disuplai oksigen). Sebelum fiksasi industri nitrogen skala besar (proses Haber), sumber utama Kalium nitrat ialah deposit yang mengkristalisasikan dari dinding gua atau mengalirkan bahan organik yang membusuk. Tumpukan kotoran juga sumber umum yang utama: amonia dari dekomposisi urea dan zat nitrogen lainnya akan melalui oksidasi bakteri untuk memproduksi nitrat (Anonim, 2011).
B. Sifat Kalium Nitrat
Beberapa sifat fisik dari kalium nitrat (KNO3) antara lain:
Bobot senyawa : 101,11 sma Titik lebur: 607 K
Titik didih: terdekomposisi pada suhu 673 K Densitas : 2,1 x 103kg/m3
Struktur kimia : aragonite
Kelarutan : 38 g dalam 100 g air
Wujud : padatan putih atau abu-abu kotor
Sedangkan untuk sifat termokimia dari kalium nitrat (KNO3) adalah:
Δf Hopadat : -495 kJ/mol
C. Pengunaan Kalium Nitrat
Salah satu penerapan yang paling berguna dari kalium nitrat ialah dalam produksi asam sendawa, dengan menambahkan asam sulfat yang terkonsentrasi pada larutan encer kalium nitrat, menghasilkan asam sendawa dan kalium sulfat yang terpisah melalui distilasi fraksional. Kalium nitrat juga digunakan sebagai pupuk, sebagai model bahan pembakar rocket, dan dalam beberapa petasan seperti bom asap. Dalam proses pengawetan makanan, kalium nitrat merupakan komposisi umum untuk pengasinan daging.. Kalium Nitrat juga digunakan dalam produksi pasta gigi untuk gigi sensitif. (Mutaqqin, 2009)
BAB III
3.1 METODE
Metode yang digunakan dalam percobaan ini adalah metode eksperimen dan dianalisis menggunakan metode deskriptif kuantitatif.
3.2 ALAT DAN BAHAN Alat yang digunakan :
1. Gelas kimia 200 mL : 1 buah 2. Gelas kimia 250 mL : 1 buah 3. Corong biasa : 1 buah 4. Termometer : 1 buah 5. Batang pengaduk : 2 buah 6. Neraca analitik : 1 buah 7. Gelas ukur 50 mL : 1 buah 8. Hotplate : 1 buah 9. Pipet tetes : 1 buah 10. Baskom : 1 buah 11. Spatula : 1 buah 12. Kaca arloji : 1 buah Bahan yang digunakan
1. Kalium klorida 2. Natrium nitrat 3. Aquades 4. Kertas saring
3.3 PROSEDUR KERJA
1. Melarutkan 15 g KCl dalam 50 mL air panas 2. Melarutkan 17 g NaNO3dalam 50 mL air panas
4. Menguapkan larutan sampai volume larutan menjadi 25 mL (pada umumnya larutan mendidih secara tidak teratur, oleh karena itu menggunakan penangas air)
5. Segera menyaring larutan ketika sedang panas-panas 6. Mendinginkan larutan hingga kalium nitrat mengkristal 7. Menyaring kristal dan mengeringkan kristal
BAB IV
HASIL DAN PEMBAHASAN
4.1 DATA PENGAMATAN
No Variabel yang diamati Hasil pengamatan 1. 15 g KCl + 50 mL air panas
bersuhu 80°C
KCl melarut dan larutan bening 2. 17 g NaNO3 + 50 mL air panas
bersuhu 80°C
NaNO3 melarut dan larutan
bening 3. Larutan KCl + larutan NaNO3
- Menguapkan
- Menyaring sewaktu panas - Mendinginkan filtrat
selama 3 jam
Larutan bening
- Larutan panas, volume larutan 25 mL
- Fitrat
- Terbentuk Kristal didasar gelas kimia
4. Menyaring Kristal basah
5. Mengeringkan Kristal kering
6. Berat Kristal yang diperoleh 1,5309 gram
4.2 PEMBAHASAN
Percobaan kali ini menggunakan prinsip pemisahan empat garam berdasarkan perbedaan kelarutannya pada suhu tertentu, serta dapat terbentuknya
kristal KNO3pada suhu rendah
Mula- mula sebanyak 15 gram KCl dilarutkan dalam 50 mL air panas dengan suhu 80°C. Dalam larutan air, KCl yang merupakan garam yang berasal dari asam kuat dan basa kuat tidak mengalami hidrolisis. KCl tidak bereaksi dengan air, dalam larutan air KCl hanya akan terurai menjadi kation dan anionnya. Proses pelarutan atau ionisasi yang terjadi:
-O H Cl K KCl → 2 + +
Selanjutnya, pada saat yang bersamaan sebanyak 17 gram NaNO3dilarutkan
dalam 50 mL air bersuhu 80°C pada gelas kimia yang berbeda. NaNO3 merupakan
garam yang berasal dari asam kuat dan basa kuat sehingga tidak mengalami hidrolisis. Proses pelarutan atau ionisasi yang terjadi:
-3 O H 3 Na NO NaNO → 2 + +
Suhu air yang digunakan sebesar 80o C karena berdasarkan diagram
kelarutan dan suhu baik KCl maupun KNO3 kelarutannya akan semakin bertambah
jika suhu dinaikkan. Hal ini terlihat dengan jelas pada grafik kelarutan dan suhu untuk garam NaCl, KCl, NaNO3, dan KNO3.
Tahap berikutnya larutan KCl dan larutan NaNO3 dicampurkan. Dari
pencampuran ini akan menghasilkan KNO3 dan NaCl dengan persamaan reaksi
sebagai berikut :
KCl (aq) + NaNO3(aq) NaCl (s) + KNO3(aq)
Untuk mendapatkan KNO3 perlu dilakukan penguapan sehingga konsentrasi
KNO3 semakin besar dan air semakin berkurang. Penguapan dilakukan sampai
volume larutan 25 mL. Berdasarkan grafik kelarutan di atas NaCl akan mengendap terlebih dahulu jika dipanaskan karena kelarutan NaCl akan semakin berkurang seiring dengan kenaikan suhu. Sedangkan KNO3 kelarutannya akan semakin
Selanjutnya dilakukan penyaringan selagi panas, penyaringan bertujuan untuk memisahkan garam NaCl dan KNO3. Penyaringan harus dilakukan selagi
panas agar KNO3 masih berwujud larutan (tidak turut mengendap). Hasil yang
didapatkan berupa filtrat yang merupakan larutan KNO3dan residunya berupa NaCl
yang berwujud padat.
Setelah dilakukan penyaringan, filtrat didiamkan selama 1 malam tujuannya mengendapkan KNO3 dan agar pembentukan kristal lebih sempurna yaitu kristal
seperti jarum ( prisma rombik ).
Untuk mengeringkan garam KNO3 dari air, maka dilakukan penyaringan
dengan corong Buchner. Dan kristal KNO3yang dihasilkan berupa kristal berwarna
putih bersih dengan butiran yang halus dengan berat sebesar7,5721 gram.
Dari perhitungan yang telah dilakukan ( terlampir ), dapat diketahui rendemen pembuatan KNO3 pada percobaan ini adalah sebesar 37,4 %.
Kemungkinan kecilnya nilai rendemen disebabkan penyaringan tidak dilakukan selagi panas sehingga banyak KNO3 yang turut mengendap bersama NaCl sehingga
ikut tersaring dan terbuang. Kristal KNO3yang dihasilkan pada percobaan berwarna
putih bersih, memiliki butiran-butiran yang kecil.
PENUTUP 5.1 KESIMPULAN
Dari percobaan diatas dapat ditarik kesimpulan sebagai berikut:
1 Prinsip dasar pembuatan Kalium Nitrat adalah pemisahan empat garam yang terbentuk dari pencampuran larutan KCl dan NaNO3 dengan perbedaan
kelarutan garam dalam air pada suhu tertentu.
2 Kristal KNO3 yang dihasilkan berwarna putih bersih dengan butiran-butiran
yang kecil (seperti serbuk).
3 Kristal KNO3 yang diperoleh dari percobaan sebesar 7,5721 gram dengan
persentase rendemennya 37,44%. .
5.2 SARAN
Berdasarkan hasil percobaan dan praktikum yang telah dilakukan, maka saran-saran yang dapat kami berikan yaitu :
1. Dalam melakukan praktikum hendaknya kita benar-benar memperhatikan prosedur kerja sehingga tidak menyebabkan kesalahan dalam percobaan, 2. Kehati-hatian dan ketelitian sangat diperlukan dalam percobaan ini.
Misalnya pada suhu di saat pemanasan
3. Penyaringan harus dilakukan selagi larutan masih panas
Anonim. 2011. Kalium Nitrat . (online) http://id.wikipedia.org/wiki/Kalium_nitrat . Diakses tanggal 4 juni 2011.
Mutaqqin. 2009. Manfaat Kalium Nitrat. (online) http://muttaqinhasyim.wordpress.com. Diakses tanggal 4 juni 2011.
Nitriatmojo, Maksum. 1991. Mengkaji Kimia Anorganik buku 1. IKIP. Malang.
Soeharto. 1994. Pengantar Kimia Anorganik. Bandung : ITB
Vogel. 1979. Analisis Anorganik Kualitatif Makro dan Semimikro Bagian II. Jakarta: PT Kalman Media Pustaka.
PERHITUNGAN
I. Perhitungan Rendemen
Berat KNO3secara teori dapat dihitung seperti berikut.
KCl (aq) + NaNO3(aq) NaCl (s) + KNO3(aq)
Berat KNO3yang diperoleh dari percobaan = 7,5721 gram
Berat KCl = 15 gram Berat NaNO3= 17 gram
Mr KNO3= 101,11 gram/mol Mr NaNO3= 85 gram/mol Mr KCl = 74,5 gram/mol 15 gram mol KCl = = 0,2 mol 74,5 gram/mol 17 gram
mol NaNO3 = =0,2mol
85 gram/mol
KCl(aq) + NaNO3(aq) NaCl(s) + KNO3(aq)
molawal 0,2 0,2 -
-molreaksi 0,2 0,2 0,2 0,2
molakhir - - 0,2 0,2
mol KNO3= 0,2 mol
Berat KNO3 = mol KNO3x Mr KNO3
= 0,2 mol x 101,11 gram/mol = 20,222 gram
berat KNO3yang diperoleh
% rendemen = x 100%
berat KNO3teoritis
7,5721 gram
= x100%
20,222 gram = 37,44 %
II. Jawaban Pertanyaan
Dari kurva pada suhu 20oC gram KNO3 menunjukkan + 30 gram KNO3
dalam 100 gram air.
Massa
mol =
Mr 30 gram
mol KNO3 = = 0,297 mol
101 gram/mol
100 gram
mol air = = 5,556 mol
18 gram/mol
mol total = mol KNO3+ mol air
= 0,297 mol + 5,556 mol = 5,853 mol
mol KNO3 0,297 mol
X KNO3 = = = + 0,051
mol total 5,853 mol
1. Jadi pada suhu 20oC fraksi mol KNO
3 adalah + 0,051 mol air adalah 100.000
g/18g/mol = 5555,56 mol mol air X air =
karena X KNO3= 0,051 maka X air = 1 – 0,051 = 0,949
5555,56 mol
0,949 =
(5555,56 mol + mol KNO3)
5272,23 mol + 0,949 mol KNO3 = 5555,56
283,33
mol KNO3 = = 298,56 mol
0,949 Berat KNO3 = mol KNO3x Mr KNO3
= 298,56 mol x 101,11 g/mol = 30187,4 gram
= 30,1874 Kg
Jadi berat KNO3 yang melarut dalam 100 L atau 100 Kg air pada suhu 20oC
adalah 30,1874 Kg.
2. Jika 50 gram Kalium Nitrat, 100 gram air didinginkan dari 40oC menjadi 20oC
Dari kurva kelarutan KNO3 dalam air pada suhu 40oC, fraksi mol KNO3 adalah
0,11 didapatkan dari perhitungan pada saat 40oC gram KNO
3= 70 gram.
Maka :
70 gram
mol KNO3 = = 0,692mol
101,11 gram/mol
mol air = 5,556 mol
mol total = (5,556 mol + 0,692 mol) = 6,248 mol
0,692 mol
mol air + mol KNO3
X air = (1 – 0,11) = 0,89
mol air Untuk X air =
Mol air + mol KNO3
5,556 mol =
5,556 mol + mol KNO3
4,945 mol + 0,89 mol KNO3 = 5,556
0,611 mol mol KNO3 =
0,89 mol
= 0,687 mol
Berat KNO3 = n x Mr KNO3
= 0,6897 mol x 101,11 g/mol = 69,46 gram
Dengan perhitungan yang sama diperoleh berat KNO3 yang larut dalam 100
gram air pada suhu 20oC adalah 29,8 gram berarti dengan mendinginkan campuran
dari 40oC menjadi 20oC dapat menurunkan kelarutan KNO
3 dari 69,46 gram/100
gram air menjadi 29,8 gram/100gram air.
Pada soal disebutkan bahwa hanya 50 gram KNO3 yang dilarutkan dalam 100
gram air suhu 40oC, sedangkan pada suhu ini kelarutan KNO
3 adalah 69,46
gram/100 gram air, berarti semua massa KNO3 larut (50 gr KNO3 semuanya larut)
sedangkan pada suhu 20oC (setelah didinginkan) kelarutannya 29,8 gram/100 gram
air. Sisinya yaitu 50 gram – 29,8 gram = 20,2 gram KNO3 yang akan mengendap
Pada suhu 20oC KNO
3 lebih sedikit melarut dan dapat mengendap lebih