LAPORAN PRAKTIKUM BIOKIMIA ISOLASI PROTEIN
Disusun oleh : Kelompok 1
Junaida Afifa, 0906487852 Aditya Noor Dwiprakoso, 1006658101
Ahdinar Rosdiana Dewi, 1006658120 Alfiani Mar’atussalehah, 1006658133
Alvin Bramantyo, 1006658146 Ervandy Rangganata, 1006658266
Fachrul Tamrin, 1006658272 Faizah Khusnayain Wijayanti, 1006658285
Fauzan Hertrisno Firman, 1006658291 Grasella Angelika Putri, 1006658303
M. Ikhsan R. H., 0806451441
FAKULTAS KEDOKTERAN UNIVERSITAS INDONESIA Jakarta/2010-2011
PENDAHULUAN
Protein adalah molekul organik terbanyak yang terdapat dalam sel. Fungsi protein antara lain memicu kontraksi dalam melakukan gerak dan memicu terjadinya berbagai proses metabolisme dalam bentuk enzim. Protein dapat pula berperan membawa informasi dari luar ke dalam sel dan di dalam bagian-bagian sel sendiri. Selain itu protein juga mengendalikan dapat tidaknya, serta waktu yang tepat untuk pengungkapan informasi yang terkandung di dalam DNA, yang diperlukan untuk sintesis protein itu sendiri.
Secara kimia, protein adalah heteropolimer dari asam-asam amino yang terikat satu sama lain dengan ikatan peptida. Protein jenis apapun dan berasal dari makhluk apapun tersusun atas 20 asam amino. Jadi sebenarnya perbedaan antara protein yang satu dengan yang lainnya disebabkan oleh jumlah dan kedudukan asam-asam amino di dalam tiap-tiap molekul.
Molekul protein berinteraksi dengan molekul air melalui ikatan hidrogen dan membentuk mantel air. Dikarenakan molekul protein besar, maka di dalam air protein membentuk larutan koloid. Adanya sejumlah elektrolit dengan konsentrasi encer sangat meningkatkan kelarutan suatu protein (salting in). Sifat ini, yakni kelarutan dalam bentuk larutan koloid yang dipermudah oleh mantel air dan elektrolit encer, dimanfaatkan untuk pemisahan protein. Selain sifat tersebut, protein juga mempunyai sifat lain yang berperan penting dan menjadi dasar dalam pemisahan protein yaitu ukuran molekulnya yang berbeda-beda sebagai akibat dari perbedaan jumlah asam amino penyusun protein serta muatan yang dikandungnya.
Sifat-sifat protein tersebut menjadi dasar pemisahan protein yang digunakan untuk deteksi atau diagnosis molekuler. Pemisahan protein dapat dilakukan dengan tiga cara, yaitu kromatografi gel, elektroforesis, dan salting out
Kromatografi gel berfungsi sebagai proses pemisahan protein berdasarkan berat dan ukuran molekul. Cara ini juga sering disebut kromatografi kolom dan size exclusion chromatography karena menggunakan butirn sintetik yang memiliki diameter dan ukuran pori-pori tertentu sebagai penyaring molekul. Molekul yang berukuran kecil akan mudah masuk ke pori-pori dan menjadi lambat berjalan keluar dari kolom, sedangkan molekul dengan ukuran lebih besar akan lebih sulit masuk ke pori-pori dan langsung menuju ke luar, sehingga hasil kromatografi akan
menunjukkan urutan pengeluaran molekul mulai dari yang terbesar hingga yang terkecil.
Dasar dari proses elektroforesis adalah fakta bahwa protein adalah makromolekul yang terdiri dari asam amino yang terikat secara kovalen. Setiap protein dibedakan dari muatan elektronnya yang berikatan secara kovalen atau ionik. Hal inilah yang menyebabkan suatu larutan dengan pH tertentu dapat mengandung protein dengan muatan listrik yang berbeda-beda. Sebab, susunan dan jumlah asam amino setiap protein tidaklah sama.
Apabila larutan protein diletakkan dalam suatu medan listrik, tiap protein akan bermigrasi ke kutub yang berlawanan dari muatan yang dikandung protein tersebut. Protein yang bermuatan negatif akan bergerak ke anode yang adalah kutub positif. Sementara itu, protein yang tidak bermuatan tidak akan bergerak.
Suatu molekul harus dapat berinteraksi dengan molekul air dengan membentuk ikatan hidrogen sehingga molekul tersebut tersebar rata di antara molekul-molekul air. Adanya muatan listrik pada molekul terlarut sangat membantu kelarutan karena muatan yang sama saling menjauhi sehingga agregasi molekul tidak terjadi. Inilah yang mendasari proses salting out. Setiap keadaan yang menyebabkan ditariknya air yang mengelilingi molekul protein sangat mengurangi kelarutan protein sehingga protein mengendap. Pada percobaan salting out, larutan garam bivalen lebih efisien dalam mengendapkan protein karena berdisosiasi menjadi tiga ion yang berinteraksi sempurna dengan air. Globulin dapat diendapkan dengan ammonium sulfat setengah jenuh, sedangkan albumin dapat diendapkan oleh ammonium sulfat jenuh, tidak dapat mengendap dengan NaCl jenuh, kecuali dengan penambahan asama mineral yang sangat kecil.
TUJUAN PRAKTIKUM
1. Mengenal reaksi umum suatu protein untuk melacak protein dalam suatu bahan.
2. Memisahkan protein dengan metode salting out dan mampu menjelaskan mekanismenya.
3. Melakukan pemisahan protein secara reversible, dengan menggunakan bahan higroskopis dan menerangkan mekanisme pemisahan tersebut. 4. Melakukan pemisahan protein secara denaturasi ireversibel dengan
menggunakan pereaksi alkaloid, menerangkan mekanisme kerjanya dan mampu melakukan untuk melacak protein.
5. Memperlihatkan kemampuan logam berat dalam mengendapkan dan mendenaturasi protein dan menjelaskan masalah yang ditimbulkan oleh logam berat sebagai pencemar lingkungan.
6. Mengetahui cara pemisahan suatu protein dari protein lain ataupun suatu senyawa lain, berdasarkan perbedaan berat molekul dengan menggunakan cara kromatografi gel penyaring molekul sederhana.
PRAKTIKUM BIOKIMIA I SALTING OUT
PRAKTIKUM UJI BIURET I. Tujuan
Memperlihatkan bahwa protein mempunyai ikatan peptida yang bereaksi positif dengan uji biuret dan reaksi ini tidak terjadi pada makro molekul lain (menguji adanya kandungan protein dalam suatu bahan). II. Dasar Teori
Ikatan-ikatan peptida yang menyusun protein dan polipeptida, dalam larutan bersuasana alkali akan bewarna lembayung bila direaksikan dengan Cu2+.
III.Bahan dan Pereaksi
1. Bahan yang diuji (pada praktikum I : serum) 2. NaOH 10%
3. CuSO4 0,1 % ± 10 tetes (hingga larutan berubah warna menjadi lembayung atau biru)
PRAKTIKUM SALTING OUT I. Tujuan
Memperlihatkan bahwa protein sebagai makromolekul yang larut dalam bentuk koloid dapat dipisahkan satu sama lain dengan menggunakan larutan garam divalent konsentrasi tinggi.
II. Alat dan Bahan - Alat
o Tabung reaksi o Kertas saring o Batang pengaduk o Pipet tetes
o Corong
o Rak tabung reaksi - Bahan
o Serum Sapi 10 mL.
o Larutan amoonium sulfat (NH4)2SO4 jenuh o Kristal amonium sulfat
o Larutan NaOH 10%
o Larutan CuSO4 0,1% o Larutan NaCl 0,9% III.Cara Kerja
1. Siapkan tabung reaksi, gelas ukur, pipet, dan kertas saring.
2. Ambil 20 mL bovine serum tambahkan dengan 20 mL larutan amonium sulfat (NH4)2SO4 jenuh.
3. Putar gelas tersebut namun tidak boleh sampai berbusa.
4. Kemudian larutan terebut disaring dengan kertas saring.
5. Ambil 1 mL filrat 50%. Kemudian, lakukan uji Biuret Tabung 1.
6. Ambil sedikit presipitannya (presipitate 50%), tambahkan 1 mL NaCl 0,9%. Kemudian, lakukan uji Biuret Tabung 2.
7. Sisa filtrat ditambahkan kristal amonium sulfat (NH4)2SO4 sampai jenuh (kristal tidak dapat larut lagi) lalu disaring.
8. Ambil 1 mL filtrat 100%. Kemudian, lakukan uji Biuret Tabung 3.
9. Ambil sedikit presipitannya (presipitate 100%), tambahkan 2 mL NaCl 0,9%. Kemudian, lakukan uji Biuret Tabung 4.
IV. Dasar Teori
Dalam melakukan berbagai studi maupun tes di laboratorium, sering kali diperlukan protein tertentu yang murni dari pelarut maupun molekul lain. Teknik purifikasi dan isolasi protein yang klasik digunakan ialah teknik salting out. Awalnya, teknik ini umum digunakan dalam usaha fraksinasi protein.
Namun, metode ini tidak memberikan tingkat diskriminasi yang tinggi dan jarang memberikan hasil berupa fraksi yang murni. Sekarang, metode salting out ini digunakan sebagai cara yang cukup murah untuk mengkonsentrasikan ekstrak protein dari sebuah larutan.1
Solubilitas protein dalam sebuah larutan dipengaruhi oleh konsentrasi garam yang ada di dalam larutan tersebut. Efek ini muncul karena adanya interaksi antara ion-ion garam dengan gugus bermuatan pada protein. Adisi garam ke dalam larutan bisa menyebabkan dua hal yang berbeda. Pada beberapa larutan dengan protein yang tidak dapat atau sulit untuk larut dalam akuades, adisi garam dalam jumlah kecil bisa menyebabkan protein tersebut larut. Fenomena ini disebut salting in. Apabila adisi garam dilanjutkan, akan terdapat suatu titik dimana adisi lebih lanjut dari garam tidak akan menambah solubilitas protein, malah akan menyebabkan presipitasi dari protein.
Fenomena ini disebut salting out. 2
Garam yang paling sering digunakan dalam metode ini adalah
ammonium sulfat [(NH4)2SO4]. Penggunaan ini didasarkan pada fakta bahwa secara empiris, anion polivalen lebih efektif daripada anion univalen dalam salting out. Sedangkan, kation polivalen cenderung menghilangkan efek dari anion polivalen. Dapat disimpulkan bahwa kombinasi terbaik bagi garam yang akan digunakan untuk salting out ialah kombinasi antara anion polivalen dan kation univalen. Anion-anion sendiri dapat disusun berdasarkan efektivitasnya dalam proses salting out (Hofmeister series). Urutan daripada anion dari efektivitas tinggi ke rendah yakni:
Dari Hofmeister series ini, sitrat adalah anion terbaik yang dapat digunakan dalam salting out. Namun, ammonium sulfat [(NH4)2SO4] lebih umum digunakan karena solubilitasnya yang tinggi dan kemudahan
mendapatkan bentuk murninya dengan biaya rendah. Selain itu, ammonium sulfat tidak memiliki efek toksik terhadap berbagai enzim. Hofmeister series juga merupakan susunan anion berdasarkan efek stabilisasi terhadap protein. Semakin ke kiri maka tingkat kosmotropy (kemampuan stabilisasi protein)
semakin meningkat sedangan semakin ke kanan tingkat chaotropy (kemampuan destabilisasi protein) semakin meningkat.1,2
Proses salting in, faktor yang memainkan peran penting ialah ionic strength dari garam yang digunakan. Ionic strength dapat dirumuskan sebagai berikut:
ci = konsentrasi dari tiap ion garam (mol/liter)
zi =muatan dari setiap ion garam.
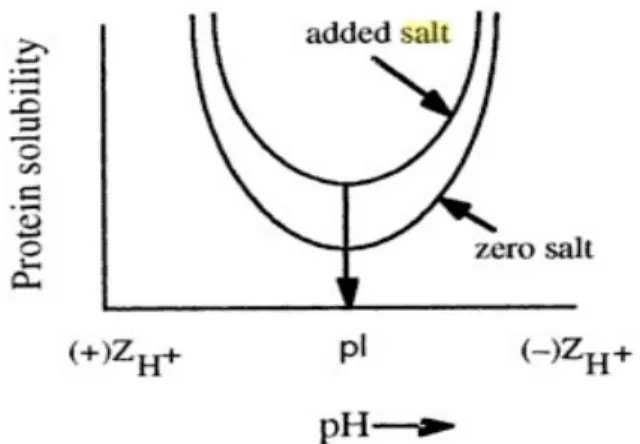
Ionic strength berefek pada konsentrasi garam yang rendah (0->0,2M). Pada ionic strength lemah, solubilitas protein berada pada tingkat minimum pada pI protein. Pada pH ini, gaya elektrostatis intramolekular antara rantai samping asam amino berada pada tingkat maksimum dimana konformasi protein sangat ketat dan hidrasi protein pada tingkat minimum. Pada pH selain pI, titrasi dari gugus-gugus yang bisa diionisasi mengarah pada pengurangan interaksi intramolekular. Hal ini mengakibatkan struktur protein lebih terelaksasi dan solubilitas serta hidrasi protein meningkat. Adisi garam memiliki efek yang sama dengan perubahan pH. Kedua efek ini bersifat kumulatif.1,3
Grafik 1. Kurva solubilitas protein terhadap pH pada penambahan garam.1 Pada konsentrasi lebih dari 0,2 M, sifat kosmotropy berperan dalam mengurangi solubilitas protein. Peran kosmotrop dalam menstabilisasi protein terletak pada efeknya yang membuat struktur protein menjadi lebih ketat dan kompak. Proses kerja garam (khususnya ammonium sulfat) dalam stabilisasi
protein bisa dijelaskan berdasarkan interaksi hidrofobik protein. Amonium sulfat yang ditambahkan ke dalam larutan dapat dilarutkan dengan cepat oleh air karena afinitasnya yang tinggi. Pada adisi lebih lanjut, jumlah molekul air yang tersedia untuk melarutkan ammonium sulfat semakin berkurang hingga mencapai pada suatu titik dimana semua molekul air telah habis terpakai. Pada adisi lebih lanjut, molekul air akan terikat lemah pada gugus hidrofobik protein untuk digunakan dalam pelarutan garam. Hal ini menyebabkan bagian
hidrofobik protein terekspos pada air dan untuk mengurangi efek ini, protein membentuk agregat yang kompak dan stabil.1,2,3
Perubahan solubilitas protein pada proses salting in atau salting out dapat diprediksi dengan menggunakan persamaan semiempiris Cohn, yaitu:
Cs = Solubilitas protein di dalam air.
C’s = Solubilitas protein dalam larutan garam.
β = Rasio solubilitas protein pada titik isoionik. I = Ionic strength garam.
Ks = Konstanta.
Perlu diperhatikan bahwa efek salting in dan salting out berlangsung secara bersamaan pada adisi garam. Dengan mempertimbangkan hal ini, persamaan semiempiris Cohn dapat diturunkan menjadi:
Kin = konstanta salting-in. Kout = konstanta salting-out.
Apabila tingkat salting-out lebih besar, solubilitas protein akan
menurun. Sebaliknya, apabila tingkat salting-in lebih besar, solubilitas protein akan naik.3
Suatu molekul yang larut dalam air berarti molekul tersebut bereaksi dengan air dengan membentuk ikatan hidrogen sehingga molekul tersebut tersebar merata diantara molekul air. Dengan adanya muatan dalam molekul
air, akan meningkatkan kelarutan karena adanya muatan yang saling menjauhi dan mencegah terbentuknya agregasi molekul.
Protein adalah senyawa yang mempunyai berat molekul yang besar dan mudah larut. Protein dapat mudah larut karena protein mempunyai gugus – NH- dan –CO- yang ada pada ikatan peptida yang dapat berikatan dengan air. Pada muatan yang sama dalam 2 partikel molekul protein yang sama akan bertolakan sehingga membantu meningkatkan kelarutan protein (salting in). Setiap keadaan yang menyebabkan ditariknya air yang mengelilingi molekul protein sangat mengurangi kelarutan protein sehingga protein menjadi mengendap. Pada larutan berkonsentrasi tinggi, menetralkan muatan pada protein sehingga membuat protein mengendap. Namun perubahan ini bersifat reversibel karena cara ini hanya bersifat menarik air di sekeliling protein namun protein sendiri tidak mengalami perubahan struktur.
Protein dalam serum darah hanya albumin dan globulin. Kedua protein dalam serum darah ini memiliki muatan dan berat jenis yang berbeda. Dalam serum sudah tidak mengandung fibrinogen lagi, sehingga apabila serum dibiarkan tidak akan mengalami koagulasi.
Larutan garam divalen lebih efisien dalam mengendapkan protein karena di dalam air garam tersebut berdisosiasi menjadi 3 ion yang berinteraksi sempurna dengan air, sebagai contoh:
- Globulin dapat diendapkan oleh (NH4)2SO4 setengah jenuh sedangkan NaCl baru dapat mengendapkan protein tersebut bila berada dalam larutan jenuh. - Albumin baru akan mengendap oleh (NH4)2SO4 jenuh dan tidak dapat
diendapkan dengan NaCl jenuh kecuali dengan penambahan asam mineral dalam jumlah yang sangat kecil.
Amonium sulfat digunakan karena mudah larut sehingga dapat diperoleh amonium sulfat dengan range konsentrasi yang cukup luas.
Urutan efektivitas anion garam yang digunakan untuk salting out dari yang terbesar adalah sitrat, fosfat, sulfat, asetat / klorida, nitrat, dan thiosianat. V. Hasil Tabung 1 Presipitat 50% Tabung 2 Filtrat 50% Tabung 3 Presipitat 100% Tabung 4 Filtrat 100%
Uji biuret + + ++ -Tabel 1. Hasil Pengamatan Praktikum Isolasi Protein Keterangan tabel:
+ = berwarna ungu, jumlah tanda (+) menunjukkan intensitas. - = berwarna biru
Hasil percobaan salting out ini menunjukkan bahwa pada Tabung 1 (presipitat 50%) larutan berubah warna menjadi warna ungu. Begitu pula pada Tabung 2 (filtrat 50%), larutan berubah menjadi warna ungu. Pada Tabung 3 (presipitat 100%), larutan berubah warna menjadi warna ungu yang lebih pekat dibandingkan tabung 1 dan tabung 2. Sedangkan, pada Tabung 4 (filtrat 100%), larutan berubah warna menjadi biru.
VI. Analisis
Tabung Warna Hasil uji biuret Analisis
1 Lembayung (Merah) + Mengandung globulin
2 Lembayung (Merah) + Mengandung albumin
3 Lembayung (Merah) + Mengandung albumin
4 Biru - Tidak mengandung protein
Tabel 2. Analisis Hasil Pengamatan Praktikum Isolasi Protein Endapan I, merupakan presipitat 50% yang kemudian diencerkan dengan menambahkan NaCl 0,9 % sebanyak 2 ml dan dilakukan uji biuret kepada endapan tersebut. Dilakukan uji biuret dengan menambahkan 2 ml NaOH 10% kedalam larutan setengah jenuh (presipitat 50%) dan kemudian ditambahkan CuSO4 0,1 % tetes demi tetes hingga terjadi perubahan warna pada larutan. Setelah ditetesi CuSO4 larutan berubah warna menjadi ungu yang menandakan bahwa di dalam larutan tersebut terdapat protein globuler. Hal ini dikarenakan berat dan ukuran protein globulin lebih besar dibanding protein albumin sehingga pada proses pengendapan setengah jenuh protein globulin tidak dapat melewati kertas penyaring.
Filtrat I, merupakan filtrat 50% yang kemudian diencerkan dengan menambahkan NaCl 0,9% sebanyak 2 ml kemudian dilakukan uji biuret. Uji biuret dilakukan dengan menambahkan NaOH 10% sebayak 2 ml dan
kemudian ditambahkan CuSO4 tetes demi tetes hingga terjadi perubahan warna pada larutan. Setelah diberikan CuSO4 tetes demi tetes, larutan berubah warna
menjadi ungu yang membuktikan adanya protein yang terkandung dalam larutan tersebut. Protein yang terkandung dalam larutan tersebut ialah Albumin, sebab albumin tidak mengendap pada larutan setengah jenuh sehingga akan melewati kertas penyaring sehingga akan tetap berada dalam filtrat.
Pemberian amonium sulfat pada tahap 2 menyebabkan sebagian protein larut air (salting in) dan lolos dari kertas saring sedangkan sebagian lainnya tertahan. Hal ini juga yang memberikan intensitas warna ungu yang mirip pada tabung 1 dan 2.
Endapan II, merupakan presipitat 100% yang kemudian diencerkan dengan menambahkan NaCl 0,9 % sebanyak 2 ml dan dilakukan uji biuret kepada endapan tersebut. Dilakukan uji biuret dengan menambahkan 2 ml NaOH 10% kedalam larutan jenuh (presipitat 100%) dan kemudian
ditambahkan CuSO4 0,1 % tetes demi tetes hingga terjadi perubahan warna pada larutan. Setelah ditetesi CuSO4 larutan berubah warna menjadi ungu yang menandakan bahwa di dalam larutan tersebut terdapat protein. Warna ungu pada presipitat 100% ini lebih pekat dibandingkan warna ungu pada presipitat 50%. Semakin kuat intensitas warna ungu yang dihasilkan, semakin besar konsentrasi protein. Ini berarti tabung 3 (Presipitat 100%) memiliki larutan yang memiliki protein dengan konsentrasi lebih besar dibandingkan tabung 1 dan tabung 2 karena tabung 3 berasal dari filtrat 50% yang diberi ammonium sulfat hingga jenuh (terjadi presipitasi protein, salting out). Tabung 3
(Presipitat 100%) ini mengandung protein albumin.
Filtrat II, merupakan filtrat 100% yang kemudian diencerkan dengan menambahkan NaCl 0,9% sebanyak 2 ml kemudian dilakukan uji biuret. Uji biuret dilakukan dengan menambahkan NaOH 10% sebayak 2 ml dan
kemudian ditambahkan CuSO4 tetes demi tetes hingga terjadi perubahan warna pada larutan. Setelah diberikan CuSO4 tetes demi tetes, larutan berubah warna menjadi biru yang membuktikan bahwa tidak ada protein yang terkandung dalam larutan tersebut. Perubahan warna biru pada larutan menunjukkan tidak adanya ikatan peptida pada larutan yang diuji, seperti pada tabung 4.
Ditemukannya albumin pada presipitat 100% sedangkan globulin tidak disebabkan oleh dua hal, yakni berat molekul dan konsentrasi kedua protein
tersebut. Protein albumin memiliki berat molekul yang lebih besar daripada berat molekul globulin (Berat molekul albumin serum adalah 69 kDa sedangkan β2-mikroglobulin memiliki berat molekul 11.5 kDa). Hal tersebut terkait pula dengan tingkat konsentrasi kedua protein dalam plasma. Konsentrasi albumin serum dalam plasma adalah 35 – 45 mg/ml sedangkan konsentrasi β2-mikroglobulin dalam plasma adalah 0.0013 mg/ml. Tingginya konsentrasi albumin serum dalam plasma mengindikasikan keberadaannya dalam fase presipitat 100% sedangkan rendahnya konsentrasi β2-mikroglobulin dalam plasma mengindikasikan keberadaannya dalam fase filtrat 100% yang nol (tidak ada).
VII. Kesimpulan
Tabung 1,2 dan 3 berubah warna menjadi ungu setelah diuji dengan uji biuret menunjukkan adanya protein. Intensitas warna ungu yang lebih kuat pada tabung 3 menunjukkan larutan pada tabung 3 memiliki konsentrasi protein yang lebih besar dibandingkan tabung 1 dan tabung 2. Tabung 3 menunjukkan perubahan warna menjadi biru sebagai tanda bahwa tidak ada protein pada larutan ini.
Globulin merupakan protein yang berukuran lebih besar sehingga dapat dipisahkan pada penyaringan pertama. Albumin berukuran lebih kecil daripada globulin sehingga bovine serum harus diberi garam sampai jenuh untuk dapat dipisahkan. Pada campuran setengah jenuh, presipitan mengandung globulin dan filtrat mengandung albumin. Pada campuran jenuh, presepitan mengandung albumin dan filtrat tidak mengandung protein.
REFERENSI
1. Dennison C. A Guide to Protein Isolation. 2nd Edition. Dordrecth: Kluwer Academic Publishers; 2003. p. 74-81.
2. Ghosal S, Srivastava AK. Fundamentals of Bioanalytical Techniques and Instrumentation. New Delhi: PHI Learning Private; 2009. p.75-78,
3. Kaul RH, Mattiason B. Isolation and Purification of Protein. New York: Marcel Dekker, Inc; 2003.p. 256-261,
PRAKTIKUM BIOKIMIA II KROMATOGRAFI GEL PENYARING
I. Tujuan
Memisahkan molekul hemoglobin dari molekul vitamin B12 dengan menggunakan butiran-butiran mikroskopis dekstran (suatu bentuk polimer dari glukosa) sebagai penyaring molekuler.
II. Dasar Teori
Kromatografi merupakan salah satu cara yang sering digunakan untuk memisahkan / mengisolasi molekul-molekul biologi seprti protein. Istilah Istilah ini diciptakan Tswett (1906) dari bahasa Yunani chroma yang berarti warna. Ia memisahkan klorofil dari pigmen-pigmen lain dalam tanaman dengan menggunakan tabung (kolom) yang diisi padat dengan kalsium karbonat sebagai adsorben. Ekstrak tanaman dimasukkan ke dalam kolom dan bila dialirkan pelarut organik yang sesuai, pigmen-pigmen dalam ekstrak bergerak turun dari kolom dengan kecepatan yang berbeda-beda dan masing-masing terpisah membentuk cincin atau pita berwarna. Kemudian ternyata bahwa cara ini juga dapat juga digunakan untuk memisahkan molekul yang tidak berwarna.
Pada pemisahan molekul dengan teknik kromatografi, molekul-molekul yang akan dipisahkan terdistribusi antara dua fasa zat, yaitu fasa stasioner yang tidak bergerak dan fasa mobil yang bergerak. Fasa stasioner data berupa zat padat atau cairan, sedangkan fasa mobil mungkin suatu cairan atau gas. Fasa mobil disebut juga eluen dan proses pergerakan suatu molekul sepanjang fasa stasioner yang disebabkan oleh eluen disebut elusi. Hasil pemisahan dengan teknik kromatografi disebut kromatogram.
Kromatografi Kolom
Kromatografi kolom merupakan teknik pemisahan molekul-molekul dari campurannya dengan melewatkan larutan yang mengandung molekul-molekul yang akan dipisahkan tersebut melalui kolom yang berisi matriks padat sebagai fasa stasioner. Sifat matriks dapat dibuat sedemikian rupa, sehingga
memungkinkan pemisahan selektif molekul-molekul tersebut. Sifat ini antara lain: kelarutan, ukuran, atau muatan molekul.
Pada kromatografi kolom yang klasik, umumnya digunakan tabung gelas berdiameter 1 cm atau lebih, dengan panjang sekitar 10 – 30 cm. Adsorben berupa partikel-partikel mikroskopis dipadatkan pada kolom membentuk fasa stasioner. Laju aliran eluen diatur dengan keran (pengatur aliran), biasanya sekitar 1 mL/menit.
Sampel, yang berupa larutan yang mengandung campuran molekul-molekul, dituang ke dalam kolom dan molekul-molekul dipisah dengan mengalirkan eluen yang sesuai. Elusi berlangsung sampai molekul-molekul keluar satu-persatu dari kolom. Fraksi-fraksi yang terdiri dari beberapa milliliter eluen yang keluar dari kolom ditampung dalam tabung-tabung secara manual atau menggunakan kolektor otomatis. Deteksi fraksi yang mengandung molekul-molekul itu dilakukan dengan cara membandingkan volume retensi (VR) dengan waktu retensi (tR) molekul-molekul tersebut dengan standar yang telah diketahui. Volume retensi adalah volume eluen yang diperlukan untuk mengelusi suatu molekul pada kadar maksimumnya, sedangkan waktu retensi menyatakan waktu yang diperlukan untuk mengelusi molekul pada kadar maksimumnya. Selanjutnya penetapan kuantitatif molekul-molekul dapat dilakukan dengna cara titrasi, spektofotometri atas metoda analisis lain.
Kromatografi Gel Penyaring
Pada teknik ini, protein/molekul lain dipisahkan dari campurannya berdasarkan perbedaan berat atau ukuran molekul. Cara ini disebut juga molecular sieve chromatography atau size exclusion chromatography karena butiran sintetis dengan diameter dan ukuran pori-pori tertentu yang dipadatkan pada kolom bekerja sebagai penyaring molekuler.
Bila larutan yang mengandung campuran protein dilewatkan pada kolom, molekul yang lebih kecil dapat masuk ke pori-pori sehingga relatif tertahan dan lebih lambat keluar dari kolom, sedangkan molekul yang lebih besar dari pori-pori terus lewat di sela butiran penyaring sehingga lebih cepat keluar dari kolom. Penyaring molekuler yang biasa digunakan adalah gel dekstran atau poliakrilamid yang tersusun dari butiran mikroskopis.
Dalam percobaan ini, digunakan butiran-butiran mikroskopis dekstran, suatu bentuk polimer dari glukosa, dengan ukuran terterntu yang seragam, sebagai fasa stasioner atau matriks pemisah. Dekstran yang menyusun butiran mikroskopis tersebut teranyam sedemikian rupa, sehingga mempunyai mata anyaman dengan ukuran terterntu pula. Partikel yang larut dalam fasa mobil dan dengan ukuran lebih kecil dari mata anyaman tersebut akan terperangkap lagi dalam butiran yang lain, demikian seterusnya. Sebaliknya, molekul dengan ukuran lebih besar dari mata anyaman tidak terperangkap dan mengalir dalam cairan di antara partikel-partikel tersebut. Akibatnya, molekul dengan ukuran lebih besar dari mata anyaman tersebut menempuh jalan yang lebih pendek dan keluar lebih dahulu dari kolom pemisah.
III.Alat dan Bahan Alat:
a. Kolom berisi gel penyaring molekul b. Tutup atas dan bawah dari dapar kolom c. Pipet tetes
d. Tabung reaksi e. Rak tabung reaksi f. Spetrofotometer Bahan:
a. Larutan yang akan dipisahkan, mengandung Hemoglobin dan Vitamin B12
b. Dapar kolom (Buffer NaCl 0.1 M + azida) IV. Cara Kerja
1. Menyiapkan 16 tabung reaksi yang digunakan sebagai penampung. Setiap tabung ditandai dengan angka 1-16. Tabung ke-16 digunakan untuk menampung sisa dapar kolom yang tidak terpakai dan ditandai dengan “sisa”.
2. Membuka penutup atas dan penutup bawah dari kolom pemisah. Kemudian, dapar kolom ditampung ke dalam tabung ke-16 (yang
berlabel “sisa”) sampai hampir seluruh dapar keluar dan berada di batas dekstran. Setelah itu, bagian bawah dari dapar kolom ditutup kembali. 3. Menempatkan kolom ke tabung nomor 1.
4. Meneteskan 3 tetes campuran HB dan vitamin B12 tepat di atas permukaan gel dengan menggunakan pipet tetes. Penetesan dilakukan dengan tidak mengganggu permukaan gel.
5. Menambahkan dapar kolom berupa buffer NaCl 0.1 M dan azida secukupnya ke atas permukaan gel dalam kolom secara perlahan-lahan. Setelah itu, penutup kolom bagian bawah dibuka.
6. Menampung fraksi 5 tetes dalam setiap tabung penampung. Permukaan gel tidak boleh kering sehingga penampungan frkasi dilakukan sambil menambahkan dapar kolom terus sedikit demi sedikit ke permukaan gel.
7. Menutup kembali kolom pemisah bagian bawah dengan penutup bagian bawah.
8. Mengamati dan mencatat warna dan intensitas setiap fraksi apakah berwarna coklat, merah, ataupun tidak berwarna.
9. Menambahkan NaCl 0.1 M sebanyak 1 mL ke dalam masing-masing tabung, yaitu tabung nomor 1-15.
10. Mengukur dan mencatat nilai absorban dari fraksi yang telah ditambah NaCl 0.1 M dari setiap tabung (1-15) dengan menggunakan alat spektrofotometer dengan λ 540 nm.
V. Hasil percobaan:
Tabel Warna, Intensitas dan Serapan Fraksi
Tabung 1 2 3 4 5 6 7 8 Warna benin g benin g merah gelap merah kecoklat an orang e muda pink terang pink mud a Intensitas + + ++ + + + +++ ++ Serapan 0.01 0.26 1.12 0.44 0.13 0.08 0.18 0.17 Tabung 9 10 11 12 13 14 15
Warna pink
pudar bening bening bening bening bening bening
Intensitas + + + + + + +
Serapan 0.04 0.03 0.03 0.03 0.01 0.00 0.00
Kurva Pengukuran Serapan fraksi
VI. Pembahasan
Berdasarkan hasil percobaan di atas, perbedaan antara dasar teori dengan hasil percobaan dimana dasar teori menyatakan bahwa molekul yang lebih berat akan keluar terlebih dahulu pada kromatografi gel penyaring sementara hasil percobaan kami menunjukkan molekul yang lebih besar (B12) keluar bersamaan dengan molekul yang lebih kecil (Hb) di awal-awal fraksi sehingga warna fraksi menjadi merah gelap karena campuran warna kecoklatan dari B12 dan merah dari Hb. Hal ini menunjukkan bahwa kromatografi gel penyaring yang kami gunakan tidak berfungsi sebagaimana mestinya karena jaring-jaring pembentuknya tidak cukup kuat mengikat Hb. Penyaringan yang tidak berhasil ini juga mengakibatkan nilai serapan di awal fraksi meningkat sangat tajam. Padahal jika penyaringan berhasil, nilai serapan tidak akan melebihi 1. VII. Jawaban Pertanyaan:
Untuk menjadi pembanding terhadap molekul Hemoglobin dimana berat molekul Vitamin B12 jauh lebih besar daripada Hemoglobin. 2. Penyebab Vitamin B12 berwarna merah:
Vitamin B12 memiliki pigmen alami berupa warna merah yang diturunkan secara genetik seperti pigmen alami lainnya melalui urophorpirinogen III1.
Penyebab Hemoglobin berwarna merah:
Adanya pigmen Hem dimana terdapat atom besi di pusat struktur Hem. Kadar kemerahan yang ditunjukkan oleh Hem bergantung pada jumlah oksigen yang diikat oleh ion Fe2+. Rentang warna dimulai dari merah segar menandai oksigen dalam jumlah maksimum dan warna merah kebiruan dalam jumlah minimum1.
3. Rumum Kimia Vitamin B12 dan gugus prostetik pada Hemoglobin1:
4. Berat Molekul Vitamin B12: ±64000 gram/mol. Berat Molekul Hemoglobin: ±13555,35 gram/mol
5. Logam yang terdapat dalam Hemoglobin dan Vitamin B12
Hemoglobin: Fe (Besi) Vitamin B12: Co (Kobalt)
Kolom kromatografi gel penyaring dapat memisahkan molekul berdasarkan perbedaan berat molekul dengan menggunakan penyaring molekuler.
REFERENSI
Murray, Robert K. Granner, Daryl K. Rodwell, Victor W. Biokimia Harper. 27th ed. Jakarta.Penerbit Buku Kedokteran EGC: 2006.
PRAKTIKUM BIOKIMIA III ELEKTROFORESIS
A. Tujuan Percobaan
Tujuan dari elektroforesis ini adalah untuk memisahkan protein berdasarkan muatannya.
B. Landasan Teori
Protein adalah heterobiopolimer yang terdiri dari asam amino melalui ikatan peptida. Protein-protein ini dibedakan berdasarkan muatan elektronnya yang berikatan secara ionik atau kovalen. Hal inilah yang menyebabkan suatu larutan protein memiliki muatan listrik yang berbeda-beda. Selain itu, dapat juga dibedakan berdasarkan berat molekulnya.
Pada teknik pemisahan protein dengan metode elektroforesis, protein serum dipisahkan berdasarkan muatan listriknya. Apabila larutan protein diletakkan dalam suatu medan listrik, tiap protein akan bermigrasi ke kutub yang berlawanan dari muatan yang dikandung protein tersebut. Protein yang bermuatan negatif akan bergerak ke anode yang adalah kutub positif. Sementara itu, protein yang tidak bermuatan tidak akan bergerak.
C. Alat dan Bahan Alat:
1. Pipet mikrometer 2. Tip
3. Aplikator 4. Power supply
5. Elektroforesis chamber dengan larutan buffer 6. Sample plate
7. Membran selulosa asetat Bahan:
1. Marker 2. Serum 3. BSA
4. Precipitate 50 % 5. Filtrate 50 % 6. Filtrate 100 % 7. Precipitate 100 % 8. Asam asetat 5 %
9. Larutan Ponceau Stain (pewarna merah) D. Cara Kerja
1. Menyuntikkan sampel marker, serum, BSA, Precipitate 50%, Filtrate 50%, Filtrate 100%, dan Precipitate 100% masing-masing sebanyak 10 ul ke dalam pelat dengan sampel menghadap ke bawah.
2. Pelat yang sudah berisi sampel larutan tersebut distempel menggunakan aplikator yang ditekan sebanyak tiga kali masing-masing selama 10 detik. Lalu, aplikator ditempelkan pada kertas membran selulosa asetat dan ditekan 1 kali selama 10 detik.
3. Meletakkan membran selulosa asetat pada elektroforesis chamber yang berisi larutan buffer 100 ml. Mengalirkan chamber tersebut dengan arus listrik selama 15 menit dengan tegangan sebesar 180 volt.
4. Setelah 15 menit, mengangkat membran selulosa asetat menggunakan pinset dari bak elektroforesis dan memasukkannya ke dalam wadah berisi larutan pencuci berupa asam asetat yang dibubuhi Ponceau Stain selama enam menit. Membran tersebut direndam sambil digoyang-goyangkan. 5. Mengangkat dan memindahakan membran selulosa asetat untuk direndam
dalam larutan pencuci. Mengulangi pencucian sebanyak dua kali dalam dua wadah dengan kepekatan yang berbeda masing-masing selama dua menit . 6. Mengangkat dan meletakkan membran di atas kertas saring untuk
Membran selulosa asetat
Sumur (well)
marker Serum, BSA, filtrate, precipitate
+
+
-Power supply
Garis yang berada di kutub positif merupakan albumin, sedangkan globulin berada di kutub negatif.
Serum mengandung protein albumin dan globulin ditunjukkan pada gambar di paling kanan
BSA hanya mengandung albumin ditujukkan pada gambar nomor dua dari kanan
Precipitate 50 % seharusnya hanya mengandung globulin, namun pada gambar (nomor tiga dari kanan) menunjukkan pita yang juga terkontaminasi oleh albumin. Hal ini dapat disebabkan oleh bercampurnya sampel pada saat penyuntikan dll.
Filtrate 50 % hanya mengandung albumin (nomor tiga dari kiri) Filtrate 100 % tidak mengandung albumin maupun globulin, jadi bukan merupakan protein (nomor 2 dari kiri, berwarna putih/ pita tidak tampak)
Precipitate 100 % hanya mengandung albumin (gambar nomor satu dari kiri)
Adanya perbedaan muatan antara protein albumin dan globulin menyebabkan keduanya bergerak ke arah kutub yang berbeda.
Protein yang mengandung globulin bergerak ke arah kutub negatif karena globulin bermuatan positif.
Protein yang mengandung albumin akan bergerak ke arah kutub positif karena albumin bermuatan negatif.
REFERENSI
1. Gel Filtration Chromatography.
http://www.science.fau.edu/chemistry/Mari/ biochemlab/05_012.jpg. Diunduh tanggal 23 Maret 2008
2. L. G. Wade, Jr. Organic Chemistry, 6th ed. New Jersey : Pearson, 2006 3. Lauralee Sherwood. Human Physiology.USA: Thomson, 2007
4. M. Sadikin. Protein Biochemistry : A Brief Introduction, 2007. 5. Robert K. Murray. Biokimia Harper edisi 25. Jakarta : EGC, 2003
6. Tim Penyusun Biokimia FKUI. Biokimia, Eksperimen Laboratorium. Jakarta: Widya Mandala, 2001