BUKU PENUNTUN
PRAKTIKUM KIMIA ANORGANIK II
OLEH :
Dr. EMRIZAL M. TAMBOESAI, M.Si, M.H
LABORATORIUM KIMIA ANORGANIK JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS RIAU
KATA PENGANTAR
Puji syukur penulis sampaikan kepada Allah SWT karena atas limpahan rahmat dan karunia-Nya, Penulis dapat menyelesaikan penyusunan Penuntun Praktikum Kimia Anorganik II. Buku penuntun praktikum ini merupakan literatur acuan bagi praktikan yang mengikuti perkuliahan Praktikum Kimia Anorganik II di Laboratorium Kimia Anorganik Jurusan Kimia FMIPA Universitas Riau.
Pada buku penuntun praktikum ini terdapat 9 (sembilan) objek percobaan. Buku penuntun praktikum ini memuat sedikit paparan teoritis tentang objek percobaan dan beberapa aturan serta petunjuk dalam mengikuti perkuliahan Praktikum Kimia Anorganik II.
Penulis menyadari bahwa buku penuntun praktikum ini belum sempurna. Oleh karena itu, penulis menerima berbagai kritik dan saran dari pembaca yang bersifat membangun. Akhir kata Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu demi terselesainya buku penuntun ini dan berharap semoga buku penuntun ini dapat memberi arti positif dalam memantapkan perkuliahan di Jurusan Kimia FMIPA Universitas Riau.
Pekanbaru, Februari 2016 Penulis
Tim Labor Kimia Anorganik
TIM PELAKSANA PRAKTIKUM KIMIA ANORGANIK II
JURUSAN KIMIA FMIPA UNIVERSITAS RIAU T.A 2015/2016
A. Kepala Lab./Penanggung Jawab : Pepi Helza Yanti, M.Si B. Dosen Pembimbing : 1. Halida Sophia, M.Si
2. Drs. Akmal Mukhtar, MS
3. Dr. Emrizal M. Tamboesai, M.Si, M.H C. Laboran : Zul Aprisna
D. Koordinator Asisten : Rizki Rilda Aulia E. Asisten Praktikum : 1. Sari Kurniawati
2. Abdi Kaumiyah 3. Enggal Satrio 4. Dede Suhendra
5. Syahri Kasiani 6. Mutia Agustina 7. Indah Puspita Sari
8. Nia 9. Zerly Marseliza 10. Merry Siska Yanti
11. Dewi Puspita 12. Titin Kasriani
13. Karmila
DAFTAR ISI
KATA PENGANTAR...i
TIM PELAKSANA PRAKTIKUM KIMIA ANORGANIK II...ii
DAFTAR ISI...iii
TATA TERTIB PRAKTIKUM KIMIA ANORGANIK II...iv
PERCOBAAN I Stabilitas dan Isolasi Senyawa Tembaga (1)...1
PERCOBAAN II Meneliti Kesadahan Air...5
PERCOBAAN III Penetapan Rumus Molekul Senyawa Kompleks...7
PERCOBAAN IV Pembuatan Natrium Peroksoborat...10
PERCOBAAN V Mengendapkan Garam, Melarutkan dan Menelitinya...12
PERCOBAAN VI Pembuatan Soda Kostik Preparatif...14
PERCOBAAN VII Pembuatan dan Pemurnian Kalium Iodat...16
PERCOBAAN VIII Senyawa Kompleks dari Na2C2O4 dan H2C2O4...19
PERCOBAAN IX Pembuatan Zeolit...21
PANDUAN PENULISAN JURNAL DAN LAPORAN PRAKTIKUM...25
TATA TERTIB PRAKTIKUM KIMIA ANORGANIK II
I. Pelaksanaan Praktikum
1. Praktikan harus mempelajari buku penuntun sebelumnya dan bersiap untuk diresponsi tentang percobaan yang akan dilakukan.
2. Praktikan harus datang 15 menit sebelum praktikum dimulai.
3. Praktikan tidak diperkenankan memasuki ruang laboratorium sebelum diberi izin oleh asisten.
4. Pratikan tidak diperkenankan mengikuti praktikum jika tidak membuat jurnal praktikum tentang percobaan yang akan dilakukan dan tidak membuat laporan praktikum dari percobaan sebelumnya.
5. Keterlambatan lebih dari 15 menit tidak diperkenankan mengikuti praktikum. 6. Tas ditinggalkan di tempat yang sudah disediakan, jangan lupa amankan
barang–barang anda.
7. Praktikan wajib mengikuti instruksi asisten praktikum, bekerja dalam kelompok dengan tenang, dan mengerjakan laporan secara individual.
8. Catat semua hasil pada lembar data segera setelah percobaan selesai dan serahkan data hasil percobaan kepada asisten kelompok (Format data hasil pengamatan sementara terlampir, wajib difotokopi).
9. Hanya praktikan yang tidak hadir karena sakit (surat ijin dari dokter) dan tugas dari jurusan/fakultas/universitas, yang diperkenankan untuk mengikuti praktikum susulan, pada kelas yang lain.
10. Sanksi akan diberikan apabila praktikan melanggar instruksi ataupun melakukan kegiatan di luar aktifitas praktikum contoh mengerjakan tugas kuliah lain selama kegiatan praktikum, melakukan kegiatan yang membahayakan diri sendiri maupun praktikan lainnya, dll.
11. Praktikan yang tidak masuk 2 kali berturut-turut atau 3 kali tidak masuk dianggap mengundurkan diri.
II.Alat dan Reagenesia
1. Praktikan harus menyediakan sendiri jas labor yang dipakai sewaktu praktikum.
2. Semua alat yang dipakai harus dipinjam dengan bon dan dikembalikan kembali dalam keadaan bersih serta lengkap.
3. Peralatan-peralatan besar untuk pemakaian bersama terletak di luar meja kerja, di dalam ruang laboratorium. Harap dipergunakan dengan bertanggungjawab.
4. Botol-botol reagen harus diletakkan ditempat yang telah ditentukan dan tidak boleh dibawa ke meja masing-masing.
5. Botol reagen yang kosong/habis harus segera diberitahukan kepada asisten. 6. Sebelum praktikum dimulai, kelompok praktikan harap memeriksa
kesesuaian jumlah alat dengan daftar yang telah dipersiapkan oleh laboran. Bila ada ketidaksesuaian harus segera dilaporkan kepada asisten.
7. Jika ada alat yang hilang atau pecah selama praktikum, maka harus diganti secepatnya atau paling lambat sebelum akhir semester oleh kelompok mahasiswa yang bersangkutan. Bila lalai menggantikan alat akan dinyatakan gagal dan nilai tidak akan dikeluarkan.
III. Keselamatan Kerja
Laboratorium kimia adalah wilayah kerja yang berbahaya. Tidak dibenarkan bekerja seorang diri di laboratorium.
1. Setiap aktifitas dan selama berada di laboratorium, wajib berpakaian sewajarnya, memakai jas laboratorium sebagaimana mestinya, bersepatu, dan bila perlu menggunakan sarung tangan dan masker.
2. Rambut panjang atau jilbab harus dijepit rapi sehingga tidak mengganggu pekerjaan anda, menjerat peralatan atau terbakar api.
3. Mengetahui letak kotak P3K, pintu keluar/darurat dan pemadam kebakaran di area sekitar laboratorium. Jangan paksakan diri anda bekerja apabila kondisi fisik anda tidak sehat.
4. Bila bahan kimia jatuh mengenai kulit, segera bilas kulit dengan air mengalir dan laporkan ke asisten. Bila bahan kimia jatuh mengenai pakaian, lepaskan dan cuci kulit di bawahnya dengan air.
5. Jangan membaui campuran reaksi secara langsung. Kurangi keterpaparan diri anda oleh uap bahan kimia secara langsung. Jika ingin membaui sesuatu uap kipaslah uap tersebut dengan tangan ke muka anda.
6. Bekerjalah di lemari asam bila menggunakan konsentrasi yang pekat dan bahan berbahaya. Jebak uap beracun yang keluar dari reaksi ke dalam air atau bahan yang sesuai atau lakukan percobaan dalam lemari asam.
7. Untuk mengencerkan asam, tuang asam pekat ke dalam air, tidak sebaliknya. 8. Jangan menggosok-gosok mata atau anggota badan lain dengan tangan yang
mungkin sudah terkontaminasi bahan kimia.
9. Dilarang menggunakan HP/laptop, makan, minum dan merokok di dalam laboratorium.
IV.Kebersihan Laboratorium
1. Tidak diperkenankan membuang sampah di tempat cucian, sampah harus dibuang di tempat yang telah disediakan.
2. Jika ada zat yang tumpah harus segera disiram/dibersihkan dengan pencuci yang sesuai.
3. Jika terjadi kecelakaan harus segera beritahu asisten.
PERCOBAAN I STABILITAS DAN ISOLASI SENYAWA TEMBAGA (I)
TUJUAN
Mempelajari cara isolasi senyawa tembaga (I) melalui pembentukan senyawa kompleks tris (tiourea) tembaga (I) sulfat.
PENDAHULUAN
Dalam larutan berair, suatu unsur dapat ada dalam beberapa keadaan oksidasi. Tiap-tiap keadaan oksidasi mempunyai stabilitas termodinamika yang berbeda. Stabilitas relatif suatu unsur pada dua keadaan oksidasi yang berbeda dapat dinyatakan sebagai potensial elektroda berikut:
Ma+ + (a-b) e- → Mb+ b>a
Potensial elektroda reaksi ini dapat dinyatakan dalam persamaan berikut :
E = Eo
Dengan
n = jumlah elektron yang terlibat dalam reaksi F = bilangan Faraday
E = potensial eleketroda larutan Eo = potensial elektroda standar
[Ma+] = aktivitas ion Ma+ dalam larutan
[Mb+] = aktivitas ion Mb+ dalam larutan
Oleh karena itu, setiap spesies yang ditambahkan ke dalam larutan yang menurunkan konsentrasi Ma+ atau Mb+ akan menyebabkan perubahan potensial
elektroda karena perubahan rasio [Ma+]/[Mb+]. Potensial elektroda dari reaksi di
atas menunjukkan apakah stabilitas keadaan oksidasi yang lebih tinggi bertambah atau berkurang dengan adanya pembentukan suatu senyawa. Namun demikian, hal itu tidak memberikan informasi tentang bagaimana kenaikan atau penurunan stabilitas keadaan oksidasi yang tidak biasa dari logam.
Tembaga (3d10 4s1) mempunyai keadaan oksidasi +1 dan +2. Keadaan oksidasi
yang normal dari tembaga ada +2, tetapi senyawa yang mengandung Cu(I) yang sudah distabilkan dapat juga dibuat dalam suatu larutan berair.
1. Stabilitas Melalui Pembentukan Suatu Senyawa Tak Larut Potensial elektroda standar untuk reaksi reduksi Cu(I) dan Cu(II) ada di bawah ini:
Cu+ + e- ↔ Cu E = 0,52 kecenderungan berubah menjadi Cu(I) dan Cu(II).
2 Cu → Cu+ + Cu2+ E = 0,357 V
Dari persamaan:
E = Eo
Setiap spesies yang ditambahkan ke dalam larutan yang menurunkan konsentrasi Cu(I) akan menyebabkan naiknya harga potensial ion yang dapat membentuk garam tidak larut dengan Cu(I) tetapi tidak dengan Cu(II).
2. Stabilisasi Molekul Pembentukan Suatu Senyawa Larut
Selain melalui pembentukan suatu senyawa tak larut, stabilisasi Cu(I) dapat juga dilakukan dengan cara pembentukan senyawa kompleks yang terbentuk cukup stabil, maka konsentrasi Cu(I) yang tereduksi cukup berarti.
Dalam senyawa kompleks, di samping terjadi ikatan sigma antara logam pusat dengan ligan juga akan terjadi pemanfaatan elektron ion logam untuk pembentukan ikatan phi. Jika ion logam mempunyai kerapatan elektron yang tinggi, maka ion logam akan lebih siap untuk menyumbangkan elektron dalam pembentukan ikatan phi dengan ligan. Dengan adanya ikatan phi ini akan menyebabkan naiknya stabilitas ion kompleks. Dengan demikian suatu jenis ion logam dengan keadaan oksidasi yang lebih rendah akan lebih siap berpartisipasi dalam pembentukan ikatan phi. Untuk keperluan stabilisasi Cu(I) dalam larutan, tiourea merupakan ligan yang cocok. Senyawa kompleks yang terbentuk adalah
tris (tiourea) tembaga (I) dengan ikatan koordinasi terjadi antara ion Cu(I) dengan atom S dari tiourea.
ALAT-ALAT
1. Gelas ukur 10 mL 6. Pembakar bunsen 2. Gelas ukur 25 mL 7. Termometer 3. Gelas piala 100 mL 8. Timbangan 4. Batang pengaduk 9. Pipet tetes 5. Kertas saring
BAHAN-BAHAN
1. Tiourea 5. Asam Sulfat 1 M 2. Akuades 6. Alkohol
3. Tembaga (II) sulfat pentahidrat 7. Bubuk tembaga 4. Es Batu 8. HCl 1 M
CARA KERJA
1. Buat larutan tiourea (2,5 g) dalam 15 mL akuades dan larutan Tembaga (II) sulfat pentahidrat (2,5 g) dalam 15 mL akuades, kemudian dinginkan kedua larutan itu dalam tempat yang berisi es.
2. Tambahkan perlahan-lahan larutan Tembaga (II) sulfat penta hidrat ke dalam larutan tiourea sambil diaduk terus-menerus.
3. Setelah larutan Tembaga (II) sulfat penta hidrat habis ditambahkan, diamkan larutan campuran hingga terbentuk kristal putih pada dinding gelas piala. 4. Siapkan larutan tiourea dingin (0,1 g) dalam 10 mL akuades dan tambahkan
ke dalam campuran reaksi.
5. Aduk campuran reaksi secara cepat kemudian dinginkan.
6. Setelah jumlah kristal putih terbentuk maksimum, lakukan penyaringan untuk memisahkan kristal dari campuran reaksi.
7. Rekristalisai dilakukan dengan cara melarutkan kristal yang diperoleh kedalam larutan tiurea (0,1g) dalam 30 mL yang mengandung beberapa tetes asam sulfat 1 M.
8. Pelarutan dapat dipercepat dengan cara memanaskan larutan pada suhu maksimum 75 oC.
9. Dinginkan larutan dan saring kristal putih yang terbentuk.
10. Cuci kristal yang diperoleh dengan 5 mLakuades, kemudian dengan 5 mL alkohol.
11. Keringkan dan timbang. TUGAS
1. Gambarkan orbital-orbital ligan yang digunakan untuk stabilisasi keadaan oksidasi Cu(I) melalui ikatan phi!
2. Buat larutan tiourea (1 g) dalam 10 mL larutan HCl 1 M. Tambahkan sedikit bubuk tembaga dan hangatkan campuran itu perlahan-lahan. Ulangi percobaan ini dengan tanpa tiourea. Apa yang terjadi?
3. Perkirakan struktur ion kompleks yang dihasilkan pada percobaan! 4. Apa manfaat senyawa yang dihasilkan pada percobaan ini?
5. Jelaskan sifat-sifat kimia dan fisika tembaga (I)!
PERCOBAAN II MENELITI KESADAHAN AIR
TUJUAN
Mahasiswa dapat membedakan air lunak dan air keras. Mahasiswa dapat melunakkan air sadah dan menghitung derajat kesadahan.
PENDAHULUAN
Air yang mengandung ion Kalsium atau ion Magnesium disebut air sadah.Kesadahan sementara disebabkan oleh garam-garam Bikarbonat dari Ca dan Mg,Sedangkan kesadahan tetap oleh garam Sulfat dan Klorida dari Ca dan Mg. Besarnya kesadahan air dapat diukur antara lain dengan derajat kesadahan jerman yaitu jumlah gram CaO yang terdapat dalam 1 liter air. Air sadah dapat menimbulkan kerak pada ketel. Kesadahan sementara dapat dihilangkan dengan
pemanasan atau penambahan air kapur, sedangkan kesadahan tetap dengan lindi soda.
ALAT-ALAT
1. Tabung reaksi 7. Batang pengaduk 2. Rak tabung 8. Bunsen
3. Gelas ukur 100 mL 9. Pipet tetes 4. Gelas ukur 10 mL 10. Kaca arloji 5. Gelas piala 250 mL 11. Timbangan 6. Erlenmeyer 250 mL
BAHAN-BAHAN
1. Natrium klorida 7. Kalsium klorida 2. Kalium nitrat 8. Akuades
3. Natrium sulfat 9. Sabun
4. Besi (II) sulfat 10. Natrium karbonat 5. Magnesium klorida 11. Asam klorida 6. Magnesium sulfat
CARA KERJA
1. Ambil 7 buah tabung reaksi, masukkan ke dalam masing- masing tabung: Natrium Klorida, Kalium Nitrat, Natrium Sulfat, Besi (II) Sulfat, Magnesium Klorida, Magnesium Sulfat, Kalsium Klorida sebanyak 0,4 g dilarutkan dalam 5 mL akuades.
2. Buatlah larutan sabun dari 1 g sabun lemak dilarutkan dalam 100 mLakuades dan alkohol dengan volume yang sama.
3. Tuangi larutan larutan sabun ke dalam masing-masing tabung reaksi dengan volume yang sama, lalu kocoklah tabung-tabung reaksi tersebut.
4. Masukkan 25 ml air sadah sementara ke dalam erlenmeyer, lalu panaskan. 5. Buanglah filtratnya, kemudian pada sisa endapan tuangi Asam Klorida. 6. Periksalah gas yang keluar dengan batang pengadukyang telah dicelupkan
dalam air kapur.
TUGAS
1. Jelaskan apa yang dimaksud dengan kesadahan karbonat dan kesadahan nonkarbonat?
2. Mengapa kesadahan air yang tinggi dapat merugikan?
3. Amati tabung- tabung reaksi. Tentukan tabung reaksi yang tidak menunjukkan busa/buih! Jelaskan penyebabnya!
4. Tulislah persamaan reaksi cara kerja no 4-6. Kesimpulan apa yang kamu peroleh dari percobaan ini?
5. Tambahkan 1 g Na2CO3 pada 20 mL air sadah, lalu kocok- kocoklah,
kemudian tuangi beberapa mL sabun, Bagaimana pembentukan busa/buih sekarang?
6. Hitunglah air sadah dalam percobaan no. 1-3 dengan derajat kesadahan Jerman!
PERCOBAAN III PENETAPAN RUMUS MOLEKUL SENYAWA KOMPLEKS
TUJUAN
Mempelajari pembuatan dan penentuan rumus molekul senyawa kompleks besi (II) oksalat.
PENDAHULUAN
Reaksi antara dua molekul stabil atau lebih dapat menghasilkan produk reaksi yang stabil dengan sifat yang karakteristik. Sebagai contoh, kompleks amina akan terbentuk jika amina direaksikan dengan Kobalt (II) Klorida. Dalam beberapa hal kompleks tidak memberikan reaksi dalam larutan yang karakteristik pada ion logam atau ligan tidak kompleks. Tetapi stabilitas termodinamika dan kinetika bervariasi sehingga hal ini bukan merupakan kriteria pembentukan senyawa koordinasi.
Hakekat struktur senyawa koordinasi adalah transfer elektron yang terjadi anatara ligan dengan ion pusat (ion logam). Dalam bentuk yang paling sederhana, ikatan koordinasi terbentuk oleh transfer pasangan elektron dari ligan (molekul) ke ion pusat. Molekul netral atau ion-ion yang bertindak sebagai ligan harus memiliki pasangan elektron sumyi (elektron bebas) seperti NH3, Cl, C2O4, dan Lain-lain.
Senyawa koordinasi paling sederhana akan terbentuk dengan ikatan sigma antara suatu ligan dan suatu molekul atau ion logam. Beberapa kompleks dikenal dimana ikatan sigma atau iatan phi keduanya dapat terjadi. Kompleks yang terjadi pada ion oksalat memungkinkan ikatan phi dari orbital 2p pada oksigen mengkonstribusi sluruh ikatan. Dalam ligan yang lain seperti Karbon Monoksida (CO) dan Nitrosida (NO), kontribusi dari orbital ikatan phi berperan dalam seluruh ikatan. Gugus CO bereaksi dengan suatu logam yang mempunyai orbital kosong dan dua orbital d terisi untuk memberikan ikatan resultan dengan ikatan phi antara logam dan karbon. Sedangkan untuk NO memerlukan suatu logam yang mempunyai orbital sigma dan dua orbital d yang hanya mengandung tiga elektron. Hal ini dapat dikatakan bahwa derajat sumbangan elektron dapat diharapkan
4. Corong Buchner 9. Kaca arloji 5. Kertas saring 10. Timbangan
BAHAN-BAHAN
1. Ammonia besi (II) sulfat 5. Aseton 2. Asam oksalat 6. Kalium Permanganat 3. Asam sulfat 2 M 7. Serbuk Seng
4. Akuades 8. Larutan tiosulfat
CARA KERJA
1. Buatlah larutan ammonia besi (II) sulfat dan larutan asam oksalat dengan cara melarutkan 8 g ammonia besi (II) sulfat dalam 25 mL akuades yang telah diasamkan dengan 1 mL asam sulfat 2 M, larutan asam oksalat dibuat dengan melarutkan 5 g asam oksalat dalam 30 mL akuades.
2. Campurkan larutan asam oksalat tersebut ke dalam larutan ammonia besi (II) sulfat, kemudian didihkan.
3. Saring endapan kuning yang terbentuk dengan corong buchner dan cuci endapan dengan air panas, lalu cuci kembali dengan Aseton dan keringkan. 4. Setelah endapan dikeringkan tentukan rendemen dan komposisihasil sintesis.
Penentuan komposisi hasil sintesis
a. Larutkan0,2-0,3 g hasil sintesis yang didapat dalam asam sulfat 2 M, kemudian dititrasi dengan larutan standar kalium permanganat. Jika warna kalium permanganat memucat, panaskan larutan sampai suhu 60oC dan lanjutkan titrasi sampai tercapai titik ekivalen.
b. Didihkan larutan dengan 2 g serbuk seng selama 10 menit. Tes larutan dengan satu tetes larutan Tiosulfat, jika muncul warna merah jambu hentikan titrasi. Tetapi jika tidak ada warna merah jambu teruskan pendidihan selama 5 menit.
c. Saring larutan dengan kertas saring dan cuci serbuk seng dengan asam sulfat 2 M.
d. Titrasi campuran filtrat Ammonia Besi (II) Sulfat dan hasil cucian dengan larutan standar kalium permanganat, dari hasil tersebut tentukan kadar oksalat dan kadar airnya. Tentukan pula rumus empirisnya.
TUGAS
1. Apa yang dimaksud dengan senyawa kompleks?
2. Jelaskan apa yang dimaksud dengan ikatan sigma dan ikatan phi pada senyawa kompleks!
3. Buatlah reaksi kimia antara ammonia besi (II) sulfat dengan asam oksalat? 4. Buatlah struktur kimia senyawa kompleks yang dihasilkan pada percobaan
ini!
5. Jelaskan manfaat/kegunaan dari senyawa kompleks yang dihasilkan pada percobaan ini!
PERCOBAAN IV PEMBUATAN NATRIUM PEROKSOBORAT
TUJUAN
Mempelajari pembuatan natrium peroksoborat dan manfaatnya di dalam kehidupan sehari-hari.
PENDAHULUAN
Natrium peroksoborat atau yang lebih dikenal natrium perborat adalah senyawa putih, tidak berbau, larut dalam air dengan rumus kimia NaBO3.
Senyawa ini mengkristal sebagai monohidrat, NaBO3.H2O,
trihidrat, NaBO3.3H2O, dan tetrahidrat, NaBO3.4H2O. monohidrat dan tetrahidrat
adalah bentuk komersial penting dari senyawa ini.Natrium perborat di dalam dunia tekstil digunakan sebagai zat pengelantang yang bersifat oksidator, yaitu menghilangkan warna kekuning-kuningan yang ada pada bahan tekstil yang disebabkan oleh pigmen-pigmen alam.
ALAT-ALAT
1. Gelas piala 100 mL 6. Corong buchner 2. Gelas piala 1000 mL 7. Kertas saring 3. Gelas ukur 10 mL 8. Kaca arloji 4. Batang pengaduk 9. Spatula 5. Pipet tetes 10. Timbangan BAHAN-BAHAN
1. Natrium tetra boraks dekahidrat 6. Alkohol 2. Natrium hidroksida 3,3 % 7. Akuades 3. Es Batu 8. H2SO4 2 M hidrogen peroksida 6 %.
3. Aduk kira-kira 20 menit atau sampai kristal terbentuk dengan sempurna.
4. Saring dengan alat penghisap.
5. Cuci dengan dengan alkohol, kemudian keringkan. Pengujian hasil
Gunakan 5 mL larutan segar dalam akuades dari zat tersebut, lalukan reaksi berikut!
a. Tambahkan H2SO4 2 M dan KMnO4 0,02 M, lalu amati apa yang terjadi!
b. Tambahkan H2SO4 2 M dan larutan KI 10 %, lalu amati apa yang terjadi!
TUGAS
1. Tuliskan reaksi kimia pembuatan natrium peroksoborat! 2. Buatlah struktur kimia natrium peroksoborat!
3. Sebutkan manfaat lainnya dari natrium peroksobat di dalam kehidupan seharihari!
4. Mengapa natrium peroksoborat pada percobaan perlu dilakukan pengujian hasil? Jelaskan kegunaannya!
5. Tuliskan reaksi kimia yang terjadi pada pengujian hasil bagian a dan b pada percobaan di atas!
PERCOBAAN V MENGENDAPKAN GARAM, MELARUTKAN DAN MENELITINYA
TUJUAN
Mengenal sifat-sifat bahan kimia dan mempelajari cara mengendapkan zat, menyaring endapan serta menuliskan persamaan reaksi penggaraman bersyarat.
PENDAHULUAN
Garam-garam Nitrat semua dapat larut, kecuali garam dari logam Alkali. Maka garam-garam karbonat, fosfat, tiosianat dan sulfat dari Ca, Ba dan Sr tidak dapat larut. Endapan-endapan itu biasanya mempunyai warna tertentu. Bila dari
suatu reaksi kimia terjadi endapan maka endapan itu dapat diteliti dari warna
3. Natrium karbonat 0,1 N 4. Besi (III) nitrat
1. Masukkan 1 g barium klorida ke dalam tabung reaksi, lalu larutkan dalam 5 mL akuades, tambahkan setetes demi setetes larutan natrium karbonat 0,1 N. 2. Bila terjadi endapan saringlah endapan itu.
3. Periksa endapan itu dengan memasukkannya sedikit ke dalam tabung reaksi, lalu tuangkan 2 tetes asam klorida, kemudian kocok. Sedikit endapan yang lain diperiksa dengan 2 tetes asam sulfat.
4. Larutkan 1 g besi (III) nitrat ke dalam 5 mL akuades.
5. Tambahkan ammonium hidroksida berlebihkan sehingga lakmus merah yang dicelupkan kedalam reaktan menjadi biru.
6. Saring endapan yang diperoleh, sebagian diperiksa dengan menambahkan Asam Klorida dan sebagian yang lain dilarutkan dengan asam sulfat, kemudian ditambahkan larutan Natrium tiosianat.
TUGAS
1. Tuliskan semua persamaan reaksi percobaan-percobaan di atas! 2. Apa yang dimaksud dengan reaksi penetralan!
3. Catatlah warna endapan yang terjadi!
4. Apa yang dimaksud dengan reaksi penggaraman bersyarat?
5. Jelaskan apa yang dimaksud dengan rekristalisasi!
PERCOBAAN VI PEMBUATAN SODA KOSTIK PREPARATIF
TUJUAN
Mempelajari cara pembuatan soda kostik sesuai dengan teori dan mengenal sifat-sifat fisika dan kimia dari soda kostik.
PENDAHULUAN
NaOH ini dapat diperoleh melalui reaksi penggaraman antara garam karbonat dan basa. Reaksi penggaraman adalah suatu reaksi bersyarat dimana harus terjadi endapan sesudah reaksi. Basa yang digunakan diperoleh dengan kapur hidup dalam air dan selanjutnya direaksikan dengan larutan natrium karbonat. Reaksi yang terjadi adalah:
CaO + H2O → Ca(OH)2 + Kalori
Ca(OH)2 + Na2CO3 → 2 NaOH + CaCO3
ALAT-ALAT
1. Timbangan 6. Bunsen 2. Kaca arloji 7. Kertas saring 3. Spatula 8. Corong buchner
4. Gelas piala 100 mL 9. Gelas ukur 10 mL 5. Batang pengaduk 10. Gelas ukur 50 mL BAHAN-BAHAN
1. Kalsium oksida 3. Natrium karbonat 2. Akuades (Na2CO3.10H2O)
CARA KERJA
1. Timbang 5,6 g CaO dan larutkan dalam 50 ml akuades dan aduk sampai menjadi bubur.
2. Panaskan dalam oven (105oC), 20 g NaC0
3.10 H20 selama 1 jam.
3. Dinginkan dan kemudian timbanglah 10,6 g dari padanya untuk dilarutkan dalam 100 ml air. Agar lebih cepat dan mudah melarutkan perlu dipanaskan sampai mendidih dan diaduk.
4. Kemudian campurkan kedua larutan di atas, aduk lalu didihkan lagi selama beberapa lama.
5. Setelah dingin, saring dengan kertas saring yang telah ditimbang dulu untuk mengetahui beratnya. Maka filtrat yang diperoleh adalah larutan soda kostik, dan ditampung untuk disimpan, sedangkan endapan yang terjadi dikeringkan dalam oven pada suhu 105 oC di atas kaca arloji selama 1 jam.
6. Periksalah filtrat yang diperoleh dengan kertas lakmus merah. 7. Setelah dingin, timbang endapan untuk mengetahui beratnya. TUGAS
1. Buatlah reaksi kimia pembuatan soda kostik pada percobaan ini!
2. Menurut percobaan di atas, berapa CaCO3 yang diperoleh? Bandingkan
dengan hasil teoritis menurut perhitungan reaksi di atas! Mengapa terjadi perbedaan?
3. Mengapa reaksi di atas harus dilakukan dalam bentuk cairan. Syarat-syarat apa yang harus dipenuhi supaya reaksi seperti dalam percobaan itu bisa terjadi?
4. Jelaskan apa yang dimaksud preparatif pada percobaan ini! 5. Sebutkan manfaat soda kostik dalam kehidupan sehari-hari!
PERCOBAAN VII PEMBUATAN DAN PEMURNIAN KALIUM IODAT
TUJUAN
Mengenal salah satu pembuatan kalium iodat, memurnikan dan menganalisanya. Mendapatkan latihan untuk teknik-teknik dasar yang sering digunakan dalam pembuatan preparat maupun pekerjaan analisa.
PENDAHULUAN
Banyak cara untuk membuat dan menganalisa suatu preparat. Pemilihan cara pembuatan yang tepat banyak, tergantung kepada bahan baku dan alat yang tersedia, hasil yang dicapai, biaya, dan pada syarat-syarat yang diperlukan pada proses pembuatannya. Begitu pula cara menganalisa zat sangat tergantung kepada
2 (dua) faktor terakhir. Salah satu cara pembuatan dan analisa akan kita kerjakan pada percobaan ini.
Pembuatan dan Pemurnian Preparatif
Tahap I. Iodat dioksidasi oleh kalium klorat yang dilakukan pada suasana asam yang sedang dalam keadaan panas.
Tahap II. Karena pada pendinginan, campuran reaksi selain kalium iodat juga terbentuk kalium hidroiodat, maka sebelum didinginkan larutan harus dinetralkan dulu dengan KOH. Pada pendinginan, kalium iodat akan mengendap.
Reaksi-reaksi yang berlangsung sebagai berikut: Tahap I
Reaksi samping yang mungkin terjadi adalah:
2 ClO3- + 12 H+ + 10 e- → Cl2 + 6 H2O
2 Cl + 2 e- → Cl 2
Pemurnian produk yang terjadi dikerjakan melalui pengkristalan kembali dan pengeringan.
Sifat-sifat bahan baku dan preparat
Iodium : zat berkristal ungu kehitaman, titik leleh 113,7 oC, kelarutan dalam air
kecil
Kalium klorat : zat berkristal putih, kelarutan dalam air sedang, 7 g/100 mL pada suhu 200 oC dan 57 g/100 mL pada 100 oC.
Kalium iodat : zat berkristal putih, kelarutan dalam air, 5 g/100 mL pada 0 oC dan
32g/100 mL pada 100 oC.
ALAT-ALAT
1. Statif 10. Corong
2. Ring besi 11. Akuades
3. Kasa 12. Gelas piala 500 mL 4. Kaki tiga 13. Pipet tetes
5. Labu bulat 14. Kertas indikator 6. Timbangan 15. Corong buchner 7. Spatula 16. Buret
8. Kaca arloji 17. Kertas saring 9. Bunsen 18. Gelas ukur 50 mL
1. Pasang ring besi (10 cm) pada statif, letakkan kasa di bawahnya. Pasang labu bulat 500 mL pada statif sehingga dasar labu tepat menyentuh kawat kasa. Tinggi pemasangan hendaknya sedemikian rupa hingga dapat diletakkan pembakar di bawahnya.
2. Timbang 31 g KCIO3 dan 36 g I2.
3. Masukkan 31 g KCIO3 beserta 100 mL akuades ke dalam labu bulat,
panaskan campuran ini hingga semua kalium klorat larut.
4. Singkirkan pembakar, kemudian tambahkan 36 g I2 dan 1 ml HNO3 6 M.
5. Tutup mulut labu dengan suatu corong (penyaring kualitatif).
6. Bila uap iodin ada keluar maka dinginkan labu tadi dalam bak berisi air dingin. Untuk menyempurnakan reaksinya labu dipanaskan dengan api kecil sambil kadang- kadang di goyang- goyang perlahan- lahan agar sisa iodin yang masih menempel di dinding labu terkena larutan kloratnya.
7. Masukkan akuades bebas ion ke dalamnya.
8. Ambil corong dari mulut labu, didihkan larutan tadi selama 10 menit.
9. Tuangkan isi labu ke dalam gelas piala 500 ml. Letakkan gelas piala ini pada kawat kasa di atas kaki tiga, panaskan larutan agar tetap mendidih.
10. Sementara larutan tetap mendidih dengan tambahkan KOH tetes demi tetes sampai larutan netral. Periksa dengan kertas indikator.
11. Biarkan pada suhu kamar sampai larutan dingin, kumpulkan kristal yang terbentuk dalam penyaring buchener. Larutan berubah menjadi tidak bewarna. 12. Ulangi titrasi sampai 3 kali hingga selisih ketiga harga tersebut maksimum
0,05 mL.
13. Hitung kadar iodat tersebut. TUGAS
1. Sebutkan manfaat kalium iodat dalam kehidupan sehari-hari!
2. Tuliskan rumus molekul dari senyawa-senyawa berikut ini! Kalium klorat, iodium, akuades, asam nitrat, kalium hidroksida.
3. Mengapa pada cara kerja no 10 harus ditambahkan KOH sampai lautan netral?
4. Jelaskan apa yang dimaksud dengan preparat dan preparatif?
5. Sebutkan faktor –faktor yang perlu diperhatikan dalam melakukan analisa?
PERCOBAAN VIII SENYAWA KOMPLEKS DARI Na2C2O4 dan H2C2O4
TUJUAN
Mempelajari pembuatan dan penentuan stoikiometri senyawa kompleks dari Na2C2O4 dan H2C2O4.
PENDAHULUAN
Senyawa kompleks merupakan senyawa yang tersusun dari suatu ion logam pusat dengan satu atau lebih ligan yang menyumbangkan pasangan elektron bebasnya kepada ion logam. Semua senyawa kompleks atau senyawa koordinasi adalah senyawa yang terjadi karena adanya ikatan kovalen koordinasi antara logam transisi dengan satu atau lebih ligan.
ALAT-ALAT
1. Kaca arloji 8. Termometer 2. Spatula 9. Es batu
3. Timbangan 10. Kertas saring
4. Gelas piala 50 mL 11. Corong
1. Siapkan larutan I yang mengandung 1,84 g (0,01 mol) Na₂C₂O₄ dalam 10 mL akuades.
2. Siapkan larutan II yang mengandung 4,50 g (0,036 mol) H₂C₂O₄.2H₂O dalam 40 mL air panas.
3. Tambahkan larutan I ke dalam larutan II sambil diaduk.
4. Dinginkan larutan sampai mendekati 0 ˚C dengan menempatkan bejana ke dalam wadah yang berisi es batu.
5. Setelah didinginkan selama 20 menit, dekantasi larutan jenuh (supernatan) melalui kertas saring yang kasar.
6. Buang filtrat, larutkan kembali endapan yang tertinggal dalam bejana dan pada kertas saring dalam air 50 mL yang mendidih.
7. Dinginkan kembali bejana gelas dalam pendinginan selama 20 menit.
8. Pindahkan endapan ke dalam kertas saring dan buang larutannya. Cuci hasil endapan 3 kali dengan 10 mL alkohol secara bertahap untuk menghilangkan air yang melekat (terikat) pada kristal. Setelah hasil dibersihkan dengan hatihati dari filtrate ke kaca arloji, hasil disebarkan sedemikian rupa untuk mempercepat penguapan alkohol. Jika hasil sudah tampak kering, timbang. 9. Keringkan kembali dalam oven pada 105 oC selam 30 menit untuk
menghilangkan air yang terhidrat dan timbang kembali.
10. Catat pH terhadap volume NaOH standar dan harus diperoleh 2 titik akhir yang berbeda, liat perbandingan dari kedua titik akhir.
11. Dari data yang didapat, tentukan RM senyawa tersebut. Sebagai kenyataan hasil tersebut mengandung H⁺ , Na⁺, C₂O₄⁻2 dalam Na₂H₂(C₂O₄) dengan
x,y dan z adalah bilangan bulat, simpulkan rumus senyawa dengan tepat sesuai dengan RM yang telah ditentukan sebelumnya.
12. Tentukan berapa mol air per mol senyawa tersebut setelah dikeringkan di udara. Kemungkinan lain: anion oksalat dapat ditentukan dengan titrasi memakai KMnO₄ sebagai standar.
Reaksi : 16 H⁺ + 5 C₂O₄⁻ + 2 MnO₄ → 10 CO₂ + 2Mn2+ + 8 H₂O
TUGAS
1. Apa yang dimaksud dengan senyawa kompleks? 2. Jelaskan pengertian ligan!
3. Jelaskan tentang pembagian ligan berdasarkan jumlah elektron yang dapat disumbangkan pada atom logam!
4. Berikan contoh manfaat senyawa kompleks dalam kehidupan sehari-hari! 5. Sebutkan syarat-syarat terbentuknya senyawa kompleks!
PERCOBAAN IX PEMBUATAN ZEOLIT
TUJUAN
Mempelajari pembuatan zeolit dan mengetahui sifat-sifat kimia dan fisikanya.
PENDAHULUAN
Mineral zeolit telah dikenal sejak Tahun 1756 oleh Baron Freiherr Axel Cronsted ketika menemukan stilbit yang bila dipanaskan seperti batuan mendidih (boiling stone). Hal ini disebabkan karena dehidrasi molekul air yang dikandungnya. Istilah zeolit sendiri berasal dari bahasa Yunani Zein yang berartimembuih dan lithos yang berarti batu, sehingga zeolit berarti batu yang berbuih.
Zeolit merupakan mineral yang terdiri dari kristal alumina silika terhidrasi yang mengandung kation alkali atau alkali tanah dalam kerangka tiga dimensi, dimana kationnya dapat diganti oleh kation lain tanpa menyebabkan perubahan pada struktur zeolit dan dapat menyerap air secara reversibel. Zeolit mempunyai
rongga dan celah dengan luas permukaan dalam yang jauh lebih besar dari pada luas permukaan kristal bagian luarnya.
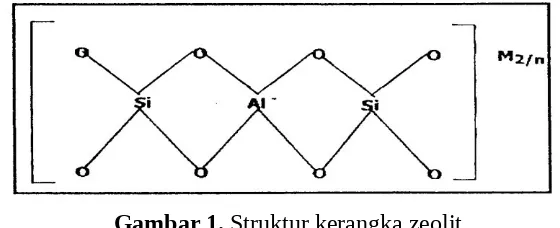
Struktur kimia sel zeolit dengan sisa aktifnya dapat digambarkan sebagai berikut :
Gambar 1. Struktur kerangka zeolit
Tipe-tipe zeolit dapat dikarakterisasi berdasarkan topologi tertentu dalam kerangka. Sisi aktif inilah yang dapat menyebabkan zeolit memiliki kemampuan sebagai penukar ion, adsorben dan katalis.
Pada struktur zeolit di atas atom Al yang berbentuk tetrahedral yang menyebabkan atom Al tersebut akan bermuatan negatif karena berkoordinasi dengan empat atom oksigen dan selalu dinetralkan oleh kation alkali dan alkali tanah untuk mencapai senyawa yang stabil.
Rumus empiris zeolit yaitu :
(Mx/n[(AlO2)x(SiO2)v]mH2O Keterangan:
M : Kation logam yang dapat saling ditukarkan n : Valensi kation M m : Jumlah molekul air perunit x,y : Menyatakan banyaknya atom Al dan Si
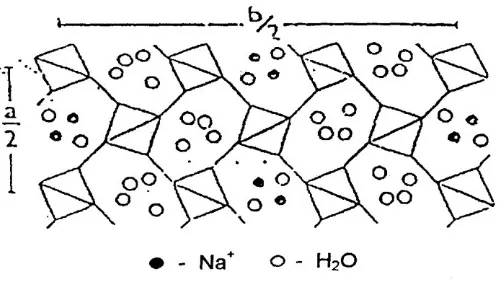
Struktur kristal zeolit merupkan gabungan dari sejumlah unit pembangun sekunder yang tersusun sedemikian rupa sehingga membentuk rongga-rongga dan saluran. Rongga-ronga dan saluran ini berisi kation dan molekul air. Kation-kation tersebut tidak terikat pada posisi yang tepat melainkan dapat digantikan dengan kation lain tanpa merusak struktur zeolit, karena molekul air juga dapat bergerak bebas dalam rongga, maka zeolit dapat menyerap air secara reversibel. Posisi kation dan molekul air dalam rongga zeolit dapat ditunjukkan pada gambar di bawah ini :
Gambar 2. Posisi kation dan molekul air dalam rongga zeolit.
Peleburan Abu Layang dengan NaOH
1. Leburkan 25 g abu layang dengan 20 g NaOH dalam furnace pada suhu 500oC selama 15 menit.
2. Dinginkan campuran dalam desikator. Pembuatan larutan Natrium Silikat
1. Setelah dingin, Larutkan campuran leburan dengan akuades secukupnya lalu dibiarkan selama 1 malam agar larut sempurna.
2. Saring larutan yang terbentuk dan encerkan dengan akuades hingga volume 250 mL.
Pembuatan Larutan Natrium Aluminat
1. Larutan aluminat dibuat dengan melarutkan 30,5 g NaOH dalam 100 mL akuades.
2. Panaskan agar larut sempurna, campuran diaduk.
3. Secara perlahan-lahan tambahkan 21,65 g Al(OH)3 sambil diaduk hingga
terbentuk larutan bening.
4. Setelah semua Al(OH)3 melarut kemudian encerkan hingga volume 250
mL dengan akuades. Mensintesis Zeolit
1. Zeolit disintesis dengan menambahkan larutan natrium aluminat secara perlahan-lahan ke dalam larutan natrium silikat sambil diaduk hingga homogen selama 3 jam,
2. Lalu terbentuk gel berwarna putih.
3. Saring gel yang terbentuk kemudian panaskan pada suhu 80oC selama 8
jam.
4. Kristal yang terbentuk dicuci dengan akuades. TUGAS
1. Sebutkan dan jelaskan jenis-jenis zeolit! 2. Sebutkan dan jelaskan karakteristik zeolit!
3. Sebutkan metode apa saja yang digunakan untuk menentukan karakteristik zeolit!
4. Sebutkan dan jelaskan aplikasi penggunaan zeolit dalam kehidupan seharisehari maupun dalam industri!
5. Termasuk jenis apakah yang disintesis pada percobaan ini?
PANDUAN PENULISAN JURNAL DAN LAPORAN PRAKTIKUM I. Jurnal Praktikum
1. Setiap praktikum wajib membuat jurnal praktikum tentang percobaan yang akan dilakukan. Praktikan yang tidak membuat jurnal praktikum tidak diperkenankan mengikuti praktikum.
2. Jurnal praktikum ditulis menggunakan buku disampul hitam. 3. Penulisan jurnal praktikum mengikuti format berikut ini:
Judul 3.2.Bahan yang diperlukan I. Tujuan Percobaan 1. ….
1.1.… 2. Dan seterusnya
1.2. Dan seterusnya IV. Skema Kerja II. Landasan Teori V. Tugas
III. Alat dan Bahan 1. …
3.1.Alat yang diperlukan 2. Dan seterusnya 1. … VI. Daftar Pustaka (minimal 5
2. Dan seterusnya dari jurnal/buku) II. Laporan Praktikum
1. Setiap percobaan yang dilakukan, praktikan diwajibkan membuat laporan praktikum pada kertas A4 sesuai format yang disediakan.
2. Penulisan laporan praktikum mengikuti format berikut ini (penulisan poin
disesuaikan dengan jurnal praktikum): Cover (Contoh terlampir)
Judul
I. Tujuan Percobaan II. Landasan Teori III.
Alat dan Bahan
3.1. Alat yang digunakan 3.2. Bahan yang digunakan IV. Skema Kerja
XI. Lampiran (foto hasil akhir percobaan beserta keterangan, bukan proses kerja dan lampiran tinjauan pustaka)
DATA HASIL PENGAMATAN SEMENTARA
Judul Percobaan : Hari, Tanggal Percobaan : Kelas/Kelompok :
Nama Anggota :
Mengetahui, Asisten Percobaan
( )
LABORATORIUM KIMIA ANORGANIK JURUSAN KIMIA FMIPA UNIVERSITAS RIAU LEMBARAN ALAT DAN BAHAN
PRAKTIKUM KIMIA ANORGANIK II
Judul Praktikum/ No Percobaan : Hari/Tanggal : Kelas/Kelompok : Nama Asisten :
No Alat Jumlah Keterangan
No Bahan Jumlah Keterangan
Pekanbaru,…………2016 Praktikan Asisten
Respon Praktikum Kimia Anorganik II
Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Riau
Judul Percobaan : Hari/Tanggal : Kelas/Kelompok : Nama Asisten :
Praktikan Asisten
Contoh Cover
LAPORAN PRAKTIKUM KIMIA ANORGANIK II STABILITAS DAN ISOLASI SENYAWA TEMBAGA (I)
OLEH :
NAMA : MEGA WATY
NIM :
1303112413 KELAS/KELOMPOK : C/VII (TUJUH)
TANGGAL PERCOBAAN 201
Laporan Praktikum Kimia Anorganik II