24 III. BAHAN DAN METODE
A. BAHAN DAN ALAT 1. Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah bahan untuk membuat ekstrak sayuran dan bahan untuk analisis. Bahan-bahan yang digunakan dalam pembuatan ekstrak sayuran adalah daun kenikir, bunga kecombrang, daun kemangi, daun katuk, daun pohpohan, daun ginseng, kucai, takokak, daun lembayung, terubuk, daun labu, bunga pepaya, pucuk mete dan daun pakis yang diperoleh dari Pasar Bogor. Daun beluntas, daun mangkokan putih, daun mangkokan, daun kendondong cina, antanan, antanan beurit, krokot, bunga turi, daun kelor dan pucuk mengkudu yang diperoleh dari kebun penduduk di daerah Dramaga, Bogor.
Bahan untuk analisis total karotenoid adalah heksana dan aseton (Brataco Chemica), KOH (BDH), metanol (Merck) dan asam asetat (Merck). Bahan untuk analisis β-karoten adalah metanol (Merck), kloroform (Merck) dan asetonitril (Merck), serta standar β-karoten (C4582-5MG, Sigma-Aldrich). Bahan yang digunakan untuk analisis antosianin adalah etanol (Merck) dan HCl (Merck). Bahan untuk analisis asam askorbat adalah soluble starch (Merck), KI (Merck) dan Iodium (Merck).
2. Alat
Alat-alat yang digunakan dalam penelitian ini adalah alat untuk membuat ekstrak sayuran dan alat untuk analisis. Alat-alat yang digunakan untuk membuat ekstrak sayuran adalah freezer, freeze dryer, blender kering, dan baskom. Analisis total karotenoid menggunakan alat-alat, antara lain neraca analitik, sudip, pipet mohr, labu takar, corong, gelas ukur, pompa vakum, kertas saring Whatman 42, tabung reaksi bertutup, vortex, alat sonifikasi, sentrifuse, tabung sentrifuse, kuvet dan spektrofotometer. Untuk analisis β-karoten alat-alat yang digunakan
25 adalah pipet mohr, tabung reaksi bertutup, vortex, freezer, membran 0.22 µm, dan sistem HPLC dengan spesifikasi seperti pada Tabel 6.
Alat-alat yang digunakan untuk analisis antosianin adalah neraca analitik, sudip, gelas piala, gelas ukur, labu takar, corong, kertas saring Whatman No.1, penyaring vakum, pipet mohr, tabung reaksi, kuvet dan spektrofotometer. Alat-alat yang digunakan untuk analisis asam askorbat adalah neraca analitik, mortar/waring blender, sudip, gelas piala, magnetic stirrer, labu takar, corong, erlenmeyer, pipet mohr, pompa vakum, kertas saring Whatman No.1, dan buret mikro.
Tabel 6. Spesifikasi HPLC untuk analisis β-karoten
Komponen HPLC Tipe
Solvent cabinet Shimadzu LC-20AD
Degasser Shimadzu DGU-20A5
Pump Shimadzu LC 20-AD
Detector UV-Vis Shimadzu SPD-20A, λ= 450 nm Manual injector Hewlett Packard Series 1100
Injector Rheodyne 20 µL
Syringe Agilent Technologies, LC 50 µL
Column C-18; 4.6x150 mm; Develosil
ODS-UG-3 (Mfg. No. 2510689), Nomura Chemical
Mobile phase Metanol:asetonitril:kloroform (48.5:48.5:3.0)
Flow rate 0.8 ml/min (isocratic)
B. METODE
Penelitian ini dilakukan dalam beberapa tahap. Tahapan yang akan dilakukan adalah 1) persiapan sampel; 2) analisis sampel; 3) analisis statistik data; 4) analisis potensi. Analisis utama pada sampel dilakukan secara duplo untuk dua ulangan.
26 1. Persiapan Sampel
Bagian tanaman kenikir, beluntas, mangkokan, kemangi, katuk, kedondong cina, pohpohan, daun ginseng, kelor, labu, lembayung, mangkokan, jambu mete, mengkudu, pakis, yang digunakan dalam penelitian ini adalah bagian daun yang masih muda. Daun muda atau pucuk ini dapat dilihat dari warna daun yang lebih muda dibandingkan dengan daun pada bagian lainnya pada tanaman tersebut. Bagian tanaman antanan, antanan beurit dan kucai yang digunakan dalam penelitian ini adalah seluruh bagiannya, sedangkan untuk tanaman kecombrang, turi, terubuk, dan pepaya, bagian yang digunakan dalam penelitian ini adalah bunganya. Bagian tanaman takokak yang digunakan dalam penelitian ini adalah buahnya dan bagian tanaman krokot yang digunakan adalah daun dan batangnya. Pemilihan bagian-bagian tanaman ini didasarkan pada bagian-bagian yang biasa dikonsumsi masyarakat.
Mula-mula sayuran dicuci bersih dan ditiriskan, kemudian dilakukan pengecilan ukuran sayuran (pemotongan). Setelah itu, sayuran dikemas dalam kantung plastik dan dibekukan dalam freezer selama satu malam untuk memudahkan proses pengeringan vakum. Selanjutnya sayuran dikeringkan dengan freeze dryer selama satu sampai dua hari tergantung dari banyaknya sampel. Setelah sampel menjadi kering, dilakukan penghancuran sampel menggunakan blender kering sampai dihasilkan sampel kering bubuk yang lolos ayakan 32 mesh. Sampel tersebut kemudian dikemas dalam plastik ber-seal dan disimpan dalam freezer. Sampel ini telah siap untuk digunakan dalam analisis selanjutnya. Tahap persiapan sampel dapat dilihat pada Gambar 6.
27 Gambar 6. Diagram alir persiapan sampel sayuran untuk analisis
Pengemasan dalam plastik ber-seal Penghancuran dengan blender kering
Dry basis beku (bubuk) lolos ayakan 32 mesh Freeze drying selama 48 jam
Dry basis beku Sampel
Pencucian dan Penirisan
Pembekuan selama 24 jam Pemotongan
28 2. Analisis Sampel
a. Analisis Kadar Air (AOAC, 1984)
Penetapan kadar air merupakan cara untuk mengukur banyaknya air yang terdapat di dalam suatu bahan pangan. Analisis kadar air dilakukan pada sampel sayuran segar (awal) dan pada sampel sayuran setelah freeze drying. Penentuan kadar air ini dilakukan dengan metode pengeringan dengan oven biasa.
Persiapan yang dilakukan adalah cawan alumunium yang akan digunakan terlebih dahulu dikeringkan dalam oven pada suhu 100oC selama 15 menit kemudian didinginkan dalam desikator selama 10 menit. Selanjutnya cawan ditimbang dengan menggunakan neraca analitik. Sampel ditimbang sebanyak 3-4 gram kemudian dikeringkan dalam oven bersuhu 100-105°C selama kurang lebih 6 jam. Setelah itu, didinginkan dalam desikator kemudian ditimbang. Contoh kembali dikeringkan dalam oven selama 30 menit lalu ditimbang kembali. Perlakuan terakhir ini diulangi terus hingga diperoleh berat kering yang relatif konstan (berat dianggap konstan jika selisih berat sampel kering yang ditimbang ≤ 0,0003 gram).
Kadar air (%) = x 100%
Keterangan:
W = bobot contoh sebelum dikeringkan (g)
W1 = bobot (contoh + cawan) sesudah dikeringkan (g) W2 = bobot cawan kosong (g)
b. Analisis Kadar Protein, Metode Mikro Kjehldal (AOAC, 1995) Sebanyak ±0.1 gram contoh ditimbang kemudian dimasukan ke dalam labu kjeldahl, lalu ditambahkan 1.0 + 0.1 gram K2SO4, 40 + 10 ml HgO, dan 2.0 + 0.1 ml H2SO4, kemudian contoh didihkan selama 1-1.5 jam sampai cairan jernih. Larutan jernih ini kemudian didinginkan, lalu dipindahkan ke dalam alat destilasi. Labu Kjehldahl dicuci dengan
W – (W1 – W2) W
29 air 5-6 kali dengan 1-2 ml air. Air cuciannnya dimasukan ke dalam alat destilasi dan ditambahkan dengan 8-10 ml larutan NaOH – Na2S2O3.
Di bawah kondensor diletakan erlenmeyer yang berisi 5 ml larutan H3BO3 3% dan 3 tetes indikator (campuran 2 bagian merah metil 0.2% dalam alkohol). Ujung tabung kondensor harus terendam dalam larutan H3BO3 kemudian isi erlemeyer diencerkan sampai 50 ml lalu dititrasi dengan HCl 0.02 N sampai terjadi perubahan warna menjadi abu-abu. Dilakukan pula terhadap blanko.
% 100 007 . 14 ) ( % X Contoh mg X HCl N X blanko HCL ml contoh HCl ml N % Protein= %N X 6.25
c. Analisis Total Karotenoid (Zakaria et al., 2000)
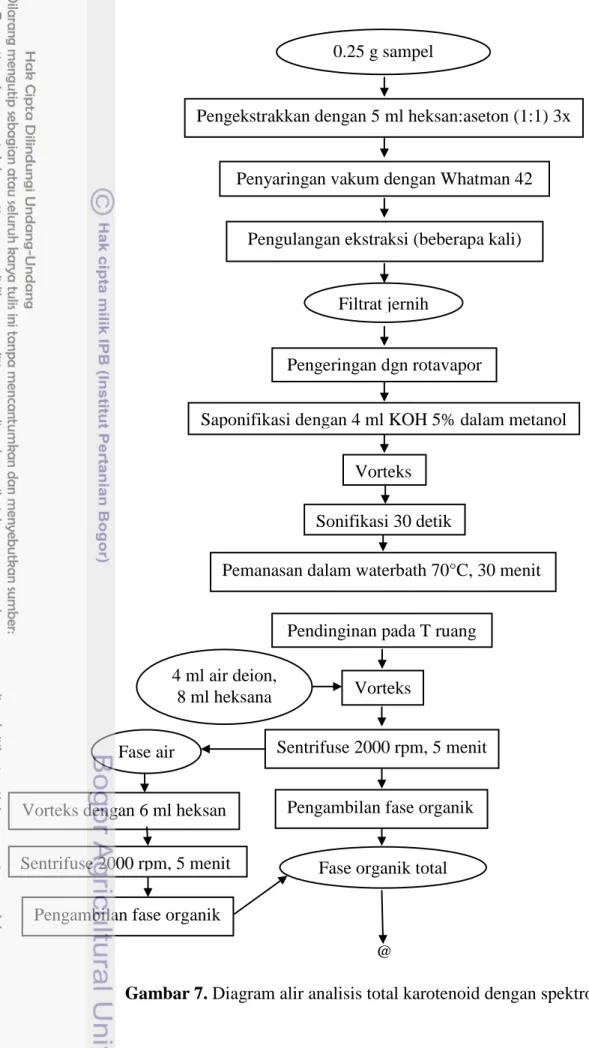
Sebanyak 0.25 gram sampel diekstrak dengan 5 ml heksan:aseton (1:1) tiga kali dan disaring vakum dengan kertas Whatman 42. Ekstraksi diulang beberapa kali hingga kertas saring dan residu menjadi jernih. Filtrat dimasukkan ke dalam tabung bertutup dan dievaporasi dengan rotavapor. Residu yang telah kering kemudian disaponifikasi dengan menambahkan 4 ml KOH 5% dalam metanol, divorteks dan dilakukan sonifikasi selama 30 detik. Ekstrak dipanaskan dalam waterbath dengan suhu 70°C selama 30 menit, kemudian didinginkan dan ditambahkan 4 ml air bebas ion dan 8 ml heksan. Setelah itu, ekstrak divorteks dan disentrifus pada 2000 rpm selama 5 menit hingga terbentuk fase organik dan fase air. Fase air ditambahkan 6 ml heksan, divorteks, dan disentrifus kembali pada 2000 rpm selama 5 menit. Fase organik yang terbentuk selanjutnya dikumpulkan.
Fase organik yang diperoleh kemudian kemudian ditambahkan dengan 3 ml asam asetat 5%, divorteks dan disentrifus pada 2000 rpm selama 5 menit. Lapisan atas (fase organik) diambil, dipindahkan dalam tabung bertutup dan dievaporasi dengan rotavapor (prosedur asli
30 menggunakan gas nitrogen untuk mengevaporasi). Untuk menghitung total karotenoid, residu kering dilarutkan dalam 4 ml heksan dan diukur absorbansinya dengan spektrofotometer pada panjang gelombang 450 nm. Sebagai blanko digunakan heksan. Prosedur analisis dapat dilihat pada Gambar 7.
Total karotenoid dihitung dengan rumus:
C= A450 x x x FP
Keterangan:
E1% = Nilai koefisien ekstingsi dari 1% larutan β-karoten (10 µg/µl) pada λ 450 nm= 2600
C = Konsentrasi total karotenoid (µg/g)
A450 = Nilai absorbansi yang diperoleh pada λ=450 nm FP = Faktor pengenceran
d. Analisis β-karoten (Zakaria et al., 2000) 1. Pembuatan Larutan Standar Β-karoten
Sebanyak 1 mg standar β-karoten dilarutkan dalam 2 ml kloroform, divorteks, ditambahkan 6 ml metanol dan divorteks kembali. Sebanyak 0.5 ml larutan diambil dan diencerkan sebanyak sepuluh kali dengan fase gerak HPLC. Selanjutnya diukur absorbansi pada panjang gelombang 450 nm dengan spektrofotometer dan sebagai blanko digunakan larutan fase gerak HPLC. Larutan standar β-karoten kemudian disuntikkan ke dalam kolom HPLC.
Konsentrasi standar β-karoten dihitung dengan rumus: (10 mg/mL)/E1% = (X 1µg/1µL)/A450 Keterangan:
E1% = Nilai koefisien ekstingsi dari 1% larutan β-karoten (10 mg/ml) pada λ 450 nm= 2600
31 A450 = Nilai absorbansi yang diperoleh pada µ 450 nm
Nilai X dikalikan dengan % kemurnian standar β-karoten yang diperoleh dari analisis HPLC.
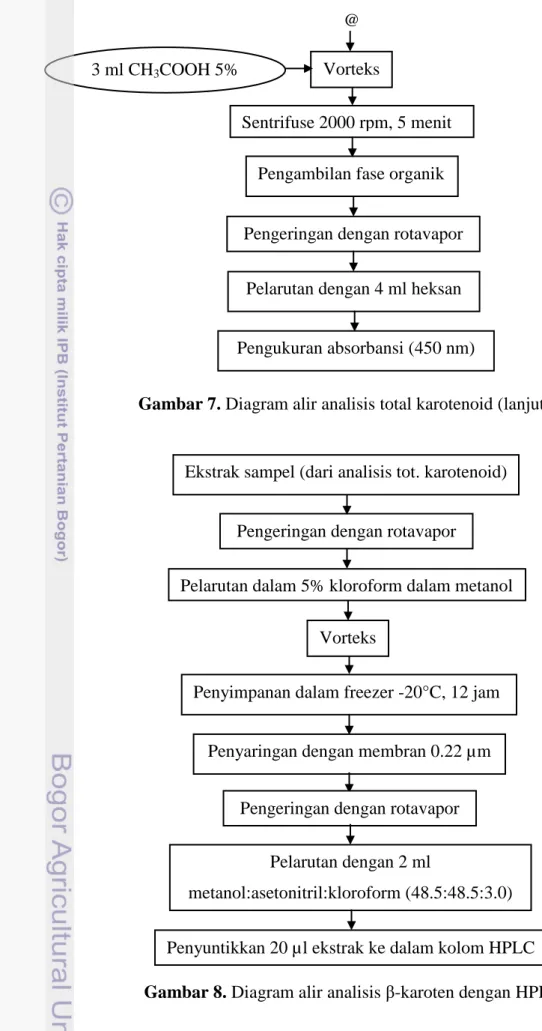
2. Persiapan dan Ekstraksi Karotenoid
Persiapan dan ekstraksi sampel sama seperti persiapan dan ekstraksi sampel untuk analisis total karotenoid. Ekstrak yang digunakan untuk analisis total karotenoid dievaporasi dengan rotavapor (prosedur asli menggunakan gas nitrogen untuk mengevaporasi), lalu dilarutkan dalam kloroform 5% dalam metanol, divorteks dan disimpan dalam freezer bersuhu -20°C selama semalam (12 jam). Larutan kemudian disaring dengan membran 0.22 µm dan dievaporasi dengan rotavapor (prosedur asli menggunakan gas nitrogen untuk mengevaporasi). Residu kering kemudian dilarutkan dalam 2 ml fase gerak HPLC yaitu metanol:asetonitril:kloroform (48.5:48.5:3.0).
Sebanyak 20 µl ekstrak disuntikkan ke dalam kolom HPLC (Vydac C-18) dengan laju aliran rata-rata 0.8 ml/menit dan panjang gelombang 450 nm. Prosedur analisis dapat dilihat pada Gambar 8. Konsentrasi β-karoten (µg/g) di sampel dihitung dengan rumus:
C= x [ ] std β-karoten (µg/µL) x
e. Analisis Antosianin
1. Ekstraksi Antosianin (Raharja dan Dianawati, 2001)
Sebanyak ±1 gram sampel diekstraksi dengan larutan HCl 5% dalam aquades. Ekstraksi dilakukan dengan merendam bahan didalam wadah botol kaca yang berwarna gelap dengan larutan HCl 5% tersebut (1:10), kemudian campuran disimpan di dalam lemari pendingin bersuhu 4°C selama semalam. Setelah itu, campuran tersebut disaring dengan kertas saring Whatman No.1
32 dengan menggunakan penyaring vakum dan filtrat yang diperoleh dianalisa kandungan antosianinnya dengan metode Lees dan Francis (1972).
2. Penentuan Konsentrasi Total Antosianin (Lees dan Francis, 1972)
Sebanyak 5 ml filtrat hasil ekstraksi diencerkan menjadi 10 ml dengan larutan etanol 95%:HCl 1.5N (85:15). Filtrat kemudian diukur absorbansinya dengan spektrofotometer pada panjang gelombang 535 nm.
Total antosianin dihitung dengan rumus:
[ ] (mg/100g sampel) = x 100
Faktor 98.2 adalah nilai ε (serapan molar) dari pigmen antosianin dalam pelarut etanol 95%:HCl 1.5N (85:15). Prosedur analisis dapat dilihat pada Gambar 9.
f. Analisis Asam Askorbat (Jacobs, 1951) 1. Ekstraksi Sampel
Sebanyak 25-50 gram sampel sayuran segar ditimbang dan ditambahkan dengan 50-100 ml aquades. Sampel kemudian dihancurkan dalam waring blender sampai diperoleh slurry (bubur). Slurry yang diperoleh sebanyak ±10 gram dimasukkan ke dalam labu takar 100 ml dan ditambahkan aquades sampai tera, kemudian disaring dengan penyaring vakum untuk memisahkan filtrat.
2. Pembuatan Larutan Iodium
Larutan iodium 0.01 N dibuat dengan cara mencampurkan 2 gram KI dan 1.269 gram I2, kemudian dilarutkan sampai volume 1 liter dengan aquades. Larutan kemudian diaduk dengan magnetic stirrer selama semalam untuk melarutkan iod secara sempurna.
33 3. Penentuan Konsentrasi Asam Askorbat
Sebanyak 10 ml filtrat dari hasil ekstraksi dimasukkan ke dalam erlenmeyer, lalu ditambahkan dengan 2 ml larutan amilum (soluble starch) 1%. Larutan kemudian dititrasi dengan 0.01 N iodium. Titik akhir titrasi ditandai dengan perubahan warna larutan menjadi semburat biru.
Konsentrasi asam askorbat dihitung dengan rumus:
[ ] vitamin C (mg/100 g sampel) = x 100 1 ml 0.01 N Iodium setara dengan 0.88 mg asam askorbat. Prosedur analisis dapat dilihat pada Gambar 10.
3. Analisis Statistik
a. Analisis ragam (Anova)
Analisis ragam (Anova) dilakukan untuk mengetahui ada tidaknya perbedaan di dalam variabel-variabel yang diuji. Setelah itu, bila ditemukan bahwa dalam variabel-variabel yang diuji ada perbedaan yang signifikan, maka dilanjutkan dengan analisis tahap kedua, yakni uji lanjut yang mengkaji pada tingkat atau faktor-faktor di dalam variabel tersebut yang berbeda nyata dan seberapa besar perbedaan tersebut terjadi. Anova dilakukan dengan menggunakan software SPSS 13.0. Bila nilai signifikansi yang dihasilkan dari output Anova menunjukkan nilai yang kurang dari α sebesar 5% (0.05), maka ada perbedaan yang signifikan antar sampel yang diuji, dan sebaliknya. Alfa (α) merupakan besarnya kesalahan (error) yang masih bisa diterima dalam pengujian.
b. Uji Lanjut Duncan
Uji lanjut Duncan merupakan kelanjutan dari Anova yang dilakukan setelah diketahui adanya perbedaan yang signifikan antar sampel yang diuji dengan Anova. Uji Duncan ini membuat perhitungan perbedaan berdasarkan perbandingan pairwise dengan cara menggunakan tingkatan perbandingan secara stepwise. Cara ini
34 mirip dengan pengurutan sebagaimana dilakukan Student-Newman-Keuls test, tetapi dalam perbandingan ini Duncan membuat “pengamanan” derajat kesalahannya dengan cara membandingkan tingkat kesalahan setiap pairwise dengan keseluruhan kesalahan setiap tingkat pasangan perlakuan yang diuji (Sumardi, 2003). Uji ini juga dilakukan dengan menggunakan software SPSS 13.00. Output yang dihasilkan berupa subset-subset dimana sampel-sampel yang berada pada subset yang sama berarti memiliki perbedaan yang tidak signifikan, sedangkan sampel pada subset yang berbeda berarti memiliki perbedaan yang signifikan pada nilai α 0.05.
c. Uji Korelasi Pearson
Uji korelasi Pearson digunakan untuk mengetahui ada tidaknya hubungan antar variabel yang tidak menunjukkan hubungan fungsional (berhubungan bukan berarti disebabkan). Korelasi antar dua variabel yang terjadi dapat berupa (Hasan, 2003):
1) Korelasi (+), yakni bila variabel yang satu (x) menaik atau menurun, maka variabel lainnya cenderung menaik atau menurun pula.
2) Korelasi (-), yakni bila variabel yang satu (x) menaik atau menurun, maka variabel lainnya cenderung menurun atau menaik. 3) Tidak ada korelasi, yakni bila kedua variabel (x dan y) tidak
menunjukkan adanya hubungan.
Output yang dihasilkan dari uji ini berupa nilai p (p-value) dan koefisien korelasi. Bilai nilai p yang dihasilkan lebih kecil dari α 0.05, maka kedua variabel berkorelasi, sedangkan bila nilai P yang dihasilkan lebih besar dari α 0.05, maka kedua variabel tidak berkorelasi. Interpretasi data dengan uji ini digambarkan dengan koefisien korelasi, yaitu indeks atau bilangan yang digunakan untuk mengukur keeratan hubungan antar variabel. Koefisien korelasi memiliki nilai antara -1 dan +1 (-1≤KK≤+1). Jika KK bernilai positif maka kedua variabel berkorelasi positif, sedangkan bila bernilai negatif maka kedua variabel berkorelasi negatif. Semakin dekat nilai
35 KK ke +1 dan -1, maka semakin kuat korelasinya. Jika KK bernilai 0 maka kedua variabel tidak menunjukkan adanya korelasi, sedangkan bila KK bernilai +1 atau -1 maka kedua variabel menunjukkan korelasi yang sempurna. Untuk menentukan keeratan hubungan atau korelasi antar variabel tersebut, maka digunakan patokan sebagai berikut (Hasan, 2003):
1) KK=0 (tidak ada korelasi)
2) 0<KK≤0.20 (korelasi sangat rendah/lemah) 3) 0.20<KK≤0.40 (korelasi rendah/lemah tapi pasti) 4) 0.40<KK≤0.70 (korelasi yang cukup berarti) 5) 0.70<KK≤0.90 (korelasi yang tinggi dan kuat)
6) 0.90<KK<1.00 (korelasi sangat tinggi, kuat sekali, dapat diandalkan)
7) KK=1 (korelasi sempurna)
Uji korelasi Pearson pada penelitian ini dilakukan dengan menggunakan software Minitab 15.0. Uji ini juga digunakan untuk mendapatkan kesimpulan hasil meta-analisis antar senyawa yang diidentifikasi pada penelitian ini.
d. Analisis Komponen Utama (PCA)
Analisis komponen utama (principal component analysis) merupakan teknik statistik yang dapat digunakan untuk menjelaskan struktur variansi-kovariansi dari sekumpulan variabel melalui beberapa variabel baru dimana variabel baru ini saling bebas, dan merupakan kombinasi linier dari variabel asal. Selanjutnya variabel baru ini dinamakan komponen utama (principal component).
Secara umum tujuan dari analisis komponen utama adalah mereduksi dimensi data dan untuk kebutuhan interpretasi. Komponen utama dibentuk berdasarkan matriks korelasi. Hal ini dilakukan jika variabel-variabel bebas yang diamati mempunyai perbedaan range yang sangat besar. Salah satu tujuan dari analisis komponen utama adalah mereduksi dimensi data asal yang semula terdapat p variabel bebas menjadi k komponen utama (dimana k < p ). Kriteria pemilihan k
36 yaitu: 1) Proporsi kumulatif keragaman data asal yang dijelaskan oleh k komponen utama minimal 80% , dan proporsi total variansi populasi bernilai cukup besar; 2) Dengan menggunakan scree plot yaitu plot antara i dengan i , pemilihan nilai k berdasarkan scree plot ditentukan dengan melihat letak terjadinya belokan dengan menghapus komponen utama yang menghasilkan beberapa nilai eigen kecil membentuk pola garis lurus (Rencher, 1998).
Output yang dihasilkan dari pengujian dengan PCA ini adalah data analisis eigen dari matriks korelasi yang berupa nilai akar cirri (eigen value), proporsi dan kumulatif. Dari nilai akar ciri dapat diidentifikasi komponen utama yang diperoleh, yakni variabel yang memiliki dua nilai akar ciri terbesar (nilai lebih dari 1), kemudian nilai proporsi menggambarkan persentase keragaman data yang dapat diterangkan oleh masing-masing komponen utama, dan nilai kumulatif menggambarkan keseluruhan persentase keragaman data yang dapat diterangkan oleh kedua komponen utama. Selain itu, dihasilkan pula grafik biplot untuk kebutuhan interpretasi data. Analisis komponen utama ini dilakukan dengan menggunakan software Minitab 15.0.
4. Analisis Potensi
Analisis potensi pada sampel dilakukan dengan beberapa tahapan berikut: 1) pengumpulan data hasil keseluruhan analisis utama (total karotenoid, β-karoten, antosianin, dan asam askorbat); 2) studi literatur, yakni menelusuri literatur dari berbagai sumber tentang manfaat dan potensi masing-masing senyawa yang diidentifikasi serta literatur tentang kandungan senyawa-senyawa yang diidentifikasi pada jenis komoditi buah/sayur lainnya untuk dapat dibandingkan dengan nilai kandungannya pada sampel sayuran indigenous pada penelitian ini; 3) justifikasi potensi terhadap keseluruhan sampel terutama sampel yang mengandung senyawa yang diidentifikasi dengan nilai yang tinggi.
37
@
Gambar 7. Diagram alir analisis total karotenoid dengan spektrofotometer Sentrifuse 2000 rpm, 5 menit Fase organik total
Pengambilan fase organik Sentrifuse 2000 rpm, 5 menit
Vorteks 4 ml air deion,
8 ml heksana
Pendinginan pada T ruang
Pemanasan dalam waterbath 70°C, 30 menit Vorteks
Saponifikasi dengan 4 ml KOH 5% dalam metanol Pengeringan dgn rotavapor
Filtrat jernih
Pengulangan ekstraksi (beberapa kali) Penyaringan vakum dengan Whatman 42
0.25 g sampel
Pengekstrakkan dengan 5 ml heksan:aseton (1:1) 3x
Sonifikasi 30 detik
Fase air
Vorteks dengan 6 ml heksan
38 @
Gambar 7. Diagram alir analisis total karotenoid (lanjutan)
Gambar 8. Diagram alir analisis β-karoten dengan HPLC Pengeringan dengan rotavapor
Sentrifuse 2000 rpm, 5 menit Pengambilan fase organik
Vorteks 3 ml CH3COOH 5%
Pelarutan dengan 4 ml heksan
Pengukuran absorbansi (450 nm)
Pelarutan dengan 2 ml
metanol:asetonitril:kloroform (48.5:48.5:3.0) Penyaringan dengan membran 0.22 µm Penyimpanan dalam freezer -20°C, 12 jam
Vorteks
Pelarutan dalam 5% kloroform dalam metanol Pengeringan dengan rotavapor
Ekstrak sampel (dari analisis tot. karotenoid)
Pengeringan dengan rotavapor
39 Gambar 9. Diagram alir analisis total antosianin dengan spektrofotometer
Pengukuran absorbansi (535 nm) Vorteks Diencerkan sampai 10 ml dengan etanol 95%:HCl 1.5N (85:15) Diambil sebanyak 5 ml filtrat
Penyaringan dengan pompa vakum ±1 gram sampel
Maserasi selama 1 malam dalam botol gelap pada suhu 4°C 10 ml HCl 5%
40 Gambar 10. Diagram alir analisis asam askorbat dengan cara titrasi
2 ml larutan amilum 1%
Titrasi dengan 0.01 N Iodium Pencampuran dalam erlenmeyer
Pengambilan 10 ml filtrat
Penyaringan dengan vakum Penempatan dalam labu takar 100 ml
sampai tera dengan aquades Pengambilan ±10 g slurry 25-50 g sayuran segar Penghancuran dengan waring blender 50-100 ml aquades