3
2.
Tinjauan Pustaka
2.1. Fuel Cell (Sel Bahan Bakar)
Fuel cell (sel bahan bakar) merupakan alat pengkonversi energi elektrokimia. Sel ini menghasilkan energi listrik dari berbagai macam jenis sumber bahan bakarnya (pada sisi anoda) dan oksidan (pada sisi katoda), yang bereaksi dengan adanya elektrolit. Secara umum, reaktan akan masuk ke sisi anoda dan produk reaksi akan keluar dari sisi katoda sementara elektrolit tetap berada dalam sel. Sel bahan bakar dapat bekerja secara terus menerus selama aliran tersebut tetap dijaga. Sel bahan bakar menggunakan banyak variasi dari bahan bakar dan oksidan yang digunakan [www.en.wikipedia.org, 2008].
Pada prinsipnya, sel bahan bakar bekerja dengan menggunakan katalis, yang memisahkan komponen elektron dan proton dari sumber bahan bakar (reaktan), dan memaksa elektron tersebut untuk melewati rangkaian alat yang kemudian mengubahnya menjadi energi listrik. Katalis tersebut biasanya berupa grup platinum atau campurannya. Elektron lalu dikombinasikan kembali dengan proton dan oksidan untuk membentuk hasil akhir (cenderung berupa senyawa sederhana seperti air dan karbon dioksida) [www.en.wikipedia.org, 2008].
2.1.1 Polymer Electrolyte Membrane Fuel Cell (PEMFC)
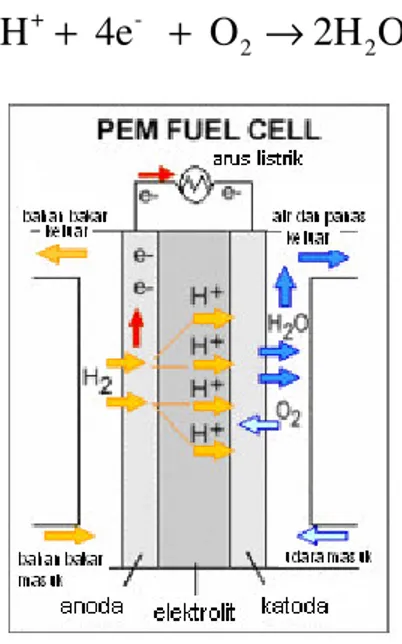
Dari sekian banyak fuel cell (sel bahan bakar), Direct Methanol Fuel Cells (DMFCs) yang menggunakan membran polimer elektrolit merupakan sel bahan bakar yang paling memungkinkan bagi aplikasi sumber energi alternatif yang mudah dibawa, sebagai kendaraan elektrik, dan aplikasi transport lainnya karena sel bahan bakar ini tidak memerlukan peralatan pengolah bahan bakar (seperti reformer dan pembakar katalitik) serta dapat bekerja pada temperatur yang rendah. Kebanyakan penelitian mengenai DMFC lebih mengkonsentrasikan pada Polymer Electrolyte Membrane Fuel Cell (PEMFC) [Won et al., 2003].
4 PEMFC (Gambar 2. 1) mengubah energi kimia yang dibebaskan selama reaksi elektrokimia dari hidrogen dan oksigen menjadi energi listrik. Aliran hidrogen dimasukkan pada sisi anoda, kemudian terpisah menjadi proton dan elektron sesuai dengan reaksi sebagai berikut:
+
-2
H
→
2H
+
2e
Proton yang baru terbentuk tersebut mengalir melalui membran polimer elektrolit menuju ke sisi katoda, sedangkan elektron akan mengalir melalui sirkuit eksternal menuju sisi katoda, yang menyebabkan timbulnya arus listrik sebagai hasil dari sel bahan bakar. Sementara itu, aliran oksigen yang diberikan pada sisi katoda mengalami reaksi dengan proton yang menembus membran polimer elektrolit dan juga beraksi dengan elektron yang berasal dari sirkuit sehingga membentuk molekul-molekul air [www.en.wikipedia.org, 2008]. Atau dengan kata lain, pada sisi katoda tersebut elektron akan berikatan dengan ion hidrogen dan oksigen untuk membentuk air sebagai produknya [Acosta et al., 2003].
Reaksi yang terjadi pada sisi katoda adalah sebagai berikut :
+
-2 2
4H
+
4e
+
O
→
2H O
Gambar 2. 1 Diagram PEM Fuel Cell
Untuk penggunaan PEMFC yang menggunakan bahan bakar hidrogen atau metanol (yaitu DMFC), Nafion® (Gambar 2. 2) merupakan membran pentransport proton standar yang digunakan [Zhang et al, 2006]. Penggunaan Nafion® sebagai membran pada DMFC memiliki banyak sekali kekurangan, diantaranya adalah akibat harganya yang sangat mahal dan permeasi metanol yang tinggi [Won et al., 2003]. Gugus asam sulfonat yang terdapat pada Nafion® membentuk celah ion mikro dimana proton dapat ditransport bersama dengan air
5 [Zhang et al., 2006]. Dengan konsep yang sama, salah satu material yang dikembangkan untuk Direct Methanol Fuel Cell (DMFC) adalah polimer tersulfonasi seperti polistiren tersulfonasi, polisulfon tersulfonasi (PSU) dan poli(eterketon) tersulfonasi, yang diharapkan dapat menjadi membran polimer elektrolit dengan harga yang relatif murah [Zhang et al., 2006].
Gambar 2. 2 Struktur Nafion®
2.2. Stiren
Stiren yang lebih dikenal dengan vinil benzena merupakan suatu senyawa organik dengan rumus molekul C6H5CH=CH2 (Gambar 2. 3). Dalam kondisi normal, senyawa hidrokarbon
aromatik ini berbentuk cairan. Senyawa ini terdapat dalam kadar rendah secara alamiah pada berbagai tanaman seperti buah, sayuran, kacang-kacangan, dan daging [www.en.wikipedia.org, 2008].
Gambar 2. 3 Struktur stiren
Stiren disintesis dari benzena dan etena dimana etena dilewatkan pada benzena cair di bawah tekanan, dengan katalis aluminium klorida sehingga menghasilkan etilbenzena. Etilbenzena tersebut didehidrogenasi menjadi stiren pada suhu 6000C dengan besi oksida atau magnesium oksida sebagai katalis. Stiren tersebut lalu didestilasi. Proses ini memerlukan biaya yang cukup mahal, namun dapat menghasilkan jumlah stiren yang cukup banyak [Billmeyer, 1962].
Stiren diproduksi dalam skala industri yang jumlahnya meningkat pada tahun 1940 untuk mendukung kebutuhan karet polimer sintetis. Akibat adanya gugus vinil dan ikatan rangkap, maka stiren dapat dijadikan sebagai monomer untuk pembuatan plastik [Billmeyer, 1962].
6 2.3. Polistiren
Polistiren merupakan polimer yang dibuat dari stiren sebagai monomernya. Polistiren ditemukan secara tidak sengaja pada tahun 1839 oleh Eduard Simondi Berlin. Beliau melakukan distilasi pada Liquidambar orientalis dan menghasilkan suatu materi yang berminyak, yaitu styrol. Beberapa hari kemudian, styrol tersebut menjadi lebih tebal akibat teroksidasi dan disebut sebagai styrol oksida (stryroloxyd) [www.en.wikipedia.org, 2008]. Pada tahun 1845, kimiawan Inggris John Blyth dan kimiawan Jerman August Wilhelm von Hofmann juga menemukan hal yang serupa, yaitu saat terjadinya perubahan styrol oleh kehadiran oksigen yang disebut metastyrol, yang ternyata serupa dengan styroloxyd yang sebelumnya telah ditemukan. Pada tahun 1866, Marcelin Berthelot mengidentifikasikan pembentukan styroloxyd dari styrol tersebut sebagai suatu proses polimerisasi. Akhirnya disadari bahwa saat styrol dipanaskan akan terjadi suatu reaksi berantai yang membentuk suatu makromolekul, yang pada akhirnya makromolekul tersebut dikenal dengan nama polistiren [www.en.wikipedia.org, 2008].
2.3.1 Sintesis Polistiren (PS)
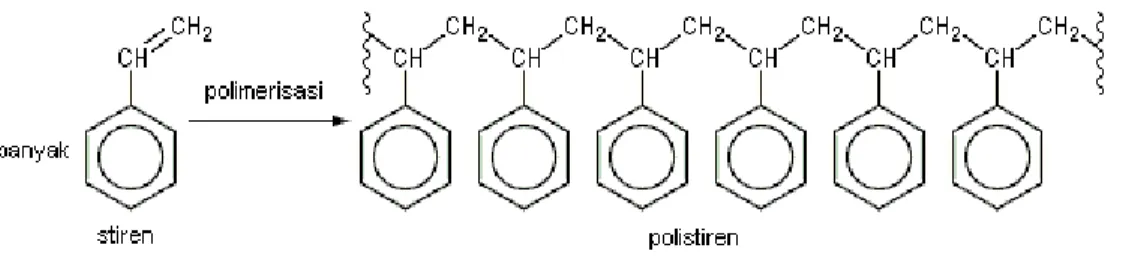
Walaupun polimerisasi dalam bentuk larutan atau emulsi sering digunakan, akan tetapi sebagian besar polistiren dibuat dengan cara polimerisasi adisi. Polimerisasi stiren (Gambar 2. 4) dimulai dengan proses prepolymerizer dimana di dalam reaktor terdapat stiren yang akan dipolimerisasi (biasanya dengan menggunakan peroksida sebagai inisiator) diaduk hingga campuran reaksi terkonsentrasi menjadi polimer akibat adanya proses pencampuran yang efisien dan perpindahan panas yang baik [Billmeyer, 1962].
Gambar 2. 4 Polimerisasi stiren menjadi polistiren
Pada saat reaksi polimerisasi (Gambar 2. 5), stiren yang mempunyai ikatan rangkap C=C akan mengalami adisi menjadi ikatan tunggal C–C [Rohandi, 2006]. Reaksi polimerisasinya secara umum adalah:
7 Gambar 2. 5 Reaksi polimerisasi polistiren dengan inisiator benzoil peroksida.
Proses polimerisasi adisi tersebut berlangsung dengan suatu inisiator, yang dapat menghasilkan radikal bebas, seperti benzoil peroksida [Rahmawati, 2007]. Tahapan reaksi yang terjadi adalah sebagai berikut:
Tahap inisiasi
Pada tahap ini, inisiator akan mengalami dekomposisi dan menjadi sumber radikal. Benzoil peroksida yang merupakan inisiator pada reaksi ini akan terdekomposisi termal menjadi suatu radikal, yaitu radikal benzoiloksi. Radikal benzoiloksi ini akan bereaksi dengan monomer, yaitu stiren sebagai awal dari perpanjangan rantai [Radiman, 2004]. Reaksi yang terjadi adalah sebagai berikut:
O O O O O. O radikal benzoiloksi 2 Tahap Propagasi
Pada tahap ini, akan terjadi reaksi adisi secara kontinu dari monomer mengakibatkan kenaikan perpanjangan rantai [Radiman, 2004]. Reaksi yang terjadi adalah sebagai berikut:
CH C H2
+
C H3(
CH2 HC)
CH2 CH n C H3 CH2 CH)
CH2 CH n+1(
Tahap TerminasiTahap ini adalah tahap terakhir dalam polimerisasi adisi. Pada tahap ini pusat aktif dinonaktifkan. Dua rantai polimer yang mempunyai radikal pada tiap rantainya akan
8 bertumbukan sehingga menyebabkan reaksi perpanjangan rantai berhenti [Radiman, 2004]. Reaksi yang terjadi adalah sebagai berikut:
+
C H3 CH2 HC CH2 CH n)
(
H3C(
CH2 CH)
CH2 CH m C H3 CH2 HC CH2 CH CH2 CH CH2 HC CH3 n(
)
m(
)
2.3.2 Benzoil PeroksidaBenzoil peroksida (Gambar 2. 6) merupakan salah satu jenis inisiator yang sering digunakan dalam reaksi polimerisasi adisi secara radikal. Benzoil peroksida memiliki dua gugus benzoil yang berikatan dengan rantai peroksida dan dapat mengalami homolisis secara termal membentuk radikal-radikal benzoiloksi [Stevens, 2001]. Sifatnya tidak stabil terhadap panas dan terurai menjadi radikal-radikal pada suhu dan laju tertentu. Benzoil peroksida merupakan sumber radikal yang kuat, mengandung lebih dari 4,9% oksigen aktif. Waktu paruhnya 10 jam (73°C), 1 jam (92°C), dan 1 menit (131°C). Jika dipanaskan melebihi suhu lelehnya, maka benzoil peroksida akan terdekomposisi dengan cepat sehingga terjadi pembakaran dan ledakan. Senyawa ini bereaksi kuat dengan asam, basa, reduktor, dan logam berat [www.chemicalland 21.com, 2008].
Gambar 2. 6 Struktur benzoil peroksida.
2.3.3 Karakteristik dan Aplikasi Polistiren
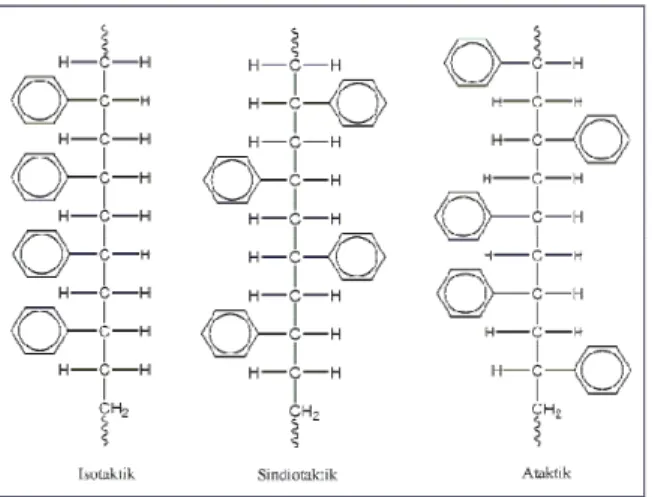
Polistien merupakan polimer yang linear, produk komersialnya berstruktur ataktik sehingga bersifat amorf. Untuk membedakan taktisitas, rantai polimer harus mempunyai atom C kiral [Radiman, 2004]. Berdasarkan kedudukan gugus fenil pada bidang rantai (Gambar 2. 7), terdapat tiga jenis polistiren, yaitu:
9 1. Polistiren isotaktik, yaitu bila semua gugus fenil berada pada posisi satu arah relatif
terhadap rantai utama.
2. Polistiren sindiotaktik, yaitu bila posisi gugus fenil tersusun secara bergantian arahnya relatif terhadap rantai utama
3. Polistiren ataktik, yaitu bila semua gugus fenil tersusun secara acak arahnya relatif terhadap rantai utama.
Gambar 2. 7 Taktisitas polistiren.
Polistiren isotaktik sebenarnya dapat dibuat, tetapi keunggulannya sangat sedikit sehingga tidak memenuhi syarat untuk dijual sacara komersial. Pada temperatur ruang, polistiren umumnya merupakan suatu termoplastik yang berwujud padat, tetapi dapat meleleh pada temperatur yang tinggi untuk dicetak dan kemudian dibentuk menjadi padatan kembali [Billmeyer, 1962]. Polistiren memiliki ketahanan terhadap asam, basa, oksidator/reduktor tetapi mudah larut dalam hidrokarbon aromatik dan berklor. Penyinaran dalam waktu lama oleh sinar UV, oksigen, atau ozon mempengaruhi kekuatan dan ketahanan polimer tersebut [Cowd, 1982].
Polistiren yang murni tidak berwarna, merupakan plastik keras dengan kelenturan yang terbatas. Polistiren ini dapat dicetak ke dalam cetakan untuk menghasilkan bentuk yang diinginkan. Polistiren ini dapat transparan atau dapat juga diberi berbagai warna. Kegunaan polistiren diantaranya adalah untuk bahan pembungkus (misalnya untuk botol), peralatan rumah tangga (misalnya bahan lemari es, AC, radio, televisi), peralatan kendaraan bermotor, dan aneka macam bahan lainnya (misalnya untuk mainan) [www.en.wikipedia.org, 2008]. Terdapat banyak senyawa turunan polistiren yang digunakan untuk berbagai macam aplikasi. Diantaranya polistiren sulfonat yang dapat digunakan sebagai membran komposit alternatif penukar proton untuk aplikasi sel bahan bakar [Chen et al., 2004], membran komposit polistiren tersulfonasi/polivinil klorida yang juga dapat digunakan untuk aplikasi sel bahan
10 bakar [Qiang et al., 2008], serta polistiren tersulfonasi-(etilen-butilen)-stiren yang dapat digunakan untuk membran penukar proton [Won et al.,2003].
2.4. Sulfonasi
2.4.1 Sulfonasi Polistiren
Sulfonasi didefinisikan sebagai reaksi substitusi yang digunakan untuk memasukkan gugus ~SO3H melalui ikatan kimia gugus atom karbon pada senyawa organik. Senyawa seperti
H2SO4 dan SO3 umumnya digunakan sebagai agen pensulfonasi. Studi pertama kali
mengenai sulfonasi pada polistiren menunjukkan terjadinya proses fungsionalisasi ionik secara acak sepanjang rantai polimer tanpa terjadinya degradasi yang signifikan atau pembentukan ikatan silang pada produk reaksi [Martins et al., 2003]. Proses sulfonasi pada polistiren (Gambar 2. 8) umumnya dilakukan dengan menggunakan asetil sulfat.
2.4.2 Asetil Sulfat
Asetil sulfat merupakan agen pensulfonasi yang disintesis dari sejumlah tertentu diklorometana, anhidrida asetat, dan asam sulfat pekat. Pembuatan agen sulfonasi ini mengikuti beberapa metode, namun metode yang umum digunakan adalah metode yang ditemukan oleh Makowski et al [Martins et al., 2003]. Reaksi pembentukan asetil sulfat adalah sebagai berikut :
C C H3 O
(
)
2O+
H
2SO
4CH
3COOH
+
C C H3 O OSO3HAsetil sulfat mensubstitusi salah satu gugus H yang terdapat pada polistiren dengan gugus ~SO3H. Asetil sulfat ini dapat digunakan untuk mensulfonasi polistiren (PS) menjadi
polistiren tersulfonasi (PSS) [Martins et al., 2003] sehingga PSS tersebut dapat diaplikasikan
CH3COOH (HC CH2) + H3C C O O SO3H HC CH2 SO3H HC CH2 +
11 pada berbagai macam kebutuhan. Misalnya saja yang sekarang paling banyak dikembangkan oleh peneliti adalah penggunaan PSS sebagai bahan membran polimer elektrolit pengganti Nafion® [Won et al., 2003].
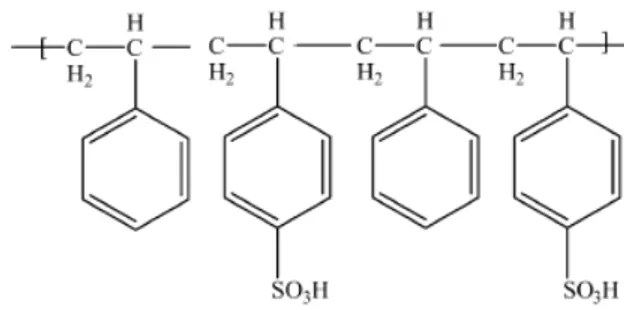
2.4.3 Karakteristik Polistiren Tersulfonasi (PSS)
Polistiren tesulfonasi memiliki karakteristik larut dalam air karena terdapat gugus ~SO3H
yang terdapat pada gugus fungsinya. Senyawa ini berwujud padatan putih pada temperatur kamar, dan secara natural bersifat higroskopis. Polistiren tersulfonasi telah banyak dikembangkan oleh para peneliti sebagai salah satu polimer yang dapat digunakan untuk pembuatan membran pengganti Nafion® yang merupakan membrankomersial yang umum digunakan dalam Polymer Electrolyte Membrane Fuel Cell (PEMFC) [Zhang et al., 2005]. Hal ini disebabkan karena struktur dari polistiren tersulfonasi (Gambar 2. 9) memiliki gugus sulfonat, yang ternyata mirip dengan struktur dari Nafion®. Oleh sebab itu, polistiren tersulfonasi menjadi salah satu material yang banyak dikembangkan untuk Direct Methanol
Fuel Cell (DMFC) selain polisulfon tersulfonasi (PSU) dan poli(eterketon) tersulfonasi. Polistiren tersulfonasi ini diharapkan dapat menjadi membran polimer elektrolit dengan harga yang relatif murah [Zhang et al, 2006].
Gambar 2. 9 Struktur polistiren tersulfonasi.
2.5. Lignin
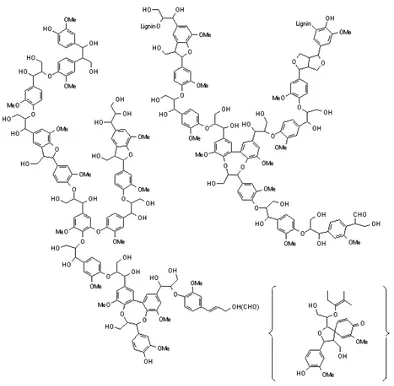
Material penyusun dinding sel tanaman terdiri dari 3 komponen utama, yaitu selulosa, lignin, dan hemiselulosa. Sekitar 30% bahan kayu mengandung lignin, yang merupakan bahan pengikat pada tumbuhan hidup. Lignin adalah polimer alam yang paling banyak terdapat di tanaman berkayu, komposisinya sekitar satu perempat atau satu pertiga dari berat total kering dari kayu. Lignin merupakan polimer fenolik alam yang terdapat dalam dinding sel tumbuhan, fungsinya sebagai perekat alami serat, memberi kekuatan fisik pada kayu yang menyebabkan kekakuan dan kekokohan [www.en.wikipedia.org, 2008]. Lignin merupakan polimer dari berbagai jenis grup yang memiliki rantai karbon dari n-propilbenzena, yang dihubungkan oleh oksigen dan juga oleh ikatan karbon (Gambar 2. 10).
12 Gambar 2. 10 Struktur lignin.
Sejumlah besar lignin tersedia sebagai produk samping dari industri kertas. Lindi hitam (black liquor) adalah limbah cair yang dihasilkan dari proses pembuatan pulp dan kertas. Komponen utama lindi hitam adalah air serta senyawa organik dari bahan organik yang dipakai ataupun yang dihasilkan selama proses pembuatan pulp. Proses pengasaman pada lindi hitam bertujuan untuk mengisolasi lignin yang terkandung dalam limbah cair tersebut. Lignin hasil isolasi tersebut dapat dimodifikasi dengan menambahkan gugus sulfonat pada struktur lignin [Arianie, 2004].
Lignin merupakan polimer yang memiliki struktur sangat meruah dengan massa molekul yang sangat besar yaitu diatas 15.000 gram/mol. Lignin dapat memiliki berbagai macam monomer penyusunnya, seperti yang terlihat pada Gambar 2. 11.
13 Lignin tersusun atas ikatan kimia yang sangat kuat, hal ini disebabkan karena banyaknya gugus OH pada strukturnya sehingga membentuk banyak ikatan hidrogen. Lignin yang dihasilkan dari produk samping pabrik kertas ternyata memiliki struktur yang mengandung gugus sulfonat akibat proses kimia yang dilakukan di pabrik tersebut. Gugus sulfonat tersebut menyebabkan lignin dapat digunakan untuk meningkatkan transport proton saat dilakukan modifikasi antara lignin dengan polistiren tersulfonasi [Zhang et al., 2006].
2.6. Poliblend
Campuran polimer atau poliblend merupakan campuran fisik dari dua atau lebih polimer/kopolimer berbeda, yang tidak terikat melalui ikatan kovalen [Stevens, 2001]. Pada umumnya, terdapat dua cara untuk membuat suatu poliblend yaitu melalui metode pelarutan dan metode pelelehan. Metode pelarutan dilakukan dengan cara melarutkan dua polimer atau lebih sampai homogen pada satu pelarut kemudian pelarut diuapkan sehingga terbentuk
poliblend. Untuk skala laboratorium metode pelarutan cukup efektif, tetapi untuk skala industri metode ini kurang disukai karena membutuhkan biaya produksi yang mahal. Dunia industri lebih menyukai metode pelelehan dimana dua polimer atau lebih dipanaskan di atas temperatur transisi gelas sehingga kedua polimer saling bercampur dan diperoleh poliblend [Rohandi, 2006]
Terdapat dua jenis poliblend, yaitu poliblend homogen (miscible polymer blend) dan
poliblend heterogen (Immiscible polymer blend). Jika polimer-polimer yang dicampurkan dapat membentuk satu fasa, maka disebut poliblend yang homogen. Sifat poliblend jenis ini sebanding dengan komposisi polimer penyusunnya. Suhu tansisi gelas (Tg) poliblend ini
hanya satu dan akan berada diantara suhu transisi gelas kedua polimernya. Sebaliknya, jika polimer-polimer yang dicampurkan membentuk dua fasa, maka disebut poliblend yang heterogen dan memiliki suhu transisi gelas (Tg) yang berbeda. Sifat akhir dari poliblend
tersebut ditentukan dari komposisi yang terbesar [www.pslc.ws/mactest/blend.htm, 2008].
2.7. Karakterisasi Polimer
Karakterisasi polimer dilakukan dengan tujuan untuk memperoleh informasi mengenai sifat-sifat dari polimer, baik sifat-sifat fisik maupun sifat-sifat kimianya. Untuk menganalisis gugus fungsi digunakan peralatan Fourier Transform Infra Red (FTIR), analisis sifat termal menggunakan peralatan Differential Thermal Analysis (DTA) dan Thermo Gravimetry Analysis (TGA), analisis sifat mekanik menggunakan Tensile Tester (Autograph), analisis berat molekul polimer menggunakan alat viskometer Ostwald, analisis konduktivitas membran
14 menggunakan alat pengukur konduktivitas, analisis derajat sulfonasi dan IEC menggunakan metode titrasi, sedangkan analisis derajat swelling digunakan metode perhitungan massa. 2.7.1. Analisis Gugus Fungsi
Analisis gugus fungsi dapat diperoleh menggunakan peralatan Fourier Transform Infra Red (FTIR). Spektroskopi infra merah merupakan suatu teknik pengukuran spektrum absorpsi molekul yang didasarkan pada transisi vibrasi gugus fungsi molekul tersebut. Inti-inti atom yang terikat oleh ikatan kovalen akan mengalami getaran (vibrasi) atau osilasi. Bila molekul tersebut menyerap radiasi inframerah, maka energi yang diserap tersebut akan menyebabkan kenaikan dalam amplitudo getaran atom-atom yang terikat, sehingga molekul berada dalam keadaan vibrasi tereksitasi. Energi yang diserap ini akan dibuang dalam bentuk panas apabila molekul tersebut kembali ke keadaan dasar. Keadaan vibrasi dari ikatan terjadi pada keadaan tetap atau tingkat-tingkat energi yang terkuantisasi. Panjang gelombang dari absorpsi suatu tipe ikatan tertentu bergantung pada macam getaran dari ikatan tersebut. Oleh karena itu, tipe ikatan yang berlainan akan menyerap radiasi infra merah pada panjang gelombang yang berlainan [Fessenden et al., 1986].
Pengukuran spektrum infra merah biasanya dilakukan pada frekuensi 400-4000 cm-1 dimana frekuensi atau panjang gelombang dari absorpsi yang terjadi bergantung pada massa relatif atom, konstanta gaya yang terdapat pada ikatan, dan geometri dari atom [Silverstein, 1998]. Terdapat dua jenis vibrasi molekul, yaitu vibrasi ulur (stretching) dan vibrasi tekuk (bending). Gerak vibrasi ulur merupakan gerakan sepanjang sumbu ikatan sehingga akan terjadi perubahan jarak antara keduanya. Vibrasi ulur ada dua macam, yaitu vibrasi ulur simetris dan vibrasi ulur asimetris. Sedangkan, vibrasi tekuk terjadi karena adanya perubahan sudut ikatan antar atom. Vibrasi tekuk terbagi menjadi empat, yaitu vibrasi goyang (rocking), vibrasi gunting (scissoring), vibrasi kibasan (wagging), dan vibrasi pelintiran (twisting) [Khopkar, 1984].
Untuk menganalisis suatu sampel, sinar infra merah dilewatkan melalui sampel sehingga muncul sinyal pada interferogram. Dengan menggunakan operasi matematis tranformasi Fourier, maka akan diperoleh kurva spektrum FTIR. Dengan menganalisis kurva tersebut maka dapat diperoleh informasi mengenai ikatan apa saja yang terdapat pada molekul yang dianalisis. Untuk analisis secara kualitatif, spektroskopi infra merah dapat digunakan untuk mengetahui struktur dari suatu polimer dengan cara membandingan dengan spektrum yang diperoleh dari literatur. Sedangkan untuk analisis secara kuantitatif, besarnya intensitas serapan dapat menunjukkan kekuatan interaksi antara sinar infra merah dengan vibrasi molekul tersebut [Rohandi, 2006].
15 2.7.2. Analisis Derajat Sulfonasi
Analisis derajat sulfonasi dilakukan untuk mengetahui seberapa banyak gugus H pada cincin aromatik polistiren mengalami reaksi substitusi dengan gugus ~SO3H akibat penambahan
agen pensulfonasi yaitu asetil sulfat. Derajat sulfonasi ini bergantung pada waktu reaksi sulfonasi itu sendiri. Semakin lama waktu reaksi sulfonasi terjadi, maka semakin besar nilai derajat sulfonasi yang diperoleh. Pada sulfonasi, pembentukan ikatan silang cenderung meningkat dengan bertambahnya jumlah dari gugus sulfonat, yaitu meningkatnya konsentrasi dari agen pensulfonasi dalam larutan polimer dan juga dengan meningkatnya temperatur pada saat reaksi terjadi [Martins et al., 2003].
Derajat sulfonasi dari polistiren tersulfonasi dapat ditentukan dengan metode titrasi menggnakan NaOH yang telah dibakukan dalam pelarut metanol [Martins, C.R et al.,2003]. perhitungan derajat sulfonasi dilakukan sesuai dengan rumus:
massa PS yang tersulfonasi
100% massa PS awal
DS = ×
Massa PS yang tersulfonasi diperoleh dari nilai mol NaOH yang diperlukan untuk mentitrasi sejumlah tertentu sampel dikalikan dengan Mr PSS. Mol NaOH tersebut sama dengan jumlah mol PS yang mengalami sulfonasi, sehingga massa dari PS yang tersulfonasi dapat diketahui. Derajat sulfonasi ini menggambarkan persen mol dari unit ulang stiren yang mengalami reaksi sulfonasi [Martins et al., 2003].
2.7.3. Analisis Derajat Swelling
Besar derajat swelling pada polimer menyatakan seberapa besar kemampuan dari sampel untuk mengalami penggembungan akibat masuknya pelarut ke dalam molekul polimer. Saat polimer dicampurkan dengan suatu pelarut, ada 2 tahap proses yang terjadi. Tahap yang pertama yaitu proses penggembungan (swelling) yang lambat/solvasi. Molekul pelarut akan terabsorpsi pada permukaan molekul polimer yang mengakibatkan terjadinya perubahan dimensi rata-ratanya. Dalam tahap ini molekul polimer akan mengembang dengan faktor δ yang ada hubungannya dengan antaraksi intramolekul antara segmen suatu rantai secara termodinamika. Tahap yang kedua yaitu saat polimer telah menggembung dengan pelarut yang baik, polimer tersebut akan terdispersi membentuk larutan polimer. Tidak ada ikatan kimia yang terputus dalam proses ini. Polimer berikatan silang yang dapat menggembung dalam pelarut yang baik tidak akan larut pada tahap kedua ini [Radiman, 2004].
Besar derajat swelling ini dapat ditentukan menggunakan 2 metode, yaitu metode massa (gravimetri) dan metode volume. Umumnya, metode yang sering digunakan adalah metode
16 massa karena kesalahan yang diperoleh cenderung lebih kecil bila dibandingkan metode volume [Radiman, 2004]. Perhitungan derajat swelling (α) dengan metode massa adalah sebagai berikut : 100% o o m m m
α
= − ×Dengan α adalah derajat swelling, m adalah massa setelah perendaman, dan mo adalah massa
awal. Polimer yang memiliki ikatan silang tidak dapat larut sempurna dalam pelarutnya, tetapi akan mengalami swelling hingga mencapai volume tertentu dengan cara menyerap pelarut yang berinteraksi dengan polimer tersebut [Billmeyer, 1962]
2.7.4. Analisis Termal
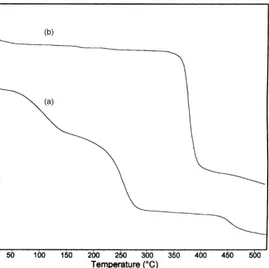
Analisis termal pada umumnya dilakukan dengan metode Differential Scanning Calorimetry (DSC), Differential Thermal Analysis (DTA) dan Thermo Gravimetry Analysis (TGA). Prinsip dasar dari TGA adalah pengukuran perubahan berat dari sampel sebagai fungsi dari suhu. Pada DTA, pengukuran ditekankan pada perbedaan suhu antara sampel dan referensi sebagai fungsi dari suhu. Ketika sampel mengalami perubahan fisik atau kimia, maka kenaikan temperatur antara sampel dan referensi akan berbeda sehingga akan muncul puncak pada sinyal DTA [Billmeyer, 1962]. Termogram dari polimer, yaitu polistiren dan polistiren tersulfonasi dapat dilihat pada Gambar 2. 12 [Smitha et al., 2003].
Gambar 2. 12 Termogram polistiren dan polistiren tersulfonasi.
Gambar 2.12 merupakan termogram TGA dari (a) Polistiren; (b) Polistiren Tersulfonasi
Pada analisis DSC, sampel dan referensi diberikan pemanasan masing-masing. Kemudian, energi diberikan agar menjaga suhu dari sampel dan referensi konstan. Sehingga pada
17 akhirnya akan diperoleh nilai perbedaan daya listrik antara sampel dengan referensi (d∆Q/dt) setiap waktu tertentu atau temperatur tertentu. Dengan menggunakan analisis termal ini, sejumlah sifat-sifat termal polimer dapat diketahui, termasuk titik kristalisasi, suhu transisi gelas (Tg), suhu pelelehan (T m), perubahan kalor (∆H), suhu dekomposisi dan stabilitas
panas dari suatu material [Stevans, 2001]. 2.7.5. Analisis Mekanik
Analisis mekanik digunakan untuk mengetahui kekuatan mekanik dari sampel yang diuji. Pengukuran kekuatan mekanik ini dilakukan dengan menggunakan tensile tester (Autograph). Dengan menggunakan analisis mekanik ini, akan diketahui nilai dari kekuatan tarik atau tegangan saat putus (tensile strength atau stress at break), persen regangan saat putus (% elongation atau % strain at break), dan perbandingan nilai tegangan-regangan saat putus (stress per strain at break). Semua nilai tersebut dapat dihitung dari beberapa data yang diperoleh dengan menggunakan alat tensile tester tersebut, yaitu dari data gaya yang diberikan saat sampel putus (dalam Kgf) dan perpanjangan sampel saat putus (dalam mm2). Untuk menentukan nilai kekuatan tarik dari sampel saat putus, nilai dari gaya yang diberikan untuk memutuskan sampel dibagi dengan luas sampel, yang dihitung dari tebal sampel dikali dengan lebar penampang sampel. Nilai kekuatan tarik sampel saat putus tersebut dapat dihitung dengan menggunakan rumus :
F A
σ
=Dengan σ = kekuatan tarik (Kgf/mm2) F = beban pada saat putus (Kgf) A = luas penampang (mm2)
Persen regangan saat putus menggambarkan perpanjangan dari suatu sampel ketika diberi beban sampai mengalami pemutusan. Nilai regangan ini dapat diperoleh dengan membagi nilai perubahan panjang dengan panjang awalnya kemudian dikalikan dengan 100%. Nilai % regangan saat putus tersebut dapat dihitung dengan menggunakan rumus :
% 0 0 ( ) ε = l l 100% l − × Dengan ε = % regangan l = panjang akhir (mm)
18
l0 = panjang awal (mm)
Nilai tegangan dibagi regangan saat putus merupakan suatu nilai yang menyatakan ukuran kekakuan dari suatu material. Nilai tersebut diperoleh dari rumus berikut :
E
σ
ε
=
Dengan E = tegangan/regangan saat putus (Kgf/mm2) ε = % regangan
σ = kekuatan tarik (Kgf/mm2)
2.7.6. Analisis Berat Molekul Polimer
Analisis berat molekul polimer dapat dilakukan dengan menggunakan metode viskometer
Ostwald. Metode ini menggunakan perhitungan dari nilai viskositas sampel dan nilai tetapan pelarut berdasarkan jenis interaksi pelarut-polimer dan suhu pengukuran. Penentuan viskositas larutan polimer dilakukan dengan menghitung nilai η dan ηo, dimana nilai tersebut
masing-masing adalah viskositas polimer dan viskositas pelarut murni. Viskositas spesifik lalu dapat dihitung dengan menggunakan rumus:
sp
η
(
)
o oη
η
η
− =Peningkatan viskositas yang disebabkan oleh peningkatan konsentrasi polimer (c) dinyatakan sebagai viskositas tereduksi, dan besarnya dapat diperoleh dari perbandingan
sp red
c
η
η
=Besarnya viskositas tereduksi pada pengenceran tak hingga dikenal sebagai viskositas batas intrinsik atau [η], yang besarnya dapat diperoleh dari kurva sebagai berikut:
[ ]
c spη
η
=lim r o o t tη
η
η
= = Konsentrasic
spη
[ ]
η19 ηr = viskositas relatif
to = waktu alir pelarut murni
t = waktu alir larutan
Nilai ηsp dapat dihitung dengan rumus ηsp = ηr – 1. Ektrapolasi ke konsentrasi nol (larutan
yang sangat encer) menghasilkan viskositas intrinsik. Mark-Houwink menyatakan bahwa angka intrinsik berhubungan dengan berat molekul relatif polimer dengan persamaan:
[ ]
aM K. =
η
Dengan M adalah berat molekul relatif, sedangkan nilai K dan a adalah tetapan yang khas untuk sistem polimer-pelarut tertentu [Billmeyer, 1962].
2.7.7. Analisis Konduktivitas
Analisis nilai konduktivitas merupakan analisis yang dilakukan untuk mengetahui kemampuan dari sampel untuk mengantarkan proton. Alat yang digunakan untuk pengukuran nilai konduktivitas ini menggunakan dua buah elektroda dimana sampel yang akan dianalisis dijepit diantara kedua elektroda tersebut sambil dilapisi dengan kertas saring yang telah dibasahi dengan aqua dm. Arus listrik dialirkan pada kedua elektroda hingga dihasilkan nilai berupa konduktansi (dalam satuan mho atau Siemens).
Konduktansi larutan merupakan kebalikan dari tahanan. Makin rendah tahanan larutan, maka makin besar konduktansinya. Tahanan sampel bertambah dengan pertambahan panjang l dan berkurang dengan pertambahan luas penampang A. Oleh karena itu dituliskan :
l R
A
ρ
= ×
Konstanta perbandingan ρ disebut resistivitas sampel. Konduktivitas ĸ merupakan kebalikan resistivitas sehingga : 1 l R A
κ
= × atau l RAκ
=Dengan tahanan dalam Ω dan dimensi dalam m, maka satuan ĸ adalah S m-1 atau dalam S cm-1) [Atkins, 1999].
20 2.7.8. Analisis Ion Exchange Capacity (IEC)
Ion Exchange Capacity (IEC) merupakan besaran yang menyatakan kemampuan atau kapasitas sampel untuk melakukan pertukaran proton. Nilai tersebut diperoleh dengan cara titrasi asam basa menggunakan indikator fenolftalein. Sampel direndam dengan larutan asam selama beberapa waktu tertentu, kemudian larutan sampel tersebut dititrasi dengan menggunakan basa atau asam. Hasil titrasi tersebut menjadi dasar perhitungan berapa benyak proton yang dapat dipertukarkan oleh sampel [Zhang et al., 2006].