Induksi Tanaman Poliploid Talas (Colocasia esculenta L.) dengan Perlakuan Orizalin
secara In Vitro
[Induction of Taro (Colocasia esculenta L.) Polyploid by Oryzalin In Vitro
Treatment]
Aida Wulansari*, Andri F Martin, & Tri Muji Ermayanti
Pusat Penelitian Bioteknologi-LIPI, Jalan Raya Bogor Km. 46, Cibinong, 16911, Jawa Barat *Email : [email protected]
Memasukkan: Januari 2016, Diterima: Mei 2016 ABSTRACT
Genetic improvement of taro (Colocasia esculenta L.) is one of important research program to increase productivity and give better cultivation on the marginal land. Induction of polyploid plants is a method useful to increase genetic diversity. The aim of this research was to induce polyploid taro by oryzalin treatment. Polyploidy was induced from in vitro diploid taro ‘bentul’ using oryzalin at 7.5; 15; 30; 60 and 75 µM soaked for 3 days. Regenerated shoots were grown on MS medium containing 2 mg/l BAP, 1 mg/l thiamine and 2 mg/l adenine. Shoot growth was recorded four weeks (subculture-0), eight weeks (subculture-1) and twelve weeks (subculture-2) after treatments. The results showed that survival rate of treated shoots was 100%. Higher oryzalin concentration reduced the proliferation of shoots, petiole length, numbers of leaves as well as the numbers of roots. Ploidy levels analysis determined by flowcytometer for 122 plantlets were investigated. The results indicated that control shoots were diploid. All treated shoots were polyploids.Oryzalin at 60 µM gave 50% of tetraploid planlets, 30 µM of oryzalin gave 5.71% hexaploids, 60 µM of oryzalin gave 9.09% octaploids. All acclimatized plantlets gave 100% survival rate.
Keywords : Colocasia esculenta L., taro, in vitro induced polyploidy, oryzalin ABSTRAK
Perbaikan genetik talas (Colocasia esculenta L.) termasuk salah satu program penelitian yang penting untuk peningkatan produksitivitas dan perbaikan budidaya di lahan marjinal. Induksi poliploidi merupakan salah satu metode untuk memperluas keragaman genetik. Tujuan dari penelitian ini adalah untuk menginduksi tanaman talas poliploid melalui perlakuan orizalin. Induksi poliploid dilakukan terhadap tunas in vitro talas bentul diploid dengan perlakuan orizalin konsentrasi 7. 5; 15; 30; 60 dan 75 µM direndam selama 3 hari. Tunas hasil perendaman kemudian ditanam pada media MS yang mengandung 2 mg/l BAP, 1 mg/l tiamin dan 2 mg/l adenin. Pertumbuhan tunas diamati pada minggu ke-4 (subkultur-0), minggu ke-8 (subkultur-1) dan minggu ke-12 (subkultur-2) setelah perlakuan. Hasil penelitian menunjukkan bahwa persentase kemampuan tunas bertahan hidup setelah perlakuan orizalin adalah 100%. Semakin tinggi konsentrasi orizalin menurunkan proliferasi tunas, panjang petiol, jumlah daun dan jumlah akar. Analisis ploidi dilakukan menggunkan flowsitometer terhadap 122 planlet. Hasil analisis menunjukkan bahwa planlet kontrol tetap diploid. Semua perlakuan orizalin menghasilkan tanaman poliploid. Konsentrasi 60 µM orizalin menghasilkan 50% planlet tetraploid; 30 µM orizalin menghasilkan 5,71% heksaploid sedangkan 60 µM orizalin menghasilkan 9,09% oktaploid. Planlet yang diaklimatisasi mempunyai 100% daya hidup.
Kata Kunci : Colocasia esculenta L., talas, induksi poliploid in vitro, orizalin
PENDAHULUAN
Upaya pengembangan diversifikasi pangan pokok selain beras merupakan salah satu program pemerintah dalam mendukung ketahanan pangan di Indonesia. Bagi Indonesia yang merupakan salah satu pusat keanekaragaman hayati dunia, program diversifikasi pangan tidak terlalu sulit untuk dilakukan, karena sumber daya hayati yang dimiliki Indonesia sangat berlimpah dan sebagian diantaranya secara turun temurun sudah dimanfaatkan dan bahkan dibudidayakan, termasuk didalamnya jenis tanaman pangan, baik dari kelompok padi-padian, ubi-ubian dan buah-buahan
(Prana & Kuswara 2002). Diversifikasi produksi pangan dapat dilakukan melalui pengembangan pangan karbohidrat khas Nusantara spesifik lokasi seperti sukun, talas, garut, sagu, jagung dan lain-lain. Salah satu tanaman pangan yang telah lama dibudidayakan dan dimanfaatkan di Indonesia adalah talas (Colocasia esculenta L.). Talas sangat potensial, karena penggunaannya sebagai bahan pangan dapat diarahkan untuk menunjang ketahanan pangan nasional melalui program diversifikasi pangan di samping peluangnya sebagai bahan baku industri yang menggunakan pati sebagai bahan dasarnya (Hartati et al. 2003).
dan peningkatan peralihgunaan lahan menyebabkan budidaya tanaman pangan umbi-umbian seperti ubi kayu, ubi jalar termasuk talas menjadi semakin berkurang. Saat ini talas hanya dikenal sebagai tanaman pokok di daerah tertentu saja, seperti di Papua dan Mentawai. Di kebanyakan daerah di Indonesia, fungsi talas memang telah bergeser menjadi tanaman pangan camilan. Hal ini mengindikasikan bahwa talas telah mengalami erosi genetika. Budidaya talas secara terbatas masih dijumpai hampir di semua kawasan di Indonesia kecuali di daerah-daerah yang beriklim ekstrim kering seperti di sebagian NTB dan NTT (Prana & Kuswara 2002). Di Bogor, umbi talas merupakan salah satu sumber penghasil produk makanan yang sangat terkenal. Kondisi ini menunjukkan bahwa talas diminati oleh sebagian besar masyarakat sehingga talas penting sebagai salah satu jenis tanaman untuk diversifikasi pangan.
Potensi genetik tanaman dapat ditingkatkan dengan pemuliaan tanaman. Pemuliaan tanaman talas melalui hibridisasi atau persilangan terkendala oleh bunga yang jarang terbentuk karena pembungaan yang sangat dipengaruhi oleh faktor lingkungan terutama suhu (Ivancic et al. 2008). Selain itu, selama ini talas diperbanyak secara vegetatif sehingga memiliki keragaman genetik sempit. Salah satu strategi yang dapat digunakan untuk mengatasi kendala tersebut antara lain dengan pemuliaan mutasi menggunakan iradiasi sinar Gamma pada talas satoimo (Martin et al. 2013), fusi protoplas (Martin et al. 2015) atau teknik manipulasi lain seperti induksi tanaman poliploid sehingga keragaman genetik talas dapat diperluas. Poliploidi adalah kondisi pada suatu organisme yang memiliki set kromosom (genom) lebih dari sepasang.
Penggunaan senyawa anti mitotik seperti kolkisin dan orizalin untuk menggandakan kromosom telah dilakukan pada banyak spesies tanaman. Meskipun kolkisin efisien dalam menghasilkan poliploid, kolkisin bersifat sangat toksik bagi manusia. Orizalin dapat digunakan sebagai senyawa alternatif untuk penggandaan kromosom dan memiliki sifat yang kurang toksik dibandingkan kolkisin (Miguel & Leonhardt 2011). Kolkisin memiliki daya afinitas yang lemah terhadap tubulin tanaman sehingga untuk menginduksi tanaman poliploid harus digunakan
pada konsentrasi milimolar, sedangkan orizalin memiliki daya afinitas yang kuat terhadap tubulin tanaman sehingga hanya memerlukan konsentrasi yang lebih rendah (mikromolar) untuk menginduksi tanaman poliploid (Sattler et al. 2016).
Induksi poliploidi telah banyak dilakukan pada berbagai tanaman dengan tujuan antara lain sebagai sumber tetua untuk menghasilkan tanaman triploid tanpa biji dan peningkatan kualitas buah seperti pada jeruk mandarin (Aleza et al. 2009), jeruk pamelo (Kainth & Grosser 2010), melon (Zhang et al. 2010), semangka (Noh et al. 2012) serta pisang (Kanchanapoom & Koarapatchaikul 2012). Selain itu juga untuk meningkatkan jumlah biomassa atau fitokimia pada tanaman obat-obatan seperti Artemisia annua (Banyai et al. 2010) dan Centella asiatica (L.) Urban (Kaensaksiri et al. 2011). Induksi poliploidi juga dilakukan pada tanaman hias untuk memperbesar ukuran dan warna bunga seperti pada mawar (Kermani et al., 2003) dan anggrek (Miguel & Leonhardt 2011). Pada tanaman sumber pangan, induksi poliploidi antara lain bertujuan untuk meningkatkan produktivitas hasil panen mengingat tanaman poliploid (triploid atau tetraploid) diketahui mempunyai sosok, ukuran buah, umbi atau bunga yang lebih besar dibandingkan dengan tanaman diploidnya (Suryo 2007).
Penelitian tentang perbanyakan bibit talas melalui kultur jaringan telah banyak dilakukan, demikian juga mikropropagasi talas unggulan yaitu ‘bentul’ sudah berhasil dilakukan oleh Wulansari et al. (2013), namun penelitian tentang metode yang optimal untuk induksi poliploidi secara in vitro pada tanaman talas aksesi bentul belum pernah dilakukan. Tujuan dari penelitian ini adalah untuk memperoleh metode induksi poliploidi menggunakan perlakuan orizalin untuk menghasilkan tanaman talas bentul poliploid. Talas bentul poliploid yang dihasilkan kemudian akan diseleksi sehingga mendapatkan tanaman yang memiliki produktivitas tinggi terkait dengan ukuran umbi yang lebih besar dibandingkan dengan talas diploid.
BAHAN DAN CARA KERJA
Eksplan yang digunakan sebagai bahan untuk induksi poliploidi adalah tunas in vitro talas bentul berumur 2 bulan. Tunas in vitro tersebut dihilangkan pelepahnya sampai berukuran 0,5 cm.
Metode induksi yang digunakan adalah perendaman dan pengocokan tunas in vitro dalam larutan orizalin saja tanpa media MS (Murashige & Skoog, 1962) selama 3 hari. Konsentrasi orizalin yang digunakan adalah 0 (kontrol); 7,5; 15; 30; 60; dan 75 µM. Setiap perlakuan diulang 3 kali dan setiap ulangan terdiri atas 5 tunas. Tunas direndam dalam erlenmeyer berisi 15 ml larutan orizalin dan dikocok dengan kecepatan 100 rpm. Metode ini merupakan modifikasi dari metode induksi poliploid pada tanaman Artemisia annua L. menggunakan orizalin (Ermayanti et al. 2014). Setelah perendaman selama 3 hari, tunas dicuci dengan akuades steril, dihilangkan pelepah terluarnya, kemudian ditanam ke media perbanyakan tunas. Media perbanyakan tunas yang digunakan adalah media MS dengan penambahan 2 mg/l BAP, 2 mg/l adenin dan 1 mg/l tiamin (Wulansari et al. 2013). Media mengandung gula (30 g/l), pH media diatur 5,8 dan dipadatkan dengan agar (3 g/l). Tunas dipelihara di dalam ruang inkubasi pada suhu 25-26° C dengan pencahayaan kontinu. Persentase tunas yang bertahan hidup diamati 4 minggu setelah perendaman orizalin.
Pengamatan pertumbuhan tunas in vitro talas bentul setelah perendaman orizalin mulai dilakukan dari subkultur ke-0 (SK-0) sampai subkultur ke-2 (SK-2). Subkultur dilakukan setiap 4 minggu ke media perbanyakan tunas. Pengamatan pertumbuhan dilakukan terhadap jumlah tunas majemuk, tinggi tunas, jumlah daun dan jumlah akar. Pengamatan terhadap jumlah tunas majemuk dilakukan dengan cara menghitung jumlah anakan yang muncul dari setiap tunas in vitro. Parameter panjang petiol atau tangkai daun diamati dengan cara mengukur pelepah atau tangkai daun terpanjang, sedangkan parameter jumlah daun dilakukan dengan cara menghitung helaian daun yang masih segar dan berwarna hijau. Pengamatan dilakukan pada umur 4, 8 dan 12 minggu setelah perlakuan. Pengamatan terhadap jumlah akar dilakukan dengan cara menghitung akar yang tumbuh dari setiap tunas in vitro pada umur 4, 8 dan 12 minggu setelah perlakuan.
Analisis ploidi dilakukan terhadap tunas in vitro pada subkultur ke-2. Penentuan tingkat ploidi dilakukan dengan menggunakan flowsitometer Cyflow ® Space Partec, Germany. Analisis ploidi dilakukan dengan menggunakan larutan Cystain
UV-ploidy yang berisi buffer dan pewarna DNA. Potongan daun diberi label, lalu dibungkus dengan kertas tisu yang telah dibasahi dengan akuades, kemudian disimpan di dalam plastik. Potongan daun berukuran sekitar 0,5 cm2 diletakkan di atas cawan petri dan ditetesi 1,5 ml buffer cystain UV-Ploidi, kemudian dicacah dengan silet. Cacahan daun disaring dengan saringan 30 μm dan filtrat dimasukkan dalam tabung kuvet untuk analisis. Sampel dibaca pada panjang gelombang 440 nm dan kecepatan 1000 nuclei per detik (Ermayanti et al. 2013). Daun tanaman diploid digunakan sebagai standar. Jumlah DNA pada inti sel sampel kontrol tanaman diploid dikalibrasi sehingga mendapatkan puncak spektrum pada channel 200. Tanaman triploid menunjukkan puncak pada channel 300 dan tanaman tetraploid menunjukkan puncak pada channel 400. Tanaman miksoploid menunjukkan lebih dari 1 puncak pada channel yang berbeda. Rata-rata kandungan DNA (mean) dan coefficient of variation (CV) dari tiap-tiap sampel pada setiap puncak diamati dan dibandingkan dengan tanaman kontrol (diploid), dan ditentukan tingkat ploidinya sesuai dengan kelipatan rata-rata jumlah kandungan DNA.
Jumlah total talas bentul hasil perendaman berbagai konsentrasi orizalin yang dianalisis flowsitometer sebanyak 122 tunas. Secara rinci jumlah tunas yang dianalisis dari tiap konsentrasi orizalin sebagai berikut : kontrol sebanyak 15 tunas, konsentrasi 7,5 µM sebanyak 15 tunas, konsentrasi 30 µM sebanyak 35 tunas, konsentrasi 60 µM sebanyak 22 tunas dan konsentrasi 75 µM sebanyak 35 tunas.
Aklimatisasi dilakukan terhadap planlet poliploid hasil analisis flowsitometer dan planlet diploid sebagai kontrol berjumlah 8 planlet. Planlet yang sudah berakar dikeluarkan dari botol dengan cara menambahkan sedikit air ke dalam botol, kemudian sedikit dikocok sehingga planlet akan terlepas dengan sendirinya dari media. Planlet yang sudah terlepas dari media kemudian dikeluarkan dari botol dan dicuci bersih sampai tidak ada media yang tertinggal di akar planlet. Planlet yang sudah bersih kemudian ditanam pada media aklimatisasi. Media yang digunakan untuk aklimatisasi adalah tanah, cocopeat dan sekam bakar dengan perbandingan 2 : 1 : 1. Media aklimatisasi kemudian dimasukkan ke dalam pot
Konsentrasi orizalin (µM)
Jumlah tunas majemuk
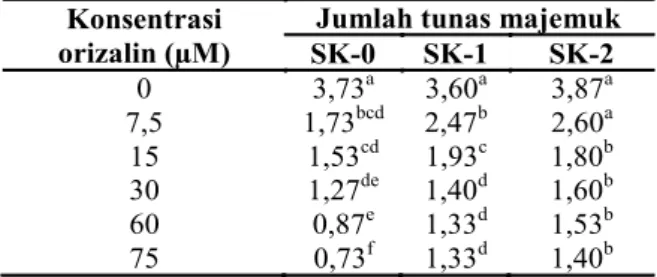
SK-0 SK-1 SK-2 0 3,73a 3,60a 3,87a 7,5 1,73bcd 2,47b 2,60a 15 1,53cd 1,93c 1,80b 30 1,27de 1,40d 1,60b 60 0,87e 1,33d 1,53b 75 0,73f 1,33d 1,40b
plastik kecil. Pot yang telah berisi planlet tersebut kemudian disungkup dengan menggunakan plastik transparan dan diletakkan di tempat teduh selama dua minggu. Setelah tunas beradaptasi selama dua minggu, sungkup plastik dibuka dan tanaman diletakkan di tempat yang mendapat sinar matahari yang cukup. Jumlah total planlet bentul poliploid yang sudah diaklimatisasi adalah 111 planlet yang terdiri dari 99 planlet tetraploid, 10 planlet heksaploid dan 2 planlet oktaploid.
HASIL
Pertumbuhan tunas in vitro setelah perendaman orizalin
Pengamatan terhadap tunas in vitro pada umur 4 minggu setelah perlakuan menunjukkan bahwa 100% tunas mampu bertahan hidup pada perlakuan orizalin konsentrasi 7,5; 15; 30; 60; dan 75 µM. Morfologi tunas in vitro umur 4 minggu setelah perlakuan perendaman orizalin ditunjukkan pada Gambar 1.
Pengamatan terhadap pertumbuhan tunas in vitro setelah perlakuan perendaman pada larutan orizalin menunjukkan penurunan dengan semakin meningkatnya konsentrasi orizalin. Rata-rata jumlah tunas majemuk menunjukkan penurunan dengan semakin meningkatnya konsentrasi orizalin (Tabel 1). Pada SK-0, jumlah tunas majemuk dari semua konsentrasi orizalin yang diujikan berbeda nyata terhadap kontrol. Pada SK-1, konsentrasi orizalin 7,5 –15 µM menunjukkan jumlah tunas majemuk berbeda nyata dibandingkan dengan konsentrasi orizalin 30–75 µM. Pada SK-2, respon tunas pada perlakuan konsentrasi orizalin 7,5 µM berbeda nyata dibandingkan dengan konsentrasi yang lainnya.
Pengamatan terhadap panjang petiol menunjukkan kecenderungan menurun dengan meningkatnya konsentrasi orizalin (Tabel 2). Pola
respon tersebut serupa dari SK-0 sampai SK-2. Respon panjang petiol talas Bentul dengan perlakuan perendaman orizalin pada SK-0 berbeda nyata pada konsentrasi orizalin 7,5-30 µM, sedangkan pada konsentrasi 60-75 µM tidak berbeda nyata. Pada SK-1, panjang petiol talas pada perendaman 7,5–15 µM orizalin. Pada SK-2, perlakuan orizalin pada konsentrasi 7,5–15 µM panjang petiol tidak berbeda nyata, demikian pula pada konsentrasi 60 dan 75 µM. Pengamatan terhadap jumlah daun memperlihatkan kecenderungan yang tidak sama seperti pada parameter jumlah tunas majemuk dan tinggi tunas yang cenderung menurun dengan meningkatnya konsentrasi orizalin. Jumlah daun antara kontrol dan perlakuan orizalin 7,5 µM pada SK-0 dan SK-1 tidak berbeda nyata (Tabel 3). Demikian pula pada SK-0 perendaman konsentrasi 15 dan 30 µM memiliki rata-rata jumlah helai daun yang sama seperti pada SK-1 pada konsentrasi 7,5 dan 15 µM. Rata-rata jumlah daun pada tunas hasil perendaman 60 µM pada SK-1 dan SK-2 meningkat dibandingkan dengan jumlah daun dari konsentrasi yang lebih rendah yaitu 30 µM.
Pertumbuhan akar pada tunas hasil perendaman orizalin lebih lambat dibandingkan dengan kontrol. Rata-rata jumlah akar tunas kontrol dan tunas hasil perendaman orizalin
A B C D E F
P3O2 P3O4
Keterangan: Perbedaan huruf menunjukkan berbeda nyata
berdasarkan DMRT
Gambar 1. Pertumbuhan tunas in vitro umur 4 minggu setelah perlakuan perendaman orizalin. (A. Kontrol, B.
Konsentrasi 7,5 µM, C. Konsentrasi 15 µM, D. Konsentrasi 30 µM, E. Konsentrasi 60 µM, F. Konsentrasi 75 µM)
Tabel 1. Jumlah tunas majemuk talas bentul hasil
Konsentrasi orizalin (µM)
Jumlah tunas majemuk
SK-0 SK-1 SK-2 0 3,73a 3,60a 3,87a 7,5 1,73bcd 2,47b 2,60a 15 1,53cd 1,93c 1,80b 30 1,27de 1,40d 1,60b 60 0,87e 1,33d 1,53b 75 0,73f 1,33d 1,40b Konsentrasi orizalin (µM) Panjang petiol (cm) SK-0 SK-1 SK-2 0 2,73a 2,97a 3,03a 7,5 1,83b 2,20b 2,53a 15 1,44bc 1,87c 2,00a 30 1,10cd 1,38d 1,53b 60 0,91d 1,17d 1,40b 75 0,90d 1,13d 1,27b Konsentrasi orizalin (µM) Jumlah akar SK-0 SK-1 SK-2 0 3,27a 3,40a 3,67a 7,5 1,40cd 1,60cde 2,13bc 15 1,67bc 1,80bcd 1,93cd 30 0,67de 1,40e 1,73e 60 0,67de 1,53de 1,80de 75 0,27f 1,67bcde 1,93cd
semua konsentrasi berbeda nyata (Tabel 4). Pada SK-0 konsentrasi 7,5 dan 15 µM rata- rata jumlah akar yang tumbuh berbeda dibandingkan dengan tunas yang berasal dari konsentrasi 30, 60 dan 75 µM. Pertumbuhan akar mulai meningkat pada SK-1 dan SK-2 meskipun lebih sedikit dibandingkan dengan jumlah akar pada kontrol.
Analisis ploidi dengan flowsitometer
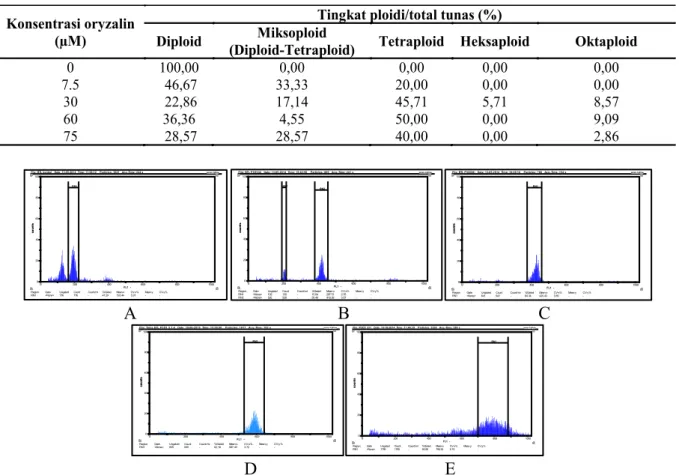
Tingkat ploidi pada semua tunas yang mampu bertahan hidup disajikan pada Tabel 5. Tunas kontrol yang dianalisis sebanyak 15 tunas dan semuanya diploid. Tunas yang berasal dari perendaman orizalin selain mampu menghasilkan tunas poliploid juga menghasilkan tunas diploid dengan persentase yang berbeda-beda. Semakin tinggi konsentrasi orizalin cenderung semakin menurun persentase tunas diploidnya.
Jumlah tunas yang dianalisis flowsitometer asal perendaman orizalin 7,5 µM menghasilkan persentase tunas diploid lebih banyak dibandingkan dengan tunas miksoploid (diploid-tetraploid) dan tunas tetraploid. Persentase tunas tetraploid pada konsentrasi ini lebih rendah dibandingkan dengan persentase tunas miksoploid. Tunas asal perendaman konsentrasi 30 µM menghasilkan persentase tunas tetraploid yang lebih banyak dibandingkan dengan tunas heksaploid dan oktaploid, bahkan lebih banyak dibandingkan persentase tunas yang tetap diploid. Persentase tunas tetraploid yang dihasilkan dari perlakuan perendaman konsentrasi 60 µM paling tinggi dibandingkan konsentrasi yang lain yaitu 50%. Pada konsentrasi yang lebih tinggi yaitu 75 µM, dihasilkan persentase tetraploid yang juga masih tinggi yaitu 40%.
Selain diperoleh tunas diploid, miksoploid dan tertraploid, juga diperoleh tunas heksaploid dan oktaploid dengan persentase yang sedikit. Demikian pula pada perendaman konsentrasi 60 µM, juga diperoleh tunas oktaploid namun tidak diperoleh tunas heksaploid. Persentase tunas oktaploid yang dihasilkan dari perendaman konsentrasi 60 µM yaitu 9,09%. Persentase tunas oktaploid yang dihasilkan dari perendaman 75 µM adalah 2,86%.
Beberapa contoh hasil analisis flowsitometer ditampilkan dalam bentuk histogram (Gambar 2). Gambar 2A mewakili profil tunas diploid yang diperoleh dari tunas kontrol. Gambar 2B menunjukkan profil tunas miksoploid yang merupakan chimera, karena memiliki 2 macam set kromosom kromosom yaitu diploid dan tetraploid. Gambar 2C, 2D dan 2E masing-masing menunjukkan profil tunas tetraploid, heksaploid dan oktaploid.
Pertumbuhan dan morfologi tunas diploid, tetraploid, heksaploid dan oktaploid yang dihasilkan ditunjukkan pada Gambar 3. Pada umur yang sama (4 minggu), semakin tinggi tingkat ploidi mengakibatkan pertumbuhan dan morfologi tunas menjadi tidak normal. Tunas diploid dan tetraploid tidak banyak menunjukkan perbedaan morfologi. Namun morfologi tunas heksaploid dan oktaploid menunjukkan perbedaan yang besar dibandingkan dengan tunas diploid dan tetraploid. Tunas heksaploid dan oktaploid memiliki petiol dan helaian daun lebih pendek dan tebal serta memiliki warna
Tabel 2. Panjang petiol talas bentul hasil perendaman
orizalin selama 3 hari
Perbedaan huruf menunjukkan berbeda nyata berdasarkan DMRT
Tabel 3. Jumlah daun talas bentul hasil perendaman
orizalin selama 3 hari
Tabel 4. Jumlah akar talas bentul hasil perendaman
A
B
C
D
lebih gelap dibandingkan dengan tunas diploid dan tetraploid.
Aklimatisasi talas poliploid
Tahapan aklimatisasi talas bentul poliploid tidak menemui banyak kendala karena semua planlet yang diaklimatisasi mampu beradaptasi dengan kondisi ex vitro. Hasil aklimatisasi menunjukkan bahwa planlet tetraploid, heksaploid dan oktaploid semua mampu hidup 100%. Morfologi bibit talas bentul diploid, tetraploid, heksaploid dan oktaploid umur 4 bulan setelah aklimatisasi ditunjukkan pada Gambar 4.
PEMBAHASAN
Perlakuan perendaman tunas in vitro talas aksesi bentul pada larutan orizalin konsentrasi 7,5; 15; 30; 60 dan 75 µM tidak menyebabkan kematian, namun analisis ploidi menggunakan flowsitometer menunjukkan diperoleh planlet poliploid. Pengamatan sampai 12 minggu setelah perlakuan menunjukkan 100% tunas in vitro mampu bertahan hidup dan mengalami pertumbuhan. Penggunaan orizalin yang diaplikasikan pada talas bentul sebagai senyawa anti mitotik dapat menjadi alternatif selain
Konsentrasi oryzalin (µM)
Tingkat ploidi/total tunas (%)
Diploid (Diploid-Tetraploid) Miksoploid Tetraploid Heksaploid Oktaploid
0 100,00 0,00 0,00 0,00 0,00
7.5 46,67 33,33 20,00 0,00 0,00
30 22,86 17,14 45,71 5,71 8,57
60 36,36 4,55 50,00 0,00 9,09
75 28,57 28,57 40,00 0,00 2,86
Tabel 5. Analisis ploidi tunas talas bentul 12 minggu setelah perlakuan orizalin
A
B
C
D
E
File: BTL kontrol Date: 13-05-2014 Time: 11:26:12 Particles: 1641 Acq.-Time: 244 s
0 200 400 600 800 1000 0 20 40 60 80 100 FL1 -co u nts 0 200 400 600 800 1000 0 20 40 60 80 100 FL1 -co u nts RN1 partec CyFlow
Region Gate UngatedCount Count/ml%GatedMean-x CV-x% Mean-y CV-y% RN1 <None>776 776 - 47.29 193.44 5.97 - -
File: BTL P3O3(4) Date: 13-05-2014 Time: 15:43:50 Particles: 889 Acq.-Time: 241 s
0 200 400 600 800 1000 0 20 40 60 80 100 FL1 -co u n ts 0 200 400 600 800 1000 0 20 40 60 80 100 FL1 -co u n ts RN1 RN2 partec CyFlow
Region Gate UngatedCount Count/ml%GatedMean-x CV-x% Mean-y CV-y% RN1 <None> 139 139 - 15.64 207.51 2.55 - - RN2 <None> 520 520 - 58.49 419.29 3.07 - -
File: BTL P3O5(8) Date: 13-05-2014 Time: 16:09:18 Particles: 760 Acq.-Time: 154 s
0 200 400 600 800 1000 0 20 40 60 80 100 FL1 -co u n ts 0 200 400 600 800 1000 0 20 40 60 80 100 FL1 -co u n ts RN1 partec CyFlow
Region Gate UngatedCount Count/ml%Gated Mean-x CV-x% Mean-y CV-y% RN1 <None> 641 641 - 84.34 425.43 3.80 - -
File: Talas BTL P3O1 5.1.4 Date: 10-06-2015 Time: 15:58:00 Particles: 1017 Acq.-Time: 192 s
0 200 400 600 800 1000 0 20 40 60 80 100 FL1 -co u n ts 0 200 400 600 800 1000 0 20 40 60 80 100 FL1 -co u n ts RN1 partec CyFlow
Region Gate UngatedCount Count/ml%Gated Mean-x CV-x% Mean-y CV-y% RN1 <None> 835 835 - 82.10 587.43 3.72 - -
File: P3O3 331 Date: 15-10-2014 Time: 11:46:39 Particles: 3536 Acq.-Time: 299 s
0 200 400 600 800 1000 0 20 40 60 80 100 FL1 -co u nts 0 200 400 600 800 1000 0 20 40 60 80 100 FL1 -co u nts RN1 partec CyFlow
Region Gate UngatedCount Count/ml%GatedMean-x CV-x% Mean-y CV-y% RN1 <None>1799 1799 - 50.88 790.92 6.10 - -
Gambar 2. Histogram flowsitometer tunas bentul kontrol dan hasil perendaman orizalin (A. Diploid, B.
Miksoploid, C. Tetraploid, D. Heksaploid, E. Oktaploid)
Gambar 3. Pertumbuhan tunas bentul poliploid umur 4 MST (A. Diploid B. Tetraploid, C. Heksaploid ,D.
Penurunan pertumbuhan tunas in vitro setelah perlakuan diduga akibat dari rusaknya jaringan selama perlakuan perendaman sehingga memerlukan waktu yang lebih lama untuk pemulihan (Damayanti & Mariska 2003).
Hasil analisis flowsitometer menunjukkan persentase tertinggi tunas tetraploid yang dihasilkan berasal dari perlakuan orizalin konsentrasi 60 µM yaitu 50% (Tabel 5). Hasil yang sama juga ditunjukkan pada pisang mas lumut yang juga menghasilkan persentase tertinggi (30%) tunas tetraploid pada konsentrasi 60 µM (Poerba et al. 2014). Persentase tunas tetraploid yang berasal dari perendaman konsentrasi 30 dan 75 µM juga termasuk tinggi yaitu 40 dan 45,71%, namun pada kedua konsentrasi tersebut juga diperoleh tunas miksoploid yang lebih besar dibandingkan dengan perlakuan pada konsentrasi 60 µM (Tabel 5). Tunas miksoploid yang dihasilkan merupakan suatu kimera yang memiliki 2 set kromosom yang berbeda dalam 1 tunas yaitu diploid dan tetraploid. Keragaman tingkat ploidi pada konsentrasi yang sama dapat terjadi karena adanya perbedaan fase dari setiap sel yang akan menginisiasi tunas sehingga meskipun sejumlah sel pada meristem sudah terinduksi poliploid namun beberapa sel yang lain tidak terpengaruh perlakuan orizalin dan tetap bersifat diploid (Thao et al. 2003). Untuk menganalisis jumlah kromosom secara lebih pasti maupun terjadinya kimera pada penelitian ini perlu dilakukan pengamatan jumlah kromosom antara lain melalui metode ‘squashing’ seperti dilakukan pada Artemisia annua (Ermayanti et al. 2014).
Morfologi tunas in vitro bentul heksaploid dan oktaploid menunjukkan petiol dan helaian daun yang lebih pendek dan tebal serta memiliki warna yang lebih gelap dibandingkan tunas diploid dan tetraploid (hasil pengamatan kolkisin yang cenderung lebih toksik dan
berbahaya bagi kesehatan manusia (Dooghe et al. 2011). Seperti dilaporkan pada induksi poliploid tanaman Passiflora edulis Sims. menunjukkan bahwa penggunaan kolkisin atau orizalin memiliki efektifitas yang tidak berbeda dalam menghasilkan tanaman poliploid (Rego et al. 2011). Demikian juga penggunaan kolkisin dan orizalin pada tanaman Artemisia annua L memiliki efektifitas yang sama dalam menghasilkan tanaman poliploid (Ermayanti et al. 2013; Ermayanti et al. 2014). Kedua senyawa anti mitotik tersebut memiliki mekanisme yang sama dalam menghambat polimerisasi mikrotubul dan menahan mitosis pada metaphase sehingga mencegah kromosom yang sudah mengganda untuk terpisah menjadi 2 sel anakan (Jones et al. 2008).
Perlakuan orizalin pada konsentrasi yang semakin tinggi cenderung menghambat pertumbuhan (Tabel 1). Pembentukan tunas majemuk pada tunas in vitro hasil perendaman orizalin lebih rendah dibandingkan dengan tunas kontrol. Peningkatan konsentrasi orizalin cenderung menurunkan jumlah tunas majemuk. Seperti ditunjukkan oleh tunas pada umur 4 minggu setelah perlakuan (SK-0), penghambatan pertumbuhan tunas majemuk hasil perlakuan konsentrasi yang tinggi (60 dan 75 µM) lebih besar dibandingkan pada umur 8 minggu (SK-1) dan 12 minggu (SK-2) setelah perlakuan. Respon yang sama juga terjadi pada rata-rata panjang petiol (Tabel 2) dan jumlah akar (Tabel 4) yang menunjukkan semakin tinggi konsentrasi orizalin, maka semakin menurun pertumbuhannya. Respon penghambatan pertumbuhan tersebut juga ditunjukkan pada induksi tetraploid tanaman jeruk setelah perlakuan senyawa anti mitotik pada konsentrasi yang semakin tinggi dan waktu perendaman yang semakin lama (Aleza et al. 2009).
Gambar 4. Morfologi bibit talas bentul poliploid umur 4 bulan setelah aklimatisasi (Keterangan: A. Diploid, B.
visual). Karakteristik tanaman poliploid biasanya memiliki daun, petiol, batang, bunga dan buah yang lebih besar ukurannya, lebih tebal serta warna yang lebih gelap, seperti pada tanaman keladi atau Alocasia micholitziana L. (Thao et al. 2003), melon (Zhang et al. 2010) serta anggrek (Miguel & Leonhardt 2011). Talas bentul hasil penelitian ini belum mencapai pembungaan, diharapkan karakter pertumbuhan yang terjadi pada jenis tanaman tetraploid lain juga terjadi pada talas bentul.
Planlet berhasil diperoleh dari tahap pendewasaan tunas in vitro talas poliploid. Planlet dengan jumlah dan pertumbuhan akar yang baik kemudian diaklimatisasi sebagai tahap adaptasi dari kondisi in vitro ke kondisi ex vitro. Aklimatisasi planlet talas poliploid menunjukkan 100% planlet mampu bertahan hidup. Planlet heksaploid dan oktaploid mampu tumbuh namun lebih lambat dibandingkan planlet diploid dan tetraploid.
KESIMPULAN
Perlakuan perendaman tunas in vitro dalam larutan orizalin pada konsentrasi 7,5 sampai 75 µM mampu menginduksi tanaman poliploid talas bentul. Perlakuan orizalin yang paling efisien dalam dalam menghasilkan tetraploid adalah perlakuan pada konsentrasi 60 µM yang menghasilkan 50% tunas tetraploid. Perlakuan dengan konsentrasi 30 µM menghasilkan tunas heksaploid sebanyak 5,71% sedangkan perlakuan pada konsentrasi 60 µM menghasilkan tunas oktaploid sebanyak 9,09%. UCAPAN TERIMA KASIH
Ucapan terima kasih ditujukan kepada Dr. Witjaksono atas dukungannya dalam penelitian ini, juga kepada Mulyana, Meta Irlianty serta Khoerudin atas bantuannya sebagai teknisi laboratorium dan lapangan. Penelitian ini didanai oleh Sub-Kegiatan Kompetitif LIPI Eksplorasi dan Pemanfaatan Terukur Sumber Daya Hayati (Darat dan Laut Indonesia) berjudul Manipulasi Sel Somatik : Induksi Poliploidi dan Fusi Protoplas untuk Meningkatkan Produktivitas Talas (Colocasia esculenta L. Schott) dan Garut (Maranta arundinacea L.) tahun 2013-2014.
DAFTAR PUSTAKA
Aleza, P., J. Juarez, J. Ollitrault, & L. Navarro. 2009. Production of tetraploid plants of non apomictic citrus genotypes. Plant Cell Report. 28:1837-1846.
Banyai, W., R. Sangthong, N. Karaket, P. Inthima, & M. Mii, K. Supaibulwatana. 2010. Overproduction of artemisinin in tetraploid Artemisia annua L. Plant Biotechnology. 27(5):427-433.
Damayanti, F., & I. Mariska. 2003. Induksi poliploidi dengan kolkisin pada hibrida F hasil persilangan antar spesies pada tanaman panili asal Ciamis. Buletin Biologi. 6(4):589-594.
Dooghe, E., K. Van Laere, T. Eeckhaut, L. Leus, & J. Van Huylenbroeck. 2011. Mitotic chromosome doubling of plant tissues in vitro. Plant Cell Tissue Organ Culture. 104:359–373.
Ermayanti, TM., EA. Hafiizh, AF. Martin, & DE. Rantau. 2013. Pengaruh kolkisin terhadap pertumbuhan tunas Artemisia annua L. secara in vitro dan analisis tingkat ploidinya. Prosiding Seminar Nasional XXIII “Kimia dalam Industri dan Lingkungan”. Yogyakarta 13 November 2013. 513-522. Ermayanti, TM., EA. Hafiizh, AF. Martin, & DE.
Rantau. 2014. Induksi tanaman poliploid Artemisia annua L. secara in vitro dengan perlakuan konsentrasi dan lama perendaman orizalin. Prosiding Seminar Nasional XVII “Kimia dalam Pembangunan”. Yogyakarta 19 Juni 2014. 1-8.
Hartati, NS. & TK. Prana. 2003. Analisis kadar pati dan serat kasar tepung beberapa kultivar talas (Colocasia esculenta (L.) Schoott). Jurnal Natur Indonesia. 6(1):29 -33.
Ivancic, A., O. Roupsard, JQ. Garcia, M. Melteras, T. Molisale, S. Tara, V. Lebot. 2008. Thermogenesis and flowering biology of Colocasia gigantea, Araceae. Journal Plant Research. 121:73–82
Jones, JF., TG. Ranney, & TA. Eaker. 2008. A novel method for inducing polyploidy in Rhododendron seedlings. Journal American Rhododendron Society. 130-135.
autotetraploids in pummelo (Citrus grandis L. Osbeck) through colchicine treatment of meristematically active seeds in vitro. Proceding. Fla. State Horticulure Society. 123:44–48.
Kanchanapoom, K., & K. Koarapatchaikul. 2012. In vitro induction of tetraploid plants from callus cultures of diploid bananas (Musa acuminata, AA group) ‘Kluai Leb Mu Nang’ and ‘Kluai Sa’. Euphytica. 183:111–117.
Kaensaksiri, T., P. Soontornchainaksaeng, N. Soonthornchareonnon, & S. Prathanturarug. 2011. In vitro induction of polyploidy in Centella asiatica (L.) Urban. Plant Cell Tissue Organ Culture. 107:187–194.
Kermani, MJ., V. Sarasan, AV. Roberts, K. Yokoya, J. Wentworth, & VK. Sieber. 2003. Oryzalin-induced chromosome doubling in Rosa and its effect on plant morphology and pollen viability. Theortical Applied Genetica. 107:1195–1200.
Martin, AF., BW. Hapsari, & TM. Ermayanti. 2013. Penentuan klaster berdasarkan pertumbuhan tunas in vitro talas satoimo (Colocasia esculenta l.) hasil iradiasi sinar gamma. Prosiding Seminar Nasional XXIII “Kimia dalam Industri dan Lingkungan”. Yogyakarta 13 November 2013. 111-116.
Martin, AF., A. Wulansari, BW. Hapsari, & TM. Ermayanti. 2015. Isolasi, purifikasi dan kultur protoplas mesofil daun talas (Colocasia esculenta L.). Seminar Nasional Bioteknologi III. UGM 2015 (Inpress)
Miguel, TP., & KW. Leonhardt. 2011. In vitro polyploid induction of orchids using oryzalin. Scientia Horticulturae. 130:314–319.
Noh, J., S. Sheikh, HG. Chon, MH. Seong, JH. Lim, SG. Lee, GT. Jung, JM. Kim, HJ. Ju, & YC. Huh. 2012. Screening different methods of
tetraploid induction in watermelon (Citrullus lanatus (thunb.) Manst. & Nakai). Horticulture Environment Biotechnology. 53 (6):521-529.
Poerba, YS., Witjaksono, F. Ahmad, & T. Handayani. 2014. Induksi dan karakterisasi pisang mas lumut tetraploid. Jurnal Biologi Indonesia. 10(2):191-200.
Prana, MS, & T. Kuswara. 2002. Budidaya Talas: Diversifikasi untuk Menunjang Ketahanan Pangan Nasional. Medikom Pustaka Mandiri. Rego, MM., ER. Rego, CH. Bruckner, FL. Finger, & WC. Otoni. 2011. In vitro induction of autotetraploids from diploid yellow passion fruit mediated by colchicine and oryzalin. Plant Cell Tissue Organ Culture .107:451– 459
Sattler, MC., CR. Carvalho, & WR. Clarindo. 2016. The polyploidy and its key role in plant breeding. Planta. 243:281-296.
Suryo. 2007. Sitogenetika. Gadjah Mada University Press.
Thao, NTP., K. Ureshino, I. Miyajima, Y. Ozaki, & H. Okubo. 2003. Induction of tetraploids in ornamental Alocasia through colchicine and oryzalin treatments. Plant Cell, Tissue and Organ Culture. 72: 19–25.
Wulansari, A., AF. Martin, DE. Rantau, & TM. Ermayanti. 2013. Perbanyakan beberapa aksesi talas (Colocasia esculenta L.) diploid secara kultur jaringan dan konservasinya mendukung diversifikasi pangan. Prosiding Seminar Nasional Riset Pangan, Obat-obatan dan Lingkungan untuk Kesehatan. Bogor, 27-28 Juni 2013. 11-20.
Zhang, W., H. Hao, L. Ma, & LX. Yu. 2010. Tetraploid muskmelon alters morphological characteristics and improves fruit quality. Scientia Horticulturae. 125(3): 396-400.