KARAKTERISASI DAN KLONING FRAGMEN GEN
PROTEIN MEMBRAN LUAR (OMP)
Candidatus liberibacter
YULIANA ISMADINA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2013
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Karakterisasi dan Kloning Fragmen Gen Protein Membran Luar (OMP) Candidatus liberibacter adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2013
Yuliana Ismadina
ABSTRAK
YULIANA ISMADINA. Karakterisasi dan Kloning Fragmen Gen Protein Membran Luar (OMP) Candidatus liberibacter. Dibimbing oleh DJAROT SASONGKO HAMI SENO dan IFA MANZILA.
Gen OMP adalah gen potensial untuk identifikasi Candidatus liberibacter, bakteri penyebab penyakit CVPD (Citrus Vein Phloem Degeneration) pada tanaman jeruk. Penelitian ini bertujuan mengkarakterisasi dan mengklon fragmen gen OMP C.liberibacter isolat Malang, Indonesia. Karakterisasi dilakukan berdasarkan nukleotida dan asam amino. Kloning fragmen DNA OMP
C.liberibacter hasil isolasi dari daun jeruk yang terinfeksi diligasi ke plasmid
vektor pGEM-T Easy, dan ditransformasi ke E.coli DH5α. Hasil isolasi DNA didapatkan fragmen berukuran 696 pb. Hasil kloning ditunjukkan oleh tumbuhnya dua koloni tunggal pada media seleksi serta fragmen 696 pb hasil PCR koloni dan PCR plasmid. Berdasarkan pengurutan nukleotida, gen OMP 99% homolog dengan C.liberibacter asiaticus. Adapun karakterisasi berdasarkan asam amino menunjukkan kekerabatan dengan OMP C.liberibacter africanus, C.liberibacter
americanus, C.liberibacter solanacearum, C.liberibacter crescens, dan Rhizobium etli. Hasil karakterisasi asam amino juga ditemukan adanya domain protein yang
dikonservasi.
Kata kunci: Candidatus liberibacter, CVPD, E.coli DH5α, kloning, vektor pGEM-T Easy.
ABSTRACT
YULIANA ISMADINA. Characterization and Cloning of Outer Membrane Protein (OMP) Gene Fragment from Candidatus liberibacter. Supervised by DJAROT SASONGKO HAMI SENO and IFA MANZILA.
Outer membrane protein (OMP) gene is a potential gene to identify
Candidatus liberibacter, patogent for CVPD (Citrus Vein Phloem Degeneration)
disease in citrus plant. The objectives of this research are to clone and to characterize OMP gene fragment of Indonesian isolate C.liberibacter. Characterization based on nucleotide and amino acid. Cloning of DNA fragment of C.liberibacter OMP gene which isolated from infectious citrus, was ligated to pGEM-T Easy vector and was transformed to E.coli DH5α. DNA isolation showed fragment is 696 bp. Cloning gene fragment showed by growth two single colonies and 696 pb gene fragment from colony PCR and plasmid PCR. Characterization based on nucleotide showed OMP gene 99% homolog with
C.liberibacter asiaticus. While amino acid characterization showed relative with
outer membrane protein in C.liberibacter africanus, C.liberibacter americanus,
C.liberibacter solanacearum, C.liberibacter crescens, and Rhizobium etli. The
result of amino acid characterization showed there are conserved protein domain. Keywords: Candidatus liberibacter, cloning, CVPD, E.coli DH5α, Huanglongbing, pGEM-T Easy vector.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
KARAKTERISASI DAN KLONING FRAGMEN GEN
PROTEIN MEMBRAN LUAR (OMP)
Candidatus liberibacter
YULIANA ISMADINA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2013
Judul Skripsi: Karakterisasi dan Kloning Fragmen Gen Protein Membran Luar (OMP) Candidatus liberibacter
Nama : Yuliana Ismadina NIM : G84090068
Disetujui oleh
Dr. Dj arot Sasongko Hami Seno, MS Dr. Ifa Manzila, MS
Pembimbing I Pembimbing II
Judul Skripsi : Karakterisasi dan Kloning Fragmen Gen Protein Membran Luar (OMP) Candidatus liberibacter
Nama : Yuliana Ismadina NIM : G84090068
Disetujui oleh
Dr. Djarot Sasongko Hami Seno, MS Pembimbing I
Dr. Ifa Manzila, MS Pembimbing II
Diketahui oleh
Dr. Ir. I Made Artika, M.App.Sc Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari hingga bulan Mei 2013 ini ialah kloning gen, dengan judul Karakterisasi dan Kloning Fragmen Gen Protein Membran Luar (OMP) Candidatus liberibacter.
Terima kasih penulis sampaikan kepada Balai Besar Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian (BB-Biogen) dan Balai Penelitian Tanaman Jeruk dan Buah Subtropika (BALITJESTRO) yang telah mendanai penelitian ini. Terima kasih pula penulis ucapkan kepada Bapak Dr. Djarot Sasongko Hami Seno, MS dan Ibu Dr. Ifa Manzila, MS selaku pembimbing, serta Bapak Dr. Tri Puji yang telah banyak memberi saran. Di samping itu, penghargaan penulis sampaikan kepada Mbak Fitrianingrum Kurniawati, M.Si dan Kak Faris Fathin, S.Si dari Lab. Biokimia BB Biogen yang telah membantu selama pengumpulan data. Terima kasih kepada seluruh teman-teman Biokimia 46, Riska, Yuli, Rahma, Eva, dan Ziah atas dukungan dan semangatnya. Ungkapan terima kasih yang terdalam penulis sampaikan kepada mamah, bapak, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat, terutama untuk perkembangan ilmu biokimia.
Bogor, Oktober 2013
DAFTAR ISI
DAFTAR GAMBAR vi DAFTAR LAMPIRAN vi DAFTAR TABEL vi PENDAHULUAN 1 Latar Belakang 1 Perumusan Masalah 2 Tujuan Penelitian 2 Manfaat Penelitian 2 METODE 2 Bahan 2 Alat 2Prosedur Analisis Data 3
HASIL DAN PEMBAHASAN 5
Hasil 5
Pembahasan 9
SIMPULAN DAN SARAN 11
Simpulan 11
Saran 11
DAFTAR PUSTAKA 11
LAMPIRAN 14
DAFTAR GAMBAR
1 Amplikon fragmen DNA OMP 5
2 Koloni transforman yang berhasil tumbuh dalam media selektif 6 3 Elektroforegram hasil PCR koloni transforman yang diamplifikasi
dengan primer spesifik OMPet 6
4 Elektroforegram hasil PCR plasmid rekombinan yang diamplifikasi
dengan primer spesifik OMPet 6
5 Sekuen fragmen DNA OMP sebanyak 696 pb yang menyandi 232 asam
amino 7
6 Pohon filogenetik hasil penyejajaran berdasarkan kesamaan nukleotida 7 7 Beberapa domain protein yang dikonservasi terdeteksi pada fragmen
OMP sampel 8
8 Daftar domain protein yang dikonservasi 9
DAFTAR LAMPIRAN
1 Diagram alir penelitian 14
2 Homologi berdasarkan nukelotida 15
3 Kekerabatan berdasarkan asam amino 19
DAFTAR TABEL
1 Hasil analisis homologi dengan 4 isolat berdasarkan nukleotida 8 2 Hasil analisis kekerabatan berdasarkan asam amino 8
PENDAHULUAN
Latar BelakangHuanglongbing atau CVPD (Citrus Vein Phloem Degeneration) merupakan penyakit yang mematikan pada tanaman jeruk (Garnier et al. 1984). Penyakit CVPD pertama kali diidentifikasi di Indonesia pada tahun 1988 di Kecamatan Malangke Barat, Sulawesi Selatan dengan kerugian mencapai 1.040 ha (BPTP Sulsel 2002). Tanaman yang terinfeksi penyakit CVPD menunjukkan belang-belang kuning pada daun dan buahnya berukuran lebih kecil dari ukuran normal (Halbert dan Manjunath 2004; Gottwald et al. 2007; BPTP Sulsel 2002).
Candidatus liberibacter adalah bakteri patogen penyebab penyakit CVPD,
dimana terjadi kerusakan jaringan floem pada tumbuhan sehingga mengalami degenerasi (Garnier et al. 1984). C.liberibacter tersebar di sentra perkebunan jeruk yang dibawa oleh kutu loncat jeruk Diaphorina citri (Aubert 1987; Gottwald et al. 1989; Hung et al. 1999) dari bibit jeruk yang sudah terinfeksi. Deteksi keberadaan infeksi C.liberibacter cukup sulit dilakukan karena inkubasi bakteri pada jaringan membutuhkan waktu sekitar 6 bulan hingga tiga tahun sejak infeksi (Weinert et al. 2004). Lamanya waktu pendeteksian ini mendorong pengembangan metode deteksi yang lebih cepat, efektif, dan efisien.
Analisis PCR-RFLP (Polymerase Chain Reaction-Restriction Fragment
Length Polymorphism) (Jagoueix et al. 1996), mikroskop elektron (Laffeche &
Bove 1970), hibridisasi dot-blot (Garnier & Bove 1993), nested PCR dan TaqMan PCR (Lin et al. 2010 merupakan teknik yang sering digunakan namun memerlukan tenaga ahli, biaya tinggi, dan sulit untuk skala besar (Lau et al. 2011). Deteksi yang lebih murah, akurat, dan dapat diaplikasikan dalam jumlah besar adalah ELISA (Enzyme-Linked Immuno-Sorbant Assay) (Omrani et al. 2009). Untuk itu dibutuhkan antibodi spesifik sebagai antibodi primer (Clarke & Adam 1977). C.liberibacter tidak dapat dikulturkan dalam media sehingga produksi antigen cukup sulit (Nurhadi 2012). Dengan demikian, perlu dikembangkan protein rekombinan yang dikembangkan dari protein C.liberibacter sebagai marka pengenal dari C.liberibacter (Lau et al. 2011). OMP (outer membrane protein) merupakan protein yang potensial untuk identifikasi bakteri C.liberibacter (Khushiramani et al. 2007). Hal itu disebabkan oleh perannya sebagai permukaan antigen saat menginfeksi inang selain sebagai penyusun membran terluar bakteri Gram-negatif. Antigen yang dikenali oleh inang akan merangsang produksi antibodi pada sel inang.
Pada penelitian ini dilakukan karakterisasi bakteri dan kloning fragmen DNA OMP C.liberibacter. Tahapan-tahapannya meliputi isolasi DNA OMP
C.liberibacter, amplifikasi dengan PCR, elektroforesis, lalu diklon ke vektor
pGEM-T Easy, dan ditransformasi ke E.coli DH5α. Hasil amplifikasi juga akan dilakukan perunutan DNA dan dianalisis homologi dan kekerabatannya. Hipotesis penelitian ini adalah C.liberibacter isolat Malang, Indonesia dapat ditentukan homologinya dan kloning gen dapat dilakukan sebagai tahap awal pembuatan OMP rekombinan.
2
Perumusan Masalah
Protein membran luar (OMP) C.liberibacter isolat Malang, Indonesia berpotensi sebagai marka deteksi namun karakterisasi gen tersebut dan kloning sebagai tahap awal pembuatan antigen belum pernah dilakukan.
Tujuan Penelitian
Penelitian ini bertujuan mengklon dan mengkarakterisasi fragmen gen OMP C.liberibacter berdasarkan urutan nukleotida dan asam amino.
Manfaat Penelitian
Penelitian ini untuk mengetahui kesamaan sekuen nukleotida dan sekuen asam amino fragmen gen OMP C.liberibacter isolat Malang, Indonesia. Manfaat lain yakni menyediakan sel E.coli yang telah memiliki fragmen gen OMP. Fragmen gen tersebut dapat digunakan pada tahap penelitian selanjutnya yaitu kloning ke vektor ekspresi dan ekspresi proteinnya.
METODE
BahanBahan-bahan yang digunakan untuk isolasi dan amplifikasi DNA dari daun jeruk adalah daun jeruk (berasal dari Balitjestro -Balai Penelitian Tanaman Jeruk dan Buah Subtropika-, Malang, Jawa Timur) yang terinfeksi bakteri
C.liberibacter, bufer ekstraksi (larutan CTAB 10%, Tris-HCl 1 M pH 8, larutan
EDTA 0,5 M pH 8, larutan NaCl 5 M), kloroform:isoamilalkohol (24:1), etanol 70%, natrium asetat, 2-propanol, dan bufer TE (Tris-HCl dan EDTA), Master Mix
Taq polimerase, primer OMPet2-reverse dan OMPet2-forward serta ddH2O.
Bahan-bahan untuk elektroforesis meliputi agarosa, EtBr, bufer TAE (Tris Base,
Glacial Acetic Acid, 0.5M EDTA pH 8, H2O) 0,5x, marker 1 kb plus DNA ladder.
Bahan-bahan untuk ligasi yaitu plasmid vektor pGEM-T Easy, enzim T4 ligase, bufer ligasi 2x. Transformasi hasil ligasi dilakukan menggunakan bakteri E.coli DH5-α dengan media cair (NaCl 1%, Trypton 1%, dan yeast extract 0,5%) dan padat (ditambah 2% agar yang mengandung ampisilin 100 μg/ml). Bahan-bahan untuk PCR koloni dan PCR plasmid serupa dengan amplifikasi DNA seperti disebutkan di atas.
Alat
Alat–alat yang digunakan dalam penelitian ini adalah mortar, tabung Eppendorf, pipet mikro, pH meter, tip plastik, sentrifus Sorvall MC 12V, sentrifus
Kokusan H-103N Series, alat elektroforesis BIO RAD Power Pac 300, vorteks Thermolyne Maxi Mix II, UV Transluminator BIO-RAD, PCR ESCO, oven,
3 inkubator Orbital Incubator SI50, laminar air flow ESCO Laboratory Fume Hood, autoklaf, neraca analitik Denver Instrument AA160, oven, peralatan gelas kaca, dan kertas alumunium.
Prosedur Analisis Data
Isolasi Fragmen DNA OMP dari Daun Jeruk yang Terinfeksi CVPD (Modifikasi Doyle & Doyle 1990)
Daun jeruk yang terinfeksi CVPD ditimbang sebanyak 0.2 g lalu digerus di dalam mortar dingin dengan bufer ekstraksi (CTAB 10%, Tris HCl 1 M pH 8, EDTA 0.5 M pH 8, NaCl 5 M) sebanyak 500 µl. Ekstrak kemudian dipindahkan ke dalam tabung Eppendorf, dibolak-balik, diinkubasi (60 menit, 65oC) dengan dibolak-balik setiap 10 menit, diinkubasi dalam es 2 menit, kemudian ditambah kloroform:isoamilalkohol (24:1) sebanyak 500 µl. Ekstrak divorteks kemudian disentrifugasi (12000 rpm, 15 menit) dan supernatan dipindahkan ke tabung Eppendorf baru. Supernatan diberi natrium asetat sebanyak 1/10 volum, divorteks, kemudian ditambahkan isopropanol (2-propanol) 2/3 volum, dibolak-balik, kemudian diinkubasi (-20oC semalam). Selanjutnya disentrifugasi (12000 rpm, 10 menit) dan peletnya dicuci dengan 500 µl etanol 70%, disentrifugasi kembali (12000 rpm, 5 menit). Supernatan dibuang, peletnya ditambah 50 µl bufer TE, lalu disimpan pada suhu -20oC.
Amplifikasi Fragmen DNA OMP (modifikasi Lau et al 2011)
Komposisi reaksi PCR terdiri atas 1 µl sampel, 12,5 ml Master Mix Taq polimerase, 1 µl primer OMPet2-forward (5’-AACACCAGGATCCTTCTCCGA-3’), 1 µl OMPet2-reverse (5’-TTAATTAAGCTTCCCTCACTC-(5’-AACACCAGGATCCTTCTCCGA-3’), dan 4,5 µl ddH2O. Kondisi PCR meliputi dengan kondisi predenaturasi (94oC, 5 menit),
denaturasi (94oC, 90 detik), penempelan primer (59oC, 45 detik), amplifikasi (72oC, 90 detik) selama 35 siklus kemudian dilanjutkan dengan pemanjangan akhir (72oC, 15 menit), dan dibiarkan pada 15oC selama penyimpanan.
Elektroforesis Fragmen DNA OMP (modifikasi Lau et al 2011)
Agarosa dilarutkan dengan bufer TAE 0.5x menjadi larutan gel 1%. EtBr ditambahkan sebanyak 1 µl. Larutan gel agarosa dituang ke dalam cetakan dan dimasukkan sisir untuk membentuk sumur-sumur hingga dibiarkan menjadi gel. DNA hasil amplifikasi sebanyak 10 µl dimasukkan ke dalam lubang sumur. Pada satu lubang sumur lain diisi DNA ladder. Elektroforesis dijalankan dengan aliran listrik 90 V, 50 mA, 30 menit. Setelah proses elektroforesis selesai, gel dilihat dengan sinar UV. Pita DNA yang berukuran ±600 pb hasil elektroforesis lalu diisolasi (elusi) menggunakan Gel Extraction Kit (GeneAid).
Ligasi (Promega 1999)
Fragmen DNA OMP hasil ekstraksi dari gel disisipkan pada plasmid vektor pGEM-T Easy. Reaksi ligasi terdiri atas 2.5 µl DNA OMP, 1 µl plasmid vektor pGEM-T Easy, 1.5 µl T4 ligase, dan 5 µl 2x bufer ligasi T4 ligase dicampur dalam tabung Eppendorf 1.5 ml. Reaksi diinkubasi selama semalam pada suhu 4oC. Hasil ligasi tersebut akan ditransfer ke E.coli DH5α.
4
Penyiapan bakteri kompeten (Nishimura 2003)
Sebanyak 100 µl sel E.coli simpanan dikulturkan dalam 50 ml media cair (37oC, 50-60 rpm selama semalam). Kultur E.coli diambil 2 ml, diinokulasi pada 50 ml media A (MgSO4.7H2O 0.125 g, glukosa 0,1 g dan media Luria Bertani cair
50 ml), diinkubasi dengan penggoyang (37oC, 50-60 rpm selama 2 jam). Kultur
E.coli dari media A dituang seluruhnya ke dalam tabung sentrifus Falcon steril,
didiamkan dalam es 10 menit. Selanjutnya disentrifugasi (4000 rpm, 15 menit). Peletnya diresuspensi dengan 2.5 ml media B (LB, glycerol 36%, PEG 7000 12% dan MgSO4.7H2O 12 mM). Siapan bakteri tersebut lalu dibagi ke dalam tabung
Eppendorf 1.5 ml masing-masing 100 µl, disimpan di lemari es (-80oC) hingga digunakan untuk transformasi.
Transformasi DNA rekombinan (Modifikasi Sambrook & Rossell 2001) DNA hasil ligasi dicampur dengan 100 µl sel E.coli DH5α kompeten dalam tabung Eppendorf, diinkubasi dalam es selama 15 menit, diinkubasi (42oC, 90 detik), kemudian diinkubasi kembali dalam es selama 5 menit. Setelah tahap transformasi selesai, sebanyak 900 µl media LB dimasukkan ke dalam tabung sampel, diinkubasi bergoyang (37oC, 50 rpm, 3 jam), disentrifugasi (12000 rpm, 2 menit). Sebagian supernatan dicampur dengan pelet dan dituang dalam media padat dengan ampisilin 100 µg/ml. Biakan ditumbuhkan semalam dalam inkubator (37oC).
PCR Koloni (Modifikasi Lau et al 2011)
Satu koloni tunggal diambil dengan tusuk gigi steril untuk diamplifikasi menggunakan PCR. Sebanyak 12.5 µl Master Mix Taq polimerase, 1 µl primer OMPet2-reverse, 1 µl primer OMPet2-forward, 5.5 µl ddH2O serta DNA cetakan
yang berasal dari satu koloni tunggal, diamplifikasi PCR dengan kondisi predenaturasi (94oC, 10 menit), denaturasi (94oC, 90 detik), penempelan primer (59oC, 45 detik), amplifikasi (72oC, 90 detik) selama 35 siklus, kemudian dilanjutkan dengan pemanjangan akhir (72oC, 15 menit). Hasil PCR koloni dielektroforesis pada gel agarosa 1% mengandung EtBr dalam bufer TAE 0.5x. Proses elektroforesis dialiri listrik 90 V, 50 mA, selama 30 menit. Selesai elektroforesis, gel dilihat dengan sinar UV untuk melihat pita DNA.
Isolasi Plasmid Rekombinan (Sambrook & Russell 2001)
Satu koloni transforman dikulturkan dalam 50 ml media cair dengan ampisilin 100 ppm, diinkubasi 37oC semalam. Kultur lalu disentrifugasi (8000 rpm, 3 menit). Endapan bakteri dibagi ke dalam 3 tabung Eppendorf 1.5 ml, masing-masing diberi nama B1, B2, dan B3. Endapan diresuspensi dengan 100 µl larutan I (50 mM glukosa, 10 mM EDTA, 25 mM Tris-HCl pH 7.5), divorteks, disimpan dalam es selama 5 menit, ditambahkan 200 µl larutan II (NaOH 0.2 M dan SDS 1%), dicampur manual (tanpa divorteks), disimpan dalam es selama 5 menit, ditambahkan 150 µl larutan III (kalium asetat 3 M), divorteks, disimpan dalam es selama 5 menit, disentrifugasi (8000 rpm, 10 menit). Supernatan dipindahkan ke tabung Eppendorf baru, ditambahkan 300 µl fenol:kloroform (1:1), dibolak-balik, disentrifugasi (12000 rpm, 5 menit). Lapisan paling atas dipindahkan ke tabung Eppendorf baru (diberi nama B1, B2, B3), ditambahkan isopropanol 2/3 volum, divorteks, disimpan suhu ruang 5 menit, disentrifugasi
5 (12000 rpm, 5 menit). Peletnya diresuspensi dengan 1 ml etanol 70%, divorteks, selanjutnya disentrifugasi (12000 rpm, 5 menit). Peletnya dikeringanginkan ±5 menit lalu diresuspensi dengan 20-50 µl bufer TE.
PCR plasmid pGEM-T Easy rekombinan (Modifikasi Lau et al 2011)
Komposisi reaksi PCR terdiri atas 1 µl DNA plasmid, 12,5 ml Master Mix
Taq polimerase, 1 µl primer OMPet2-forward, 1 µl OMPet2-reverse, dan 4,5 µl
ddH2O. Kondisi PCR meliputi predenaturasi (94oC, 5 menit), denaturasi (94oC, 90
detik), penempelan primer (59oC, 45 detik), amplifikasi (72oC, 90 detik) selama 35 siklus kemudian dilanjutkan dengan pemanjangan akhir (72oC, 15 menit) dan dibiarkan pada 15oC selama penyimpanan. Hasil PCR plasmid dielektroforesis pada gel agarosa 1% yang mengandung EtBr dalam bufer TAE 0.5x. Proses elektroforesis dialiri listrik 90 V, 400 mA selama 30 menit. Setelah elektroforesis selesai, gel dilihat dengan sinar UV untuk melihat pita DNA.
Pengurutan DNA
Sampel DNA hasil amplifikasi dikirim ke PT. Makrogen, Korea Selatan untuk dilakukan pengurutan basa DNA.
Analisis Homologi dan Kekerabatan
Analisis homologi berdasarkan nukleotida dilakukan menggunakan program BLAST pada peranti lunak NCBI melalui situs www.ncbi.nlm.nih.gov. Analisis kekerabatan berdasarkan asam amino dilakukan menggunakan program BLASTX pada situs yang sama.
HASIL DAN PEMBAHASAN
HasilAmplikon fragmen DNA OMP
Hasil isolasi fragmen DNA OMP dari C.liberibacter dengan teknik PCR menggunakan primer spesifik OMPet2-reverse dan OMPet2-forward memperlihatkan adanya fragmen berukuran 696 pb (Gambar 1). Hal ini menunjukkan keberhasilan isolasi fragmen DNA OMP C.liberibacter dari daun jeruk yang terinfeksi CVPD.
6
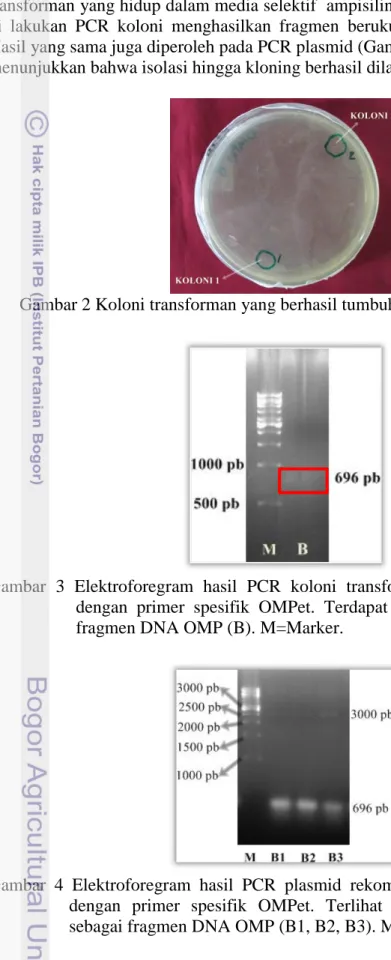
Hasil Kloning fragmen DNA OMP
Hasil kloning (Gambar 2-4) memperlihatkan diperolehnya koloni transforman yang hidup dalam media selektif ampisilin (Gambar 2), yang setelah di lakukan PCR koloni menghasilkan fragmen berukuran 696 pb (Gambar 3). Hasil yang sama juga diperoleh pada PCR plasmid (Gambar 4). Data-data tersebut menunjukkan bahwa isolasi hingga kloning berhasil dilakukan dengan baik.
Gambar 2 Koloni transforman yang berhasil tumbuh dalam media selektif
Gambar 3 Elektroforegram hasil PCR koloni transforman yang diamplifikasi dengan primer spesifik OMPet. Terdapat fragmen 696 pb sebagai fragmen DNA OMP (B). M=Marker.
Gambar 4 Elektroforegram hasil PCR plasmid rekombinan yang diamplifikasi dengan primer spesifik OMPet. Terlihat adanya fragmen 696 pb sebagai fragmen DNA OMP (B1, B2, B3). M=Marker.
7 Urutan Nukleotida Fragmen DNA OMP
Hasil pengurutan fragmen DNA OMP menghasilkan 696 pb nukleotida, yang menyandi 232 asam amino (Gambar 5). Sekuen ini memiliki dua situs restriksi (BamHI dan HindIII) yang berasal dari primer OMPet2-forward dan OMPet2-reverse.
Gambar 5 Sekuen fragmen DNA OMP sebanyak 696 pb yang menyandi 232 asam amino. Daerah yang digarisbawahi merupakan sekuen restriksi BamHI (no. 1) dan HindIII (no. 2)
Homologi Urutan Nukleotida Fragmen OMP
Urutan basa nukleotida fragmen OMP dianalisis serta dibandingkan dengan database gen di situs NCBI menggunakan program BLAST (Basic Local
Allignment Search Tool). Analisis ini dilakukan untuk mengetahui identitas dan
tingkat homologinya. Hasilnya menunjukkan bahwa sampel yang dianalisis termasuk ke dalam C.liberibacter asiaticus (Gambar 6).
Gambar 6 Pohon filogenetik hasil penyejajaran berdasarkan kesamaan nukleotida
8
Tabel 1 Hasil analisis homologi dengan 4 isolat berdasarkan nukleotida
No. Aksesi Deskripsi Query
coverage E value Max ident
JQ928885.1
Gen OMP C.liberibacter asiaticus isolat WZ, Amerika, complete cds
95% 0.0 99%
AY842432.1
Gen OMP C.liberibacter asiaticus isolat Thailand,
complete cds
95% 0.0 99%
AY842429.1
Gen OMP C.liberibacter asiaticus isolat China,
complete cds
95% 0.0 99%
AY842431.1
Gen OMP C.liberibacter asiaticus isolat Filipina,
complete cds
95% 0.0 99%
Kekerabatan Sekuen Asam Amino Fragmen OMP
Kekerabatan dianalisis dengan mensejajarkan sekuen asam amino fragmen gen penyandi OMP dengan sekuen asam amino dari database Bank Gen di situs NCBI. Penyejajaran ini menggunakan program BLASTX dengan menghasilkan protein yang disandi oleh sekuen asam amino yang sama. Didapatkan sekuen sampel homolog atau berkerabat dengan beberapa protein membran luar
Candidatus (Tabel 2) dan ditemukan pula beberapa daerah yang dikonservasi
(Gambar 7) yang ditemukan juga pada protein lain (Gambar 8). Tabel 2 Hasil analisis kekerabatan berdasarkan asam amino
Nama spesies Hits Jenis protein
C.liberibacter asiaticus str psy62 2 Antigen permukaan
C.liberibacter africanus 1 Putatif grup 1
C.liberibacter solanacearum 4 Membran luar
C.liberibacter americanus 1 Antigen permukaan
Liberibacter crescens 2 Membran luar
Rhizobium etli 7 Membran luar
Rhizobium leguminosarum 2 Membran luar
Gambar 7 Beberapa domain protein yang dikonservasi terdeteksi pada fragmen OMP sampel
9
Gambar 8 Daftar domain protein yang dikonservasi. Protein-protein yang terdaftar dalam tabel adalah protein yang memiliki domain yang sama dengan fragmen gen sampel.
Pembahasan Amplikon Fragmen DNA OMP
Isolasi DNA merupakan tahap awal untuk mendapatkan DNA murni dari suatu sel (Brown 2010). DNA C.liberibacter diisolasi dari bagian daun tanaman jeruk yang diduga terserang penyakit CVPD. Daun merupakan bagian yang menunjukkan gejala awal secara makroskopis dari serangan penyakit CVPD (Himawan et al 2010). Hasil isolasi DNA berupa DNA total yakni DNA total tanaman jeruk dan DNA total C.liberibacter. Isolasi fragmen DNA OMP
C.liberibacter dilanjutkan menggunakan teknik PCR. Teknik tersebut hanya
mengamplifikasi fragmen DNA OMP karena menggunakan primer spesifik OMPet2-reverse dan OMPet2-forward. Primer MHO 353 dan MHO 354 juga digunakan untuk mengamplifikasi DNA spesifik C.Liberibacter (Himawan et al. 2010). Reaksi amplifikasi DNA OMP berjalan dengan bantuan enzim Taq Polimerase. DNA hasil amplifikasi yang dikatalisis dengan Taq polimerase memiliki tambahan basa adenin pada ujung basanya. Penambahan satu utas basa ini memudahkan proses ligasi pada vektor pGEM-T Easy karena plasmid tersebut memiliki ujung basa timin pada situs kloningnya (Promega 2005). Hasil isolasi dan amplifikasi divisualisasi dengan sinar UV menghasilkan satu fragmen DNA dengan ukuran 696 pb yang berada diantara fragmen DNA penanda (marker/ladder) ukuran 1000 pb dan 500 pb (Gambar 1). Hasil isolasi dan amplifikasi ini sesuai dengan penelitian Ahmad et al. (2009) yang menghasilkan fragmen 600 pb dengan primer OMP-F1, OMP-F2, OMP-F3, dan OMP-F4 serta Himawan et al. (2010) dengan primer MHO353 dan MHO354, sedangkan Lau et
al. (2011) menghasilkan fragmen berukuran 877 pb dengan primer OMP-F1. Hasil Kloning Fragmen DNA OMP
Fragmen DNA OMP yang sudah dimurnikan dari gel agarosa merupakan fragmen DNA asing yang disisipkan dalam plasmid vektor. Plasmid vektor pGEM-T Easy mengandung gen resistensi antibiotik ampisilin (Promega 2005). Fragmen DNA sampel disisipkan pada bagian Multiple Cloning Site sehingga dapat dilakukan seleksi koloni transforman pada media selektif ampisilin. Hasil kloning dalam media selektif ampisilin menghasilkan dua koloni tunggal (Gambar
10
2). Koloni E.coli DH5α juga tumbuh dalam media selektif ampisilin dan X-Gal setelah ditransfer plasmid pGEM-T Easy yang membawa DNA genom pengapit transposon berukuran 0.8 kb (Nurdiani 2006). Koloni yang tumbuh pada media ampisilin diverifikasi dengan PCR koloni. PCR koloni dilakukan untuk mengetahui keberhasilan insersi fragmen sampel. Elektroforegram menunjukkan adanya fragmen 696 pb (Gambar 3). Pita DNA tersebut menunjukkan ukuran yang sama untuk posisi pita fragmen OMP saat isolasi. Verifikasi dengan PCR menggunakan plasmid rekombinan sebagai cetakan DNA dan primer yang sama berhasil dilakukan. Amplikon hasil PCR plasmid diperoleh dua fragmen, yaitu 696 pb dan ±3000 pb (Gambar 4). PCR plasmid dengan sisipan DNA genom transposon 0.8 kb menghasilkan satu fragmen (Nurdiani 2006). Pertumbuhan koloni tunggal dan fragmen DNA dengan ukuran yang sama hasil PCR koloni dan PCR plasmid menunjukkan bahwa kloning fragmen DNA OMP pada pGEM-T Easy dan E.coli galur DH5α berhasil dengan baik.
Karakterisasi fragmen DNA OMP
Pengurutan fragmen DNA OMP yang telah diamplifikasi dengan primer OMPet2-forward dan OMPet2-reverse berhasil dilakukan (Gambar 5). Sekuen nukleotida memiliki 696 pb yang menyandi 232 asam amino. Analisis menggunakan program BLAST pada situs NCBI untuk mengkarakterisasi fragmen DNA sampel berdasarkan kesamaan nukleotida. Hasil analisis memperlihatkan sekuen sampel homolog dengan spesies C.liberibacter asiaticus (Gambar 6). C.liberibacter yang menginfeksi perkebunan jeruk di wilayah Asia diantaranya Malaysia, Filipina, Thailand, dan Cina, merupakan spesies
C.liberibacter asiaticus (Ahmad et al. 2009). Tingkat homologi sampel dengan
isolat Filipina, Thailand, Cina, dan Amerika mencapai 99% (Tabel 1). Perbedaan utas antara basa adenin dan sitosin pada sekuen sampel dengan dua basa timin dari data sekuen OMP di situs NCBI, kedua basa terdapat diurutan 676 dan 677 dari sekuen sampel.
Sekuen sampel kemudian dianalisis kekerabatan asam aminonya menggunakan program BLASTX pada situs NCBI. Hasil analisis kekerabatan sekuen asam amino (Tabel 2) menunjukkan kekerabatan yang tinggi dengan beberapa protein membran luar C.liberibacter diantaranya C.liberibacter
africanus, C.liberibacter solanacearum dan C.liberibacter americanus. Selain itu,
sekuen sampel berkerabat dengan prekursor faktor YaeT untuk OMP
C.liberibacter crescens dan lipoprotein penyusun membran luar Rhizobium etli.
Berdasarkan hasil analisis asam amino, ditemukan pula domain protein yang dikonservasi. Domain protein merupakan unit-unit protein yang mengalami evolusi molekuler dan memiliki fungsi molekuler yang khusus sebagai situs katalitik atau situs pengikatan. Domain protein yang dikonservasi merupakan domain protein yang selalu ada pada setiap generasi, dapat dikelompokkan berdasarkan kesamaan sekuen asam amino walaupun memiliki fungsi yang berbeda pada setiap generasinya. Berdasarkan hasil analisis (Gambar 7-8), fragmen gen sampel menyandi domain protein antigen pelindung OMA87 yang terlibat dalam proses biogenesis membran sel (kode COG4775), protein YaeT (kode OM_YaeT) berupa kompleks protein YfiO untuk protein-protein yang menyusun membran luar bakteri Gram-negatif. Kompleks protein tersebut memiliki kesamaan pada sekuen dan fungsi sebagai paralog non-esensial seperti
11 kompleks protein YtfM. Pada protein YfiO terdapat lima kopi variabel antigen permukaan (pfam01103) dengan formasi dua-dua yang diikuti domain beta-barel membran luar sedangkan protein YtfM hanya memiliki satu kopi (pfam07244) sebagai protein dan peptida untuk sekresi dan lalu lintas metabolisme. Kode PRK11067 berupa kumpulan faktor protein YaeT pada kompleks OMP. Kumpulan faktor protein ini pun dikonservasi pada kompleks OMP bakteri Gram-negatif.
SIMPULAN DAN SARAN
SimpulanKloning fragmen gen OMP C.liberibacter isolat Malang, Indonesia berhasil dilakukan dengan ukuran fragmen 696 pb. Karakterisasi nukelotida menunjukkan fragmen gen tersebut homolog 99% dengan C.liberibacter asiaticus. Sekuen asam aminonya sekerabat dengan beberapa protein permukaan
Candidatus juga didapat daerah domain protein yang dikonservasi. Domain
protein tersebut banyak ditemukan pada beberapa OMP bakteri lain. Saran
Penelitian ini merupakan tahap awal dalam penelitian pembuatan protein rekombinan. Oleh karena itu, perlu dilakukan penelitian lanjutan untuk mengkloning fragmen gen OMP ke vektor ekspresi untuk ekspresi gennya.
DAFTAR PUSTAKA
Ahmad K, Kamaruzaman S, Habibuddin H, Jugah K, Syed OSR. 2009. Characterization of Candidatus liberibacter asiaticus isolated from Citrus
grandis and Citrus reticulate based on 16S rDNA and outer membran protein
(OMP) genes. Inter J Agric Bio. 11(4).
Aubert B. 1987. Trioza erytreae Del Guercio and Diaphorina citri Kuwayama (Homoptera: Psyllidae), the two vectors of citrus greening disease: biological aspect and possible control strategies. Fruits. 42:149-162.
[BPTP] Badan Pengkajian Teknologi Pertanian Sulsel. 2002. Pengenalan
Penyakit CVPD Pada Tanaman Jeruk dan Upaya Pengendaliannya. Luwu
Utara (ID): Departemen Pertanian.
Brown TA. 2010. Gene Cloning & DNA Analysis: an introduction sixth edition. Oxford (UK): Wiley-Blackwell.
Clarke MF, Adams AN. 1977. Characteristics of the microplate method of enzyme-linked immunosorbent assay for the detection of plant viruses. J Gen
Virol. 34:475-483.
Doyle JJ, Doyle JL. 1990. Isolation of Plant DNA from Fresh Tissue. Focus. 12:13-15.
12
Garnier MN, Danel, JM Bove. 1984. The greening organism is a gram negative bacterium. Proc 9th Conf Inter Organ Citrus Virol. pp:115-124.
Garnier M, Bove JM. 1993. Citrus greening disease. Proc 12th Conf Inter Org Citrus Vir. p:212-219.
Gottwald TR, B. Aubert, XY Zhau. 1989. Preliminary analysis of disease progress of citrus greening disease epidemics in the People’s Republic of China and French Reunion Island. Phytopathol. 79: 687-693.
Gottwald TR, Da Graca JV, Bassanezi RB. 2007. Citrus Huanglongbing The Pathogen and Its Epidemiology, and Impact. Plant Healthy Progress. Doi:10.1094.
Halbert SE, Manjunath KL. 2004. Asian citrus psyllids (Sternorrhyncha : Psyllidae) and greening disease of citrus : a literature review and assessment of risk in Florida. Florida entomologist. 87(3): 330-352.
Himawan A, Yohanes BS, Susanto S, Yohanes AT, Andrew B. 2010. Deteksi menggunakan PCR Candidatus liberibacter asiaticus, penyebab Huanglongbing pada jeruk siem dengan beberapa tipe gejala pada daun. J HPT
Tropika. 10(2):178-183.
Hung TH, ML Wu, HJ Su. 1999. Development of rapid method for the diagnosis of citrus greening disease using polymerase chain reaction. J Phytopathol. 147: 599-604.
Jagoueix S, Bove JM, Garnier M. 1996. PCR detection of the two Candidatus Liberobacter species associated with greening disease of citrus. Molecular
Cellular Probes. 10: 43-50.
Khushiramani R, Girisha SK, Karunasagar I. 2007. Protective efficacy of recombinant OmpTS protein of Aeromonas hydrophila in Indian major carp.
Vaccine. 25: 1157-1158.
Lau YH, H Habibudin, & CS Tan. 2011. Cloning, expression, and purification of a partial outer membran protein (OMP) from Candidatus liberibacter asiaticus causing greening disease of citrus. J Trop Agric Fd Sc. 39(2): 179-189.
Lin H, Chen C, Doddapaneni H, Duan Y, Civerolo EL, Bai X, Zhao X. 2010. A new diagnostic system for ultra-sensitive and specific detection and quantification of Candidatus liberibacter asiaticus, the bacterium associated with citrus Huanglongbing. J Microbiol Method. 81:17-25.
Nurdiani D. 2006. Analisis fragmen DNA genom yang terlibat dalam toleransi asam-alumunium pada Bradyrhizobium japonicum. [tesis]. Bogor (ID): Institut Pertanian Bogor.
Nurhadi. 2012. Epidemi penyakit Huanglongbing (HLB) dan implikasinya terhadap manajemen penyakit. Di dalam: Workshop Rencana Aksi Rehabilitasi
Agribisnis Jeruk Keprok SoE Yang Berkelanjutan Untuk Substitusi Impor di Nusa Tenggara Timur; 2011 Jul 21; Kupang, Indonesia. Kupang (ID): Badan
Litbang Dirjen Hortikultura.
Omrani M, Ansari MHK, Agaverdizade D 2009. PCR and ELISA methods (IgG and IgM); their comparison with conventional techniques for diagnosis of
Mycobacterium tuberculosis. J Biol Sci. 12: 373-377.
Promega 2005. Technical Manual pGEMT dan pGEMT-Easy Vector System. USA. dalam Hartati. 2007. Kloning Gen Penyandi Sukrosa Sintase dari Tanaman Sengon (Paraserianthes falcataria). [tesis]. Bogor (ID): Institut Pertanian Bogor.
13 Promega Corp. 1999. Rapid ligation for the pGEM-T and pGEMT-Easy Vector
Systems. Promega Notes. 71:p.08.
Sambrook J, Russel DW. 2001. Molecular cloning a Laboratory Manual. 3rd ed. New York(US): Cold Spring Harbor Laboratory Press.
Weinert MP, SC Jacobson, JF Grimshaw, GA Bellis, PM Stephen, TE Gunua, MF Kame, RI Davis. 2004. Detection of Huanglongbing (citrus greening disease) in Timur Leste (East Timor) and Papua New Guinea. Australasian Plant Pathol. 33: 135-136.
14
Amplifikasi fragmen gen OMP dan verifikasi dengan elektroforesis gel
agarosa 1%
Elusi fragmen DNA OMP dari gel agarosa
Ligasi ke plasmid vektor pGEMT-Easy
Transformasi ke sel inang E.coli DH5α dan seleksi transforman dengan media
ampisilin dan PCR koloni
Isolasi plasmid rekombinan
Deteksi fragmen gen OMP dengan PCR plasmid
Ekstraksi DNA dari sampel daun jeruk
Analisis hasil pengurutan nukleotida & asam amino
Lampiran 1 Diagram alir penelitian
15 Lampiran 2 Homologi berdasarkan nukleotida
16
Lampiran 2 Homologi berdasarkan nukleotida (lanjutan) Isolat-isolat bakteri yang homolog dengan gen sampel
17 Lampiran 2 Homologi berdasarkan nukleotida (lanjutan)
18
Lampiran 2 Homologi berdasarkan nukelotida (lanjutan)
Pensejajaran sekuen sampel (Query) dengan sekuen nukleotida database NCBI (Sbjct).
19 Lampiran 3 Kekerabatan berdasarkan asam amino
20
Lampiran 3 Kekerabatan berdasarkan asam amino (lanjutan)
Pensejajaran sekuen sampel (Query) dengan sekuen asam amino database NCBI (Sbjct).
21 Lampiran 3 Kekerabatan berdasarkan asam amino (lanjutan)
22
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 31 Juli 1992 dari ayah Dede Suhaedi dan ibu Kukun Suryati. Penulis merupakan putri ketiga dari empat bersaudara. Tahun 2009 penulis lulus dari SMA Negeri 1 Cigombong Kab. Bogor dan pada tahun yang sama penulis lulus seleksi masuk IPB melalui jalur Ujian Talenta Mandiri IPB. Penulis diterima di Program Biokimia, Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam. Selama mengikuti program S1 di IPB, penulis bergabung dengan organisasi Dewan Perwakilan Mahasiswa Fakultas Matematika dan Ilmu Pengetahuan Alam (2010-2012), Majelis Permusyawaratan Mahasiswa Keluarga Mahasiswa IPB (2011-2012), dan UKM Koran Kampus IPB (2009-2011). Penulis juga pernah menjadi asisten praktikum untuk mata kuliah Struktur dan Fungsi Biomolekul di Departemen Biokimia FMIPA IPB pada tahun 2011. Pada tahun 2012, penulis melaksanakan praktik lapangan di Laboratorium Biokimia, BB Biogen, Bogor dengan judul Potensi Metabolit Sekunder Meniran Hijau (Phyllanthus niruri L.) Sebagai Antivirus ChiVMV pada Tanaman Cabai Merah (Capsicum annum).