OPTIMASI WAKTU REAKSI KONDENSASI ANTARA 3,4-DIMETOKSIKASETOFENON DAN
3,4-DIMETOKSIBENZALDEHID
SKRIPSI
Diajukan kepada Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Negri Yogyakarta Untuk Memenuhi Sebagian Persyaratan Guna Memperoleh
Gelar Sarjana Sains Kimia
Oleh:
SAFRINA HARFAH 13307141023
PROGRAM STUDI KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI YOGYAKARTA
OPTIMASI WAKTU REAKSI KONDENSASI ANTARA 3,4-DIMETOKSIASETOFENON DAN 3,4-DIMETOKSIBENZALDEHID Oleh: Safrina Harfah 13307141023 ABSTRAK
Penelitian ini bertujuan untuk menentukan waktu reaksi optimum sintesis antara 3,4-dimetoksiasetofenon dan 3,4-dimetoksibenzaldehid dalam suasana basa pada variasi waktu pengadukan 2 jam, 4 jam dan 6 jam, dengan hasil rendemen maksimum pada hasil sintesis. Selain itu, mengidentifikasi senyawa hasil sintesis menggunakan spektrofotometer UV- Vis, IR dan 1H-NMR.
Penelitian dalam kondisi basa ini diawali dengan mereaksikan senyawa 3,4-dimetoksiasetofenon dan 3,4-dimetoksibenzaldehid dengan variasi waktu pengadukan yaitu 2, 4 dan 6 jam pada suhu 25-30oC. Hasil pengadukan didiamkan selama sehari dan hasil yang disaring dikeringkan selam 3 hari. Senyawa hasil sintesis diidentifikasi menggunakan spektrofotometer IR, UV-Vis dan 1H-NMR.
Hasil penelitian ini menunjukkan rendemen dari masing-masing variasi waktu pengadukan 2, 4 dan 6 jam berturut-turut 62,57%; 63,35% dan 59,43 %. Waktu pengadukan optimum adalah 4 jam dengan rendemen terbanyak. Hasil analisis spektra UV-Vis, IR dan 1H-NMR dapat dipastikan senyawa yang diharapkan.
Kata kunci: Kalkon, 3,4-dimetoksiasetofenon, 3,4-dimetoksibenzaldehid, reaksi kondensasi.
OPTIMATION REACTION CONDESTATION TIME BETWEEN 3,4-DIMETHOXYACETOPHENON AND 3,4-DIMETHOXYBENZALDEHYDE By: Safrina Harfah 13307141023 ABSTRACT
The aim of this research is to determine the optimum reaction time between synthesis dimethoxyacetophenon and 3,4-dimethoxybenzaldehyde as the starting material and NaOH as the catalyst at various stirring reaction time 2, 4 and 6 hours with the highest yield of the synthesis product and besides identifying the yield using UV-Vis, IR,
1
H-NMR spectrophotometer.
This research-under base condition was started by reacting 3,4-dimethoxyacetophenon and 3,4-dimethoxybenzaldehyde with various stirring time 2, 4 and 6 hours at 25-30oC. The yield of stirring process was settling for a day and result from the drying process need to be dried for three day. All the yield of each product were identified using UV-Vis, IR and 1H-NMR spectrophotometer.
The result shows that the yield for each variation stirring time 2, 4 and 6 hours respectively were 62,57%; 63,35% and 59,43%. The optimum stirring time with highest yield was at 4 hours. According to UV-Vis, IR,
1
H-NMR spectra analyses could be ascertained the expected compound. Key words: Chalcone, 3,4-dimethoxyacetophenon,
MOTTO
Jangan pernah takut dengan
KESENDIRIAN karena Allah selalu
ada didekatmu YAKINLAH
( Safrina Harfah )
Allah dulu, Allah
lagi, Allah terus
( Ust. Yusuf Mansur )
HALAMAN PERSEMBAHAN
Skripsi ini saya persembahkan untuk :
(Alm) bapak saya TURMUDZI dan (almh) ibu saya
HANNAH yang telah memberikan kasih sayang yang
sungguh luar biasa kepada saya yang tiada duanya, ilmu dan
didikan yang beliau ajarkan kepada saya saat dulu sungguh
sangat luar biasa
Adek saya NAJIH IMTIKHANI yang menjadi salah satu alasan
saya untuk mau tetap bertahan ketika saya sudah malas
mengerjkan semua hal. Kak Ina sayang adek LOVE you.
Keluarga baru saya di kos Shandi Irma Kharismayanti, Yusnita
Afrida dan Melda Eka Saputri yang telah diberikan Allah kepada
saya, yang selalu setia menemani saya selama saya di Jogja.
Kehadiran mereka mebuatat saya seperti layaknya mempunyai
keluarga baru yang komplit lagi.
Keluarga saya ketika dikampus Muftiatul Rahmawati dan Tanti
Wulandari yang selalu setia mendengarkan keluhan, cerita dan
selalu memberikan kasih sayang yang tiada henti-hetinya. Kalian
salah satu nikmat Allah yang sungguh sangat luar biasa.
Teman-teman kimia B yang selalu memberikan dukungan dan
semangat yang tiada henti.
Teman-teman penelitian kimia organik (Lilin
best partner
, linda
tri, asiah, devry, elga, shinta, maya, melia, hajjar, novia, eka, fitri,
tanti, asida dan rekzy) yang telah memberikan semangat dan
bantuan.
KATA PENGANTAR
Puji syukur kepada Tuhan Yang Maha Esa, yang telah melimpahkan berkat dan penyertaan-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Optimasi Waktu Reaksi
Kondensasi Antara 3,4-dimetoksiasetofenon dan
3,4-dimetoksibenzaldehid”. Penulis menyadari bahwa dari masa kuliah hingga terselesaikannya skripsi ini tidak lepas dari bantuan, bimbingan dan arahan dari banyak pihak. Oleh karena itu, penulis mengucapkan terima kasih kepada:
1. Bapak Dr. Hartono, selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Yogyakarta.
2. Bapak Drs. Jaslin Ikhsan, M.App.Sc., Ph.D. selaku Ketua Jurusan Pendidikan Kimia Fakultas Matematika dan Ilmu Pengetahuan alam Universitas Negeri Yogyakarta.
3. Ibu Prof. Dr. Indyah Sulistyo Arty, M.S selaku dosen pembimbing skripsi, dan ketua penguji yang telah memberikan bimbingan, arahan dan saran.
4. Bapak Karim Theresih, S.U selaku penguji utama, atas pertanyaan, kritik, dan saran yang diberikan.
5. Ibu Dr. Hj. Amanatie, M.Pd., M.Si selaku penguji pendamping, atas pertanyaan, kritik, dan saran yang diberikan.
6. Ibu Cornelia Budi Marwanti, M.Si selaku Dosen Penasehat Akademik yang telah memberikan izin penelitian.
7. Seluruh Dosen, Staff dan Laboran Jurusan Pendidikan Kimia FMIPA UNY yang telah banyak membantu selama perkuliahan dan penelitian.
8. Semua pihak yang telah membantu dan memberikan dukungan secara moral maupun material dalam penyelesaian tugas akhir skripsi ini, yang tidak dapat penulis sebut satu per satu.
Penulis menyadari bahwa penulisan skripsi ini masih jauh dari kesempurnaan, sehingga penulis mengharap kritik dan saran yang bersifat membangun. Semoga skripsi ini bermanfaat bagi pembaca dan almamater.
Yogyakarta, 20 Juli 2017
DAFTAR ISI HALAMAN JUDUL ... i ABSTRAK ... ii ABSTRACT ... iii HALAMAN PERSETUJUAN ... iv HALAMAN PENGESAHAN ... v HALAMAN PERNYATAAN ... vi MOTTO ... vii
HALAMAN PERSEMBAHAN ... viii
KATA PENGANTAR ... ix
DAFTAR ISI ... xi
DAFTAR GAMBAR ... xiii
DAFTAR TABEL ... xiv
DAFTRA LAMPIRAN ... xvi
BAB I PENDAHULUAN A. Latar Belakang Masalah ... 1
B. Identifikasi Masalah ... 4
C. Pembatasan Masalah ... 4
D. Rumusan Masalah ... 5
E. Tujuan Penelitian ... 5
F. Manfaat Penelitian ... 6
BAB II TINJAUAN PUSTAKA A. Deskripsi Teori ... 7
1. Senyawa 3,4-dimetoksiasetofenon ... 7
2. Senyawa 3,4-dimetoksibenzaldehid ... 8
3. Senyawa (E)1-3-bis-(3,4-dimetoksikalkon)-prop-en-1-on ... 9
4. Kondensasi Aldol Silang ... 10
5. Kromatografi Lapis Tipis (KLT) ... 15
6. Pemerikasaan Titik Lebur ... 16
7. Spektroskopi UV-Vis ... 17
8. Spektofotometer IR ... 18
9. Spektrofotometer 1H-NMR ... 20
B. Penelitian yang Relevan ... 23
C. Kerangka Berpikir ... 24
BAB III METODE PENELITIAN A. Subjek dan Objek Penelitian ... 25
B. Instrumen Penelitian ... 25
C. Prosedur Penelitian ... 28
D. Teknik Analisis Data ... 29
BAB IV HASIL PENELITIAN DAN PEMBAHASAN A. Hasil Penelitian ... 30
1. Data Senyawa Hasil Penelitian ... 30
2. Data Identifikasi Struktur Senyawa Hasil Sintesis ... 31
B. Pembahasan ... 44
1. Optimasi Waktu Reaksi Hasil Senyawa Sintesis ... 47
2. Data Identifikasi Struktur Senyawa Hasil Sintesis ... 48
BAB V KESIMPULAN DAN SARAN A. Kesimpulan ... 54
B. Saran ... 54
DAFTAR PUSTAKA... 55
DAFTAR GAMBAR
Gambar 1. Struktur senyawa 3,4-dimetoksiasetofenon ... 7
Gambar 2. Struktur senyawa 3,4-dimetoksibenzaldehid ... 8
Gambar 3. Kerangka dasar struktur senyawa kalkon ... 9
Gambar 4. Senyawa (E)1-3-bis-(3,4-dimetoksikalkon)-prop-en-1-on ... 9
Gambar 5. Mekanisme reaksi pembentukan aldol dengan katalis asam………...12
Gambar 6. Mekanisme reaksi pembentukan aldol dengan katalis basa..………...13
Gambar 7. Mekanisme reaksi kondensasi aldol silang antara 3,4-dimetoksiasetofenon dan 3,4-dimetoksibezaldehid dengan katalis basa……….………..………...……....14
Gambar 8. Senyawa hasil sintesis 2 jam (a), 4 jam (b), & 6 jam (c) ... 31
Gambar 9. Kromatogram KLT Scanner senyawa hasil sintesis selama 2 jam ... 34
Gambar 10. Kromatogram KLT Scanner senyawa hasil sintesis selama 4 jam ... 34
Gambar 11. Kromatogram KLT Scanner senyawa hasil sintesis selama 6 jam ... 35
Gambar 12. Spektrum UV-Vis senyawa hasil sintesis 2 jam ... 36
Gambar 13. Spektrum UV-Vis senyawa hasil sintesis 4 jam ... 37
Gambar 14. Spektrum UV-Vis senyawa hasil sintesis 6 jam ... 38
Gambar 15. Spektrum IR senyawa hasil sintesis 2 jam ... 39
Gambar 16. Spektrum IR senyawa hasil sintesis 4 jam ... 40
Gambar 17. Spektrum IR senyawa hasil sintesis 6 jam ... 41
DAFTAR TABEL
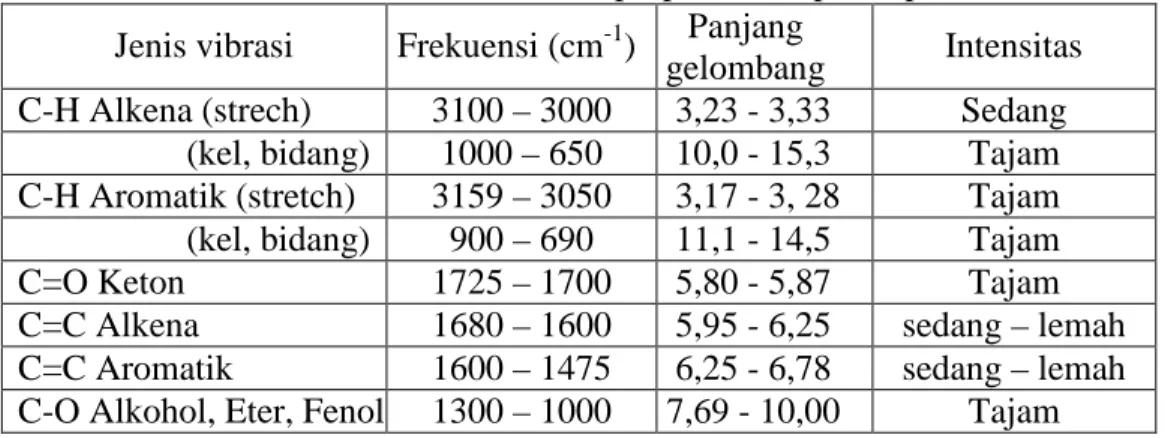
Tabel 1. Perkiraan serapan gugus fungsional senyawa
(E)1-3-bis-(3,4-dimetoksikalkon)-prop-en-1-on pada spektra IR ... 21 Tabel 2. Data spektrum (E)1-3-bis-(3,4-dimetoksikalkon)-prop-en-1-on hasil pnelitian Hestiningrum ... 23 Tabel 3.Data hasil sintesis dalam berbagai variasi waktu reaksi
berdasar waktu reaksi ... 30 Tabel 4. Data Rf senyawa hasil sintesis. ... 32
Tabel 5. Data spektrum UV- Vis senyawa hasil sintesis
suasana basa 2 jam... 37 Tabel 6. Data spektrum UV- Vis senyawa hasil sintesis
suasana basa 4 jam... 37 Tabel 7. Data spektrum UV- Vis senyawa hasil sintesis
suasana basa 6 jam... 38 Tabel 8.F Data spektrum IR senyawa hasil sintesis
suasana basa selama 2 jam ... 39 Tabel 9. Data spektrum IR senyawa hasil sintesis
suasana basa selama 4 jam ... 40 Tabel 10. Data spektrum IR senyawa hasil sintesis
suasana basa selama 6 jam ... 41 Tabel 11. Data spektrum 1H-NMR senyawa hasil sintesis ... 44
xvi
DAFTAR LAMPIRAN
Lampiran 1. Perhitungan rendemen senyawa hasil sintesis
(2 jam, 4 jam, dan 6 jam ) ... 57 Lampiran 2. Diagram Prosedur kerja suasana basa ... 58 Lampiran 3. Kromatogram KLT Scanner bahan sintesis ... 60 Lampiran 4. Kromatogram KLT Scanner
hasil produk 2 jam ... 61 Lampiran 5. Kromatogram KLT Scanner
hasil produk 4 dan 6 jam ... 61 Lampiran 6. Spektrum UV-Vis hasil produk
2 jam ... 62 Lampiran 7. Spektrum UV-Vis hasil produk
4 jam ... 63 Lampiran 8. Spektrum UV-Vis hasil produk
6 jam ... 64 Lampiran 9. Spektrum IR hasil produk
2 jam ... 65 Lampiran 10. Spektrum IR hasil produk
4 jam ... 66 Lampiran 11. Spektrum IR hasil produk
6 jam ... 67 Lampiran 12. Spektrum 1H-NMR senyawa hasil sintesis ... 68 Lampiran 13. Dokumentasi foto kerja penelitian ... 75
BAB I PENDAHULUAN A. Latar Belakang Masalah
Kalkon merupakan salah satu senyawa metabolit sekunder golongan flavanoid yang dapat diperoleh dengan cara isolasi dari tumbuhan dan diketahui memiliki aktivitas biologis yang beragam (Desai dan Mistry, 2004). Ikan (1969) menggolongkan flavanoid menjadi 11 kelas.
Semua kelas ini mengandung 15 atom karbon dalam inti dasarnya, yang tersusun dalam konfigurasi C6-C3-C6 yaitu dua cincin aromatis yang
dihubungkan oleh satuan tiga karbon yang dapat atau tidak dapat membentuk cincin ketiga. Perbedaan tingkat oksidasi -C3- penghubung inilah yang menjadi menjadi dasar penggolongan jenis flavonoid. Flavonoid terdapat pada semua bagian tumbuhan hijau, seperti pada: akar, daun, kulit kayu, benang sari, bunga, buah dan biji buah. Sedangkan pada hewan hanya dijumpai pada kelenjar bau berang-berang, "sekresi lebah" (propolis) dan dalam sayap kupu-kupu (Harborne, 1987).
Berbagai macam jenis flavanoid utama seperti falavon, flavonol dan antosianidin banyak ditemukan di alam. Sedangkan flavanoid dengan jumlah terbatas adalah kalkon, auron, katecin flavanon dan leukoatonsianidin (Achmad, 1986). Beberapa turunan kalkon memiliki aktivitas biologis yang sangat bermanfaat diantaranya sebagai antibakteri, antifungal, insektisida, anastesik, analgesik, ulserogenik dan lain-lain (Desai dan Mistry, 2004). Untuk mensistesis senyawa kalkon yang tersubtitusi dapat dilakukan dengan dua jalur sintesis yaitu kondensasi Knovenagel
yang dilanjutkan dengan asilasi Friedel-Crafts dan melalui kondensasi aldol. Jalur yang lebih singkat dan praktis untuk sintesis senyawa kalkon merupakan jalur kondensasai aldol. Pada metode ini tidak banyak menggunakan pelarut yang toksik, waktu yang digunakan relatif tidak terlalu lama dan pada temperatur kamar.
Adanya gugus metoksi pada posisi meta maupun posisi para akan mempengaruhi reaktivitas cincin aromatis pada pereaksi 3,4-dimetoksiasetofenon maupun 3,4-dimetoksibenzaldehida, sehingga mempengaruhi hasil sintesis turunan kalkon tersebut. Secara teoritis gugus metoksi bersifat sebagai pendorong elektron sehingga dapat menyumbangkan elektron pada cincin aromatis. Adanya resonansi pada cincin aromatis membuat dorongan elektron dari metoksi akan meningkatkan rapatan elektron cincin aromatis (benzena). Hal ini menyebabkan kerapatan elektron menjadi δ- (kerapan elektron rendah) sehingga atom C karbonil kerapan elektronnya menjadi δ+ (kerapatan elektron tinggi). Dengan demikian atom C karbonil menjadi lebih mudah diserang oleh nukleofil sehingga reaksi lebih mudah berlangsung. Penelitian tentang pengaruh posisi gugus metoksi oleh Suzana., 2013 (Pengaruh Posisi Gugus Metoksi Pada Pada Posisi Orto (o) dan Para (p) Pada Benzaldehida Terhadap Sintesis Turunan Kalkon Dengan Metode Kondensasi Aldol) menunjukan bahwa hasil sintesis senyawa 2-metoksikalkon (75,9%) dan 4-metoksikalkon (84,2%) terlihat bahwa hasil randemen pada posisi orto (o) lebih banyak.
Kondensasi aldol dapat dilakukan dalam larutan alkalin basa, Ba(OH)2, LiOH, irradiasi microwave dan irradiasi ultrasound, maupun
dalam asam menggunakan HCl, BF3, B2O3, asam p-toluensulfonat dan
lain-lain. Namun pada umumnya katalis yang banyak digunakan adalah katalis NaOH, karena akan didapatkan hasil sintesis yang besar (Brown et al., 2012). Penelitian oleh Budimarwanti & Sri handayani., 2010 tentang (Efektivitas Katalis Asam dan Basa Pada Sintesis 2-Hidroksikalkon) menunjukan bahwa hasil sintesis senyawa 2-hidroksikalkon dengan katalis asam tidak mendapatkan senyawa yang diharapkan, yaitu tidak diperoleh
kristal, sedangkan dengan katalis basa berhasil diperoleh senyawa 2- hidroksikalkon, berbentuk kristal oranye, dengan rendemen 31,22%, dan
kemurnian 64%. Penggunaan suhu 5-10oC oleh peneliti (Rotama, 2011) pada sintesis senyawa turunan kalkon menghasilkan rendemen sebesar 46,27% dengan lama reaksi 5 jam. Disisi lain, penelitian tentang sintesis kalkon juga pernah dilakukan oleh Suzana pada suhu kamar selama satu jam melalui reaksi kondensasi aldol silang dan menghasilkan rendemen sebanyak 66,4%.
Penelitian ini dilakukan untuk mendapatkan waktu optimum sintesis senyawa kalkon. Variasi waktu yang digunakan 2, 4 & 6 jam. Bahan dasar yang digunakan dalam penelitian ini adalah 3,4-dimetoksiasetofenon dan 3,4-dimetoksibezaldehid. Metode sintesis yang digunakan dalam penelitian ini adalah reaksi kondensasi aldol silang dalam suasana basa pada suhu kamar sekitar 25-30ºC dalam suasana basa. Senyawa hasil sintesis
diidentifiksikan menggunakan TLC dan TLC scanner untuk menguji kemurniannya dan untuk menentukan strukturnya diidentifikasi dengan menggunakan spektrofotometer UV-VIS, IR dan 1H-NMR. Data rendemen hasil sintesis dalam berbagai variasi waktu dapat digunakan untuk mengetahui waktu optimum sintesis senyawa kalkon.
B. Identifikasi Masalah
Dari latar belakang yang telah diuraikan, maka dapat diidentifikasi beberapa masalah sebagai berikut :
1. Senyawa yang digunakan sebagai bahan dasar sintesis senyawa kalkon.
2. Katalis yang digunakan dalam reaksi kondensasi.
3. Metode sintesis yang digunakan dalam reaksi kondensasi.
4. Variasi waktu pengadukan yang digunakan dalam reaksi kondensasi.
5. Metode yang digunakan untuk indentifikasi senyawa hasil sintesis. C. Pembatasan Masalah
Pada penelitian ini masalah dibatasi pada permasalahan berikut untuk menghindari kemungkinan masalah yang melebar:
1. Bahan dasar yang akan digunakan adalah 3,4-dimetoksiasetofenon dan 3,4-dimetoksi bezaldehid.
2. Katalis yang digunakan dalam reaksi kondensasi adalah NaOH. 3. Metode kondenesasi yang digunakan untuk mensintesis senyawa
4. Variasi waktu yang digunakan dalam reaksi kondensasi adalah 2,4 dan 6 jam.
5. Indentifikasi senyawa hasil sintesis mengunakan spektrofotometer UV-VIS, spektofotometri IR, dan spektometer 1H-NMR.
D. Rumusan Masalah
Perumusan masalah dari penelitian ini adalah :
1. Apa senyawa hasil reaksi kondensasi antara senyawa 3,4-dimetoksiasetofenon dan 3,4-dimetoksibezaldehid dalam suasana basa ?
2. Berapakah rendemen senyawa hasil sintesis antara senyawa 3,4-dimetoksiasetofenon dan 3,4-dimetoksibezaldehid dalam suasana basa pada variasi waktu yang digunakan ?
3. Berapakah waktu reaksi optimum dari beberapa variasi waktu reaksi yang ditunjukkan dengan hasil rendemen maksimum pada hasil sintesis ?
E. Tujuan Penelitian
Adapaun tujuan dari penelitian ini adalah :
1. Mengetahui struktur senyawa hasil reaksi kondensasi antara senyawa 3,4-dimetoksiasetofenon dan 3,4-dimetoksibezaldehid dalam suasana basa.
2. Menentukan rendemen senyawa hasil sintesis antara senyawa 3,4-dimetoksiasetofenon dan 3,4-dimetoksibezaldehid dalam suasana basa.
3. Menentukan waktu reaksi optimum dari beberapa variasi waktu reaksi yang ditunjukkan dengan hasil rendemen maksimum pada hasil sintesis.
F. Manfaat Penelitian
Dari hasil Hasil penelitian ini diharapkan mampu menjadi tambahan data untuk penelitian mengenai metode sintesis senyawa kalkon dari bahan dasar 3,4-dimetoksiasetofenon dan 3,4-dimetoksibezaldehid melalui kondensasi aldol silang.
BAB II
TINJAUAN PUSTAKA
A. Dekskripsi Teori
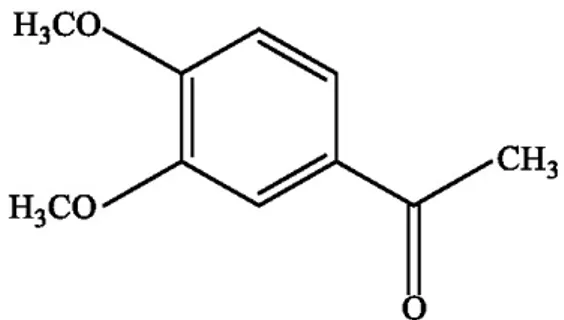
1. Senyawa 3,4-dimetoksiasetofenon
Senyawa 3,4-dimetoksiasetofenon atau Acetoveratrone merupakan turunan dari senyawa asetofenon yang memiliki dua gugus metoksi dalam posisi meta dan posisi para. Senyawa ini memiliki massa molekul realtif (Mr) 180,20 gr/mol. Senyawa 3,4-dimetoksi asetofenon memiliki gugus
metoksi dan gugus karbonil keton pada cincin benzene. Kisaran titik didih senyawa ini adalah 286–288°C. Rumus kimia senyawa 3,4-dimetoksi asetofenon adalah C10H12O3 dengan struktur senyawa seperti pada
Gambar 1.
Gambar 1. Struktur senyawa 3,4-dimetoksiasetofenon
Senyawa 3,4-dimetoksi asetofenon dapat larut dalam berbagai pelarut air panas, etanol, dietil eter, kloroform, dan benzena.
2. Senyawa 3,4-dimetoksibenzaldehid
Senyawa 3,4-dimetoksibenzaldehid atau Veratrylaldehid merupakan turunan dari senyawa benzaldehid yang memiliki dua gugus metoksi dalam posisi meta dan para. Senyawa ini berwarna peach berbentuk kristal memilik berat molekul 166,18 gr/mol. Senyawa 3,4-dimetoksibenzaldehid
memiliki gugus metoksi dan gugus karbonil aldehid pada cincin benzena. Kisaran titik lebur senyawa adalah 40-43 °C. Rumus kimia senyawa 3,4-dimetoksibenzaldehid adalah C9H10O3 dengan struktur senyawa seperti pada
Gambar 2.
Gambar 2. Struktur senyawa 3,4-dimetoksibenzaldehid Senyawa ini larut dalam air. Pelarut lain yang juga digunakan dalam senyawa ini adalah bahan kimia organik (mengandung karbon) yang sering disebut pelarut organik.
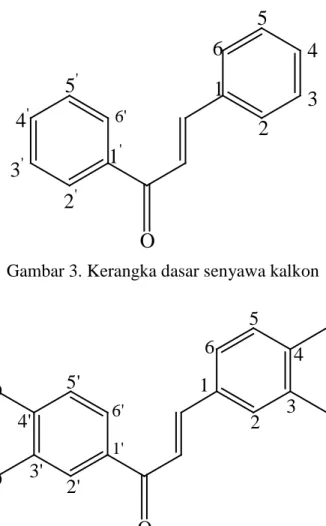
3. Senyawa (E)1-3-bis-(3,4-dimetoksikalkon)-prop-en-1-on
Senyawa (E)1-3-bis-(3,4-dimetoksikalkon)-prop-en-1-on adalah senyawa turunan kalkon yang tersubtitusi gugus metoksi pada posisi meta dan posisi para. Letak gugus metoksi ini terdapat pada cincin A dan pada cincin B. Senyawa ini pernah disintesis oleh Hastiningrum (2013) dengan rendemen 98 %, berbentuk Kristal dengan serbuk berwarna kuning dan memiliki titik leleh 92-94 °C pada kondisi basa selama 4 jam. Kerangka dasar senyawa kalkon dan struktur senyawa (E)1-3-bis-(3,4-dimetoksikalkon)-prop-en-1-on dapat dilihat pada Gambar 3 dan 4.
1
6
5
4
2
3
2
'3
'4
'5
' 6'1
'O
Gambar 3. Kerangka dasar senyawa kalkon
1 6 5 4 2 3 2' 3' 4' 5' 6' O OCH3 OCH3 H3CO H3CO 1'
Gambar 4. Struktur senyawa
4. Kondensasi Aldol Silang
Kondensasi aldol adalah adisi nukleofilik terhadap gugus karbonil dari ion enolat dengan produk reaksi β-hidroksi keton atau β-hidroksi aldehida, dimana senyawa yang diserang enolat dan gugus karbonil adalah dua senyawa yang sama yaitu enolat dan gugus karbonil.
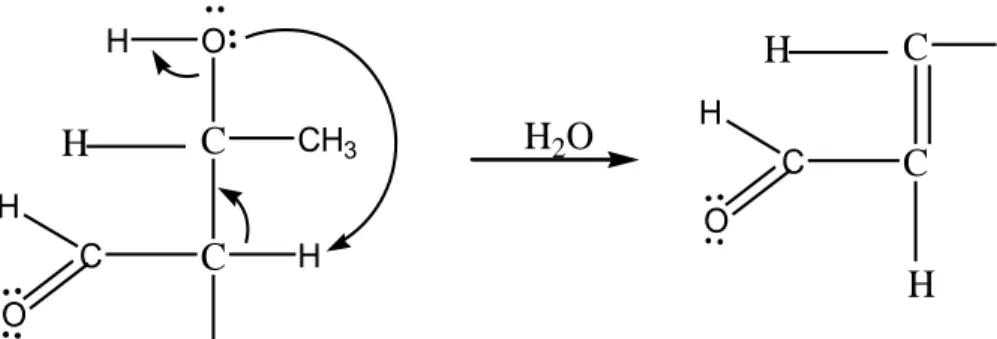
Syarat aldehida untuk dapat berkondensasi aldol adalah dengan adanya Hα pada gugus karbonil sehingga aldehida dapat membentuk ion enolat dalam basa. Sebuah aldol mudah mengalami dehidrasi pada suatu senyawa karbonil β-hidroksi, karena ikatan rangkap dalam produk berkonjugasi dengan gugus karbonilnya. Apabila dehidrasi terjadi secara spontan, maka dehidrasi tersebut akan menghasilkan suatu ikatan rangkap yang terkonjugasi dengan suatu cincin aromatik (Bruice, 2007).
Suatu aldehid tidak dapat membentuk ion enolat tanpa hidrogen α dan demikian tidak dapat berdemirisasi dalam suatu kondensasi aldol. Namun jika aldehid semacam ini dicampur dengan senyawa karbonil lain yang memiliki hidrogen alfa, maka kondensasi antara keduanya dapat terjadi. Reaksi ini disebut reaksi kondensasi aldol silang (cross aldol
condensation). Apabila hanya ada satu senyawa karbonil yang memiliki
hidrogen alfa maka dapat terjadi suatu kondensasi aldol silang, namun jika tidak akan diperoleh poduk campuran (Fessenden dan Fessenden, 1991).
Ada dua macam cara yang dapat dilakukan dalam mekanisme kondensasi aldol silang yaitu enol dan enolat. Apabila menggunakan katalis asam maka menggunakan mekanisme enol, sedangkan untuk katalis basa
menggunakan mekanisme enolat (Wade, 1999). Berikut ini mekanisme enol dengan menggunakan katalis HCl.
Mekanisme enol :
a) Pembentukan ion enol
C O H C H H H+ H+ C O H C H H H H C O H C H H H H ROH C C HO H H H ROH2 + b) Serangan neuklofil C C O H H H H C CH3 O H H C CH3 O H C H C H O H H C CH3 O H C H C H O H H H
c) Pembentukan produk aldol
H C CH3 O H C H C H O H H C CH3 O H C H C H O H H ROH H melepas H+ H C CH3 O H C H C H H O ROH2 +
d) Dehidrasi H C CH3 O C H C H H O H H2O H C CH3 C C H H O 2-butenaldehid
Gambar 5. Mekanisme reaksi pembentukan aldol dengan katalis asam Sedangkan mekanisme enolat dengan menggunakan katalis basa NaOH dapat dilihat pada Gambar 6.
Mekanisme Enolat : a) Pembentukan ion enolat
C
O HC
H H H+
-OH
C
O HC
H HC
O HC
H H+ H
2O
b) serangan nukleofil C O H C H H C O CH3 H C O H C H H C H O -CH3 alkoksida karbonil enolatc) Pembentukan produk aldol C O H C H H C H O -CH3 alkoksida H O H C O H C H H C H O H-O-H H -OH + Produk aldol d) Dehidrasi C O H C H H C H O CH3 H -H2O C O H C H C H CH3 2-butenaldehid Gambar 6. Mekanisme reaksi pembentukan aldol dengan katalis basa
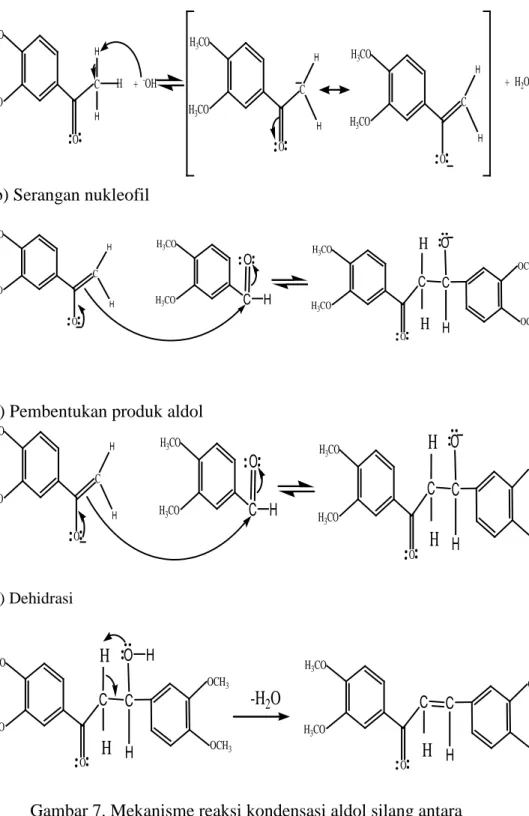
Dalam penelitian ini, untuk mendapatkan senyawa kalkon dalam suasana basa menggunakan reaksi kondensasi aldol silang. Mekanisme reaksi aldol silang dalam bentuk basa mengikuti mekanisme enolat, dimana katalis basa yang digunakan ion hidroksida. Pertama adalah ion hidroksida akan mengambil proton alfa yang bersifat asam dari molekul 3,4-dimetoksiasetofenon dan menghasilkan resonansi ion enolat.
Nukleofililik ion enolat akan menyerang gugus karbonil dari molekul 3,4-dimetoksibenzaldehid menghasilkan garam alkoksida. Alkoksida akan terprotonasi oleh pelarut air menghasilkan produk aldol yang netral dan membebaskan ion hidroksida kemudian akan mengalami dehidrasi menjadi senyawa
(E)1-3-bis-(3,4-dimetoksikalkon)-prop-en-1-on. Mekanisme reaksinya dapat dilihat pada Gambar 7. a) Pembentukan ion enolat
C O H3CO H3CO H H H + -OH C O H3CO H3CO H H C O H3CO H3CO H H + H2O b) Serangan nukleofil C O H3CO H3CO H H H3CO C H3CO O H C O H3CO H3CO C OCH3 OCH3 O H H H
c) Pembentukan produk aldol
C O H3CO H3CO H H H3CO C H3CO O H C O H3CO H3CO C OCH3 OCH3 O H
H
H
d) Dehidrasi -H2O C O H3CO H3CO C OCH3 OCH3 O H H H H C O H3CO H3CO C OCH3 OCH3 H HGambar 7. Mekanisme reaksi kondensasi aldol silang antara 3,4-dimetoksiasetofenon dan 3,4-dimetoksibezaldehid dengan katalis basa.
5. Kromatografi Lapis Tipis (KLT)
Kromotografi Lapis Tipis (KLT) banyak digunakan karena teknik penggunaannya sederhana, salah satu metodenya menggunakan lempeng kaca. Biasanya larutan cuplikan ditotolkan pada lempeng kaca menggunakan pipa kapiler. Pada bagian bawah lempeng dicelup dalam larutan pengulsi di dalam wadah yang tertutup. Teknik ini dikembangkan pada tahun 1938 oleh Izmailoff dan Schraiber.
Kromotografi adalah suatu proses migrasi diferensial dimana komponen-komponen cuplikan ditahan secara selektif oleh fase diam. Kromotografi merupakan cara pemisahan yang berdasarkan partisi cuplikan antara fase diam dan fase gerak. Lapisan yang memisahkan terdiri dari fasa diam ditempatkan pada penyangga yang berupa pelat gelas, logam atau lapisan yang cocok. Lapisan yang akan dipisahkan berupa larutan, ditotolkan berupa bercak atau pita (awal) (Geritter, Bobbit dan Scwarting, 1991) pada salah satu bagian tepi pelat kromotografi (sebanyak 0,01-0,1 µg).
Setelah pelat atau lapisan ditaruh dalam bejana yang rapat yang berisi larutan pengembang yang cocok (fasa gerak) pemisahan ini terjadi selama perambatan kapiler (pengembangan) (Geritter, Bobbit dan Scwarting, 1991). Untuk melaksanakan pemisahan dilakukan pada suhu kamar, sampai permukaan pelarut mencapai tinggi 15-18 cm, waktu yang diperlukan antara 20-40 menit (Khopkar, S.M, 2008).
Noda plat KLT dapat diamati langsung dengan lampu UV pada panjang gelombang 254 nm/366 nm, atau dengan menggunkan pereaksi semprot penimbul warna (Hardjono Sastrohamidjojo, 1985). Setelah kering noda plat di identifikasi dengan harga Rf, meskipun harga Rf dalam lapisan tipis kurang tepat bila dibandingkan dengan kertas (Geritter, Bobbit dan Scwarting, 1991).
𝑅𝑓 =Jarak noda terhadap titik awal (jarak tempuh zat terlarut) Jarak eluen terhadap titik awal (jarak tempuh pelarut)
Harga Rf yang diperoleh hanya berlaku untuk campuran tertentu
pada pelarut dan penyerap yang digunakan, meskipun demikian
harga-harga Rf untuk berbagai campuran dari pelarut dan penyerap dapat
diperoleh. Harga Rf untuk senyawa murni dapat dibandingkan dengan
harga standar, biasanya digunakan untuk keperluan kualitatif. Sedangkan
untuk penentuan kadar secara kuntitatif, plat KLT dibaca dengan alat TLC
scanner yang dapat mengukur kekuatan noda menurut nilai absorbansi
berbanding lurus dengan kadar.
6. Pemeriksaan Titik Lebur
Ciri penting pada senyawa organik padat merupakan titik lebur. Dalam identifikasi dan pengukuran kemurnian jarak lebur memiliki arti penting. Didasarkan pada fakta bahwa untuk identifikasi semua senyawa murni mempunyai jarak temperatur yang sangat kecil ketika berubah
sempurna dari padat ke cair, atau jarak lebur yang tajam. Untuk senyawa murni jarak temperatur maksimumnya adalah 1-2 0C. Selain itu, senyawa yang tidak murni menunjukkan 2 fenomena untuk identifikasi yang juga didasarkan pada fakta, dimana fakta pertama yaitu memiliki jarak lebur yang lebih besar, dan yang kedua suhu lebur lebih rendah (Sharp, et al., 1989).
Tes kemurnian dengan uji titik lebur merupakan tes kemurnian yang harus dilakukan. Termopan adalah alat yang digunakan untuk menguji titik lebur suatu senyawa. Titik lebur yang diperoleh merupakan tetapan fisika tujuan dilakukannya untuk identifikasi kualitatif, terutama untuk suatu senyawa hasil sintesis, isolasi, maupun kristalisasi. Pada tekanan udara 1 atm titik lebur suatu kristal padatan mulai berubah menjadi cairan. Suatu molekul senyawa akan menyerap energi, jika suhu dinaikkan. Makin tinggi suhu makin banyak energi yang diserap maka akan menaikkan gerakan vibrasi dan rotasi molekul. Namun, apabila suhu terus dinaikkan dapat mengakibatkan rusaknya molekul dan berubah dari padatan menjadi cairan. Pada keadaan cairan, molekul masih dapat terikat antara satu dengan yang lainnya tetapi molekul tersebut sudah tidak teratur lagi (Saputro, 2009).
Untuk melihat kemurnian suatu senyawa salah satunya dapat dilihat dari rentang titik lebur suatu senyawa tersebut. Senyawa murni menunjukkan perbedaan jarak leburnya kurang dari 20C. Senyawa dapat dikatakan kurang murni, jika rentangannya lebih besar dari harga tersebut, sehinga dapat dilakukan tahap-tahap pemurnian misal rekristalisai.
7. Spektroskopi UV-VIS
Prinsip dari spektroskopi UV-VIS adalah molekul yang dapat menyerap energi dalam spektrum cahaya ultra violet dan cahaya tampak, tergantung dari struktur elektronik dari molekul. Energi yang diserap menghasilkan elevasi elektron dari keadaan dasar ke orbital yang lebih tinggi, terjadi kedudukan eksitasi. Serapan tersebut di rekam dan ditampilkan sebagai kurva serapan dengan absis menunjukkan panjang gelombang dan ordinat berupa intensitas serapan. Spektrofotometri UV-Vis digunakan untuk menganalisis senyawa yang memiliki gugus kromofor (sistem ikatan rangkap terkonjugasi). Sistem kromofor yang berbeda memberikan puncak serapan maksimum dan bentuk kurva serapan yang khas (Kosela, 2010).
Senyawa hasil sintesis (E)1-3-bis-(3,4-dimetoksikalkon)-prop-en-1-on, memiliki sistem kromofor berupa gugus fenil yang terkonjugasi dengan karbonil. Terlebih adanya auksokrom gugus metoksi pada kromofor fenil pada cincin. Menurut (Markham, K.R, 1988) kisaran UV-Vis senyawa kalkon memiliki rentangan serapan λ maksimum di daerah 340-390 nm pada pita I, dan λ maksimum di daerah 230-270 nm pada pita II.
Untuk memperkirakan λ maksimum senyawa kalkon yaitu senyawa (E)1-3-bis-(3,4-dimetoksikalkon)-prop-en-1-on dapat digunakan rumus-rumus empiris woodward-Fischer untuk menghitung λ maksimumnya (Hardjonosastrohamidjojo, 2001).
Berdasarkan aturan Woodward-Fischer, dapat diperkirakan perhitungan secara teori untuk λ maksimum dari senyawa (E)1-3-bis-(3,4-dimetoksikalkon)-prop-en-1-on adalah 1 6 5 4 2 3 2' 3' 4' 5' 6' O OCH3 OCH3 H3CO H3CO 1'
Perkiraan unit benzoil:
1) Harga dasar C6H5COR : 246 nm
2) 3) OMe kedudukan γ OMe kedudukan δ : 17 : 31 nm nm λ maksimum : 284 nm
Perkiraan unit sinamoil:
1) Harga dasar enon asiklis : 215 nm 2) 3 konjugasi ikatan rangkap@30 nm : 90 nm
3) OMe kedudukan γ : 17 nm
4) OMe kedudukan δ : 31 nm +
λ maksimum : 353 nm
Kisaran UV-Vis senyawa kalkon memiliki rentangan serapan λ maksimum di daerah 340-390 nm pada pita I, dan λ maksimum di daerah 230-270 nm pada pita II (Markham, K.R, 1988).
8. Spektroskopi IR
Kebanyakan energi vibrasi dari molekul sesuai dengan daerah inframerah dari spektrum elektromagnetik. Vibrasi dari molekul dapat di ukur dengan instrumen spektroskopi inframerah. Vibrasi yang informatif untuk tujuan elusidasi struktur adalah pada daerah antara panjang bilangan gelombang 4000 cm-1 hingga 400 cm-1. Besarnya panjang bilangan gelombang bergantung pada kekuatan ikatan dan massa atom yang melakukan ikatan kimia. Cahaya yang diserap oleh molekul diterjemahkan kedalam sebuah kurva spektrum inframerah dengan absis berupa panjang bilangan gelombang dan ordinat berupa intensitas serapan. Hal yang perlu diperhatikan dalam mengintrpretasi kurva serapan inframerah adalah: panjang bilangan gelombang, bentuk kurva serapan (sempit, tajam atau melebar), intensitas serapan (kuat, sedang atau lemah) (Kosela, 2010).
Spektroskopi IR memiliki prinsip dasar untuk mengukur frekuensi/panjang gelombang dimana berbagai gugus fungsional menyerap sinar radiasi dalam spektrum IR. Spektroskopi IR dapat digunakan untuk mengenal (elusidasi) struktur molekul, khususnya seperti gugus fungsional seperti OH, C=O, dan C=C (Hardjono Sastrohamidjojo, 2001).
Pada spektroskopi IR terdapat data-data korelasi yang membahas tentang gugus fungsional yang ditangkap oleh spektrum IR (Hardjono
Sastrohamidjojo, 2001). Data-data tersebut berisi jenis vibrasi pada setiap gugus fungsional, frekuensi (cm-1), panjang gelombang, dan intensitasnya.
Berdasarkan data-data korelasi pada spektroskopi IR, dapat diperkirakan serapan gugus fungsional pada senyawa (E)1-3-bis-(3,4-dimetoksikalkon)-prop-en-1-on yang akan muncul pada spektroskopi IR ditunjukkan pada Tabel 1.
Tabel 1. Perkiraan serapan gugus fungsional senyawa (E)1-3-bis-(3,4-dimetoksikalkon)-prop-en-1-on pada spektra IR Jenis vibrasi Frekuensi (cm-1) Panjang
gelombang Intensitas C-H Alkena (strech) 3100 – 3000 3,23 - 3,33 Sedang
(kel, bidang) 1000 – 650 10,0 - 15,3 Tajam C-H Aromatik (stretch) 3159 – 3050 3,17 - 3, 28 Tajam (kel, bidang) 900 – 690 11,1 - 14,5 Tajam
C=O Keton 1725 – 1700 5,80 - 5,87 Tajam
C=C Alkena 1680 – 1600 5,95 - 6,25 sedang – lemah
C=C Aromatik 1600 – 1475 6,25 - 6,78 sedang – lemah C-O Alkohol, Eter, Fenol 1300 – 1000 7,69 - 10,00 Tajam
9. Spektroskopi Resonansi Magnet Inti (1H -NMR)
Molekul yang berada dalam medan magnet yang kuat akan menyerap inti-inti atom pada unsur tertentu dalam molekul organik, inilah yang menjadi prinsip dasar dari spektroskopi NMR (Hardjono Sastrohamidjojo, 2001). Kegunaannya spektroskopi 1H-NMR untuk memberika informasi mengenai berbagai jenis atom hidrogen dalam molekul (Cresswell, 1982). Informasi penting mengenai struktur molekul bisa didapatkan dari fenomena spin-spin splitting, karena adanya suatu spektra yang memiliki daya pisah tinggi, sehingga pita absorpsi akan terpisah (resolved atau split) menjadi sekelompok puncak yang disebabkan
oleh adanya proton tetangga (proton pada atom karbon didekatnya).
Proton yang puncaknya telah memisah dapat dikatakan telah mengalami kopling pada spin-spinnya. Pemisahan puncak berasal dari spin (paralel dan antiparalel) proton tetangganya. Banyaknya puncak yang terpisah secara spin-spin dari suatu proton tertentu atau sekelompok proton tak ekuivalen dapat diramalkan dengan memecah proton-proton tetangga (n) tak ekuivalen dengan proton yang sedang dibahas dan menambah 1 pada n itu. Aturan ini disebut aturan n + 1. Sebuah proton yang tidak memiliki proton tetangga tak ekuivalen akan menunjukkan puncak tunggal yang disebut singlet. Jika sebuah proton memiliki satu proton tetangga tak ekuivalen akan memberikan suatu isyarat terbelah menjadi satu puncak rangkap yang disebut doublet. Demikian seterusnya untuk proton yang memiliki dua atau tiga buah proton tetangga tak ekuivalen akan menunjukkan puncak yang disebut triplet dan kuartet (Fessenden dan Fessenden, 1991).
Pergeseran kimia pada senyawa organik untuk proton 1H mempunyai skala 0-12 ppm (Hardjono Sastrohamidjojo, 2001). Data-data pergeseran yang dibaca oleh spektroskopi 1H-NMR yaitu panjang gelombang (ppm), jumlah proton 1H, dan multiplisitas.
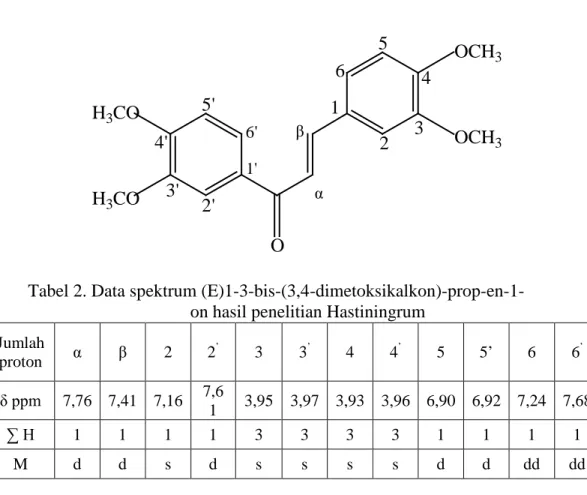
Hasil penelitian Hastiningrum (2013) menunjukan bahwa pergeseran kimia pada senyawa (E)1-3-bis-(3,4-dimetoksikalkon)-prop-en-1-on yang muncul pada spektrofotometer 1H-NMR ditampilkan pada Tabel 2 berikut ini.
1 6 5 4 2 3 2' 3' 4' 5' 6' O OCH3 OCH3 H3CO H3CO 1'
Tabel 2. Data spektrum (E)1-3-bis-(3,4-dimetoksikalkon)-prop-en-1-on hasil penelitian Hastiningrum
Jumlah proton α β 2 2 ’ 3 3’ 4 4’ 5 5’ 6 6’ δ ppm 7,76 7,41 7,16 7,61 3,95 3,97 3,93 3,96 6,90 6,92 7,24 7,68 ∑ H 1 1 1 1 3 3 3 3 1 1 1 1 M d d s d s s s s d d dd dd
B. Penelitian yang Relevan
Pada penelitian ini, ada 3 penelitian yang telah dilakukan oleh para peneliti tentang sintesis senyawa kalkon sebagai berikut :
1. Sri Handayani, Sunarto, dan Susila Kristianingrum (2005) meneliti tentang optimasi waktu reaksi pada sintesis flavonoid menggunakan benzaldehid dan turunannya dengan hasil yaitu waktu reaksi optimum pada sintesis kalkon, 4-metoksikalkon, dan 3,4-dimetoksikalkon masing-masing yaitu 12, 30, dan 30 jam.
2. Suzana, Melanny Ika, dkk (2013) meneliti tentang pengaruh gugus metoksi pada gugus orto (o) dan para (p) pada benzaldehid terhadap sintesis turunan kalkon dengan hasil yaitu pada posisi orto (o) hasil sintesis 2-metoksikalkon (75,9%), pada posisi para (p) hasil sintesis
α β
4-metoksikalkon (84,2%), dan hasil sintesis kalkon (66,4%).
3. Hastingrum (2013) meneliti tentang sintesis kalkon turunan 3,4-dimetoksi asetofenon dengan turunan benzaldehid yang tersubtitusi metoksi (2,3-dimetoksi benzaldehid, 3,4-dimetoksi benzaldehid, dan 2,4,5-dimetoksi benzaldehid) dengan katalis basa. Rendemen yang diperoleh berturut-turut yaitu 84,24%, 98%, dan 79,13% dengan waktu reaksi yaitu 4 jam.
C. Kerangka Berpikir
Senyawa turunan kalkon dapat dihasilkan melalui sintesis dari bahan awal asetofeon dengan benzaldehid dalam suasna asam maupun basa. Senyawa 3,4-dimetoksibenzaldehid turunan dari senyawa bezaldehid sedangkan senyawa 3,4-dimetoksiasetofenon turunan asetofenon. Reaksi kondensasi ini dilakukan pada suhu kamar menggunakan katalis NaOH dalam pelarut etanol. Waktu reaksi akan dilakukan dengan variasi waktu , yaitu 2, 4 dan 6 jam, untuk mengetahui apakah waktu kurang atau lebih dari 4 jam menghasilkan rendemen yang lebih banyak daripada waktu 4 jam yang sudah dilakukan penelitian. Sehingga dapat mengetahui waktu optimum dalam sintesis senyawa (E)1-3-bis-(3,4-dimetoksikalkon)-prop-en-1-on wa, karena pada penelitian sebelumnya belum diketahuai waktu optimum pada senyawa (E)1-3-bis-(3,4-dimetoksikalkon)-prop-en-1-on. Senyawa hasil kemudian diuji kemurnian dengan TLC dan TLC scanner dan diindifikasi dengan menggunakan spektrofotometer UV-VIS, IR dan 1H-NMR.
BAB III
METODE PENELITIAN
A. Subjek dan Objek Penelitian 1. Subjek Penelitian
Subjek penelitian ini adalah hasil senyawa reaksi kondensasi antara 3,4 -dimetoksiasetofenon dan 3,4-dimetoksibezaldehid dalam suasana basa. 2. Objek Penelitian
Objek penelitian ini adalah waktu optimum untuk mensintesis senyawa kalkon dari bahan dasar 3,4-dimetoksiasetofenon dan
3,4-dimetoksibezaldehid dalam suasana basa. B. Instrumen Penelitian
1. Alat-alat penelitian yang digunakan :
a. Spektrofotometer UV-VIS (Shimadzu UV-2400PC) b. Spektrofotometer IR (Shimadzu FTIR Prestige 21)
c. Spektrofotometer 1H-NMR (Agilent 400/54 Premium Shilded) d. TLC Scanner (CAMAG)
e. Plat KLT silica gel 60 GF254 (Merck)
f. Chamber kromatografi g. Neraca analitik
h. Kertas saring Whatmann i. Thermometer
j. Corong Buchner
l. Alat-alat gelas, diantaranya yaitu : corong gelas, gelas ukur, beacker glass, erlenmeyer, gelas arloji, pengaduk gelas, pipet ukur, pipet tetes, botol timbang, botol kaca.
2. Bahan-bahan penelitian yang digunakan adalah : a. 3,4-dimetoksibenzaldehid Aldrich 99% b. 3,4-dimetoksiasetofenon Aldrich 98% c. Etanol p.a E-Merck
d. Akuades
e. n-heksana p.a E-Merck f. Etil asetat p.a E-Merck g. Kristal NaoH p.a-Merck
C. Prosedur Penelitian
Reaksi optimasi waktu kondensasi antara 3,4-dimetoksiasetofenon dan 3,4-dimetoksi benzalehid dalam suasana basa:
1. Rangkaian alat refluks diset dilengkapi dengan magnetic stirrer dan penangas air.
2. Sebanyak 0,2 gram padatan NaOH ditambahkan kedalam labu leher tiga.
3. Pelarut etanol : akuades (1:1) sebanyak 7,5ml : 7,5ml dimasukkan kedalam labu leher tiga, kemudian di aduk hingga NaOH larut. 4. 3,4-dimetoksi asetofenon sebanyak 0,9 gram dimasukkan kedalam labu
leher tiga sampai diaduk sampai larut.
5. 3,4-dimetoksi benzaldehid sebanyak 0,83 gram dimasukkan kedalam labu leher tiga diaduk sampai larut.
6. Campuran diaduk dalam labu leher tiga dengan variasi waktu selama 2, 4, dan 6 jam dengan suhu reaksi larutan dalam labu leher tiga 25-300C
7. Hasil pengadukan kemudian dituangkan ke dalam gelas beker dan didiamkan selama 18-24 jam.
8. Larutan tersebut disaring filtratnya dan endapan tersebut kemudian dikeringkan selama 3 hari, lalu ditimbang dengan neraca analitik. 9. Titik lelehnya ditentukan dengan menggunakan melting point
apparatus.
10. Uji kemurnian dilakukan dengan menggunakan TLC dan TLC Scanner
menggunakan eluen campuran 2 pelarut organik yang sesuai. 11. Struktur senyawa hasil sintesis diidentifikasi dengan menggunakan
D. Teknik Analisis Data 1. Data Kuantitatif
Rendemen senyawa hasil untuk setiap prosedur dihitung dengan cara berikut :
2. Data Kualitatif
Senyawa hasil sintesis untuk setiap reaksi dianalisis dengan TLC & TLC Scanner untuk mengetahui kemurniannya, kemudian diidentifikasi
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
A. HASIL PENELITIAN
1. Data senyawa hasil penelitian
Senyawa hasil sintesis turunan kalkon dengan berbagai variasi waktu berupa serbuk kuning yang masing-masing dimasukkan kedalam botol flakon yang diberi label dapat dilihat pada Gambar 8. Data hasil senyawa turunan kalkon dengan berbagai variasi waktu 2, 4 dan 6 jam menunjukan adanya perbedaan pada hasil rendemen seperti yang ditunjukkan pada Tabel 3 berikut.
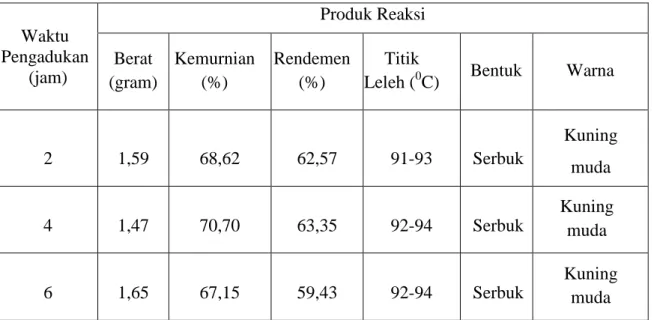
Tabel 3. Data hasil sintesis dengan variasi waktu reaksi
Waktu Pengadukan (jam) Produk Reaksi Berat (gram) Kemurnian (%) Rendemen (%) Titik
Leleh (0C) Bentuk Warna
2 1,59 68,62 62,57 91-93 Serbuk Kuning muda 4 1,47 70,70 63,35 92-94 Serbuk Kuning muda 6 1,65 67,15 59,43 92-94 Serbuk Kuning muda
(a) (b) (c)
Gambar 8. Senyawa hasil sintesis 2 jam (a), 4 jam (b), & 6 jam (c) 2. Data Identifikasi Struktur Senyawa Hasil Sintesis
a. Analisis Kromotografi Lapis Tipis (KLT) dan Spektra KLT Scanner
Hasil senyawa sintesis kalkon pada (Gambar 10) di analisis menggunakan KLT dengan eluen yang berbeda. Hal ini bertujuan agar pemisahan yang diperoleh baik (bercak noda tunggal) dan mempunyai harga Rf berkisar antara 0,2-0,8. Analisis kromotografi lapis tipis pada hasil sintesis menggunakan eluen n-heksana : kloroform, eluen n-heksan : etil asetat dan eluen kloroform : etil asetat dengan perbandingan yang berbeda-beda yang disajikan pada Tabel 4 berikut.
Tabel 4. Data Rf senyawa hasil sintesis Jenis eluen Waktu Pengadukan (jam) Rf Gambar n-heksana : etil asetat ( 6 : 4 ) 2 4 6 0,73 0,73 0,75 a b 2 4 6 n-heksana : kloroform ( 6 : 4 ) 2 4 6 0,17 0,2 0,28 a b 2 4 6
n-heksana : etil aetat ( 7 : 2 ) 2 4 6 0,33 0,3 0,32 a b 2 4 6 Keterangan :
a : 3,4-dimetoksiasetofenon 4 : Hasil sintesis 4 jam b : 3,4-dimetoksibenzaldehid 6 : Hasil sintesis 6 jam 2 : Hasil sintesis 2 jam
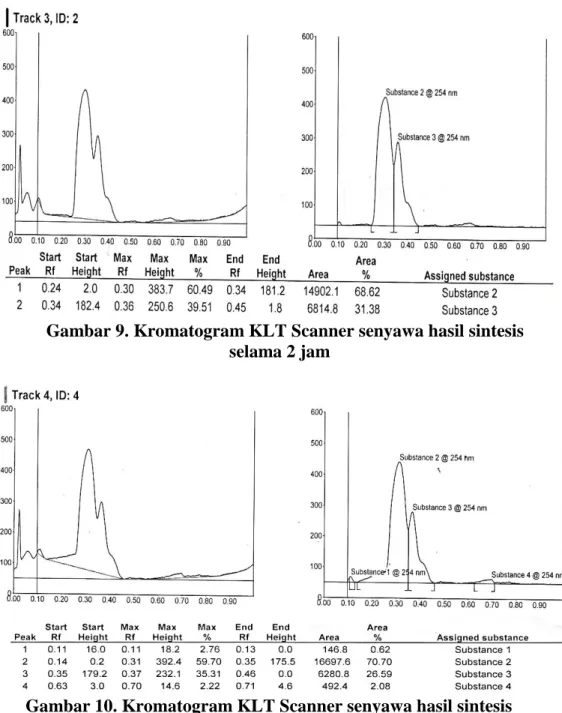
Dari kedua jenis eluen yang digunakan pada Tabel 4, perbandingan eluen n-heksan : etil asetat (7 : 2) merupakan eluen yang baik, karena memberikan nilai Rf yang baik dan menunjukan persentase kemurnian senyawa yang baik berdasarkan luas area yang diperoleh. Hal ini ditunjukkan dalam kromoatogram KLT Scanner senyawa hasil sintesis selama 2 jam, 4 jam dan 6 jam pada Gambar 9, 10 dan 11 berikut.
Gambar 9. Kromatogram KLT Scanner senyawa hasil sintesis selama 2 jam
Gambar 10. Kromatogram KLT Scanner senyawa hasil sintesis selama 4 jam
Gambar 11. Kromatogram KLT Scanner senyawa hasil sintesis selama 6 jam
Hasil KLT Scanner pada campuran eluen n-heksan dan etil asetat dengan perbandingan (7 : 2) menunjukkan bahawa senyawa hasil sintesis yang dilakukan selama 4 jam (gambar 10) mempunyai kemurnian yang cukup tinggi, yaitu sebesar 70,70 %.
Selanjutnya senyawa hasil sintesis diuji titik lelehnya menggunakan Fisher John Melting Apparantus menghasilkan titik leleh pada rentang suhu sebesar 91 – 93 oC untuk hasil sintesis 2 jam, sedangkan untuk hasil sitesis 4 jam dan 6 jam menghasilkan titik leleh pada rentang suhu 92 – 94oC.
b. Data Spektra UV-Vis Produk Sintesis
Senyawa hasil sintesis selanjutnya, diindentifikasi dengan spektroskopi UV-Vis. Senyawa ini diukur pada panjang gelombang maksimal (λmaks) pada daerah 200-400 nm. Hal ini bertujuan agar diketahui serapan panjang gelombang maksimumnya sehingga dapat
menentukan gugus kromofor dalam suatu senyawa organik. Senyawa kalkon menurut Markham (1988) memiliki rentangan serapan spektrum UV pada pita I (unit sinamoil) di daerah 340-390 nm dan pita II (unit benzoil) di daerah 230-270 nm. Semua senyawa hasil sintesis (2 dan 4 jam) menunjukkan bahwa adanya unit sinamoil dan unit benzoil. Namun untuk hasil sintesis 6 jam hanya menunjukkan adanya unit sinamoil. Spektrum hasil sintesis dengan serapan panjang gelombanga pada pita I dan serapan pita II senyawa kalkon dapat diperhatikan pada Gambar 12 dan Tabel 5 untuk hasil sintesis selama 2 jam, Gambar 13 dan Tabel 6 untuk hasil sintesis selama 4 jam dan Gambar 14 dan Tabel 7 untuk hasil sintesis selama 6 jam.
Gambar 12. Spektrum UV-Vis senyawa hasil sintesis 2 jam
Tabel 5. Data spektrum Uv-Vis senyawa hasil sintesis 2 jam
Gambar 13. Spektrum UV-Vis senyawa hasil sintesis 4 jam Tabel 6. Data spektrum Uv-Vis senyawa hasil sintesis 4 jam
No. Panjang gelombang (nm)
Absorbansi
1 359,80 1,221
2 242,80 0,622
3 206,60 1,469
No. Panjang gelombang (nm)
Absorbansi
1 359,80 0,522
2 243,20 0,261
Gambar 14. Spektrum UV-Vis senyawa hasil sintesis 6 jam Tabel 7. Data spektrum Uv-Vis senyawa hasil sintesis 6 jam
c. Analisis Data Spektra IR Produk Sintesis
Pada penelitian ini hasil senyawa sintesis kalkon di analisis dengan spektrum IR dengan tujuan untuk mengetahui gugus fungsional pada senyawa hasil sintesis. Adanya gugus fungsioanal tersebut dapat membantu dalam penentuan struktur senyawa hasil sintesis kalkon seperti C-H aromatik, C=O, C=C aromatik dan C-O. Spektrum IR senyawa hasil sintesis ditunjukan oleh gambar dan tabel berikut :
No. Panjang gelombang (nm)
Absorbansi
Gambar 15. Spektrum IR senyawa hasil sintesis selama 2 jam Tabel 8. Data spektum IR senyawa hasil sintesis selama 2 jam
No Jenis Vibrasi Frekuensi (cm-1) Intensitas
1 C-H aromatik 3078,39 Sedang
2 C=O keton 1651,07 Tajam
3 C=C aromatik 1589,34 , 1512,19 Sedang , tajam
4 C-O 1262,30 Sedang 5 C-O-C 1026,13 Tajam 1 2 3 4 5
Gambar 16. Spektrum IR senyawa hasil sintesis selama 4 jam Tabel 9. Data spektum IR senyawa hasil sintesis selama 4 jam
No Jenis Vibrasi Frekuensi (cm-1) Intensitas
1 C-H aromatic 3082,75 Sedang
2 C=O keton 1651,53 Tajam
3 C=C aromatic 1575,92 , 1509,71 Sedang , tajam
4 C-O 1262,36 Sedang 5 C-O-C 1017,13 Tajam 1 2 3 4 5
Gambar 17. Spektrum IR senyawa hasil sintesis selama 6 jam Tabel 10. Data spektum IR senyawa hasil sintesis selama 6 jam
No Jenis Vibrasi Frekuensi (cm-1) Intensitas
1 C-H aromatik 3086,11 Sedang
2 C=O keton 1651,07 Tajam
3 C=C aromatik 1581,63 , 1512,19 Sedang , tajam
4 C-O 1265,30 Sedang
5 C-O-C 1026,13 Tajam
d. Analisis Data Spektra 1H-NMR Produk Sintesis
Hasil dari data spektra inframerah yang telah di analisis mempunyai gugus-gugus fungsional yang diharapkan. Namun untuk menyakinkan bahwa hasil sintesis merupakan
(E)1-3-bis-(3,4-1
2
3
dimetoksikalkon)-prop-en-1-on perlu didukung dengan adanya data spketra 1H-NMR. Spektofotomotor 1H-NMR pada penelitian ini digunakan untuk mengetahui jumlah proton, sifat lingkungan dan jenis proton yang terdapat dalam stuktur senyawa. Analisis menggunakan Kromatografi Lapis Tipis (KLT), titik leleh, spketrofotometer UV-Vis dan IR menunjukkan kemiripan pada ketiga hasil senyawa sintesis, namun pada analisi KLT scanner untuk senyawa hasil pengadukan 4 jam memiliki kemurnian yang paling tinggi yakni 70,70% sehingga analisis dengan menggunakan 1H-NMR hanya dilakukan pada senyawa hasil sintesis pengadukan 4 jam. Hasil spektrum 1H-NMR dari senyawa hasil sintesis disajikan dalam Gambar 20 berikut :
Gambar 18. Spektrum 1H-NMR senyawa hasil sintesis Data spektrum 1H-NMR senyawa hasil sintesis ditunjukkan pada Tabel 7 berikut ini. 1 6 5 4 2 3 2' 3' 4' 5' 6' 1'
O
OCH
3OCH
3H
3CO
H
3CO
7,744 ppm (1H, d) 3,934 ppm (3H, s) 3,926 ppm (3H, s) 7,127 ppm (1H, d) 7,206 ppm (1H, dd) 3,919 ppm (3H, s) 3,894 ppm (3H, s) 7,401 ppm (1H, s) 7,586 ppm (1H, d) 7,649 ppm (1H, dd) 7,713 ppm (1H, d) 7,371 ppm (1H, s) A B α βTabel 11. Data spektrum 1H-NMR senyawa hasil sintesis No
Atom (C) δ ppm (∑H, m) Jenis proton
2 7,371 ppm (1H, s) Ar 2-H 3 3,926 ppm (3H, s) -OCH3 4 3,934 ppm (3H, s) -OCH3 5 7,127 ppm (1H, d) Ar 5-H 6 7,206 ppm (1H, dd ) Ar 6-H Cα 7,744 ppm (1H, d) =CHα Cβ 7,713 ppm (1H, d ) =CHβ 2’ 7,401 ppm (1H, s) Ar 2’-H 3’ 3,894 ppm (3H, s) -OCH3 4’ 3,919 ppm (3H, s) -OCH3 5’ 7,586 ppm (1H, d ) Ar 5’-H 6’ 7,649 ppm (1H, dd ) Ar 6’-H B. PEMBAHASAN
Penelitian ini menggunakan bahan dasar 3,4-dimetoksiasetofenon dan 3,4-dimetoksibenzaldehid dengan jenis sintesisnya menggunakan reaksi kondensasi aldol silang dalam suasana basa. Untuk proses pengadukan, bahan dasar dilarutkan dalam etanol dan akuades dengan suhu kamar 25-30oC.
Bahan dasar senyawa 3,4-dimetoksiasetofenon mempunyai atom Hα, sehingga dalam kondisi basa mampu membentuk karbanion. Karbanion tersebut realtif stabil karena dapat berkonjugasi menghasilkan ion enolat. Proses pengadukan dilakukan dalam berbagai variasi waktu yaitu 2, 4, dan 6 jam.
Karbanion ini akan bereaksi dengan 3,4-dimetoksibenzaldehid dengan menyerang karbon gugus karbonil melalui reaksi kondensasi menghasilkan ion alkoksida. Hasil kondensasi ini mengalami transfer proton dari molekul air mengahsilkan β-hidroksiketon. Tahap reaksi selanjutnya adalah dehidrasi senyawa β-hidroksiketon, hal ini dipercepat dengan adanya Hα pada senyawa β-hidroksiketon yang mudah lepas dengan adanya basa kemudian membentuk produk. Hasil dari pengadukan dalam berbagai variasi waktu disimpen dalam semalam agar senyawa kalkon mengalami dehidrasi untuk membentuk senyawa produk. Mekanisme yang terjadi dapat yang terjadia pada bahan antara 3,4-dimetoksibenzaldehid dan 3,4 dimetoksiasetofenon yaitu :
a) Pembentukan ion enolat
C O H3CO H3CO H H H +-OH C O H3CO H3CO H H C O H3CO H3CO H H + H2O
b) Pembentukan ion alkoksida
C O H3CO H3CO H H H3CO C H3CO O H C O H3CO H3CO C OCH3 OCH3 O H
H
H
c) Pembentukan β-hidroksiketon H-O-H C O H3CO H3CO C OCH3 OCH3 O H H H C O H3CO H3CO C OCH3 OCH3 O H H H H
d) Dehidrasi dilanjutkan pembentukan senyawa produk
-H2O C O H3CO H3CO C OCH3 OCH3 O H H H H C O H3CO H3CO C OCH3 OCH3 H H
Menurut Sykes (1989) aldehid yang mempunyai Hα dengan gugus karbonil akan mengalami reaksi aldol relatif lebih cepat dengan mereaksikan asetofenon dengan larutan basa. Walaupun tingkat rendemen untuk katalis basa kurang memuasakan secara umum apabila dibandingkan dengan katalis asam (Fessenden dan Fessenden, 1999).
Hasil penelitian pada berbagai variasi waktu yang berbentuk serbuk dapat dilihat pada Tabel 3. Sampel dengan berbagai variasai waktu ditentukan titik lelehnya dengan alat melting point apparatus. Produk (kalkon) yang diinginkan memiliki nama secara IUPAC adalah (E)1-3-bis-(3,4-dimetoksikalkon)-prop-en-1-on.
1. Optimasi Waktu Reaksi Sintesis Senyawa Kalkon
Waktu reaksi yang digunakan untuk sintesis senyawa kalkon dari 3,4-dimetoksiasetofenon dan 3,4-dimetoksibenzaldehih adalah 2, 4 dan 6 jam. Optimasi waktu reaksi pada sintesis kalkon ini bertujuan untuk menentukan waktu reaksi yang paling optimum untuk mendapatkan produk yaitu senyawa kalkon yang rendemennya paling tinggi.
Hasil sintesis yang didapatkan menunjukkan bahwa rendemen tertinggi terdapat pada senyawa hasil sintesis dengan lama pengadukan 4 jam (Tabel 3). Dapat dilihat dari tabel bahwa dari hasil penelitian ini ternyata waktu reaksi tidak mempengaruhi besarnya randemen yang dihasilkan. Tabel hasil menunjukan bahwa waktu reaksi yang digunakan untuk mensistesis dari waktu 2 jam ke 4 jam mengalami peningkatan hasil pada senyawa produk dan mengalami penurunan ketika waktu reaksi yang digunakan bertambah yakni sampai 6 jam. Kenaikan waktu reaksi dari 2 jam ke 4 jam menyebabkan naiknya randemen. Hal ini disebabkan terjadinya peningkatan jumlah tumbukan antar partikel penyusun, akibatnya terjadi peningkatan rendemen. Sedangkan pada waktu 6 jam terjadi penurunan rendemen disebabkan karena pada sintesis senyawa telah terjadi reaksi kesetimbangan dan terjadi beberapa reaksi yang berlangsung selama reaksi.
Hal ini sesuai dengan penelitian yang telah dilakukan Kapella (2010) yang menjelaskan bahwa reaksi optimum pada reaksi kondensasi aldol silang rata-rata terjadi pada waktu reaksi 3-5 jam. Penurunan
rendemen pada waktu reaksi 6 jam berlawanan dengan penelitian yang telah dilakukan Sri Handayani, et al (2005) pada sintesis Flavanoid, yang menyatakan bahwa semakin lama waktu reaksi yang digunakan maka semakin banyak produk reaksi yang dihasilkan.
Randemen diperoleh melalui uji kemurnian senyawa hasil sintesis menggunakan TCL scanner dengan data berat hasil sintesis. Masing-masing variasi waktu yang didapatkan randemen secara berturut-turut yaitu 62,57; 63,35; dan 59,43%. Randemen terbesar diperoleh pada waktu reaksi 4 jam, sehingga waktu reaksi tersebut merupakan waktu reaksi optimum yang diperoleh.
2. Data Identifikasi Struktur Senyawa Hasil Sintesis
a. Analisis Kromatografi Lapis Tipis (KLT) dan Spektra KLT Scanner Analisis menggunakan KLT bertujuan untuk mengetahui jumlah komponen apakah bercak noda tunggal atau tidak, sehingga dapat mengetahui kemurnian senyawa. Pada penelitian ini digunakan beberapa eluen dan perbandingan yang berbeda untuk mendapatkan eluen yang menghasilkan pemisahan yang baik.
Pemilihan eluen dan perbandingan campuran eluen disesuaikan dengan polaritas senyawa kimia yang akan dipisahkan (Pavia et al., 2011). Hasil KLT menggunakan eluen campuran n-heksana dan kloroform dengan perbandingan 6 : 4 (Tabel 4) mengahasilkan bercak noda tunggal dan tidak berekor dengan harga Rf 0,5; 0,58; 0,17; 0,2; dan 0,28. Untuk hasil KLT dengan menggunakan eluen campuan n-heksana dan etil asetat
6 : 4 (Tabel 4) menghasilkan bercak noda tunggal dan tidak berekor dengan harga Rf 0,95; 0,97; 0,73; 0,73 dan 0,75.
Sedangkan untuk hasil KLT menggunakan eluen campuran n-heksana dan etil asetat dengan perbandingan 7 : 2 (Tabel 4) menghasilkan bercak noda tunggal dan tidak berekor dengan Rf sebesar 0,58; 0,67; 0,33; 0,3; dan 0,32. Pemisahan yang baik untuk menentukan kemurnian senyawa apabila dihasilkan bercak noda tunggal, tidak berekor, dan mempunyai harga Rf berkisar antara 0,2-0,8.
Dari ketiga perbandingan eluen, hasil KLT dengan campuran eluen n-heksana dan etil asetat dengan perbandingan 7 : 2 yang menghasilkan bercak noda tunggal, tidak berekor dan harga Rf berkisar antara 0,2-0,8 sedangkan hasil KLT pada perbandingan 6 : 4 Rf berkisar antara 0,1-0,9. Sehingga hasil KLT dari campuran eluen dengan perbandingan 7 : 2 ini yang di analisis lanjut dengan menggunakan KLT scanner untuk mengetahui persentase kemurnian dan data Rf senyawa yang dianalisis. Hasil KLT scanner menunjukkan kemurnian hasil sintesis 2 jam, 4jam dan 6 jam berturut-turut sebagai berikut 68,62; 70,70; dan 67,15. Persen kemurnian yang ditunjukkan oleh ketiga hasil sintesis tersebut merupakan hasil sintesis yang cukup baik.
Selanjutnya senyawa hasil sintesis diuji titik lelehnya menggunakan Fisher John Melting Point Apparatus mengahsilkan titik leleh pada rentang suhu sebesar 92-94oC untuk hasil senyawa dengan waktu pengadukan selam 2 dan 4 jam. Sedangkan untuk waktu
pengadukan selam 6 jam rentang suhu sebesar 91-93oC. Dari data tersebut dapat dikatakan bahwa senyawa hasil sintesis telah murni karena rentang titik lelehnya tidak lebih dari 2oC (Pevia et el., 2011)
b. Analisis Data Spektra UV-Vis Produk Sintesis
Spektrskopi UV-Vis merupakan salah satu teknik analisis instrumental yang melibatkan intearaksi radiasi elektromagnetik ultra violet dekat (190-380 nm) dan sinar tampak (380-780 nm). Radiasi elektromagnetik tersebut bila dilewatkan melalui materi, maka akan dipantulkan, diserap, diteruskan, dan dihamburkan (Mistry, 2009).
Untuk serapan panjang gelombang senyawa kalkon yang merupakan senyawa flavonoid menunjukkan serapan yang khas karena adanya sistem benzoil pada panjang gelombang 220-270 nm dan karena adanya sistem sinamoil pada serapan panjang gelombang 340-390 nm (Markham, 1988). Perkiraan hasil berdasarkan perhitungan Fischer, serapan senyawa hasil sintesis dalam suasana basa diperkirakan terjadi pada 284 nm (pita I) dan 353 nm (pita II).
Senyawa hasil sintesis diukur panjang gelombang maksilam (λmaks)
pada daerah 200-400 nm. Dari hasil pengukuran diperoleh λmaks pada hasil
sintesis senyawa kalkon dengan pengadukan 2 jam menunjukkan adanya serapan pita I pada panjang gelombang 359,80 nm dan serapan pita II pada panjang gelombang 242,80 nm (Gambar 12, Tabel 5). Untuk hasil sintesis senyawa kalkon dengan lama pengadukan 4 jam menunjukkan adanya
serapan pita I pada panjang gelombang 359,80 nm dan serapan pita II pada panjang gelomang 243,20 nm (Gambar 13, Tabel 6). Dari literatur, senyawa kalkon memiliki λmaks 340-390 nm sehingga hasil sintesis pada
waktu pengadukan 4 jam adalah kalkon. Sedangakan hasil sintesis senyawa kalkon dengan lama pengadukan 6 jam menunjukkan hanya terliht adanya serapan pita I pada panjang gelombang 359,60 nm (Gambar 14, Tabel 7). Panjang gelombang yang terjadi pada pita I dan pita II semua sarapan dari ketiga sampel dengan waktu pengadukan 2, 4, dan 6 jam menunjukkan perbedaan antara panjang gelombang maksimum pada pita I dan II dengan hasil perhitungan. Perbedaan panjang gelombang pada pita I yang mengalami pergeseran serapan kearah panjang gelombang lebih besar (pergesaran batokromik) dan pada pita II yang mengalami pergeseran serapan kearah panjang gelombang lebih pendek (pergeseran hipsokromik) ke dua hal ini disebabkan karena adanya pengaruh subtituen atau pengaruh pelarut dimana pada pita I yang mengalami kenaikan λmaks
karena adanya perpanjangan ikatan rangkap terkonjugasi dan pada pita II mengalami penurunan λmaks karena kehilangan ikatan rangkap
terkonjugasi.
c. Analisis Data Spektra IR Produk Sintesis
Analisis untuk mengetahui adanya gugus fungsi pada senyawa dilakukan dengan uji spektroskopi IR. Uji spektroskopi IR memberikan informasi bahwa senyawa target diduga terbentuk dengan munculnya pita
serapan pada bilangan gelombang tertentu. Untuk senyawa turunan kalkon mempunyai frekuensi vibrasi khas untuk gugus C=O, C=C, dan gugus aromatik pada bilangan gelombang tertentu.
Gugus C=O terdapat pada daerah serapan 1820-1600 cm-1, C=C aromatik pada 1650 cm-1 , C-H aromatik 3000-2700 cm-1 (Mistry, 2009). Spektra IR senyawa hasil sintesis 2, 4 dan 6 jam menunjukkan berbagai gugus fungsi dengan munculnya puncak-puncak serapan dengan intensitas sedang berturut-turut 3078,39 cm-1; 3082,75 cm-1; dan 3086,11 cm-1 merupakan serapan dari gugus C-H aromatik. Serapan dengan intensitas tajam pada 1262,30 cm-1; 1262,36 cm-1; dan 1265,30 cm-1 menunjukkan adanya gugus C-O serta Serapan dengan intesistas sedang pada 1589,34 cm-1; 1575,92 cm-1; dan 1581,63 cm-1 menunjukkan adanya gugus C=C aromatik. Gugus C=C aromatik juga terbaca pada serapan dengan intensitas tajam pada 1512,19 cm-1; 1509,71 cm-1; dan 1512,19 cm-1. Serapan dengan intesistas tajam pada 1651,07 cm-1, 1651,53 cm-1, dan 1651,07 cm-1 menunjukan adanya gugus karbonil (C=O) keton. Frekuensi serapan ini terjadi karena gugus karbonil terkonjugasi dengan ikatan rangkap (C=C) dan cincin aromatis (vinil).
d. Analisis Data Spektra 1H-NMR Produk Sintesis
Pada spektra 1H-NMR puncak yang pertama muncul adalah (s, 3H) dengan pergeseran kimia berturut-turut yakni δ=3,926 ppm; 3,894 ppm; 3,934 ppm; dan 3,919 ppm menunjukkan bahwa spektra ini sebagai gugus
metoksi (-OCH3) pada posisi atom C- 3, C-3’, C- 4 dan C- 4’. Pada cincin
aromatis A, posisi atom C-5 mengalami kopling sebanyak satu kali dengan posisi atom C-6, sedangkan pada cincin aromatis B, posisi atom C-5’ juga mengalami kopling sebanyak satu kali dengan posisi atom C-6’ dengan pergeseran kimia berturut-turut δ = 7,127 ppm dan δ=7,586 (d, 1H). Pada pergeseran kimia δ = 7,744 ppm (d, 1H), δ=7,713 ppm (d, 1H) berturut-turut memperlihatkan proton H pada C-α dan C-β. Dilihat dari dari harga tetapan kopling tersebut dapat diperkirakan bahwa proton pada pada ikatan rangkap ini mempunyai konfigurasi trans (E). Pergeseran kimia δ=7,371 ppm menunjukkan proton H pada posisi atom C-2 dan δ=7,713 ppm pada posisi atom C-2’ dengan puncak singlet. Proton pada posisi atom C-6 dan C-6’ muncul sebagai puncak double doublet. Untuk posisi atom C-6 dengan pergeseran kimia δ=7,206 ppm selain berinteraksi dengan proton posisi C-5, juga berinteraksi dengan posisi C-2, sedangkan posisi atom C-6’ dengan pergeseran kimia δ=7,649 berinteraksi dengan proton posisi C-5’ dan posisi C-2’.
Hasil identifikasi data spektra UV-Vis, IR dan 1H-NMR pada hasil sintesis dapat disimpulkan struktur senyawanya sesuai dengan senyawa target yang diinginkan yaitu (E)1-3-bis-(3,4-dimetoksikalkon)-prop-en-1-on.
BAB V
KESIMPULAN DAN SARAN A. KESIMPULAN
Berdasarkan data penelitian yang telah didapatkan, maka dapat disimpulkan yaitu:
1. Struktur senyawa hasil sintesis dengan menggunakan reaksi kondensasi aldol silang antara senyawa 3,4-dimetoksiasetofenon dan 3,4-dimetoksibenzaldehid dalam suasana basa adalah (E)1-3-bis-(3,4-dimetoksikalkon)-prop-en-1-on.
2. Rendemen senyawa (E)1-3-bis-(3,4-dimetoksikalkon)-prop-en-1-on tersebut pada variasi waktu 2, 4, dan 6 jam berturut-turut 62,57 %, 63,35% dan 59,43%.
3. Waktu reaksi optimum dengan rendemen maksimum adalah 4 jam.
B. SARAN
Saran yang dapat disampaikan terkait penelitian ini, yaitu Sintesis senyawa kalkon perlu dilakukan dengan metode sintesis lain agar diperoleh rendemen yang lebih baik dan waktu sintesis yang relatif cepat, misalnya dengan menggunakan metode iridasi gelombang mikro.
DAFTAR PUSTAKA
Achmad, S.A. (1986). Buku Materi Pokok Kimia Organik Bahan Alam. Jakarta: Karunika Universitas Terbuka.
Budimarwanti, C., Handayani, S. (2010). Efektivitas Katalis Asam Basa pada Sintesis 2-Hidroksikalkon, Senyawa yang Berpotensi sebagai Zat Warna. Prosiding Seminar Nasional Kimia dan Pendidikan
Kimia 2010 ISBN: 978-97998117-7-6.
Bruice, P. Y. (2007). Organic Chemistry, Fifth edition. New York.
Brown, W., Christopher, S.F., & Brent, L.,I., Eric, V.A. (2012). Organic Chemistry, 6th Ed. USA: Brooks/Cole,Cengage Learning, p.744,748-749.
Creswell, C., Ollaf Ruquist & Malkom Campbell. (1982). Analisis
Spektrum Senyawa Organik. Bandung: ITB.
Desai, K.R., & Mistry, N.M. (2004). Studies on Synthesis of Some Novel Heterocyclic Chalcone, Pyrazoline, Pyrimidine - 2 - One, Pyrimidine -2 - Thione, para – Acetanilide Sulphonyl and Benzoyl Derivatives and their Antimicrobial Activity. E-Journal of
Chemistry. 2 (6) : 30-41.
Fessenden & Fesenden. (1999). Kimia Organik, Edisi Ketiga, Jilid 2. Jakarta: Erlangga.
Gritter, R.J., Robbit, J M., & Schwarting, A E. (1991). Pengantar
Kromotografi (K. Padmawinata, Trans.). Bandung: Penerbit ITB
Bandung.
Harborne, J.B. (1987). Metode Fitokimia, Penuntun Cara Modern
Menganalisis Tumbuhan. Penerjemah:Padmawinata, K. Terbitan
kedua. Bandung: Penerbit ITB.
Ikan, R. (1969). Natural products (A loboratory Guide). Jerusalem: The Hebrew University of Jerusalem.
Kapelle, I.B.D. (2010). Sintesis Senyawa Turunan Khalkon 3-fenil-(5’-alil-2’hidroksi 3-metoksifenil) Prop-2-enon dari Minyak Kulit Lawang. Hlm.125-132.
Khopkar, S.M. (2008). Konsep Dasar Kimia Analitik. Jakarta: UI-Press Kosela, S. (2010). Cara Mudah dan Sederhana Penentuan Struktur
Molekul Berdasarkan Spektra Data (NMR, Mass, IR, UV). Jakarta: