Reaksi Kondensasi Terkatalisis Basa: Sintesis Dilantin
Adrian Ferrariski Putra (1406601113), Adysta Nandya, Hayatul Husna
Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Indonesia
Kampus UI Depok, 16424, Depok, Jawa Barat, Indonesia
E-mail:
adrian.ferrariski@ui.ac.idAbstrak
Benzoin, α-ketoalkohol mudah mengalami oksidasi membentuk diketon kuning, benzil, dan keduanya dapat tereduksi menjadi spesi diolnya, hidrobenzoin. Kondensasi terkatalisis basa dibenzil dengan urea dapat menghasilkan sebuah turunan heterosiklik yaitu dilantin yang dapat digunakan dalam pengobatan karena sifat anticolvunsantnya. Sintesis Dilantin memiliki prinsip reaksi kondensasi reversible antara katalis basa dari benzil dengan urea yang menghasilkan turunan heterosiklik Dilantin, dimana Dilantin merupakan obat dari golongan hidantoin yang mempunyai sinonim Difenilhidantoin (DPH) atau berdasarkan nama IUPAC 5,5-Difenilimidazolidin-2,4-dion. Proses ini melibatkan penataan ulang dari rangka (skeletal rearrangement) dengan kedua gugus fenil sampai ujung atom karbon yang sama. Metode yang digunakan yaitu metode ekstraksi mengikuti kaidah prinsip refluks, dimana prinsip refluks ialah pemanasan, kondensasi, dan sistem tertutup. Hasil yang diperoleh dari percobaan kali ini, yaitu pada Dilantin, dimana Dilantin berbentuk padatan berwarna putih. Berdasarkan data hasil praktikum, didapat massa Dilantin sebesar 2,21 gram dengan % Yield dari perhitungannya sebesar 460,42% dan dan Kesalahan Relatifnya sebesar 360,42% yang membuktikan bahwa pada hasil percobaan ini terdapat kesalahan positif.
Kata kunci: Sintesis Dilantin, Kondensasi, dan Refluks
1. PENDAHULUAN
Percobaan ini bertujuan untuk mengetahui cara pembuatan dilantin dari bahan dasar benzil dan urea, mengetahui mekanisme reaksi kondensasi dengan katalis basa, serta memahami reaksirearrangement yang terjadi dalam sintesis dilantin.
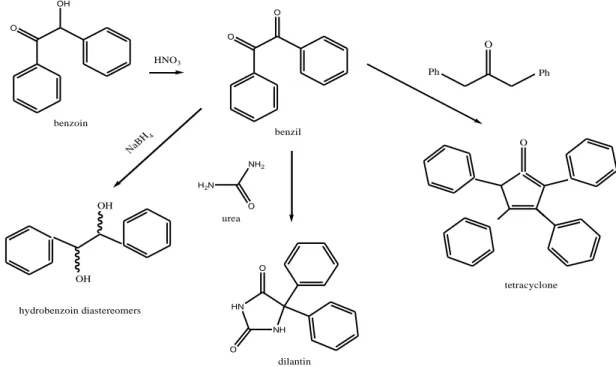
Benzoin, -ketoalkohol, mudah mengalami oksidasi membentuk diketon kuning, benzil, dan keduanya dapat tereduksi menjadi spesi diolnya, hidrobenzoin. Kondensasi terkatalisis basa dibenzil dengan urea dapat menghasilkan sebuah turunan heterosiklik yaitu dilantin yang dapat digunakan dalam pengobatan karena sifat anticolvunsantnya. Kondensasi terkatalisis basa dari benzil dengan dibenzil keton akan menghasilkan keton siklik, tetrasiklon, senyawa ungu yang tidak biasa. Reduksi dari benzil dengan Natrium Borohidrida akan menghasilkan campuran dari diastereomer, rasemik- dan meso-hidrobenzoin. Jumlah diastereomer
Meso akan mendominasi dan dapat diisolasi dengan cara kristalisasi dari air, di mana senyawanya harus
OH O benzoin HNO3 O O benzil O Ph Ph O tetracyclone NH2 O H2N urea O HN NH O dilantin NaB H4 OH OH hydrobenzoin diastereomers
Reaksi Pembentukan Dilantin
Sumber: Tim KBI Kimia Organik.2016. Diktat Penuntun Praktikum Kimia Organik. Depok : Departemen Kimia FMIPA UI.
Dalam percobaan ini, dilantin disintesis pertama-tama dengan dengan cara mencampurkan benzil, urea, etanol, dan NaOH. Setelah semua reagen awal tercampur, dilakukan pemanasan dengan bantuan pendingin tegak atau refluks selama ± 60 menit, kemudian didinginkan dan ditambahkan air suling serta HCl(p) secara
perlahan. Campuran kemudian didiamkan selama 15 menit dan setelah itu padatannya disaring menggunakan corong buchner. Pada proses penyaringan, etanol digunakan sebagai larutan pencuci.
2. TINJAUAN PUSTAKA 2.1 Benzil
Benzil (sistematis dikenal sebagai 1,2-diphenylethane-1,2-dion) adalah senyawa organik dengan rumus (C6H5CO)2, umumnya disingkat (PhCO)2. Benzil merupakan salah satu diketones paling umum.
Penggunaan utamanya adalah sebagai fotoinisiator dalam kimia polimer. Benzil berupa padatan berwarna kuning dengan titik leleh 950C dan titik didih 6560F. Senyawa ini memiliki berat molekul 210,23 gr/mol. Senyawa ini larut dalam air panas dan air dingin. Benzil memiliki bahaya kronik dapat menyebabkan kerusakan pada organ yang terlibat, dapat menyebabkan iritasi, dan berbahaya jika terhirup maupun tertelan. Pertolongan pertama jika terpapar benzil adalah sebagai berikut: Jika terkena mata, cuci dengan air dingin selama 15 menit. Air hangat juga harus digunakan. Jika terkena kulit, cuci dengan air selama 15 menit. apabila terhirup, keluar ke udara terbuka.
Gambar 1. Struktur Benzil 2.2 Urea
Urea adalah senyawa nitrogen yang mengandung gugus karbonil terikat pada dua kelompok amina dengan aktivitas diuretik osmotik. Secara In vivo, urea terbentuk di hati melalui siklus urea dari amonia dan merupakan produk akhir akhir metabolisme protein. Urea berbentuk kristal pelet putih yang tidak berbau dengan densitas 1,335 g/cc. Urea cukup larut dalam air dan tidak mudah terbakar.
Gambar 2. Strukur Urea 2.3 Etanol absolut
Alkohol murni atau etanol absolut merupakan sejenis cairan yang mudah menguap, mudah terbakar, tak berwarna, dan merupakan alkohol yang paling sering digunakan dalam kehidupan sehari-hari. Senyawa ini merupakan obat psikoaktif dan dapat ditemukan pada minuman beralkohol dan termometer modern. Etanol adalah salah satu obat rekreasi yang paling tua. Etanol termasuk ke dalam alkohol rantai tunggal, dengan rumus kimia C2H5OH dan rumus empiris C2H6O. Ia merupakan isomer
konstitusional dari dimetil eter. Etanol sering disingkat menjadi EtOH, dengan "Et" merupakan singkatan dari gugus etil (C2H5).
2.4 Dilantin (Fenitoin)
Dilantin berupa padatan putih dengan titik leleh 2950C. Senyawa ini memiliki berat molekul 252,27 gram/mol dan tekanan uap 1,2 mmHg pada 200C. Dilantin dapat dengan mudah larut dalam air yang biasanya menghasilkan larutan agak keruh karena terhidrolisis sebagian dan menyerap CO2, dilantin
dapat larut dalam etanol namun tidak larut dalam eter dan kloroform.
Gambar 3. Struktur Dilantin
Dilantin (Fenitoin) merupakan obat dari golongan hidantoin yang mempunyai sinonim Difenilhidantoin (DPH) atau berdasarkan nama IUPAC 5,5-Difenilimidazolidin-2,4-dion. Fenitoin merupakan obat antiepilepsi nonsedatif tertua, dikenal sejak tahun 1938 (Harknee, 1989; Yuen 1989). 2.5 Metode Ekstraksi Dan Kondensor Refluks
Metode ekstraksi itu sendiri merupakan metode pemisahan yang melibatkan proses pemindahan satu atau lebih senyawa dari satu fasa ke fasa yang lain berdasarkan prinsip kelarutan dimana senyawa tersebut larut dalam pelarut polar dan senyawa satunya larut dalam pelarut non polar.
Refluks adalah salah satu metode dalam ilmu kimia untuk mensintesis suatu senyawa, baik organik maupun anorganik. Umumnya digunakan untuk mensistesis senyawa-senyawa yang mudah menguap atau volatile. Pada kondisi ini jika dilakukan pemanasan biasa maka pelarut akan menguap sebelum reaksi berjalan sampai selesai. Prinsip dari metode refluks adalah pelarut volatil yang digunakan akan menguap pada suhu tinggi, namun akan didinginkan dengan kondensor sehingga pelarut yang tadinya dalam bentuk uap akan mengembun pada kondensor dan turun lagi ke dalam wadah reaksi sehingga pelarut akan tetap ada selama reaksi berlangsung. Sedangkan aliran gas N2 diberikan agar tidak
ada uap air atau gas oksigen yang masuk terutama pada senyawa organologam untuk sintesis senyawa anorganik karena sifatnya reaktif.
2.6 Reaksi Kondensasi Katalis Basa dan Rearrangement
Reaksi kondensasi aldol dapat dilangsungkan oleh senyawa aldehida yang mempunyai hidrogen α. Reaksi kondensasi aldol terjadi pada satu jenis aldehida dengan adanya asam atau basa encer. Senyawa hasil reaksi kondensasi aldol adalah aldehida β-hidroksi yang sering disebut dengan senyawa aldol. Senyawa aldol adalah senyawa yang memiliki gugus fungsi aldehida dan alkohol sekaligus.
Reaksi rearrangement atau reaksi penataan ulang adalah reaksi dalam kimia organik yang membentuk senyawa baru dengan rumus molekul sama tetapi strukturnya berbeda (Isomer). Ciri khas dari reaksi penataan ulang ditandai oleh adanya suatu gugus yang berpindah dari suatu atom ke atom yang lain dalam suatu molekul. Mekanisme reaksi yang terjadi pada kondensasi aldol adalah sebagai berikut.
Penjelasan Mekanisme yang terjadi pada bagian pertama reaksi ini adalah sebuah reaksi aldol, sedangkan bagian kedua reaksi ini adalah reaksi dehidrasi. Dehidrasi dapat diikuti oleh dekarboksilasi ketika terdapat sebuah gugus karboksil yang aktif. Produk adisi aldol dapat didehidrasi via dua mekanisme, yakni mekanisme enolat yang menggunakan basa kuat dan mekanisme enol yang menggunakan katalis asam.
3. METODE PERCOBAAN 3.1 Alat dan Bahan
Alat yang digunakan pada percobaan ini antara lain labu bulat yang berfungsi sebagai wadah terjadinya reaksi, gelas ukur untuk mengukur volume reagen, pendingin tegak (refluks) serta penyaring Buchner yang digunakan untuk menyaring sisa fasa cairan yang masih menempel di endapannya. Sedangkan untuk bahan yang digunakan pada percobaan Dilantin ini, yaitu : 0,4 g sampel benzil, 0,2 g urea, 6 mL etanol absolut, 1,2 mL larutan NaOH 30%, HCl Pekat dan 10 mL air suling.
3.2 Pembuatan Dilantin
Pertama-tama, ditempatkan 0,4 g sampel benzil ke dalam labu bulat 25 mL bersama dengan 0,2 g urea, 6 mL etanol absolut dan 1,2 mL larutan NaOH 30%. Kemudian ditambahkan batu didih dan sebuah kondensor reflux dipasangkan. Campuran lalu dipanaskan dengan bantuan reflux selama 35 – 45 menit. Didiamkan selama 10 menit pada suhu ruang, setelah itu, bagian luar labu bulat dialiri air keran agar dingin. Selanjutnya ditambahkan 10 mL aquadest dan HCl pekat sampai campuran dalam labu bulat menjadi asam. Keasaman campuran harus diuji dengan menggunakan kertas lakmus. Setelah campuran bersifat asam, lalu dilakukan penyaringan dengan penyaring Buchner dan endapan dicuci dengan etanol. Endapan yang didapat kemudian dikeringkan dan ditimbang.
3.3 Data Pengamatan
Campuran 0,4 gr Benzil + 0,2 gr urea + 6 mL Etanol
Absolut + 1,2 mL lat NaOH 30% di atas heater
Campuran setelah ditambahkan 10 mL Aquades dan HCl(p).
Aquades berfungsi untuk mengubah laktim (enol) menjadi laktam (keto).
Massa Dilantin + kertas saring yang didapat sebesar 3,15 gr, dengan
massa murni Dilantin (tanpa kertas saring)
3.4 Perhitungan secara teoritis M Benzil = 0,4 gr M Urea = 0,2 gr Mr Benzil = 210 gr/mol Mr Urea = 60.07 gr/mol Mr Dilantin = 252 gr/mol
Pertama menentukan berat dilantin secara teoritis ; Mol reaktan Mol benzil =
-3
mol
Mol Urea =-3
mol
Reaksi yang terjadi :
M: -3
mol -3 mol
R: -3 mol -3 mol -3 mol
____________________________________________________________________________ S: - -3 mol -3 mol
Sehingga didapatkan massa teoritis Dilantin = -3
mol x 252 gr/mol = 0,4800 gram 3.5 Perhitungan secara percobaan
Dari percobaan didapatkan massanya :
Kertas saringnya 0,94 gr dan Endapannya 3,15 gr (Endapan + Kertas Saring)
Pada percobaan didapatkan massa Dilantin = (massa kertas saring + endapan) – (massa kertas saring) = (3,15 gr – 0,94 gr) = 2,21 gr
3.6 Kesalahan Relatif dan Yield
% KR massa
= |
| x 100%
= |
–| x 100%
= 360,42 %
% Yield massa =
x 100%
=
x 100%
= 460,42 %
4. HASIL DAN PEMBAHASAN
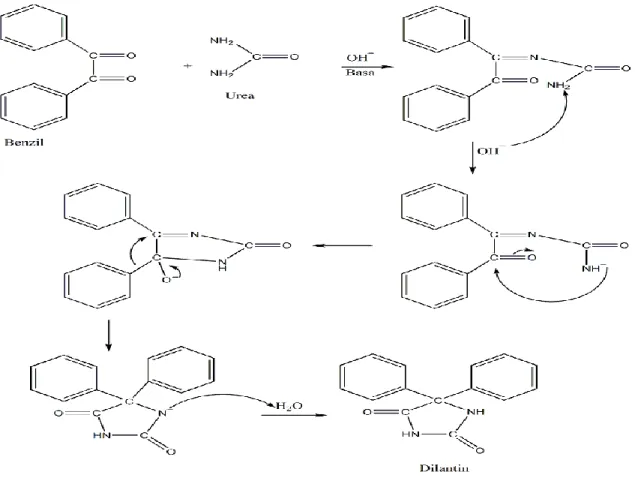
Ketika dipanaskan, benzil dan urea bersama dengan basa sebagai katalis kondensasi akan menghasilkan dilantin. Proses ini melibatkan penataan ulang dari rangka (skeletal rearrangement) dengan kedua gugus fenil sampai ujung atom karbon yang sama. Prinsip dari reaksi sintesis dilantin ini adalah reaksi kondensasi antara katalis basa dari benzil dengan urea yang menghasilkan turunan heterosiklik dilantin. Berikut Reaksi secara umumnya:
Gambar 4. Reaksi Sintesis Dilantin
Pada saat ion enolat ini bereaksi maka akan terbentuk lagi yang baru (bersifat reversible). Ion enolat bereaksi dengan suatu molekul aldehida lain dengan cara mengadisi pada karbon karbonil untuk membentuk suatu ion alkoksida, yang kemudian merebut sebuah proton dari air untuk menghasilkan aldol produk tersebut. Syarat aldehida untuk dapat berkondensasi aldol adalah harus memiliki Ha terhadap gugus karbonil sehingga aldehida dapat membentuk ion enolat dalam basa. Suatu senyawa karbonil b-hidroksi seperti sebuah aldol mudah mengalami dehidrasi, karena ikatan rangkap dalam produk berkonjugasi dengan gugus karbonilnya. Bila dehidrasi menghasilkan suatu ikatan rangkap yang berkonjugasi dengan suatu cincin aromatik maka dehidrasi berlangsung spontan. Mekanisme reaksi yang terjadi, yaitu:
Dalam percobaan ini, disintesis dilantin dengan cara mencampurkan 0,4 g sampel Benzil ke dalam labu bulat 25 mL bersamaan dengan 0,2 g urea, 6 mL etanol absolut dan 1,2 mL larutan NaOH 30%. Benzil berfungsi sebagai reagen utama yang memiliki gugus C C
O O
sehingga dapat bereaksi dengan urea membentuk suatu amida siklik (laktam). Urea berfungsi sebagai reagen utama yang mempunyai gugus diamida dengan atom hidrogen-β yang bersifat asam, sehingga hidrogen β akan mudah lepas dan diserang oleh suatu nukleofilik. NaOH berfungsi untuk memberi suasana basa dan sebagai Katalis Basa untuk mempercepat reaksi, serta memiliki ion OH- untuk menyerang hidrogen β pada urea, sehingga urea dan benzil dapat berikatan. Etanol berfungsi sebagai pelarut benzil, urea, dan NaOH karena benzyl dan urea tidak dapat bercampur menjadi satu fasa. Etanol bersifat semipolar karena memiliki gugus –OH yang bersifat polar dan gugus –CH3 yang bersifat nonpolar.
Batu didih ditambahkan ke dalam campuran sebelum dipanaskan dengan metode refluks agar saat pemanasan tak terjadi bumping. Setelah itu, campurannya direfluks sekitar 35 – 45 menit, dimana Prinsip dari metode refluks adalah pelarut volatile yang digunakan akan menguap pada suhu tinggi, namun akan didinginkan dengan kondensor sehingga pelarut yang tadinya dalam bentuk uap akan mengembun pada kondensor dan turun lagi ke dalam wadah reaksi, sehingga pelarut akan tetap ada selama reaksi berlangsung. Pada saat refluks pemanasan dilakukan dengan heating mantle karena agar panas yang diberikan merata pada labu bulat.
Setelah direfluks, diamkan campuran pada suhu ruang selama 10 menit, dan aliri dinding labu bulatnya dengan air keran yang mengalir, tujuannya supaya campurannya lebih endotermis dan langsung bisa dipindahkan ke beaker glass. Lalu, menambahkan 10 mL aquades. Aquades berfungsi untuk mengubah laktim (enol) menjadi laktam (keto). Pada penambahan aquades, tidak terjadi endapan karena dilantin tidak bisa mengendap pada suasana basa. Oleh karena itu, dilakukan penambahan HCl pekat untuk membuat suasana asam sampai terjadi endapan. Menguji keasaman campuran dengan menggunakan kertas lakmus. Setelah dilakukan penambahan HCl pekat, terdapat endapan kuning yang merupakan endapan dilantin. HCl juga berfungsi untuk menurunkan kelarutan dilantin sehingga dilantin dapat mengendap. Setelah itu, endapan disaring dengan penyaring Buchner dan dicuci dengan aquades. Pencucian dengan aquades ini bertujuan untuk membersihkan endapan dari pengotor-pengotor polar. Didapatkan Endapan Dilantin murni yang berupa padatan putih tanpa kertas saring sebesar 2,21 gram.
Dilantin (Fenitoin) merupakan obat dari golongan hidantoin yang mempunyai sinonim Difenilhidantoin (DPH) atau berdasarkan nama IUPAC 5,5-Difenilimidazolidin-2,4-dion. Fenitoin merupakan obat antiepilepsi nonsedatif tertua, dikenal sejak tahun 1938 (Harknee, 1989; Yuen 1989). Dilantin berupa padatan putih dengan titik leleh 2950C. Senyawa ini memiliki berat molekul 252,27 gram/mol dan tekanan uap 1,2 mmHg pada 200C.
Dilantin dapat digunakan dalam pengobatan karena sifat antikonvulsantnya yang digunakan terutama untuk mencegah dan mengobati bangkitan epilepsi (epileptic seizure). Golongan obat ini lebih tepat dinamakan antiepilepsi, sebab obat ini jarang digunakan untuk gejala konvulsi lain. Bromida, obat pertama yang digunakan untuk terapi epilepsi telah ditinggalkan karena ditemukannya berbagai antiepilepsi baru yang lebih efektif. Fenobarbital diketahui mempunyai efek antikonvulsi spesifik, yang berarti efek antikonvulsinya tidak berkaitan langsung dengan efek hipnotiknya. Di Indonesia fenobarbital ternyata masih digunakan, walaupun di luar negeri obat ini mulai banyak ditinggalkan. Fenitoin (difenilhidantoin), sampai saat ini masih tetap merupakan obat utama antiepilepsi.
4.5 Analisis Hasil
Hasil yang diperoleh dari percobaan kali ini, yaitu Dilantin, dimana Dilantin berbentuk padatan berwarna putih. Kemudian, endapan dilantin yang diperoleh ditimbang berat massanya. Didapatkan massa Dilantin murni tanpa kertas saring sebesar 2,21 gr, dengan titik leleh 2950C. Senyawa ini memiliki berat molekul 252,27 gram/mol dan tekanan uap 1,2 mmHg pada 200C. Dilantin dapat digunakan dalam pengobatan karena sifat antikonvulsantnya yang digunakan terutama untuk mencegah dan mengobati bangkitan epilepsi (epileptic seizure). Dengan % Yield massa dari perhitungannya sebesar 460,42 % yang membuktikan bahwa pada hasil percobaan terdapat kesalahan positif.
4.7 Analisis Kesalahan
Pada percobaan kali ini, didapatkan % kesalahan relatif sintesis Dilantin dari massanya sebesar 360,42%. Hal ini dikarenakan beberapa faktor, baik faktor dari praktikan maupun alat dan bahannya. Kesalahan yang mungkin terjadi antara lain:
4.7.1 Faktor dari Praktikan
Kurangnya ketelitan dalam pengukuran berat senyawa yang telah disintesis. Kurangnya ketepatan dalam mensintesis pencampuran senyawanya
Kurangnya ketelitian pada penyaringan dengan corong buchner.
Waktu merefluks campuran yang singkat dan panas dari heating mantle yang cukup kecil. 4.7.2 Faktor dari Alat dan Bahan
Tidak dilakukan pengecekan pH setelah ditambahkan air suling dan HCl(p) sehingga
kesempurnaan reaksinya tidak diketahui. Peralatan yang kurang bersih.
Reagen yang sudah lama dan terkontaminasi. 5. KESIMPULAN
Dilantin digunakan sebagai obat anti kejang dan anti epilepsi dengan cara memerintahkan otak untuk mengehentikan kejang. Dilantin dapat diperoleh dengan mereaksikan benzil dan urea dalam suasana basa (NaOH) dan terbentuk dilantin dalam suasan asam (HCl). Reaksi yang terjadi adalah kondesasi aldol dengan katalis basa dan reaksi rearrangement. Metode yang digunakan dalam percobaan ini adalah metode refluks. Massa dilantin yang diperoleh sebesar 2,21 gram dengan % KR 360,42% dan % yield sebesar 460,42%. UCAPAN TERIMA KASIH
Terima kasih kepada Tuhan Yang Maha Esa yang telah memberikan saya kesehatan, sehingga saya dapat melakukan percobaan kali ini mengenai “Reaksi Kondensasi Terkatalisis Basa: Sintesis Dilantin” dan dapat menyelesaikan laporan. Terimakasih juga untuk rekan praktikum saya yang telah bekerjasama dalam melaksanakan percobaan Sintesis Dilantin ini dan tentunya asisten laboratorium saya kak Nanda yang telah membantu mendampingi saya melakukan percobaan Sintesis Dilantin ini.
DAFTAR PUSTAKA
Aicardi, Jean. 2008. Epilepsy: a comprehensive textbook (2nd ed.). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. p. 1431. ISBN 9780781757775.
Fessenden, Ralph J dan Fessenden, Joan S.1986. Kimia Organik Jilid 1 Edisi Ketiga (A. H. Pudjaatmaka,
Penerjemah). Jakarta: Erlangga.
Nasution, Arfin. Catatan Penting Penuntun Praktikum Sintesis Kimia Organik. Depok : Departemen Kimia FMIPA UI. 2013. handwrite.
N. N. Greenwood, A. Earnshaw, 1997, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK.
Tim KBI Kimia Organik.2016. Diktat Penuntun Praktikum Kimia Organik.Depok: Departemen Kimia FMIPA UI.
LAMPIRAN
Material Safety Data Sheet (MSDS)
1. Benzil
a. Keadaan Fisik : Padatan b. Mr : 210.23 g/mol c. Titik didih : -
d. Titik leleh : 95°C (203°F)
e. Kelarutan : Tidak larut dalam air dingin dan air panas
f. Stabilitas : Stabil
g. Efek kronis pada manusia : Berbahaya jika tersentuh kulit (iritasi), kontak mata (iritasi), iritasi pernapasan. Benzyl beracun untuk kulit, sistem saraf pusat. Sentuhan berulang atau berkepanjangan dengan benzyl bisa menghasilkan kehancuran target-target organ.
2. Urea
a. Keadaan Fisik : Padatan b. Mr : 60,06 g/mol c. Titik didih : -
d. Titik leleh : 132.7°C (270.9°F)
e. Kelarutan : Mudah larut dalam air dingin dan air panas
f. Stabilitas : Stabil
g. Efek kronis pada manusia : Berbahaya jika tersentuh kulit (iritasi), kontak mata (iritasi), iritasi pernapasan.
3 NaOH 30%
a. Keadaan Fisik : Cairan
b. Mr : -
c. Titik didih : 100°C (212°F) d. Titik leleh : -
e. Kelarutan : Mudah larut dalam air dingin f. Stabilitas : Stabil
g. Efek kronis pada manusia : Sangat berbahaya jika tercerna. Berbahaya jika kontak kulit (iritasi), kontak mata (iritasi), sangat berbahaya jika terhirup.
4 Etanol Absolut
a. Keadaan Fisik : Cairan
b. Mr : -
c. Titik didih : 78.5°C (173.3°F) d. Titik leleh : -114.1°C (-173.4°F)
e. Kelarutan : Mudah larut dalam air dingin, air panas, metanol, dietil eter, aseton. f. Stabilitas : Stabil
g. Efek kronis pada manusia : Sangat berbahaya jika tercerna. Berbahaya jika kontak kulit (iritasi), kontak mata (iritasi), sangat berbahaya jika terhirup.
3. HCl pekat
a. Keadaan Fisik : Cairan b. Mr : 36,5 g/moll
c. Titik didih : 108.58°C @ 760 mm Hg (untuk 20.22% HCl dalam air) 83°C @ 760 mm Hg (untuk 31% HCl dalam air) 50.5°C (untuk 37% HCl dalam air)
d. Titik leleh : 62.25°C (80°F) (20.69% HCl dalam air) 46.2°C (31.24% HCl dalam air) -25.4°C (39.17% HCl dalam air)
e. Kelarutan : Larut dalam air dan dietil eter f. Stabilitas : Stabil
g. Efek kronis pada manusia : Sangat berbahaya jika tersentuh kulit (korosif, iritasi), kontak mata (iritasi, korosif). Berbahaya untuk saluran pencernaan, pernapasan. Sedikit berbahaya untuk kontak kulit (korosif). Inflamasi mata ditandai dengan kemerahan, berair, dan gatal. Inflamasi kulit ditandai dengan gatal, bersisik, kemerahan, atau, kadang-kadang, melepuh.
h. Pertolongan pertama : Jika terkena mata, cuci dengan air dingin selama 15 menit. Air hangat juga harus digunakan. Jika terkena kulit, cuci
dengan air selama 15 menit. Apabila terhirup, keluar ke udara terbuka.
4. Dilantin (Fenitoin)
a. Keadaan Fisik : Padatan b. Mr : 252.27 g/mol c. Titik didih : -
d. Titik leleh : 295°C (563°F)
e. Kelarutan : Tidak larut dalam air dingin f. Stabilitas : Stabil
g. Efek kronis pada manusia : Sangat berbahaya jika tercerna. Berbahaya jika kontak dengan mata (iritasi) pernapasan. Sedikit berbahaya jika kontak dengan kulit (iritasi). Interaksi yang berlebihan dapat menyebabkan kematian.
h. Pertolongan pertama : Jika terkena mata, cuci dengan air dingin selama 15 menit. Air hangat juga harus digunakan. Jika terkena kulit, cuci dengan air selama 15 menit. Apabila terhirup, keluar ke udara terbuka.