UIN SYARIF HIDAYATULLAH JAKARTA
Modifikasi Struktur Etil
ρ
-metoksisinamat Melalui
Reaksi Kondensasi Aldol dengan Etil Metil Keton
SKRIPSI
PUTRI HAYATI NUFUS
1112102000030
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
UIN SYARIF HIDAYATULLAH JAKARTA
Modifikasi Struktur Etil
ρ
-metoksisinamat Melalui
Reaksi Kondensasi Aldol dengan Etil Metil Keton
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi
PUTRI HAYATI NUFUS
1112102000030
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
Nama : Putri Hayati Nufus Program Studi : Strata-1 Farmasi
Judul Skripsi : Modifikasi Struktur Etil ρ-metoksisinamat melalui Reaksi Kondensasi Aldol dengan Etil Metil Keton.
Etil ρ-metoksisinamat (EPMS) merupakan senyawa yang terkandung dalam kencur (Kaempferia galanga L) yang memiliki aktivitas sebagai antiinflamasi. Gugus ester pada EPMS merupakan gugus yang kurang stabil karena mudah terhidrolisis. Penelitian ini bertujuan untuk memodifikasi struktur etil ρ-metoksisinamat (EPMS) melalui reaksi kondensasi aldol dengan etil metil keton. Gugus ester pada EPMS akan diubah menjadi gugus keton. Modifikasi EPMS melalui tiga proses yaitu proses hidrolisis menggunakan NaOH, proses oksidasi menggunakan Ca(NO3)2 dan proses
kondensasi aldol menggunakan etil metil keton dengan adanya NaOH dalam air. Reaksi dilakukan dengan menstirer campuran pada suhu ruang. Analisis struktur molekul senyawa ditentukan berdasarkan data fisika, GCMS dan 1H-NMR. Hasil
hidrolisis EPMS menghasilkan senyawa asam ρ-metoksisinamat (APMS) yang di oksidasi sehingga menghasilkan senyawa 4-metoksibenzaldehid. Senyawa tersebut direaksikan dengan etil metil keton melalui reaksi kondensasi aldol. Setelah dilakukan reaksi selama 24 jam diperoleh senyawa target dengan rendemen 35,26 %. Reaksi kondensasi aldol menggunakan basa NaOH dalam air yang akan merubah senyawa etil metil keton menjadi ion enolat sehingga bereaksi pada gugus karbonil senyawa 4-metoksibenzaldehid. Berdasarkan analisa menggunakan GCMS dan 1 H-NMR menunjukkan bahwa senyawa target adalah senyawa 1-(4-metoksifenil)-1-penten-3-on. Senyawa 1-(4-metoksifenil)-1-penten-3-on merupakan bentuk keton dari
etil ρ-metoksisinamat (EPMS) berupa kristal putih hingga kuning dengan titik leleh 53-60οC. Identifikasi senyawa menggunakan KLT dengan eluen heksan-etil asetat (4:1) menunjukkan nilai Rf 0,525. Identifikasi menggunakan GCMS menunjukkan waktu retensi 9,857 dan berat molekul 190 dengan fragmentasi masa pada 161, 133, 118, 103, 89 dan 76. Identifikasi menggunakan 1H-NMR menunjukkan sinyal CH2
pada 2,66 ppm yang membuktikan bahwa gugus ester telah berubah menjadi gugus keton.
Programme Study : Pharmacy
Title : Structure Modification of Ethyl ρ-methoxycinnamate Compound through Aldol Condensation Reaction with Methyl Ethyl Ketone.
Ethyl ρ-methoxycinnamate (EPMS) is a compound contained in kencur (Kaempferia galanga L) which has anti-inflammatory activity. EPMS ester group is less stable because it is easily hydrolyzed. The aims of this study were to structure modification of ethyl ρ-methoxycinnamate (EPMS) compound through aldol condensation reaction with methyl ethyl ketone. Ester groups on EPMS will be converted into a ketone group. Modifications EPMS through three processes, namely the process of hydrolysis using NaOH, the oxidation process using Ca(NO3)2 and aldol
condensation process using methyl ethyl ketone in the presence of NaOH in water. Carried out by stirring the reaction mixture at room temperature. Analysis of the molecular structure of the compound is determined based on the data of physics, GCMS, and 1H-NMR. EPMS hydrolysis produced acid ρ-methoxycinnamate (APMS) compound which are oxidized to produced 4-methoxybenzaldehide compound. This compound is reacted with methyl ethyl ketone through aldol condensation reaction. After reaction for 24 hours is obtained compound with a yield of 35.26%. Aldol condensation reaction using NaOH alkaline water that will change methyl ethyl ketone compounds into the enolate ion to react the carbonyl group in 4-methoxybenzaldehide compound. Based on an analysis using GCMS and 1H-NMR showed that the target compound is 1- (4-methoxyphenyl) -1-penten-3-on compound. The 1- (4-methoxyphenyl) -1-penten-3-one compound is a ketone form of ethyl ρ -methoxycinnamate (EPMS) in the form of white to yellow crystals with a melting point 53-60οC. The identification of compounds by TLC with eluent hexane-ethyl acetate (4: 1) showed Rf value of 0.525. Identification using GCMS showed a retention time of 9.857 and a molecular weight of 190 with fragmentation period at 161, 133, 118, 103, 89 and 76. Identification using 1H-NMR showed CH2 signal at
2.66 ppm that proves that the ester groups have been transformed into a ketone group.
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas pertolongan,
rahmat, dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul
“Modifikasi Struktur Etil ρ-metoksisinamat Melalui Reaksi Kondensasi Aldol dengan
Etil Metil Keton”. Shalawat dan salam senantiasa terlimpah kepada junjungan kita Nabi Muhammad SAW, teladan bagi umat manusia dalam menjalani kehidupan.
Skripsi ini disusun untuk memenuhi salah satu syarat menempuh ujian akhir
guna mendapatkan gelar Sarjana Farmasi Fakultas Kedokteran dan Ilmu Kesehatan
Universitas Islam Negeri Syarif Hidayatullah Jakarta. Dalam menyelesaikan masa
perkuliahan hingga penulisan skripsi ini penulis tentu menemukan berbagai kesulitan
dan halangan yang menyertai. Oleh karena itu, penulis tidak terlepas dari bantuan,
doa, dan bimbingan dari banyak pihak. Pada kesempatan ini penulis menyampaikan
ucapan terima kasih yang sebesar-besarnya kepada :
1. Bapak Dr. Arief Sumantri, SKM, M.Kes selaku Dekan Fakultas Kedokteran dan
Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
2. Ibu Ismiarni Komala, M.Sc., Ph.D., Apt sebagai Pembimbing I dan Ibu Ofa
Suzanti Betha, M.Si., Apt sebagai Pembimbing II yang telah memberikan ilmu,
nasihat, waktu, tenaga, dan pikiran selama masa perkuliahan hingga penelitian
dan penulisan skripsi.
3. Ibu Dr. Nurmeilis., M.Si., Apt selaku Ketua Program Studi Farmasi Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif
Hidayatullah Jakarta.
4. Prof. Dr. Atiek Soemiati M.Si., Apt selaku pembimbing akademik yang telah
memberikan bimbingan dan bantuan selama masa perkuliahan.
5. Bapak dan Ibu staf pengajar, serta karyawan yang telah memberikan arahan
selama masa perkuliahan.
6. Kedua orang tua tercinta, Bapak Drs. H. Munasir dan Ummi Hj. Masturoh yang
telah memberikan dukungan material, moral, nasihat-nasihat, serta doa yang
menyusun skripsi ini.
8. Teman-teman Kingdom : Owi, Beni, Gilman, Mutia, Noni, Atul, Nita, Elsa, Ani,
dan Windi yang telah memberikan doa, semangat, serta bantuan selama
penyusunan skripsi.
9. Teman-teman seperjuangan Echa, Tania dan Fika atas semangat dan
kebersamaan selama perkuliahan hingga saat ini.
10. Teman-teman Farmasi 2012 yang telah memberikan motivasi dan bantuan
selama masa perkuliahan dan penyusunan skripsi.
11. Kak Walid, Mba Rani, Ka Eris, Ka Yaenab, Ka Lisna, Ka Tiwi dan Ka Rahmadi
yang telah membantua selama melakukan penelitian.
12. Kepada semua pihak yang telah membantu penulis selama ini yang tidak dapat
disebutkan namanya satu persatu.
Semoga bantuan yang telah diberikan mendapat balasan dari Allah SWT.
Penulis menyadari bahwa penulisan skripsi ini masih jauh dari kesempurnaan. Oleh
karena itu, saran dan kritik yang bersifat membangun akan penulis nantikan. Akhir
kata, semoga skripsi ini dapat bermanfaat bagi pengembangan ilmu pengetahuan.
Ciputat, 18 Agustus 2016
HALAMAN JUDUL... ii
HALAMAN PERNYATAAN ORISINALITAS……….… iii
HALAMAN PERSETUJUAN PEMBIMBING... iv
HALAMAN PENGESAHAN……… v
ABSTRAK……….. vi
ABSTRACT………. vii
KATA PENGANTAR………... viii
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI……….. x
DAFTAR ISI... xi
2.3 Modifikasi Struktur EPMS... 7
2.4 Optimasi Reaksi Kimia... 8
2.5 Hidrolisis... 9
2.6 Oksidasi Alkena... 10
2.7 Kondensasi Aldol... 11
2.8 Natrium Hidroksida... 13
2.9 Kalsium Nitrat... 14
2.10Asam Asetat Glasial... 14
2.11Etil Metil Keton... 15
2.12Iradiasi Microwave... 16
2.12.1 Mekanisme Reaksi Secara Polarisasi Dipol... 17
2.12.2 Mekanisme Reaksi Secara Konduksi... 17
2.13Iidentifikasi... 17
2.13.1 Kromatografi... 17
a. Kromatografi Lapis Tipis... 18
b. Kromatografi Gas... 21
2.13.2 Spektrofotometri... 22
BAB 3 METODOLOGI PENELITIAN... 25
2.1 Tempat dan Waktu Penelitian... 25
3.1.1 Tempat... 25
3.1.2 Waktu... 25
3.2 Alat dan Bahan... 25
3.2.1 Alat... 25
3.2.2 Bahan... 25
3.3 Prosedur Penelitian... 26
3.3.1 Preparasi………..…... 26
3.3.3 Modifikasi Etil ρ-metoksisinamat ... 27
a. Proses Hidrolisis... 27
b. Proses Oksidasi... 27
c. Proses Kondensasi Aldol………...…. 27
3.3.4 Pemurnian dengan KLT Preparatif………...….. 28
3.3.5 Identifikasi Senyawa... 28
a. Identifikasi Organoleptis... 28
b. Pengukuran Rf... 28
c. Pengukuran Titik Leleh... 28
d. Identifikasi Senyawa Menggunakan GCMS... 28
e. Identifikasi Senyawa Menggunakan 1H-NMR…………... 28
BAB 4 HASIL DAN PEMBAHASAN………...….. 29
4.1 Hasil Isolasi Senyawa Etil ρ-metoksisinamat………....… 29
4.1.1 Hasil Determinasi………...…. 30
4.1.2 Pembuatan Serbuk Simplisia………... 30
4.1.3 Isolasi Etil ρ-metoksisinamat………...…... 30
4.1.4 Identifikasi Senyawa Etil ρ-metoksisinamat………... 31
4.2 Reaksi Hidrolisis Etil ρ-metoksisinamat……….. 32
4.2.1 Identifikasi Senyawa Hasil Hidrolisis EPMS..………... 34
4.3 Reaksi Oksidasi Asam ρ-metoksisinamat……….… 35
4.3.1 Identifikasi Senyawa Hasil Oksidasi APMS……….. 36
4.4 Reaksi Kondensasi Aldol 4-metoksibenzaldehid……….. 37
4.5 Identifikasi Senyawa Hasil Reaksi Kondensasi Aldol……….. 40
BAB 5 KESIMPULAN……….…. 45
5.1 Kesimpulan……….………… 45
5.2 Saran……….….…… 45
DAFTAR PUSTAKA... 46
Tabel 4.1 Data pergeseran kimia (δ) spektrum 1
Halaman
Gambar 2.1 Kandungan kimia rimpang kencur………... 5
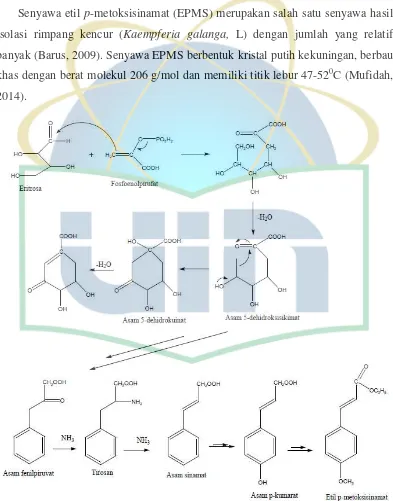
Gambar 2.2 Jalur asam sikhimat dalam biosintesa fenilpropanoid untuk menghasilkan etil p-metoksisinamat……….... 6
Gambar 2.3 Beberapa trasformasi gugus fungsi dari EPMS……….... 7
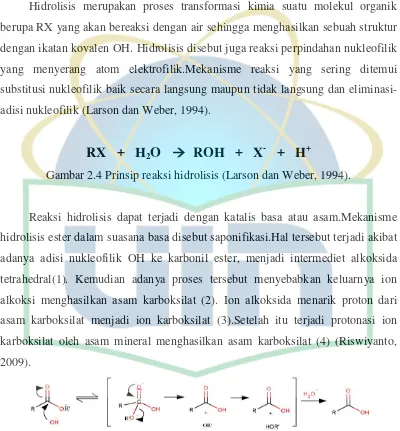
Gambar 2.4 Prinsip reaksi hidrolisis ………... 9
Gambar 2.5 Mekanisme hidrolisis ester dalam suasana basa ………….……... 9
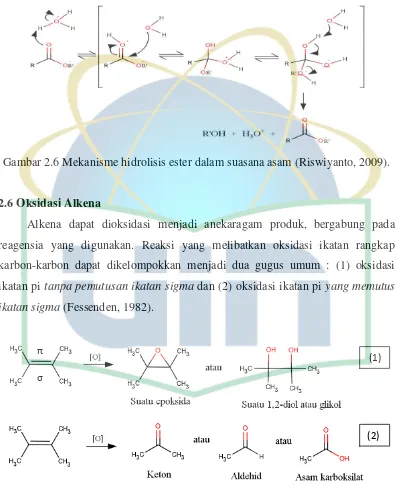
Gambar 2.6 Mekanisme hidrolisis ester dalam suasana asam……….… 10
Gambar 2.7 Reaksi oksidasi alkena ………... 10
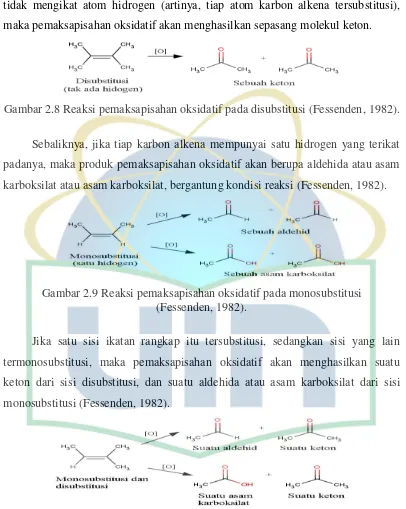
Gambar 2.8 Reaksi pemaksapisahan oksidatif pada disubstitusi ………...…… 11
Gambar 2.9 Reaksi pemaksapisahan oksidatif pada monosubstitusi …………. 11
Gambar 2.10 Reaksi pemaksapisahan oksidatif pada disubstitusi dan monosubstitusi………... 11
Gambar 2.11 Mekanisme reaksi kondensasi aldol………... 12
Gambar 2.12 Mekanisme dehidrasi aldol………. 13
Gambar 2.13 Struktur natrium hidroksida……… 14
Gambar 2.14 Struktur kalsium nitrat……… 14
Gambar 2.15 Struktur asam asetat………...……….……… 15
Gambar 2.16 Struktur etil metil keton……….. 15
Gambar 2.17 Skema kromatografi lapis tipis……….….. 20
Gambar 4.1 KLT uji pendahuluan oksidasi ……….. 29
Gambar 4.2 Simplisia kencur ……….………..…. 30
Gambar 4.3 KLT isolat kencur …….………... 31
Gambar 4.4 Kristal EPMS ………. 31
Gambar 4.5 Pola fragmentasi GCMS etil ρ-metoksisinamat ……….…... 32
Gambar 4.6 Mekanisme reaksi hidrolisis etil ρ-metoksisinamat …….………. 33
Gambar 4.7 KLT senyawa hasil hidrolisis ………. 33
Gambar 4.13 Pola fragmentasi GCMS 4-metoksibenzaldehid……… 37
Gambar 4.14 KLT optimasi reaksi kondensasi aldol……… 38
Gambar 4.15 KLT senyawa hasil kondensasi aldol……….. 39
Gambar 4.16 Senyawa hasil reaksi kondensasi aldol………..…. 39
Gambar 4.17 Mekanisme reaksi kondensasi aldol senyawa 4-metoksibenzaldehid dengan etil metil keton…………...…..….. 40
Gambar 4.18 KLT semua senyawa……….…. 41
Gambar 4.19 Pola fragmentasi GCMS 1-(4-metoksifenil)-1-penten-3-on……. 42
Lampiran 1. Kerangka Penelitian……….. 51
Lampiran 2. Isolasi Etil ρ-metoksisinamat……… 52
Lampiran 3. Determinasi Tanaman Kencur……….. 53
Lampiran 4. Spektrum GCMS Senyawa Etil ρ-metoksisinamat………... 54
Lampiran 5. Spektrum GCMS Senyawa Asam ρ-metoksisinamat……… 55
Lampiran 6. Spektrum GCMS Senyawa 4-metoksibenzaldehid………... 56
Lampiran 7. Spektrum GCMS Senyawa 1-(4-metoksifenil)-1-penten-3-on………. 57
Lampiran 8. Spektrum 1H-NMR Senyawa 1-(4-metoksifenil)-1-penten-3-on……….. 59
Lampiran 9. Spektrum GCMS Hasil Optimasi Reaksi Kondensasi Aldol……… 62
APMS : Asam ρ-metoksisinamat
EMK : Etil Metil Keton
EPMS : Etil ρ-metoksisinamat
g : Gram
GCMS : Gas Cromatography Mass Spectrometry
KLT : Kromatografi Lapis Tipis
mg : Mili gram
MS : Mass Spectrometry
NaOH : Natrium hidroksida
NMR : Nuclear Magnetic Resonance
1.1 Latar Belakang
Indonesia merupakan negara yang beriklim tropis dengan keanekaragaman
hayati terbesar kedua di dunia setelah Brazil. Indonesia memiliki sekitar
25.000-30.000 spesies tanaman yang merupakan 80% dari jenis tanaman di dunia dan 90%
dari jenis tanaman di Asia (Pramono E, 2002; Erdelen, 1999). Tanaman merupakan
bahan baku yang banyak digunakan sebagai obat herbal. Hal tersebut tentunya
menjadi potensi besar yang harus dikembangkan dan dimanfaatkan untuk menunjang
sektor kesehatan dalam rangka meningkatkan derajat kesehatan dan kesejahteraan
bangsa Indonesia (BPOM RI, 2014). Sekitar 9.600 spesies tanaman merupakan
tanaman yang memiliki khasiat sebagai obat dengan kurang lebih 300 spesies
tanaman telah digunakan sebagai bahan baku obat tradisional oleh industri di
Indonesia (Depkes RI, 2007).
Kencur (Kaempferia galanga L.) merupakan salah satu tanaman di Indonesia
yang berpotensi sebagai obat. Kencur termasuk ke dalam famili Zingiberaceae dan
merupakan tanaman asli India yang penyebarannya sudah memasuki kawasan Asia
Tenggara termasuk Indonesia. Kencur secara empiris telah dimanfaatkan dalam
mengobati berbagai penyakit seperti radang lambung, radang anak telinga, influenza
pada bayi, masuk angin, sakit kepala, batuk, memperlancar haid, mata pegal, keseleo,
diare, menghilangkan darah kotor dan mengusir lelah (Al-Fattah, 2011).
Sebelumnya telah dilaporkan penelitian mengenai aktivitas kencur, diantaranya
adalah aktivitas ekstrak minyak atsiri kencur sebagai antibakteri dan antifungi
(Tewtrakul et al., 2005), aktivitas ekstrak etanol kencur sebagai penyembuh luka
(Tara et al., 2006), ekstrak air dari kencur yang memiliki aktivitas sebagai
antinosiseptif dan antiinflamasi (Sulaiman et al., 2008), aktivitas kencur sebagai
antioksidan (Mekseepralard, 2010), aktivitas ekstrak etanol kencur sebagai analgesik
dan antiinflamasi (Vittalro et al., 2011) dan efek toksisitas ekstrak metanol kencur
Kandungan metabolit sekunder ekstrak kencur diantaranya adalah etil
p-metoksisinamat (80,05 %), beta-sitosterol (9,88%), asam propionat (4,71%),
pentadekan (2,08%), asam tridekanoat (1,81) dan 1,21-docosadiene (1,47%). Etil
p-metoksisinamat (EPMS) merupakan senyawa utama dalam kencur yang memiliki
aktivitas antiinflamasi melalui penghambatan COX-1 (42,9%) dan COX-2 (57,82%),
dengan masing-masing nilai IC501,12 μM dan 0,83 μM (Umar et al., 2012).
Efek terapi antiinflamasi non steroid (AINS) berhubungan dengan mekanisme
kerja penghambatan pada enzim siklooksigenase-1 (COX-1) yang dapat
menyebabkan efek samping pada saluran cerna dan penghambatan pada enzim
siklooksigenase-2 (COX-2) yang dapat menyebabkan efek samping pada sistem
kardiovaskular. Kedua enzim tersebut dibutuhkan dalam biosintesis prostaglandin
pada saat terjadi inflamasi (Lelo dan Hidayat, 2004). Oleh karena itu, pada dekade
terakhir ini desain dan sintesis obat antiinflamasi khususnya golongan AINS banyak
mengambil perhatian ahli kimia medisinal. Maka dilakukan banyak sekali modifikasi
pada AINS seperti memberikan elaborasi konjugat gugus tertentu sesuai tujuan
khusus (Qandil, 2012).
Senyawa etil p-metoksisinamat mudah diisolasi dan merupakan senyawa yang
sangat potensial sebagai bahan dasar sintesa karena mempunyai gugus fungsi reaktif
seperti ester dan olefin yang mudah ditransformasikan menjadi gugus fungsi yang
lain (Surbakti, 2008). Penelitian mengenai modifikasi etil p-metoksisinamat telah
banyak dilakukan diantaranya adalah modifikasi melalui reaksi hidrolisis, reaksi
transesterifikasi, dan reaksi degradasi sinamat (Mufidah, 2014), reaksi reduksi
(Qudsi, 2014), proses nitrasi (Indriyani, 2015; Aulia, 2015) dan reaksi amidasi (Reza,
2015). Namun belum dilakukan penelitian modifikasi etil p-metoksisinamat melalui
reaksi kondensasi aldol.
Kondensasi aldol merupakan reaksi suatu aldehid yang diolah dengan basa
seperti NaOH dalam air, sehingga membentuk ion enolat yang akan bereaksi dengan
suatu molekul aldehid lain atau keton dengan cara mengadisi pada karbon karbonil
(Fessenden, 1982). Pada penelitian ini akan dilakukan modifikasi etil p
reaksi kondensasi aldol. Gugus ester mudah terhidrolisis sehingga dapat merubah etil
p-metoksisinamat (EPMS) menjadi asam p-metoksisinamat (APMS). Perubahan
senyawa EPMS menjadi APMS dapat menghilangkan aktivitas antiinflamasi
(Mufidah, 2014). Pada kurkumin terdapat gugus diketon dan ikatan rangkap yang
berperan dalam aktivitas biologis sebagai antiinflamasi, antikanker dan antimutagenik
(Da’i, 2003).
Senyawa aldehid dalam reaksi kondensasi aldol ini diperoleh dengan terlebih
dahulu menghidrolisis etil p-metoksisinamat sehingga membentuk asam p
-metoksisinamat yang kemudian akan di oksidasi sehingga didapatkan senyawa
aldehid yaitu 4-metoksibenzaldehid. Berdasarkan hasil uji pendahuluan, etil p
-metoksisinamat bila langsung di oksidasi akan menghasilkan senyawa lain yang lebih
banyak dibandingkan dengan mengoksidasi asam p-metoksisinamat. Oleh karena itu,
etil p-metoksisinamat dihidrolisis terlebih dahulu menjadi asam p-metoksisinamat.
Senyawa 4-metoksibenzaldehid yang didapat akan direaksikan dengan etil metil
keton melalui reaksi kondensasi aldol dengan bantuan basa natrium hidroksida
(NaOH) dalam air. Reaksi kondensasi aldol dilakukan dengan menstirer campuran
pada suhu ruang.
1.2Rumusan Masalah
Apakah struktur etil p-metoksisinamat dapat dimodifikasi melalui reaksi
kondensasi aldol dengan etil metil keton ?
1.3Tujuan Penelitian
Melakukan modifikasi struktur etil p-metoksisinamat melalui reaksi kondensasi
aldol.
1.4Manfaat Penelitian
Memberikan data ilmiah tentang metode dan produk modifikasi struktur etil p
TINJAUAN PUSTAKA
2.1 Tumbuhan Kencur
Kencur (Kaempferia galanga L.) merupakan tanaman tropis yang banyak
tumbuh diberbagai daerah di Indonesia sebagai tanaman yang dipelihara (Barus,
2009). Tanaman ini diperkirakan berasal dari India (Rukmana, 1994). Terdapat
dua tipe pertumbuhan, yang pertama berdaun lebar dan terhampar diatas tanah dan
yang kedua berdaun sempit dan agak tegak. Bagian dari kencur yang digunakan
adalah rimpang (Depkes, 1989).
Tanaman kencur tidak berbatang, rimpang bercabang-cabang, akar-akar
berbentuk gelendong, kadang-kadang berumbi, panjang 1-1,5 cm. Berdaun
sebanyak 1-3 (umunya 2 helai), lebar merata, berbentuk jantung, ujung lancip,
bagian atas tidak berbulu, bagian bawah berbulu halus, pinggir bergelombang
berwarna merah kecoklatan, bagian tengah berwarna hijau, panjang helai daun
7-15 cm, lebar 2-8 cm, dan tangkai pendek. Panjang bunga 4 cm dan mengandung
4-12 bunga (Depkes, 1977).
Sub divisi : Angiospermae
Kelas : Monocotyledonae
yang sedikit terlindung. Di Indonesia, Kencur dapat tumbuh di Sumatra,
Jawa, Nusa tenggara, Sulawesi, Maluku, dan Irian (Depkes, 1977). Produksi,
mutu dan kandungan bahan aktif didalam rimpang kencur ditentukan oleh
varietas, cara budidaya dan lingkungan tempat tumbuhnya (Muhlisah, 1999).
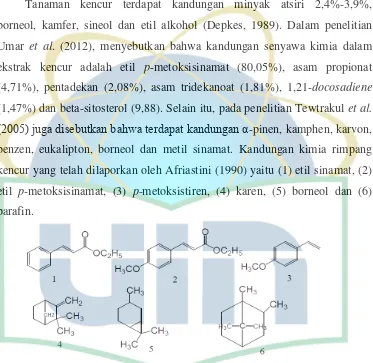
2.1.3. Kandungan Kimia
Tanaman kencur terdapat kandungan minyak atsiri 2,4%-3,9%,
borneol, kamfer, sineol dan etil alkohol (Depkes, 1989). Dalam penelitian
Umar et al. (2012), menyebutkan bahwa kandungan senyawa kimia dalam
ekstrak kencur adalah etil p-metoksisinamat (80,05%), asam propionat
(4,71%), pentadekan (2,08%), asam tridekanoat (1,81%), 1,21-docosadiene
(1,47%) dan beta-sitosterol (9,88). Selain itu, pada penelitian Tewtrakul et al.
(2005) juga disebutkan bahwa terdapat kandungan α-pinen, kamphen, karvon,
benzen, eukalipton, borneol dan metil sinamat. Kandungan kimia rimpang
kencur yang telah dilaporkan oleh Afriastini (1990) yaitu (1) etil sinamat, (2)
etil p-metoksisinamat, (3) p-metoksistiren, (4) karen, (5) borneol dan (6)
parafin.
Gambar 2.1. Kandungan kimia rimpang kencur (Afriastini, 1990).
2.1.4. Manfaat
Tanamana kencur banyak digunakan sebagai ramuan obat tradisional
dan sebagai bumbu masakan (Barus, 2009).Kencur dapat digunakan sebagai
obat batuk, obat gosok (sakit kulit) dan sakit perut (Depkes, 1989). Ekstrak
kencur banyak memiliki aktivitas diantaranya yaitu ekstrak alkohol sebagai
antiinflamasi dan analgesik (Vittalrao et al., 2011) serta sebagai penyembuh
(Sulaiman et al., 2008), ekstrak metanol sebagai repellent dan memiliki
toksisitas terhadap larva dan pupa Anopheles stephensi (Dhandapani et al.,
2011), dan ekstrak minyak atsiri kencur meiliki aktivitas antimikroba dan
antifungi (Tewtrakul et al., 2005).
2.2 Senyawa Etil p-metoksisinamat
Senyawa etil p-metoksisinamat (EPMS) merupakan salah satu senyawa hasil
isolasi rimpang kencur (Kaempferia galanga, L) dengan jumlah yang relatif
banyak (Barus, 2009). Senyawa EPMS berbentuk kristal putih kekuningan, berbau
khas dengan berat molekul 206 g/mol dan memiliki titik lebur 47-520C (Mufidah,
2014).
EPMS termasuk senyawa ester yang memiliki cincin benzena dan gugus
metoksi yang bersifat nonpolar serta gugus karbonil yang mengikat etil yang
bersifat sedikit polar sehingga dalam ekstraksinya dapat menggunakan pelarut
dengan variasi kepolaran. EPMS lebih larut dalam pelarut heksan karena terdapat
dua gugus yang mendukung sifat nonpolar sedangkan hanya satu gugus yang
mendukung sifat polar (Tufikhurohmah et al., 2008). Etil p-metoksisinamat
merupakan turunan asam sinamat sehingga biosintesanya melalui jalur biosintesis
asam sikhimat (Bangun, 2011).
2.3 Modifikasi Struktur EPMS
Senyawa etil p-metoksisinamat mudah diisolasi dan merupakan senyawa
yang sangat potensial sebagai bahan dasar sintesa karena mempunyai gugus
fungsi reaktif seperti ester dan olefin yang mudah ditransformasikan menjadi
gugus fungsi yang lain (Surbakti, 2008). Derivat EPMS memiliki aktivitas sebagai
tabir surya, antara lain Sorboil-2-merkaptoetil p-metoksisinamida dan
S-Crotonil-2-merkaptoetil p-metoksisinamamida (Hanson et al., 2006).
Gambar 2.3 Beberapa trasformasi gugus fungsi dari EPMS (Ekowati et al., 2009)
Perubahan gugus asam karboksilat APMS menjadi amida menunjukkan
aktivitas biologis berupa sedasi pada hewan coba mencit (Ekowati et al., 2009).
Perubahan ikatan rangkap vinilik pada APMS menjadi ikatan tunggal dengan
reaksi hidrogenasi, akan menurunkan aktivitas analgesik senyawa tersebut
(Ekowati et al., 2007). Beberapa penelitian telah dilakukan terkait modifikasi
struktur EPMS dengan substitusi gugus amina, diantaranya modifikasi struktur
dietanolamin (Bangun, 2011) dengan cara konvensional dan dengan iradiasi
microwave (Ferround et al., 2008; Khalafi et al., 2003).
2.4 Optimasi Reaksi Kimia
Menurut Kamus Besar Bahasa Indonesia, optimalisasi berasal dari kata
optimal yang berarti terbaik dan tertinggi (Depdikbud, 1995). Reaksi kimia
(chemical reaction) yaitu suatu proses dimana zat atau senyawa diubah menjadi
satu atau lebih senyawa baru (Chang, 2004). Laju (kecepatan) menyatakan sesuatu
yang terjadi persatuan waktu, misalnya perdetik, permenit, dan lain-lain.Yang
terjadi dalam reaksi kimia adalah perubahan jumlah pereaksi dan hasil
reaksi.(Petrucci, 1987). Kinetika kimia membahas tentang laju reaksi dan
mekanisme terjadinya reaksi. Mekanisme adalah serangkaian reaksi-reaksi
sederhana yang menerangkan reaksi keseluruhan. Untuk mengetahui mekanisme
suatu reaksi, dipelajari perubahan laju yang disebabkan oleh perbedaan
konsentrasi pereaksi, hasil reaksi dan katalis. Keterangan yang penting dapat pula
diperoleh dari studi tentang suhu, tekanan, pelarut, konsentrasi elektrolit atau
komposisi isotopik terhadap laju reaksi (Sukardjo, 1986).
Ada enam faktor yang memperngaruhi laju reaksi yaitu (Goldberg, 2002) :
1. Sifat alami reaktan. Sifat ini adalah sifat yang paling tidak dapat dikontrol
oleh ahli kimia.
2. Suhu. Secara umum, semakin tinggi suhu sistem, akan semakin cepat reaksi
kimia berlangsung.
3. Kehadiran katalis. Katalis adalah zat yang dapat mempercepat reaksi kimia
tanpa mengubah komposisinya.
4. Konsentrasi reaktan. Secara umum, semakin tinggi konsentrasi reaktan, akan
semakin cepat pula reaksinya.
5. Tekanan reaktan gas. Secara umum, semakin tinggi tekanannya, akan
semakin cepat reaksinya.
6. Wujud partikel molekul. Semakin kecil ukuran reaktan padat, semakin kecil
wujud partikel molekulnya dan akan semakin cepat reaksinya.
pH adalah suatu ukuran keasaman suatu air (larutan). Laju reaksi dalam
proses katalisis. Untuk mengetahui pengaruh pH maka faktor-faktor lainnya yang
berpengaruh seperti suhu, kekuatan ionik dan komposisi pelarut harus dibuat tetap
(Arisandi, 2008).
2.5 Hidrolisis
Hidrolisis merupakan proses transformasi kimia suatu molekul organik
berupa RX yang akan bereaksi dengan air sehingga menghasilkan sebuah struktur
dengan ikatan kovalen OH. Hidrolisis disebut juga reaksi perpindahan nukleofilik
yang menyerang atom elektrofilik.Mekanisme reaksi yang sering ditemui
substitusi nukleofilik baik secara langsung maupun tidak langsung dan
eliminasi-adisi nukleofilik (Larson dan Weber, 1994).
RX + H
2O
ROH + X
+ H
+Gambar 2.4 Prinsip reaksi hidrolisis (Larson dan Weber, 1994).
Reaksi hidrolisis dapat terjadi dengan katalis basa atau asam.Mekanisme
hidrolisis ester dalam suasana basa disebut saponifikasi.Hal tersebut terjadi akibat
adanya adisi nukleofilik OH ke karbonil ester, menjadi intermediet alkoksida
tetrahedral(1). Kemudian adanya proses tersebut menyebabkan keluarnya ion
alkoksi menghasilkan asam karboksilat (2). Ion alkoksida menarik proton dari
asam karboksilat menjadi ion karboksilat (3).Setelah itu terjadi protonasi ion
karboksilat oleh asam mineral menghasilkan asam karboksilat (4) (Riswiyanto,
2009).
Gambar 2.5 Mekanisme hidrolisis ester dalam suasana basa (Riswiyanto, 2009).
Mekanisme hidrolisis ester dalam suasana asam dapat dilakukan namun
tidak hanya menghasilkan asam karboksilat saja melainkan menghasilkan asam
karboksilat dan alkohol.Pada suasana asam, protonasi gugus karbonil terjadi untuk
intermediet tetrahedral (2). Hal tersebut menyebabkan terjadinya transfer proton
yang kemudian mengubah OR menjadi gugus pergi yang baik (3). Kemudian
terjadi pelepasan alcohol menghasilkan asam karboksilat dan katalis asam (4)
(Riswiyanto, 2009).
Gambar 2.6 Mekanisme hidrolisis ester dalam suasana asam (Riswiyanto, 2009).
2.6 Oksidasi Alkena
Alkena dapat dioksidasi menjadi anekaragam produk, bergabung pada
reagensia yang digunakan. Reaksi yang melibatkan oksidasi ikatan rangkap
karbon-karbon dapat dikelompokkan menjadi dua gugus umum : (1) oksidasi
ikatan pi tanpa pemutusan ikatan sigma dan (2) oksidasi ikatan pi yang memutus
ikatan sigma (Fessenden, 1982).
Gambar 2.7 Reaksi Oksidasi alkena (Fessenden, 1982).
Produk oksidasi dengan pemaksapisahan (cleavage) bergantung pada
kondisi oksidasi dan struktur alkena. Pertama-tama akan diperhatikan struktur
alkena. Wajah strutural alkena yang menentukan produk pemaksapisahan
(1)
(2) π
oksidatif ialah adanya atom hidrogen pada karbon sp2. Jika tiap karbon alkena
tidak mengikat atom hidrogen (artinya, tiap atom karbon alkena tersubstitusi),
maka pemaksapisahan oksidatif akan menghasilkan sepasang molekul keton.
Gambar 2.8 Reaksi pemaksapisahan oksidatif pada disubstitusi (Fessenden, 1982).
Sebaliknya, jika tiap karbon alkena mempunyai satu hidrogen yang terikat
padanya, maka produk pemaksapisahan oksidatif akan berupa aldehida atau asam
karboksilat atau asam karboksilat, bergantung kondisi reaksi (Fessenden, 1982).
Gambar 2.9 Reaksi pemaksapisahan oksidatif pada monosubstitusi (Fessenden, 1982).
Jika satu sisi ikatan rangkap itu tersubstitusi, sedangkan sisi yang lain
termonosubstitusi, maka pemaksapisahan oksidatif akan menghasilkan suatu
keton dari sisi disubstitusi, dan suatu aldehida atau asam karboksilat dari sisi
monosubstitusi (Fessenden, 1982).
Gambar 2.10 Reaksi pemaksapisahan oksidatif pada disubstitusi dan monosubstitusi (Fessenden, 1982).
2.7 Kondensasi Aldol
Bila suatu senyawa aldehida dioleh dengan basa seperti NaOH dalam air,
ion enolat yang terjadi dapat bereaksi pada gugus karbonil lain dari molekul
aldehida lain. Reaksi tersebut disebut reaksi kondensasi aldol.Kata “aldol” yang
diturunkan dari aldehida dan alcohol, memerikan produ itu, yang merupakan suatu
aldehida β-hidroksi.Suatu reaksi kondensasi ialah reaksi di mana dua molekul atau lebih bergabung menadi satu molekul yang lebih besar, dengan atau tanpa
hilangnya suatu molekul kecil (seperti air). Kondensasi aldol merupakan suatu
reaksi adisi di mana tidak dilepaskan suatu molekul kecil (Fessenden, 1982).
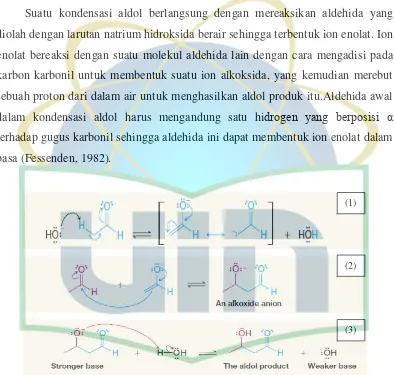
Suatu kondensasi aldol berlangsung dengan mereaksikan aldehida yang
diolah dengan larutan natrium hidroksida berair sehingga terbentuk ion enolat. Ion
enolat bereaksi dengan suatu molekul aldehida lain dengan cara mengadisi pada
karbon karbonil untuk membentuk suatu ion alkoksida, yang kemudian merebut
sebuah proton dari dalam air untuk menghasilkan aldol produk itu.Aldehida awal
dalam kondensasi aldol harus mengandung satu hidrogen yang berposisi α
terhadap gugus karbonil sehingga aldehida ini dapat membentuk ion enolat dalam
basa (Fessenden, 1982).
Gambar 2.11 Mekanisme reaksi kondensasi aldol (Solomons, 2013) Keterangan : (1) Pembentukan enolat, (2) Adisi enolat, dan (3) Protonasi
alkoksida
Suatu aldehida tanpa hidrogen α tidak dapat membentuk ion enolat dan
demikian tidak dapat berdimerisasi dalam suatu kondensasi aldol.Namun aldehida
tersebut dapat dicampur dengan aldehida yang memiliki hidrogen alfa, maka
kondensasi antara keduanya dapat terjadi.Reaksi ini disebut kondensasi aldol
(1)
(2)
silang (cross aldol condensation).Suatu kondensasi aldol silang juga dapat terjadi
antara aldol dengan keton (Fessenden, 1982).
Suatu senyawa karbonil β-hidroksi, seperti suatu aldol, mudah mengalami dehidrasi, karena ikatan rangkap dalam produk berkonjugasi dengan gugus
karbonilnya. Oleh karena itu, suatu aldehida α,β-tak jenuh dapat dengan mudah
diperoleh sebagai produk suatu kondensasi aldol. Bila dehidrasi menghasilkan
suatu ikatan rangkap yang berkonjugasi dengan suatu cincin aromatik, seringkali
dehidrasi itu berlangsung sertamerta (spontan), bahkan juga dalam larutan basa
(Fessenden, 1982).
Gambar 2.12 Mekanisme dehidrasi aldol (Solomons, 2013).
2.8 Natrium Hidroksida
Natrium hidroksida merupakan pellet, serpihan atau batang berwarna putih
atau praktis putih yang dapat melebur. Bila dibiarkan di udara, akan cepat
menyerap karbon dioksida dan lembab. Natrium hidroksida berupa massa keras,
rapuh dan menunjukkan pecahan hablur (Depkes RI, 1995). Natrium hidroksida
merupakan basa kuat sehingga biasa digunakan untuk membuat suasana basa
dalam suatu reaksi.Pada reaksi kondensasi aldol, natrium hidroksida digunakan
untuk membentuk ion enolat sehingga dapat berikatan dengan senyawa
elektrofilik (Fessenden, 1982).
Sifat-sifat natrium hidroksida adalah sebagai berikut (Depkes RI, 1995;
Gambar 2.13 Struktur natrium hidroksida (Pubchem).
2.9 Kalsium Nitrat
Kalsium nitrat disebut juga Norgessalpeter (Norwegia sendawa) merupakan
senyawa organikdengan rumus Ca(NO3)2. Senyawa ini tidak berwarna dan dapat
menyerap kelembaban dari udara dan biasanya ditemukan sebagai
tertrahidrat.Sifat-sifat dari kalsium nitrat adalah sebagai berikut (Pubchem) :
Rumus Kimia : Ca(NO3)2
Masa molar : 164,088 g/mol (anhidrat), 236,15 g/mol (tetrahidrat).
Penampilan : Kristal tidak berwarna sampai putih, padat, dan
higroskopis.
Masa jenis : 2,504 g/cm3 (anhidrat), 1,896 g/cm3 (tetrahidrat).
Titik lebur : 561οC (1042οF; 834οK) (anhidrat), 42,7 C (109οF; 316οK)
(tetrahidrat).
Kelarutan dalam air : anhidrat : 1212 g/L (20οC), 2710 g/L (40οC);
tetrahidrat: 1050 g/L (0οC), 1290 g/L (20οC), 3630 g/L
(100οC).
Kelarutan : larut dalam ammonia, hampir tidak larut dalam HNO3.
Kelarutan dalam etanol : 51,4 g/100 g (20οC); 62,9 g/100 g (40οC).
Kelarutan dalam aseton : 16,8 g/kg (20οC)
Keasaman (pKa) : 6
Gambar 2.14 Struktur kalsium nitrat (Pubchem).
2.10 Asam Asetat Glasial
Asam asetat glasial mengandung tidak kurang dari 99,5% dan tidak lebih
dari 100,5 % b/b C2H4O2. Asam asetat glasial merupakan cairan bening atau
dienceran dengan air. Asam asetat glasial mendidih pada suhu lebih kurang
118οC dan mempunyai bobot jenis lebih kurang 1,05 g/cm3 (Depkes RI,
1995).Asam asetat diproduksi untuk cuka konsumsi rumah tangga yang
mengandung 3-9% asam asetat glasial.Selain itu, asam asetat juga diproduksi
sebagai precursor untuk polivinil asetat dan selulosa asetat.Asam asetat pekat
(asam asetat glasial) bersifat korosif dan dapat menyerang kulit (Pubchem).
Sifat-sifat dari asam asetat adalah sebagai berikut (Depkes RI, 1995; Pubchem) :
Rumus molekul : C2H4O2
Nama lain : Asetil hidroksida (AcOH); asam metanakarboksilat.
Berat molekul : 60,05 g/mol.
Kelarutan : Dapat bercampur dengan air, etanol, da gliserol.
Suhu beku : Tidak lebih rendah dari 15,6οC.
Titik lebur : 289 sampai 290 K.
pKa : 4,76.
Gambar 2.15 Struktur asam asetat (Pubchem).
2.11 Etil Metil Keton
Etil metil keton (EMK) atau 2-butanon merupakan senyawa organik berupa
cairan bening, berbau tajam, berbau manis seperti butterscotch dan aseton. EMK
larut dalam air dan biasanya digunakan sebagai pelarut industri (Pubchem).
Sifat-sifat dari etil metil keton adalah sebagai berikut (Pubchem) :
Nama Lain :2-butanon, metilpropanon, metil asetoon.
Rumus kimia : C4H5O
Masa molar : 72,11 g/mol
Masa jenis : 0,8050 g/mL
Titik lebur : -86C (-123F; 187K).
Titik didih : 79,64C (175,35F; 352,79K).
Kelarutan dalam air : 27,5 g/100 mL.
2.12 Iradiasi Microwave
Gelombang mikro merupakan radiasi elektromagnetik yang terletak diantara
frekuensi radiasi inframerah dan radio, dengan panjang gelombang mulai dari 1
mm hingga 1 m, frekuensinya mulai dari 300 GHz hingga 300 MHz (Bogdal,
2005; Loupy, 2006). Ketika sebuah bahan logam dipaparkan radiasi microwave,
microwave akan secara luas menyebar pada permukaan, namun benda tersebut
tidak dipanaskan dengan menggunakan microwave melainkan karena adanya
respon dari medan magnet dari radiasi microwave yaitu elektron bergerak bebas
pada permukaan bahan, dan aliran electron tersebut dapat menghasilkan panas
(Bogdal, 2005).
Reaksi dengan menggunakan microwave dapat dikategorikan sebagai green
chemistry. Tujuan dari green chemistry adalah untuk mengurangi atau
meminimalkan penggunaan dari pelarut yang mudah menguap dalam sintesis
modern dan mengurangi penggunaan energi. Pengembangan dari metode sintesis
baru bebas pelarut dengan menggunakan bantuan microwave saat ini menjadi
topik penting dalam penelitian, karena reaksi bebas pelarut mengurangi
penggunaan pelarut, prosedur sintesis dan pemisahan yang lebih sederhana,
mencegah pemborosan dan menghindari resiko bahaya atau toksik terkait dengan
penggunaan pelarut (Loupy, 2006).
Semua peralatan standar (Oven domestik atau reactor lebih spesifik yang
didedikasikan untuk sintesis kimia) beroperasi pada frekuensi dari v = 2,45 GHz
(setara dengan ƛ = 12,2 cm) untuk mengurangi intervensi dari frekuensi radio dan
radar. Reaksi kimia dengan microwave didasarkan pada interaksi dari molekul
dengan gelombang oleh efek “microwave dielectric heating”. Fenomena ini
bergantung pada kemampuan suatu bahan untuk mengabsobsi radiasi microwave
dan mengubahnya menjadi panas. Komponen elektrik dari medan elektromagnetik
telah menunjukkan bahwa perannya sangat penting. Dalam hal tersebut, maka
reaksi yang terjadi melibatkan dua mekanisme yaitu polarisasi dipolar dan
konduksi ionik. Iradiasi dari senyawa polar pada frekuensi microwave
meghasilkan orientasi dari dipol atau ion pada medan listrik (Loupy, 2006).
Untuk produk cair (contohnya pelarut), hanya molekul polar yang secara
bereaksi (inert).Pada konteks dari absorbsi gelombang mikro, telah menunjukkan
bahwa titik didih lebih tinggi ditemukan ketika pelarut diberikan iradiasi
microwave daripada pemanasan biasa. Efek ini dikenal dengan “super heating
effect” yang telah ditujukan untuk penghambatan dari nukleasi dalam pemanasan
microwave (Loupy, 2006).
2.12.1 Mekanisme Reaksi Secara Polarisasi Dipolar
Prinsip dari mekanisme reaksi polarisasi dipolar adalah adanya interaksi
dipol-dipol antara molekul-molekul polar ketika di radiasi dengan microwave.
Molekul yang berinteraksi dipol tersebut sangat sensitif terhadap suatu medan
magnet yang berasal dari luar sehingga dapat mengakibatkan terjadinya rotasi
pada molekul tersebut sehingga menghasilkan sejumlah energi (Lidstrom et
al., 2001; Loupy, 2006).
2.12.2 Mekanisme Reaksi Secara Konduksi
Mekanisme secara konduksi dapat terjadi pada larutan-larutan yang
mengandung ion. Bila suatu larutan mengandung suatu partikel bermuatan
atau ion yang berikatan dengan suatu medan listrik maka ion-ion tersebut
akan bergerak. Pergerakan tersebut akan menyebabkan terjadinya
peningkatan kecepatan dari tumbukanantar molekul sehingga akan merubah
energi kinetik menjadi energi kalor (Kingson, 1988).
2.13 Identifikasi
2.13.1 Kromatografi
Kromatografi pertama kali dikembangkan oleh seorang ahli botani
Rusia Michael Tswett pada tahun 1903 untuk memisahkan pigmen berwarna
dalam tanaman dengan cara perkolasi ekstrak petroleum eter dalam kolom
gelas yang berisi kalsium karbonat (CaCO3) (Gandjar dan Rohman, 2007).
Kromatografi merupakan metode fisika untuk pemisahan
komponen-komponen dengan mendistribusikannya diantara dua fase, salah satunya
merupakan lapisan stasioner dengan permukaan yang luas dan fase lainnya
berupa zat alir (fluid) yang mengalir lambat (perkolasi) sepanjang lapisan
stasioner tersebut. Fase stasioner dapat berupa zat padat atau cairan dan fase
Kromatografi dapat dibedakan berdasarkan mekanisme pemisahannya
menjadi kromatografi adsorpsi, kromatografi partisi, kromatografi penukar
ion, kromatografi pasangan ion dan kromatografi eksklusi
ukuran.Berdasarkan pada alat yang digunakan, kromatografi dapat dibagi
menjadi kromatografi planar yaitu kromatografi kertas dan kromatografi lapis
tipis, kromatografi cair kinerja tinggi (KCKT) dan kromatografi gas (KG)
(Gandjar dan Rohman, 2007).Menurut Farmakope Indonesia, jenis-jenis
kromatografi tersebut dan kromatografi kolom bermanfaat dalam analisis
kualitatif dan kuantitatif yang digunakan dalam penetapan kadar dan
pengujian. Kromatografi kertas dan kromatografi lapis tipis umumnya lebih
bermanfaat untuk tujuan identifikas karena sederhana dan mudah.(Depkes,
1995).
a. Kromatografi Lapis Tipis
Kromatografi lapis tipis (KLT) dikembangkan oleh Izmailoff dan
Schraiber pada tahun1938 (Gandjar dan Rohman, 2007).Kromatografi lapis
tipis merupakan metode pemisahan fisikokimia.Lapisan yang memisahkan
terdiri atas bahan berbutir-butir (fase diam) yang ditempatkan pada
penyangga berupa pelat gelas atau lapisan yang cocok.Pelat fase diam
tersebut diletakkan di dalam bejana tertutup rapat yang berisi
larutanpengembang yang cocok (fase gerak) dan terjadi pemisahan dengan
caraperambatan kapiler (pengembangan).Selanjutnya senyawa yang tidak
berwarna harus ditampakkan (dideteksi) (Stahl Egon dalam Khoirunni’mah,
2013).
Fase diam yang digunakan dalam KLT merupakan penjerap kecil dan
seragam (uniform) dengan diameter partikel antara 10-30 um. Semakin kecil
ukuran dan semakin sempit kisaran ukuran fase diam, maka semakin baik
kinerja KLT dalam hal resolusi dan efisiensinya.Penjerap yang paling sering
digunakan adalah silika dan serbuk selulosa, sementara mekanisme sorpsi
yang utama pada KLT adalah partisi dan absorpsi.Fase gerak pada KLT dapat
dipilih dari pustaka, tetapi lebih sering dengan mencoba-coba karena waktu
yang diperlukan hanya sebentar.Sistem yang paling sederhana adalah
tersebut mudah diatur sehingga pemisahan dapat terjadi secara optimal
(Gandjar dan Rohman, 2007).
Pemilihan dan pengoptimasian fase gerak harus memperhatihan hal
sebagai berikut :
1) KLT merupakan teknik yang sensitif sehingga fase gerak yang digunakan
harus memiliki kemurnian yang sangat tinggi.
2) Daya elusi fase gerak harus diatur untuk memaksimalkan pemisahan
dimana harga Rf terletak antara 0,2-0,8.
3) Untuk pemisahan dengan menggunakan fase diam yang bersifat polar
seperti silika gel, polaritas fase gerak akan menentukan kecepatan migrasi
solut sehingga dapat menentukan nilai Rf. Penambahan pelarut yang
bersifat sedikit polar seperti dietil eter ke dalam pelarut non polar seperti
metil benzena akan meningkatkan harga Rf secara signifikan.
4) Solut-solut ionik dan polar lebih baik digunakan campuran pelarut sebagai
fase geraknya, seperti campuran air dan metanol dengan perbandingan
tertentu. Penambahan sedikit asam etanoat akan membuat solut bersifat
asam, sedangkan penambahan dengan ammonium akan membuat solut
besifat basa (Gandjar dan Rohman, 2007).
Penotolan larutan uji dan larutan baku berdasarkan cara yang tertera
pada masing-masing monografi dengan jarak antara lebih kurang 1,5 cm dan
lebih kurang 2 cm dari tepi bawah lalu lempeng dibiarkan hingga mengering.
Ketika bekerja dengan lempeng harus menghindarkan zat penjerap dari
gangguan fisik.Pada jarak 10 cm hingga 15 cm diatas titik penotolandiberi
tanda.Lempeng ditempatkan pada rak penyangga hingga tempat penotolan
terletak disebelah bawah lalu rak dimasukkan ke dalam bejana kromatografi
(Depkes, 1995).Bejana kromatografi sebelumnya dijenuhkan dengan uap fase
gerak dan tepi bagian bawah pelat yang telah ditotoli sampel dicelupkan
kedalam fase gerak kurang lebih 0,5-1 cm. Tinggi fase gerak harus dibawah
pelat yang telah berisi totolan sampel (Gandjar dan Rohman, 2007).
Bejana di tutup hingga rapat dan dibiarkan hingga fase gerak merambat
10 cm hingga 15 cm di atas titik penotolan, umumnya diperlukan waktu lebih
tanda batas rambat pelarut. Lempeng dikeringkan di udara dan bercak
mula-mula diamati dengan cahaya ultraviolet gelombang pendek (254 nm) dan
kemudian dengan cahaya ultraviolet gelombang panjang (366 nm). Dilakukan
pengukuran jarak tiap bercak dari titik penotolan serta dicatat panjang
gelombang untuk tiap bercak yang diamati. Harga Rf bercak ditentukan
laludibandingkan antara kromatogram larutan uji dengan larutan baku
(Depkes, 1995).
Gambar 2.17 Skema kromatografi lapis tipis
Pendeteksian bercak-bercak yang umumnya tidak berwarna dapat
dilakukan dengan pendeteksian secara kimia, fisika, maupun biologi. Cara
kimia dilakukan dengan mereaksikan bercak dengan suatu pereaksi melalui
cara penyemprotan sehingga bercak menjadi jelas. Cara fisika digunakan
dengan pencacahan radioaktif dan fluoresensi sinar ultra violet (Gandjar dan
Rohman, 2007).
Mengidentifikasi bercak sangat lazim mengunakan harga Rf
(Retordation Factor). Harga Rf mulai dari 0 sampai 1. Faktor-faktor yang
mempengaruhi nilai Rf diantaranya struktur kimia dari senyawa yang sedang
dipisahkan, tebal dan kerataan dari lapisan penjerap, sifat penjerap, teknik
percobaan, pelarut dan derajat kemurniannya, derajat kejenuhan uap
pengembang dalam bejana, jumlah cuplikan yang digunakan, kesetimbangan
dan suhu (Sastrohamidjojo, 1985).
Kromatografi lapis tipis telah luas dipergunakan dan merupakan cara
pemisahan yang baik, khususnya untuk kegunaan analisis kualitatif.
Kromatografi lapis tipis dapat digunakan untuk memisahkan berbagai
terdapat di alam maupun sintetik dan kompleks senyawa-senyawa organik
dengan anorganik (Adnan, 1997).Kromatografi lapis tipis juga telah banyak
digunakan untuk analisis obat di laboratorium farmasi (Stahl Egon dalam
Khoirunni’mah, 2013).
Kromatografi lapis tipismempunyai kelebihan dibandingkan dengan
kromatografi kertas yaitu pengerjaannya lebih cepat, hasil pemisahannya
lebih sempurnadan kepekaannya lebih tinggi (Adnan, 1997).Kromatografi
lapis tipis hanya membutuhkan perlengkapan yang sedikit dan waktu analisis
yang singkat (15-60 menit), memerlukan jumlah cuplikan yang sangat sedikit
(kira-kira 0,1 g). Selain itu, hasil palsu yang disebabkan oleh komponen
sekunder tidak mungkin terjadi, kebutuhan ruangan minimum dan
penanganannya sederhana (Stahl Egon dalam Khoirunni’mah, 2013).
b. Kromatografi Gas
Kromatografi gas (KG) yang dikenalkan pertama kali pada tahun
1950-an merupak1950-an suatu teknik instrumental deng1950-an metode y1950-ang dinamis untuk
pemisahan dan deteksi senyawa-senyawa organik yang mudah menguap dan
senyawa-senyawa gas anorganik dalam suatu campuran. Kromatografi gas
digunakan untuk analisis sampel-sampel padat, cair, dan gas.Sampel padat
dapat diekstraksi atau dilarutkan dalam suatu pelarut sehingga dapat
diinjeksikan ke dalam sistem KG, sedangkan sampel gas dapat lagsung
diambil dengan penyuntik (syringe) yang ketat terhadap gas.Ruang suntik
sampel biasanya berupa lubang yang ditutupi dengan septum atau pemisah
karet. Suhu ruang suntik biasanya 10-150C lebih tinggi dari suhu kolom
maksimum sehingga seluruh sampel akan segera menguap setelah
disuntikkan (Gandjar dan Rohman, 2007).
Fase gerak pada KG disebut juga gas pembawa karena digunakan hanya
untuk membawa solut ke kolom dan tidak mempengaruhi selektifitas. Gas
pembawa biasanya mengandung helium, nitrogen, hidrogen, atau campuran
argon dan metana.Helium merupakan gas pembawa yang sering digunakan
karena memberikan efisiensi kromatografi yang lebih baik (mengurangi
pelebaran pita).Proses pemisahan terjadi pada kolom dimana terdapat fase
column) dan kolom kapiler (capillary column).Kolom kapiler lebih kecil
dibanding kolom kemas.Semakin sempit diameter kolom, maka efisiensi
pemisahan kolom semakin besar atau puncak kromatogram yang dihasilkan
semakin tajam (Gandjar dan Rohman, 2007).
Prinsip KG yaitu solut-solut yang mudah menguap (dan stabil terhadap
panas) akanbermigrasi melalui kolom yang mengandung fase diam dengan
suau kecepatan yang tergantung pada rasio distribusinya. Pada umumnya
solut akan terelusi berdasarkan pada peningkatan titik didihnya, kecuali jika
ada interaksi khusus antara solut dengan fase diam. Pemisahan pada
kromatografi gas didasarkan pada titik didih suatu senyawa dikurangi dengan
semua interaksi yang mungkin terjadi antara solut dengan fase diam. Fase
gerak yang berupa gas akan mengelusi solut dari ujung kolom lalu
menghantarkannya ke detektor. Penggunaan suhu yang meningkat (biasanya
kisaran 50-3500C) bertujuan untuk menjamin bahwa solut akan menguap dan
karenanya akan cepat terelusi.Kromatogram hasil pemisahan fisik
komponen-komponen oleh KG disajikan oleh detektor sebagai deretan luas puncak
terhadap waktu.Waktu dalam kromatogram dapat digunakan sebagai data
kualitatif, sedangkan luas puncak dipakai sebagai data kuantitatif (Gandjar
dan Rohman, 2007).
Beberapa kelebihan kromatografi gas diantaranya pada penggunaan
kolom yang lebih panjang dapat menghasilkan efisiensi pemisahan yang
tinggi.Fase gas dibandingkan fase cair tidak bersifat reaktif terhadap fase
diam dan zat-zat terlarut.Gas dan uap mempunyai viskositas yang rendah,
serta kesetimbangan partisi antara gas dan cairan berlangsung cepat, sehingga
sensitivitasnya tinggi dan analisis relatif cepat.Adapun kelemahannya yaitu
terbatas hanya untuk zat-zat yang mudah menguap (Khopkar, 2003).
2.13.2 Spektrofotometri
Spektrofotometri merupakan pengukuran suatu interaksi antara reaksi
radiasi elektromagnetik dan molekul atau atom dari suatu zat kimia (Depkes,
1995). Spektrofotometri terdiri atas spektrometer dan fotometer.
Spektrofotometermenghasilkan sinar dari spektrum dengan panjang
yang ditranmisikan atau yang diabsorpsi.Spektrofotometer tersusun atas
sumber spektrum yang kontinyu, monokromator, selpengabsorpsi untuk
larutan sampel atau blangko dan suatu alat untuk mengukur pebedaanabsorpsi
antara sampel dan blangko ataupun pembanding (Khopkar, 1990).
Komponen-komponen pada instrumen spektrofotometri meliputi
(Khopkar, 1990):
1. Sumber radiasi. Sumber tenaga radiasi harusstabil. Sumber yang biasa
digunakan adalah lampuwolfram.
2. Monokromator. Digunakan untuk memperoleh sumber sinar yang
monokromatis.
3. Sel absorpsi. Pada pengukuran di daerah visibel menggunakan kuvet kaca
atau kuvetkaca corex, tetapi untuk pengukuran pada UV menggunakan sel
kuarsa karena gelastidak tembus cahaya pada daerah ini.
4. Detektor. Detektor radiasi dihubungkan dengan sistem meter atau pencatat.
Peranandetektor untuk memberikan respon terhadap cahaya pada berbagai
panjanggelombang.
Spektrofotometri yang sering digunakan dalam analisis famasi meliputi
spektrofotometri serapan ultra violet (UV), cahaya tampak (Visibel),
inframerah (IR) dan serapan atom (AAS) (Depkes, 1995).
a. Spektrofotometri Resonansi Magnetik
Spektrum resonansi magnetik nuklir (NMR) melengkapi spektrum
infamerah yang hanya dapat memberikan gambaran mengenai gugus fungsi
tetapi hanya sedikit memberi informasi mengenai atom-atom hidrogen dalam
sebuah molekul organic (Fessenden, 1986). Kombinasi IR dan data NMR
seringkali cukup untuk menentukan secara benar struktur molekul yang tidak
diketahui (Pavia et al., 2008).
Spektroskopi NMR didasarkan pada penyerapan gelombang radio oleh
inti-inti tertentu dalam molekul organik yang berada dalam medan magnet
yang kuat (Fessenden, 1986). Radiasi pada daerah frekuensi radio digunakan
untuk mengeksitasi atom-atom, biasanya proton-proton atau atom-atom
karbon-13, sehingga spinnya berubah dari sejajar menjadi sejajar melawan
eksitasi dan pola-pola pembagian kompleks yang dihasilkan sangat khas pada
struktur kimia molekul tersebut (Watson, 2009). NMR dapat menentukan
jumlah masing-masing jenis yang berbeda dari inti hidrogen serta
memperoleh informasi mengenai sifat dasar dari lingkungan terdekat dari
masing-masing jenis. Informasi yang sama dapat ditentukan untuk inti karbon
(Pavia et al., 2008).
Spektrum NMR biasanya ditentukan dari larutan substansi yang
dianalisis, oleh karena itu pelarut yang digunakan tidak boleh mengandung
atom hidrogen karena akan mengganggu puncak spektrum. Pelarut yang
dapat digunakan seperti tetraklormetana (CCl4) yang tidak mengandung
hidrogen atau pelarut yang atom hidrogennya telah diganti menjadi isotopnya
yaitu deuterium seperti CDCl3. Atom-atom deuterium mempunyai sifat
magnetik yang sedikit berbeda dengan hidrogen sehingga menghasilkan
puncak pada area spektrum yang berbeda (Sudjadi, 1983).
Instrument NMR terdiri atas komponen-komponen sebagai berikut
(Willard et al., 1988) :
1. Magnet untuk memisahkan energi spin nuklir.
2. Paling tidak terdapat dua saluran frekuensi radio, satu untuk stabilisasi
medan atau frekuensi dan satu untuk memberikan frekuensi radio untuk
energi penyinaran. Yang ketiga dapat digunakan untuk masing-masing inti
yang akan dipisahkan.
3. Probe sampel yang mengandung kumparan untuk kopling sampel dengan
bidang frekuensi radio.
4. Detektor untuk memproses sinyal NMR.
5. Generator (Sweep Generator) untuk menyapu bersih baik medan magnet
amupun frekuensi radio melalui frekuensi resonansi sampel.
3.1 Tempat dan Waktu Penelitian
3.1.1 Tempat
Penelitian modifikasi struktur etil p-metoksisinamat melalui reaksi
kondensasi aldol dengan etil metil keton dilaksanakan di Laboratorium Penelitian
I, Laboratorium Farmakognosi dan Fitokimia, Laboratorium Kimia Obat, dan
Laboratorium Analisa Obat dan Pangan Halal, Program Studi Farmasi, Fakultas
Kedokteran dan Ilmu Kesehatan.
3.1.2 Waktu
Penelitian ini dilaksanakan pada bulan November 2015 sampai dengan Juli 2016.
3.2 Alat dan Bahan
3.2.1 Alat
Spektrofotometri 1H-NMR (500 MHz, JEOL), vaccum rotary evaporator
(SB-1000 Eyela), digital water bath (SB-100 Eyela), GCMS (AGILENT
TECHNOLOGIES), microwave, lemari pendingin, plat alumunium TLC silica
gel 60 F254 (Merck), melting point SMP10, oven, timbangan analitik, statif, labu
reaksi, corong, corong pisah, hotplate, erlenmeyer, rak, tabung reaksi, chamber
KLT, plat kaca, termometer, pipet eppendorf, mikropipet, batang pengaduk,
pinset, kertas saring, kapas, aluminuim foil, vial uji, botol, pH meter, labu ukur,
gelas ukur, gelas piala, dan magnetik stirrer.
3.2.2 Bahan
Senyawa etil p-metoksisinamat hasil isolasi dari kencur (Kaempferia
galanga L.), etil metil keton (Merck), natrium hidroksida (NaOH) (Merck),
kalsium nitrat (Ca(NO3)2) tetrahidrat (Merck), silica gel 60 GF254 (Merck), asam
asetat glasial (Merck), methanol gradient grade for LC (Merck), asam klorida
3.3 Prosedur Penelitian
3.3.1 Preparasi
a. Pengambilan Sampel
Rimpang kencur (Kaemferia galanga L,) diperoleh dari kebun Balitro
(Balai Penelitian Tanaman Rempah dan Obat) di wilayah Sukabumi, Jawa Barat
pada bulan November 2015.
b. Determinasi Tumbuhan
Determinasi tumbuhan kencur (Kaempferia galanga L.) dilakukan di
Herbarium Bogoriense Bidang Botani, Puslit Biologi, LIPI Cibinong.
c. Penyiapan Bahan untuk Ekstraksi
Sebanyak 55 kg kencur dibersihkan, dicuci dengan air mengalir, lalu
dirajang sekitar 2-3 mm. Kencur dijemur selama 5-6 hari tanpa terkena sinar
matahari. Setelah kering, kencur dihaluskan menggunakan blender (Barus, 2009).
d. Pembutan Plat KLT Preparatif
Sebanyak 5 gram silika gel 60 GF254 ditambakan 11 ml aquades di dalam
erlenmeyer lalu kocok dengan kuat hingga tercampur sempurna. Tuangkan bubur
silika gel ke atas plat kaca dengan ukuran 10 cm x 10 cm. Keringkan plat KLT
preparatif pada suhu ruang selama 2 jam lalu aktivasi dalam oven pada suhu
120οC selama 1 jam (Merck).
3.3.2 Isolasi Etil p-metoksisinamat (Mufidah, 2014)
Serbuk simplisia kencur dimaserasi dengan menggunakan pelarut n-heksan
yang telah didestilasi dengan waktu perendaman 5 hari sambil sesekali dilakukan
pengocokan. Setelah 5 hari disaring sehingga diperoleh ampas dan filtrat. Ampas
dilakukan maserasi ulang sebanyak 4 kali hingga hasil maserasi menunjukkan
warna hampir jernih. Seluruh filtrat hasil maserasi dipekatkan dengan
menggunakan vacuum rotary evaporator. Filtrat pekat didiamkan pada suhu
kamar sampai terbentuk kristal. Kristal yang diperoleh dimurnikan dengan
menggunakan n-heksan dan direkristalisasi dengan cara melarutkan kristal dalam
sehingga terbentuk kristal kembali. Kristal dipisahkan dengan penyaringan dan
dihitung rendemennya.
3.3.3 Modifikasi Etil p-metoksisinamat
a. Proses Hidrolisis
Sebanyak 3 gram NaOH (0,075 mmol) dilarutkan dengan etanol pro
analisis dalam erlenmeyer dengan bantuan stirrer. Tambahkan senyawa etil p
-metoksisinamat sebanyak 10 gram (0,0484 mmol) dan reaksi dijaga pada suhu
60οC di atas hotplate selama 5 jam. Hasil reaksi dilarutkan dengan aquades,
kemudian ditambahkan HCl 15 % untuk membentuk endapan APMS hingga
tidak ada lagi endapan putih yang terbentuk atau pH mencapai 4. Endapan yang
didapat disaring dengan menggunakan kertas saring dan dikeringkan pada suhu
ruang (Aulia, 2015).
b. Proses Oksidasi
Sebanyak 4 gram APMS (0,0224 mmol) ditambahkan 10 gram Ca(NO3)2
(0,0423 mmol) dan 20 ml asam asetat glasial (0,3497 mmol). Campuran reaksi
tersebut di iradiasi menggunakan microwave pada 300 watt selama 2 menit. Hasil
reaksi segera ditambahkan dengan aquadest dingin lalu dinginkan di dalam
kulkas. Hasil reaksi di ekstraksi dengan heksan lalu dipekatkan menggunakan
vacuum rotary evaporator (Komala, 2014).
c. Proses Kondensasi Aldol
Sebanyak 206,2 mg NaOH dilarutkan dengan 1 mL aquadest dalam
erlenmeyer dengan bantuan stirrer. Tambahkan campuran 468,8 mg p
-metoksibenzaldehid (3,447 mmol) dengan 4,16 ml etil metil keton (46,5345
mmol) (1 : 13,5). secara perlahan lalu stirer selama 24 jam pada suhu ruang.
Reaksi di cek menggunakan KLT dan GCMS. Hasil reaksi di partisi dengan
aquades-etil asetat. Lapisan etil asetat kemudian dipekatkan dengan vacuum
3.3.4 Pemurnian dengan KLT Preparatif
Beri batas 1 cm pada bawah dan atas KLT perapatif. Totolkan hasil reaksi
kondensasi aldol sepanjang batas bawah plat KLT preparatif dan biarkan hingga
kering. Masukkan plat KLT preparatif ke dalam gelas beaker yang telah
dijenuhkan dengan eluen heksan-etil asetat (4:1) lalu elusi hingga mencapai batas
atas. Periksa dan tandai spot dibawah UV 254 nm dan 365 nm. Spot yang
terbentuk di kikis lalu di ekstraksi dengan etil asetat dan dibiarkan pada suhu
ruang hingga membentuk kristal. Kristal yang terbentuk direkristalisasi dengan
menggunakan metanol.
3.3.5 Identifikasi Senyawa
a. Identifikasi Organoleptis
Senyawa yang didapat dari hasil modifikasi diidentifikasi warna, bentuk
dan bau.
b. Pengukuran Rf
EPMS dan semua senyawa hasil modifikasi di KLT dengan menggunakan
eluen heksan-etil asetat (4:1).
c. Pengukuran Titik Leleh
Senyawa yang didapat dari hasil modifikasi diidentifikasi titik lelehnya
menggunakan alat melting point SMP10.
d. Identifikasi Senyawa Menggunakan GCMS
Kolom yang digunakan adalah HP-5MS (30 m x 0,25 mm ID x 0,25 um),
suhu awal 700C selama 2 menit, dinaikkan ke suhu 2850C dengan kecepatan
200C/min selama 20 menit. Suhu MSD 2850C. Kecepatan aliran 1,2 mL/min
dengan split 1:100. Parameter scanning dilakukan dari massa paling rendah yakni
35 sampai paling tinggi 550 (Umar et al., 2012).
e. Identifikasi Senyawa Menggunakan 1H-NMR
Sedikit sampel padat (kira-kira 10 mg) dilarutkan dalam pelarut kloroform
bebas proton (khusus NMR), kemudian dimasukkan ke dalam tabung khusus
Pada penelitian ini dilakukan modifikasi senyawa etil ρ-metoksisinamat yang diisolasi dari tanaman kencur melalui reaksi kondensasi aldol sehingga merubah
gugus ester menjadi gugus keton. Senyawa etil ρ-metoksisinamat terlebih dahulu di
ubah menjadi asam ρ-metoksisinamat melalui reaksi hidrolisis. Senyawa asam ρ
-metoksisinamat yang telah didapat kemudian di oksidasi sehingga diperoleh senyawa
aldehid yang direaksikan dengan etil metil keton melalui reaksi kondensasi aldol
dengan adanya basa NaOH dalam air.
Pada percobaan pendahuluan, reaksi oksidasi langsung pada etil ρ
-metoksisinamat (EPMS) dapat menghasilkan senyawa aldehid dan beberapa senyawa
lain. Pada saat EPMS diubah terlebih dahulu menjadi asam ρ-metoksisinamat
(APMS) melalui reaksi hidrolisis maka didapatkan senyawa aldehid dan senyawa lain
yang lebih sedikit (gambar 4.1).
Gambar 4.1 KLT uji pendahuluan oksidasi dengan eluen heksan-etil asetat (4:1)
(visualisasi UV ƛ 254 nm). Keterangan : (1) reaksi oksidasi EPMS, (2) reaksi oksidasi
APMS, (3) APMS, dan (4) EPMS
4.1 Hasil Isolasi Senyawa Etil ρ-metoksisinamat
Proses isolasi senyawa EPMS dimulai dari determinasi, pembuatan serbuk
simplisia rimpang kencur segar, isolasi dan rekristalisasi EPMS, serta identifikasi
EPMS.
1 2 3 4
4.1.1 Hasil Determinasi
Pada penelitian ini dilakukan determinasi untuk memastikan kebenaran
tumbuhan yang digunakan. Determinasi dilakukan di Herbarium Bogoriense,
Pusat Penelitian Biologi LIPI, Bogor, Jawa Barat. Hasil determinasi
menunjukkan bahwa sampel merupakan spesies Kaempferia galanga L
(Lampiran 3).
4.1.2 Pembuatan Serbuk Simplisia Rimpang Kencur Segar (RKS)
Sebanyak 55 kg RKS digunakan dalam penelitian ini. Setelah melalui
proses pembuatan simplisia, diperoleh serbuk simplisia kencur sebanyak 7 kg.
Simplisia kencur yang didapatkan berwarna kecoklatan (gambar 4.2).
Gambar 4.2 Simplisia kencur
4.1.3 Isolasi Etil ρ-metoksisinamat
Simplisia RKS yang didapat diekstraksi dengan cara maserasi
menggunakan pelarut heksan. Hasil maserasi diperoleh filtrat yang dapat
mengkristal pada suhu ruang sehingga memudahkan dalam isolasi. Kristal yang
diperoleh direkristalisasi dengan heksan dan metanol sehingga didapatkan kristal
yang berwarna putih kekuningan (gambar 4.4).
Persen rendemen kristal EPMS yaitu :
Gambar 4.3 KLT isolat kencur dengan eluen heksan-etil asetat (4:1)
(visualisasi UV ƛ 254 nm)
Gambar 4.4 Kristal EPMS
4.1.4 Identifikasi Senyawa Etil ρ-metoksisinamat
Senyawa EPMS dilakukan identifikasi organoleptis, pengukuran titik leleh,
dan identifikasi menggunakan GCMS.
a. Identifikasi Organoleptis Senyawa Etil ρ-metoksisinamat
Senyawa etil ρ-metoksisinamat memiliki karakteristik sebagai berikut:
Warna : putih kekuningan
Bau : khas
Bentuk : kristal
b. Pengukuran Titik Leleh Senyawa Etil ρ-metoksisinamat
Pengukuran titik leleh menggunakan alat melting point didapatkan rentang