SINTESIS DAN KARAKTERISASI PENYERAP GAS CO2 BERBASIS BENTONIT
BERSINERGI DENGAN LARUTAN BASA
SKRIPSI
Diajukan untuk Memenuhi Sebagian dari Syarat untuk Memperoleh Gelar Sarjana Sains
Jurusan Pandidikan Kimia
Oleh
SYAMSUL RIZAL MUHARAM 0807633
PROGRAM STUDI KIMIA JURUSAN PENDIDIKAN KIMIA
SINTESIS DAN KARAKTERISASI PENYERAP
GAS CO
2
BERBASIS BENTONIT
BERSINERGI DENGAN LARUTAN BASA
Oleh
Syamsul Rizal Muharam
Sebuah skripsi yang diajukan untuk memenuhi salah satu syarat memperoleh gelar Sarjana pada Fakultas Pendidikan Matematika dan Ilmu Pengetahuan Alam
© Syamsul Rizal Muharam 2013
Universitas Pendidikan Indonesia
Februari 2013
Hak Cipta dilindungi undang-undang.
LEMBAR PENGESAHAN
SINTESIS DAN KARAKTERISASI PENYERAP GAS CO2 BERBASIS BENTONIT
BERSINERGI DENGAN LARUTAN BASA
Diajukan oleh : Syamsul Rizal Muharam
0807633
DISETUJUI DAN DISAHKAN OLEH PEMBIMBING : Pembimbing I
Drs. Ali Kusrijadi, M.Si. NIP. 196706291992031001
Pembimbing II
Dr. Anggoro Tri Mursito, M.Sc. NIP. 197702222000121001
Mengetahui,
Ketua Jurusan Pendidikan Kimia FPMIPA UPI
SINTESIS DAN KARAKTERISASI PENYERAP GAS CO
2BERBASIS
BENTONIT BERSINERGI DENGAN LARUTAN BASA
ABSTRAK
Fenomena efek gas rumah kaca (GRK) yang disebabkan oleh gas CO2 akhir-akhir ini menjadi
masalah penting dalam pengaruh perubahan iklim dan cuaca yang menjadi lebih ekstrim di
dunia. Penyerapan gas CO2 merupakan teknik pengendalian efek gas rumah kaca yang paling
murah, mudah, dan efektif. Bentonit merupakan bahan berbasis mineral silika yang banyak digunakan dalam proses adsorbsi. Dalam penelitian ini digunakan tiga macam bentonit yaitu Ca-Bentonit putih (CaBK), Ca-Bentonit merah muda (CaMM), dan Na-Bentonit Merah
(NaBK) yang diberi penambahan NaOH, KOH, dan Ca(OH)2 dengan kondisi suhu 5 dan
60oC. Hasil penyerapan gas CO2 dengan penambahan beberapa senyawa basa menunjukan
bahwa penyerapan gas CO2 lebih baik dibandingkan dengan tanpa penambahan senyawa
basa. Penyerapan gas CO2 yang paling tinggi ditunjukkan pada penambahana basa Ca(OH)2.
Proses karbonasi dengan suhu yang lebih tinggi meningkatkan penyerapan gas CO2 dalam
sampel hal ini ditunjukkan pada penggunaan suhu 5 °C. CaBK, CaMM, dan NaBK dengan
penambahan berbagai basa dapat menyerap masing-masing sebanyak ± 1,4 – 9,87%; ± 1,1 –
8,3%; dan ± 0,7 – 9,87% gas CO2 dari berat batuan. Pada Hasil FTIR senyawa karbonat
terlihat pada serapan rentang bilangan gelombang 1300-1500 dan 850-890 cm-1. Kristal
karbonat yang terbentuk juga muncul pada hasil analisis menggunakan SEM. Dan pada hasil XRD didapat bahwa mineral-mineral bentonit yang telah diberi perlakuan menghasilkan senyawa karbonat. Mineral karbonat yang terbentuk pada proses karbonasi adalah mineral
kalsit (CaCO3).
SYNTHESIS AND CHARACTERIZATION OF ABSORBING CO
2GAS
BASED BENTONITE SYNERGY WITH BASE SOLUTIONS
ABSTRACT
The phenomenon of greenhouse gas (GHG) emissions caused by CO2 gas lately become an
important issue in the climate change and the weather is becoming more extreme in the
world. CO2 absorption technique is controlling greenhouse gases the most inexpensive, easy,
and effective. Bentonite is a mineral silica-based materials are widely used in the adsorption process. This study used three kinds, namely Bentonite bentonite white (CaBK), Ca-Bentonite pink (CAMM), and Na-Ca-Bentonite Red (Nabk) given the addition of NaOH, KOH,
and Ca(OH)2 with the conditions of a temperature of 5 and 60°C. The absorption of CO2 by
the addition of some basic compounds showed that the absorption of CO2 gas is better than
without the addition of a basic compound. CO2 absorption is shown in the high alkaline
penambahana Ca(OH)2. Carbonation with higher temperature increases the absorption of CO2
in this case the sample is shown in the use of a temperature of 5 °C. CaBK, CAMM, and Nabk with the addition of various bases to absorb each one as much as ± 1.4 - 9.87%, ± 1.1 -
8.3% and ± 0.7 - 9.87% by weight of CO2 gas rocks. In the FTIR results of carbonate
compounds seen in absorption wavenumber range 1300-1500 and 850-890 cm-1. Carbonate crystals that form also appear in the results of the analysis using SEM. And the XRD results obtained that bentonite minerals that had been treated produce carbonate compounds.
Carbonate minerals formed in the process of mineral carbonation is calcite (CaCO3).
DAFTAR ISI
ABSTRAK ... i
KATA PENGANTAR ... ii
UCAPAN TERIMA KASIH ... iii
DAFTAR ISI ...v
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xii
BAB I PENDAHULUAN ... 1
1.1. Latar Belakang Penelitian ... 1
1.2. Rumusan Masalah Penelitian ... 4
1.3. Batasan Masalah ... 4
1.4. Tujuan Penelitian ... 4
1.5. Manfaat Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Mineral Silika Di Indonesia ... 6
2.1.1 Kelompok Mineral Silikat ... 7
2.1.2 Kelompok Bukan Mineral Silikat ... 10
2.2 Bentonit ... 11
2. 5 Karbonasi Dalam Larutan ... 20
2.6 Karbonasi Dalam Mineral... 22
2.7 Penelitian-Penelitian Penyerapan Gas CO2 ... 23
BAB III METODE PENELITIAN ... 26
3.1 Sistematika Penelitian ... 27
3.2 Alat dan Bahan ... 30
3.2.1 Alat ... 30
3.2.2 Bahan ... 31
3.3 Prosedur Penelitian ... 31
3.3.1 Preparasi Sampel ... 31
3.3.2 Pengaliran Gas CO2 ... 32
3.3.3 Penambahan Senyawa Basa ... 33
3.3.4 Pengukuran Sampel Setelah Dialiri Gas ... 34
3.4.4.1 Padatan ... 34
3.4.4.2 Cairan ... 34
3.4 Karakterisasi Sampel ... 36
3.5 Waktu dan tempat Penelitian ... 36
BAB IV HASIL DAN PEMBAHASAN... 38
4.1 Analisis Kandungan Unsur Dalam Bentonit... 38
4.2 Proses Karbonasi Mineral ... 38
4.2.2 Karbonasi Dengan Penambahan Basa ... 42
4.3 Reaksi Karbonasi Dalam Air ... 46
4.4 Reaksi Karbonasi Dalam Padatan ... 48
4.5 Analisis Sampel Hasil Karbonasi Mineral ... 50
4.5.1 Analisis Hasil Karbonasi Mineral Menggunakan FTIR ... 50
4.5.2 Analisis Hasil Karbonasi Mineral Menggunakan X-Ray Flourescence ... 53
4.5.3 Analisis Hasil Karbonasi Mineral Menggunakan X-Ray Diffraction ... 55
4.5.4 Analisis Hasil Karbonasi Mineral Menggunakan SEM ... 57
BAB V KESIMPULAN DAN SARAN ... 61
5.1. Kesimpulan ... 61
5.2. Saran ... 62
DAFTAR PUSTAKA ... 63
DAFTAR TABEL
Tabel 2.1 Data Unsur Mayor Na-Bentonit ... 14
Tabel 2.2 Data Unsur Mayor Ca-Bentonit dan Ca-Bentonit MM ... 16
Tabel 2.3 Kemampuan Beberapa Mineral Dalam Menyerap CO2 ... 20
Tabel 4.1 Hasil Analisis XRF Raw Bentonit ... 38
Tabel 4.2 Data Kadar gas CO2 dalam Sampel Padatan Sebelum perlakuan... 39
Tabel 4.3 Data Hasil Laju Optimalisasi Aliran Gas CO2 ……… 39
Tabel 4.4 Hasil Analisis pH dan EC campuran Bentonit Sebelum dan Setelah Pemberian Aliran Gas CO2 ... 40
Tabel 4.5 Data Hasil Pengukuran Gas CO2 pada Padatan Menggunakan Orsat ... 42
Tabel 4.6 Data hasil aliran gas dengan penambahan senyawa NaOH, KOH, dan Ca(OH)2 dan pengukuran gas CO2 pada suhu 60 °C ... 43
Tabel 4.7 Data hasil aliran gas dengan penambahan senyawa NaOH, KOH, dan Ca(OH)2 dan pengukuran gas CO2 pada suhu 5 °C. ... 44
Tabel 4.8 Data Persentase (%) Daya Penyerapan Gas CO2 Dalam Bentonit Dengan Menggunakan Senyawa Basa ... 44
Tabel 4.9 Hasil Titrasi Asiditas dan Alkalinitas Sampel yang Sudah Dialirkan Gas (dalam satuan ppm) ... 45
DAFTAR GAMBAR
Gambar 2.1 Skema Pengelompokan Mineral Silikat ... 9
Gambar 2.2 Struktur Na-Bentonit ... 13
Gambar 2.3 Bongkahan Na-Bentonit ... 13
Gambar 2.4 Struktur Ca-Bentonit ... 15
Gambar 2.5 Bongkahan Ca-Bentonit Putih ... 15
Gambar 2.6 Bongkahan Ca-bentonit Merah muda ... 17
Gambar 2.7 Reaksi CO2 Dalam Air... 21
Gambar 2.8 Hubungan Konsentrasi CO2 Dalam Air Berdasarkan Gambar 2.8 Perubahan pH... 21
Gambar 3.1 Skema Penelitian ... 26
Gambar 3.2 Preparasi Sampel ... 27
Gambar 3.3 Proses Karbonisasi Sampel ... 28
Gambar 3.4 Proses Karbonisasi Dengan Penambahan Senyawa Basa... 29
Gambar 3.5 Analisis Gas CO2 Padatan Hasil Aliran ... 30
Gambar 3.6 Titrasi Filtrat Hasil Aliran Gas CO2 ... 30
Gambar 4.1 Grafik Optimalisasi Laju Alir Gas CO2 ... 40
Gambar 4.2 Grafik Penyerapan gas CO2 dengan berbagai sampel dan kondisi dalam Ton/Ton ... 44
Gambar 4.4 Hasil Analisis FTIR sampel CaBK raw, KOH, NaOH,
Ca(OH)2 ... 51
Gambar 4.5 Hasil Analisis FTIR sampel CaBK raw, KOH, NaOH, Ca(OH)2 ... 51
Gambar 4.6 Difraktogram XRD CaBK ... 55
Gambar 4.7 Difraktogram XRD CaMM ... 56
Gambar 4.8 Difraktogram XRD NaBK ... 56
Gambar 4.9 Hasil Analisis SEM (a) NaBK Raw, (b) NaBK + Ca(OH)2, (c) NaBK + NaOH, (d) NaBK + KOH ... 58
Gambar 4.10 Hasil Analisis SEM (a) CaBK Raw, (b) CaBK + Ca(OH)2, (c) CaBK + NaOH, (d) CaBK + KOH ... 59
DAFTAR LAMPIRAN
LAMPIRAN A : Perhitungan Penyerapan Gas CO2 Dalam Sampel ... 70
LAMPIRAN B : Tabel Penyerapan Gas CO2 oleh Ca(OH)2 ... 76
LAMPIRAN C : Tabel Data XRF Ketiga Sampel Dalam Satuan ppm ... 76
LAMPIRAN D : Grafik FTIR Sampel CaBK ... 77
LAMPIRAN E : Grafik FTIR Sampel CaMM ... 78
LAMPIRAN F : Grafik FTIR Sampel NaBK ... 80
LAMPIRAN G: Grafik XRD Sampel CaBK ... 81
LAMPIRAN H: Grafik XRD Sampel CaMM ... 82
LAMPIRAN I : Grafik XRD Sampel NaBK ... 83
LAMPIRAN J: Gambar SEM Permukaan Sampel CaBK ... 85
LAMPIRAN K:Gambar SEM Permukaan Sampel CaMM ...86
BAB I PENDAHULUAN
1.1 Latar Belakang Penelitian
Emisi CO2 dari waktu ke waktu terus meningkat baik pada tingkat global,
regional, nasional pada suatu negara maupun lokal untuk suatu kawasan. Hal ini
terjadi karena semakin besarnya penggunaan energi dari bahan organik (fosil),
perubahan tataguna lahan dan kebakaran hutan, serta peningkatan kegiatan
antropogenik (Slamet S., 2008). Antropogenik adalah istilah yang umum dipakai
untuk menyatakan segala sesuatu yang terjadi di alam karena campur tangan
manusia (efek, proses, obyek dan material), kejadian tersebut sebagai lawan kata
dari kejadian alami (Hairiah, 2007). Konsentrasi gas karbon dioksida (CO2),
metana (CH4), Nitrogen oksida (N2O), dan aerosol mulai meningkat sejak tahun
1750, ketika dimulainya revolusi industri terutama dinegara-negara Eropa.
Peningkatan gas CO2 terutama disebabkan karena pembakaran energi fosil dan
perubahan tataguna lahan. Penyebab utama peningkatan konsentrasi gas metana
dan Nitrogen oksida ialah dampak dari pembangunan pertanian (Buddemeier et.
al., 2004; Salim, 2007).
Berdasarkan data National Oceanic and Atmospheric Administration
(NOAA) pada saat mulai terjadi revolusi industri konsentrasi CO2 di atmosfer
adalah 282,32 ppm (parts per million), tahun 2005 konsentrasinya 380 ppm
(Salim, 2007), tahun 2009 konsentrasinya 387,35 ppm, tahun 2010 konsentrasinya
388,38 ppm dan pada Juni 2011 konsentrasi CO2 mencapai 450 ppm (Purba,
2011). Peningkatan gas metana terjadi dari 715 ppb (parts per billions) menjadi
1732 ppb pada tahun 1990an dan 1774 ppb pada tahun 2005. Peningkatan gas
Nitrogen oksida terjadi dari 270 ppb menjadi 319 ppb pada tahun 2005, terutama
disebabkan oleh aktifitas pertanian. Pengaruh pemanasan global sebagai dampak
dari peningkatan konsentrasi terutama oleh gas CO2, metana, dan Nitrogen Oksida
radiasi yang ditimbulkan terkait dengan meningkatnya karbon dioksida, metana
2
mengalami peningkatan sekitar 20% antara tahun 1995 sampai 2005, paling tinggi
dalam 200 tahun terkahir (Muhammad dkk, 2009).
Emisi GHG (greenhouse gases) di Indonesia telah mencapai tingkat yang
mengkhawatirkan. Indonesia menempati posisi ketiga, setelah USA dan China,
sebagai negara dengan emisi GHG terbesar di dunia. Jika negara-negara
Uni-Eropa dimasukkan, maka Indonesia menempati posisi keempat (Kusumawardani,
2009). Sejak tahun 1995-2009, dunia internasional melakukan pertemuan rutin
setiap tahun untuk membahas berbagai hal yang berkaitan dengan perubahan
iklim, termasuk solusi yang harus dilakukan. Indonesia mengambil sikap dengan
memberikan solusi pada pertemuan G20 di Pittsburgh, USA. Dalam pidatonya,
Presiden Indonesia menyatakan bahwa Indonesia berusaha mengurangi emisi gas
rumah kaca sebanyak 26% dan jika ditambah dengan dukungan dari dunia
internasional sebanyak 15% maka Indonesia dan dunia dapat menekan angka
pertumbuhan emisi gas rumah kaca sebanyak 41% hingga 2020 sebagai mana
dikemukakannya dalam pidato tersebut: “… We are devising an energy mix policy
including LULUCF (Land Use, Land Use Change, and Forestry) that will reduce
our emissions by 26 percent by 2020 from BAU (Business As Usual). With
international support, we are confident that we can reduce emissions by as much
as 41 percent. This target is entirely achievable because most of our emissions come from forest related issues, such as forest fires and deforestation.” (Yudhoyono, 2009).
Untuk itu diperlukan suatu cara agar gas CO2 yang akan dilepaskan ke
udara dapat ditangkap/disaring, Adsorpsi adalah salah satu cara atau metode yang
efektif untuk menangkap/menyaring gas CO2. Adsorpsi adalah fenomena fisik
yang terjadi antara molekul-molekul gas atau cair dikontakkan dengan suatu
permukaan padatan. Proses ini sangat dipengaruhi oleh pasangan adsorben dan
adsorbatnya. Karakteristik adsorpsi merupakan salah satu parameter yang
menentukan kemampuan adsorben menyerap adsorbat (Arnas, 2008). Selain
proses adsorpsi, proses yang banyak digunakan untuk menyerap gas CO2 adalah
3
terhadap gas CO2 yang diberikan sehingga akan menghasilkan suatu senyawa
yang disebut dengan karbonat (IPCC, 2007).
Penelitian tentang rekayasa penyerapan gas CO2 sebenarnya sudah banyak
dilakukan dengan berbagai cara, diantaranya dengan menggunakan mikroalga
(Purba, 2011; Santoso, 2011), karbon aktif (Arnas, 2008), Fly ash (Hernandez et.
al., 2009), air laut (Morse et. al., 1997; Fang et. al., 2010), batu bara (Mursito et.
al., 2011), limbah semen (Bocheňczyk et. al, 2011), mineral Serpentine
(Alexander et. al, 2008), mineral Olivine (O’Conor et. al, 2001), mineral
Wollastonite (Huijgen et. al, 2006), mineral Magnesium Silikat (Zevenhoven et.
al, 2001). Penelitian tentang penyerapan gas CO2 dengan menggunakan mineral
montmorillonit sebenarnya sudah ada, proses yang digunakan menggunakan
larutan asam asetat sebagai senyawa aktivasi (Ptáček et. al, 2012). Penyerapan gas
CO2 dengan menggunakan senyawa basa seperti NaOH (Kumoro, 2000;
Mahmoudkhani et. al., 2009) dan Ca(OH)2 juga sudah pernah dilakukan dengan
kajian yang diteliti mengacu pada laju kinetik dan termodinamiknya (Hernandez
et. al., 2012).
Indonesia memiliki cadangan mineral industri berbasis silika alam seperti
Bentonit, Perlit, Zeolit, dan Kaolin yang sangat besar, dan tersebar di seluruh
pelosok nusantara salah satunya di Karangnunggal Tasikmalaya. Penggunaan
bahan mineral industri tersebut selalu digunakan dalam proses yang tidak kontinu,
sehingga selalu menghasilkan limbah-limbah mineral yang tidak digunakan
kembali (Lubis, 2008). Oleh karena itu, untuk meningkatkan daya guna dalam
pemanfaatan bahan industri yang sudah tidak terpakai maka dilakukan reuse
kembali bahan-bahan dasar industri tersebut dengan memanfaatan mineral industri
sebagai bahan alternatif untuk penyerapan gas CO2 sehingga bahan-bahan industri
tersebut akan memiliki nilai guna yang lebih sebagai bahan yang sangat berguna
dalam mengurangi emisi GHG di tingkat nasional maupun internasional.
Namun, penelitian dengan menggunakan mineral Bentonit dengan
penambahan senyawa basa belum banyak yang melakukan. Oleh karena itu dalam
penelitian ini dilakukan proses penyerapan gas CO2 dengan menggunakan
4
berwarna merah muda, dan Na-Bentonit berwarna merah yang diberi penambahan
senyawa basa seperti NaOH, KOH, dan Ca(OH)2 sebagai senyawa pengaktivasi
untuk meningkatkan proses penyerapan gas CO2 dalam mineral.
1.2 Rumusan Masalah Penelitian
Berdasarkan uraian yang telah dikemukakan di atas, didapat beberapa
rumusan masalah penelitian, sebagai berikut:
1. Apakah pengaruh penambahan senyawa NaOH, KOH, dan Ca(OH)2 pada
mineral Ca-Bentonit, Ca-bentonit merah muda, dan Na-Bentonit dapat
meningkatkan daya penyerapan gas CO2?
2. Seberapa besar kemampuan gas CO2 yang terserap pada mineral
Ca-Bentonit, Ca-bentonit merah muda, dan Na-Bentonit yang terakivasi oleh
penambahan senyawa basa?
3. Bagaimana karakteristik mineral Ca-Bentonit, Ca-Bentonit merah muda,
dan Na-Bentonit sebelum dan sesudah teraktivasi oleh penambahan
senyawa basa pada penyerapan gas CO2?
1.3 Batasan Masalah Penelitian
Batasan masalah dalam penelitian ini adalah Bentonit putih,
Ca-bentonit merah muda, dan Na-Bentonit yang digunakan berbahan baku lokal yaitu
berasal dari karangnunggal, Tasikmalaya. Suhu yang digunakan dalam penelitian
ini adalah 5 °C dan 60 °C. Uji karakterisasi yang dilakukan menggunakan uji
FTIR, XRD, XRF, SEM, dan Unsur Mayor.
1.4 Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui pengaruh penambahan senyawa
basa terhadap peningkatan daya serap gas CO2 pada bentonit, kemudian penelitian
ini pun bertujuan untuk mengetahui karakteristik dari mineral Bentonit,
Ca-Bentonit merah muda, dan Na-Ca-Bentonit sebelum dan sesudah diberi tambahan
5
1.5 Manfaat Penelitian
Manfaat penelitian ini diharapkan menjadi sumber acuan dalam
pengembangan alat yang digunakan untuk penyerapan gas CO2, sehingga mineral
yang digunakan dalam penelitian ini memiliki nilai tambah dalam fungsinya
selain untuk bahan baku dalam industri. Selain itu juga dapat menjadikan langkah
alternatif dalam menurunkan gas emisi CO2 di udara sehingga pemanasan global
BAB III
METODOLOGI PENELITIAN
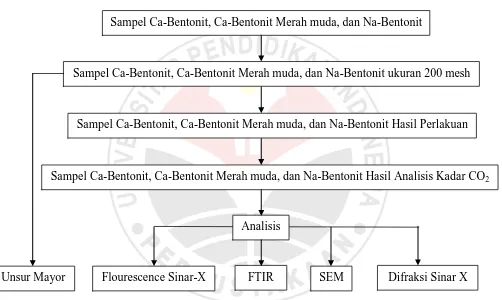
3.1 Sistematika Penelitian
Penelitian yang dilakukan berdasarkan skema penelitian berikut ini:
Gambar 3.1 Skema Penelitian
Sampel Ca-Bentonit, Ca-Bentonit Merah muda, dan Na-Bentonit
Sampel Ca-Bentonit, Ca-Bentonit Merah muda, dan Na-Bentonit ukuran 200 mesh
Sampel Ca-Bentonit, Ca-Bentonit Merah muda, dan Na-Bentonit Hasil Perlakuan
Sampel Ca-Bentonit, Ca-Bentonit Merah muda, dan Na-Bentonit Hasil Analisis Kadar CO2
Analisis
FTIR SEM Difraksi Sinar X
27
28
30
Gambar 3.5 Analisis Gas CO2 Padatan Hasil Aliran
Gambar 3.6 Analisis Gas CO2 Cairan Hasil Aliran
3.2 Alat dan Bahan 3.2.1 Alat
Peralatan yang digunakan adalah jaw crusher, ball mill, screening
(ukuran 200 mesh), corong, oven, agat, kaca arloji, gelas kimia (ukuran 50,
100, 250, 500, 1000, 2000 mL), batang pengaduk, spatula, Neraca Sauter,
pipet tetes, pipet seukuran (ukuran 20 mL), ball filler, kaca masir, vaccum,
31
klem dan statif, gas wash bottle, pH meter (ADWA, AD1000), EC meter
(ADWA, AD3000), krustang, cawan porselen, dan desikator, waterbath
(Memmert), Coolbath (Heto lab equipment, CB-2513), ORSAT, XRF
(NITON, XL3t), FTIR (Shimadzu, FTIR-8400), SEM (JEOL, JSM-6360LA),
XRD.
indikator methyl orange (Merck®), indikator phenolphthalein (Merck®),
H2SO4 (Merck®, 96%), Gas CO2, Bahan sampel batuan yang digunakan
Na-Bentonit, Ca-Bentonit putih, dan Ca-Bentonit MM.
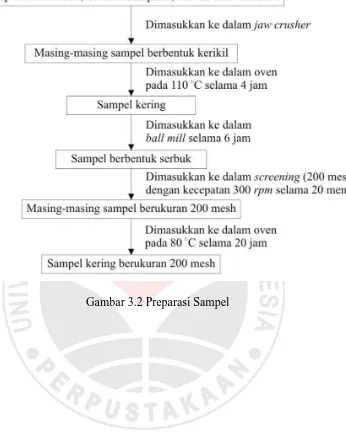
3.3 Prosedur Penelitian 3.3.1 Preparasi Sampel
Preparasi sampel batuan yang lain dari bentuk bongkahan hingga
berbentuk serbuk halus, proses yang dilakukan adalah sampel batuan tersebut
dihaluskan hingga menjadi berbentuk serbuk yang berukuran 200 mesh.
Sampel batuan Na-Bentonit, Ca-Bentonit, dan Ca-Bentonit Merah Muda yang
selanjutnya diberi kode NaBK, CaBK, dan CaMM dihaluskan menggunakan
32
alat selama 2 jam sehingga diperoleh sampel dalam bentuk kerikil. Kemudian
sampel dimasukkan ke dalam oven selama 4 jam pada suhu 110 °C, setelah
itu masing-masing sampel NaBK, CaBK, dan CaMM dimasukkan ke dalam
alat ball mill selama 6 jam hingga sampel berbentuk serbuk. Setelah itu,
sampel dimasukkan ke dalam screening dengan ukuran 200 mesh dengan
kecepatan 300 rpm selama 20 menit, setelah itu semua sampel kembali
dimasukkan ke dalam oven selama 1 hari dengan suhu 80 °C.
3.3.2 Pengaliran Gas CO2
Pengaliran gas CO2 terhadap sampel dalam penelitian ini dilakukan
dengan cara CaBK, CaMM, dan NaBK di timbang sebanyak 5 g dengan
penambahan air sebanyak 95 g kemudian masing-masing campuran diukur
pH dan EC (Electro Conductivity) nya, setelah itu masing-masing campuran
dimasukkan ke dalam tabung gas wash bottle. Campuran yang sudah berada
di dalam gas wash bottle dimasukan ke dalam waterbath yang sudah diset
dengan suhu 60 °C. Kemudian diberi aliran gas CO2 sebesar 4 L/min selama
1 jam. Setelah diberi aliran, masing-masing sampel diukur kembali pH dan
ECnya. Setelah itu disaring dengan menggunakan kaca masir yang dibantu
dengan vacuum. setelah itu didapat 2 hasil penyaringan yang berupa filtrat
(cairan) dan residu (padatan). Residu yang berupa padatan dikeringkan ke
dalam oven dengan suhu 90 °C selama 2 jam, sedangkan filtrat hasil saringan
33
3.3.3 Penambahan Senyawa Basa
Selain bahan dasar yang diberi aliran gas CO2, dilakukan juga
percobaan dengan penambahan senyawa-senyawa basa, diantaranya dengan
penambahan Ca(OH)2, NaOH, dan KOH, proses yang dilakukan pun sama
dengan prosedur sebelumnya, masing-masing sampel CaBK, CaMM, dan
NaBK ditimbang sebanyak 5 g kemudian diberi Ca(OH)2 sebanyak 1 g,
setelah itu baru diberi tambahan air sebanyak 94 g sehingga total berat
campuran tetap 100 g. setelah ditimbang, campuran tersebut diukur pH dan
EC nya. Kemudian campuran tersebut dimasukkan ke dalam gas wash bottle.
Campuran yang sudah berada di dalam gas wash bottle dimasukan ke dalam
waterbath yang sudah diset dengan suhu 60 °C. Kemudian diberi aliran gas
CO2 sebesar 4 L/min selama 1 jam. Setelah pengaliran dengan gas CO2
campuran tersebut diukur kembali pH dan EC nya, lalu disaring dengan
menggunakan kaca masir dan dibantu dengan menggunakan vacuum, setelah
itu didapat 2 hasil penyaringan yang berupa filtrat (cairan) dan residu
(padatan). Residu yang berupa padatan dikeringkan ke dalam oven dengan
suhu 90 °C selama 2 jam, sedangkan filtrat hasil saringan yang berupa cairan
dimasukkan ke dalam botol penyimpanan. Prosedur selanjutnya dilakukan
sama dengan sebelumnya hanya saja dilakukan dengan penambahan
masing-masing senyawa basa yang lain yaitu NaOH, dan KOH. Proses penambahan
semua senyawa-senyawa basa ini juga dilakukan pada suhu 5 °C dengan
34
3.3.4 Pengukuran Sampel Setelah Dialiri Gas 3.3.4.1 Padatan
Setelah proses pengaliran dan pengeringan selesai
dilakukan, langkah selanjutnya adalah masing-masing sampel
ditimbang sebanyak 0.4 g, kemudian sampel tersebut
dimasukkan ke dalam tabung kimia yang besar, setelah itu
tabung kimia tersebut dipasang dalam alat ORSAT dan
dilanjutkan dengan pemberian tetesan HCl 8 N dengan
menggunakan buret hingga sampel larut semua atau hingga
sampel tidak menghasilkan gas. gas akan keluar dari batu
gamping dan gas akan terukur di dalam ORSAT.
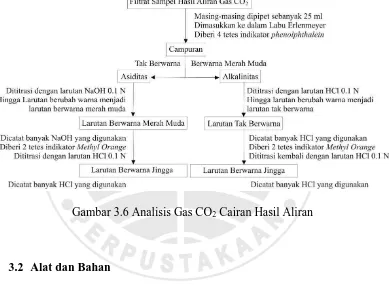
3.3.4.2 Cairan
Sampel cairan hasil saringan disimpan dibotol
penyimpanan, metode pengukuran kadar CO2 didalam cairan
menggunakan cara titrasi asiditas dan alkalinitas. Langkah
yang pertama kali dilakukan adalah mempipet sampel
sebanyak 25 ml. dengan menggunakan pipet seukuran 25 ml.
kemudian sampel dimasukkan ke dalam labu Erlenmeyer,
setelah itu sampel diberi 4 tetes larutan indikator
phenolphthalein kemudian sampel diamati. Ketika sampel
35
terjadi perubahan warna maka dilakukan proses titrasi
asiditas. Pada proses titrasi alkalinitas, sampel yang berwarna
merah muda dititrasi dengan menggunakan larutan HCl 0.1 N
hingga warna muda pada sampel hilang menjadi sampel yang
tidak berwarna. Catat pemakaian larutan HCl yang
digunakan. Setelah sampel menjadi larutan tak berwarna
sampel diberi tambahan 2 tetes larutan indikator Methyl
Orange, sampel akan berubah warna menjadi larutan
berwarna orange/jingga pekat. Setelah sampel berubah
warna, sampel kembal dititrasi dengan larutan HCl 0.1 N
hingga sampel berubah warna kembali dari warna
orange/jingga pekat menjadi berwarna kuning dan terakhr
berubah menjadi warna jingga pucat. Setelah selesai titrasi
catat pemakaian larutan HCl yang digunakan.
Proses Asiditas diawali dengan sampel yang sudah diberi
4 tetes larutan indikator phenolphthalein namun sampel tidak
berubah warna. Sampel yang tak berwarna ini selanjutnya
dititrasi dengan menggunakan larutan NaOH 0.1 N hingga
larutan berubah warna dari sebelumnya merupakan larutan
tak berwarna menjadi larutan berwarna merah muda. Catat
pemakaian larutan NaOH yang digunakan. Setelah sampel
sudah berubah warna menjadi merah muda, selanjutnya
36
sehingga sampel akan berubah warna menjadi larutan
berwarna orange/jingga pekat. Setelah berubah warna sampel
selanjutnya dititrasi kembali dengan menggunakan larutan
HCl 0.1 N hingga sampel berubah warna dari warna jingga
pekat kemudian kuning lalu terakhir berwarna jingga pudar.
Catat penggunaan larutan HCl yang telah digunakan.
3.4 Karakterisasi Sampel
Sampel yang sudah kering dilakukan karakterisasi dengan menggunakan
beberapa alat diantaranya FTIR, SEM, XRD, dan XRF. Keberhasilan
pembentukan senyawa karbonat dalam mineral ditunjukkan dalam FTIR dan
XRD, sedangkan perubahan senyawa-senyawa kandungan sampel dapat dilihat
dari uji XRF. Sedangkan SEM digunakan untuk melihat bentuk dari kristal
hasil sebelum dan sesudah perlakuan sampel terhadap pemberian aliran gas
CO2.
3.5 Waktu dan Tempat Penelitian
Pelaksanaan penelitian dimulai dari bulan Maret sampai dengan bulan
September 2012 di Ruang Preparasi Batuan Mineral, Laboratorium Analisis
Kimia Mineral, serta Laboratorium Pemanfaatan Bitumen dan Pengolahan
Mineral Gd. 80 Kampus LIPI (Lembaga Ilmu Pengetahuan Indonesia)
Ca-37
penelitian dilakukan di empat tempat yaitu di Lab. Instrument Kimia UPI
(FTIR), Laboratorium Kimia Mineral Tekmira (Major Element dan XRD), dan
Laboratorium Pusat Survei Geologi (SEM), Laboratorium Analisis XRF Puslit
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Kesimpulan yang diperoleh dari penelitian sinergitas bentonit dengan
penambahan senyawa basa sebagai agen penyerapan gas CO2 dengan proses
karbonasi adalah sebagai berikut:
1. Dengan penambahan senyawa basa NaOH, KOH, dan Ca(OH)2 ketiga
sampel mineral Ca-Bentonit, Ca-Bentonit merah muda, dan Na-Bentonit
merah mampu meningkatkan daya penyerapan gas CO2 dari sebelumnya
semua mineral Bentonit tidak dapat menyerap gas CO2.
2. Besaran kemampuan gas CO2 yang terserap pada mineral Bentonit,
Ca-Bentonit merah muda, dan Na-Ca-Bentonit yang terakivasi oleh penambahan
senyawa basa berbeda-beda, pada penambahan NaOH sampel CaBK,
CaMM, dan NaBK dapat menyerap gas CO2 sebesar 2-2,4% ; 1,1-2,5% ;
dan 2,1-3.8% dari berat sampel. Pada penambahan KOH sampel CaBK,
CaMM, dan NaBK dapat menyerap gas CO2 sebesar 1,5-1,9% ; 1,5-2,3% ;
dan 0,8-1,3% dari berat sampel. Pada penambahan Ca(OH)2 sampel
CaBK, CaMM, dan NaBK dapat menyerap gas CO2 sebesar 8,9-9,9%;
8,1-8,3%; dan 9,7-9,9% dari berat sampel.
3. Karakteristik Hasil analisis mineral Ca-Bentonit, Ca-Bentonit merah
puncak serapan yang muncul pada bilangan gelombang 1300-1500 cm-1
62
yang menunjukkan adanya puncak mineral karbonat pada bilangan 2θ 29,
39, 43, 47, dan 48 mineral yang terbentuk adalah mineral karbonat yaitu
mineral kalsit (CaCO3).
5.2 Saran
Penelitian yang dilaksanakan merupakan penelitian awal untuk mengkaji dan
mengetahui penyerapan gas CO2 menggunakan mineral tambang industri seperti
batuan bentonit yang berbasiskan penggunaan sumber kekayaan mineral lokal.
Berdasarkan evaluasi terhadap hasil penelitian, perlu dilakukan penelitian lebih
lanjut untuk menutup kekurangan dari penelitan ini, diantaranya:
1. Kajian secara khusus mengenai adsorpi isotherm antara penyerapan gas
CO2 tanpa menggunakan senyawa basa dengan penyerapan gas CO2
menggunakan basa.
2. Kajian secara khusus mengenai kinetika adsorpsi dari laju gas alir dengan
raw maupun setelah penambahan senyawa basa terhadap penyerapan gas
CO2 pada sampel.
3. Adanya variasi dari beberapa variable yang telah dilakukan seperti
penambahan variasi suhu, waktu, laju alir gas CO2, pemberian senyawa
basa lain, dan penambahan senyawa basa secara bertahap.
4. Pengujian terhadap pori-pori sampel yang telah diberi aliran gas CO2 baik
raw maupun setelah penambahan senyawa basa dengan memperhatikan
aspek kapasitas panyerapan.
DAFTAR PUSTAKA
Agus, F. 2008. Cadangan, Emisi, dan Konservasi Karbon Pada Lahan Gambut. Balai Penelitian Tanah.
Alemdar, A. et. al. 2005. Effects of Poliethylimine Adsorption of Rheology of Bentonit Suspension. Indian Academy of Science. 28, 287-291.
Alexander, G. et. al. 2008. Serpentine and single stage mineral carbonation for the storage of carbon dioxide. Enero. 6, (1), 7-10.
Arihara, K. et. al. 2001. Characterization of the adsorption state of carbonate ions at the Au(111) electrode surface using in situ IRAS. Journal of Electroanalytical Chemistry
510, 128–135.
Arnas. 2008. Kapasitas penyerapan CO2 pada karbon aktif yang berasal dari batu bara
sumatera selatan dengan tekanan maksimum 2,3 bar. [Skripsi]. Universitas Indonesia.
Azlin bin Ishak. 2011. Modul Al-Kimiya Cahpter 8 - Salts. Tersedia:
cikguadura.wordpress.com. [Akses: 20 Desember 2012]
Bocheňczyk, A. U. et. al. 2011. Mineral sequestration of CO2 with the use of cement waste.
Energy Procedia 4. 2855-2860.
Bӧke, H. et. al. 2004. Quantification of CaCO3–CaSO3∙0.5H2O–CaSO4∙2H2O mixtures by
FTIR analysis and its ANN model. Materials Letters 58, 723– 726.
Buddemeier, R. W. et. al. 2004. Coral Reefs and Global Climate Change: Potential Contributions of Climate Change to Stresses on Coral Reef Ecosystems. Prepared for the Pew Center on Global Climate Change.
Carlson, L. 2004. Bentonite Mineralogy. Working report Geological Survey of Finland. Finland.
Dariah, A., Susanti, E., dan Agus, F. 2011. Simpanan Karbon dan Emisi CO2 lahan gambut.
Balai Penelitian Tanah.
Davis, K. J. et. al. 2004. Morphological consequences of differential Mg2+ incorporation at
structurally distinct steps on calcite. American Mineralogist. 89, 714–720.
65
Fang, Y. et. al., 2010. Characteristics of CO2 Sequestration In Saline Aquifers. Pet. Sci. 7.
83-92.
Gasc, F. et. al. 2009. Methods for synthesizing diethyl carbonate from ethanol and supercritical carbon dioxide by one-pot or two-step reactions in the presence of potassium carbonate. The Journal of Supercritical Fluids. 50, 46-53.
Graf, D. J. 1961. Crystallographic Tables For The Rombhohedral Carbonates. American Mineralogist. 46, 1283-1316.
Günister, E. et. al. 2004. Effect of sodium dodecyl sulfate on flow and electrokinetic properties of Na-activated bentonite dispersions. Bull. Mater. Sci. 27, (3), 317–322.
Hairiah, K. 2007. Perubahan klom Global : Pemicu Terjadinya Peningkatan GRK. Draft Modul 3. Universitas Brawijaya. Malang.
Hernandez, G. M. et. al. 2009. Mineral sequestration of CO2 by aqueous carbonation of coal
combustion fly-ash. Journal of Hazardous Materials 161. 1347–1354.
Hernandez, G. M. et. al. 2012. Gas-solid carbonation of Ca(OH)2 and CaO particles under
non-isothermal and isothermal conditions by using a thermogravimetric analyzer: Implications for CO2 capture. International Journal of Greenhouse Gas Control 11, 3.
172-180.
Ho, Patience C., and Donald A. Palmer, 2008. Electrical Conductivity Measurements of Aqueous Electrolyte Solutions at High Temperatures and High Pressures. Chemical and Analytical Sciences Division Oak Ridge National Laboratory. Tennessee, USA.
Huijgen. W.J.J. et. al. 2006. Mechanism of Aqueous Wollastonite carbonation as a possible CO2 sequestration process. Chemical Engineering Science.
IPPC. 2007. Chapter 7: Mineral carbonation and industrial uses of carbon dioxide. IPCC Special Report on Carbon dioxide Capture and Storage
Jeffery, G. H. et. al. 1989. Vogel’s Textbook of Quantitative Chemical Analysis Fifth Edition.
Longman Scientifics & Technical. New York.
Kern, F., dan Smith, A. 2008. Restructuring energy systems for sustainability? Energy transition policy in the Netherlands. Sussex Energy Group. University of Sussex.
Kleypas, J. A. et. al. 1999. Geochemical consequences of increased atmospheric carbon dioxide on coral reefs. Science 284:118–120.
66
Kusumawardani, D. 2009. Emisi CO2 dari Penggunaan Energi di Indonesia: Perbandingan
Antar Sektor. Jurnal Ekonomi dan Bisnis. 8, (3), 176–187.
Labaik, G. 2002, Kajian Terhadap Bentonit di Kabupaten Tasikmalaya dan Kemungkinannya Dijadikan Bahan Pembersih Minyak Sawit (CPO). Kolokium Direktorat Investasi Sumber Daya Mineral.
Lackner, K. S. et. al. 1995. Carbon dioxide disposal in carbonate minerals. Energy, 20. 1153-1170.
LAPI ITB. 1992. Buku Panduan Analisis Laboratorium, Studi Peningkatan Kwalitas Air Bersih: Air Harapan, Baloi, dan Nongsa Pulau Batam. ITB.
Lower, S. K. 1999. Carbonate equilibria in natural waters. Environments Chemistry. Simon Fraser University.
Lubis, G. 2008. Bentonit Sebagai Bahan Baku Industri di Sumatera Utara. Media Litbang Sumatera Utara. Inovasi 5. (3).
Madjid, A. 2009. Dasar-dasar Ilmu Tanah. Bahan Ajar Online Fakultas Pertanian
Universitas Sriwijaya. [Online] tersedia
http://dasar2ilmutanah.blogspot.com/2009/05/mineral-tanah.html.[Akses: 21 Desember 2012].
Mahmoudkhani, M. dan Keith, D. W. 2009, Low-energy sodium hydroxide recovery for CO2
capture from atmospheric air—Thermodynamic analysis. International Journal of Greenhouse Gas Control 156. (9).
Marion, G. M. 2000. Carbonate mineral solubility at low temperatures in the Na-K-Mg-Ca-H-Cl-SO4-OH-HCO3-CO3-CO2-H2O system. Geochimica et Cosmochimica Acta 65.
Morse, J.W., et. al. 1997. Influence of Temperature and Mg:Ca ratio on CaCO3 precipatates from seawater. Geology 25, 85-87.
Muhammad, S. et. al. 2009. Adaptasi Pengelolaan Wilayah Pesisir Dan Kelautan Terhadap Dampak Perubahan Iklim Global. Makalah Seminar Nasional Pemanasan Global: Strategi Mitigasi dan Adaptasi Perubahan Iklim di Indonesia. Malang.
67
Noor, D. 2009. Mineral Dan Batuan. Pengantar Geologi. Universitas Sriwijaya.
O’Connor, W. K. et. al. 2001. Aqueous Mineral Carbonation Studies Using Olivine and Serpentine. Albany Research Center Office of Fossil Energy. Pittsburg.
O’Connor, W. K. et. al. 2000. Carbon Dioxide Sequestation By Direct Mineral Carbonation With Carbonic Acid. Proceedings of the 25th International Technical Conf. On Coal Utilization & Fuel Systems, Coal Technology Assoc., Clear Water, FL.
O’Connor, W. K. et. al. 2001. Carbon Dioxide Sequestration by Direct Mineral Carbonation: Results from Recent Studies and Current Status. Albany Research Center Office of Fossil Energy. Oregeon.
Othman, M.R., Martunus, R. Zakaria, W.J.N. Fernando. 2009. Strategic planning on carbon
capture from coal fired plants in Malaysia and Indonesia: A review. Energy Policy. 37.
1718-1735.
Ӧztϋrk, N. et. al. 2007. Newly synthesized bentonite–histidine (Bent–His) micro-composite
affinity sorbents for IgG adsorption. Colloids and Surfaces A: Physicochem. Eng.
Aspects 301, 490–497.
Parningotan, M.R., 2002. Inventarisasi dan Evaluasi Mineral Non Logam di Kab. Ciamis dan Kab. Tasik, Prov. Jawa Barat, DIM, Bandung. Kolokium Direktorat Inventarisasi Sumber Daya Mineral.
Pavličević, J. et. al. 2010. The Influence of Montmorillonitand Bentonite Addition on Thermal Properties of Polyurethanes Based on Aliphatic Polycarbon Diols. Thermochimica Acta. 509. 73-80
Priambodo, A. dan Kumar S. 2001. Energy Use and Carbon Dioxide emission of Indonesian Small and Medium Scale Industry. Energy Conversion and Management. 42. 1335-1348.
Ptáček, P. et. al. 2012. Activation of Bentonite and Talc by Acetic Acid as a Carbonation Feedstock for Mineral Storage of CO2. Atomic Absorption Spectroscopy. 221-258.
Purba, E. 2011. Perbandingan Profil Volume Dan Periode Penggantian Mikroalga Dalam
Penyerapan Gas CO2 Dalam Udara Menggunakan Tetraselmis chuii Dan
Nannochloropsis oculata. Prosiding Seminar Nasional Sains Dan Teknologi – IV.
Puslitbang Tekmira. 2005. Bentonit. [Online] tersedia:
http://tekmira.esdm.go.id/data/bentonit/ulasan.asp?xdr=Bentonit%commId=88&com=B entonit. [Akses: 15 September 2012].
68
Robie, R. A., Hemingway, B. S., Fischer, J. R. 1978: Thermodynamic Properties of minerals and related substances at 298.15 K and 1 bar (105 Pascal) pressure and at higher temperatures, US Geological Bulletin 1452, Washington DC.
Rojac, T. et. al. 2012. Using Infrared Spectroscopy to Identify New Amorphous Phases - A Case Study of Carbonato Complex Formed by Mechanochemical Processing. Infrared Spectroscopy - Materials Science, Engineering and Technology. InTech.
Salim, E. 2007. Perubahan Iklim dalam Seminar Nasional Pemanasan Global dan Perubahan Global. 15 Nopember 2007. LAPAN. Bandung.
Santoso, A. D. et. al. 2011. Mikro Alga Untuk Penyerapan Emisi CO2 dan Pengolahan
Limbah Cair Di Lokal Industri. Jurnal Ilmu dan Teknologi Kelautan Tropis, 3, (2), Hal. 62-70.
Seifritz, W.. 1990. CO2 disposal by means of silicates. Nature 345, 486
Skinner, A. J. et. al. 1994. Structure and bonding of calcite: A theoretical study. American Mineralogist. 79, 205-214.
Slamet S., L. 2008. Skenario Emisi CO2 di Indonesia. Prosiding Seminar Nasional
Pemanasan Global dan Perubahan Global - Fakta, Mitigasi, dan Adaptasi. Pusat Pemanfaatan Sains Atmosfer dan Iklim LAPAN.
Stolaroff, J. K. et. al. 2008. Carbon Dioxide Capture from Atmospheric Air Using Sodium Hydroxide Spray. Environ. Sci. Technol. 42. 2728–2735
Xu, T. et. al. 2004. Numerical simulation of CO2 disposal by mineral trapping in deep
aquifers. Applied Geochemistry 19. 917–936.
Yudhoyono, S. B. 2009. Speech on Climate Change at the G-20 Leaders Summit. Pittsburg.
Yusuf, A.F., 2004. Pemetaan Endapan Fosfat di Daerah Taraju dan Sukaraja, Kabupaten Tasikmalaya. Kolokium Direktorat Investasi Sumber Daya Mineral.
Zainith, A. et. al. 2002. Hasil Kegiatan Inventarisasi dan Evaluasi Sub Tolok Ukur Mineral Non Logam Tahun Anggaran 2002. Kolokium Direktorat Inventarisasi Sumber Daya Mineral.
Zevenhoven, R. et. al. 2001. CO2 Sequestration by Magnesium Silicate Mineral Carbonation