Pembuatan Dan Karakterisasi Kalali.\" Oksida Mangan Dengan Pendukung Bentonit Berpilar Alumina Untuk Oksidasi Gas CO (Adel Fisli)
PEMBUATAN
DAN KARAKTERISASI
KATALIS
OKSIDA
MANGAN DENGAN PENDUKUNG
BENTONIT
BERPILAR
ALUMINA
UNTUK OKSIDASI GAS CO,
Adel Fislil daD Dery Daerudiw
lPuslitbang Iptek Bahan (P31B)-BATAN Kawasan Puspiptek, Serpong, Tangerang 15314
2Pusat Penelitian Kimia-LIPI
Kawasan Puspiptek, Serpong, Tangerang 15314
ABSTRAK
PEMBUATAN DAN KARAKTERISASI KATALIS OKSIDA MANGAN DENGAN PENDUKUNG BENTONIT
BERPILAR ALUMINA UNTUK OKSIDASI GAS CO. Pilarisasi bentonit dilakukan dengan menambahkan polikatioan alumina jenis Keggin [AlI3O4(OH)24(H20)12]'+ ke dalam suspensi bentonit serta pertukaran polikation ke dalam ruang antara lembaran-lembaran benton it clan dilanjutkan dengan kalsiriasi pada 400°C selama 6 jam. Hasil karakterisasi bentonitini menunjukkan adanya peningkatan luas permukaan spesifik daTi 46 m'/g menjadi 148 m'/g, peningkatan ruang basal daTi 9,75 A menjadi 17,48 A clan peningkatan ketahanan terhadap perlakuan panas. Impregnasi mangan (ll) asetat pada benton it berpilar clan suhu kalsinasi 400°C selama 6 jam, membentuk fraksi MnO, clan Mn,O3 pada bentonit. Uji aktifitas katalitik terhadap oksidasi CO menjadi CO2 menunjukkan konversi maksimum sebesar 63,9% pada 400°C, dengan rasio CO,/CO maksimum sebesar 67,2% pada 340°C serta energi aktivasi adsorbsi CO pada suhu 150 -375°C adalah 37,1 kllmol (8,83 kkal/mol).
Kala kunci ..Bentonit berpilar alumina, katalis mangan oksida, pilarisasi.
ABSTRACT
PREPARATION AND CHARACTERIZATION OF MANGANESE OXmE CATALYSTS SUPPORTED ON
ALU-MINA PILLARED BENTONITE FOR OXIDATION OF CO. Pillarization of betonite was carried out by ion exchange of Keggin-Type polycation [Al13O4(OH)24~O)12]7+ into the interlayers of bentonite, which then calcined at 400°C for 6 hours. The characterization of the bentonite showed that the specific surface area was increased from 46 m2/g to 148 m2/g, basal spacing was increased from 9,75 A to 17,48 A and the thermal stability was enhanced. Impregnation of the pillared bentonite with manganese (JI) acetate and the calcination of its results at 400°C for 6 hours showed theP resence of MnO and Mn 0 fractions
2 2 3
on bentonite. The catalytic activity tests showed, that the maximum conversion was 63,9% at 400°C, with the maximum ratio of CO2/CO was 67,2% at 340°C and the activation energy at 150-375°C was 37,1 kJ/mol (8,8 kkal/mol).
Key words: Alumina pillared bentonite, manganese oxide catalyst, pillarization.
PENDAHULUAN
daD ukuran lebih besar seperti polikation at au polihidroksi yang berbasis logam seperti; AI, Zr, Ti, Cr, Fe dan Ga. Sebagai hasil pertukaran kation ini, dihasilkan suatu bahan yang berdimensi dua seperti ziolit yang dikenal dengan liat berpilar. Setelah pemanasan, pilar polikation ini akan membentuk cluster oksida yang membuka antar lembaran liat secara permanen dan menghasilkan ruang-ruang berdimensi molekular yang mempunyai sistem pori yang baik. Sebagai hasilliat berpilar ini akan diperoleh tekstur permukaan yang bersifat asam basa yang cocok untuk bermacam-macam aplikasi katalitik seperti; cracking minyak bumi, alkilasi, dehidrasi alkohol, produksi bahan kimia murni dan lain-lain [4,5,6].
Dari sekian banyak bahan pemilar, logam polikation aluminium jenis Keggin [AI1JO 4(OH)24(H20)12]7+ yang paling banyak dipelajari daD relatif mudah reproduksi. Keutamaan lain Bentonit (montmorillonite) termasuk jenis
mineral liat hidrous phyllo.'iilicate yang struktur materialnya berbentuk lembaran. Setiap lembaran montmorilonite terdiri daTi 21apisan tetrahedral yang disusun oleh unsur utama Si(O,OH) dan mengapit llapisan oktahedral yang disusun oleh unsur M (0, OH) M= AI, Mg, Fe. Di antara lembaran-lembaran ini, terdapat ruang yang diisi oleh molekul-molekul air dan kation-kationlain. Apabilamontmorillonite inidilarutkandalam air, alkohol, etilen glikol dan gliserol, ruang antara lembaran ini dapat mengembang. Montmorillonite mempunyai rumus molekul idealnya Al'lsMgoss(Sisoo)02o(OH)4XossnH20, dan muatan lisii'iknya .muncUl dari kation divalensi, biasanya dari unsur Mg, sedangkan X adalah kation monovalensi yang ada di antara lembaran [1,2,3]
Kation-kation yang ada di antara lembaran dapat diganti dengan kation-kation yang mempunyai muatan
Prosiding Pertemuan Ilmiah lImu Pengetahuan dan Teknologi Bahan 2002
Serpong, 22 -23 Oktober 2002
ISSN 1411-2213
menggunakan polikation alwninium sebagai pilar liat ini adalah meningkat ruang basal antara lembaran sampai 18-20 Ao, teroentuknya struktur pori yangmengandung sisi-sisi asam Lewis dan Brosnted dan meningkatkan kestabilan termal sampai suhu 500°C [7]. Bahranowski [5] melaporkan, bahwa basil pengukuran luas permukaan spesifik terhadap berbagai polikation yang digunakan sebagai pilar diperoleh urutan sebagai berikut AI-PILC > Zr-PILC > Ti-PILC. Sedangkan ketahanan termal Unltannya adalah Al-PilLC > Fe-PILC > Zr-PILC>Cr-PILC [8].
montmorilonite berpilar, pengujian ketahanan tennal dilakukan dengan DTAffG dan adanya penempelan oksida mangan pada pennukaan pendukung ditentukan dengan xrd. Keberhasilan pembuatan katalis dilakukan dengan pengujian aktifitas katalis terhadap oksidasi CO menjadi CO2, menggunakan reaktor aliI yang dihubungkan secara online denganMicro GC.
METODE KERJA
Bahan
Bentonit awal yang digunakan didalam penelitian ini adalah bentonitkaya Ca (Ca-Bentonit) (Sigma) daD semua bahan kimia yang digunakan adalah kualitas analytical grade, diantaranya; aluminium chloride (AICIJ (Merck), natrium hidroksida (NaOH) (Merck), manganese (II) acetate tetra hydrate
«C~COO)2Mn.4~O) (Merck), gas helium (He) (UHP), gas oksigen (OJ (UHP) dan gas karbon monoksida (CO), (UHP) .
Alat
Alat yang digunakan dalam penelitian ini adalah; Sentrifugasi, Model J2-21M/E Centrifuge (Backman), Quntasorb (Quanta Chrome) (pengukuran BET), XRD Xpert (Philips) (pengukuran pola difraksi sinar-x), STA Setaram TAG 24 S (France) (pengukuran DTArrG),
Seperangkap alat Reaktor alir RDP 830 daTi ~nci Tecnologiss (Cedex) (uji aktifitas katalitik) yang dihubungkan secara online denganMicro GC Hewlett Packard model QUAD beserta software HP EZChrom Chromatography Data System, pH Cdberscand 2000 (pengukuran pH larutan) danMagnetic stirrer/Hotplate SM26 Stuart Scientific
Tata
Kerja
Pembuatan larutan polikation aluminum
500 mL larutan NaOH 0,2 M diteteskan dengan kecepatan 1 mL/menit ke dalam 500 mL larutan AICI3 0,1 M dalam keadaan diaduk dengan cepat dengan magnetic stirer pacta suhu kamar. Penambahan larutan NaOH dihentikan setelah perbandingan OH/ Al+3 sarna dengan 2,2, yang ditandai dengan pH larutan 4, 1. Setelah itu, larutan polikation dibiarkan semalam dalam keadaan diaduk pacta suhu kamar.
Liat berpilar ini, disamping cocok untuk bermacam-maalm aplikasi analitik juga dapat digunakan
sebagai pendukung katalis (komponen aktit) yang bersifat katalitik. Hal-hal yang menguntungkan bagi liat berpilar sebagai pendukung katalis, diantaranya; luas permukaan yang tinggi, bentuk porositas yang khas, mempunyai kestabilan termal yang cukup daD mempunyai permukaan aktif secara katalitik. Penggabungan liat berpilar dengan komponen aktif, yang bersifat kataIitik, biasanya logam-logam transisi, seperti; Cu, Ni, Pt, Mn, Fe, dan Co akan diperoleh suatu bahan katalis yang lebih elektif daD selektif sesuai dengan sifat katalitik logam transisi yang digunakan [4,9].
Sifat -sifat aktifitas katalitik dari oksida mangan sangat menarik untuk dipelajari. Penelitian-penelitian yang telah dilakukan yang berhubungan dengan sifat-sifat katalitik mangan oksida di antaranya, dekomposisi potasium perklorat di dalam larutan, dekomposisi hidrogen peroksida dan oksidasi CO, penyerapan merkuri dari gas buangan, oksidasi gas naftalen, oksidasi karbon monoksida dan metana dari hasil peleburankayudan dekomposisi NO [10, 11,12].
Karbon monoksida adalah gas yang sangat berbahaya daD sangat beracun terhadap manusia daD mamalia, karena CO ini bereaksi sangat cepat dan terikat kuat sekali dengan hemoglobin darah, sehingga dapat menghalangi terjadinya pengangkutan oksigen ke seluruh tubuh oleh darah. CO merupakan salah satu sumber pencemaran udara dan dihasilkan dari pembakaran yang tidak sempurna akibat kekurangan oksigen pada bahan yang mengandung karbon. Sumber karbon monoksida yang tidak terkontrol berasal dari pembakaran batubara, gas buangan kendraan bermotor, pabrik kalsium karbida, operasi pembakaran, penambangan daD rokok. Di dalam bidang katalis, gas CO ini sering digunakan sebagai uji sifat aktifitas bahan katalis [2].
Di dalam penelitian ill dibahas pembuatan katalis oksida mangan berpendukung bentonit berpilar alumina untuk digunakan sebagai oksidasi gas karbon monoksida (CO). Mangan didispersikan ke permukaan pendukung dengan cara impregnasi dari larutan prekursor mangan (II) asetat. Karakterisasi katalis dilakukan dengan penentuan luas permukaan spesifik (metode BET) daD penentuan ruang basal (xrd) untuk pengujian terhadap adanya pembentukan
Pemilaran Bentonit
Ca-Bentonit ditimbang 5 g dan dilarutkan dalam 500 mL air demineralisasi. Suspensi diaduk kira-kira 1 jam pada suhukamar. Lamtan polikation ditambahkan
sedikit demi sedikit ke dalam suspensi bentonit yang sedang diaduk. Setelah penambahan larutan polikation, pH lamtan diatur menjadi 3,8 dengan penambahan HCl 0,1 M. Lamtan tetap diaduk sernalam pada suhu kamar. Selanjutnya, campuran ini disentrifugasi dengan kecepatan 10.000 rpm selama 30 menit. Endapan yang
Pemhuatan Dan Karakterisasi Kalalis Oksida Mangan Dengan Pendukung Bentonit Berpilar Alumina Untuk Oksidasi Gas CO (Adel Fisli)
Pengukuran aktifitas katalis
Pengukuran aktifitas katalis dilakukan dengan menggunakan alat Reaktor alir RDP 830 dari ~nci
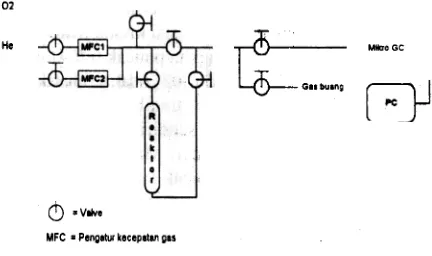
Technologies, Perancis yang dihubungkan secara online dengan Micro GC Hewlett-Packard model QUAD. Micro-GC dikontrol dan data diproses dengan bantuan perangkap lunak dari HP EzChorm Chromatography Data System. Sedangkan gas umpan yang digunakan adalah S% CO/He dengan kecepatan O,S mL/detik. Skema Reakor alir RDP 830 dapat dilihat pada Gambar 1,
HASIL DAN PEMBAHASAN
diperoleh dicuci dengan air hangat suhu 60°C sampai airbasil cucian menunjukkan reaksi negatif dengan pereaksi AgNO, 0,1 M. Padatan dikeringkan dalam oven semalam pada sUhu 80°C dan dikalsinasi pada suhu 400°C dengan kecepatan kenaikan suhu 5 °C/menit selama 6 jam. Pembuatan katalis Mangan oksida didukung oleh bentonit beJl)ilar.
Penempelan katalis mangan pada pendukung bentonit berpilar dilakukan dengan cara impregnasi basah. 2 g bentonit berpilar yang telah dikalsinasi, dilarutkan dalam 40 mL air demineralisasi dan suspensi diaduk kira-kira 1 jam. 5 mL larutan garam prekur.sor (CH3COO)2Mn 0,5 M ditambahkan tetes demi tetes dengan kecepatan 0,05 mL/detik ke dalam suspensi bentonit dalam keadaan diaduk pada suhu 70°C. Setelah penambahan larutan prekursor, larutan tetap diaduk pada suhu 70°C sarnpai larutannya menjadi kental. Padatan yang diperoleh dikeringkan di dalam oven pada suhu 120°C selama 24 jam dan selanjutnya dikalsinasi pada suhu 400°C selama 6 jam dengan kecepatan kenaikan suhu 5°C/menit.
Karakterisasi.
Luas permukaan spesifik sampel ditentukan dengan alat Quanta.s-orb, Quanta Chrome. Gas campuran N2/He (x(N2)=0,1 -0,35 dibuat dengan bantuan alat ma.s.s flow controller. Proses isotermal adsorbsi daD desorbsi oleh sampel dilakukan pada suhu 77 K. Luas permukaan spesifik dihitung menggunakan persamaan Bruneur-Emmet-Teller (BET).
Difraktogram sinar-x diperoleh dengan menggunakan alat difraksi sinar-x dengan sumber CuKa., A = 1,54 nm.Ada dua cara pengambilandifraktogram, yaitu; pengukuran sudut 28 antara 2 -10° untuk
menentukan ruang basal daTi liat berpilar dan pengukuran sudut 28 antara 10 -80° untuk menentukan rasa oksida mangan yang terbentuk pada permukaan bentonit.
Untuk menentukan ketahanan termal dilakukan dengan alat STA Setaram TAG 24 S, France sampai suhu 800°C dengan kecepatan kenaikan suhu 15°C/menit.
Pembuatan katalis oksida mangan
Di dalam pembuatan polikation All), jumlah polikation All) yang terbentuk, tergantung pacta asal reaktan, konsentrasi awal, kecepatan penambahan reaktan dan lamanya penuaan [I]. Penambahan NaOH secara lambat pacta suhu kamar, akan diperoleh All) 90 % [13], sedangkan pacta perbandingan mol OHI Al)+ = 2,2 diperoleh mikroporos liat berpilar yang paling besar setelah polikation ini terpilar [14].
lumlah polikation yang dimasukkan ke dalam antar lembaran bentonit ini adalah Al/bentonit = 10 mmol/g. Didalam literatur disebutkan, bahwa bervariasi sekali jumlah perbandingan Al/liat yang digunakan sebagai pemilar, namun pacta umumnya berkisar antara 5 -20 mmol/g liat. Perbandingan polikatioan dengan liatyang lebihrendah «0,6 mmoVg) tidak memperlihatkan ruang basal yangjelas dan tidak
menunjukkan kestabilan termal, sedangkan komposisi AVliat > 0,6 mmoVg memperlihatkan ruang basal yang jelas dan tajam setelah dikarakterisasi dengan XRD [15]. Penempelan prekursor garam mangan pada permukaan bentonit dan bentonit berpilar dengan tara impregnasi, disebabkan karena volume larutan prekursor melebihi dari pacta volume pendukung. lumlah mangan yani diimpregnasi diperhitungkan berdasarkan basil akhir padatan katalis dengan perbandingan MnO2/g liat= 10% [4].
Karakterisasi
02 Hasil pengukuran luas permukaan spesifik
bentonit, bentonit berpilar daD katalis mangan oksida berpedukung bentonit berpilar dapat dilihat pada Tabel
1. Setelah bentonit dipilarisasi dengan polikation aluminium, luas permukaan spesifiknya meningkat dengan tajam, daTi 46 m2/g menjadi 147,6 m2/g. Narayanan [16] melaporkan, bahwa pemilaran Na-montmori//onite dengan polikation aluminium mengakibatkan terjadinya peningkatan luas permukaan
spesifik dari 27,43 m2/g menjadi 169,56 m2/g. Proses pemilaran akan mengakibatkan terjadinya pengembangan ruang antara lembaran Garak ruang
basal) daD terbentuknya sistem pori yang baik, sehingga
He _.GC
~
r;]J
(!) -Vllie
MFC -PengatUl ke,epetan ge.
Gambar 1. Diagram skematik reaktor alir RDP 830 yang dihubungkan secara online dengan micro GC.
Pro.fidi~g Pertemuan llmiah llmu PengetaJ,uan dan Teknologi Bahan 2002
Serpong, 22 -,23 Oktoher 2002
ISSN 1411-2213
InfoQt13Si yang lebih penting daTi pola difraksi ini adalah tel:iadinya pergeseran puncak setelah bentonit ini dipilarisasi. dari 9,05 (9,75 AO) meltjadi 5,05 (17,48 AO). lni n1enunjukkan, bahwa jarak ruang basal yang awaJnya 9,75 Ao pada bentonit tanpa dipilarisasi meningkat menjadi 17,48 A ° setelah bentonit dipilarisasi. Sesuai dengan yang dilaporkan oleh Canizares [8], bahwa mineral montl"orillonite dipilarisasi dengan palikation alutninium ,\kan meningkatkan jarak ruang basal menjadi sekitar 18 Ao. Penambahan ini lebih kurang samadengan ukuran dimensi dari polikation itu sendiri (9-11 A O). memperbesar hJas pennukaan liat setelah dipilarisasi [7].
Tilb~t 1. Hasil pengukuran luas permukaan spesitik (BET) sampel bentonit, bentonit berpilar dan mangan berpendukung bentonit berpilar.
,-,--i No Jenis Sampel
r-:;-
f-~-~I
I 6~ 'cl
Bent-AI 10 mmol
Mn-Bent-AiIO nunal
\
t\
J
I
'\iJ\J'J~\
"V'
"'l
,
, ...I .., -oT-r",-. 0 ' 0 .., ..!
I.,
.",
...
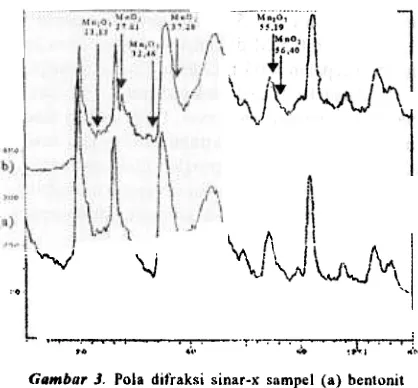
G"mbar J. Poll dit'raksi sinar-x sampel (a) bentonit berpilar AI dan (b) mangan oksida belJlendukung bentonit
Pola difraksi sinar-x pada katalis mangaQ, didukung oleh bentotut berpilar setelah dikalsinasi pada suhu 4()O"C, dapat dilihat pada Gambar 3. Menumt data base yang dikeluarkan oleh JCPDS- International Centre jor DifractiQn Data, bahwa MnO2 jenis Pyrolusite (i 2-0716) memperlihatkan 3 puncak reflektan terl>esarpada 28,401"(100),37,280"(50) dan 56,402"(50), sedangkan Mn2O) jenis Bixb.yite-C (41-1442) memperlihatkan 3 puncak reflektan terbesar pada 32,95 1"(1 (){), 55,1~1'(28)dan23,131"(16). Pada katalisMo yang didukung oleh bentonit berpilar adanya puncak reflektan 27,81" terjadinya pergeseran yang sehamsnya 28,4"dari Mn°2 yang terlihat denganjelas. Pergeseran ini kemungkit1an disebaQkan terjadinya interaksi salah satu sisi kristal MnO2 dengan permukaan benton it, sehingga mempengamhi jarak sisi kristal MnO2 yang berinteraksi tersebut. Sedangkan puncakreflektan lain dari MoO]' yaitu; 37,28" daD 56,402", tidak terlihat dengan jelas karena terjadinya tumpang tindih, yang berasal daTi puncak r~/lektan bentonit itu s~ndiri. Puncak reflektan 32,951" (lOll) yang berasal daTi Mn2O), juga terlihat dengan jelas, sedangkan puncak lainnya daTi Mn2O) tidak terlihat dengan jelas karena terjadinya tumpang tindih deng:ln puncak reflektan daTi bentonit. Dari basil kar,lkteisasi dengan XRD ini dapat disimpulkan, bahwa katalis mangan berpendukung bentonit berpilar daD setelah dikalsinasi pacta suhu 400"C selama 6 jam Setelah katalis mangan terdispersi pada
permukaan pendukung, maka tet:iadi penurunan luas per~ukaan spesifiknya dari 147,6 m2/g menjadi 62,6 m2/g (Mn-Bent-Al 10 mmol). Pada proses
impregnasi, terjadi pendispersian mangan pad a permukaan pendukung, sehingga terjadi penumnaliluas permukaan. Sesuai dengan yang dilaporkan oleh Gandia (4), bahwa impregnasi prekursor Mn(NO3)2 pada monotmori//onite berpilar alumina mengakibatkan terjadinya penurunan luas permukaan spesifik sebesar 300/0, Faktor lain )"a11g mempengaruhi di~rsi komponen aktif pada pendukung katalis adalah jenis garam prekur.\'or yapg digunakan. Kapteijn [17] melaporkan, bahwa prekur sor mangan(II) asetat terdispersi lebih tinggi pada pendukung alumina hila dibandingkan dengaQ prekur .'Ior mangan(Il) nitrat. Hal ini disebabkan karena teIjadi interaksi asam dan basa gugus permukaan-OH, yang ada pada pendukung dengan gugus asetat yang ada pada prekursor.
Hasil pengukuran pola difraksi sinar-x terhadap sampel bentonit dan bentonit berpilar pada 28 antara 2-10 dapat dilihat pada Gambar 2. Pada bentonit tanpa berpilar (Gambar 2a), terlihat adanya puncak reflektan pada 9,050 (9,75 AO). Puncak ini agak lebardanlemah di~ebabkan oleh tidak homogennya jarak ruang basal dari bentonit tanpa berpilar. Setelah bentonit dipilarisasi dengan alumnia (Gambar 2b), maka terjadi perubahan bentuk puncak intensitasnya menjadi lebih tinggi dan lebih runcing. Ini menunjukkan, bahwa adanya peningkatan homogenitas pada jarak ruang basal.
800
600
8 on
200
(b)
La:1-.
.~ 0
~ 4 v ~ 'v 2 4 6 8
28 28
Gambar 2. Oitraksi sinar-x sampel (a) bentonit tanpa
Pemhuatan Dan Karakterisasi Kalalis Oksida Mangan Dengan Pendukung Bentonit Berpilar Alumina Untuk Ok.vidasi Gas CO (Adel Fisll)
suhu 305-377 °C.
' ;0""".;0,'.;;"."'"""'"'~'~'~~.;t
"-,,",
-~-".
~'!--!!! ,:,~
~.~=~~:~
terbentuknya fraksi oksida mangan Mn°2 dan Mn2O3. Mangan dapat membentuk bermacam-macam rasa oksida kristalinnya, yang secara umum tergantung pacta suhu kalsinasi, yang merupakan aspek termodinamikanya. Kanungo [10 J melaporkan perubahan rasa daTi a.-MnO2 menjadi ~-MnO2 pada daerah suhu 200 -400°C. Perubahan rasa Mn°2menjadi ~O3 teIjadi pada daerah suhu 500-700°C. Gandia [4J melaporkan, bahwa kalsinasi mangan yang didukung oleh montmorillonite pacta suhu 500°C memperlihatkan terbentuknya fraksi MnO2 daD Mn2O3'
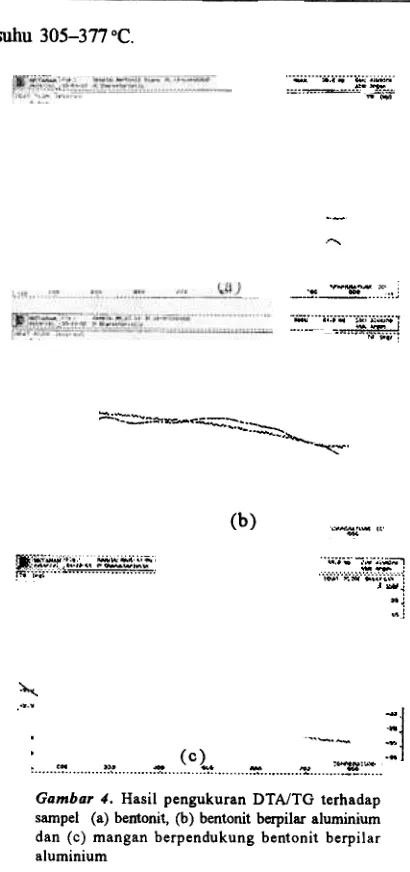
Hasil analisis DTAfTG daTi bentonit, bentonit berpilar daD mangan berpendukung bentonit berpilar dapat dilihat pada Gambar 4, Kurva DT A pada bentonit (4a) memperlihatkan teIjadinya dua puncak endotermik. Puncak endotermik pertama terjadi pada suhu sekitar
144 °C dan bersamaan dengan itu teIjadinya kehilangan berat, yang dapat dilihat pada kurva TG, Puncak ini berasal daTi pembebasan air yang terikat secara fisika pada permukaan lembaran bentonit. Pada suhu 718°C, terlihat adanya puncak endotermik pada kurva DTA daD bersamaan dengan itu, tejadi pengurangan atau kehilangan berat pacta kurva TG. lni disebabkan teIjadinya dehidrasi daTi gugus hidroksil yang terikat pacta lembaran silikat daD diikuti runtuhnya lembaran liat
~--=::'::"~~--"""-~::-:.:~"",----;:--'
(b)
"-,~"
...
ifi;~-:~~\.;:i~;;.~?~;;:;
:;-';,..-;,;0,';''-*-"-""""--'
~""';
...w,
:j
: 0'"
~~
.~
.( C ) ""'N'"'O,
~~ ~ ~ ~~ ~ ~ ~ Gambar 4. Hasil pengukuran DTAITG terhadap
sampel (a) bentonit, (b) bentonit berpilar aluminium dan (c) mangan berpendukung bentonit berpilar aluminium
Uji aktifitas katalitik
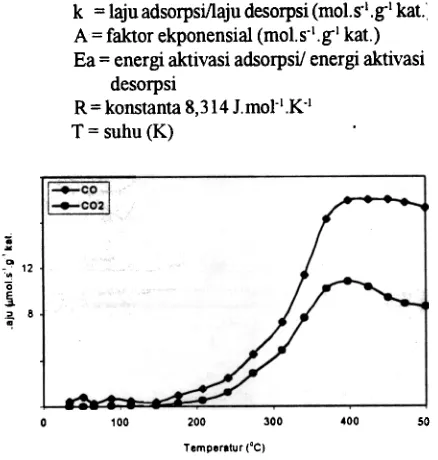
Uji aktifitas katalitik terhadap oksidasi CO oleh katalis mangan berpendukung bentonit berpilar pada suhu 30 -500°C, dapat dilihat dalam Gambar 5. Pada suhu 30°C telah memperlihatkan adsorpsi CO oleh katalis, demikian pula laju adsoIbsi maksimum CO dan desorbsi maksimum CO2 terjadi pada suhu sekitar 400°C dimana keadaan steady state tercapai pada suhu ini. F. Kapteijn
[17] melaporkan, bahwa hasil analisis FTIR pada suhu rendah 150 K (-123 DC), dimana CO telah teradsorpsi pada permukaan katalis mangan berpendukung alumina. Menurut Arrhenius, pada jarak suhu tertentu adanya hubungan linier antara laju reaksi dengan suhu, yang dapat digambarkan dalam persamaan sebagai berikut [18].
dimana: Pacta bentonit berpilar alumina (4b), puncak
endotermis pacta suhu sekitar 140 tetap acta yang berasal daTi pelepasan air yang terikat secara fisika pacta permukaan bentonit. Sedangkan puncak endotermik pacta suhu 718°C tidak terlihat lagi setelah bentonit dipilarisasi, yang menunjukkan tidak terjadi runtuhnya lembaran bentonit pacta suhu ini. Dari kurva DTAffG ini dapat disimpulkan bahwa adanya peningkatan ketahanan termal setelah bentonit dipilarisasi dengan alumina. Sesuai dengan yang dilaporkan oleh Occelli
[7], bahwa proses pemilaran dapat mengakibatkan pengembangan ruang antar lembaran sehingga memperbesar luas permukaan, menjaga secara permanen ruang antar lembaran supaya jangan sampai runtuh akibat daTi pengaruh suhu atau meningkatkan ketahanan termal. Canizares [8] juga melaporkan, bahwa pacta bentonit berpilar, 50% air yang terserap pacta permukaan akan hilang pacta suhu 150°C, sedangkan sisa air lainnya yang terserap di dalam struktur mikropori lembaran silikat dan bahan pemilar yang akan mulai hilang secara gradual pacta suhu diatas 150°C.
Hasil pengukuran DT A pacta mangan berpendukung bentonit berpilar (Gambar 4c) memperlihatkan puncak eksotermik pada suhu 360°C, yang merupakan basil pembentukan oksida mangan, yang diikuti dengan penguapan asetat daTi prekursor mangan asetat. Adanya penguapan asetat ini, dapat dilihat pacta kurva TG, yaitu terjadinya penurunan. Sesuai dengan yang dilaporkan oleh F. Kapteijn [17], bahwa oksida mangan berpendukung alumina, yang dibuat daTi prekur.50r mangan asetat, terjadi pacta
Ea
Ink=lnA- .(1)
Prosiding Pertemuan llmiah Ilmu Pengetahuan dan Teknologi Bahan 2002
Serpong, 22 -23 Oktober 2002
ISSN1411-2213
aktivasi adsorpsi
CO antara 5,53 -14,59 kkal.mol"l dan
dengan faktor konversinya antara 4,3 -45,0 %.
Sedangkan
gas umpan yang digunakan adalah 5% CO
di dalam udara.
k = laju adsorpsi/laju desorpsi (mol.s.1.g-1 kat.: A= faktor ekponensial (mol.s'I.g-1 kat.) Ea = energi aktivasi adsorpsi/ energi aktivasi
desorpsi
R = konstanta 8,314 J.motl.K-1
T = suhu (K) Tabel 2. Energi aktivasi absorbsi CO daD
desorbsi CO2 dari oksidasi CO oleh katalis oksida mangan berpendukung bentonit berpilar alumina.
r-=- --
I
--co
~o.!:.
.
~-~ 12 "!
I;
i
~ 8
c:
--~
0 100 200 300 400
Temperltur ('C)
Gambar 5. Laju adsorpsi CO dan laju desorpsi CO2 oleh katalis mangan berpendukung bentonit berpilar alumina
pada suhu 30 -500 'C.
50
Hasiloksidasi CO dengan katalis oksida rnangan berpendukung bentonit berpilar alumina pacta suhu 150 "C sampai 375 DC, mengakibatkan acta hubungan linier yang mengikuti plot .4rrheniuL~' Hubungan linier antara laju adsorbsi CO dan desorbsi CO2 pada suhu
150-375"C dapat dilihat pacta Gambar 6. Dari rnasing-masing persamaan linier adsorbsi CO dan desorbsi CO2 akan diperoleh energi aktivasi seperti yang diperlihatkan pacta Tabel 2. Dan hasil penghitungan energi aktivasi memperlihatkan, bahwa intereaksi antara gas CO dengan kata.lis oksida mangan berpendukung bentonit berpilar alumina termasuk dalam kelompok kemisorpsi rendah karena nilai energi aktivasinya < 15 kkal mol-) (63 kJmol"l) [9]. Hasil ini masuk da.lam batasan hasil penelitian yang dilaporkan oleh Kanungo [10], bahwa oksidasi CO oleh katalis MnO2 dan Mn°2-CuO, yang dibuat daTi bermacam-macam prekurL~or dengan prosedur yang berbeda-beda, memberikan energi
Faktor konversi dan rasio CO2/CO daTi oksidasi CO oleh katalis mangan oksida berpendukung bentonit berpilar dapat dilihat pada Gambar 7. Konversi CO (perbandingan CO yang terserap dengan CO umpan) pada awal reaksi pada suhu 30°C cukup rendah dengan
nilai 2,85 %. Penyerapan CO terns meningkat dengan suhu dinaikkan. Penyerapan maksimum CO terjadi pada suhu sekitar 400°C dengan nilai konversi maksimum mencapai 63,9%. Pada suhu diatas 400°C laju penyerapan CO tidak bertambah lagi dengan meningkatnya suhu, yang mana keadaan .\'tedy state telah tercapai.
Oksidasi CO dalam proses katalitik, ada dua kemungkinan reaksi karbon monoksida terjadi, yaitu [9]; CO(su) + Dcat ~ CO2(su) + []cat (1)
2CO(gu) ~ C(adl,) + CO2(gu) .(2)
reaksi pertama (1) adalah reaksi CO dengan pennukaan oksida logam yang bersifat katalitik menghasilkan gas CO2 daD membentuk kekosongan oksigen pacta pennukaan logam. Penentu laju reaksi persamaan (1) ditentukan oleh tahap pelepasan CO2 daTi pennukaan katalis yang sangat dipengaruhi oleh suhu. Jika suhu
diturunkan maka laju pelepasan CO2 juga turun dengan
om .¥
"0
.,~
-0 §.
" ~
.£
0 100 200 300 400 Tcnperatur ("C)
Gambar 7. Konversi CO clan rasio (CO1/CO) dari oksidasi CO oleh katalis mangan oksida berpendukung bentonit
berpilar alumina
1/T(K)
Gambar 6. Hubungan linier antara laju adsorbsi CO dan desorbsi CO2 oleh katalis ok.~ida mangan berpendukung bentonit berpilar pada suhu 150 -375 .C
Pembuatan Dan Karakterisasi Kalalis Oksida Mangan Dengan Pendukung Bentonit Berpilar Alumina Untuk Ok.~idasi Gas CO (Adel FisJi)
katalis oksida mangan berpendukung bentonit berpilar tem1asuk dalam kelompok kemisorpsi rendah karena nitai
energi aktivasinya < 15 kkal motl (63 kJmotl).
DAFTARPUSTAKA
[I]. A. VACCARI, Preparation and Catalitic Properties of Cationic and Anionic Clays, Catal. Today, 41, (1998), 53-71.
[2]. K. OTHMER, Encyclopedia of Chemical Tecnology,4th ed. 5 and 6, John Wiley and Sons, NewYorli:, (1993).
[3]. A. C.D. NEWMAN, Chemistry of Clays and Clay .Mineral, Mineralogical Society (6), Longman Sci.
Tech., England, (1987).
[4]. L.M. GANDIA, M.A. VICENTE, A. GIL, Preparation and Characterization of Manganese Oxide Catalysts Supported on Alumina and Zirconia-Pillared Clays, Appl. Catal. A: General,
196, (2000), 281-292.
[5]. K. BAHRANOWSKI, M. GASIOR, A.KlELSKI, J. PODOBINSKI, E.M. SERWICKA, L:A.
VARTIKIAN, K. WODNICKA,
Physico-Chemical Characterization and Catalytic Properties of Cupper-Doped Alumina -Pillared Montmorillonites, Clays Clay MineraL~, 46, (1998),98-102.
[6]. A. GIL., M.A. VICENTE, L.M. GANDIA, Main Factors Controlling The Texture of Zirconia and Alumina Pillared Clays, MicropO1: Mesop°1: Mater., 34,(2000),115 -125.
[7]. M.L. OCCELl, J.A. BERTRAND, S.A.C. GOUL, J.M. DOMINGGUEZ, Physicochemical Characterization of A Texas Montmorillonite Pillared with Polyoxocations of Aluminum Part I: The Microporous Structure, Microp. Me.fop. Mater, 34, (2000),195-206.
[8]. P. CANIZARES, J.L VALVERDE, MR SUNKOU, C.B. MOLINA, Synthesis and Characterizatioftof PILCs with Singel and Mixed Oxide Pillars Prepared from Two Different Bentonit. A Comparative Study, Microp. Mesop. Mater, 29, (1999),267-281.
[9]. J. T. RICHARDSON, Principles of Cata./.vst Development, Plenum Press, New York, (1989), 220-222.
[10]. S.B. KANUNGO, Physicochemical properties of Mn°2 and MnO:'CuO and Their Relationship with the catalytic activity for H2O2 Decomposition and CO oxidation,J. Catal, 58, (1979), 419-435. [11]. S. CAVALLARO, N.BERTUCCIO, P..
.ANTONUCCI, N. GIORDANO, Mercury Removal from Waste Gass by Manganese Oxide Acceptors,J: Catal., 73, (1982), 337-348. [12]. J. CARNO, M FERRANDON, E. BJORNBOM, S.
JARAS, Mixed Manganese Oxide/Platinum cepat, dan sebaliknya jika suhu dinaikkan maka laju
pelepasan CO2 meningkat dengan cepat [19]. Reaksi persamaan (2) diakibatkan oleh dekomposisi dari molekul CO membentuk residu karbon dan karbon dioksida. Residu karbon yang terbentuk ini teradsorpsi pada permukaan katalis yang menyebabkan katalis terdeaktivasi. Laju reaksi persamaan (2) relatifkecil tetapi
semakin rendah suhu maka nilainya bertambah berarti. Sumber lain terbentuknya residu karbon adalah adatlya 2 kekosongan oksigen pada permukaan logam bertetangga sebagai basil reaksi persamaan (1), seperti yang diperlihatkan dalam reaksi berikut;
CO ,+ [ ]cat -7 COIdI...R8I
(3)
COBdl+[]cat ~CIdI +OIdl (4)
Sesuai dengan keterangan diatas, seperti yang diperlihatkan pada kurva rasio CO2/CO didalam Gambar 7, bahwa pada suhu 66°C nilai rasio CO2/CO cukup rendah yaitu 4,5 %. lni menunjukkan, bahwa pada suhu rendah, laju reaksi pesamaan (I), yang ditentukan oleh pelepasan CO2, relatiflambat meskipun tetap teIjadi adsorpsi CO. Pada suhu rendah ini, laju reaksi persamaan (2) lebih berarti berlangsung. Sehingga basil darileseluruhan reaksi ini pada suhu rendah, CO2 yang terbentuk, sangat kecil sekali. Semakin meningkat suhu maka laju reaksi persamaan reaksi (I) meningkat dengan cepat. Hal ini dapat dilihat daTi peningkatan kurva rasio CO2/CO dengan meningkatnya suhu. Pada suhu340°C tercapainya rasio CO2/CO maksimum dengan nilai 67,24%. Pada suhu lebih besar daTi 370°C adsorpsi CO telah mulai memperlihatkan kejenuhan sedangkan persamaan reaksi (3) dan (4) terns meningkat dengan meningkatnya suhu, akibatnya teIjadinya penurunan daTi kurva rasio CO2/CO. Dari data tersebut dapat disimpulkan bahwa pada suhu lebih besar daTi 370, adsorpsi CO telah mencapai kejenuhan sedangkan laju pembentukan residu karbon tetap meningkat dengan meningkatnya suhu.
t(ESIMPULAN
Bentonit dipilarisasi dengan polikation aluminium Al1~jenis Keggin [AI,~O 4(OH)24(H20) 12]7+ menghasilkan bahan berpilar yang mempunyai ruang basal Garak antara lembaran), luas permukaan spesifik, ketahanan termal yang lebih tinggi daTi pada bentonit awalnya. Penempelan katalis mangan pada permukaan penyangga bentonit berpilar dan dikalsinasi pada suhu 400°C selama 6 jam terbentuknya fraksi Mn°4 dan Mn2O~ pada permukaan penyangga. Hasil uji aktifitas katalitik terhadap oksidasi CO pada suhu 30°C -500°C memperlihatkan aktifitas maksimum adsorpsi CO terjadi pada suhu sekitar 400°C dengan konversi maksimum 63,9% dan rasio CO2/CO maksimum terjadi pada suhu 340°C sebesar 67,24%. lntereaksi antara gas CO dengan
Pro.fiding Pertemuan llmiah llmu Pengetahuan dan Teknoulg; Bahan 2002
Serptlng. 22 -23 Oktober 2002
ISSN 1411-2213
dibandingkan dengan bentonit dipilar dengan
aluminium.
Tuti Setiawati. S, IPB-Bogor Pertanyaan
I. Teknik pengukuran untuk mengubah Co menjadi CO2 2 Bagaimana mengetahui terbentuk fraksi MnO2 dan
Mn2OJ Jawaban
I. Teknik pengukural1 yang digunakan untuk rnenentukan CO dan CO2 adalah teknik kromatografi gas yang dipasang secara online dengan reaktor uji aktifitas katalis. Gas keluaran reaktor langsung dialirk:u\ ke dalaIli kc1.olll krolrunografi sehingga gas CO daD CO2 terpisahkan, selanjutnya ditentukan 5ecara kualitatif dan kuantitatif dengan detektor TCD. 2. Untuk mengetahui terbentuknya fraksi MnO2 dan
Mn2O) ditentukan dengan difraksi sinar-x (XRD). Pola difraksi masing-rnasing spesies Mn°2 dan
Mn20., yang dihasilkan pada pengukuran XRD disesuaikan dengan pvla dif~aksi pada spesies yang sarna yang ada d..11arn data base yang dikeluarkan oleb JCPDS-/mernasional centre for diffraction data. Metode XRD ini hanya dapat menentukan MnO~ daD ~O3 secara kualitatif.
Elman Panjaitan,
P3ffi-BATAN
Penanyaan
1. Apa korelasi peningkatan mang basal dengan
ketahanan
panas pada bentonit yang ditambahkan
Keggin.
Catalysts for Total Oxidation of Model gas fromwood boilers, Appl. Catal.. A.. General, 155, (1997), 265-281.
(13]. P. H. HSU, Effect of Temperatur on The Degradation of All3 Complex, ClaysClayMiner., 45, (1997), 286-289.
(14). N.D. HlTrSON, M.J. HOEKSTRA, R.T. YANG, Control of Micro porosity of Al2O)-Pillared clays: effect of pH, calcination temperatur and clay cation exchange capacity, Micropor. Mesopor. ,"'-fater., 28, (1999), 447-459.
[15]. S.M. maMAS, M.L. OCCELL!, Effects of synthesis Conditions on the Thermal Stability of A Texas montmorillonite expanded with (AI,)O4~O)] 7+,Clays Clay Miner., 48, (2000),
304-3~.
[16). S. NARAYANAN, K. DESHPANDE, Alumina Pillared Montmorillonite: Characterization and Catalysis of Toluene Benzylation and Aniline
Ethylation, .4ppl. Caral A.. General, 193, (2000), 17-27.
(17). F. KAPTEIJN., A.D. VANLANGEVELD, J. A. MOULUN, A. ANDREINI, M. A. VUURMAN, A. M. TUREK, J. M. JEHNG, I. E. WACHS, Alumina-Supported Manganese Oxide Catalysts (I. Characterization: Effect of Precursor and Loading),J. Catal, 150, (1994), 94 -104.
(18). R.P,H. GASSER, An Introduction to Chemi.\'orption and Catalysis by Metals, Clarendon Press, Oxford, (1985), 206-252. (19). G. K. BORESKOV,Catalytic Activation of
Dioxygen, dalam Catalysis, Science and Technology, 2, Ed.:J.R. Anderson, M. Boudart,
Springer-\:t:rlag, Berlin, (1981). Jawahan
I. Korelasi peningkatan ruang basal dengan ketahanan panas pada dasarnya tidak ada, tetapi peningkatan ruang basal dan peningkatan ketahanan termal dihubungkan dengan akibat daTi pemilaran bentonit dengan polikation jenis Keggin. Hasil penelitian ini sesuai dengan literamr yang ada akibat pemilaran terjadi peningkatan ruang basal (jarak antara lembaran yang sam dengan yang lainnya) daTi 9,75 A menjadi 17,48 A, penambahan ruang basal ini diakibatkan teljadi pernasukan polikation ini diantara lembaran bentonit. Dan juga akibat pemilaran ini teljadi peningkatan ketahanan tennal , seperti yang diperlihatkan dalam Gambar 4a basil karakterisasi DTAfI'G pacta Sllhu 700°C pada bentonit tanpa pilar. Actanya puncak endotermis yang menunjukkan putusnya lembaran bentonit. Sedangkan Gambar 4b bentonit berpilar tidak acta puncak endotennis pacta suhu 700°C yang menunjukkan tidak putusnya lembaran bentonit.
TANYAJAWAB
Sugik Sugiantoro,
P3ffi-BATAN
Pel1anyaan
I. Apa fungsi penambahan
pilar alumina
2. Bagaimana
j ika lansgung
ditambah Mn asetat
tanpa
pemberian
pilar alumina
Jawabm
1. Fungsi penambahan
pilar pacta
bentonit ini adalah
untuk membuka ruang antara lembaran bentonit
secara permanen dan menghasilkan ruang-ruang
berdimensi
molekularyang mempunyai
sistem
pori
yang cocok untuk aplikasi katalitis. Akibat dari
pemilaran menghasilkan
bahan yang mempunyai
luas permukaan,
dan ketahanan
termal yang lebih
tinggi hila dibandingkan dengan bentonit tanpa
dipilar.
~. Jika Mn II asetat langsung ditambahkan
ke dalam
bentpnnit tanpa dipilar (tanpa aluminium) akan
menghasilkan bahan katalis yang mempunyai
aktifitas dan ketahanan termal yang rendah hila
264