PRODUKSI DAN KARAKTERISASI BAKTERIOSIN ASAL
Lactobacillus plantarum 1A5 SERTA AKTIVITAS
ANTIMIKROBANYA TERHADAP
BAKTERI PATOGEN
SKRIPSI
THEO MAHISETA SYAHNIAR
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR 2009
RINGKASAN
THEO MAHISETA SYAHNIAR. D14051400. Produksi dan Karakterisasi
Bakteriosin Asal Lactobacillus plantarum 1A5 serta Aktivitas Antimikrobanya terhadap Bakteri Patogen. Skripsi. Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Irma Isnafia Arief, S.Pt., MSi.
Pembimbing Anggota : Dr. Ir. Rarah Ratih Adjie Maheswari, DEA.
Daging merupakan salah satu penyumbang protein hewani bagi penduduk Indonesia namun bersifat perishable atau mudah rusak khususnya oleh aktivitas mikroorganisme pembusuk. Alternatif dalam mengatasi masalah tersebut adalah dengan pengolahan dan pengawetan atau preservasi. Metode preservasi yang telah banyak diaplikasikan adalah penambahan bahan pengawet pada makanan, baik bahan pengawet sintetis maupun yang alami. Pemilihan bahan pengawet alami, terutama bakteriosin yang sangat dianjurkan pemakaiannya. Salah satu isolat lokal asal daging, yaitu Lactobacillus plantarum 1A5 telah mampu menunjukkan aktivitas antimikrobanya secara invitro terhadap ketiga bakteri indikator yang merupakan bakteri patogen.
Penelitian ini bertujuan untuk mempelajari produksi substrat antimikroba bakteriosin yang dihasilkan pada media berbeda, karakterisasinya melalui sensitivitas terhadap enzim katalase dan enzim proteolitik dan penghambatannya terhadap bakteri patogen, antara lain Staphylococcus aureus ATCC 25923, Salmonella typhimurium ATCC 14028 dan enteropathogenic Escherichia coli K11 (EPEC K11) serta konsentrasi penghambatan minimumnya. Bakteriosin Lactobacillus plantarum
1A5 diproduksi melalui media dengan tiga inducer yang berbeda (NaCl 1%, kombinasi NaCl 1% dan YE 3% dan tripton 1%) dan dikondisikan pada pH 5 dan pH 6. Pengujian produksi dan karakterisasi bakteriosin dilakukan melalui uji antagonistik dengan metode difusi sumur agar terhadap ketiga bakteri indikator yang merupakan bakteri patogen. Tiga hasil uji antagonistik terbaik dari produksi bakteriosin tersebut dilanjutkan dengan purifikasi bakteriosin melalui presipitasi protein dengan amonium sulfat. Hasil terbaik dari purifikasi tersebut dikarakterisasi melalui uji sensitivitas terhadap enzim katalase dan enzim proteolitik serta terakhir dilakukan penentuan persentase MIC dan MBC dengan metode kontak terhadap
Staphylococcus aureus ATCC 25923.
Hasil penelitian menunjukkan bahwa aktivitas penghambatan bakteriosin
Lactobacillus plantarum 1A5 yang diproduksi pada keenam media (supernatan antimikroba yang dihasilkan dari media pertumbuhan dengan inducer NaCl 1%, kombinasi inducer NaCl 1% dan YE 3% serta inducer tripton 1% yang masing-masing dikondisikan pada pH 5 dan pH 6) tidak berbeda sehingga purifikasi bakteriosin dilakukan pada media dengan masing-masing inducer (NaCl 1%, kombinasi NaCl 1% dan YE 3% dan tripton 1%) yang dikondisikan pada pH 6 untuk menghilangkan pengaruh antimikroba dari asam organik. Purifikasi parsial bakteriosin yang menunjukkan aktivitas penghambatan terbesar pada uji antagonistik adalah bakteriosin yang dihasilkan dari media dengan inducer tripton 1%. Bakteriosin kasar 1A5 dikarakterisasi melalui uji sensitivitas terhadap enzim katalase dan enzim proteolitik. Hasil karakterisasi tersebut mengindikasikan bahwa
komponen aktif yang bekerja sebagai antimikroba adalah bakteriosin yang merupakan komponen protein dan bukan hidrogen peroksida.
Aktivitas penghambatan bakteriosin kasar Lactobacillus plantarum 1A5 yang dihasilkan dari media produksi dengan inducer tripton 1% pada kondisi pH 6 juga dilihat dari penentuan nilai konsentrasi penghambatan minimumnya baik berupa
MIC maupun MBC terhadap Staphylococcus aureus ATCC 25923. Nilai MIC
bakteriosin kasar 1A5 terhadap Staphylococcus aureus ATCC 25923 menunjukkan bahwa konsentrasi minimum bakteriosin kasar 1A5 yang dibutuhkan sebesar 70% sedangkan pada nilai MBC-nya dibutuhkan konsentrasi bakteriosin kasar 1A5 sebesar 80%.
Kata-kata kunci: Lactobacillus plantarum, bakteriosin, uji antagonistik, MIC dan MBC
ABSTRACT
Production and Characterization of Bacteriocin from Lactobacillusplantarum
1A5 and It’s Antimicrobe Activity to Patogenic Bacteria
Syahniar, T.M., I.I. Arief and R.R.A. Maheswari
The aims of this research were to study antimicrobial activity of bacteriocin produced by lactic acid bacteria Lactobacillus plantarum 1A5 in six different media (media with NaCl 1%, combination of NaCl 1% and YE 3%, and trypton 1% inducers that were conditioned on pH 5 dan pH 6, respectively). Characteristic of bacteriocin 1A5 determined by catalase and proteolytic enzymes with antagonistic assay against pathogenic bacterias (Staphylococcus aureus ATCC 25923, Salmonella typhimurium ATCC 14028 and enteropathogenic Escherichia coli K11) and determination of Minimum Inhibitory Concentration (MIC) and Minimum Bactericide Concentration (MBC)’s value against Staphylococcus aureus ATCC 25923. The result showed that the inhibitory activity was produced significantly by crude bacteriocin 1A5 from media with trypton 1% inducer and was conditioned at pH 6. Characterization of active compound from crude bacteriocin 1A5 could be classified as bacteriocin neither antimicrobial compounds such as hydrogen peroxide because it was stable to catalase treatment. The other characteristic of its bacteriocin was nature proteinaeous that showed loss it’s activity after trypsin treatment against
Staphylococcus aureus ATCC 25923 and enteropathogenic Escherichia coli K11, neither Salmonella typhimurium ATCC 14028. Inhibition activity of crude bacteriocin 1A5 could explained with MIC and MBC’s value, especially against
Staphylococcus aureus ATCC 25923. MIC’s and MBC’s value needed respectively
70% dan 80% concentration of crude bacteriocin.
PRODUKSI DAN KARAKTERISASI BAKTERIOSIN ASAL
Lactobacillus plantarum 1A5 SERTA AKTIVITAS
ANTIMIKROBANYA TERHADAP
BAKTERI PATOGEN
THEO MAHISETA SYAHNIAR D14051400
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR 2009
PRODUKSI DAN KARAKTERISASI BAKTERIOSIN ASAL
Lactobacillus plantarum 1A5 SERTA AKTIVITAS
ANTIMIKROBANYA TERHADAP
BAKTERI PATOGEN
Oleh:
THEO MAHISETA SYAHNIAR D14051400
Skripsi ini telah disetujui dan disidangkan di hadapan Komisi Ujian Lisan pada tanggal 22 Oktober 2009
Pembimbing Utama Pembimbing Anggota
Irma Isnafia Arief, S.Pt. MSi. Dr. Ir. Rarah R.A. Maheswari, DEA.
Dekan Ketua Departemen
Fakultas Peternakan Ilmu Produksi dan Teknologi Peternakan
Institut Pertanian Bogor Fakultas Peternakan
Institut Pertanian Bogor
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 17 Juni 1987 di Probolinggo. Penulis adalah anak pertama dari dua bersaudara dari pasangan Sudarsono dan Emi Sumartini, S.Sos. Riwayat pendidikan penulis dimulai dari Sekolah Dasar Negeri Sukabumi 2 Probolinggo (1993-1999), Sekolah Lanjutan Tingkat Pertama Negeri 1 Probolinggo (1999-2002) dan dilanjutkan ke Sekolah Menengah Atas Negeri 1 Probolinggo (2002-2005). Penulis kemudian melanjutkan pendidikan dan diterima sebagai mahasiswa Institut Pertanian Bogor melalui jalur USMI (Ujian Seleksi Masuk IPB) pada tahun 2005. Penerapan Sistem Mayor Minor yang dilakukan oleh IPB membawa penulis pada Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor.
Selama masa pendidikan, penulis aktif dalam organisasi kemahasiswaan Badan Eksekutif Mahasiswa Fakultas Peternakan periode 2007-2008 serta dalam kepanitian kegiatan-kegiatan kampus lainnya. Penulis juga pernah menjadi asisten praktikum pada mata kuliah Dasar-Dasar Teknologi Hasil Ternak tahun ajaran 2007-2008 dan pada mata kuliah Metodologi Penelitian dan Rancangan Percobaan tahun ajaran 2008-2009.
Penulis melakukan penelitian dan penulisan skripsi yang berjudul ”Produksi
dan Karakterisasi Bakteriosin Asal Lactobacillus plantarum 1A5 serta Aktivitas Antimikrobanya terhadap Bakteri Patogen” guna memenuhi salah satu syarat untuk memperoleh gelar sarjana pada Fakultas Peternakan, Institut Pertanian Bogor.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala limpahan nikmat dan rahmat-Nya hingga akhirnya penulisan skripsi ini dapat diselesaikan dengan baik. Shalawat serta salam semoga selalu dilimpahkan kepada Nabi Muhammad SAW dan untuk keselamatan seluruh umat Islam.
Penulis juga mengucapkan terima kasih kepada seluruh pihak yang telah memberi dukungan, baik secara moril maupun materil hingga skripsi yang berjudul
”Produksi dan Karakterisasi Bakteriosin Asal Lactobacillus plantarum 1A5 serta Aktivitas Antimikrobanya terhadap Bakteri Patogen” ini dapat diselesaikan guna memenuhi salah satu syarat memperoleh gelar Sarjana Peternakan pada Fakultas Peternakan Institut Pertanian Bogor.
Substansi skripsi ini terkait tentang pengkajian lebih dalam mengenai substrat antimikroba yang dihasilkan oleh bakteri asam laktat Lactobacilllus plantarum 1A5 berupa bakteriosin kasar. Bakteriosin kasar 1A5 mampu menunjukkan aktivitas antimikrobanya terhadap ketiga bakteri patogen setelah melalui proses optimasi produksi dan proses purifikasi parsial bakteriosin. Komponen aktif yang bekerja sebagai antimikroba pada bakteriosin kasar 1A5 merupakan komponen protein.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Namun demikian, penulis telah berusaha semaksimal mungkin agar skripsi ini dapat bermanfaat bagi seluruh pihak, khususnya dalam peningkatan keamanan pangan di Indonesia melalui biopreservatif alami. Saran dan kritik yang membangun sangat bermanfaat bagi penulis.
Bogor, Nopember 2009
DAFTAR ISI Halaman RINGKASAN ... i ABSTRACT ... iii LEMBAR PERNYATAAN ... iv LEMBAR PENGESAHAN ... v RIWAYAT HIDUP ... vi
KATA PENGANTAR ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 2
TINJAUAN PUSTAKA ... 3
Mikrobiologi Daging ... 3
Bakteri Asam Laktat ... 4
Lactobacillus ... 6
Lactobacillus plantarum 1A5 ... 6
Antimikroba ... 7
Asam Organik ... 8
Hidrogen Peroksida ... 9
Bakteriosin ... 9
Mekanisme Penghambatan Senyawa Antimikroba ... 12
Enzim Proteolitik ... 13 Bakteri Patogen ... 15 Staphylococcus aureus ... 16 Salmonella typhimurium ... 16 Escherichia coli ... 17 METODE ... 19
Lokasi dan Waktu ... 19
Materi ... 19
Rancangan ... 19
Prosedur ... 20
Strain Bakteri dan Media Pertumbuhan ... 20
Produksi Bakteriosin pada Media yang Berbeda ... 21
Pengukuran pH ... 21
Pengukuran Total Asam Tertitrasi ... 21
Uji Antagonistik Bakteriosin terhadap Bakteri Indikator .... 23
Purifikasi Parsial Bakterosin ... 23
Uji Sensitivitas Bakteriosin Kasar 1A5 terhadap Enzim Katalase ... 24
Uji Sensitivitas Bakteriosin Kasar 1A5 terhadap Enzim Proteolitik ... 25
Penentuan Minimum Inhibitory Concentration (MIC) dan Minimum Bactericide Concentration (MBC) Bakteriosin Kasar 1A5 dengan Metode Kontak ... 25
HASIL DAN PEMBAHASAN ... 28
Penelitian Pendahuluan ... 28
Penelitian Utama ... 30
Produksi Bakteriosin dari Media yang Berbeda ... 30
Purifikasi Parsial Bakteriosin ... 37
Sensitivitas Bakteriosin Kasar 1A5 terhadap Enzim Katalase ... 41
Sensitivitas Bakteriosin Kasar 1A5 terhadap Enzim Proteolitik ... 43
Minimum Inhibitory Concentration (MIC) dan Minimum Bactericide Concentration (MBC) Bakteriosin Kasar 1A5 47
KESIMPULAN DAN SARAN ... 50
Kesimpulan ... 50
Saran ... 50
UCAPAN TERIMA KASIH ... 51
DAFTAR PUSTAKA ... 52
DAFTAR TABEL
Nomor Halaman
1. Batas Maksimum Cemaran Mikroba pada Daging (CFU/g)
Berdasarkan SNI No. 01-6366-2000 ... 4
2. Kelas-Kelas Bakteriosin ... 11
3. Spesifitas Pemotongan Berbagai Enzim Proteolitik ... 14
4. Penggunaan Padatan Amonium Sulfat (% Penjenuhan) ... 24
5. Kombinasi Bakteriosin Kasar 1A5 dengan Pengencer NB untuk Penentuan MIC dan MBC ... 26
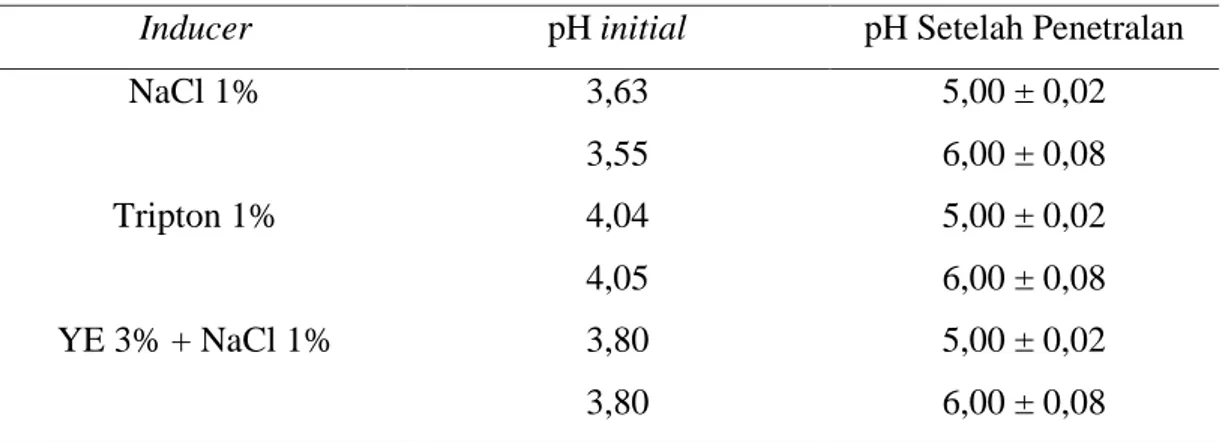
6. Kondisi pH Supernatan Antimikroba Lactobacillus plantarum 1A5 pada Media MRS Broth dengan Inducer yang Berbeda ... 31
7. Persentase Zona Hambat Supernatan Antimikroba Lactobacillus plantarum 1A5 pada Media Produksi yang Berbeda terhadap Bakteri Indikator ... 36
8. Diameter Zona Hambat Ekstrak Bakteriosin Kasar 1A5 terhadap Bakteri Indikator ... 38
9. Diameter Zona Hambat Bakteriosin Kasar 1A5 dengan Perlakuan Enzim Proteolitik terhadap Bakteri Indikator ... 44
DAFTAR GAMBAR
Nomor Halaman
1. Lactobacillus plantarum 1A5 ... 7
2. Staphylococcus aureus ... 16
3. Salmonella typhimurium ... 17
4. Escherichia coli ... 18
5. Morfologi Lactobacillus plantarum 1A5 ... 28
6. Morfologi Bakteri-Bakteri Indikator (A) Staphylocoocus aureus ATCC 25923; (B) Salmonella typhimurium ATCC 14028; (C) enteropathogenic Escherichia coli K11 ... 29
7. Nilai Total Asam Tertitrasi (TAT) pada Berbagai Kondisi pH Supernatan Antimikroba Lactobacillus plantarum 1A5 ... 32
8. Diameter Zona Hambat Supernatan Antimikroba Lactobacillus plantarum 1A5 dari Media Produksi yang Berbeda terhadap (A). Staphylococcus aureus ATCC 25923; (B). Salmonella typhimurium ATCC 14028 dan (C). Enteropathogenic Escherichia coli K11 (EPEC K11) ... 34
9. Diameter Zona Hambat Ekstrak Bakteriosin Kasar 1A5 terhadap Bakteri Indikator ... 39
10.Zona Hambat Ekstrak Bakteriosin Kasar 1A5 (dengan inducer tripton 1%) terhadap Staphylococcus aureus ATCC 25923 ... 40
11.Diameter Zona Hambat Bakteriosin Kasar 1A5 tanpa dan dengan Penambahan Enzim Katalase terhadap Bakteri Indikator ... 41
12.Zona Hambat Bakteriosin Kasar 1A5 dengan Perlakuan Enzim Katalase terhadap Staphylococcus aureus ATCC 25923 ... 43
13.Zona Hambat Bakteriosin Kasar 1A5 dengan Perlakuan Enzim Proteolitik terhadap Staphylococcus aureus ATCC 25923 ... 46
14.Penentuan Nilai Minimum Inhibitory Concentration (MIC) dan Minimum Bactericide Concentration (MBC) Bakteriosin Kasar 1A5 terhadap Staphylococcus aureus ATCC 25923 ... 48
DAFTAR LAMPIRAN
Nomor Halaman
1. Analisis Ragam Persentase Zona Hambat Supernatan Antimikroba
Lactobacillusplantarum 1A5 pada Media Produksi yang Berbeda
terhadap Staphylococcus aureus ATCC 25923 ... 58
2. Uji Kruskal-Wallis Persentase Zona Hambat Supernatan
Antimikroba Lactobacillus plantarum 1A5 pada Media Produksi yang Berbeda terhadap Salmonella typhimurium ATCC 14028 .... 58
3. Analisis Ragam Persentase Zona Hambat Supernatan
Antimikroba Lactobacillus plantarum 1A5 pada Media Produksi yang Berbeda terhadap enteropathogenic Escherichia coli K11 (EPEC K11) ... 58 4. Analisis Ragam Diameter Zona Hambat Ekstrak Bakteriosin
Kasar 1A5 terhadap Staphylococcus aureus ATCC 25923 ... 59 5. Uji Kruskal-Wallis Diameter Zona Hambat Ekstrak Bakteriosin
Kasar 1A5 terhadap Salmonella typhimurium ATCC 14028 ... 59 6. Uji Kruskal-Wallis Diameter Zona Hambat Ekstrak Bakteriosin
Kasar 1A5 terhadap enteropathogenic Escherichia coli K11
(EPEC K11) ... 59 7. Uji Kruskal-Wallis Diameter Zona Hambat Bakteriosin Kasar
1A5 dengan Perlakuan Enzim Proteolitik terhadap
Staphylococcus aureus ATCC 25923 ... 59 8. Analisis Ragam Diameter Zona Hambat Bakteriosin Kasar 1A5
dengan Perlakuan Enzim Proteolitik terhadap Salmonella
typhimurium ATCC 14028 ... 60 9. Uji Kruskal-Wallis Diameter Zona Hambat Bakteriosin Kasar 1A5
dengan Perlakuan Enzim Proteolitik terhadap enteropathogenic Escherichia coli K11 (EPEC K11) ... 60 10.Gambar Kombinasi Bakteriosin Kasar 1A5 dengan Pengencer NB untuk Penentuan MIC dan MBC ... 61 11.Gambar Presipitasi Supernatan Antimikroba Lactobacillus
plantarum 1A5 dengan Amonium Sulfat ... 61 12.Gambar Alat Sentrifuse (10000 rpm) ... 61
PENDAHULUAN
Latar Belakang
Bahan pangan asal ternak khususnya daging merupakan salah satu penyumbang protein hewani bagi penduduk Indonesia. Mutu dan keamanan pangan asal ternak tersebut perlu diperhatikan karena sifat daging yang perishable atau mudah rusak dan sangat dipengaruhi oleh keberadaan mikroorganisme. Mikroorganisme patogen yang terdapat secara alami di dalam daging, misalnya
Escherichia coli, Salmonella sp., dan Listeria sp. beresiko menimbulkan penyakit bahkan kematian. Alternatif dalam mengatasi masalah tersebut adalah dengan pengolahan dan pengawetan atau preservasi.
Metode preservasi yang telah banyak diaplikasikan adalah penambahan bahan pengawet pada makanan, baik bahan pengawet sintetis maupun yang alami. Penggunaan pengawet sintetis atau antibiotik dapat menyebabkan adanya kemungkinan toksisitas akibat residu yang masih aktif dalam daging, bahaya mikroorganisme yang resisten dan dapat menimbulkan infeksi pada konsumen. Penggunaan beberapa pengawet kimia yang dapat diserap oleh bahan organik mengakibatkan berkurangnya efektivitas bahan pengawet alami berupa antimikroba yang dihasilkan oleh bakteri asam laktat yang secara alami terdapat di dalam daging. Oleh karena itu, bahan pengawet alami lebih berpotensi untuk diaplikasikan sebagai pengganti pengawet sintetis khususnya pada daging karena tidak mengandung toksin, dapat didegradasi oleh enzim-enzim pencernaan dan lebih aman dikonsumsi.
Bahan pengawet alami berupa supernatan antimikroba yang dihasilkan oleh isolat-isolat bakteri asam laktat (Lactobacillus spp. 2B1, 1A1, 2B3, 2D1, 1D2, 2A2, 1D1, 1C3, 1B1, 1A5, 1A32 dan 1C6) asal daging telah menunjukkan aktivitas antimikrobanya terhadap ketiga bakteri uji yang merupakan bakteri patogen, antara lain Staphylococcus aureus, Escherichia coli dan Salmonella typhimurium. Aktivitas antimikroba tersebut menurut hasil penelitian Permanasari (2008) menunjukkan dominasi aktivitas dari asam organik dan Lactobacillus plantarum 1A5 menunjukkan aktivitas penghambatan paling baik yang dibuktikan dengan pembentukan rataan diameter zona hambat terbesar. Oleh karena itu, perlu dilakukan penelitian lebih lanjut mengenai aktivitas antimikroba dengan spesifikasi bakteriosin, khususnya
mempelajari optimasi produksi dan karakterisasi bakteriosin bakteri asam laktat
Lactobacillus plantarum 1A5 serta aktivitas antimikrobanya terhadap bakteri patogen.
Tujuan
Penelitian ini bertujuan untuk mempelajari produktivitas antimikroba bakteriosin asal Lactobacillus plantarum 1A5 pada media produksi yang berbeda dan karakterisasi bakteriosin 1A5 melalui sensitivitasnya terhadap enzim katalase dan enzim proteolitik serta penghambatannya terhadap bakteri patogen, yaitu
Staphylococcus aureus ATCC 25923, Salmonella typhimurium ATCC 14028 dan
enteropathogenic Escherichia coli K11 (EPEC K11). Penelitian ini juga bertujuan untuk mempelajari aktivitas antimikroba bakteriosin 1A5 melalui penentuan
Minimum Inhibitory Concentration (MIC) dan Minimum Bactericide Concentration
TINJAUAN PUSTAKA
Mikrobiologi Daging
Mikrobiologi adalah suatu cabang ilmu tentang mikroorganisme. Mikroorganisme berukuran sangat kecil, biasanya bersel tunggal, secara individual tidak dapat dilihat dengan mata telanjang tetapi hanya dapat dilihat dengan mikroskop. Mikroorganisme tersebar luas di alam dan dijumpai pula pada pangan. Jumlah dan jenis mikroorganisme yang terdapat dalam bahan pangan dapat menentukan mutu mikrobiologi dari suatu produk pangan tersebut. Hal ini akan menentukan ketahanan simpan dari produk tersebut ditinjau dari kerusakan oleh mikroorganisme. Populasi mikroorganisme yang berada pada suatu bahan pangan umumnya bersifat sangat spesifik dan tergantung pada jenis bahan pangan dan kondisi tertentu dari penyimpanannya (Buckle et al., 1987).
Daging sangat memenuhi persyaratan untuk perkembangan mikroorganisme, terutama mikroorganisme pada perusak atau pembusuk. Hal ini disebabkan oleh mikroorganisme yang mempunyai kadar air tinggi antara 68%-75%, kaya akan zat yang mengandung nitrogen dengan kompleksitas yang berbeda, mengandung sejumlah karbohidrat yang dapat difermentasikan, kaya akan mineral dan kelengkapan faktor untuk pertumbuhan mikroorganisme serta mempunyai pH yang menguntungkan bagi sejumlah mikroorganisme sekitar 5,3-6,5 (Soeparno, 1994).
Kebanyakan bakteri tumbuh di permukaan daging, namun tidak tertutup kemungkinan ditemukan bakteri dalam daging. Bakteri yang dapat mencapai jaringan dalam karkas dengan berbagai cara, diantaranya melalui mekanisme berikut: (1) jaringan ternak sehat dapat mengandung sebuah populasi kecil bakteri namun dinamis bila bakteri secara terus-menerus memperoleh akses ke dalam jaringan ternak hidup dengan penetrasi membran mukosa saluran respirasi dan pencernaan untuk mengganti yang telah dibasmi oleh mekanisme ketahanan tubuh ternak; (2) bakteri dari usus dapat menyerang jaringan karkas, baik selama pemotongan (agonal invasion) maupun setelah pemotongan (post mortem invasion); (3) bakteri dapat terbawa ke jaringan oleh luka sebelum pemotongan; (4) bakteri yang mengkontaminasi permukaan karkas dapat mempenetrasi ke lapisan jaringan otot yang lebih dalam. Tipe bakteri yang umum dijumpai pada daging adalah strain dari
Pseudomonas, Moraxella, Acinetobacter, Lactobacillus, Brochotrix thermopacta dan beberapa genera dari famili Enterobacteriaceae (Gill, 1982).
Kualitas mikrobiologis daging dapat dilihat dari kandungan mikroorganisme dalam daging, terutama mikroorganisme patogen. Soeparno (1994) menjelaskan batas jumlah mikroba selama pelayuan tidak melebihi 105 cfu/cm2 dan jenis bakteri patogen yang tidak boleh terdapat di dalam daftar cemaran daging antara lain
Clostridium sp., Salmonella sp., Campylobacter sp.dan Listeria sp. Standar cemaran mikroba sebagai penentu kualitas daging sapi segar ditetapkan oleh Badan Standarisasi Nasional dengan batas maksimum cemaran dapat dilihat pada Tabel 1.
Tabel 1. Batas Maksimum Cemaran Mikroba pada Daging (CFU/g) Berdasarkan SNI No. 01-6366-2000
No. Jenis Cemaran Mikroba Batas Maksimum Cemaran Mikroba
Daging Segar/Beku Daging tanpa Tulang
1. 2. 3. 4. 5. 6. 7. 8. 9.
Angka Lempeng Total Bakteri (ALTB) Escherichia coli Staphylococcus aureus Clostridium sp. Salmonella sp. Coliform Enterococci Campylobacter sp. Listeria sp. 1 x 104 5 x 101 1 x 101 0 Negatif 1 x102 1 x 102 0 0 1 x 104 1 x 101 1 x 102 0 Negatif 1 x102 1 x 102 0 0
Keterangan : (*) dalam satuan MPN/gram (**) dalam satuan kualitatif
Bakteri Asam Laktat
Bakteri asam laktat sering ditemukan secara alamiah dalam bahan pangan. Bakteri ini secara luas terdistribusi pada susu, daging segar, sayuran serta produk-produknya. Penggunaan bakteri asam laktat sebagai kultur starter dalam produksi daging fermentasi, produk-produk susu serta sayuran dan buah-buahan adalah salah satu metode pemrosesan pangan tertua yang digunakan untuk menstabilkan produk-produk pangan tersebut hingga diperoleh cita rasa yang spesifik (Smid dan Gorris, 2007).
Bakteri asam laktat juga disebut sebagai biopreservatif karena berkontribusi dalam menghambat pertumbuhan bakteri lain khususnya patogen dan mampu membawa dampak positif bagi kesehatan manusia (Smid dan Gorris, 2007). Efek preservatif yang ditimbulkan oleh bakteri asam laktat pada pangan fermentasi disebabkan oleh kondisi asam yang terbentuk selama pemrosesan dan selanjutnya selama penyimpanan. Efek asam tersebut diakibatkan adanya konversi karbohidrat menjadi asam organik (asam laktat dan asam asetat) dan menurukan pH produk
selama fermentasi. Hal tersebut merupakan karakteristik penting guna
memperpanjang masa simpan dan keamanan produk (Vuyst dan Vandamme, 1994). Bakteri asam laktat mempunyai karakteristik morfologi, fisiologi dan metabolit tertentu. Deskripsi secara umum dari bakteri ini adalah termasuk dalam bakteri Gram positif, tidak berspora, berbentuk bulat maupun batang, dan menghasilkan asam laktat sebagai mayoritas produk akhir selama memfermentasi karbohidrat (Axelsson, 2004). Bakteri asam laktat terbagi menjadi 8 genus antara lain
Lactobacillus, Streptococcus, Lactococcus, Pediococcus, Enterococcus, Leuconostoc, Bifidobacterium, dan Corinebacterium. Berdasarkan tipe fermentasinya, bakteri asam laktat terbagi menjadi homofermentatif dan heterofermentatif. Kelompok homofermentatif menghasilkan asam laktat sebagai produk utama dari fermentasi gula sedangkan kelompok heterofermentatif menghasilkan asam laktat dan senyawa lain yaitu CO2, etanol, asetaldehid, diasetil
serta senyawa lainnya (Fardiaz, 1992).
Bakteri asam laktat memproduksi berbagai komponen bermassa molekul rendah termasuk asam, alkohol, karbon dioksida, diasetil, hidrogen peroksida dan metabolit lainnya. Banyak metabolit mempunyai spektrum aktivitas yang luas melawan spesies lain dan produksi tersebut dipengaruhi secara luas oleh matriks makanan itu sendiri (Helander et al., 1997). Satu atribut penting dari bakteri asam laktat adalah kemampuannya memproduksi komponen antimikroba, khususnya bakteriosin yang potensial menjadi biopreservatif menggantikan pengawet kimiawi pada bahan makanan guna memperpanjang umur simpan produk. Kemampuan bakteriosin dalam melakukan aktivitasnya sebagai biopresevatif dicapai oleh efek penghambatannya terhadap mikroorganisme patogen yang berbahaya (Savadogo et al., 2006).
Lactobacillus
Lactobacillus dicirikan dengan bentuk batang, biasanya panjang tetapi terkadang berbentuk bulat, umumnya dalam rantai-rantai pendek dan biasanya berukuran 0,5-1,2 µm x 1,0-10,0 µm. Lactobacillus merupakan bakteri Gram positif, tidak menghasilkan spora, biasanya tidak bergerak, anaerob fakultatif, katalase negatif, koloninya dalam media agar berukuran 2-5 mm, konfeks, opak, sedikit transparan dan tidak berpigmen. Hampir setengah dari metabolit akhir bahkan yang menjadi metabolit utamanya adalah laktat. Genus ini tumbuh baik pada suhu 30 o C-40 oC dan tersebar luas di lingkungan terutama dalam produk-produk pangan asal hewan dan sayuran. Bakteri ini menetap dalam saluran pencernaan unggas dan mamalia (Holt et al., 1994).
Lactobacillus plantarum 1A5
Lactobacillus plantarum termasuk bakteri dalam filum Firmicutes, kelas Bacilli, ordo Lactobacillales, family Lactobacillaceae dan genus Lactobacillus. Lactobacillus plantarum mempunyai kemampuan untuk menghambat mikroorganisme patogen pada bahan pangan dengan daerah penghambatan terbesar dibandingkan dengan bakteri asam laktat lainnya (Jenie dan Rini, 1995).
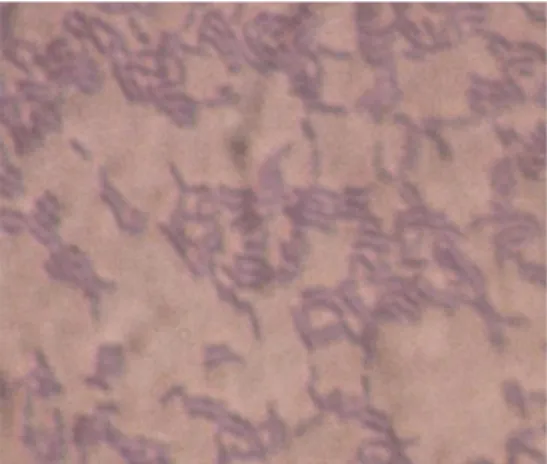
Lactobacillus plantarum 1A5 merupakan isolat bakteri asam laktat kelima dari daging sapi yang berasal dari Pasar Anyar Bogor dengan umur 9 jam postmortem pada suhu ruang (Arief, 2005). Isolat bakteri Lactobacillus plantarum 1A5 merupakan bakteri yang mampu bertahan hidup melalui uji invitro pada pH lambung (pH 2), pH usus (pH 7,2) dan garam empedu (0,3 %) (Wijayanto, 2009).
Substrat antimikroba yang dihasilkan oleh Lactobacillus plantarum 1A5 dengan didominasi oleh asam organik mempunyai aktivitas penghambatan paling besar terhadap ketiga bakteri uji (Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922 dan Salmonella typhimurium ATCC 14028). Aktivitas penghambatan tersebut ditunjukkan dengan diameter zona hambat terhadap
Staphylococcus aureus ATCC 25923 dengan rataan 8,99 mm; terhadap Escherichia coli ATCC 25922 dengan rataan 7,87 mm dan terhadap Salmonella typhimurium
ATCC 14028 dengan rataan 11,76 mm. Selain itu, nilai konsentrasi penghambatan minimumnya terhadap ketiga bakteri uji yaitu 90% (Permanasari, 2008).
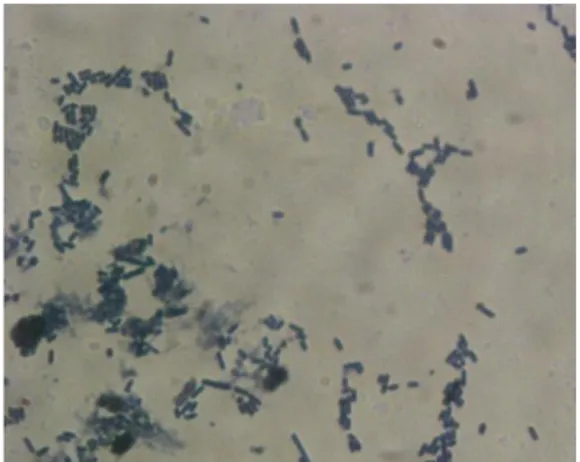
Gambar 1. Lactobacillus plantarum 1A5
Sumber: Permanasari (2008) Antimikroba
Senyawa antimikroba adalah senyawa kimiawi atau biologis yang dapat menghambat pertumbuhan dan aktivitas mikroba. Komponen antimikroba terdapat dalam bahan pangan melalui salah satu dari berbagai cara, yaitu terdapat secara alamiah di dalam bahan pangan, ditambahkan secara sengaja ke dalam makanan dan terbentuk selama pengolahan atau oleh jasad renik yang tumbuh selama fermentasi pangan (Fardiaz, 1992). Suatu preservatif untuk memperpanjang masa simpan produk pangan, terutama daging, harus memenuhi kriteria antara lain tidak mengubah flavor, bau dan tekstur bahan pangan; aman bagi konsumen dan efektif sebagai preservatif atau aman untuk dikonsumsi selama masa simpan tertentu; preservatif harus mudah dikenali dan kadarnya dapat dipastikan secara pasti serta harus memenuhi kebutuhan yang diizinkan; kualitas bahan pangan tidak merugikan konsumen; ekonomis (Soeparno, 1994); dan tidak menyebabkan timbulnya galur resisten dan diutamakan bersifat membunuh daripada hanya menghambat pertumbuhan mikroba (Frazier dan Westhoff, 1988).
Senyawa antimikroba dapat bersifat bakterisidal (membunuh bakteri), bakteristatik (menghambat pertumbuhan mikroba), fungisidal (membunuh kapang), fungistatik (menghambat pertumbuhan kapang) dan germisidal (menghambat germinasi spora bakteri). Kemampuan suatu zat antimikroba dalam menghambat pertumbuhan mikroba dipengaruhi oleh beberapa faktor, antara lain konsentrasi zat pengawet, waktu penyimpanan, suhu lingkungan, sifat-sifat mikroba (jenis, konsentrasi, umur dan keadaan mikroba), sifat-sifat fisik dan kimia makanan, termasuk kadar air, pH, jenis dan jumlah senyawa di dalamnya (Fardiaz, 1992).
Senyawa antimikroba adalah senyawa biologis dan atau kimiawi yang dapat menghambat pertumbuhan dan aktivitas mikroba. Bakteri asam laktat mampu berperan sebagai senyawa antimikroba, baik melalui penggunaannya secara langsung di dalam makanan pada proses fermentasi maupun melalui metabolit-metabolit yang dihasilkannya untuk memperpanjang masa simpan, meningkatkan kualitas produk
serta menghambat pertumbuhan mikroorganisme patogen dan pembusuk (Holzapfel,
1998). Metabolit-metabolit bakteri asam laktat yang berfungsi sebagai senyawa antimikroba antara lain asam organik (asam laktat dan asam asetat), bakteriosin, hidrogen peroksida, diasetil, CO2 dan semua metabolit yang mempunyai aktivitas
antimikroba (Vuyst dan Vandamme, 1994; Ouwehand dan Vesterlund, 2004).
Asam Organik
Asam organik merupakan substansi alami dari berbagai jenis makanan. Aksi antimikroba dari asam organik berdasarkan pada kemampuannya untuk menurunkan pH dalam pangan yang berfase air. Asam organik dalam pangan dapat berfungsi sebagai asidulan atau pengawet, sementara garamnya atau ester dapat menjadi antimikroba yang efektif pada pH mendekati netral. Asam laktat adalah produk utama pada pangan hasil fermentasi. Asam asetat, propionat, malat dan asam-asam lainnya dengan konsentrasi yang beragam juga dihasilkan tergantung jenis produk dan mikroorganisme yang digunakan (Samelis dan Sofos, 2003).
Penghambatan pertumbuhan pada mikroba yang disebabkan oleh asam organik diakibatkan adanya pelepasan proton ke dalam sitoplasma sehingga pH dalam membran sel menjadi sangat asam secara mendadak. Akan tetapi hipotesis tersebut dibantah oleh peneliti lain yang menyatakan bahwa penyebab dari penghambatan pertumbuhan oleh asam organik bukanlah karena adanya translasi proton tetapi karena adanya akumulasi anion. Anion menyebabkan berkurangnya kecepatan dari sintesis makromolekul dan mempengaruhi transportasi antar membran sel. Bakteri asam laktat dan juga bakteri lain meniadakan efek dari akumulasi anion dengan cara mengurangi pH pada sitoplasma (Ouwehand dan Vesterlund, 2004). Perubahan permeabilitas membran akan menghasilkan efek ganda, yaitu mengganggu transportasi nutrisi ke dalam sel dan menyebabkan metabolit internal keluar dari sel.
Hidrogen Peroksida
Bakteri asam laktat memproduksi hidrogen peroksida di bawah kondisi pertumbuhan aerob, dan karena berkurangnya katalase selular, pseudokatalase atau peroksidase. Bakteri asam laktat mengekskresikan H2O2 tersebut sebagai alat
pelindung diri yang mampu bersifat bakteriostatik maupun bakterisidal. Hidrogen peroksida merupakan salah satu agen pengoksidasi yang kuat dan dapat dijadikan sebagai zat antimikroba melawan bakteri, fungi dan bahkan virus (Ray, 2004). Kemampuan bakterisidal dari H2O2 beragam tergantung pH, konsentrasi, suhu,
waktu dan tipe serta jumlah mikoorganisme. Pada kondisi tertentu, spora bakteri ditemukan paling resisten terhadap H2O2, diikuti dengan bakteri Gram positif.
Bakteri yang paling sensitif terhadap H2O2 adalah bakteri Gram negatif, terutama
koliform (Ouwehand dan Vesterlund, 2004).
Hidrogen peroksida (H2O2) merupakan oksidator, bleaching agent dan anti
bakteri. Hidrogen peroksida murni tidak berwarna, berbentuk cairan seperti sirup dan memiliki bau yang menusuk. Kemampuan H2O2 untuk mengoksidasi menyebabkan
perubahan tetap pada sistem enzim sel mikroba sehingga digunakan sebagai antimikroba. Selain itu, senyawa ini juga dapat terdekomposisi menjadi air dan oksigen. Perubahan kondisi lingkungan seperti pH dan suhu mempengaruhi kecepatan dekomposisi H2O2. Peningkatan suhu dapat meningkatkan keefisienan
dalam menghancurkan bakteri dan kecepatan terdekomposisinya juga semakin cepat (Branen, 1993).
Bakteriosin
Bakteriosin yang diproduksi oleh bakteri asam laktat dapat didefinisikan sebagai protein aktif atau kompleks protein yang menunjukkan aksi bakterisidal melawan bakteri Gram positif dan terutama spesies yang berkerabat dekat dengan spesies penghasil (Vuyst dan Vandamme, 1994; Jack et al., 1995; Ray, 2004; Parada
et al., 2007). Bakteriosin dikarakterisasi sebagai suatu senyawa yang bersifat letal terhadap intraspesies telah diperjelas oleh Jack et al. (1995) meliputi beberapa kriteria umum, antara lain mempunyai spektrum aktivitas yang relatif sempit terpusat pada spesies yang filogenik; senyawa aktifnya berupa fraksi protein berukuran 20-60 asam amino yang disintesis di ribosom; bersifat bakterisidal dan tahan panas; memiliki reseptor spesifik pada sel sasaran; dan gen determinan terdapat pada
plasmid yang berperan dalam sintesis dan tidak membunuh strain penghasil. Vuyst dan Vandamme (1994) menuliskan bahwa bakteriosin bersifat irreversible, aktif pada konsentrasi rendah, mudah dicerna, berpengaruh positif terhadap kesehatan dan biasanya digunakan sebagai biopreservatif makanan.
Bakteriosin hanya menghambat spesies lain yang biasanya berkerabat dekat dengan spesies penghasil atau mikroorganisme Gram positif lainnya. Beberapa hasil telah dideskripsikan berpengaruh sinergis antara berbagai antimikroba, kemudian secara potensial aplikasinya diperluas. Pengetahuan baru untuk pengendalian bakteri Gram negatif secara efektif menggunakan agen antibakteri potensial harus direalisasikan dengan mekanisme penelitian yang dapat melewati hambatan permeabilitas dari membran luar (Helander et al., 1997).
Bakteriosin-bakteriosin asal bakteri asam laktat dikarakterisasi sebagai peptida yang berasal dari ribosom. Bakteriosin berakumulasi di dalam media kultur selama fase pertumbuhan eksponensial hingga fase pertumbuhan stasioner (Vuyst dan Vandamme, 1994). Bakteriosin mencapai produksi tertinggi dengan aktivitas penghambatan terbesar pada pertengahan fase pertumbuhan eksponensial hingga awal fase stasioner dan aktivitasnya akan berkurang bahkan tidak terdeteksi lagi selama fase pertumbuhan stasioner (Venema et al., 1997; Nowroozi et al., 2004; Abo-Amer, 2007; Rashid et al., 2009). Produksi bakteriosin dipengaruhi oleh tipe dan level karbon, sumber nitrogen dan fosfat, surfaktan kation dan penghambat (Savadogo et al., 2006).
Bakteriosin secara biologis disintesis sebagai prepeptida inaktif yang membawa sebuah N-terminal pada peptida utama untuk ditranslasikan menjadi C-terminal propeptida (Hoover dan Chen, 2005). Setelah proses translasi, peptida utama yang membawa molekul propeptida ditranportasikan dari dalam sitoplasma ke lingkungan luar melalui membran yang mempunyai ikatan pembawa ABC. Ikatan pembawa ABC tersebut beraksi sebagai endopeptidase yang memotong peptida utama sehingga bagian propeptidanya dapat dikeluarkan ke lingkungan sedangkan peptida utama tetap berada di dalam sitoplasma untuk berperan kembali dalam sintesis bakteriosin selanjutnya. Propeptida tersebut merupakan molekul-molekul bakteriosin yang terbentuk (Ray, 2004).
Bakteriosin yang diproduksi oleh bakteri asam laktat dapat dibagi menjadi 3 kelas utama antara lain kelas I adalah lantibiotik, kelas II adalah peptida berukuran kecil dan tahan panas, dan kelas III adalah protein berukuran besar dan tidak tahan panas. Kelas IV dari bakteriosin dengan struktur yang komplek juga telah diusulkan tetapi belum diterima secara luas (Ouwehand dan Vesterlund, 2004). Keberadaan kelas keempat tersebut terutama didukung oleh observasi bahwa beberapa aktivitas bakteriosin dihasilkan di dalam supernatan bebas sel, contohnya aktivitas Lb. plantarum LPCO 10 dihilangkan tidak hanya oleh perlakuan enzim proteolitik tetapi juga oleh enzim glikolitik dan lipolitik (Jimenez-Diaz, 1993). Kelas I dan II adalah kelas-kelas utama dari bakteriosin mempunyai potensi untuk digunakan di dalam aplikasi komersial. Kelas-kelas bakteriosin dapat dilihat pada Tabel 2.
Tabel 2. Kelas-Kelas Bakteriosin
Kelas Subkelas Deskripsi
Kelas I (lantibiotik)
A(1)
A(2)
B
berbentuk linier, kationik, membran aktif, sedikit yang bermuatan + atau –
berbentuk linier, kationik, membran aktif, banyak yang bermuatan –
berbentuk globular, berukuran kecil*, penghambatan dengan enzim spesifik, bermuatan – atau sama sekali tidak bermuatan*, tidak diproduksi oleh bakteri asam laktat
Kelas II
IIa IIb IIc
berukuran kecil (< 10 kDa), tahan panas (suhu sedang 100oC hingga suhu tinggi 121oC), peptida-peptida membrane aktif yang tidak mengandung lantionin peptida-peptida yang aktif menghambat Listeria bakteriosin yang mengandung dua peptida bakteriosin yang mengandung peptida lain
Kelas III berukuran besar (> 30 kDa), protein tidak tahan panas
Kelas IV bakteriosin komplek: protein dengan lipid dan atau
karbohidrat
Sumber: Ouwehand dan Vesterlund (2004) *Hoover dan Chen (2005)
Mekanisme Penghambatan Senyawa Antimikroba
Mekanisme penghambatan pertumbuhan mikroba oleh senyawa antimikroba yaitu dengan cara merusak dinding sel sehingga lisis maupun mengubah atau menghambat pembentukan dinding sel pada sel yang sedang tumbuh, mengubah permeabilitas membran sitoplasma yang menyebabkan kebocoran nutrien di dalam sel, denaturasi protein sel dan perusakan sistem metabolisme dalam sel dengan cara menghambat kerja enzim intraseluler (Pelczar dan Rheid, 1986). Beberapa cara antimikroba dalam aksinya melawan mikroorganisme yaitu memberikan efek bakteriostatik, bakterisidal ataupun bakterilisis. Sifat bakteriostatik akan menghambat pertumbuhan dan replikasi mikroorganisme, namun tidak menyebabkan kematian. Sifat bakterisidal berhubungan dengan kemampuan senyawa untuk menyebabkan kematian mikroorganisme, sedangkan sifat bakterilisis akan menyebabkan lisis sel mikroorganisme (Gonzales et al., 1996).
Bakteriosin bakteri asam laktat bersifat bakterisidal terhadap sel sensitif dan dapat mengalami kematian dengan sangat cepat pada konsentrasi rendah. Beberapa bakteriosin mempunyai sifat bakterisidal melawan beberapa strain dan spesies yang berelasi dekat tetapi beberapa dapat efektif melawan banyak strain dalam spesies dan genera yang berbeda. Namun, sel penghasil bakteriosin akan mengalami ketahanan terhadap bakteriosin yang dihasilkannya sendiri, disebabkan memperoleh ketahanan protein yang spesifik. Bakteriosin ini pada umumnya sangat efektif melawan sel dari bakteri Gram positif yang lain (Ray, 2004).
Normalnya, strain bakteri Gram positif sensitif terhadap bakteriosin dengan spektrum yang sangat bervariasi, sedangkan strain bakteri Gram negatif resisten terhadap bakteriosin. Namun, bakteri Gram negatif tersebut dapat menjadi sensitif mengikuti perusakan struktur lipopolisakarida pada permukaan sel secara fisik dan tekanan kimia. Bakteriosin asal bakteri asam laktat tidak efisien dalam menghambat bakteri Gram negatif karena membran terluarnya bersifat hidrofilik dan dapat menghalangi aksi bakteriosin (Ray, 2004). Bakteri Gram negatif memiliki sistem seleksi terhadap zat-zat asing yaitu pada lapisan lipopolisakarida (Branen, 1993).
Penentuan aktivitas antimikroba adalah terjadinya interaksi awal antara molekul-molekul kationik dari bakteriosin dengan polimer-polimer anionik di permukaan sel, salah satunya adalah asam teikoat. Asam teikoat tersebut merupakan
reseptor bakteriosin yang hanya dihasilkan oleh bakteri Gram positif. Selanjutnya, aksi bakterisidal dari bakteriosin melawan sel yang sensitif akan dihasilkan melalui destabilisasi fungsi dari membran sitoplasmik, berupa peningkatan permeabilitas membran sehingga mengganggu keseimbangan barier dan dapat mengakibatkan kematian sel (Jack et al., 1995). Mekanisme-mekanisme aksi lainnya dari bakteriosin antara lain perubahan aktivitas enzim, penghambatan germinasi spora dan inaktivasi pembawa anionik langsung membentuk pori-pori selektif dan non selektif (Ray, 2004).
Enzim Proteolitik
Enzim proteolitik atau yang sering disebut dengan protease merupakan berbagai jenis enzim yang mencerna protein menjadi unit-unit yang lebih kecil dimana enzim secara umum bertugas sebagai katalisator dengan cara menurunkan energi aktivasi di dalam sel, bersifat khas (Murray, 2006) dan sebagai katalis pada pemecahan molekul protein dengan cara hidrolisis (Poedjiadi, 1994). Oleh karena yang dipecah adalah ikatan pada rantai peptida, maka enzim tersebut dinamakan peptidase. Enzim-enzim ini meliputi protease-protease pankreas, khimotripsin dan tripsin, bromelin, papain, fungal proteases dan Serratia peptidase (Murray, 2006).
Tripsin (EC 3.4.21.4) merupakan famili dari protease serin yang memecah protein pada gugus karboksil dari asam amino lisin dan arginin, kecuali protein tersebut diikuti oleh prolin. Tripsin dihasilkan oleh pankreas dalam bentuk tripsinogen yang tidak aktif. Tripsinogen tersebut kemudian disekresikan ke usus halus, tempat enzim enterokinase mengaktifkannya menjadi tripsin (Poedjiadi, 1994) atau secara autokatalitik pada pH 8 (Suhartono, 1992).
Pepsin (EC 3.4.23.1) adalah suatu enzim yang berguna untuk memecah molekul protein menjadi molekul yang lebih kecil yaitu pepton dan proteosa. Enzim ini dihasilkan oleh sel-sel utama lambung dalam bentuk pepsinogen, yaitu calon enzim yang belum aktif. Pepsinogen ini kemudian diubah menjadi pepsin yang aktif dengan adanya HCl (Poedjiadi, 1994). Enzim pepsin menghidrolisis ikatan peptida protein pada sisi karboksil tirosin, fenilalanin, triptofan, leusin, glutamat dan glutamin (Suhartono, 1992). Spesifitas pemotongan berbagai enzim proteolitik dapat dilihat pada Tabel 3.
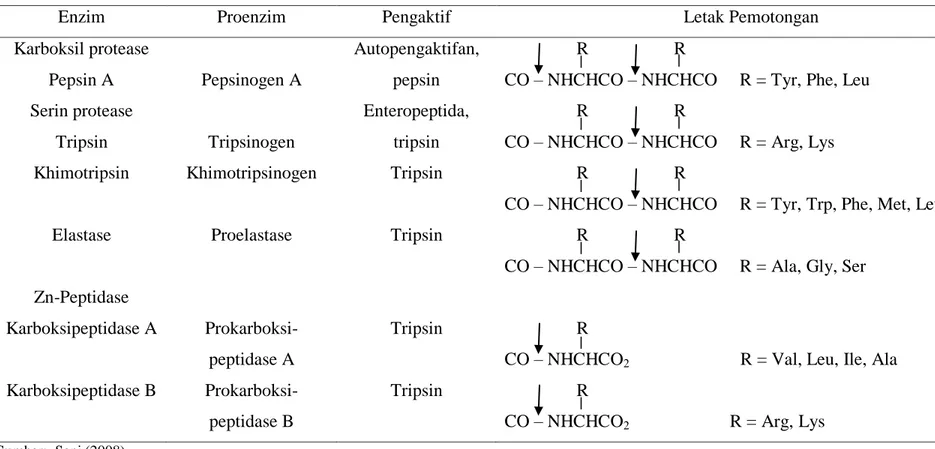
Tabel 3. Spesifitas Pemotongan Berbagai Enzim Proteolitik
Enzim Proenzim Pengaktif Letak Pemotongan
Karboksil protease
Pepsin A Pepsinogen A
Autopengaktifan, pepsin
R R
CO – NHCHCO – NHCHCO R = Tyr, Phe, Leu Serin protease
Tripsin Tripsinogen
Enteropeptida, tripsin
R R
CO – NHCHCO – NHCHCO R = Arg, Lys
Khimotripsin Khimotripsinogen Tripsin R R
CO – NHCHCO – NHCHCO R = Tyr, Trp, Phe, Met, Leu
Elastase Proelastase Tripsin R R
CO – NHCHCO – NHCHCO R = Ala, Gly, Ser Zn-Peptidase Karboksipeptidase A Prokarboksi-peptidase A Tripsin R
CO – NHCHCO2 R = Val, Leu, Ile, Ala
Karboksipeptidase B
Prokarboksi-peptidase B
Tripsin R
CO – NHCHCO2 R = Arg, Lys Sumber: Sani (2008)
Sensitivitas substansi antibakteri yang diproduksi oleh bakteri asam laktat terhadap -khimotripsin, tripsin, pronase E, fisin, pepsin, papain dan lipase ditentukan dalam penanganan dan kondisi perbanyakan. Semua komponen secara keseluruhan maupun sebagian diinaktivasi oleh beberapa enzim proteolitik. Hal ini mengindikasikan bahwa komponen tersebut adalah protein alami. Komponen penghambat diproduksi oleh strain-strain yang ada dengan sensitivitas yang berbeda. Seluruh komponen penghambat tersebut secara lengkap diinaktivasi oleh -khimotripsin, pronase E dan fisin. Nisin dibedakan dengan bakteriosin lactococcal lainnya dengan fakta bahwa -khimotripsin adalah enzim proteolitik satu-satunya yang menyebabkan nisin menjadi sensitif. Namun demikian, nisin juga dapat diinaktifasi oleh enzim lainnya, misalnya pronase E dan fisin (Bromberg et al., 2004).
Bakteri Patogen
Bakteri yang tumbuh dalam bahan pangan terbagi menjadi bakteri pembusuk yang dapat menyebabkan kerusakan makanan dan bakteri patogen penyebab penyakit pada manusia. Jumlah bakteri pembusuk umumnya lebih dominan dibandingkan dengan bakteri patogen. Bakteri patogen merupakan mikroorganisme indikator keamanan pangan. Bakteri patogen dibedakan atas penyebab intoksikasi dan infeksi. Intoksikasi yaitu keracunan yang disebabkan oleh toksin yang dihasilkan bakteri patogen yang berkembang di dalam bahan makanan, sedangkan infeksi yaitu bakteri yang menghasilkan racun di dalam saluran pencernaan. Beberapa mikroba yang diamati sebagai bakteri pembusuk dan patogen pada produk fermentasi adalah dari famili Enterobacteriaceae, di dalamnya termasuk famili Enterobacter, Erwinia, Citrobacter, Klebsiella, Proteus, Salmonella, Serattia, Shigella dan Yersinia
(Fardiaz, 1992).
Bakteri secara umum dibedakan menjadi dua bagian berdasarkan sifat pewarnaan Gram yaitu Gram positif dan Gram negatif. Bakteri Gram positif adalah bakteri yang memberi respon berwarna biru keunguan jika dilakukan uji pewarnaan Gram, sedangkan Gram negatif memberi respon warna merah (Tortora et al., 2006). Kelompok bakteri patogen yang bersifat Gram positif diantaranya Staphylococcus aureus, Listeria monocytogenes dan Clostridium perfringens, sedangkan bakteri
patogen yang bersifat Gram negatif diantaranya Escherichia coli enteropatogenik
dan Salmonella typhimurium.
Staphylococcus aureus
Staphylococcus aureus temasuk famili Micrococcaceae, merupakan bakteri Gram positif, berbentuk kokus yang terdapat dalam bentuk tunggal, berpasangan tetrad atau berkelompok, seperti buah anggur dengan diameter berkisar 0,5-1,5 µm, anaerob fakultatif, tidak bergerak, tidak berspora dan biasanya termasuk katalase positif (Holt et al., 1994). Kebanyakan galur Staphylococcus aureus bersifat patogen dan memproduksi enterotoksin yang tahan panas. Beberapa galur, terutama yang bersifat patogen, memproduksi koagulase, bersifat proteolitik, lipolitik dan -hemolitik. Bakteri ini sering terdapat pada pori-pori dan permukaan kulit, kelenjar keringat dan saluran usus serta dapat menyebabkan intoksikasi dan infeksi bisul, pneumonia, mastitis pada hewan (Fardiaz, 1992).
Suhu optimum pertumbuhan Staphylococcus aureus adalah 35-37 oC, suhu minimum 6,7 oC dan suhu maksimum 45,5 oC. Bakteri dapat tumbuh pada pH 4,0-9,8 dengan pH optimum sekitar 7,0-7,8. Pertumbuhan pada pH mendekati 4,0-9,8 hanya
mungkin apabila substratnya mempunyai komponen yang baik untuk
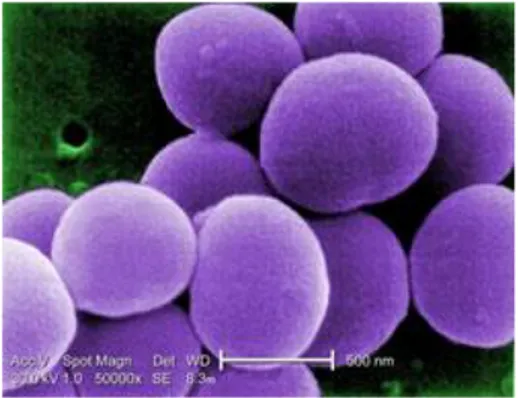
pertumbuhannya (Supardi dan Sukamto, 1999). Staphylococcus aureus secara mikroskopis dapat dilihat pada Gambar 2.
Gambar 2. Staphylococcus aureus
Sumber: Gillen (2009)
Salmonella typhimurium
Salmonella merupakan bakteri Gram negatif, tidak membentuk spora, berbentuk batang, dapat memfermentasi glukosa dan biasanya disertai dengan pembentukan gas tetapi tidak memfermentasi laktosa maupun sukrosa (Frazier dan
Westhoff, 1988). Salmonella berbentuk batang lurus, berukuran 0,7-1,5 µm x 2-5 µm, termasuk bakteri anaerob fakultatif dan biasanya dapat bergerak menggunakan flagela peritrikus (Holt et al., 1994). Salmonella sp. dapat tumbuh pada kisaran suhu antara 5 oC hingga 45-47 oC dengan suhu optimum 35-37 oC. Salmonella sp. tumbuh pada tingkat keasaman antara 4,5-5,4 dengan pH optimumnya sekitar 7 dan aw
minimum 0,94. Nilai pH minimum bervariasi tergantung pada suhu inkubasi, komposisi media, aw dan jumlah sel. Pada pH kurang dari 4,0 dan lebih dari 9,0
Salmonella akan mati secara perlahan (Adam dan Moss, 2007).
Makanan yang sering terkontaminasi oleh Salmonella typhimurium adalah telur, susu, ikan, daging ayam, daging sapi serta hasil olahannya. Buckle et al. (1987)
menyatakan bahwa Salmonella dapat bergerak dengan metabolisme bersifat
fakultatif anaerob. Selain itu, bakteri ini merupakan bakteri patogen berbahaya, selain dapat menyebabkan gejala gastrointestinal (gangguan perut), juga dapat menyebabkan demam tifus (Salmonella typhimurium) dan paratifus (Salmonella paratyphi) (Fardiaz, 1992). Salmonella typhimurium secara mikroskopis dapat dilihat pada Gambar 3.
Gambar 3. Salmonella typhimurium
Sumber: Fox (2000)
Escherichia coli
Escherichia coli merupakan bakteri Gram negatif yang berbentuk batang dengan ukuran 1,1-1,5 µm x 2,0-6,0 µm, soliter maupun berkoloni, anaerobik fakultatif dan katalase positif (Holt et al., 1994). Escherichia coli termasuk dalam grup Enterobacteriaceae dan digunakan sebagai mikroba indikator terhadap kontaminasi feses pada air dan susu, bersifat motil dengan flagela peritrikus (Buckle
minimum 4 dan pH maksimum 8,5. Bakteri ini sensitif terhadap panas dan pada makanan yang mengalami pemanasan. Suhu optimum untuk pertumbuhannya adalah 37 oC dengan kisaran suhu 10-40 oC (Frazier dan Westhoff, 1988).
Flora normal (Escherichia coli) ini terdapat di dalam saluran pencernaan hewan dan manusia sehingga mudah mencemari air. Kontaminasi bakteri ini pada makanan biasanya berasal dari kontaminasi air yang digunakan. Dosis yang dapat menimbulkan gejala infeksi Escherichia coli pada makanan berkisar antara 108 - 109 sel. Bahan makanan yang sering terkontaminasi oleh Escherichia coli antara lain daging sapi, daging ayam, daging babi, ikan dan makanan hasil laut lainnya, telur dan produk olahannya, sayuran, buah-buahan, sari buah serta susu (Supardi dan Sukamto, 1999). Escherichia coli secara mikroskopis dapat dilihat pada Gambar 4.
Gambar 4. Escherichia coli
Sumber: Beavers (2005)
Enteropathogenic Escherichia coli (EPEC) merupakan salah satu dari keempat kelompok bakteri patogenik indikator kontaminasi fekal dan penyebab diare, selain ETEC (Enterotoxigenic Escherichia coli), EIEC (Enteroinvasif
Escherichia coli) dan VTEC (Escherichia coli penghasil verotoksin). Bakteri ini secara normal terdapat pada saluran usus anak-anak dan orang dewasa sehat dengan jumlah yang mencapai 109 CFU/g. Penyakit yang disebabkan oleh grup EPEC adalah diare berair yang disertai dengan muntah dan demam. EPEC umumnya dikaitkan dengan bayi dan anak-anak di bawah usia 3 tahun (Hartoko, 2009). Enteropathogenic Escherichia coli melekatkan diri pada sel mukosa usus kecil dan membentuk filamentus aktin pedestal sehingga menyebabkan diare cair (watery diarrehoae) yang bisa sembuh dengan sendirinya atau berlanjut menjadi kronis (Arifin, 2009).
METODE
Lokasi dan Waktu
Kegiatan penelitian ini dilakukan di Laboratorium Ruminansia Besar dan Laboratorium Mikrobiologi Bagian THT Perah, Fakultas Peternakan Institut Pertanian Bogor yang terletak di Kampus IPB Dramaga, Bogor. Kegiatan penelitian dilaksanakan selama 8 bulan dari bulan Januari hingga bulan Agustus 2009.
Materi
Bahan-bahan utama yang digunakan dalam penelitian ini antara lain isolat bakteri asam laktat dari daging sapi yaitu Lactobacillus plantarum 1A5 (koleksi Arief, 2005), bakteri indikator (Staphylococcus aureus ATCC 25923, Salmonella typhimurium ATCC 14028 dan enteropathogenic Escherichia coli K11 (EPEC K11 merupakan isolat koleksi Fakultas Kedokteran Hewan IPB yang diisolasi dari feses
bayi yang mengalami diare)), media De Man Rogosa and Sharpe Agar (MRSA), De
Man Rogosa and Sharpe Broth (MRSB), Nutrient Agar (NA), Buffer Water Pepton
(BPW), Mueller Hinton Agar (MHA), Yeast Extract (YE)3%, NaCl 1%, tripton 1%, NaOH 0,1 N, amonium sulfat, larutan Mc. Farland no. 0,5 serta aquades.
Alat-alat yang digunakan dalam penelitian ini antara lain tabung reaksi, jarum Öse, cawan Petri, gelas ukur, pipet volumetrik, mikro pipet, pipet Pasteur, pemanas Bunsen, kertas saring, alat sentrifuse, membran filter Millipore (0,20 µm), alumunium foil, kapas, tip, ependorf, pH meter, jangka sorong, inkubator, oven, refrigerator, otoklaf, vortex dan buret.
Rancangan
Rancangan percobaan yang digunakan adalah rancangan acak lengkap (RAL) dengan perlakuan media dan 3 ulangan untuk produksi bakterosin pada media yang berbeda, purifikasi parsial bakteriosin dan uji sensitivitas bakteriosin terhadap enzim proteolitik. Model statistika yang digunakan sebagai berikut:
keterangan:
Yijk = nilai respon ke-k dari kombinasi perlakuan pada taraf ke-i dan ke-j
= nilai tengah populasi
i = pengaruh perlakuan ke-i dari 6 taraf perlakuan media pertumbuhan untuk
produksi bakteriosin, 3 taraf perlakuan media pertumbuhan untuk purifikasi parsial bakteriosin dan 3 taraf perlakuan enzim proteolitik untuk uji sensitivitas bakteriosin kasar 1A5
ij = pengaruh galat dari nilai respon ke-j dari perlakuan pada taraf ke-i.
Peubah yang diamati untuk rancangan acak lengkap adalah diameter zona hambat hasil uji antagonistik dari supernatan antimikroba hasil produksi bakterosin dengan perlakuan media yang berbeda, ekstrak bakteriosin kasar 1A5 hasil purifikasi parsial bakteriosin dengan perlakuan media yang berbeda dan dari bakteriosin kasar 1A5 dengan perlakuan enzim proteolitik terhadap masing-masing bakteri indikator (Staphylococcus aureus ATCC 25923, Salmonella typhimurium ATCC 14028 dan
enteropathogenic Escherichia coli K11 (EPEC K11)). Data yang didapat dianalisis dengan analisis ragam dan apabila hasil yang diperoleh adalah nyata akan dilanjutkan dengan Uji Tukey (Gaspersz, 1991).
Rancangan percobaan lainnya yang digunakan adalah secara deskriptif baik untuk produksi bakteriosin pada media yang berbeda, purifikasi parsial bakteriosin, uji sensitivitas bakteriosin terhadap enzim katalase dan enzim proteolitik serta penentuan nilai MIC dan MBC bakteriosin kasar 1A5. Pengolahan data secara deskriptif ini perlu dilakukan guna memperjelas pembahasan terhadap hasil yang telah diperoleh.
Prosedur
Strain Bakteri dan Media Pertumbuhan
Bakteri asam laktat Lactobacillus plantarum 1A5 yang digunakan dalam penelitian ini merupakan isolat BAL asal daging sedangkan bakteri indikatornya
adalah Staphylococcus aureus ATCC 25923, Salmonella typhimurium ATCC 14028
dan enteropathogenic Escherichia coli K11 (EPEC K11). Kultur bakteri asam laktat (BAL) yang telah dipropagasi dalam media MRS broth pada suhu inkubasi 37 oC selama 24 jam, dibiakkan kembali ke dalam tiga media, yaitu MRS broth yang
YE 3% serta MRS broth yang ditambahkan dengan tripton 1%, agar didapatkan kultur kerja dengan masa inkubasi 20 jam pada suhu 37 oC. Ketiga bakteri indikator lainnya dibiakkan pada media Nutrient Agar (NA) selama 24 jam pada suhu 37 oC agar diperoleh kultur kerja bakteri indikator.
Produksi Bakteriosin pada Media yang Berbeda
Lactobacillus plantarum 1A5 ditumbuhkan pada tiga media yang berbeda yaitu yaitu MRS broth yang ditambahkan dengan NaCl 1%, MRS broth yang ditambahkan dengan NaCl 1% dan YE 3% serta MRS broth yang ditambahkan dengan tripton 1% (Ogunbawo et al., 2003) selama 20 jam pada suhu 37 oC. Selanjutnya, diekstraksi menggunakan sentrifugasi dengan kecepatan 10000 rpm selama 20 menit pada suhu 4 oC (Savadogo et al., 2004). Supernatan bebas sel yang didapat, dipisahkan dari endapan kemudian diukur nilai pH dan TAT-nya. Supernatan bebas sel yang diperoleh dikondisikan pada pH 5,0 dan 6,0 menggunakan NaOH 0,1 N untuk menghilangkan pengaruh antimikrobial dari asam organik (Savadogo et al., 2004). Setelah itu, seluruh supernatan bebas sel disterilisasi melalui filtrasi menggunakan filter Millipore 0,20 m. Selanjutnya, uji antagonistik dilakukan melalui konfrontasi supernatan antimikroba dengan ketiga bakteri indikator menggunakan metode sumur difusi agar. Hasil dari uji antagonistik yang dilakukan adalah berupa zona bening di sekitar lubang sumur yang kemudian nilai diameter zona hambatnya dipersentasekan dengan rumus (Rashid et al., 2009):
Pengukuran pH. Sebelum persiapan uji antagonistik, karakterisasi supernatan antimikroba dilakukan pengukuran nilai pH supernatan menggunakan pH meter yang terlebih dahulu dikalibrasi dengan buffer untuk pH 7 dan pH 4. Kalibrasi dilakukan setiap akan melakukan pengukuran. Pengukuran dilakukan dengan mencelupkan elektroda ke dalam supernatan bebas sel setelah terlebih dahulu elektroda dibersihkan dengan aquades. Skala nilai pH dibaca pada saat muncul kata ready atau angka penunjuk telah berada posisi tetap.
Pengukuran Total Asam Tertitrasi. Supernatan dipipet sebanyak 10 ml ke dalam labu erlenmeyer kemudian ditambahkan 3 tetes larutan indiktor phenolphtalein
(pp 1%). Supernatan bebas sel kemudian dititrasi dengan larutan NaOH 0,1 N hingga terbentuk warna merah muda (Nielsen, 2003). Perhitungan persentase asam laktat sebagai berikut:
Total asam tertitrasi (%) =
keterangan: a = bobot/volume sampel, dinyatakan dalam ml b = volume larutan NaOH, dinyatakan dalam ml c = normalitas larutan NaOH, dinyatakan dalam N eq.wt = konstanta asam laktat (90,08)
Persiapan Uji Antagonistik
Bakteri indikator yang telah ditumbuhkan dalam media NA selama 24 jam pada suhu 37 oC distandarisasi terlebih dahulu. Standarisasi dilakukan dengan cara menyetarakan kekeruhannya (turbiditas) sesuai standar Mc Farland no. 0,5 untuk menghasilkan populasi bakteri setara 1,5 x 108 cfu/ml (P0). Konfrontasi pada tahap produksi bakteriosin pada media yang berbeda dilakukan antara supernatan antimikroba dan bakteri indikator dengan populasi 1,5 x 106 cfu/ml (setara dengan 0,1 dari P0) yang diperoleh dengan mengencerkannya sebanyak 100 kali ke dalam BPW steril. Sedangkan konfrontasi pada tahapan-tahapan selanjutnya (purifikasi parsial bakteriosin, uji sensitivitas bakteriosin kasar 1A5 terhadap enzim katalase dan enzim proteolitik) konfrontasi dilakukan antara substrat bakteriosin kasar 1A5 dan bakteri indikator dengan populasi 1,5 x 108 cfu/ml (P0) guna meratakan populasi
bakteri indikator di media Mueller Hilton Agar (MHA) dan mempermudah
pengukuran diameter zona hambat yang terbentuk.
Suspensi bakteri indikator diambil dengan menggunakan pipet steril sebanyak 1 ml kemudian dituangkan ke dalam cawan petri steril dan ditambahkan media MHA steril bersuhu 50 oC sebanyak 20 ml. Setelah itu, cawan petri diputar-putar membentuk angka delapan di atas bidang datar agar media MHA dan suspensi bakteri indikator menjadi homogen kemudian media konfrontasi didiamkan hingga
mengeras. Setelah mengeras, dibuat sumur berdiamater 5 mm dengan
menggunakan ujung pipet pasteur steril sebanyak 6 buah di setiap cawan dan dibuat duplo dengan tiga ulangan untuk masing-masing supernatan antimikroba.
Uji Antagonistik Bakteriosin terhadap Bakteri Indikator
Supernatan antimikroba sebanyak 50 l dimasukkan ke dalam masing-masing lubang sumur menggunakan mikropipet. Selanjutnya, cawan dilapisi dengan kertas saring terlebih dahulu sebelum ditutup. Seluruh cawan yang berisi bakteri indikator (Staphylococcus aureus ATCC 25923, Salmonella typhimurium ATCC 14028 dan
enteropathogenic Escherichia coli K11 (EPEC K11)) dan supernatan antimikroba BAL Lactobacillus plantarum 1A5 diinkubasi selama 2 jam pada suhu ± 10 oC yang kemudian dilanjutkan untuk diinkubasi selama 24 jam pada suhu 37 oC (Savadogo et al., 2004).
Zona hambat yang terbentuk di sekitar sumur pada seluruh cawan diamati dan diukur diameternya dengan menggunakan jangka sorong. Diameter dari masing-masing zona hambat diukur sebanyak tiga kali di daerah yang berbeda yang kemudian hasilnya dirata-ratakan. Setiap pengujian diulang sebanyak tiga kali dan pada setiap ulangan dilakukan secara duplo. Zona hambat yang positif ditunjukkan dengan warna bening maupun warna semu dan akan negatif apabila tidak terdapat warna bening maupun warna semu disekitar sumur. Zona bening maupun warna semu tersebut menunjukkan bahwa bakteriosin berperan dalam membunuh maupun menghambat aktivitas bakteri indikator.
Purifikasi Parsial Bakteriosin
Purifikasi parsial bakteriosin dilakukan pada supernatan antimikroba
Lactobacillus plantarum 1A5 yang dihasilkan dari ketiga media produksi bakteriosin (supernatan antimikroba yang dihasilkan dari media pertumbuhan dengan inducer
NaCl 1%, kombinasi inducer NaCl 1% dan YE 3% serta inducer tripton 1% ) dengan kondisi pH 6. Serbuk amonium sulfat ditambahkan sebanyak 40% ke dalam supernatan antimikroba yang telah disaring steril untuk manghasilkan endapan protein, kemudian dihomogenkan secara perlahan dan didiamkan pada suhu refrigerator selama semalam (Savadogo et al., 2004; Todorov et al., 2004; Nowroozi
et al., 2004; dan Abo-Amer, 2007). Endapan protein yang terbentuk dibuat ekstrak bakteriosin kasar dengan cara memisahkan filtrat dengan sebagian besar supernatannya kemudian menghomogenkan filtrat tersebut dengan supernatan yang masih tersisa sehingga dihasilkan ekstrak bakteriosin kasar sebanyak ± 20% dari
volume awal (Venema et al., 1997). Penghitungan padatan amonium sulfat didasarkan pada Tabel 4.
Tabel 4. Penggunaan Padatan Amonium Sulfat (% Penjenuhan)
Awal
% 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100 Konsentrasi Akhir dari Padatan Amonium Sulfat (gram)
0 10,6 13,4 16,4 19,4 22,6 25,8 29,1 32,6 36,1 39,8 43,6 47,6 51,6 55,9 60,3 65,0 69,7 5 7,9 10,8 13,7 16,6 19,7 22,9 26,2 29,6 33,1 36,8 40,5 44,4 48,4 52,6 57,0 61,5 66,2 10 5,3 8,1 10,9 13,9 16,9 20,0 23,3 26,6 30,1 33,7 37,4 41,2 45,2 49,3 53,6 58,1 62,7 15 2,6 5,4 8,2 11,2 14,1 17,2 20,4 23,7 27,1 30,6 34,3 38,1 42,0 46,0 50,3 54,7 59,2 20 0 2,7 5,5 8,3 11,3 14,3 17,5 20,7 24,1 27,6 31,2 34,9 38,7 42,7 46,9 51,2 55,7 25 0 2,7 5,6 8,4 11,5 14,6 17,9 21,1 24,5 28,0 31,7 35,5 39,5 43,6 47,8 52,2 30 0 2,8 5,6 8,6 11,7 14,8 18,1 21,4 24,9 28,5 32,3 36,2 40,2 44,5 48,8 35 0 2,9 5,7 8,7 11,8 15,1 18,4 21,8 25,8 29,6 32,9 36,9 41,0 45,3 40 0 2,9 5,8 8,9 12,0 15,3 18,7 22,2 26,3 29,6 33,5 37,6 41,8 45 0 3,0 5,9 9,0 12,3 15,6 19,0 22,6 26,3 30,2 34,2 38,3 50 0 3,0 6,0 9,2 12,5 15,9 19,4 23,5 26,8 30,8 34,8 55 0 3,1 6,1 9,3 12,7 16,1 20,1 23,5 27,3 31,2 60 0 3,1 6,2 9,5 12,9 16,8 20,1 23,9 27,9 65 0 3,2 6,3 9,7 13,2 16,8 20,5 24,4 70 0 3,2 6,5 9,9 13,4 17,1 20,9 75 0 3,3 6,6 10,1 13,7 17,4 80 0 3,4 6,7 10,3 13,9 85 0 3,4 6,8 10,5 90 0 3,4 7,0 95 0 3,5 100 0 Sumber: Simpson (2006)
Ekstrak bakteriosin kasar tersebut diuji aktivitasnya melalui uji antagonistik terhadap ketiga bakteri indikator. Diameter zona hambat hasil uji antagonistik antara ekstrak bakteriosin kasar dengan bakteri indikator diharapkan mempunyai nilai lebih besar daripada diameter zona hambat hasil uji antagonistik pada tahap produksi bakteriosin pada media yang berbeda.
Uji Sensitivitas Bakteriosin Kasar 1A5 terhadap Enzim Katalase
Uji lanjut dari purifikasi parsial bakteriosin adalah karakterisasi bakteriosin kasar 1A5 yang berupa uji sensitivitas bakteriosin terhadap enzim katalase. Enzim katalase (2,0 U/mg) distabilkan di dalam buffer 10 mM potasium fosfat (pH 7,0). Sampel bakteriosin kasar 1A5 sebanyak 1 ml diinkubasi dengan 1 mg/ml enzim katalase pada suhu 25 oC (Savadogo et al., 2004). Hasil karakterisasi bakteriosin tersebut dilihat setelah diuji antagonistik kembali dengan bakteri indikator, antara