PENETAPAN KADAR SENYAWA FENOLIK TOTAL DALAM ASAP CAIR (LIQUID SMOKE) DIHITUNG SEBAGAI FENOL
DENGAN METODE BROMATOMETRI
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh : Hartono NIM : 038114054
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
Dipersembahkan kepada :
Orang tuaku The Song Khiang dan Tjan Sioe Moei Adikku Lusiani
Almamaterku
KATA PENGANTAR
Puji syukur kepada Tuhan Yang Maha Esa, atas berkat dan rahmat-Nya,
sehingga penulis dapat menyelesaikan skripsi yang berjudul “Penetapan Kadar
Senyawa Fenolik Total dalam Asap Cair (Liquid Smoke) Dihitung Sebagai Fenol dengan Metode Bromatometri”. Skripsi ini disusun untuk memenuhi salah satu
syarat memperoleh gelar Sarjana Farmasi (S.Farm.) di Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta.
Selama penyusunan skripsi ini, penulis mengalami berbagai kesulitan,
yang dikarenakan oleh keterbatasan penulis. Namun sebagian besar kesulitan
tersebut dapat diatasi berkat bantuan banyak pihak. Untuk itu, pada kesempatan
ini, penulis ingin mengucapkan terima kasih kepada:
1. Rita Suhadi, M.Si., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata
Dharma Yogyakarta.
2. Dra. M.M. Yetty Tjandrawati, M.Si. selaku dosen pembimbing yang telah
memberikan motivasi, bimbingan, dan diskusi.
3. Dr. Sabikis, Apt. selaku dosen penguji yang banyak memberikan
masukan-masukan bagi penulis.
4. Prof. Dr. Sudibyo Martono, M.S., Apt. selaku dosen penguji yang banyak
memberikan masukan-masukan bagi penulis.
5. Yunita Linawati, S.Si., Apt., yang selalu memberikan pencerahan, motivasi
dan dukungan di saat penulis menghadapi keputusasaan.
6. Segenap staf pengajar, staf tata usaha, para laboran Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta, yang telah membantu dan
memberikan fasilitas selama penulis menempuh studi.
7. William Salim atas diskusi mekanisme reaksi dan dukungan motivasinya.
8. Winarto, Widyono, dan Lusiani yang selalu mengingatkanku untuk
menyelesaikan skripsi tepat waktu dan atas persahabatannya selama ini.
9. Erika Dwijayanti Buntoro atas semangat, doa, dukungan, dan diskusinya.
10.Teman-teman kelas B angkatan 2003 serta teman-teman Tasura 52 yang selalu
bersamaku sejak awal kuliah.
11.Semua pihak yang tidak dapat penulis sebutkan satu persatu yang telah banyak
membantu penulis.
Penulis menyadari bahwa masih banyak kekurangan dalam penyusunan
skripsi ini, penulis memohon kritik dan saran yang sifatnya membangun. Penulis
memiliki harapan yang sangat besar, semoga laporan ini dapat bermanfaat bagi
pembaca.
Yogyakarta, 6 Juni 2007
Penulis
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak
memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam
kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 6 Juni 2007
Penulis
Hartono
DAFTAR ISI
HALAMAN JUDUL ………
HALAMAN PERSETUJUAN PEMBIMBING ………..
HALAMAN PENGESAHAN ………..
HALAMAN PERSEMBAHAN ………...
KATA PENGANTAR ………..
PERNYATAAN KEASLIAN KARYA ………...
DAFTAR ISI ………
DAFTAR TABEL ………
DAFTAR LAMPIRAN ………
INTISARI ……….
ABSTRACT ………...
BAB I PENGANTAR ..……….………... A. Latar Belakang Masalah…...………...
B. Perumusan Masalah ………
C. Keaslian Penelitian ……….
D. Manfaat Penelitian ………..
1. Manfaat teoritis ………
2. Manfaat praktis ………
3. Manfaat metodologis ………
E. Tujuan Penelitian ………
A. Asap Cair (Liquid Smoke)………... B. Fenol...………..
C. Farmakokinetika Fenol ...
D. Bahan Tambahan Makanan ...
E. Titrasi Redoks....……….
F. Hipotesis ……….
BAB III METODOLOGI PENELITIAN ………….………...… A. Jenis dan Rancangan Penelitian ……….
B. Variabel Penelitian dan Definisi Operasional ………
C. Bahan Penelitian ……….
D. Alat Penelitian ………
E. Jalannya Penelitian …………..………...
1. Pembuatan Laruta Standar Kalium Bromat ...…………..
2. Pembuatan dan Pembakuan Larutan Standar Natrium Tiosulfat ...…
3. Pembuatan Larutan Pereaksi ...……...
4. Uji Validasi Metode Penetapan Kadar Senyawa Fenolik Total ...
5. Pengambilan dan Penyiapan Sampel ...
6. Uji Kualitatif Senyawa Fenolik Sampel ...
7. Penetapan Blanko ...
8. Penetapan Kadar Senyawa Fenolik Total dalam Asap Cair ...……...
F. Analisis Data ……….
BAB IV HASIL PENELITIAN DAN PEMBAHASAN ………. A. Pembuatan dan Standarisasi Larutan Baku ……....………
B. Uji Validasi Metode dan Percobaan Pendahuluan …..………...
C. Penetapan Kadar Senyawa Fenolik dalam Sampel .………...
1. Penyiapan Sampel Asap Cair ...
2. Uji Kualitatif Senyawa Fenolik Sampel ...
3. Penetapan Kadar Senyawa Fenolik Total Sampel Dihitung Sebagai
Fenol ...
D. Hasil Penetapan Kadar Senyawa Fenolik dalam Sampel ...……….
BAB V KESIMPULAN DAN SARAN ………...….. A. Kesimpulan ……….
B. Saran ………...
DAFTAR PUSTAKA ………..
LAMPIRAN ……….
BIOGRAFI PENULIS ……….. 32
36
36
37
38
40
45
45
45
46
49
55
DAFTAR TABEL
Tabel I. Sifat Fisika Kimia Fenol ………..
Tabel II. Koefisien Fenol Beberapa Fenol Tersubstitusi dan Senyawa
Fenolik yang Memiliki Daya Bakterisid ...
Tabel III. Syarat Penggunaan Pipet ...
Tabel IV. Syarat Penggunaan Buret ...
Tabel V. Hasil Standarisasi Larutan Na2S2O3 ...
Tabel VI. Data perhitungan recovery dan kesalahan sistematik ... Tabel VII. Data perhitungan kesalahan acak ...
Tabel VIII.Kadar Senyawa Fenolik Total dihitung sebagai fenol dalam
asap cair A tanpa penambahan fenol ...
Tabel IX. Kadar Senyawa Fenolik Total dihitung sebagai fenol dalam
asap cair B tanpa penambahan fenol ...
Tabel X. Kadar Senyawa Fenolik Total dihitung sebagai fenol dalam
asap cair A dengan penambahan fenol ...
Tabel XI. Kadar Senyawa Fenolik Total dihitung sebagai fenol dalam
asap cair B dengan penambahan fenol ...
Tabel XII. Hasil analisis Paired Samples T-test untuk asap cair A dengan B tanpa adisi fenol ...
Tabel XIII.Hasil analisis Paired Samples T-test untuk asap cair Adengan B dengan penambahan fenol ...
Tabel XIV.Hasil analisis Paired Samples T-test untuk asap cair B tanpa penambahan fenol dan penambahan fenol ...
Tabel XV. Hasil analisis Paired Samples T-test untuk asap cair A tanpa penambahan fenol dan penambahan fenol ...
Tabel XVI.Data Penimbangan kalium bromat ... 43
49
DAFTAR LAMPIRAN
Lampiran 1. Perhitungan Normalitas Larutan Kalium Bromat 0,1 N ...
Lampiran 2. Standarisasi Larutan Standar Natrium Tiosulfat ...
Lampiran 3. Perhitungan Recovery dan Kesalahan Sistematik ... Lampiran 4. Perhitungan Kesalahan Acak ...
Lampiran 5. Hasil Penetapan Kadar Senyawa Fenolik dalam Sampel Asap
Cair (Liquid Smoke) ... 48
49
50
52
53
INTISARI
Salah satu pengawet makanan yang diusulkan sebagai pengganti formalin dan boraks adalah asap cair, yang merupakan hasil pirolisis lignin dan selulosa. Di dalam asap cair diduga ada kandungan senyawa fenolik sehingga dapat digunakan untuk mengawetkan makanan. Padahal senyawa fenolik sangat toksik, bahkan dapat menimbulkan kematian. Penelitian ini bertujuan untuk menetapkan kadar senyawa fenolik pada kedua jenis asap cair yang mengalami cara pengolahan yang berbeda.
Penelitian ini termasuk penelitian non-eksperimental analitik dengan rancangan penelitian acak lengkap pola satu arah. Pada penelitian ini, kadar senyawa fenolik total dalam asap cair ditetapkan dengan metode bromatometri. Data yang diperoleh dianalisis dengan Paired Samples T-test dengan taraf kepercayaan 95%.
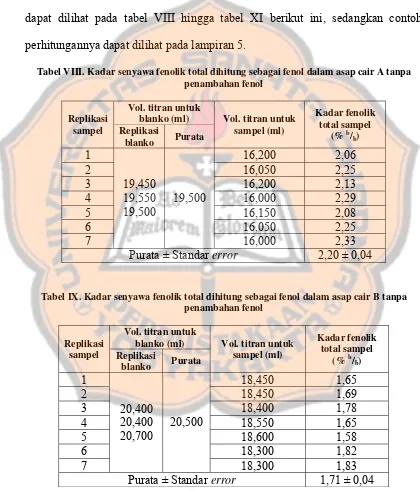
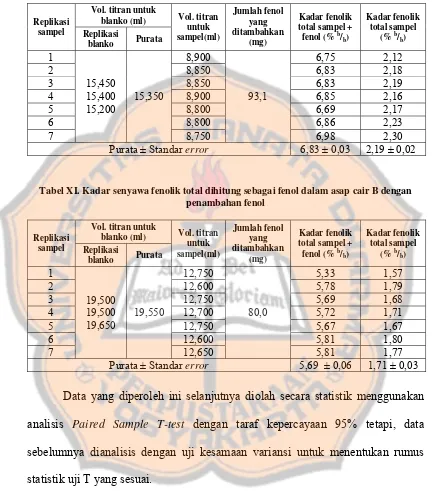
Hasil penelitian menunjukkan rata-rata kadar senyawa fenolik dalam asap cair dua kali distilasi disertai penyaringan (1,71 ± 0,04) % b/b dan asap cair satu
kali destilasi (2,20 ± 0,04) % b/b. Dari analisis T-test didapatkan nilai signifikansi
0,00 < 0,05, maka dapat disimpulkan bahwa terdapat perbedaan yang signifikan antara kadar senyawa fenolik total dalam asap cair dua kali distilasi disertai penyaringan dengan asap cair satu kali distilasi. Dalam hal ini, kadar senyawa fenolik total dalam asap cair dua kali distilasi disertai penyaringan lebih sedikit daripada asap cair satu kali distilasi.
Kata kunci : Senyawa Fenolik, Bromatometri, asap cair
ABSTRACT
Liquid smoke is one of preservatives that is claimed to substitute formalin and borax. It is gained throughout the busting of lignin and cellulose in plant. Therefore, it may contains phenol substances. In the other hand, phenol is very toxic as it can causes sudden death on human. This research is aimed to determine the phenol substances level in two different kinds of liquid smoke.
This research is one direction completed random analitic non-experimental design. In this research, phenol substances in liquid smoke is detemined throughout bromatometric method. The data then analyzed with Paired Samples T-test in confidence level 95%.
The result shows that average level of phenol substance in twice distilled and refined liquid smoke is (1.71 ± 0.04) % w/w while (2.20 ± 0.04) % w/w in once
distilled liquid smoke. Based on the Paired T-test result, there is a significant difference of phenolic substances cointained in both liquid smoke. In this case, the level of phenolic substances in twice distilled and refined liquid smoke is smaller than in once distilled liquid smoke.
Keywords : Phenol substances, Bromatometric method, liquid smoke
BAB I PENGANTAR
A. Latar Belakang Masalah
Pada umumnya bahan makanan memerlukan pengawet untuk mencegah
kerusakan bahan makanan tersebut selama proses distribusi sampai ke tangan
konsumen. Bahan makanan yang diberi pengawet makanan adalah bahan
makanan dalam kemasan yang memiliki kadaluarsa maupun bahan makanan
segar.
Bahan pengawet makanan ditambahkan ke dalam makanan untuk
mempertahankan kesegaran makanan yang diawetkan. Bahan makanan segar yang
banyak diawetkan antara lain adalah daging, sayur-sayuran, ikan, tahu dan mie
basah. Pengawet yang sering digunakan untuk mengawetkan bahan makanan
segar adalah formalin dan boraks. Badan Pengawasan Obat dan Makanan
Republik Indonesia (BPOM-RI) pada tanggal 9 Januari 2006 melaporkan bahwa
77,78 persen sampel tahu di Jakarta mengandung formalin. Di Yogyakarta,
sebanyak 64 persen sampel produk mie basah mengandung formalin. Ini berarti
bahwa Yogyakarta merupakan daerah yang cukup rawan dan potensial dari
peredaran mie yang mengandung formalin.
Formalin merupakan salah satu dari lima puluh empat bahan berbahaya
yang tercantum dalam lampiran 1 Peraturan Menteri Kesehatan Republik
Indonesia Nomor: 472/Men.Kes/Per/V/1996 tentang Pengamanan Bahan
Berbahaya bagi Kesehatan. Formalin adalah larutan 37% gas formaldehida dalam
air yang merupakan salah satu dari zat yang dilarang oleh pemerintah untuk
digunakan dalam makanan. Boraks (Na2BB4O7.10H2O), bentuk garam dari asam
borat seharusnya digunakan sebagai antiseptik untuk pemakaian luar badan.
Berdasarkan Peraturan Menteri Kesehatan Republik Indonesia Nomor
1168/Men.Kes/Per/X/1999, dicantumkan bahwa formalin (formaldehida) dan
boraks termasuk salah satu dari 10 bahan pengawet yang dilarang penggunaannya
dalam makanan (Anonim, 1999 b).
Keracunan formalin dapat terjadi akibat dari konsumsi formalin dengan
kadar tinggi yang digunakan sebagai pengawet dalam makanan, contohnya mie
basah. Jenis makanan ini merupakan makanan yang banyak dikonsumsi oleh
masyarakat. Ketidaktahuan masyarakat akan kemungkinan adanya formalin dalam
makanan dapat menjadi sebab terjadinya keracunan formalin. Kalau terpapar
formaldehida dalam jumlah banyak, misalnya terminum, bisa menyebabkan
kematian. Dalam tubuh manusia, formaldehida dikonversi menjadi asam format
yang meningkatkan keasaman darah, tarikan nafas menjadi pendek dan sering,
hipotermia, juga koma, atau sampai kepada kematian (Anonim, 2006).
Keracunan boraks dapat terjadi jika boraks dengan kadar tinggi masuk ke
dalam tubuh. Boraks mempunyai efek merugikan pada testis dan hypotalamic pituitary. Pada manusia dan hewan percobaan, zat kimia tersebut dapat mempengaruhi fungsi reproduksi. Boraks mampu menekan produksi hormon
testosteron dan sperma. Boraks juga mengganggu mekanisme balik sistem
janin. Selain itu, penelitian pada sejumlah pekerja yang terpapar boraks,
menunjukkan bahwa zat kimia tersebut terbukti dapat mengakibatkan eksema dan
iritasi pada saluran pernapasan.
Bahan pengawet alternatif yang diduga cukup aman untuk digunakan adalah
bahan pengawet makanan alami, misalnya asap cair (liquid smoke). Untuk pengawetan bahan makanan, asap cair tidak sedahsyat formalin atau boraks. Jika
formalin bisa membuat makanan bertahan sangat lama dengan kondisi terlihat
segar serta tidak berpengaruh pada cita rasa, asap cair tetap memiliki rasa dan bau
seperti asap walau dari segi kesehatan lebih baik dibandingkan bahan kimia.
Menurut penemu asap cair, Dr. A. H. Bambang Setiaji, M.Sc. dalam Setiaji
(2000), pembuatan asap cair (liquid smoke) sangat sederhana. Tempurung kelapa dipanaskan dalam tungku pirolisis berdiameter 1,5 m. Tungku bagian atas ditutup
dan diberi pipa saluran untuk mengumpulkan asap ke dalam drum besar yang
dilengkapi dengan alat pendingin dan kumparan yang menghasilkan embun. Dari
kondensasi tersebut terbentuklah cairan asap cair (liquid smoke). Agar cairan tidak terlalu hitam, perlu didistilasi agar lebih jernih. Asap cair dapat digunakan sebagai
bahan pengawet karena kemungkinan mengandung senyawa fenolik dan aldehida
yang dapat membunuh bakteri pembusuk.
Asap cair yang dijual di pasaran ada dua macam, yaitu asap cair dengan satu
kali distilasi dan asap cair dengan dua kali distilasi disertai penyaringan. Dengan
adanya perbedaan jumlah distilasi terhadap asap cair, maka diduga terdapat
Senyawa fenolik termasuk fenol, merupakan substansi yang sangat
berbahaya bagi kesehatan dan tidak termasuk dalam bahan tambahan makanan
(additive) pada Codex Alimentarius, maupun yang dikeluarkan oleh Depkes berdasarkan Peraturan Menteri Kesehatan RI No. 722/MenKes/Per/IX/88.
Apalagi, dengan paparan oral fenol sebesar 1 gram pada manusia dapat
menimbulkan kematian. Dengan demikian, asap cair tidak cukup aman untuk
digunakan sebagai bahan pengawet alternatif.
Metode-metode yang dapat digunakan untuk menetapkan kadar senyawa
fenolik adalah bromatometri, Gas Chromatography (Tesatovai dan Pacaikovai, 1983), HPLC (Tesatovai dan Pacaikovai, 1983), dan spektrofotometri visibel menggunakan pereaksi 4-amino-phenazon (Lacoste, Venable, dan Stone, 1959). Metode yang digunakan untuk menetapkan kadar senyawa fenolik dalam
penelitian ini adalah bromatometri.
B. Perumusan Masalah
Berdasarkan latar belakang tersebut muncul permasalahan sebagai berikut:
a. Apakah ada kandungan senyawa fenolik dalam asap cair?
b. Berapakah kadar senyawa fenolik total di dalam asap cair?
c. Apakah terdapat perbedaan kadar senyawa fenolik total antara dua macam
C. Keaslian Penelitian
Sejauh penelusuran pustaka yang telah dilakukan, penelitian tentang
penetapan kadar senyawa fenolik total dalam asap cair dengan metode
bromatometri belum pernah dilakukan.
D. Manfaat Penelitian 1. Manfaat teoritis
a. Penelitian ini diharapkan dapat bermanfaat sebagai sumber informasi
tentang adanya kandungan senyawa fenolik dalam asap cair.
b. Penelitian ini diharapkan dapat bermanfaat sebagai sumber informasi
tentang besarnya kadar senyawa fenolik total dalam asap cair.
c. Penelitian ini diharapkan dapat bermanfaat sebagai sumber informasi
tentang ada tidaknya perbedaan kadar senyawa fenolik total dalam dua
macam asap cair yang berbeda pengolahannya.
2. Manfaat praktis
Penelitian ini diharapkan dapat bermanfaat sebagai acuan bahwa perbedaan
cara pengolahan asap cair akan mengakibatkan perbedaan kadar senyawa
fenolik total dalam asap cair (liquid smoke).
3. Manfaat metodologis
Penelitian ini diharapkan dapat bermanfaat sebagai acuan penetapan kadar
E. Tujuan Penelitian
1. Untuk menetapkan kadar senyawa fenolik total di dalam asap cair (liquid smoke)
BAB II
PENELAAHAN PUSTAKA
A. Asap Cair (Liquid Smoke)
Asap diartikan sebagai suatu suspensi partikel-partikel padat dan cair
dalam medium gas (Buell dan Girard, 1992). Asap cair (liquid smoke) merupakan larutan dari dispersi asap kayu dalam air yang dibuat dengan mengkondensasikan
asap hasil pirolisis kayu. Cara yang umum digunakan untuk menghasilkan asap
pada pengasapan makanan adalah dengan membakar serbuk gergaji kayu keras
dalam suatu tempat yang disebut alat pembangkit asap, kemudian asap tersebut
dialirkan ke rumah asap dalam kondisi sirkulasi udara dan temperatur yang
terkontrol (Setiaji, 2000).
Asap cair yang diperoleh dari hasil pembakaran batok kelapa berupa cairan
berwarna coklat keruh, sehingga asap cair tersebut didistilasi terlebih dahulu
untuk mengurangi kandungan benzo[a]pyrene dalam asap cair. Namun, asap cair yang telah didistilasi masih keruh sehingga distilat yang diperoleh kemudian
didistilasi kembali kemudian disaring sehingga didapatkan asap cair yang lebih
jernih dan berwarna coklat sangat muda (Setiaji, 2000).
Produksi asap cair merupakan hasil pembakaran tidak sempurna yang
melibatkan reaksi dekomposisi karena pengaruh panas, polimerisasi, dan
kondensasi. Penggunaan berbagai jenis kayu sebagai bahan bakar pengasapan
telah banyak dilaporkan. Pembuatan bandeng asap di daerah Sidoarjo,
menggunakan berbagai jenis kayu sebagai bahan bakar seperti kayu bakau, serbuk
gergaji kayu jati, ampas tebu, dan kayu bekas kotak kemasan. Asap yang
dihasilkan dari pembakaran kayu keras akan berbeda komposisinya dengan asap
yang dihasilkan dari pembakaran kayu lunak. Pada umumnya kayu keras akan
menghasilkan aroma yang lebih unggul, lebih kaya kandungan aromatik dan lebih
banyak mengandung senyawa asam dibandingkan kayu lunak (Buell dan Girard,
1992).
Asap cair memiliki kemampuan untuk mengawetkan bahan makanan
karena adanya senyawa asam, fenolik, dan karbonil. Pirolisis tempurung kelapa
menghasilkan asap cair dengan kandungan senyawa-senyawa sebagai berikut :
asam asetat, asam formiat, maltol, metil siklopentenolon, etil siklopentenolon,
dimetilsiklopentenolon, furfural, dan 5-hidroksimetilfurfural (dari hasil pirolisis
selulosa), fenol, orto-, meta- dan para-kresol, guaiakol, metilguaiakol, 4-etilguaiakol, 4-propilguaiakol, pirokatekol, trimetilfenol, vanilin,
(2-propio)-vanilon, (1-propio)-(2-propio)-vanilon, aseto(2-propio)-vanilon, 2,4,5-trimetilbenzaldehida,
4-hidroksiasetofenon, eugenol, cis- dan trans-isoeugenol, 2,6-dimetoksifenol (Syringol), 4-methylsyringol, 4-ethylsyringol, 4-propylsyringol, 4-acetosyringol,
4-(2-propio)-syringol, 4-(1-propio)-syringol, cis- dan trans -4-(1-propenyl)-syringol, 4-(2-propenyl)--4-(1-propenyl)-syringol, dan syringaldehyde (dari hasil pirolisis lignin)
(Anonim, 2001).
Di Amerika Serikat, pengolah daging menggunakan asap cair yang telah
mengalami pengendapan dan penyaringan untuk memisahkan senyawa tar. Pasar
internasional untuk produk asap cair ini meliputi Amerika, Eropa, Afrika,
pengawetan daging, termasuk daging unggas, kudapan daging, ikan salmon dan
kudapan lainnya. Asap cair juga digunakan untuk menambah citarasa pada saus,
sup, sayuran dalam kaleng, bumbu, dan rempah-rempah (Setiaji, 2000).
Asap cair sudah umum digunakan untuk menggantikan pengasapan
tradisional dan sudah diproduksi secara komersial. Komponen asap terutama
berfungsi untuk memberi cita rasa dan warna yang diinginkan pada produk
asapan, dan berperan dalam pengawetan dengan bertindak sebagai antibakteri dan
antioksidan. Asap telah diketahui memiliki sifat antioksidan dan antimikroba
disamping sifat-sifat lain misalnya merubah tekstur pada produk olahan (daging,
ikan) dan merubah kualitas nutrisi pada produk olahan (Setiaji, 2000).
Aplikasi baru asap cair adalah untuk menambah cita rasa pada makanan
rendah lemak. Pada aplikasi tersebut perlu diperhatikan warna produk yang
dihasilkan, karena ada beberapa produk yang menghendaki warna coklat,
sementara beberapa produk lainnya tidak menghendaki terbentuknya warna
coklat. Selain memiliki segi-segi keuntungan, proses pengasapan dapat
menyebabkan bahan pangan mengandung benzo[a]piren yang bersifat karsinogen yang tidak dikehendaki, dan telah banyak dilakukan usaha untuk mengeliminasi
kandungan senyawa tersebut dalam produk pengasapan (Setiaji, 2000).
Asap cair memiliki banyak manfaat dan telah digunakan pada berbagai
industri, antara lain :
1. Industri pangan
Asap cair ini mempunyai kegunaan yang sangat besar sebagai pemberi rasa
antioksidannya. Dengan tersedianya asap cair maka proses pengasapan
tradisional dengan menggunakan asap secara langsung yang mengandung
banyak kelemahan seperti pencemaran lingkungan, proses tidak dapat
dikendalikan, kualitas yang tidak konsisten serta timbulnya bahaya kebakaran
dapat dihindari. Juga digunakan untuk food processing seperti tahu, mie basah, dan bakso.
2. Industri perkebunan
Asap cair dapat digunakan sebagai koagulan lateks dengan sifat fungsional
asap cair seperti antijamur, antibakteri dan antioksidan tersebut dapat
memperbaiki kualitas produk karet yang dihasilkan.
3. Industri kayu
Kayu yang diolesi dengan asap cair mempunyai ketahanan terhadap serangan
rayap daripada kayu yang tanpa diolesi asap cair (Setiaji, 2000).
B. Fenol
Fenol merupakan senyawa hidrokarbon aromatik monosubstitusi. Fenol
murni berupa padatan kristalin yang berwarna putih, bahkan hampir tidak
berwarna. Fenol akan terasa manis, berbau seperti bau asam bila terlarut dengan
konsentrasi sekitar 40 ppb dalam udara dan 1-8 ppm dalam air. Fenol sangat
mudah menguap/volatil, dan sangat larut dalam air. Fenol termasuk dalam
senyawa yang mudah terbakar (ATSDR, 1988). Sifat fisika kimia fenol yang
Tabel I. Sifat Fisika Kimia Fenol
Sinonim
Benzenol, hydroxybenzene, monophenol,
oxybenzene, phenyl alcohol, phenyl hydrate,
phenyl hydroxide
Nama dagang Carbolic acid, phenic acid, phenic alcohol
Titik lebur (°C) 43
Titik didih (°C) 181,8
Tekanan uap (pada 25 °C) 0,3513
Kerapatan 1,0576
Flashpoint 85 °C
Kelarutan (g/L pada 25 °C) 87
Log Kow 1,46
Berat molekul 94,12
Rumus empiris C6H6O
Rumus struktur OH
(Lide, 1993)
Fenol secara alami terdapat dalam feses hewan maupun manusia, sebagai
hasil penguraian asam amino aromatik dalam sistem metabolisme tubuh manusia.
Semua tumbuhan yang mengandung lignin dan selulosa juga bertindak sebagai
sumber alami fenol di alam, sehingga fenol dalam skala besar biasanya didapatkan
dengan mengisolasi kandungan fenol dalam batu bara (ATSDR, 1988).
Fenol banyak digunakan sebagai senyawa intermediate dalam sintesis senyawa resin fenolik, yang banyak digunakan dalam pembuatan plywood,
senyawa adhesive, konstruksi bangunan, perakitan mobil, dan mesin-mesin industri. Fenol juga digunakan untuk membuat fiber sintetis misalnya nilon dan
Fenol bersifat toksik pada bakteri dan jamur, sehingga banyak digunakan
sebagai disinfektan. Karena sifat anastetiknya, fenol pernah digunakan sebagai
obat anti-infeksi. Aktivitas bakterisid senyawa fenolik dibandingkan dengan fenol
USP, dinyatakan sebagai koefisien fenol, yang menunjukkan perbandingan
pengenceran desinfektan terhadap pengenceran fenol yang diperlukan untuk
membunuh galur mikroorganisme tertentu (Wilson dan Gisvold, 1982).
Tabel II memberikan koefisien fenol beberapa fenol tersubstitusi dan
senyawa fenolik yang memiliki daya bakterisid (Auterhoff, 1978).
Tabel II. Koefisien fenol beberapa fenol tersubstitusi dan senyawa fenolik yang memiliki daya bakterisid.
Senyawa fenolik Koefisien fenol
Fenol 1 m-Kresol 2,5
Timol 30 Xylenol 70 Klor-timol 75
Akan tetapi, sekarang fenol tidak lagi digunakan dalam pengobatan karena
paparan akut oleh fenol per inhalasi maupun kontak dermal dapat menyebabkan
iritasi kulit, selaput membran, dan luka bakar. Paparan akut per oral sangat
beracun, paparan sebanyak satu gram dapat bersifat letal bagi manusia. Dalam
jumlah yang lebih rendah dapat menyebabkan kerusakan hepar dan ginjal,
kerusakan sistem kardiovaskuler mencakup turunnya heart rate, depresi otot jantung dan penurunan tekanan darah. Paparan kronis fenol dapat menyebabkan
C. Farmakokinetika Fenol
Hasil penelitian pada tikus maupun sukarelawan menunjukkan bahwa
fenol sangat mudah memapari manusia melalui berbagai jalur absorbsi.
Ditemukannya lebih dari 90% fenol dari dosis yang diberikan pada urin
menunjukkan bahwa fenol dapat diabsorbsi sempurna oleh tubuh (Hughes dan
Hall, 1995; Kenyon et al., 1995). Jumlah fenol yang dapat diabsorbsi tubuh akan dipengaruhi oleh jalur pemaparan fenol. Pemaparan melalui kulit memungkinkan
fenol yang terabsorbsi menjadi lebih sedikit dibanding pemaparan jalur per oral
dan per inhalasi (Tanaka et al., 1998). Akan tetapi, kecepatan absorbsi fenol melalui pemaparan jalur manapun adalah sama, yang ditunjukkan dengan waktu
onset penampakan gejala keracunan fenol adalah 4,5 jam setelah pemaparan
(Hotchkiss et al., 1992; Hughes dan Hall, 1995).
Fenol akan segera terdistribusi dengan cepat di dalam tubuh melalui jalur
pemaparan manapun. Penelitian pada tikus menunjukkan bahwa organ-organ yang
memiliki kemampuan perfusi tinggi, seperti hepar, ginjal, dan paru mengandung
fenol dalam kadar yang lebih tinggi dibanding di dalam darah (Hughes dan Hall,
1995).
Di dalam tubuh, fenol akan mengalami biotransformasi umumnya pada
fase dua dengan berlangsungnya konjugasi sulfat dan glukuronat. Namun fenol
yang tidak terkonjugasi akan menjadi substrat untuk oksidasi enzim sitokrom
P450 2E1, menghasilkan senyawa hidrokuinon, bifenol dan katekol (Barron,
Hasil penelitian Capel et al. (1972) dengan memberikan senyawa fenol secara per oral dengan dosis 0,01 mg/kgBB pada tiga orang dewasa sehat,
menunjukkan bahwa 85-95% dari dosis fenol yang diberikan akan diekskresikan
keluar dari tubuh setelah 24 jam dengan 69-90% dieksresikan sebagai fenil sulfat,
4-23% dieksresikan sebagai fenil glukuronida, sementara sisanya dieksresikan
sebagai hidrokuinon.
Namun pada pemberian dengan dosis lebih tinggi, jalur sulfasi dan
glukuronidasi menjadi jenuh, sehingga fenol tidak dapat termetabolisme. Hal ini
akan mengakibatkan naiknya kadar fenol secara mendadak di dalam darah yang
berkorelasi dengan semakin meningkatnya toksisitas akut fenol (Sawahata dan
Neal, 1983; Gilmour et al., 1986; Chapman et al., 1994; Kenyon et al., 1998). Fenol dalam jumlah kecil akan sangat mudah diekskresikan dari tubuh
tanpa mengalami akumulasi, dengan jalur utama ekskresi adalah melalui urin, dan
sedikit sekali yang dikeluarkan melalui hepar (Ohtsuji dan Ikeda, 1972). Fenol
juga memiliki klirens dalam darah yang sangat cepat karena waktu paruh fenol
dalam darah diperkirakan hanya 13,86 jam (Bentur et al., 1998).
D. Bahan Tambahan Makanan 1. Pengertian bahan tambahan makanan
Bahan tambahan makanan dalam pengertian luas adalah setiap bahan
yang ditambahkan pada makanan. Istilah ini menunjukkan bahwa bahan
tambahan makanan yang digunakan bertujuan untuk memberikan karakteristik
dalam produksi, pengolahan, pengemasan, pengangkutan, atau penyimpanan
makanan (Anonim, 1999 a).
Bahan tambahan makanan dalam pengertian khusus adalah senyawa
kimia yang sengaja dimasukkan ke dalam makanan untuk membantu proses
pembuatan, bertindak sebagai pengganti atau memperbaiki kualitas makanan
yang bertujuan untuk mengawetkan makanan atau untuk membuatnya lebih
menarik (deMan, 1989).
Penggunaan bahan tambahan dalam makanan mempunyai fungsi
yang beragam. Bahan tambahan dapat membantu kestabilan pada
penyimpanan makanan seperti membuat awet, sehat, dan menarik dari tempat
awal produksi sampai tempat pemasaran. Bahan pangan membutuhkan bahan
tambahan karena bahan pangan dapat rusak akibat pengaruh faktor
lingkungan, misalnya perubahan temperatur, oksidasi, dan pencemaran
mikroorganisme (Buckle et al., 1987).
Bahan tambahan mempunyai lima kegunaan, yaitu sebagai bahan
yang ditambahkan untuk memelihara konsistensi produk (sebagai emulgator,
stabilisator, pengembang, anti kempal), membuat makanan tetap dalam tekstur
yang baik, meningkatkan atau menjaga nilai gizi (vitamin dan mineral),
mempertahankan makanan tetap sehat (contohnya pengawet dan antioksidan),
mengontrol keasaman atau kebasaan (contohnya ragi dan bahan-bahan untuk
memodifikasi keasaman atau kebasaan makanan), mempertinggi aroma, dan
memperkuat warna yang dikehendaki dengan bumbu-bumbu dan aroma alami
2. Bahan pengawet kimia
Bahan pengawet menurut Peraturan Menteri Kesehatan Republik
Indonesia Nomor : 722/Men.Kes/PER/X/1988 adalah bahan tambahan yang
dapat mencegah atau menghambat fermentasi, pengasaman atau peruraian lain
terhadap makanan yang disebabkan oleh mikroorganisme (Anonim, 1990).
Bahan-bahan pengawet kimia adalah salah satu kelompok dari
sejumlah besar bahan-bahan kimia yang ditambahkan dengan sengaja ke
dalam bahan pangan atau ada di dalam bahan pangan sebagai akibat dari
perlakuan pra-pengolahan atau penyimpanan. Untuk penyesuaian dengan
penggunaannya dalam pengolahan secara baik, penggunaan bahan-bahan
pengawet ini seharusnya tidak menimbulkan penipuan, menurunkan nilai gizi
bahan pangan, dan tidak memungkinkan pertumbuhan organisme-organisme
yang menimbulkan keracunan bahan pangan (Buckle et al., 1987).
National Health and Medical Research Council menyebutkan bahwa bahan-bahan pengawet kimia yang digunakan dalam makanan antara lain:
asam benzoat, sulfit, metabisulfit, nisin, asam askorbat dan propionat atau
garam-garamnya dan senyawa peroksida (Buckle et al., 1987).
E. Titrasi Redoks
Analisis secara titrimetri berdasarkan reaksi kimia seperti :
aA + tT → hasil (1)
Dengan keterangan : a molekul analit A bereaksi dengan t molekul pereaksi T.
dengan konsentrasi yang diketahui. Titran merupakan larutan standar dan
konsentrasinya ditetapkan oleh suatu proses standarisasi. Penambahan titran
dilakukan hingga sejumlah titran yang secara kimia setara dengan analit yang
telah ditambahkan maka dapat dikatakan bahwa titik ekivalen telah tercapai.
Untuk mengetahui apakah penambahan titran sudah harus dihentikan, dapat
digunakan suatu senyawa kimia yang disebut indikator, yang mempunyai
tanggapan terhadap adanya titran berlebih yang biasanya ditunjukkan dengan
perubahan warna (Underwood dan Ray, 1999).
Titik ekivalen tercapai bila grek analit tepat sama banyaknya dengan grek
zat standar. Dalam titrimetri, titik ekivalen tersebut ditetapkan dengan memakai
suatu indikator, yaitu zat yang akan mengalami perubahan saat titik ekivalen
tercapai. Wujud perubahan indikator itu mungkin suatu perubahan warna atau
pembentukan suatu presipitan. Pada umumnya perubahan indikator tersebut tidak
terjadi tepat pada titik ekivalen tetapi beberapa saat setelah titik ekivalen itu
tercapai. Saat suatu indikator mengalami perubahan disebut sebagai titik akhir
titrasi. Pemilihan indikator harus setepat-tepatnya agar selisih antara titik ekivalen
dan titik akhir titrasi menjadi sekecil-kecilnya sehingga mampu menekan resiko
terjadinya kesalahan titrasi (Skoog dan West, 1994).
Titrasi redoks adalah titrasi yang meliputi hampir semua reaksi
oksidasi-reduksi. Istilah oksidasi mengacu pada setiap perubahan kimia pada saat suatu
senyawa mengalami kenaikan bilangan oksidasi sedangkan reduksi digunakan
untuk setiap penurunan bilangan oksidasi. Artinya, proses oksidasi disertai dengan
senyawa yang mengandung salah satu atom yang mengalami penurunan bilangan
oksidasi. Sebaliknya pada reduktor atom yang terkandung mengalami kenaikan
bilangan oksidasi. Oksidasi atau reduksi harus selalu berlangsung bersama dan
saling mengkompensasi satu sama lain. Istilah oksidator reduktor mengacu kepada
suatu senyawa tidak pada atomnya saja. Jika suatu zat berperan baik sebagai
oksidator atau reduktor maka zat tersebut dikatakan mengalami auto oksidasi atau
disproporsionasi (Khopkar, 1990).
Berbeda dengan reaksi netralisasi, pada reaksi redoks terjadi transfer
elektron dari pasangan reduktor ke pasangan pengoksidasi. Kedua reaksi paro dari
suatu reaksi reduksi-oksidasi umumnya ditulis sebagai berikut :
red oks + ne (2)
Red menunjukkan bentuk tereduksi dan oks menunjukkan bentuk teroksidasi, n
adalah jumlah elektron yang ditransfer dan e adalah elektron. Tidak mungkin ada suatu reaksi paro redoks (reduksi-oksidasi), untuk itu diperlukan 2 reaksi paro,
satu memberikan elektron dan yang lainnya mempergunakannya. Pada persamaan
(2) terlihat bahwa oksidasi adalah proses hilangnya elektron pada suatu senyawa
dan reduksi adalah proses suatu senyawa memperoleh elektron (Connors, 1982).
Hal lain yang harus diperhatikan pada analisis secara titrimetri adalah
peneraan alat yang akan digunakan. Peneraan atau kalibrasi alat sangat penting
untuk mengurangi kesalahan sistematik akibat pemilihan dan penggunaan alat
yang digunakan dalam analisis. Pemilihan pipet dan buret dapat dilihat pada tabel
Tabel III. Syarat penggunaan pipet
Volume (ml) 1 2 3 10 25 50 100 Batas kesalahan (ml) 0,006 0,006 0,01 0,02 0,03 0,05 0,08 Batas kesalahan (%) 0,6 0,3 0,2 0,2 0,12 0,1 0,08
Tabel IV. Syarat penggunaan buret
Volume (ml) 10 25 50 Pembagian skala (ml) 0,02 0,1 0,1 Batas kesalahan (ml) 0,02 0,03 0,05
Tabel III dan IV dapat membantu penentuan pilihan terhadap penggunaan alat
pipet maupun buret (Anonim, 1995).
F. Hipotesis
Cara pengolahan asap cair yang berbeda menyebabkan perbedaan kadar
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini tergolong dalam penelitian non-eksperimental analitik
dengan rancangan penelitian murni sederhana dengan analisis statistik
menggunakan uji T (Turkey).
B. Variabel Penelitian dan Definisi Operasional 1. Variabel Penelitian
a. Variabel bebas.
Variabel bebas yaitu variabel yang direncanakan untuk diberi pengaruhnya
terhadap variabel tergantung. Variabel bebas dalam penelitian ini adalah
perlakuan pengolahan untuk mendapatkan asap cair yaitu distilasi dua kali
disertai penyaringan dan distilasi satu kali.
b. Variabel tergantung.
Variabel tergantung yaitu titik pusat permasalahan yang merupakan
kriteria penelitian ini. Variabel tergantung dalam penelitian ini adalah
kadar senyawa fenolik total dalam asap cair.
c. Variabel pengacau terkendali
Variabel pengacau terkendali yaitu variabel yang diketahui atau secara
teoritis mempuyai pengaruh terhadap variabel tergantung, tetapi dapat
dikendalikan. Variabel pengacau terkendali dalam penelitian ini adalah :
1) Jenis asap cair. Asap cair yang digunakan adalah asap cair yang
diambil dari satu toko.
2) Alat yang digunakan yaitu buret dan pipet dikendalikan dengan cara
mengukur validitas metode yang digunakan [persen perolehan kembali
(recovery), kesalahan sistematik, dan kesalahan acak]. 2. Definisi Operasional
a. Liquid smoke adalah asap yang diperoleh dari hasil pirolisis tempurung kelapa yang kemudian dikondensasi untuk selanjutnya digunakan sebagai
bahan pengawet makanan.
b. Bromatometri adalah titrasi yang melibatkan reaksi reduksi oksidasi tidak
langsung antara analit dengan brom bebas yang diperoleh dari reduksi
bromat.
c. Pengolahan asap cair yaitu distilasi satu kali dan distilasi dua kali disertai
penyaringan.
d. Kadar senyawa fenolik total dihitung sebagai fenol dalam asap cair dalam
satuan % b/b.
C. Bahan Penelitian
Kalium bromat, natrium tiosulfat pentahidrat, amilum soluble, fenol, dan
natrium hidroksida (p.a. E. Merck); Kalium bromida, kalium iodida (Sigma
D. Alat Penelitian
Alat-alat gelas yang lazim digunakan dalam laboratorium analisis,
timbangan analitik dengan sensitivitas 100,0 mg (Shimadzu, type LM20), buret dengan skala terkecil 0,05 ml.
E. Jalannya Penelitian 1. Pembuatan larutan Kalium bromat 0,1 N
Larutan kalium bromat 0,1 N dibuat dengan melarutkan 0,2784 g kalium
bromat P (KBrO3) dalam aquadest hingga 100,0 ml (Anonim, 1995).
2. Pembuatan dan pembakuan larutan standar Natrium tiosulfat 0,1 N Pembuatan.
Lebih kurang 6,5 g natrium tiosulfat pentahidrat P dan 50 mg natrium
karbonat P dilarutkan dalam air bebas CO2 yang sebelumnya telah dididihkan
5 menit dan didinginkan, hingga 250,0 ml (Anonim, 1995).
Pembakuan.
Lebih kurang 40,0 ml larutan kalium bromat dipindahkan secara seksama ke
dalam labu Erlenmeyer bersumbat kaca, kemudian ditambahkan 3 g kalium
iodida P dan 3 ml asam klorida P. Iodium yang dibebaskan dititrasi dengan
natrium tiosulfat, dan 3 ml indikator kanji LP ditambahkan mendekati titik
Standarisasi larutan natrium tiosulfat dilakukan sebelum penetapan kadar
sampel dengan tiga kali replikasi. Setelah diketahui normalitas rata-ratanya,
dihitung standar error untuk setiap kali standarisasi.
3. Pembuatan larutan pereaksi a. Larutan Brom 0,1 N
Tiap 1000 ml larutan mengandung 7990 g Br (Anonim, 1995). Satu koma
lima (1,5) g kalium bromat Pdan 7,5 g kalium bromida P dilarutkan dalam
aquadest hingga 500,0 ml (Anonim, 1995). b. Larutan Kalium iodida LP
Enam belas koma lima (16,5) g kalium iodida P dilarutkan dalam aquadest
hingga 100 ml (Anonim, 1995).
c. Larutan Kanji LP
Lima ratus (500) mg kanji P digerus dengan 5 ml aquadest, lalu
ditambahkan ke dalam aquadest hingga 100 ml sambil diaduk, didihkan
hingga seluruh kanji larut, kemudian disaring (Anonim, 1995).
4. Uji validasi metode penetapan kadar senyawa fenolik total a. Pembuatan larutan stock fenol 1,00% b/v
Satu (1) gram fenol baku ditimbang seksama, kemudian dilarutkan dalam
b. Penetapan blanko
Sepuluh mililiter (10,0 ml) aquadest dipipet ke dalam labu Erlenmeyer bersumbat kaca, lalu ditambahkan 20,0 ml brom 0,1 N LV, kemudian
ditambahkan 5 ml asam klorida P, dan segera ditutup. Labu dikocok
berulang-ulang selama 30 menit, didiamkan selama 15 menit, dan 5 ml
larutan kalium iodida LP ditambahkan dengan cepat, kemudian ditutup.
Labu dikocok kuat-kuat, sumbat dibuka untuk dibilas dengan sedikit
aquadest ke dalam labu. Iodium bebas dititrasi dengan natrium tiosulfat 0,1 N LV, menggunakan indikator 3 ml kanji LP yang ditambahkan
sebelum titik akhir, titrasi dilanjutkan sampai warna biru tepat hilang.
c. Penentuan perolehan kembali (recovery)
Dari larutan stock fenol dibuat tiga peringkat larutan fenol dengan kadar 0,10, 0,20, dan 0,30% b/v dengan lima kali replikasi menggunakan pelarut
aquadest hingga volume 100,0 ml. Larutan fenol tersebut dipipet 10,0 ml ke dalam labu Erlenmeyer bersumbat kaca, ditambah 20,0 ml brom 0,1 N
LV, kemudian ditambah 5 ml asam klorida P, segera tutup. Labu dikocok
berulang-ulang selama 30 menit, kemudian didiamkan selama 15 menit,
ditambah 5 ml larutan kalium iodida LP. Labu dikocok kuat-kuat, dibuka
sumbatnya, sumbat dan leher labu dibilas dengan sedikit aquadest ke
dalam labu. Iodium bebas yang dihasilkan dititrasi dengan natrium
tiosulfat, dengan indikator dalam kanji LP yang ditambahkan menjelang
titik akhir titrasi dilanjutkan sampai warna biru tepat hilang (Anonim,
Data yang diperoleh dihitung untuk mendapatkan kadar fenol dalam
larutan. Penemuan kembali diperoleh dengan mencari rasio antara kadar
terukur dengan kadar sebenarnya dikalikan 100%.
Rumus penentuan perolehan kembali, recovery (P):
P = x100%
sebenarnya Kadar
terukur Kadar
Syarat metode analisis yang valid yaitu jika metode tersebut memberikan
nilai perolehan kembali (recovery) yang tinggi (97 – 103% untuk kadar analit pada matriks sampel antara 1-10%) (Harmita, 2004).
d. Kesalahan sistematik
Kesalahan sistematik = 100% - P
Keterangan : P adalah perolehan kembali, recovery (%)
Kesalahan sistematik yang baik yaitu kurang dari 3% untuk kadar analit
pada matriks sampel antara 1-10% (Harmita, 2004).
e. Kesalahan acak
Kesalahan acak dicerminkan oleh CV (coefficient of variation)
Kesalahan acak (CV) = X SD
x 100%
Keterangan : simpangan baku (SD) =
1
Nilai kesalahan acak yang baik yaitu kurang dari 2,5% untuk kadar analit
5. Pengambilan dan Penyiapan Sampel
Asap cair yang digunakan adalah asap cair yang diambil dari satu toko. Asap
cair ditimbang seksama 2 g, lalu dimasukkan ke dalam labu ukur volume 100
ml, dilarutkan dengan 4 ml NaOH 10% b/v hingga pH = 10, kemudian
ditambah dengan aquadest hingga batas tanda (Helrich, 1990).
6. Uji Kualitatif Senyawa Fenolik Sampel
Sampel asap cair diuji kandungan senyawa fenoliknya dengan pereaksi FeCl3,
kemudian diamati warna yang terbentuk. Hasilnya kemudian ditambah etanol
untuk diamati perubahan intensitas warnanya.
7. Penetapan Blanko
Sepuluh mililiter (10,0 ml) aquadest dipipet ke dalam labu Erlenmeyer
bersumbat kaca, lalu ditambahkan 20,0 ml brom 0,1 N LV, kemudian
ditambahkan 5 ml asam klorida P, dan segera ditutup. Labu dikocok
berulang-ulang selama 30 menit, didiamkan selama 15 menit, dan 5 ml larutan kalium
iodida LP ditambahkan dengan cepat, kemudian ditutup. Labu dikocok
kuat-kuat, sumbat dibuka untuk dibilas dengan sedikit aquadest ke dalam labu. Iodium bebas dititrasi dengan natrium tiosulfat, menggunakan indikator 3 ml
kanji LP yang ditambahkan sebelum titik akhir, titrasi dilanjutkan sampai
8. Penetapan kadar senyawa fenolik total dalam asap cair
Sepuluh (10,0) ml larutan sampel dipindahkan ke dalam labu Erlenmeyer
bersumbat kaca, lalu ditambahkan 20,0 ml brom 0,1 N LV, 5 ml asam klorida
P, dan segera ditutup. Labu dikocok berulang-ulang selama 30 menit, dan
didiamkan selama 15 menit, lalu ditambahkan dengan cepat 5 ml larutan
kalium iodida LP, dan segera ditutup. Setelah itu, labu dikocok kuat-kuat,
sumbatnya dibuka, dibilas dengan sedikit air ke dalam labu. Iodium bebas
yang dihasilkan dititrasi dengan natrium tiosulfat, dengan indikator kanji LP
yang ditambahkan sebelum titik akhir, titrasi dilanjutkan sampai warna biru
tepat hilang (Anonim, 1995).
F. Analisis Data
Data yang diperoleh dalam penelitian ini berupa volume titran (Natrium
tiosulfat) yang dibutuhkan untuk meniter iodium bebas yang dilepaskan oleh
tiap-tiap sampel. Dari data tersebut kemudian dihitung kadar senyawa fenolik total
dalam sampel dan dinyatakan dengan satuan persen berat (% b/b).
Data penetapan kadar senyawa fenolik total dalam sampel yang diperoleh
dari uji kuantitatif untuk masing-masing jenis sampel asap cair dianalisis dengan
uji Turkey untuk melihat perbedaan masing-masing perlakuan pengolahan terhadap kadar senyawa fenolik total yang terkandung di dalamnya.
• Rumus perhitungan dengan uji T.
Daerah krisis tahap nyata α = 0,05 secara dua arah dengan n1 dan n2 adalah
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
A. Pembuatan dan Standarisasi Larutan Standar
Pada penelitian ini, metode yang digunakan untuk menetapkan kadar
senyawa fenolik total dalam liquid smoke adalah bromatometri. Untuk
menetapkan kadar senyawa fenolik total dalam sampel pada metode ini,
diperlukan larutan standar yang sudah diketahui normalitasnya. Dengan
mengetahui normalitas larutan standar, maka kadar senyawa fenolik total dalam
sampel dapat diketahui. Larutan standar yang digunakan dalam penelitian ini yaitu
natrium tiosulfat.
Larutan natrium tiosulfat merupakan larutan standar sekunder. Hal ini
disebabkan karena natrium tiosulfat merupakan larutan yang tidak stabil dalam
penyimpanan karena akan terdekomposisi menjadi natrium hidrogen sulfit dan
endapan belerang menurut reaksi :
S2O32- (aq) + H+ → HSO3- (aq) + S (s)
Dekomposisi tersebut dapat dipengaruhi oleh pH larutan, adanya mikroorganisme,
konsentrasi larutan, keberadaan ion Cu2+, dan pengaruh cahaya. Dengan adanya
dekomposisi natrium tiosulfat tersebut, maka normalitas larutan natrium tiosulfat
tidak dapat diketahui dengan pasti, sehingga perlu distandarisasi dengan suatu
larutan standar primer.
Larutan natrium tiosulfat distandarisasi dengan larutan kalium bromat
yang telah diketahui normalitasnya. Karena normalitas larutan kalium bromat
telah diketahui, maka normalitas larutan natrium tiosulfat dapat ditentukan. Dalam
penelitian ini, normalitas larutan kalium bromat yang digunakan dapat dilihat pada
lampiran 1.
Menurut Skoog et al. (1994), larutan standar primer yang terbaik untuk menstandarisasi larutan natrium tiosulfat adalah larutan kalium iodat dan larutan
kalium iodida dalam suasana asam, yang akan menghasilkan I2 bebas untuk
mengoksidasi ion tiosulfat menjadi ion tetrationat. Namun dalam Farmakope
Indonesia edisi IV, larutan standar primer yang digunakan untuk menstandarisasi
larutan natrium tiosulfat adalah larutan kalium bromat dan larutan kalium bromida
(air brom) dalam suasana asam. Bila kalium bromat dan kalium bromida
dicampurkan dalam aquadest kemudian diasamkan, maka akan segera terjadi
reaksi :
BrO3- + 5Br- + 6H+ → 3Br2↑ + 3H2O
Brom yang dibebaskan kemudian direaksikan dengan kalium iodida yang
berlangsung secara stoikiometri menurut reaksi :
Br2 + 2I- → 2Br- + I2
Iodin (I2) yang dibebaskan ini sangat larut dalam air (1,33x10-3 M pada suhu 20
ºC), namun kelarutannya akan bertambah bila iodin bebas tersebut membentuk
kompleks dengan iodida membentuk triiodida/iodin terlarut. Reaksi :
I2 + I- → I3-
Iodin terlarut yang dihasilkan ini yang akan mengoksidasi tiosulfat menjadi ion
tetrationat menurut reaksi :
Baik brom maupun iodin terlarut dapat sama-sama bertindak sebagai
oksidator untuk mengoksidasi tiosulfat menjadi tetrationat. Akan tetapi karena
daya oksidasi brom lebih kuat daripada iodin, maka tiosulfat yang sudah
teroksidasi oleh brom membentuk tetrationat akan teroksidasi lebih lanjut lagi
membentuk peroksidisulfat. Reaksinya adalah sebagai berikut :
Br2 + 2S2O32- → 2Br- + S4O6
2-S4O62- + 9Br2 + 10H2O → 18HBr + 2S2O82- + 2H+
Rentang buret yang digunakan berkisar 20-80% dari volume buret
tersebut. Hal ini untuk menjaga agar persentase kesalahan penggunaan buret tidak
semakin besar sehingga kesalahan sistematik yang mungkin terjadi juga dapat
dihindari.
Data hasil standarisasi larutan standar Na2S2O3 dapat dilihat di tabel V dan
contoh perhitungannya dapat dilihat pada lampiran 2.
Tabel V. Hasil Standarisasi Larutan standar Na2S2O3
Percobaan ke- Normalitas Na2S2O3
tidak mengalami penyimpangan yang berarti pada setiap replikasi dalam satu kali
standarisasi. Selanjutnya data ini digunakan untuk menganalisis penetapan kadar
senyawa fenolik dalam sampel.
B. Uji Validasi Metode dan Percobaan Pendahuluan
Uji validasi metode dilakukan dengan maksud untuk mengetahui apakah
metode penetapan kadar secara bromatometri untuk sampel yang telah dirancang
memenuhi kriteria penetapan kadar secara umum atau tidak.
Sebelum dilakukan uji validasi metode, juga dilakukan percobaan
pendahuluan untuk mencari batasan optimal untuk tiap-tiap langkah kerja dalam
penetapan kadar senyawa fenolik. Beberapa parameter yang dioptimasi antara lain
jumlah penambahan larutan brom, lamanya waktu penggojogan labu, dan lamanya
waktu pendiaman labu setelah digojog.
Berdasarkan hasil beberapa kali percobaan pendahuluan, didapatkan
bahwa jumlah penambahan larutan brom berbanding lurus dengan jumlah titran
Na2S2O3 yang dibutuhkan. Maka diputuskan untuk menambahkan larutan brom
sebanyak 20,0 ml dengan pertimbangan bahwa kadar senyawa fenolik total di
dalam sampel cukup kecil, sehingga penambahan dalam jumlah besar tidak
efisien. Hal ini disebabkan jumlah brom yang bereaksi dengan sampel sangat
sedikit sehingga akan tersisa brom dalam jumlah banyak, yang mengakibatkan
banyaknya jumlah titran yang dibutuhkan untuk menitrasi I2 yang dibebaskan dari
sisa brom.
kadar senyawa fenolik dengan metode bromatometri, asalkan labu digojog sampai
homogen. Waktu penggojogan labu yang dipakai selama penelitian adalah 30
menit karena cairan di dalam labu baru mulai terdispersi homogen setelah digojog
hampir 30 menit.
Berdasarkan hasil percobaan pendahuluan, bila labu didiamkan kurang
dari 15 menit, maka brom yang terbentuk belum bereaksi seluruhnya dengan
senyawa fenolik dalam sampel, yang ditunjukkan dengan timbulnya kembali
warna ungu setelah titik akhir titrasi tercapai dan analit dibiarkan selama lebih
dari 10 menit. Namun, setelah didiamkan lebih dari 10 menit, jumlah titran yang
dibutuhkan semakin lama semakin sedikit. Hal ini dimungkinkan karena brom
bebas yang terbentuk menguap, karena senyawa halogen termasuk senyawa yang
mudah menguap. Dengan demikian, didapatkan waktu pendiaman labu yang
optimal adalah 15 menit.
Prinsip dari metode bromatometri adalah reaksi substitusi nukleofilik pada
posisi orto dan para pada gugus –OH fenolik terhadap senyawa-senyawa fenol oleh brom berlebih yang dihasilkan dari reaksi oksidasi reduksi antara kalium
bromat dengan kalium bromida dalam suasana asam. Brom sisa yang tidak
mensubstitusi senyawa fenol akan bereaksi dengan kalium iodida membentuk
iodin, yang akan dicari jumlahnya dengan menitrasi iodin yang dibebaskan
tersebut dengan natrium tiosulfat. Jumlah iodin yang didapatkan menunjukkan
jumlah brom sisa yang tidak bereaksi dengan senyawa fenol.
Tahapan reaksi yang terjadi adalah sebagai berikut :
3Br2
Metode bromatometri ini merupakan metode titrasi tidak langsung karena
fenol tidak langsung bereaksi dengan larutan kalium bromat, melainkan bereaksi
dengan brom berlebih yang didapat dari reaksi oksidasi reduksi antara kalium
bromat dengan kalium bromida dalam suasana asam.
Range recovery yang digunakan dalam penelitian ini adalah 97-103%, batas kesalahan sistematik adalah kurang dari 3%, dan batas kesalahan acak
adalah kurang dari 2%.
Tabel VI. Data perhitungan recovery dan kesalahan sistematik
Kadar
5 0,1174 100,1733
98,3893 1,6107 0,0005
1 0,3529 100,4020
2 0,3545 100,8594
3 0,3545 100,8594
4 0,3553 101,0881
0,3515
5 0,3521 100,1733
Dari tabel VI, data recovery yang diperoleh dari masing-masing variasi konsentrasi sampel masuk dalam range recovery yang telah ditentukan sedangkan data persentase kesalahan sistematik yang terjadi dalam penelitian ini juga cukup
kecil, yaitu kurang dari 10%. Hal ini membuktikan bahwa metode penetapan
kadar yang digunakan memiliki keakuratan yang tinggi. Contoh perhitungan
recovery dan kesalahan sistematik dapat dilihat pada lampiran 3.
Tabel VII. Data perhitungan kesalahan acak
Simpangan baku (SD)
Nilai purata (X) Kesalahan acak (%) (CV)
0,0012 0,1153 1,0408 0,0019 0,2293 0,8286 0,0013 0,3539 0,3673
Dari tabel VII, besarnya kesalahan acak yang terjadi pada masing-masing
variasi konsentrasi untuk uji validasi metode cukup kecil yaitu di bawah 2%. Hal
ini berarti bahwa metode bromatometri yang akan digunakan untuk menetapkan
kadar sampel selanjutnya juga dianggap cukup teliti. Contoh perhitungan
kesalahan acak dapat dilihat pada lampiran 4.
Untuk uji sensitivitas, metode ini mampu mendeteksi fenol pada
konsentrasi 0,3515%, 0,2343% hingga konsentrasi 0,1172% dari sampel yang
ditetapkan. Hal ini ditunjukkan oleh data persentase kadar yang diperoleh dari
masing-masing variasi konsentrasi sampel yang sesuai dengan syarat range
C. Penetapan Kadar Senyawa Fenolik Total dalam Sampel 1. Penyiapan sampel asap cair
Asap cair (liquid smoke) yang digunakan sebagai sampel berasal dari satu toko, dan sebelum dianalisis harus dihomogenkan terlebih dahulu agar setiap
bagian asap cair mempunyai kesempatan untuk terambil sebagai sampel karena
syarat pengambilan sampel harus representatif, jika pengambilan sampel salah
(walaupun metode analisisnya tepat dan teliti) maka hasilnya akan keliru. Asap
cair setiap perlakuan disiapkan sebanyak lima jerigen dan masing-masing jerigen
berisi lima liter. Kelima jerigen tersebut dicampur menjadi satu dalam satu wadah
dan kemudian diambil sebagian untuk kemudian ditimbang sebanyak tiap-tiap 5
gram untuk dianalisis.
Sampel yang sudah ditimbang kemudian ditambah NaOH. Dengan
demikian, senyawa fenolik dalam sampel yang bersifat asam lemah akan berikatan
dengan NaOH membentuk ion fenolat, menurut reaksi :
OH
NaOH
ONa
H2O
Penambahan NaOH berguna untuk menciptakan suasana basa, karena
medium titrasi berupa medium basa. pH medium yang dibutuhkan adalah ± 10,
tidak terlalu basa. Apabila medium titrasi terlalu basa, maka brom bebas yang
dihasilkan dapat mengalami reaksi autoredoks membentuk bromida dan
hipobromida menurut reaksi :
Br2 + 2OH- → Br- + BrO- + H2O
menguraikan indikator amilum menjadi sakarida yang lebih sederhana daripada
amilum. Selain itu dapat meningkatkan kekuatan beberapa reduktor, padahal
sampel juga mengandung senyawa yang bersifat reduktor.
Ion iodida (I-) yang terbentuk dari reaksi antara tiosulfat dan iodin juga
akan teroksidasi kembali membentuk iodin apabila medium titras berupa medium
basa. Dengan demikian, ekivalensi iodine dari titrasi menjadi tidak setara dengan
ekivalensi senyawa fenolik dalam sampel yang akan ditetapkan kadarnya. Reaksi
yang terjadi adalah sebagai berikut :
4I- + O2 + 4H+ → 2I2 + 2H2O
2. Uji Kualitatif Senyawa Fenolik Sampel
Untuk memastikan apakah sampel asap cair mengandung senyawa fenolik,
maka dilakukan uji kualitatif kandungan senyawa fenolik dalam asap cair. Uji
kualitatif senyawa fenolik dilakukan dengan menambahkan ferri-klorida (FeCl3)
ke dalam sampel, yang akan memberikan warna ungu apabila sampel
mengandung senyawa fenolik. Hasil uji kualitatif menunjukkan bahwa sampel
asap cair mengandung senyawa fenolik karena memberikan warna ungu ketika
ditambahkan larutan FeCl3.
Reaksi antara senyawa fenolik dengan ion Fe3+ akan menghasilkan
senyawa kompleks yang berwarna ungu.
Selanjutnya untuk mengetahui apakah senyawa fenolik dalam asap cair
merupakan derivat senyawa salisilat atau bukan, maka ke dalam hasil reaksi
fenolik derivat salisilat mampu membentuk kompleks dengan Fe3+ dengan kuat
sehingga dengan penambahan etanol, warna ungu yang terbentuk tidak akan
memudar. Dari hasil penelitian, ternyata penambahan sejumlah etanol
menurunkan intensitas warna ungu yang terbentuk. Hasil ini menunjukkan
senyawa fenolik dalam asap cair bukan merupakan derivat salisilat.
3. Penetapan kadar senyawa fenolik total sampel dihitung sebagai fenol
Bromatometri merupakan metode titrasi tidak langsung sehingga
melibatkan titrasi blanko. Pada titrasi blanko, akan diperoleh data jumlah brom
total yang dihasilkan. Dengan mengurangkan jumlah brom sisa yang tidak
bereaksi dengan senyawa fenolik dari jumlah brom total, maka akan diketahui
jumlah brom yang bereaksi dengan senyawa fenolik, sehingga jumlah dan kadar
senyawa fenolik total dalam sampel yang dihitung sebagai fenol dapat diketahui.
Pada titrasi blanko, semua brom yang dihasilkan dari reaksi oksidasi
reduksi antara kalium bromat dengan kalium bromida dalam suasana asam akan
langsung bereaksi dengan kalium iodida yang ditambahkan. Dengan demikian,
jumlah iodin yang dihasilkan juga akan lebih banyak dibanding pada titrasi
sampel. Akhirnya, jumlah natrium tiosulfat yang dibutuhkan untuk meniter iodin
juga akan lebih banyak.
Tahapan reaksi pada titrasi blanko adalah sebagai berikut :
BrO3- + 5Br- + 6H+ → 3Br2 + 3H2O
Br2 + 2I- → 2Br- + I2
I3- + 2S2O32- → 3I- + S4O62-
Seperti pada saat pembakuan, untuk mendeteksi titik akhir titrasi
ditambahkan indikator kanji LP (larutan amilum) ke dalam larutan analit
menjelang titik akhir titrasi. Titik akhir titrasi terjadi bila warna biru yang
terbentuk dari kompleks iodin-amilum menjadi bening karena terurainya
kompleks iodin-amilum tersebut. Amilum merupakan indikator pilihan utama
dalam titrasi yang melibatkan iodin karena amilum sangat spesifik dan sensitif
terhadap keberadaan iodin . Amilum hanya dapat membentuk senyawa kompleks
berwarna biru tua dengan keberadaan iodin, meskipun dalam konsentrasi yang
sangat kecil, yaitu pada konsentrasi 10-5 M. Tanpa indikator amilum, iodin hanya
akan tampak memberikan warna kuning semburat pada larutan iodin pada
konsentrasi 10-2 M.
Indikator larutan amilum ditambahkan menjelang titik akhir titrasi karena
amilum merupakan senyawa yang sangat mudah terdegradasi. Salah satu produk
degradasinya, yaitu glukosa merupakan senyawa reduktor yang dapat mereduksi
iodin. Dengan demikian, jumlah iodin yang dapat dititrasi oleh natrium tiosulfat
berkurang, dan menyebabkan kesalahan titrasi.
Pengambilan sampel dilakukan dari hanya satu toko untuk mengurangi
kesalahan dalam penelitian yang diakibatkan oleh variabel pengacau tak
terkendali. Dengan mengambil sampel hanya dari satu toko, maka diharapkan
terdapat keseragaman dalam proses pembuatan, pengolahan, penyimpanan
maupun manajemen distribusi sampel asap cair tersebut.
tidak selektif. Brom yang dihasilkan dari reaksi oksidasi reduksi antara kalium
bromat dengan kalium bromida dalam suasana asam tidak hanya mensubstitusi
senyawa fenolik saja, melainkan juga dapat mengadisi senyawa-senyawa tidak
jenuh serta mengoksidasi senyawa-senyawa lainnya yang bersifat reduktor.
Senyawa-senyawa tidak jenuh yang terkadung dalam asap cair yang dapat
mengganggu penetapan kadar senyawa fenolik total dalam penelitian ini antara
lain eugenol. Sedangkan senyawa reduktor yang dapat bereaksi dengan brom
adalah formaldehide.
D. Hasil Penetapan Kadar Senyawa fenolik total dalam Sampel Pada penelitian ini, kadar senyawa fenolik total dalam sampel ditetapkan
dengan dua perlakuan, di mana ke dalam sampel yang satu tanpa diberi tambahan
fenol, sedangkan sampel yang lainnya diberi tambahan fenol. Hal ini dilakukan
dengan pertimbangan bahwa metode titrasi lebih efektif bila digunakan untuk
analit yang memiliki kadar besar. Hasil percobaan awal/orientasi menunjukkan
kadar senyawa fenolik total dalam asap cair cukup kecil, yaitu hanya berkisar
antara 1,00-2,00 %. Meskipun hasil uji validasi metode menunjukkan bahwa
metode ini mampu menetapkan kadar fenol dengan akurasi dan presisi tinggi
bahkan pada konsentrasi sekecil 0,1172%, namun dikhawatirkan senyawa fenolik
tidak tertetapkan karena kadarnya yang cukup kecil dalam sampel.
Data yang diperoleh dari titrasi ini adalah volume titran natrium tiosulfat
0,1 N. Dari data tersebut, dapat dihitung grek iodin, di mana 1 grek iodin setara
yang bereaksi dengan kalium iodida, di mana 1 grek brom setara dengan 1 grek
iodin. Akhirnya kadar senyawa fenolik total dalam sampel dapat dicari di mana 1
grek fenol ekivalen dengan 1 grek brom.
Data hasil titrasi dan penetapan kadar senyawa fenolik total dalam sampel
dapat dilihat pada tabel VIII hingga tabel XI berikut ini, sedangkan contoh
perhitungannya dapat dilihat pada lampiran 5.
Tabel VIII. Kadar senyawa fenolik total dihitung sebagai fenol dalam asap cair A tanpa penambahan fenol
Vol. titran untuk blanko (ml) Replikasi
sampel Replikasi
blanko Purata
Vol. titran untuk sampel (ml)
Tabel IX. Kadar senyawa fenolik total dihitung sebagai fenol dalam asap cair B tanpa penambahan fenol
Vol. titran untuk blanko (ml) Replikasi
sampel Replikasi
blanko Purata
Tabel X. Kadar senyawa fenolik total dihitung sebagai fenol dalam asap cair A dengan penambahan fenol
Vol. titran untuk blanko (ml) Replikasi
sampel Replikasi
blanko Purata
Vol. titran
Tabel XI. Kadar senyawa fenolik total dihitung sebagai fenol dalam asap cair B dengan penambahan fenol
Vol. titran untuk blanko (ml) Replikasi
sampel Replikasi
blanko Purata
Vol. titran
Data yang diperoleh ini selanjutnya diolah secara statistik menggunakan
analisis Paired Sample T-test dengan taraf kepercayaan 95% tetapi, data
sebelumnya dianalisis dengan uji kesamaan variansi untuk menentukan rumus
statistik uji T yang sesuai.
Dari uji kesamaan variansi diperoleh hasil bahwa tidak terdapat
perbedaan variansi antara kedua macam sampel asap cair. Selanjutnya untuk
melihat apakah ada perbedaan bermakna antara purata kadar senyawa fenolik total
Apabila nilai signifikansi adalah kurang dari 0,05, maka menunjukkan adanya
perbedaan bermakna antara purata kadar senyawa fenolik dalam asap cair.
Tabel XI. Hasil analisis Paired Sample T-test untuk asap cair A dengan B tanpa penambahan fenol
Paired Samples Test
-.4866143 .0981531 .0370984 -.5773907 -.3958378 -13.117 6 .000 Data1 - Data2
t df Sig. (2-tailed)
Tabel XII. Hasil analisis Paired Sample T-test untuk asap cair A dengan B dengan penambahan fenol
Paired Samples Test
-.4822857 .0590607 .0223229 -.5369078 -.4276636 -21.605 6 .000 Data3 - Data4
t df Sig. (2-tailed)
Tabel XIII. Hasil analisis Paired Sample T-test untuk asap cair B tanpa penambahan fenol dan penambahan fenol
Paired Samples Test
.0007286 .0854154 .0322840 -.0782675 .0797246 .023 6 .983 Data1 - Data3
t df Sig. (2-tailed)
Tabel XIV. Hasil analisis Paired Sample T-test untuk asap cair A tanpa penambahan fenol dan penambahan fenol
Paired Samples Test
.0050571 .0813049 .0307304 -.0701374 .0802517 .165 6 .875 Data2 - Data4
Dari hasil analisis dengan Paired Sample T-test untuk asap cair B dengan asap cair A baik tanpa penambahan fenol maupun dengan penambahan fenol
seperti yang tertera pada tabel XI dan tabel XII, diperoleh nilai signifikansi 0,000
< 0,05 sehingga dapat dikatakan bahwa terdapat perbedaan yang bermakna antara
purata kadar senyawa fenolik total dalam kedua jenis asap cair tersebut.
Sementara hasil analisis dengan Paired Sample T-test untuk jenis asap cair yang sama namun yang satu tanpa penambahan senyawa fenol sementara yang
lainnya ditambah fenol, seperti yang tertera pada tabel XIII dan tabel XIV,
diperoleh nilai signifikansi yang lebih besar dari 0,5 yaitu 0,983 untuk asap cair B,
dan 0,875 untuk asap cair A. Maka dapat dikatakan bahwa tidak terdapat
perbedaan bermakna antara purata kadar senyawa fenolik total dalam asap cair
sejenis yang dibandingkan. Hasil ini menunjukkan bahwa dengan bromatometri
hanya dapat menetapkan kadar senyawa fenolik total dalam asap cair, dan tidak
dapat digunakan hanya untuk menetapkan kadar fenol saja.
Sesuai dengan permasalahan penelitian, maka penelitian ini telah
membuktikan bahwa kadar senyawa fenolik total dalam asap cair B yang
didistilasi dua kali disertai penyaringan lebih sedikit daripada asap cair A yang
BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Dari hasil penelitian dapat disimpulkan bahwa kadar senyawa fenolik total
dalam asap cair B adalah 1,71 ± 0,04 % b/b sedangkan asap cair A mengandung
senyawa fenolik total sebanyak 2,20 ± 0,04 % b/b.
B. Saran
1. Perlu dilakukan uji toksisitas terhadap penggunaan asap cair untuk
mengawetkan makanan.
2. Perlu dilakukan penelitian untuk menetapkan kadar senyawa fenolik total
dalam asap cair dengan metode lainnya, salah satunya dengan metode
spektrofotometri visibel menggunakan pereaksi 4-amino-phenazon.