INSTITUT TEKNOLOGI INDONESIA
DESEMBER 2011
LAPORAN PENELITIAN HIBAH BERSAING
Dibiayai oleh Direktorat Jendral Pendidikan Tinggi, Departemen Pendidikan Nasional, sesuai dengan Surat Perjanjian Pelaksanaan Hibah Penelitian
No: 091/SP2H/PL/Dit.Litabmas/IV/2011, Tanggal 14 April 2011
BIDANG REKAYASA
PRODUKSI BIOPLASTIK DAN BIOSURFAKTAN
SECARA SIMULTAN DENGAN TEKNIK KULTIVASI
UMPAN CURAH BERULANG
OLEH :
Ir. Darti Nurani, M.Si.
Dr. Ir. Sidik Marsudi, M.Si.
3
RINGKASAN
Bioplastik polihidroksialkanoat (PHA) dari bakteri diakumulasi oleh sel bakteri sebagai produk intraseluler. Disisi lain, biosurfaktan ramnolipid diproduksi oleh bakteri sebagai produk ektraseluler. Produksi komersil bioproduk ini dihadapkan pada masalah mahalnya biaya produksi. Berbagai upaya telah dilakukan untuk menurunkan biaya produksi namun hasilnya belum dapat menurunkan biaya produksi secara signifikan. Oleh karena itu, diperlukan suatu strategi teknik produksi yang mampu memberikan penurunan biaya produksi sehingga kedua bioproduk tersebut dapat dipasarkan dengan harga yang bersaing dengan plastik dan surfaktan konvensional.
Pada penelitian tahun pertama ini, percobaan dilakukan dengan teknik kultivasi umpan curah berulang (repeated fed bacth culture) skala lab. Percobaan terdiri dari dua tahap yaitu tahap pertama (1) produksi ramnolipid dengan teknik kultivasi umpan curah dan tahap kedua (2) produksi PHA dengan teknik kultivasi umpan curah. Pada tahap kedua ini, seluruh sel dari kultivasi tahap pertama ini digunakan untuk produksi PHA pada tahap kedua, teknik ini disebut kultivasi berulang. Sebelum dilakukan percobaan tersebut di atas, terlebih dahulu dilakukan percobaan pendahuluan dengan teknik kultivasi curah berulang menggunakan sumber karbon minyak sawit dan limbah cair industri biodiesel dari CPO. Tujuannnya yaitu menguji kemampuan limbah cair industri biodiesel dari CPO untuk digunakan sebagai bahan baku produksi biosurfaktan ramnolipid dan bioplastik PHA.
Hasil percobaan menunjukkan bahwa limbah cair industri biodiesel dari CPO dapat digunakan sebagai bahan baku produksi biosurfaktan ramnolipid dan bioplastik PHA. Dengan menggunakan sumber karbon limbah cair industri biodiesel dari CPO diperoleh konsentrasi sel kering sebanyak 4,2 g/l dari sumber karbon 25 g/l. Nilai ini sebanding dengan konsentrasi sel kering yang dihasilkan dari sumber karbon minyak sawit sebanyak yaitu 3,9 g/l dari sumber karbon 10 g/l. Meskipun, ramnolipid yang dihasilkan dengan sumber karbon limbah cair industri biodiesel dari CPO dibandingkan dengan dari minyak sawit masing masing secara berurutan adalah 170 mg/l dan 56 mg/l. Hasil ramnolipid dari limbah cair industri biodiesel dari CPO yang dihasilkan lebih sedikit sangat dimungkinkan karena bahan limbah ini juga mengandung alkali (NaOH) yang relatif tinggi sehingga dapat menurunkan pembentukan ramnolipid. Hal yang sama juga terjadi pada pembentuk biopasltik PHA. PHA yang dihasilkan dengan sumber karbon limbah cair biodiesel lebih rendah dibandingkan dengan dari minyak sawit yaitu masing masing secara berurutan 0,15 g PHA/l dan 0,4 g PHA/l. Meskipun ramnolipid dan PHA yang dihasilkan dari limbah cair industri biodiesel lebih rendah dibandingkan dengan dari minyak sawit (hampir 3 kali
4 lipat), namun bila ditinjau dari harga bahan baku, limbah cair industri biodiesel tidak ada harganya namun minyak sawit mencapai ribuan rupiah per liter. Dengan demikian, untuk selanjutnya limbah cair industri biodiesel digunakan sebagai sumber karbon.
Pada kultivasi umpan curah berulang, pengumpanan sumber karbon (limbah cair industri biodiesel dari CPO) dilakukan secara impul yaitu setelah dilakukan sampling pada periode tertentu, sumber karbon ditambahkan untuk meningkatkan konsentrasi sumber karbon di dalam kultur. Hasilnya menunjukkan bahwa pada tahap pertama, maksium berat kering sel dan ramnolipid yang dihasilkan adalah 2 g/l dan 250 mg/l dari konsentrasi sumber karbon 25 g/l. Konsentrasi ramnolipid yang dihasilkan ini empat kali lebih besar dibandingkan dengan yang dihasilkan dengan teknik kultivasi curah dengan sumber karbon yang sama. Pada percobaan tahap kedua, dari berbagai konsentrasi sumber karbon yang diuji, konsentrasi sumber karbon 25 g/l memberikan hasil konsentrasi sel kering dan konsentrasi PHA terbesar, yaitu masing masing 1,2 g/l dan 0,35 g/l. Konsentrasi PHA yang dihasilkan ini dua kali lebih besar bila dibandingkan dengan hasil yang diperoleh melalui kultivasi curah berulang. Dengan demikian dapat disimpulkan bahwa produksi ramnolipid dengan teknik kultivasi umpan curah memberikan hasil empat kali lebih besar dibandingkan dengan teknik kultivasi curah. Disamping itu, dengan teknik kultivasi umpan curah berulang, PHA yang dihasilkan dua kali lebih besar dibandingkan dengan teknik kultivasi curah berulang.
5
PRAKATA
Pertama tama kami mengucapkan terima kasih kepada Departemen Pendidikan Nasional Republik Indonesia, cq Direktorat Penelitian dan Pengabdian kepada Masyarakat, Dikti, atas kesempatan yang telah diberikan kepada kami untuk melaksanakan penelitian dengan judul “Produksi Bioplastik dan Biosurfaktan Secara Simultan dengan Teknik Kultivasi Umpan Curah Berulang ”
Laporan penelitian ini merupakan laporan tahun pertama dilakukan dengan melakukan percobaan pendahuluan produksi PHA ramnolipid dengan teknik kultivasi curah berulang dengan bahan baku minyak sawit dan limbah cair industri biodiesel dari CPO. Selanjutnya percobaan produksi PHA dan ramnolipid dilakukan dengan teknik kultivasi umpan curah berulang yang dilakukan dengan dua tahap percobaan. Tahap pertama, kultivasi diarahkan untuk pemproduksi ramnolipid dan tahap ke dua, kultivasi darahkan untuk memproduksi PHA. Pada percobaan tahap kedua ini, sel dari percobaan tahap pertama digunakan untuk memproduksi PHA. Semua percobaan dilakukan pada skala laboratorium.
Semoga laporan ini dapat memberikan alternatif baru dalam pemanfaatan produk samping industri biodiesel dengan bahan baku CPO untuk memproduksi PHA dan ramnolipid.
Serpong, Nopember 2011 Tim Peneliti,
Ir. Darti Nurani, M.Si. Dr.Ir. Sidik Marsudi, M.Si.
6
DAFTAR ISI
HALAMAN PENGESAHAN ...………... ii
A. LAPORAN HASIL PENELITIAN RINGKASAN... iii
PRAKATA ...……...…… v
DAFTAR ISI ... vi
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ...……... vii
BAB I PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Peta Jalan (Roadmap) Penelitian ... 3
BAB II
TINJAUAN PUSTAKA
2.1 Produksi Bioplastik PHA dan Biosurfaktan Rhamnolipid secara Terpisah .... 42.2 Penelitian yang Pernah Dilakukan tentang Produksi Bioplastik PHA dan Biosurfaktan Rhamnolipid ... 5
BAB III TUJUAN DAN MANFAAT PENELITIAN 3.1 Tujuan khusus ... 7
3.2 Manfaat Penelitian ... 7
BAB IV METODE PENELITIAN 4.1 Optimasi produksi ramnolipid dengan teknik kultivasi umpan curah ... 10
4.2 Optimasi produksi polihidroksialkanoat (PHA) dengan teknik kultivasi umpan curah menggunakan sel yang berasal dari produksi ramnolipid ... 11
BAB V HASIL DAN PEMBAHASAN 5.1 Aktivasi Sel P.aeruginosa IFO 3924 dan Persiapan Media Padat Serta Media Cair dari Medium IFO 802 untuk Sub Culture ... 12
5.2 Produksi PHA dan Rhamnolipid dengan Teknik Kultivasi Curah Berulang secara Simultan ... 12
5.2.1 Produksi Rhamnolipid dengan Teknik Kultivasi Curah ... 13
5.2.2 Optimasi Produksi PHA dengan Teknik Kultivasi Curah ... 16
5.3 Produksi PHA dan Rhamnolipid secara Simultan dengan Teknik Kultivasi Umpan Curah Berulang ... 19
7 Kultivasi Umpan Curah, pengumpanan sumber karbon
secara impuls ... 19
5.3.2 Optimasi Produksi PHA dengan Teknik Kultivasi Umpan Curah, pengumpanan sumber karbon secara impuls ... 21
BAB VI KESIMPULAN DAN SARAN 6.1 Kesimpulan ... 24
6.2 Saran ... 24
Daftar Pustaka
... 25LAMPIRAN ... 29
Lampiran 1. Komposisi Media Lampiran 2. Rekapitulasi hasil analisis rata-rata berat kering sel (g/l) dan perolehan rhamnolipid (mg/l) pada produksi biosurfaktan kultivasi curah dengan variasi konsentrasi sumber karbon (minyak sawit) dan waktu fermentasi Lampiran 3. Rekapitulasi hasil analisis rata-rata berat kering sel (g/l) dan perolehan rhamnolipid (mg/l) pada produksi biosurfaktan kultivasi curah dengan variasi konsentrasi sumber karbon (limbah cair biodiesel dari CPO) dan waktu fermentasi Lampiran 4. Rekapitulasi hasil analisis rata-rata berat kering sel (g/l) dan perolehan PHA (g/l) pada produksi bioplastik kultivasi curah dengan variasi konsentrasi sumber karbon (minyak sawit) dan waktu fermentasi Lampiran 5. Rekapitulasi hasil analisis rata-rata berat kering sel (g/l) dan perolehan PHA (g/l) pada produksi bioplastik kultivasi curah dengan variasi konsentrasi sumber karbon (limbah cair biodiesel dari CPO) dan waktu fermentasi Lampiran 6. Rekapitulasi hasil analisis rata-rata berat kering sel (g/l) dan perolehan rhamnolipid (mg/l) pada produksi biosurfaktan kultivasi umpan curah dengan variasi konsentrasi sumber karbon (limbah cair biodiesel dari CPO) dan waktu fermentasi Lampiran 7. Rekapitulasi hasil analisis rata-rata berat kering sel (g/l) dan perolehan PHA (g/l) pada produksi biosurfaktan kultivasi umpan curah dengan variasi konsentrasi sumber karbon (limbah cair biodiesel dari CPO) dan waktu fermentasi Lampiran 8. Foto-foto penelitian ... 34
Lampiran 9. Organisasi Ketua dan Semua Anggota Tim Pengusul ... 36
8
DAFTAR GAMBAR
Gambar 1.1 Tahapan Rencana Penelitian Menuju komersialisasi ... 3 Gambar 5.1 Pengaruh konsentrasi sumber karbon dalam media MBSM
dan lama fermentasi pada perolehan berat kering sel
(sumber C: minyak sawit) ... 13 Gambar 5.2 Pengaruh konsentrasi sumber karbon dalam media
MBSM dan lama fermentasi pada perolehan rhamnolipid
(sumber C: minyak sawit) ... 14 Gambar 5.3 Pengaruh konsentrasi sumber karbon dalam media MBSM
dan lama fermentasi pada perolehan berat kering sel
(sumber C:limbah biodiesel dari CPO) ... 14 Gambar 5.4 Pengaruh konsentrasi sumber karbon dalam media MBSM
dan lama fermentasi pada perolehan rhamnolipid
(sumber C:limbah biodiesel dari CPO) ... 15 Gambar 5.5 Pengaruh konsentrasi sumber karbon dalam media BSM
dan lama fermentasi pada perolehan berat kering sel
(sumber C: minyak sawit) ... 16 Gambar 5.6 Pengaruh konsentrasi sumber karbon dalam media BSM
dan lama fermentasi pada perolehan PHA
(sumber C: minyak sawit) ... 17 Gambar 5.7 Pengaruh konsentrasi sumber karbon dalam media BSM
dan lama fermentasi pada perolehan berat kering sel
(sumber C:limbah biodiesel dari CPO) ... 17 Gambar 5.8 Pengaruh konsentrasi sumber karbon dalam media BSM
dan lama fermentasi pada perolehan berat kering sel
(sumber C:limbah biodiesel dari CPO) ... 18 Gambar 5.9 Pengaruh konsentrasi sumber karbon dalam media
MBSM dan lama fermentasi pada perolehan berat kering sel (sumber C: limbah biodiesel dari CPO), teknik kultivasi
umpan curah berulang, metode pengumpanan impuls ... 20 Gambar 5.10 Pengaruh konsentrasi sumber karbon dalam media MBSM
dan lama fermentasi pada perolehan rhamnolipid (sumber C: limbah biodiesel dari CPO), teknik kultivasi umpan curah berulang,
metode pengumpanan impul ... 21 Gambar 5.11 Pengaruh konsentrasi sumber karbon dalam media
BSM dan lama fermentasi pada perolehan berat kering sel (sumber C: limbah biodiesel dari CPO), teknik kultivasi umpan curah berulang, metode pengumpanan impuls ... 22 Gambar 5.12 Pengaruh konsentrasi sumber karbon dalam media BSM
dan lama fermentasi pada perolehan PHA (sumber C: limbah biodiesel dari CPO), teknik kultivasi umpan curah berulang,
9 BAB I
PENDAHULUAN 1.1 Latar Belakang
Plastik mempunyai peranan yang sangat penting dalam memenuhi kebutuhan manusia. Sulit dibayangkan kehidupan manusia tanpa plastik. Meskipun demikian, tidak semua kesempurnaan yang dimiliki plastik menguntungkan sebab buangan plastik telah menjadi masalah serius terhadap pencemaran lingkungan karena plastik yang banyak digunakan saat ini sulit didegradasi di alam. Salah satu alternatif untuk mengatasi masalah ini adalah penggunaan bahan baku plastik dari polihidroksialkanoat (PHA) yang diproduksi secara fermentasi. Buangan bioplastik PHA dapat didegradasi oleh mikroorganisme menjadi karbon dioksida dan air hanya dalam waktu beberapa bulan saja (Lee, 1996b). Bioplastik PHA dari bakteri telah diproduksi secara komersial dan berpotensi untuk digunakan pada bidang kesehatan, pertanian, dan pembungkus makanan (Lee, 1996a). Produksi Bioplastik PHA dihadapkan pada persoalan mahalnya biaya produksi.
Bioplastik PHA diproduksi oleh sel bakteri sebagai produk intraseluler (PHA diakumulasi di dalam sel bakteri). Dengan demikian, untuk memproduksi bioplastik PHA dengan jumlah yang banyak diperlukan jumlah sel bakeri yang sangat banyak pula. Selain itu, dalam memproduksi bioplastik PHA, sel bakteri harus dihancurkan terlebih dahulu untuk mendapatkan dan memurnikan bioplastik PHA.
Untuk mengatasi mahalnya biaya produksi bioplastik PHA diperlukan suatu strategi baru dalam memproduksi PHA. Stateginya yaitu sebelum sel bakteri dihancurkan untuk mengisolasi dan memurnikan bioplastik PHA, sel bakteri tersebut digunakan/dimanfaatkan dulu untuk memproduksi biomaterial berharga lainnya terutama biomaterial yang diproduksi sel bakteri sebagai produk ekstraseluler. Oleh karena itu, diperlukan informasi tentang bakteri yang dapat memproduksi bioplastik PHA sebagai intraseluler produk dan biomaterial lain sebagai ekstraseluler produk.
10
Pseudomonas spesies (Pseudomonas sp.) merupakan bakteri yang telah dikenal dapat memproduksi bioplastik polihidroksialkanoat (PHA) dari berbagai jenis sumber karbon untuk pertumbuhannya (Ashby dan Foglia, 1998; Solaiman dkk., 2001). Khusus P.aeruginosa, bakteri ini telah diketahui juga mampu memproduksi biomaterial berharga yaitu biosurfaktan ramnolipid sebagai ektraseluler produk baik dengan menggunakan sumber karbon hidrofilik (seperti glukosa, sukrosa dan gliserol) maupun hidrokarbon hidrofobik (seperti n-arafin, minyak olive, minyak kacang kedelai, dan minyak jagung) (Lee dkk., 1999; Lang Wullbrandt, 1999; Mairier dan Sobero-Chavez, 2000).
Adanya kemampuan untuk memproduksi dua jenis bioproduk berharga yaitu bioplastik PHA dan biosurfaktan ramnolipid pada suatu jenis bakteri dimanfaatkan oleh Hori dkk. (2002) dan Marsudi (2002) untuk memproduksi dua jenis produk tersebut secara bersamaan dari satu jenis bakteri (monoculture). Pendekatan ini berbeda dengan proses produksi yang sudah ada selama ini, yaitu biasanya target produksi diarahkan untuk memproduksi satu jenis produk saja seperti bioplastik PHA atau biosurfaktan ramnolipid saja yang diproduksi secara terpisah dari satu jenis bakteri.
Hori dkk., (2002) telah menguji kemampuan beberapa spesies
Pseudomonas untuk memproduksi kedua jenis bioproduk tersebut dengan menggunakan asam dekanoat sebagai sumber karbon dengan kultivasi curah (batch culture). Hasilnya menunjukkan bahwa P.aeruginosa (IFO 3924) merupakan strain terbaik diantara beberapa spesies yang diuji dalam hal produksi PHA dan ramnolipid secara simultan.
Selain itu, Hori dkk. (2002) menyimpulkan bahwa penelitian tersebut akan mematahkan pendapat umum bahwa biaya untuk memproduksi PHA tidak akan lebih kecil dari biaya untuk memproduksi sel itu sendiri. Meskipun demikian, penelitian tersebut masih dalam tahap mendemostrasikan produksi bioplastik PHA dan biosurfaktan ramnolipid secara simultan. Oleh karena itu, diperlukan penelitian lanjutan guna menurunkan biaya produksi kedua produk tersebut.
Penelitian lanjutan yang diperlukan antara lain yaitu: (a) mencari dan mengoptimalkan penggunaan berbagai sumber karbon yang relatif murah, (b) mengoptimalkan proses recovery bioplastik PHA dan biosurfaktan ramnolipid,
11 serta (3) menemukan strategi teknik kultivasi yang sesuai pada produksi kedua biomaterial berharga tersebut secara simultan.
1.2 Peta Jalan (Roadmap) Penelitian
Strategi produksi bioplastik PHA dan biosurfaktan rhamnolipid secara simultan dari bakteri pertama kali dikemukakan oleh Marsudi (2002) dan Hori dkk. (2002). Bakteri yang telah dikenali dapat memproduksi dua jenis bioproduk tersebut yaitu spesies Pseudomonas aeruginosa. Sumber karbon yang telah digunakan untuk memproduksi bioproduk tersebut antara lain minyak sawit, asam oleat, glukosa, dan asam dekanoat (Hori dkk. 2002; Marsudi, dkk. 2008). Kandungan PHA dalam sel adalah 36 % berat kering sel dan konsentrasi ramnolipid yang dicapai yaitu 1,24 g/l.
Costa dkk., (2009) juga mempelajari produksi PHA dan rahmnolipid secara simultan dengan memanfaatkan air limbah singkong (cassava wastewater) sebagai sumber karbon. Hasil yang diperoleh yaitu kandungan PHA dalm sel dan ramnolipid secara berurutan adalah 39 % berat kering sel dan 660 mg/l. Nilai ini masih relatif kecil, karena percobaan percobaan tersebut di atas menggunakan kultivasi curah (batch culture). Oleh karena itu, perlu dilakukan teknik kultivasi lain yaitu kultivasi umpan curah (fed batch culture) dan kultivasi umpan curah berulang (repetaed fed batch culture). Adapun peta jalan penelitian ini secara singkat dijelaskan dalam Gambar 1 berikut ini.
Gambar 1.1 Tahapan Rencana Penelitian Menuju komersialisasi
2011 2012 2013 2015
Hibah Bersaing dari DP2M Dikti
Insentif dari Kementrian RISTEK
Produksi PHA dan ramnolipid dengan teknologi kultivasi umpan curah berulang
Produksi PHA dan ramnolipid dalam skala semi pilot
Rekayasa genetika untuk mendapatkan mikroba unggul dalam memproduksi PHA dan
ramnolipid, optimasi penggunaan berbagai sumber karbon dan produksi PHA dan ramnolipid skala komersil
12 BAB II
TINJAUAN PUSTAKA
2.1 Produksi Bioplastik PHA dan Biosurfaktan Rhamnolipid secara Terpisah Bioplastik polihidroksialkanoat (PHA) dari bakteri merupakan biomaterial yang menarik perhatian para pemerhati lingkungan karena buangan bioplastik ini mudah didegradasi di lingkungan menjadi CO2 dan H2O dalam waktu beberapa
bulan (Lee, 1996a). Produksi bioplastik PHA secara komersil dihadapkan pada masalah mahalnya biaya produksi, terutama biaya substrat dan biaya pemisahan/ektraksi. Berbagai penelitian telah dilakukan untuk menurunkan biaya produksi dan meningkatkan produktivitasnya antara lain dengan memanfaatkan limbah sebagai sumber karbon (Serafim dkk. 2008), menggunakan asam asaa lemak volatil sebagai sumber karbon (Marsudi dan Setiadi, 1997), memproduksi bioplastik PHA dengan sumber karbon carbon dioksida (Marsudi dkk., 1998), memproduksi PHA dengan kultivasi umpan curah/fed batch (Sun dkk., 2009), melakukan rekayasa genetika untuk dapat memperoleh bakteri yang unggul dalam memproduksi PHA (Davis dkk. 2008), serta memproduksi PHA dengan menggunakan bakteri Pseudomonas putida (Marsudi dkk. 2007; Marsudi dkk. 2003).
Biosurfaktan ramnolipid merupakan biomaterial yang juga menarik para pemerhati lingkungan karena biomaterial ini ramah lingkungan. Berbagai usaha juga telah dilakukan untuk menurunkan biaya produksi dan meningkatkan produktivitasnya antara lain mendapatkan bakteri unggul untuk memproduksi ramnolipid (Muller dkk., 2010), menggunakan teknik kultivasi substrat padat (Neto dkk., 2008), menggunakan teknik kultivasi curah/batch culture dan umpan curah/fed batch culture (Lee dkk., 2004), serta mengendalikan jumlah oksigen yang diumpankan ke dalam fermentor (Kronemberger dkk., 2008).
Produksi pada skala komersil kedua biomaterial tersebut di atas yang dilakukan secara terpisah mengalami kendala utama yaitu mahalnya biaya produksi terutama biaya sumber karbon dan biaya pemisahan/ektraksi. Selain itu, hingga saat ini belum ada teknologi yang telah diunggulkan sebagai teknologi terbaik untuk memproduksi bioplastik PHA maupun biosurfaktan. Salah satu
13 strategi yang telah ditawarkan untuk mengatasi mahalnya biaya produksi yaitu memproduksi dua biomaterial tersebut di atas secara simultan. Konsep produksi secara simultan, dijelaskan lebih detil pada bagian berikut ini.
2.2 Penelitian yang Pernah Dilakukan tentang Produksi Bioplastik PHA dan Biosurfaktan Rhamnolipid
Untuk mengatasi masalah mahalnya biaya produksi bioplastik PHA dan biosurfaktan ramnolipid, suatu strategi telah diusulkan yaitu memproduksi dua biomaterial tersebut secara simultan. Strategi ini pertama kali diusulkan oleh Marsudi (2002) dan Hori dkk., (2002). Konsep strategi produksi secara simultan dua biomaerial ini didasari atas hal berikut ini.
(1) Satu jenis bakteri mampu memproduksi dua jenis biomaterial berharga (bioplastik PHA dan biosurfaktan ramnolipid)
(2) Dua jenis biomaterial tersebut salah satunya merupakan produk intraseluler (bioplastik PHA) dan yang lainnya merupakan produk ektraseluler (biosurfaktan ramnolipid)
(3) Teknis produksinya diawali dengan mengkondisikan sel bakteri untuk memproduksi ektraseluler produk yaitu biosurfaktan ramnolipid. Setelah biosurfaktan ramnolipid dipanen serta dilakukan pemisahan atara produk biosurfaktan ramnolipid dengan sel bakterinya, sel bakteri ini digunakan kembali untuk memproduksi ektraseluler produk yaitu bioplastik PHA. Pada tahap ini, sel bakteri dikondisikan/diarahkan untuk dapat memproduksi intraseluler produk yaitu bioplastik PHA.
Beberapa penelitian yang telah dilakukan dalam memproduksi PHA dan ramnolipid secara simultan yaitu:
1. Marsudi (2002) dan Hori dkk., (2002) mempelajari potensi beberapa bakteri
Pseuedomonas dalam memproduksi bioplastik PHA dan biosurfaktan ramnolipid. Hasil yang diperoleh yaitu bakteri Pseudomonas aeruginosa IFO 3924 merupakan bakteri yang terbaik dalam memproduksi dua biomaterial tersebut secara simultan.
14 Pada penelitian di atas, dikaji pula potensi beberapa sumber karbon (asam dekanoat, glukosa, dan etanol) untuk memproduksi dua biomateril tersebut secara simultan. Hasil yang diperoleh yaitu dibandingkan beberapa sumber karbon yang telah diuji, dekanoat merupakan sumber karbon yang cocok untuk produksi secara simultan dua biomaterial ini. Kandungan PHA dalam sel yaitu 26% berat kering sel dan konsetrasi ramnolipid maksimum mencapai 600 mg/l.
2. Marsudi dkk (2008) mempelajari potensi minyak sawit beserta turunannya (asam oleat dan gliserol) sebagai sumber karbon dalam memproduksi bioplastik PHA dan biosurfaktan ramnolipid secara simultan dengan teknik kultivasi curah (batch culture) menggunakan bakteri Pseudomonas aeruginosa IFO 3924. Hasil terbaik yang diperoleh yaitu minyak sawit merupakan sumber terbaik dibandingkan sumber karbon yang dikaji. Dengan sumber karbon ini, kandungan PHA dalam sel adalah 36 % berat kering sel dan konsentrasi ramnolipid yang dicapai yaitu 1,24 g/l.
Total perolehan (yield) bioplastik PHA dan biosurfaktan ramnolipid pada sumber karbon minyak sawit, asam oleat dan, gliserol masing masing secara berurutan adalah: 0,174 g/g; 0,066 g/g, dan 0, 113 g/g.
3. Costa dkk., (2009) mempelajari pemanfaatan air limbah singkong (cassava wastewater) sebagai sumber karbon dalam memproduksi bioplastik PHA dan biosurfaktan ramnolipid secara simultan menggunakan bakteri P.aeruginosa. Hasil yang diperoleh yaitu kandungan PHA dalm sel dan ramnolipid secara berurutan adalah 39 % berat kering sel dan 660 mg/l.
Hasil hasil yang diperoleh seperti tersebut di atas masih relatif kecil dibandingkan dengan produksi bioplastik PHA maupun rhamnolipid secara terpisah. Hal ini diperkirakan karena percobaan percobaan tersebut di atas menggunakan kultivasi curah (batch culture). Oleh karena itu, perlu dilakukan teknik kultivasi lain yang diperkirakan akan meningkatkan kandungan PHA, konsentrasi ramnlipid, serta produktivitas kedua bioproduk tersebut. Teknik kultivasi tersebut yaitu kultivasi umpan curah (fed batch culture) dan kultivasi umpan curah berulang (repetaed fed batch culture)
15 BAB III
TUJUAN DAN MANFAAT PENELITIAN
Tujuan utama penelitian ini yaitu mencari alternatif untuk mempoduksi bioplastik PHA dan ramnolipid dengan harga yang realtif murah. Adapun stratetgi yang dilakukan yaitu dengan menggunakan teknik kultivasi umpan curah berulang dan memanfaatkan limbah cair industri biodiesel berbahan baku CPO sebagai sumber karbon. Adapun tujuan khusus dan manfaat penelitian ini lebih rinci dijelaskan berikut ini.
3.1 Tujuan khusus
Tujuan khusus peneilitian ini adalah:
1. Mempelajari teknik kultivasi umpan curah (fed batch culture) dan teknik kultivasi umpan curah berulang (repeated fed batch culture) dalam memproduksi bioplastik PHA dan biosurfaktan ramnolipid secara simultan 2. Meningkatkan produktivitas sel bakteri dalam memproduksi bioplastik PHA dan biosurfaktan ramnolipid secara simultan dibadingkan penelitian yang ada selama ini (Hori dkk., 2002; Marsudi dkk., 2008; dan Costa dkk., 2009).
Dengan didapatkan produksitivitas dan yield yang tinggi, dhiarapkan biaya produksi bioplastik PHA dan biosurfaktan akan turun drastis dan kedua bioproduk tersebut dapat dipasarkan dengan harga yang relatif murah dan mampu bersaing dengan produk plastik dan surfaktan konvensional.
3.2 Manfaat Penelitian
Penelitian produkdi bioplastik PHA dan biosurfaktan ramnolipid secara simultan pertama kali dikemukakan oleh marsudi (2002) dan Hori dkk., (2002). Latar belakang kajian ini adalah selama ini bioplastik dan bisorufaktan ramnolipid diproduksi secara terpisah/individu. Komersialisasi produksi biopolimer dari bakteri dihadapkan pada masalah biaya poroduksi. Disis lain, komersialisasi
16 produksi biosurfaktan ramnolipid juga dihadapkan pada masalah yang sama yaitu mahalnya biaya produksi.
Manfaat usulan penelitian ini yaitu akan diperoleh strategi baru untuk memproduksi PHA dan ramnolipid dengan teknik kultivasi umpan curah. Disisi lain, pada percobaan ini digunakan limbah cair industri biodiesel dari CPO. Pemanfaatan limbah cair ini merupakan upaya untuk mengolah sekaligus memanfaatkan dan meningkatkan nilai tambah limbah. Disamping itu, dengan dimanfaatkan limbah cair idnustri biodiesel, hal ini akan memberikan dukungan terhadap industri biodiesel yang saat ini sedang berkembang guna memenuhi target penggunaan energi nasional dari minyak nabati.
17 BAB IV
METODE PENELITIAN
Penelitian ini dilakukan di Laboratorium Mikrobiologi dan laboratorium teknologi fermentasi Institut Teknologi Indonesia Serpong, Tangerang, selama 1 tahun (tahun pertama penelitian, 2011). Produksi PHA dan ramnolipid secara simultan oleh Pseudomonas sp. menggunakan minyak sawit dan produk samping (limbah cair) industri biodiesel dari CPO sebagai sumber karbon. Percobaan dilakukan di dalam erlenmeyer yang diletakkan pada rotary shaker pada suhu kamar dan putaran 200 rpm. Volume inokulum yang digunakan yaitu 2 %(v/v) yang sebelumnya diinkubasi di dalam medium IFO 802 (IFO = Institut of Fermentation, Osaka) selama 18 jam pada suhu 30 C. Medium untuk produksi bioplastik PHA dan biosurfaktan ramnolipid adalah medium garam dasar (Hori dkk., 2002; Marsudi, 2002) dan medium dasar yang dimodifikasi (modifed bassal salt medium/MBSM) yang ditambah sumber karbon. Adapun tahapan-tahapan penelitian yang akan dilakukan adalah sebagai berikut.
Kegiatan Tahun 2011 (tahun pertama)
(1). Optimasi produksi biosurfaktan ramnolipid dengan teknik kultivasi umpan curah (fed batch culture).
(2) Optimasi produksi polihidroksialkanoat (PHA) dengan teknik kultivasi umpan curah (fed batch culture) menggunakan sel yang berasal dari produksi ramnolipid (poin 1).
Integrasi produksi biosurfaktan ramnolipid (poin 1) dan produksi bioplastik PHA (poin 2) disebut “Produksi PHA dan ramnolipid secara simultan dengan teknik kultivasi umpan curah berulang (repeated fed batch culture)”. Pengumpanan sumber karbon dilakukan setiap kali setelah dilakukan pengambilan sampel.
Sebelum percobaan tersebut diatas dilakukan, pecobaan diawali dengan memproduksi PHA dan ramnolipid dengan teknik kultivasi curah. Sumber karbon yang digunakan adalah minyak sawit dan limbah cair idustri minyak sawit. Tujuan
18 penelitian ini adalah untuk membandingkan perbedaan antara produksi PHA dari minyak sawit dan limbah industri biodiesel.
4.1 Optimasi produksi ramnolipid dengan teknik kultivasi umpan curah Optimasi produksi biosurfaktan ramnolipid dgn teknik kultivasi umpan curah dilakukan menggunakan shaker fermentor. Sekitar 10 persen inokulum ditambahkan ke dalam erlenmeyer 1 liter dengan volume kerja 250 ml yang telah mengandung medium dasar dan ditambahkan minyak sawit atau produk samping industri biodiesel sebagai sumber karbon dan amonium nitrat sebagai sumber nitrogen (amonium nitrat berguna untuk merangsang/menstimulasi produksi ramnolipid). Selanjutnya, sumber karbon sebagai umpan ditambahkan secara impuls ke dalam fermentor sesuai dengan variabel penelitian. Adapun penelitian dilakukan sebagai berikut.
a. Konsentrasi awal sumber karbon di dalam fermentor: 5 g/L, 10, g/L, 15 g/L untuk sumber karbon minyak sawit serta 5, 25, dan 50 g/l untuk sumber karbon limbah cair industri biodiesel.
b. Teknik pengumpanan sumber karbon dan impuls
c. Waktu pemanenan (waktu pengambilan sample): setiap 6 jam selama 48 jam.
Pada pengumpanan sumber karbon secara impuls, sumber karbon ditambahkan setiap kali setelah pengambilan sampel dan jumlah sumber karbon yang ditambahkan didasarkan pada laju peningkatan konsentrasi sel dimana setiap penambahan konsentrasi sel 0.6 gram/l, maka jumlah sumber karbon yang ditambahkan adalah 1 gram/l. Selama fermentasi berlangsung, 10 ml sampel diambil setiap 6 jam sekali (variabel waktu pemanenan). Sampel selanjutnya di sentrifugasi untuk memisahkan sel dan supernatan. Sel dikeringkan dan selanjutnya dianalisa kandungan PHAnya (meskipun kemungkinan konsentrasinya sangat kecil karena tahap ini sel diarahkan untuk memproduksi ramnolipid) dan supernatan digunakan untuk analisa konsentrasi ramnolipid.
Analisa konsentrasi PHA dilakukan dengan gas kromatograpi (Hori dkk., 2002) dan dengan metode ektraksi,. konsentrasi ramnolpid dianalisa dengan
19 pengujian orsinol (Koch dkk., 1991) dan dengan teknik ektraksi. Analisa konsentrasi sel dilakukan dengan analisa berat kering sel.
Data yang diperoleh diplot sebagai profil ramnolipid terhadap waktu. Selain itu profil petumbuhan sel, produksi ramnolipdi dan PHA.
4.2 Optimasi produksi polihidroksialkanoat (PHA) dengan teknik kultivasi umpan curah menggunakan sel yang berasal dari produksi ramnolipid
Pada prinsipnya teknik optimasi produksi polihidroksialkanoat ini mirip dengan optimasi produksi ramnolipid, hanya pada tahap ini sel dari proses produksi ramnolipid digunakan kembali untuk memproduksi PHA. Selain itu, untuk merangsang/stimulasi akumulasi PHA, sumber nitrogen tidak ditambahkan sehingga medium tidak perlu disterilkan. Dengan demikian, konsumsi sumber karbon oleh sel akan lebih banyak digunakan untuk mengakumulasi PHA (peningkatan berat) dan bukan untuk memperbanyak jumlah (satuan) sel.
Untuk optimasi produksi PHA ini, tingkat variabel sangat dipengaruhi oleh jumlah sel yang dihasilkan dari optimasi produksi ramnolipid. Meskipun demikian, tingkat variabel adalah sebagai berikut:
a. Konsentrasi awal sumber karbon di dalam fermentor: 5 g/L, 10, g/L, 15 g/L untuk sumber karbon minyak sawit dan 5, 25, dan 50 g/l untuk sumber karbon limbah cair industri biodiesel.
b. Teknik pengumpanan sumber karbon secara impuls
c. Waktu pemanenan (waktu pengambilan sample): setiap 6 jam selama 48 jam.
20 BAB V
HASIL DAN PEMBAHASAN
5.1 Aktivasi Sel P.aeruginosa IFO 3924 dan Persiapan Media Padat Serta Media Cair dari Medium IFO 802 untuk Sub Culture.
Aktivasi sel serta persiapan medium padat dan medium cair telah dilakukan berdasarkan petunjuk pengaktipan dan pembuatan medium IFO 802 yang dikeluarkan oleh Institute of Fermentation, Osaka Jepang. Persiapan ini diperlukan untuk melakukan aktivasi sel yang disimpan dari ampul (telah disimpan dalam waktu yang lama).Untuk penggunaan rutin, sel disimpan dalam refrigerator pada media padat dengan suhu 4 C dan diaktifkan kembali menggunakan medium cair IFO 802.
Pengaktifan sel dari dalam ampul ke medium padat dapat dilakukan dengan baik. Sel dapat dibiakkan kembali dari dari ampul ke media cair dan media padat dan disimpan dalam refrigerator pada suhu 4 °C. Untuk kebutuhan penggunaan rutin, Sub kultur dilakukan tiap 3 minggu sekali. Selain pengaktifan sel, bakteri P. aeruginosa IFO 3924 ini juga ditumbuhkan pada media kaya substrat (rich medium). Sel ditumbuhkan dengan rentang waktu dari 0-42 jam dan dari hasil percobaan menunjukkna bahwa pertumbuhan berada pada fase logarikmit dari 9 jam hinggga 20 jam. Oleh karena itu, untuk keperluan produksi PHA dan rhamnolipid dalam labu erlenmeyer, digunakan sel bakteri yang telah ditumbuhkan dalam medium IFO 803 selama 18-20 jam.
5.4 Produksi PHA dan Rhamnolipid dengan Teknik Kultivasi Curah Berulang secara Simultan
Percobaan ini telah dilakukan guna mendapatkan beberapa parameter kinetik pertumbuhan, kondisi optimum untuk pertumbuhan dan produksi rhamnolipid dan PHA. Medium garam dasar (Bassal salt medium, BSM) seperti yang digunakan oleh Hori dkk (2002) ditambah sumber karbon minyak sawit atau produk samping industri biodiesel dari CPO yang disiapkan dengan mengatur pH medium hingga 7. Kultivasi curah dilakukan pada 500 ml labu erlenmeyer yang berisi 250 ml medium, diletakkan pada shaker dengan kecepatan 250 rpm dan suhu 30 C.
21 Variasi dari percobaan ini adalah: jenis sumber karbon (minyak sawit dan limbah cair biodiesel dari CPO); konsentrasi sumber karbon (minyak sawit): 5 g/l, 10 g/l dan 15 g/l; konsentrasi sumber karbon (limbah cair biodiesel dari CPO): 5 g/l, 25 g/l dan 50 g/l; Waktu pemanenan: 24 jam, 48 jam dan 72 jam. Parameter yang dianalisa adalah konsentrasi sel, jumlah rhamnolipid dan jumlah PHA yang dihasilkan.
5.2.1 Produksi Rhamnolipid dengan Teknik Kultivasi Curah
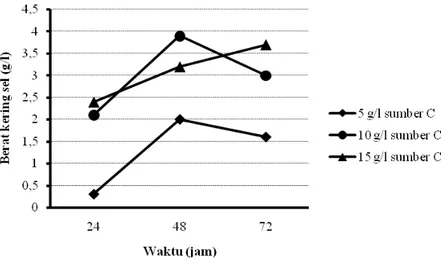
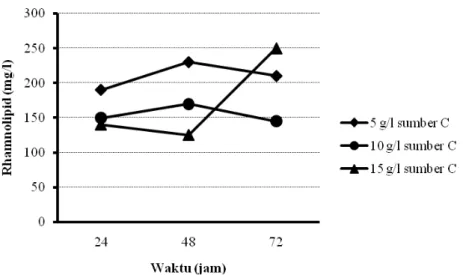
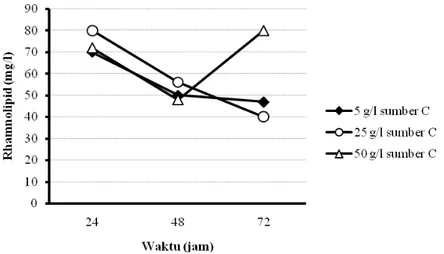
Produksi rhamnolipid dengan teknik kultivasi curah menggunakan sumber karbon minyak sawit dan limbah cair industri biodiesel ditunjukkan pada Gambar 5.1, 5.2, 5.3, dan 5.4.
Gambar 5.1.Pengaruh konsentrasi sumber karbon dalam media MBSM dan lama fermentasi pada perolehan berat kering sel (sumber C: minyak sawit)
22
Gambar 5.2 Pengaruh konsentrasi sumber karbon dalam media MBSM dan lama fermentasi pada perolehan rhamnolipid (sumber C: minyak sawit)
Gambar 5.3 Pengaruh konsentrasi sumber karbon dalam media MBSM dan lama fermentasi pada perolehan berat kering sel (sumber C:limbah biodiesel dari CPO)
23
Gambar 5.4 Pengaruh konsentrasi sumber karbon dalam media MBSM dan lama fermentasi pada perolehan rhamnolipid (sumber C:limbah biodiesel dari CPO)
Hasil percobaan menunjukkan bahwa pada penggunaan sumber karbon dari produk samping industri biodiesel dengan bahan baku CPO, sampai konsentrasi sumber karbon 25 g/l yang ditambahkan pada media produksi, maka semakin meningkat jumlah sel bakteri dan produk rhamnolipid yang dihasilkan. Namun, penambahan sumber karbon pada konsentrasi yang lebih tinggi (50 g/l) ternyata tidak mampu meningkatkan perolehan sel bakteri maupun rhamnolipid. Tidak demikian halnya pada penggunaan sumber karbon dari minyak sawit, semakin tinggi konsentrasi sumber karbon yang ditambahkan (sampai konsentrasi 15 g/l), semakin menurun produk rhamnolipid yang dihasilkan. Walaupun perolehan sel bakterinya semakin menurun. Pada penggunaan sumber karbon dari produk samping industri biodiesel dengan bahan baku CPO 25 g/l, diperoleh rhamnolipid maksimum sebesar 80 mg/l pada kultivasi selama 24 jam. Sedangkan, pada penggunaan sumber karbon minyak sawit 5 g/l, perolehan rhamnolipid maksimum sebesar 230 mg/l didapatkan pada kultivasi 48 jam.
Dari percobaan tersebut diketahui pula bahwa pada penggunaan sumber karbon dari produk samping industri biodiesel dengan bahan baku CPO, dengan semakin meningkatnya pertumbuhan sel selama rentang waktu kultivasi 24 hingga 48 jam, produk rhamnolipid yang dihasilkan cenderung semakin menurun. Tidak demikian halnya pada penggunaan sumber karbon dari minyak sawit, dengan
24 semakin meningkatnya pertumbuhan sel selama rentang waktu kultivasi 24 hingga 48 jam, produk rhamnolipid yang dihasilkan cenderung semakin meningkat.
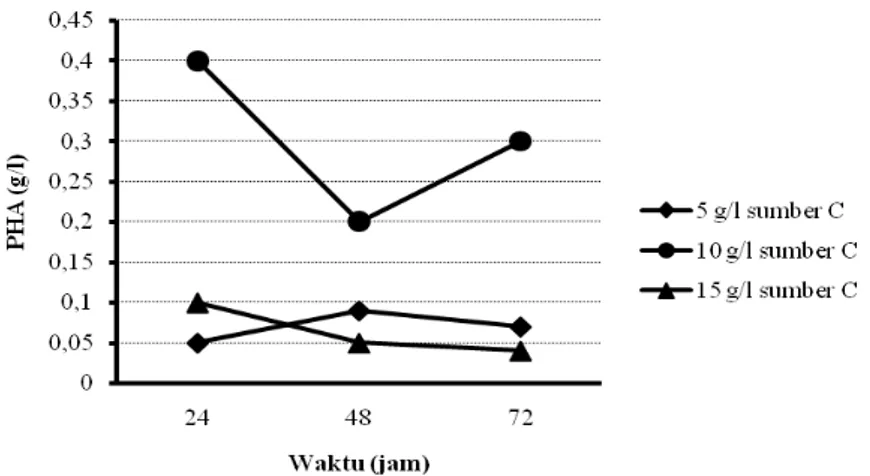
5.2.2 Optimasi Produksi PHA dengan Teknik Kultivasi Curah
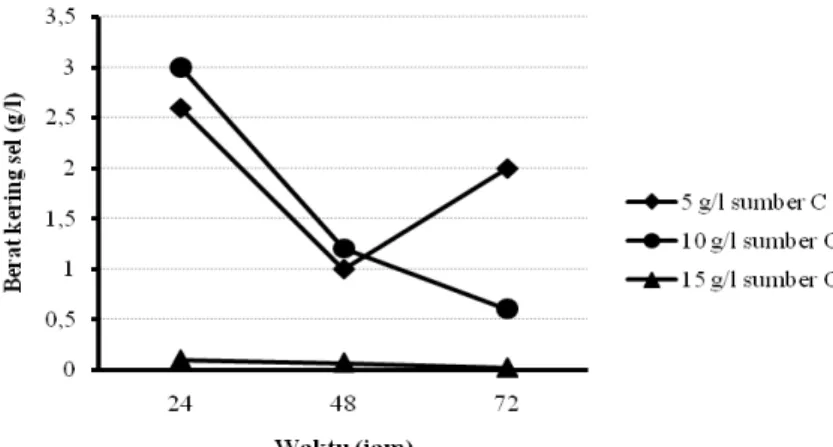
Produksi PHA dengan teknik kultivasi curah telah dilakukan dengan berbagai variabel dan hasilnya ditunjukkan pada Gambar 5.5, Gambar 5.6, Gambar 5.7, dan Gambar 5.8.
Gambar 5.5. Pengaruh konsentrasi sumber karbon dalam media BSM dan lama fermentasi pada perolehan berat kering sel (sumber C: minyak sawit)
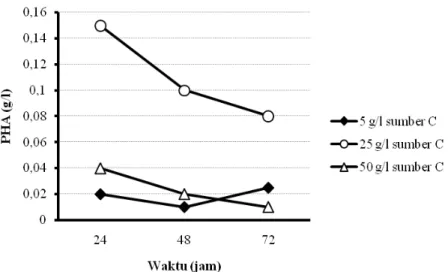
Pada produksi PHA menggunakan sel bakteri yang disuspensikan kembali setelah digunakan untuk memproduksi rhamnolipid, hasilnya menunjukkan bahwa pada penggunaan sumber karbon dari produk samping industri biodiesel dengan bahan baku CPO, sampai konsentrasi sumber karbon 25 g/l yang ditambahkan pada media produksi, maka semakin meningkat jumlah sel bakteri dan produk PHA yang dihasilkan. Namun, penambahan sumber karbon pada konsentrasi yang lebih tinggi (50 g/l) ternyata tidak mampu meningkatkan perolehan sel bakteri maupun PHA.
25
Gambar 5.6 Pengaruh konsentrasi sumber karbon dalam media BSM dan lama fermentasi pada perolehan PHA (sumber C: minyak sawit)
Gambar 5.7 Pengaruh konsentrasi sumber karbon dalam media BSM dan lama fermentasi pada perolehan berat kering sel (sumber C:limbah biodiesel dari CPO)
26
Gambar 5.8 Pengaruh konsentrasi sumber karbon dalam media BSM dan lama fermentasi pada perolehan berat kering sel (sumber C:limbah biodiesel dari CPO)
Demikian pula halnya, pada penggunaan sumber karbon dari minyak sawit, sampai konsentrasi sumber karbon 10 g/l yang ditambahkan pada media produksi, maka semakin meningkat jumlah sel bakteri dan produk PHA yang dihasilkan. Namun, penambahan sumber karbon pada konsentrasi yang lebih tinggi (15 g/l) ternyata tidak mampu meningkatkan perolehan sel bakteri maupun PHA. Pada penggunaan sumber karbon dari produk samping industri biodiesel dengan bahan baku CPO 25 g/l, diperoleh PHA maksimum sebesar 0,15 g/l pada kultivasi selama 24 jam. Sedangkan, pada penggunaan sumber karbon minyak sawit 10 g/l, perolehan PHA maksimum sebesar 0,4 g/l didapatkan pada kultivasi 24 jam.
Pada produksi PHA menggunakan sel bakteri yang disuspensikan kembali setelah digunakan untuk memproduksi ramnolipid, diketahui pula bahwa pada penggunaan sumber karbon dari produk samping industri biodiesel dengan bahan baku CPO, dengan semakin menurunnya pertumbuhan sel selama kultivasi 72 jam, media produksi, perolehan PHA yang dihasilkan cenderung semakin menurun. Demikian pula halnya pada penggunaan sumber karbon dari minyak sawit, dengan semakin menurunnya pertumbuhan sel selama kultivasi 72 jam, produk PHA yang dihasilkan cenderung semakin menurun bahkan relatif stabil.
27
5.3 Produksi PHA dan Rhamnolipid secara Simultan dengan Teknik Kultivasi Umpan Curah Berulang
Percobaan ini dilakukan guna mendapatkan optimasi produksi biosurfaktan rhamnolipid dengan teknik kultivasi umpan curah (fed batch culture) dan optimasi produksi PHA dengan teknik kultivasi umpan curah (fed batch culture)
menggunakan sel yang berasal dari produksi rhamonolipid sebelumnya.
5.3.3 Optimasi Produksi Rhamnolipid dengan Teknik Kultivasi Umpan Curah, pengumpanan sumber karbon secara impuls.
Percobaan optimasi produksi biosurfaktan rhamnolipid dengan teknik kultivasi umpan curah dilakukan menggunakan 1 liter erlenmeyer. Sejumlah 10 ml inokulum Pseudomonas aeruginusa, IFO 3924 ditambahkan ke dalam flask (erlenmeyer) yang telah berisi medium dasar ditambah produk samping industri biodiesel berbahan baku CPO sebagai sumber karbon dan amonium nitrat sebagai sumber nitrogen (amonium nitrat berguna untuk merangsang/ menstimulasi produksi rhamnolipid). Selanjutnya, sumber karbon sebagai umpan ditambahkan secara impuls ke dalam flask sesuai dengan variabel penelitian. Adapun variabel penelitiannya adalah
a. Konsentrasi awal sumber karbon di dalam flask: 5 g/l, 25 g/l dan 50 g/l b. Teknik pengumpanan sumber karbon: impuls
c. Waktu pemanenan (waktu pengambilan sampel): setiap 6 jam selama 72 jam.
Pada teknik pengumpanan sumber karbon secara impuls, sumber karbon ditambahkan setiap kali setelah pengambilan sampel dan jumlah karbon yang ditambahkan setelah diperhitungkan adalah berturut-turut untuk setiap variasi konsentrasi awal sumber karbon (5 g/l, 25 g/l dan 50 g/l) adalah 0,25; 2,5 dan 5 ml dan untuk setiap kali pengambilan sampel. Selama fermentasi berlangsung, 10 ml sampel diambil setiap 6 jam sekali (variabel waktu pemanenan). Sampel selanjutnya disentrifugasi untuk memisahkan sel dan supernatan. Sel dikeringkan dan selanjutnya dianalisa kandungan PHA nya (meskipun konsentrasinya sangat
28 kecil karena tahap ini sel diarahkan untuk memproduksi rhamnolipid) dan supernatan digunakan untuk analisa konsentrasi rhamnolipid.
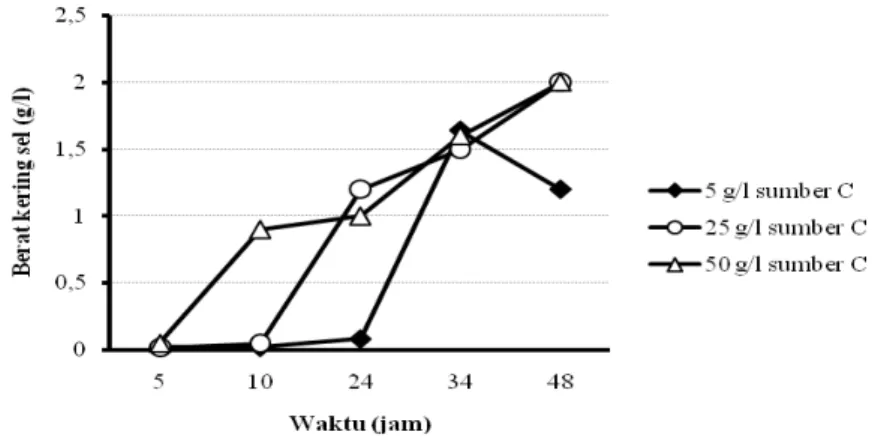
Gambar 5.9 dan Gambar 5.10 menunjukkan hasil percobaan optimasi produksi ramnolipid dengan pengumpanan secara impuls. Dari gambar tersebut terlihat bahwa penggunaan sumber karbon dari produk samping industri biodiesel dengan bahan baku CPO, pada konsentrasi awal 5 g/l dan dengan pengumpanan sumber karbon secara impuls setiap 6 jam selama 48 jam fermentasi, menghasilkan pertambahan perolehan rhamnolipid yang cenderung lebih cepat pada rentang waktu kultivasi 24-34 jam, dibandingkan dengan perlakuan konsentrasi sumber karbon lainnya.
Gambar 5.9 Pengaruh konsentrasi sumber karbon dalam media MBSM dan lama fermentasi pada perolehan berat kering sel (sumber C: limbah biodiesel dari CPO), teknik kultivasi umpan curah berulang, metode pengumpanan impuls
Kenaikan perolehan rhamnolipid ini maksimum dicapai pada kultivasi selama 34 jam, yaitu sebesar 270 mg/l. Hasil tersebut jauh lebih tinggi dibandingkan dengan perolehan rhamnolipid yang dihasilkan dari teknik kultivasi curah menggunakan jenis sumber karbon yang sama.
29
Gambar 5.10 Pengaruh konsentrasi sumber karbon dalam media MBSM dan lama fermentasi pada perolehan rhamnolipid (sumber C: limbah biodiesel dari CPO), teknik kultivasi umpan curah berulang, metode pengumpanan impul
5.3.4 Optimasi Produksi PHA dengan Teknik Kultivasi Umpan Curah, pengumpanan sumber karbon secara impuls.
Pada prinsipnya teknik optimasi produksi polihidroksialkanoat ini mirip dengan optimasi produksi rhamnolipid, hanya pada tahap ini sel dari proses produksi rhamnolipid digunakan kembali untuk memproduksi PHA. Selain itu, untuk merangsang/menstimulasi akumulasi PHA, sumber nitrogen tidak perlu ditambahkan. Dengan demikian, konsumsi sumber karbon oleh sel akan lebih banyak digunakan untuk mengakumulasi PHA (peningkatan berat) dan bukan untuk memperbanyak jumlah (satuan) sel.
Untuk optimasi produksi PHA ini, tingkat variabel sangat dipengaruhi oleh jumlah sel yang dihasilkan dari opimasi produksi rhamnolipid. Adapun variabel penelitiannya adalah:
a. Konsentrasi awal sumber karbon di dalam flask: 5 g/l, 25 g/l dan 50 g/l b. Teknik pengumpanan sumber karbon : impuls
c. Waktu pemanenan (waktu pengambilan sampel): setiap 6 jam selama 72 jam.
Pada teknik pengumpanan sumber karbon secara impuls, metode pengumpanan sama dengan yang digunakan pada optimasi produksi rhamnolipid.
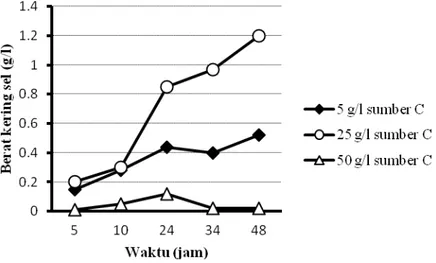
30 Hasil percobaan produksi PHA dengan teknik kultivasi umpan curah dengan pengumpanan secara impuls ditunjukkan pada Gambar 5.11 dan gambar 5.12. Hasil percobaan memperlihatkan bahwa penggunaan sumber karbon dari produk samping industri biodiesel dengan bahan baku CPO, pada konsentrasi awal 25 g/l dan dengan pengumpanan sumber karbon secara impuls setiap 6 jam selama 48 jam fermentasi, menghasilkan pertambahan perolehan PHA yang cenderung lebih cepat pada rentang waktu kultivasi 24-34 jam, dibandingkan dengan perlakuan konsentrasi sumber karbon lainnya. Kenaikan perolehan PHA ini maksimum dicapai pada kultivasi selama 34 jam, yaitu sebesar 0,35 g/l. Hasil tersebut jauh lebih tinggi dibandingkan dengan perolehan rhamnolipid yang dihasilkan dari teknik kultivasi curah menggunakan jenis sumber karbon yang sama.
Gambar 5.11 Pengaruh konsentrasi sumber karbon dalam media BSM dan lama fermentasi pada perolehan berat kering sel (sumber C: limbah biodiesel dari CPO), teknik kultivasi umpan curah berulang, metode pengumpanan impuls
31
Gambar 5.12 Pengaruh konsentrasi sumber karbon dalam media BSM dan lama fermentasi pada perolehan PHA (sumber C: limbah biodiesel dari CPO), teknik kultivasi umpan curah berulang, metode pengumpanan impuls
32 BAB VI
KESIMPULAN DAN SARAN
Dari hasil percobaan yang telah dilakukan dapat diambil beberapa kesimpulan dan saran saran untuk tindak lanjut penelitian berikutnya.
6.1 Kesimpulan
1. Rhamnolipid dan PHA dapat diproduksi dari bakteri P.aerugionsa dengan substrat dari produk samping industri biodiesel berbahan baku CPO
2. Konsetrasi awal sumber karbon (minyak sawit) 5 g/l memberikan hasil sel dan rhamnolipid terbaik dari beberapa konsetrasi yang telah diuji, sedangkan konsetrasi awal sumber karbon (minyak sawit) 10 g/l memberikan hasil sel dan PHA terbaik dari beberapa konsetrasi yang telah diuji pada kultivasi curah berulang secara simultan.
3. Konsetrasi awal sumber karbon (limbah biodiesel dari CPO) 25 g/l memberikan hasil sel, rhamnolipid dan PHA terbaik dari beberapa konsetrasi yang telah diuji, pada kultivasi curah berulang secara simultan.
4. Teknik kultivasi umpan curah dengan metode pengumpanan sumber C (produk samping industri biodiesel dari bahan baku CPO) secara impuls dapat meningkatkan produksi rhamnolipid; dan hasil maksimum sebesar 270 mg/l dicapai pada konsentrasi sumber karbon awal 5 g/l, selama 34 jam kultivasi. 5. Pada konsentrasi sumber karbon limbah cair industri biodiesel 25 g/l dengan
teknik kultivasi umpan curah berulang pengumpanan secara impuls diperoleh konsentrasi PHA dan berat kering sel yang lebih tinggi dibandingkan konsentrasi sumber karbon lain yang diuji yaitu masing masing secara berurutan adalah 0,35 g/l dan 1,2 g/l
6.2 Saran
Sebagai tindak lanjut penelitian ini disaran kan beberapa hal berikut ini terkait dengan uapaya untuk kelayakan produksi baik secara teknis maupun ekonomis.
33
1. Peningkatan kapasitas produksi/scale up ke tahap semi pilot.
2. Produksi PHA dan ramnolipid dengan pengumpanan secara kontinyu. 3. Identifikasi dan karakterisasi PHA dan ramnolipid yang dihasilkan. 4. Perhitungan kelayakan teknis dan ekonomis untuk produksi ramnolipid
sebagai bioinsektisida atau untuk keperluan sebagai bahan suplemen kosmetik
34
Daftar Pustaka
Ashby, R.D. dan T.A. Foglia. 1998. Poly(hydroxyalkanoates) biosynthesis from triglyceride substrate. Appl Microbil Biotechnol. 49: 431-437.
Chen G.Q., G Zhang, S.J. Park, dan S.Y. Lee, 2001, Industrial scale production of poly(3-hydroxybutyrate-co-3-hydroxyhexanoate), Appl Microbiol Biotechnol. 57: 50-55
Costa S.G.V.A.O, • Lépine F., •Milot S., Déziel E., •dan M. Nitschke, 2009, •Cassava wastewater as a substrate for the simultaneous production of rhamnolipids and polyhydroxyalkanoates by Pseudomonas aeruginosa, J Ind Microbiol Biotechnol 36:1063–1072.
Davis R., P.K. Anil Kumar, A. Chandrasekar, dan T.R. Shamala, 2008, Biosynthesis of polyhydroxyalkanoates co-polymer in E.coli using genes from Pseudomonas and Bacillus, Antonie van Leeuwenhoek 94: 207-216 De Koning, G.J.M, dan B. Witholt, 1997, A process for recovery of
poly(hydroxyalkanoates) from Pseudomonads, prt 1: Solubilization. Bioprocess Engineering, 17, 7-13.
Hori, K., S. Marsudi, dan H. Unno. 2002. Simultaneous production of polyhydroxyalkanoates and rhamnolipid by Psedomonas aeruginosa.
Biotechnology and Bioengineering. 78 (6). 699-707.
Koch, A.K., O. Kappeli, A. Ficher, dan J. Reiser. 1991. Hydrocarbon assimilation and biosurfactant production in Pseudomonas aeruginosa mutants. Journal of Bacteriology.173 (13): 4212-4219.
Kronemberger F. A., L.M.M.S. Anna, A. C. L. B. Fernades, R. R. Menezes, C.P. Borges, dan D.M.G. Freire, 2008, Oxygen-controlled Biosurfactant Production in a bench Scale bioreactor, Appl Biochem Biotechnol 147:33-45
Lang, S. dan D. Wullbrant. 1999. Rhamnose lipids-biosynthesis, microbial production and application potential. Appl Microbiol Biotechnol. 51: 22-32.
Lee, S. Y., 1996a, Plastic bacteria? progress and prospects for polyhydroxyalkanoate production in bacteria. Trends Biotechnology, 14, 431-438
Lee, S. Y., 1996b, Bacterial polyhydroxyalkanoates, Biotechnology and Bioengineering, 49, 1-14
Lee, L., S.Y. Lee, dan J.W. Yang. 1999. Production of rhmanolipid Biosurfactant by fed-batch culture of Pseudomonas aeruginosa using glucose as a sole carbon source. Biosci. Biotechnol. Biochem. 63(5): 946-947.
Lee, S.Y., H.H Wong, J. Choi, S.H. Lee, S.C. Lee, dan C.S. Han, 2000, Production of medium chain length polyhydroxyalkanoates by high-cell-density cultivation of Pseudomonas putida under phosphorus limitation.
Biotechnology and Bioengineering, 68(4): 466-470.
Lee K.M., S.H. Hwang, S.D. Ha, J. H. Jang, D.J. Lim, dan J. Y. Kong, 2004, Rhamnolipid production in batch and fed batch fermentation using pseudomonas aeruginosa BYK-2 KCTC 18012P, Biotechnology and Bioprocess engineering
35 Maier R. M. dan G. Soberon-Chavez. 2000. Pseudomonas aeruginosa
rhamnolipids: Biosynthesis and potential applications. Appl Microbiol Biotechnol. 54: 625-633.
Matsufuji, M. K. Nakata, dan K. Yoshimoto, 1997. High Production of rhamnolipids by Pseudomonas aeruginosa growing on ethanol.
Biotechnol. Lett 19 : 1213 – 1215.
Marsudi, S. dan T. Setiadi, 1997, Preliminary study of polyhydroxyalkanoates (PHAs) biosynthesis by Rhadobacter sphaeroides IFO 12203 photosynthetic bacterium using volatile fatty acid as carbon sources, dalam
Proceeding of the Indonesian Biotechnology Conference (IBC-1997), June 17-19, Jakarta, Indonesia.
Marsudi, S., A. Ishihara, S. Yamamoto, dan H. Unno, 1998, Accumulation of polyhydroxyalkanoates (PHAs) by Alcaligenes eutrophus H16 utilizing carbon dioxide and valeric acid as carbon sources, dalam Proceeding of Regional Symposium on Chemical Engineering, October 14-16, 1998, Manila, Philippines, 241-246.
Marsudi S., 2002, Simultaneous Production of Polyhydroxyalkanoates (PHAs) and Rhamnolipids by Pseudomonas aeruginosa IFO 3924, Disertasi S3, Tokyo Institut Teknologi Indonesia, Tokyo Jepang.
Marsudi, S. 2002, Studi on simultaneous microbial production of polyhydroxyalkanoates and rhamnolipids. Disertasi S3, TIT, Tokyo, Jepang.
Marsudi, S., Irene K.P. Tan, S. N. Gan, dan K. B. Ramachandran, 2003, Production of Medium Chain Length Polyhydroxyalkanoates (PHAmcl) in Fermenter using saponified crude palm oil (SCPO) and saponified crude palm kernel oil (SCPKO) as Carbon sources, dalam Proceeding of the International Conference on Chemical and Bioprocess Engineering
(ICCBPE 2003), August 27-29, 2003, Kota Kinibalu, Malaysia, 194-198 Marsudi, S., Irene K.P. Tan, S. N. Gan, dan K. B. Ramachandran, 2007,
Production of medium-chain-length Polyhydroxyalkanoates (PHA-mcl) from oleic acid using Pseudomonas Putida PGA1 by fed batch culture,
Makara Seri Teknologi, 11 (1): 1-6
Marsudi S., H. Unno dan K. Hori, 2008, Palm oil utilization for the simultaneous production of polyhydroxyalkanoates and rhamnolipids by Pseudomonas aeruginosa, Appl. Microbiol Biotechnol 78: 955-961
Muller M.M., B. Hormann, C. Syldatk, dan R. Hausmann, 2010, Pseudomonas aeruginosa PAO1 as a model for rhamnolipid production in bioreactor systems, Appl Microbiol Biotechnol 83: 123-130
Neto D.C. , J.A. Meira, J.M. Araujo, D.A. Mitchell, dan N. Krieger, 2008, Optimization of the production of rhamnolipids by Pseudomonas aeruginosa UFPEDA 614 in Solid-state culture, Appl Microbiol Biotechnol 81: 441-448
Serafim L.S., P.C.Lemos, M.G.E. Albuqueque, dan M.A.M. Reis, 2008, Strategies for PHA production by mixed cultures and renewable waste materials,
Appl Microbiol Biotechnol, 81:615-628
Sun Z., J.A. Ramsay, M. Guay, dan B.A. Ramsay, 2009, Fed batch production of unsaturated medium chain length polyhydroxyalkanoates with controlled
36 composition by Pseudomonas putida KT 2440, Appl Microbiol Biotechnol
82:657-662
Solaiman D.K.Y., R. D. Ashby, dan T.A. Foglia. 2001. Production of polyhydroxyalkanoates from intact triacylglycerols by genetically engineered Pseudomonas. Appl Microbiol Biotechnol. 56. 664-669.
37 LAMPIRAN
Lampiran 1a. Komposisi media IFO 802
Uraian Konsentrasi per liter air
Polypepton 10 g
Yeast Extract 2 g
MgSO4 7H2O 1 g
Lampiran 1b. Komposisi media garam dasar (Basssal Salt Medium, BSM)
Uraian Konsentrasi per liter air
(NH4)2 HPO4 1.10 g
K2HPO4 5.80 g
KH2PO4 3.70 g
MgSO4 0.12 g
Mikroelemen 1 ml
Lampiran 1c. Komposisi media modifikasi garam dasar (Modified Basssal Salt Medium, MBSM)
Uraian Konsentrasi per liter air
NH4 NO3 0.666 g
K2HPO4 6.6852 g
KH2PO4 4,1413 g
MgSO4.7H2O 0.12 g
Mikroelemen 1 ml
Lampiran 1d. Komposisi Mikroelemen
Uraian Konsentrasi per liter air
FeSO47H2O 2.80 g MnSO45H2O 2.40 g CoCl2 6H2O 2.40 g CaCl2 H2O 1.70 g CuCl2 2H2O 0.20 g ZnSO4 7H2O 0.30 g NaMoO4 0.25 g
38 Lampiran 2. Rekapitulasi hasil analisis rata-rata berat kering sel (g/l) dan
perolehan rhamnolipid (mg/l) pada produksi biosurfaktan kultivasi curah dengan variasi konsentrasi sumber karbon (minyak sawit) dan waktu fermentasi
Perlakuan
Berat kering sel (g/l)
Perolehan rhamnolipid (mg/l) Konsentrasi sumber karbon-minyak sawit (g/l) Waktu fermentasi (jam) 5 24 0,30 190 48 2,00 230 72 1,60 210 10 24 2,10 150 48 3,90 170 72 3,00 145 15 24 2,40 140 48 3,20 125 72 3,70 250
Lampiran 3. Rekapitulasi hasil analisis rata-rata berat kering sel (g/l) dan perolehan rhamnolipid (mg/l) pada produksi biosurfaktan kultivasi curah dengan variasi konsentrasi sumber karbon (limbah cair biodiesel dari CPO) dan waktu fermentasi
Perlakuan
Berat kering sel (g/l)
Perolehan rhamnolipid (mg/l) Konsentrasi sumber karbon-limbah cair biodiesel (g/l) Waktu fermentasi (jam) 5 24 0,10 70 48 0,80 50 72 0,50 47 25 24 1,70 80 48 4,20 56 72 2,80 40 50 24 1,50 72 48 2,50 48 72 3,00 80
39 Lampiran 4. Rekapitulasi hasil analisis rata-rata berat kering sel (g/l) dan
perolehan PHA (g/l) pada produksi bioplastik kultivasi curah dengan variasi konsentrasi sumber karbon (minyak sawit) dan waktu fermentasi
Perlakuan
Berat kering sel (g/l) Perolehan PHA (g/l) Konsentrasi sumber karbon-minyak sawit (g/l) Waktu fermentasi (jam) 5 24 2,60 0,05 48 1,00 0,09 72 2,00 0,07 10 24 3,00 0,40 48 1,20 0,20 72 0,60 0,30 15 24 0,03 0,10 48 0,03 0,05 72 0,01 0,04
Lampiran 5. Rekapitulasi hasil analisis rata-rata berat kering sel (g/l) dan perolehan PHA (g/l) pada produksi bioplastik kultivasi curah dengan variasi konsentrasi sumber karbon (limbah cair biodiesel dari CPO) dan waktu fermentasi
Perlakuan
Berat kering sel (g/l) Perolehan PHA (g/l) Konsentrasi sumber karbon-limbah cair biodiesel (g/l) Waktu fermentasi (jam) 5 24 0,80 0,02 48 0,30 0,01 72 0,60 0,03 25 24 1,80 0,15 48 0,60 0,10 72 0,20 0,08 50 24 0,05 0,04 48 0,03 0,02 72 0,01 0,01
40 Lampiran 6. Rekapitulasi hasil analisis rata-rata berat kering sel (g/l) dan
perolehan rhamnolipid (mg/l) pada produksi biosurfaktan kultivasi umpan curah dengan variasi konsentrasi sumber karbon (limbah cair biodiesel dari CPO) dan waktu fermentasi
Perlakuan
Berat kering sel (g/l)
Perolehan rhamnolipid (mg/l) Konsentrasi sumber karbon-limbah cair biodiesel (g/l) Waktu fermentasi (jam) 5 5 0,018 150 10 0,020 140 24 0,082 150 34 1,640 270 48 1,200 250 25 5 0,017 120 10 0,050 160 24 1,200 180 34 1,500 260 48 2,000 150 50 5 0,050 180 10 0,900 130 24 1,000 140 34 1,600 150 48 2,000 100
41 Lampiran 7. Rekapitulasi hasil analisis rata-rata berat kering sel (g/l) dan
perolehan PHA (g/l) pada produksi biosurfaktan kultivasi umpan curah dengan variasi konsentrasi sumber karbon (limbah cair biodiesel dari CPO) dan waktu fermentasi
Perlakuan
Berat kering sel (g/l) Perolehan PHA (g/l) Konsentrasi sumber karbon- limbah cair biodiesel dari CPO (g/l) Waktu fermentasi (jam) 5 5 0,15 0,01 10 0,28 0,02 24 0,44 0,04 34 0,40 0,04 48 0,52 0,05 25 5 0,20 0,10 10 0,30 0,18 24 0,85 0,23 34 0,97 0,35 48 1,20 0,30 50 5 0,01 0,01 10 0,05 0,01 24 0,12 0,06 34 0,02 0,05 48 0,02 0,05
42 Lampiran 8. Foto-foto penelitian
Biakan Pseudomonas aerugenosa dalam ampul dan proses aktivasi sel
43
Proses pemisahan sel
44
Lampiran 9. Organisasi Ketua dan Semua Anggota Tim Pengusul
No.
Nama Jabatan Dalam
Tim Tugas Dalam TIM (diuraikan dengan rinci) NIP Alokasi Waktu,
Jam/Minggu
1.
Ir. Darti Nurani, M.Si. Ketua Tim - Merencanakan penelitian
- Optimasi produksi PHA dan ramnolipid
- Konfirmasi produksi PHA dan ramnolipid
- Penulisan artikel ilmiah dan paten/HKI - Pembuatan laporan - 25 jam/minggu 2. Dr.Ir. Sidik Marsudi, M.Si.
Anggota Tim - Set up peralatan dan preparasi medium
- Analisa PHA dan ramnolipid (konsentrasi dan properti)
- Penulisan artikel ilmiah
- Pembuatan laporan 19661231 199203 1 017 20 jam/minggu
45
Biodata Pengusul
1. Ketua Tim
Name : Ir. Darti Nurani,M.Si. Nationality : Indonesian
Place/Date of Birth : Magelang, July 21, 1961 Religion : Moslem
Present position : a.Head of Agroindustrial Technology Laboratory
b.Lecturer and researcher at Indonesia Institute of Technology
Home address : Telaga Kahuripan, BIP – A4/8, Parung, Bogor, Indonesia Email: n_darti@hotmail.com
Office address : Department of Agroindustrial Technology Indonesia Institute of Technology
Jl. Raya Puspiptek, Serpong, Tangerang 15320 Telp. 0217560544, Fax 7560542
Educational Background
1. 2002, Master of Science (Industrial Agricultural of Technology), Bogor Agricultural University, Bogor, Indonesia
2. 1986, Undergraduate (S1) of Agricultural Product Technology, Gajah Mada University, Yogyakarta, Indonesia
Professional Association
1. Indonesian Association of Microbiologist (PERMI), member 2. Indonesian Association of Food Technologist (PATPI), member 3. Indonesian of Society for Lactic Acid Bacteria (ISLAB), member Working Experiences
1. Lecturer in General Microbiology, Industrial Microbiology, Packaging Technology, Department of Agroindustrial Technology, Indonesia Institute of Technology, 1994 - present
2. Lecturer in Food Chemistry, Department of Agroindustrial Technology, Indonesia Institute of Technology, 1994 - present
3. Lecturer in Microbiology for Engineers, Department of Chemical Engineering, Indonesia Institute of Technology, 2004 - present
4. Secretary of Department of Agroindustrial Technology, Indonesia Institute of Technology, 1991 - 1992
5. Head of Microbiology Laboratory, Department of Agroindustrial Technology, Indonesia Institute of Technology, 1992 – 1997; 2002 - 2008 6. Head of Agroindustrial Technology Laboratory, Indonesia Institute of
Technology, 2008 – present
7. Organizing Committee in Symposium Biotechnology of Probiotic for Human Health, Center for Assessment of Biotechnology collaboration with Shinshu University, Japan and National University of Singapore, Jakarta 2002
8. Organizing Committee in International Symposium on Probiotic, Center for Assessment of Biotechnology collaboration with Japan Collection of
46 Microorganism – RIKEN and National University of Singapore, Bali 2004 9. Organizing Committee in PATPI Congress and Seminar, Jakarta 2004
10. Organizing Committee in The 4th Indonesian Biotechnology Conference: Biotechnology for Better Food, Health and Environment, Bogor 5 – 7 August 2008
11. Organizing Committee in International Symposium on Probiotic from Asian Traditional Fermented Foods for Healthy Gut Function, SEAMEO – TROPMED Regional Center for Community Nutrition University of Indonesia, Jakarta August 19th – 20th 2008
Course
1. Marine Pollution Monitoring and Training Programme, LIPI – UNESCO/UNDP, Puslitbang Oceanologi, LIPI Jakarta, November 20 – 23, 1989
2. Seminar Ilmiah Persatuan Ahli Teknologi Laboratorium Kesehatan Indonesia (Patelki): Peranan pengawasan mutu untuk peningkatan dan pengendalian keamanan produk pangan dalam menyongsong UU Pangan dan era pasar bebas, Jakarta November 25 – 26, 1996
3. International Seminar and Exhibition: Release and Biosafety of Genetically Modified Foods, Bogor Agricultural University, September 10 – 11, 1997 4. One day seminar on The Challenging Prospect and Strategies of Yeast
Diversity and National Workshop on Isolation and Identification of Yeast, August, 19 – 23 1999, Wisma Makara, University of Indonesia
5. Indonesian International Joint Research Grant Program (RUTI): Workshop The First Year Result: In vivo and clinical studies and probiotic properties of indigenous Dadih lactic bacteria for starter culture. December, 17 2002. Balai Pengkajian Bioteknologi, BPPT, Serpong
6. Kursus identifikasi mikroba, August 27 – 28 2003. PAU, ITB, Bandung 7. Visiting Researcher University of Turku, Finland. October 2006 – February
2007
Research activities
1. Screening of Lactic Cultures Isolated from Dadih Bukittinggi for Fermented Culture, 1996 - 1997
2. Amino Acid Profiles of Some Lactic Acid Bacteria from Dadih, 1997 – 1998 3. The Effect of Preserving Lactic Acid Bacteria Isolated from Dadih on Viability, Biochemical Activity and Antimutagenicity of The Bacterial Cells. URGE Project, Batch III, 1998/2000
4. Exploration of Indigenous Lactic Acid Bacteria from Dadih from West Sumatra for Good Starter Culture and Probiotic Bacteria (URGE – DCRG 2000 - 2001)
5. In Vivo and Clinical Studies on Probiotic Properties of Indigenous Dadih Lactic Acid Bacteria for Starter Culture, RUTI, Assessment of Biotechnology, BPPT 2001 – 2003
6. Study on Starter Culture Media Formulation of Yoghurt Probiotic. 2003 7. Viability of Probiotic in Cream Biscuit Storage. 2003
8. Optimatization Condition for α – amylase Extracelluler Production. 2003 9. Characterization Probiotic Properties of Lactic Acid Bacteria Isolated from
47 “Badeg Pace”. 2004
10. Pengaruh Konsumsi Probiotik pada Aktivitas Mikrobiologis Saluran Cerna. 2006
11. Probiotic for Decontaminating Microcystin Containing Indonesia Water Samples. University of Turku, Finland, October 2006 – February 2007 12. Assessment of Probiotic Lactobacillus plantarum from Dadih for Human
Health Promotion. Applied Research Program SEAMEO – TROPMED, University of Indonesia. 2007
13. Production of Probiotic Concentrate IS-725 for The Powder Milk Product. 2008
14. 15.
Investigation any Bacteriocin Produced by Lactic Acid Bacteria Isolated from Dadih. 2008
Pengaruh suplementasi yoghurt probiotik asal Dadih Enterococcus faecium,
IS-27526 terhadap morbidas diare dan respon imun IgA secretory pada balita. 2009. Penelitian Isu Strategis (UNJ), dana DIKTI
Publication
1. Nurani, D. dan I.S. Surono, 1996. Pengaruh cara pengeringan dan lama penyimpanan pada karakteristik jamur pangan kering. Jurnal IPTEK – Institut Teknologi Indonesia, No V, November 1996
2. Nurani, D., T. Tedja, A. Suryani, I.S. Surono, 2000. Viabilitas dan aktivitas biokimiawi pada pembekuan dan penyimpanan beku kultur bakteri laktat asal Dadih. Jurnal IPTEK – Institut Teknologi Indonesia, No XVIII, September 2000
3. Surono, I.S., D. Nurani dan A.A.A. Dharmawati, 1997. Seleksi kultur bakteri laktat asal Dadih Bukittinggi sebagai starter susu fermentasi.
Jurnal IPTEK – Institut Teknologi Indonesia, No VII, Agustus 1997 4. Nurani, D., E. Martius, I.S. Surono dan Koesnandar, 2003. Study on
Starter Culture Media Formulation of Yoghurt Probiotic. Buku Program dan Abstrak PIT – PERMI, 29 – 30 Agustus 2003, Bandung
5. Trismilah, B. Wahyuntari dan D. Nurani, 2004. Pemanfaatan berbagai jenis pati sebagai sumber karbon untuk produksi α-amilase ekstraseluler Bacillus SW2. Buku Program dan Abstrak PIT – PERMI, Agustus 2004, Semarang
6. Surono, I.S., U. Pato, Koesnandar, D. Nurani and A. Latief, 2004. Dadih Probiotic: In Vivo and Clinical Studies on Lactic Bacteria IS-27526. Programme/Abstract of International Symposium Probiotic for Human Health and Immunity. Bali 7 – 8 September 2004
7. Surono, I.S., F. Riewpassa, D. Nurani, C.M. Kusharto, 2004. In vivo Immune Response of Spraque Dawley Rat Fed with Casein, Fish Protein Concentrate Biscuit. Programme/Abstract of International Symposium Probiotic for Human Health and Immunity. Bali 7 – 8 September 2004 8. Surono, I.S., Koesnandar, F.R. Zakaria, D. Nurani, F. Koestomo, N.
Novitasari, J. Dharmawan, Yuan Kun Lee, 2005. Immunodulatory Properties of Dadih Probiotic Bacteria in Indonesian Undernourished Children. Buku Program dan Abstrak PIT – PERMI, 25 – 28 Agustus 2005, Bali