EFEK PEMBERIAN STATIN TERHADAP PROLIFERASI
ENDOTHELIAL PROGENITOR CELL (EPC) PADA DARAH TEPI PENDERITA PENYAKIT JANTUNG KORONER STABIL
Karya Akhir Untuk Mendapatkan Keterangan Keahlian di Bidang Ilmu Penyakit Jantung dan Pembuluh Darah
Peneliti Feranti Meuthia, dr
NIM : 011181303
Pembimbing
Dr. Yudi Her Oktaviono, dr., SpJP(K), FIHA Prof. Dr. Djoko Soemantri, dr., SpJP(K), FIHA
PROGRAM PENDIDIKAN DOKTER SPESIALIS – 1
DEPARTEMEN ILMU PENYAKIT JANTUNG DAN PEMBULUH DARAH FAKULTAS KEDOKTERAN UNIVERSITAS AIRLANGGA
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT atas berkat, rahmat dan anugerahNya sehingga karya akhir dengan judul Efek Pemberian Statin Terhadap Proliferasi Endothelial Progenitor Cell (EPC) Pada Darah Tepi Penderita Penyakit Jantung Koroner Stabil telah terselesaikan dengan baik.
Penulis menyadari bahwa karya akhir ini tidak dapat terselesaikan dengan baik tanpa bantuan, bimbingan dan dorongan dari berbagai pihak. Kepada Dr. Yudi Her Oktaviono, dr. SpJP(K), FIHA dan Prof. DR. Djoko Soemantri, dr. SpJP(K), FIHA selaku pembimbing karya akhir kami, pembimbing metodologi penelitian dan statistik serta sebagai koordinator penelitian, penulis ucapkan terima kasih yang sebesar-besarnya atas segala bimbingan, dukungan dan semangat yang telah diberikan untuk menyelesaikan penelitian ini. Pada kesempatan ini penulis juga menghaturkan terima kasih kepada yang terhormat: 1. Prof. Dr. H. Fasich, Apt selaku Rektor Universitas Airlangga saat penulis
2. Muhammad Aminuddin,dr., SpJP (K)., FIHA., FAsCC selaku Departemen Ilmu Penyakit Jantung dan Pembuluh Darah FK Unair saat penulis memulai pendidikan hingga saat ini atas kesempatan untuk menempuh pendidikan, bimbingan serta bantuannya selama pendidikan.
3. Andrianto, dr., SpJP (K)., FIHA, FAsCC selaku Ketua Program Studi Ilmu Penyakit Jantung dan Pembuluh Darah FK Unair atas kesempatan menempuh pendidikan, dan bimbingan serta bantuannya selama pendidikan.
4. Agus Subagjo, dr., Sp.JP(K), FIHA, FAsCC selaku Ketua Program Studi Ilmu Penyakit Jantung dan Pembuluh Darah FK Unair saat penulis memulai pendidikan atas kesempatan menempuh pendidikan, dan bimbingan serta bantuannya selama pendidikan.
5. Prof. Dr. Djoko Soemantri, dr., Sp.JP(K), FIHA, FAsCC dan Dr. J. Nugroho, dr., Sp.JP(K), FIHA, FasCC selaku koordinator penelitian pada Program Studi Ilmu Penyakit Jantung dan Pembuluh Darah FK Unair atas segala bimbingan dan bantuannya selama pendidikan.
6. Prof. Maria Inge Lusida, dr., M.Kes., Ph.D., SpMK(K) sebagai kepala ITD-UNAIR Surabaya dan Dr. Purwati, dr., SpPD, FINASIM, selaku kepala Instalasi Laboratorium Stem Cell ITD-UNAIR Surabaya beserta jajaran staf dan teknisinya (Helen Susilowati, SKM., dkk) yang telah memberikan saya kesempatan dan dukungan untuk melakukan penelitian di tempat tersebut, memberikan bantuan, dukungan, dan arahan untuk menyelesaikan karya akhir ini.
8. Prof. Dr. Budi Susetyo Juwono (Alm), dr., SpJP (K)., FIHA dan Jatno Karjono (Alm), dr., SpJP (K)., FIHA atas bimbingan, bantuan dan keteladanan yang diberikan selama masa hidup beliau selama pendidikan. 9. Seluruh Staf Pengajar Program Studi Ilmu Penyakit Jantung dan Pembuluh
Darah FK Unair : Prof. Dr. Budi S. Pikir, dr., SpJP (K)., Prof. Dr. Rochmad Romdoni, dr., SpJP (K)., Jeffrey D. Adipranoto, dr., SpJP (K)., RP. Soeharsohadi, dr., SpJP (K)., Iswanto Pratanu, dr., SpJP (K)., Dyah Priyatini, dr., SpJP (K)., Esti Hindariati, dr., SpJP (K)., Budi Baktijasa, dr., SpJP (K)., I Gde Rurus Suryawan, dr., SpJP (K)., Bambang Herwanto, dr., SpJP (K)., Achmad Lefi, dr., SpJP (K)., Yudi Her Oktaviono, dr., SpJP (K)., Moh. Budiarto, dr., SpJP., M. Yusuf., dr., SpJP., Meity Ardiana, dr., SpJP., Rerdin Julario, dr., SpJP., Rosi Amrilla F, dr., SpJP. dan Nia Dyah Rahmianti, dr., SpJP. atas segala bimbingan, bantuan dan semangat yang diberikan selama pendidikan.
10. Kepala Bagian/SMF Ilmu Penyakit Dalam, Paru, Radiologi, Rehabilitasi Medik, dan Ilmu Kesehatan Anak beserta staf pengajar atas kesempatan belajar serta bimbingannya selama pendidikan.
11. Kepala Ruangan Rawat Inap, Poliklinik Jantung, ICCU, IDIK, IRD dan Ekokardiografi beserta seluruh staf paramedis RSUD Dr. Soetomo Surabaya dan karyawan bagian Ilmu Penyakit Jantung dan Pembuluh Darah FK Unair atas segala bimbingan, kerjasama, motivasi dan bantuannya selama pendidikan.
13. Rekan – rekan seangkatan : Ahmad Surya Darma.dr, Intan Komalasari.dr, Devie Caroline.dr, Revi Adheriyani.dr, Aussie F. Ghaznawie.dr, dan Nadya Luthfah.dr, atas kerjasama, dukungan, motivasi dan semangat selama pendidikan.
14. Rekan – rekan seperjuangan dalam ujian tulis nasional (CBT Maret 2016): Rina Mawarti.dr, Irma Kartikasari.dr, Susetyo Atmojo.dr, Ahmad Faizal Amir.dr, dan Luh Oliva S.dr, atas segala bantuan, dukungan dan kerjasamanya.
15. Rekan – rekan PPDS-1 stase IDIK yang turut memberikan dukungan dalam penyelesaian penelitian ini atas jerih payah, kerjasama dan dukungan yang diberikan
16. Rekan – rekan PPDS – 1 Ilmu Penyakit Jantung dan Pembuluh Darah FK Unair atas segala kerjasama, bantuan, semangat selama pendidikan.
17. Anak saya tercinta, Tania Rossa Fidelya, atas segala pengertian, dukungan, kesabaran, pengorbanan, serta doa yang diberikan selama menempuh pendidikan.
18. Orang tua saya, Prof. Dr. Sabilal Alif (Alm), dr, SpU(K) dan Nur Laily, serta kakak-adik saya Ferizal Ardiansyah, ST., MBA., Fikri Rizaldi, dr. SpU., Ferdian Rizaliansyah, dan Farhan Nurdiansyah dengan penuh kasih sayang dan perhatian mendoakan dan memberikan dukungan, motivasi, dan bantuannya selama menempuh pendidikan.
19. Semua pihak yang tidak bisa disebutkan satu – persatu, yang turut membantu dan mendukung penulis selama menjalani pendidikan.
di masa mendatang. Saya berharap karya akhir ini dapat bermanfaat bagi masyarakat dan bagi perkembangan ilmu pengetahuan. Tidak lupa penulis memohon maaf yang sebesar – besarnya kepada semua pihak atas segala kekurangan dan kesalahan yang dilakukan selama menjalani pendidikan.
ABSTRAK
Efek Pemberian Statin Terhadap Proliferasi Endothelial Progenitor Cell
(EPC) Pada Darah Tepi Penderita Penyakit Jantung Koroner Stabil Feranti Meuthia
Yudi Her Oktaviono Djoko Soemantri
Latar Belakang: Lesi atherosklerotik merupakan akibat dari proses inflamasi yang diawali oleh kerusakan endotel. EPC, yang berasal dari sumsum tulang, berpartisipasi dalam perbaikan endotel dan pertumbuhan pembuluh darah baru. Farmakoterapi kardiovaskular telah dibuktikan dapat memperbaiki jumlah dan fungsi EPC pada penderita dengan risiko kardiovaskular dan penyakit kardiovaskular. Banyak studi melaporkan bahwa statin memiliki efek yang menguntungkan terhadap EPC yaitu dengan meningkatkan proliferasi dan diferensiasi. Oleh karena itu, kami melakukan penelitian untuk menganalisis efek tiga statin yang berbeda terhadap proliferasi EPC.
Tujuan: Untuk menganalisis efek pemberian statin terhadap proliferasi EPC pada darah tepi penderita penyakit jantung koroner stabil.
Metode: Penelitian ini kami lakukan secara in vitro true experimental post-test only control group design. Sel mononuklear diisolasi dari darah tepi penderita penyakit jantung koroner stabil dan dilakukan kultur dalam medium CFU-Hill selama 3 hari. Kemudian sampel dibagi menjadi empat kelompok yaitu kelompok simvastatin,, atorvastatin, rosuvastatin dan kelompok kontrol. Tiap kelompok yang diberi perlakuan dibagi lagi menjadi 3 subkelompok dengan dosis yang berbeda, yaitu 0.1 µmol/L, 0.5 µmol/L, dan 2.5 µmol/L kemudian diinkubasi selama 48 jam. Proliferasi EPC dievaluasi setelahnya dengan MTT cell proliferation assay. Metode imunositokimia dilakukan untuk identifikasi EPC dengan mengevaluasi ekspresi CD34+. Pemeriksaan dan penghitungan CFU-Hill dilakukan untuk mengkonfirmasi karakteristik fungsional EPC. Data dianalisis dengan uji T independen dan ANOVA.
Hasil: MTT cell prolifeation assay menunjukkan peningkatan bermakna terhadap proliferasi EPC pada kelompok simvastatin, atorvastatin, dan rosuvastatin dibandingkan dengn kelompok kontrol (0.237±0.007, 0.248±0.01, 0.231±0.008 vs 0.019±0.008, p<0.05). Proliferasi EPC juga berbeda antar kelompok statin, dimana efek tertinggi didapatkan pada kelompok atorvastatin. Proliferasi EPC pada kelompok atorvastatin lebih tinggi daripada kelompok simvastatin (0.248±0.01 vs 0.237±0.007, p<0.05), dan simvastatin lebih tinggi daripada kelompok rosuvastatin (0.237±0.007 vs 0.231±0.008, p<0.05). Penghitungan CFU-Hill memperlihatkan jumlah tertinggi pada kelompok rosuvastatin, diikuti atorvastatin, dan simvastatin. Pemeriksaan imunositokimia menunjukkan ekspresi positif terhadap CD34.
Kesimpulan: Statin meningkatkan proliferasi EPC pada darah tepi penderita penyakit jantung koroner stabil. Efek tertinggi tampak pada kelompok atorvastatin, diikuti kelompok simvastatin, dan rosuvastatin. Tiap statin meningkatkan proliferasi dengan bergantung dosis (dose-dependent).
ABSTRACT
Effect of Statins on Endothelial Progenitor Cell (EPC) Proliferation from Peripheral Blood of Stable Coronary Artery Disease Patient
Feranti Meuthia Yudi Her Oktaviono
Djoko Soemantri
Background: Atherosclerotic lesions develop as the result of an inflammatory process initiated by endothelial damage. EPCs, which is derived from bone marrow, participate in endothelial repair and new vessel growth. Cardiovascular pharmacotherapies have been shown to improve overall numbers and function of EPCs in patients with cardiovascular risk and cardiovascular disease. Studies have reported that statins exert beneficial effects on EPCs by enhancing EPC proliferation and differentiation. Thus, we require a research to analyze the effects of three different statins on EPC proliferation.
Objective: To analyze the effect of statins on EPC proliferation from peripheral blood of stable coronary artery disease patient.
Methods: This is an in vitro true experimental post-test only control group design. The MNCs were isolated from peripheral blood of stable coronary artery disease patient and were cultured in CFU-Hill medium for 3 days. Then samples were put into four groups, simvastatin experiment group, atorvastatin experiment group, rosuvastatin experiment group and control group. Each experiment group was divided into 3 subgroups with different doses, 0.1 µmol/L, 0.5 µmol/L, dan 2.5 µmol/L then incubated for 48 hours. EPC proliferation was evaluated afterwards with MTT cell proliferation assay. Immunocytochemistry method was performed for EPC identification to evaluate expression of CD34+. CFU-Hill were observed to confirm functional characteristics of EPC. Datas were analyzed by independent T test and ANOVA.
Results: MTT cell proliferation assay showed a significant increase of EPC proliferation in simvastatin, atorvastatin, and rosuvastatin groups compared with control group (0.237±0.007, 0.248±0.01, 0.231±0.008 vs 0.019±0.008, p<0.05). It also revealed significant difference in EPC proliferation between each experiment groups, which atorvastatin showed the highest effect. EPC proliferation in atorvastatin is higher than simvastatin group (0.248±0.01 vs 0.237±0.007, p<0.05), and simvastatin is also higher than rosuvastatin group (0.237±0.007 vs 0.231±0.008, p<0.05). CFU-Hill counts demonstrated highest number in rosuvastatin group, followed by atorvastatin, and simvastatin. Immunocytochemistry showed positive expression of CD34.
Conclusion: Statins increase EPC proliferation from peripheral blood of stable coronary artery disease patient. Atorvastatin showed the highest EPC proliferation, followed by simvastatin, and rosuvastatin. Each statins increased EPC proliferation dose-dependently.
DAFTAR ISI
SAMPUL DEPAN SAMPUL DALAM
LEMBAR PENGESAHAN ... ii
PERNYATAAN ... iii
DAFTAR LAMPIRAN ... xvii
DAFTAR SINGKATAN ... xix
BAB 1 PENDAHULUAN ... 1
BAB 2 TINJAUAN KEPUSTAKAAN ... 6
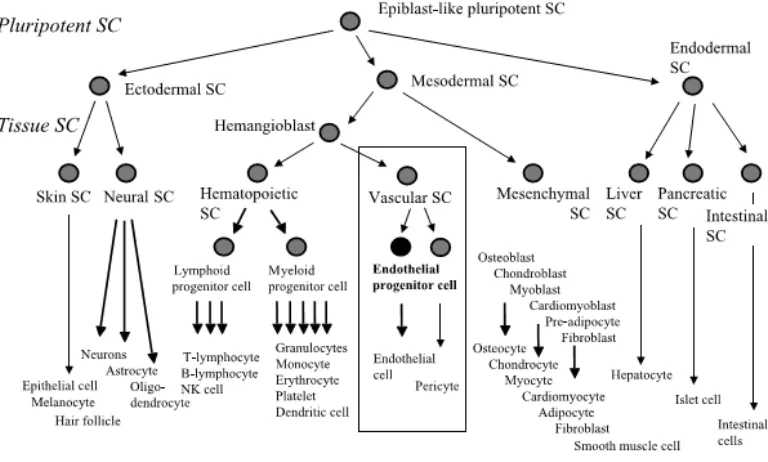
2.1. Endothelial Progenitor Cell (EPC) ... 6
2.1.1. Definisi dan Karakteristik EPC ... 6
2.1.2. Mobilisasi dan Homing EPC ... 8
2.1.3. Isolasi dan Kuantifikasi EPC ... 10
2.2. Transduksi Sinyal pada Proliferasi EPC ... 13
2.2.1. Reseptor Transmembran ... 13
2.2.2. Second Messenger .... 14
2.2.3. Jalur Transduksi Sinyal ... 15
2.4. EPC dan Kolesterol ... 20
2.5. EPC dan Penyakit Jantung Koroner ... 21
2.6. HMG-CoA reductase inhibitor (Statin) ... 23
BAB 3 KERANGKA KONSEP DAN HIPOTESIS ... 34
3.1. Kerangka Konsep ... 34
3.2. Hipotesis Penelitian ... 35
BAB 4 MATERI DAN METODE PENELITIAN ... 36
4.1. Rancangan Penelitian ... 36
4.9. Pengumpulan, Pengolahan, dan Analisis Data ... 48
4.9.1. Pengumpulan Data ... 48
4.9.2. Pengolahan dan Analisis Data ... 48
4.10. Kelaikan Etik ... 48
BAB 5 HASIL PENELITIAN ... 50
5.1. Gambaran Umum Penelitian ... 50
5.2. Karakteristik Subjek Penelitian ... 51
5.3.1. Perbandingan Proliferasi EPC antara Kelompok yang
Diberikan Simvastatin dan Kontrol ... 52
5.3.2. Perbandingan Proliferasi EPC antara Kelompok yang Diberikan Atorvastatin dan Kontrol ... 53
5.3.3. Perbandingan Proliferasi EPC antara Kelompok yang Diberikan Rosuvastatin dan Kontrol ... 53
5.4. Perbedaan Proliferasi EPC antara Kelompok Simvastatin, Atorvastatin, dan Rosuvastatin ... 55
5.5. Perbedaan Proliferasi EPC pada Dosis Rendah, Sedaang, Tinggi dari Simvastatin, Atorvastatin, dan Rosuvastatin ... 56
5.5.1. Perbedaan Proliferasi EPC pada Simvastatin Dosis Rendah, Sedang, dan Tinggi ... 56
5.5.2. Perbedaan Proliferasi EPC pada Atorvastatin Dosis Rendah, Sedang, dan Tinggi ... 57
5.5.3. Perbedaan Proliferasi EPC pada Rosuvastatin Dosis Rendah, Sedang, dan Tinggi ... 58
5.6. Pemeriksaan CFU pada Kelompok Simvastatin, Atorvastatin, Rosuvastatin, dan Kontrol ... 59
5.7. Pemeriksaan Imunofluoresensi ... 61
BAB 6 PEMBAHASAN ... 62
BAB 7 KESIMPULAN DAN SARAN ... 67
7.1. Kesimpulan ... 67
7.2. Saran ... 67
DAFTAR PUSTAKA ... 69
DAFTAR GAMBAR
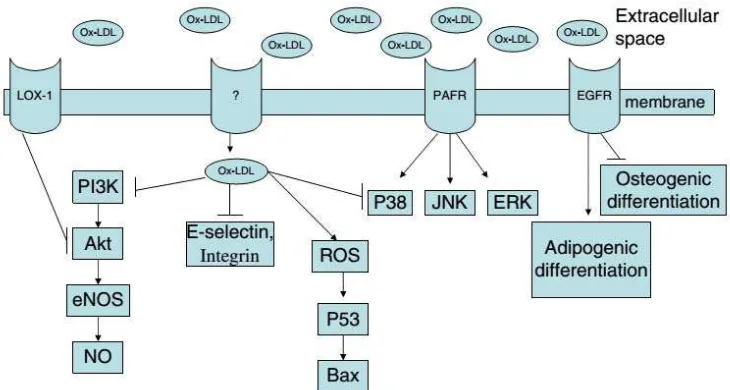
Gambar 2.7. Efek molekular dari oxLDL ... 20
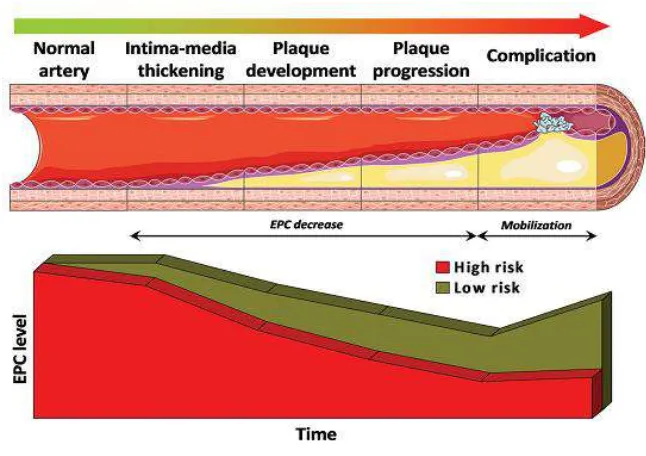
Gambar 2.8. Regulasi EPC pada perjalanan atherosklerosis ... 23
Gambar 2.9. Jalur mevalonate ... 25
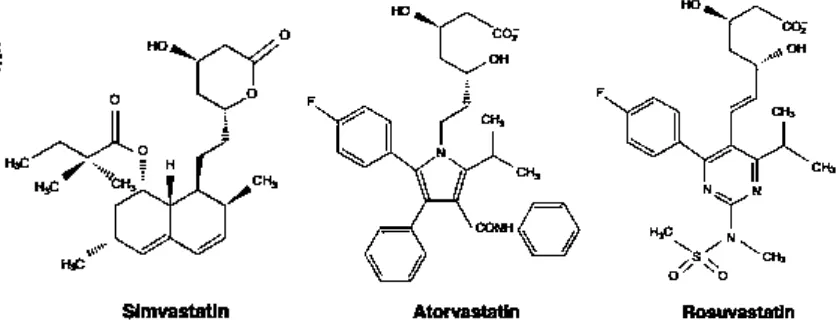
Gambar 2.10. Stuktur kimia statin ... 25
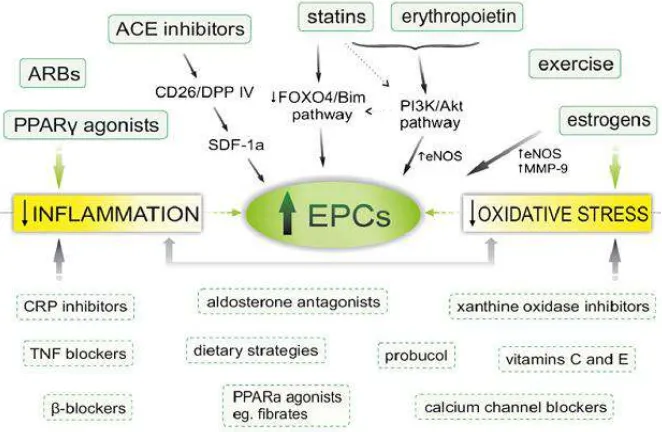
Gambar 2.11. Intervensi terapi untuk peningkatan EPC ... 29
Gambar 2.12. Skema representasi ERK 1/2, Akt, dan eNOS oleh atorvastatin ... 30
Gambar 2.13. Peran statin pada inflamasi dalam patogenesis penyakit jantung koroner ... 32
Gambar 2.14. Efek statin dan SDF-1 dalam meningkatkan angiogenesis ... 33
Gambar 3.1. Kerangka konseptual penelitian ... 34
Gambar 4.1. Desain penelitian “postest only control group design” ... 36
Gambar 4.2. Alur penelitian ... 47
Gambar 5.1. Perbandingan proliferasi EPC antara kelompok Simvastatin dan kontrol ... 52
Gambar 5.2. Perbandingan proliferasi EPC antara kelompok Atorvastatin dan kontrol ... 53
Gambar 5.3. Perbandingan proliferasi EPC antara kelompok Rosuvastatin dan kontrol ... 54
sedang, dan tinggi ... 56 Gambar 5.6. Perbedaan proliferasi EPC pada Atorvastatin dosis rendah,
sedang, dan tinggi ... 57 Gambar 5.7. Perbedaan proliferasi EPC pada Rosuvastatin dosis rendah,
sedang, dan tinggi ... 58 Gambar 5.8. Gambaran mikroskopis CFU kelompok kontrol ... 59 Gambar 5.9. Gambaran mikroskopis CFU kelompok simvastatin
a. dosis 0.1 µmol/L b. dosis 2.5 µmol/L ... 59 Gambar 5.10. Gambaran mikroskopis CFU kelompok atorvastatin
a. dosis 0.1 µmol/L b. dosis 2.5 µmol/L ... 60 Gambar 5.11. Gambaran mikroskopis CFU kelompok simvastatin
DAFTAR TABEL
Tabel 2.1. Faktor Risiko Kardiovaskular dan EPC ... 18 Tabel 5.1. Karakteristik dasar subjek penelitian ... 51 Tabel 5.2. Perbandingan proliferasi EPC antara kelompok Simvastatin
Atorvastatin, Rosuvastatin, dan kontrol ... 54 Tabel 5.3. Jumlah CFU pada kelompok kontrol, simvastatin, atorvastatin
DAFTAR LAMPIRAN
Lampiran 1 Lembar pengumpulan Data Subjek Penelitian ... 73 Lampiran 2 Penjelasan Untuk Mendapatkan Persetujuan Subjek
Penelitian Dewasa (Information for Consent) ... 76 Lampiran 3 Persetujuan Ikut Serta Dalam Penelitian
DAFTAR SINGKATAN
AGE Advanced Glycation Endproduct
eNOS endothelial Nitric Oxide Synthase
EPC Endothelial Progenitor Cell
CABG Coronary Artery Bypass Graft
CARE Cholesterol and Recurrent Events
CIMT Carotid Intima-Media Thickness
CFU Colony Forming Unit
CRP C-Reactive Protein
CXCR C-X-C Chemokine Receptor
DNA Deoxyribose Nucleic Acid
ECM Extracellular Matrix
EGF Epidermal growth factor
eNOS endothelial Nitric Oxide Synthase
ERK Extracellular Signal-Regulated Kinase
FBS Fetal Bovine Serum
FCS Fetal Calf Serum
Flk-1 Fetal liver kinase-1
FOXO Forkhead Box O
GGPP Geranylgeranylpyrophosphate
GTP Guanosine Triphosphate
HIV Human Immunodeficiency Virus
HMG-CoA 3-Hydroxy-Methylglutaryl Coenzyme A
HDL-C High-Density Lipoprotein Cholesterol
HSC HematopoeticStem Cell
hsCRP High-sensitivity C-Reactive Protein
ICAM-1 Intercelluar Adhesion Molecule-1
IDIK Instalasi Diagnostik Intervensi Kardiologi
IMA Infark Miokard Akut
ITD Institute of Tropical Disease
LDL Low Density Lipoprotein
LOX-1 Lectin-like Oxidized Low Density Lipoprotein Receptor 1
MAPK Mitogen-Activated Protein Kinase
MAPK K Mitogen-Activated Protein Kinase Kinase MMP Matrix Metalloproteinase
MNC Mononuclear Cell
MCP-1 Monocyte Chemoattractant Protein-1
NAD(P)H Nicotinamide Adenine Dinucleotide Phosphate
NF-ҡβ Nuclear Factor-ҡβ
NO Nitric Oxide
oxLDL oxidized Low Density Lipoprotein
PBS Phosphate Buffer Saline
PDK-1 Pyruvate dehidrogenase Kinase-1
PI3K Phosphatidil Inositol-3-Kinase
PIP2 Phosphatidilinositol biphosphate
PIP3 Phosphatidilinositol triphosphate
PJK Penyakit Jantung Koroner
PP Pyrophosphate
ROS Reactive Oxygen Species
RTK Tyrosine Kinase Receptor
SCAD Stable Coronary Artery Disease
SDF-1 Stromal cell-derived factor-1
TPHA Treponema Pallidum Haemagglutination
VDRL Venereal Disease Research Laboratory
VEGF Vascular Endothelial Growth Factor
VEGFR-2 Vascular Endothelial Growth Factor Receptor-2
VLDL Very-Low-Density Lipoprotein
BAB 1 PENDAHULUAN
1.1. Latar Belakang Masalah
Penyakit kardiovaskular saat ini tetap merupakan penyebab terbanyak kematian di seluruh dunia. Pada tahun 2008 lebih dari 17 juta penderita mengalami kematian akibat penyakit kardiovaskular, dimana serangan jantung merupakan penyebab kematian pada 7.3 juta penderita. Proses yang mendasari penyakit jantung koroner adalah atherosklerosis. Atherosklerosis merupakan proses patologis kompleks pada dinding pembuluh darah yang terjadi bertahun-tahun (Mendis et al., 2011). Definisi dari penyakit jantung koroner stabil atau
stable coronary artery disease (SCAD) adalah suatu penyakit dengan manifestasi nyeri dada yang disebabkan oleh suatu aktivitas atau stress akibat penyempitan ≥50% arteri koroner left main dan ≥70% pada satu atau lebih pembuluh darah koroner mayor lainnya. Prevalensi angina pada studi populasi menunjukkan peningkatan sesuai usia pada kedua jenis kelamin, mulai dari 5-7% pada wanita usia 45-64 tahun, hingga 10-12% pada wanita usia 65-84 tahun, dan 4-7% pada laki-laki usia 45-64 tahun hingga 12-14% pada laki-laki usia 65-84 tahun (Montalescot et al., 2013).
Patofisiologi yang mendasari penyakit jantung koroner (PJK) adalah adanya gangguan aliran darah koroner akibat atherosklerosis yang dipicu terutama oleh ketidakseimbangan homeostasis endotel (Padfield et al., 2010). Adanya penemuan bahwa sel-sel yang berasal dari sumsum tulang yang dikenal dengan
kardiovaskular ini (Fadini et al., 2007). Terapi saat ini untuk penyakit kardiovaskular meliputi manajemen gaya hidup, kontrol farmakologis terhadap faktor risiko, revaskularisasi baik melalui intervensi maupun operasi, dimana tidak dapat mengontrol penyakit jantung koroner secara komplit. Oleh karena itu, pendekatan baru seperti terapi berbasis sel diperlukan. Sejak EPC ditemukan berkontribusi pada vaskularisasi jaringan setelah kejadian iskemik di ekstremitas, retina, dan miokard, EPC mempunyai peluang yang menjanjikan sebagai terapi baru sebagai perbaikan vaskular dan kontrol penyakit kardiovaskular (Du et al., 2012). EPC memiliki peran utama dalam pembentukan pembuluh darah baru. EPC pertama kali berhasil diisolasi oleh Ashahara dkk pada tahun 1997 sebagai suatu sel progenitor hematopoietik dari sel darah tepi. Peran utama dari EPC adalah mendukung proses vaskulogenesis serta memperbaiki kerusakan dan disfungsi endotel (Ana et al., 2012).
Hubungan antara jumlah EPC dengan PJK telah dibuktikan dalam beberapa hasil penelitian. Jumlah dan aktivitas EPC menurun pada kondisi risiko tinggi PJK. Beberapa peneliti telah menunjukkan bahwa jumlah EPC pada penderita PJK lebih rendah bila dibandingkan orang sehat dan berkorelasi negatif dengan jumlah faktor risiko. Sebaliknya, penelitian akhir menunjukkan adanya peningkatan jumlah EPC pada penderita infark miokard akut (IMA), angina pektoris stabil kronik, maupun paska coronary artery bypass grafting (CABG). Pada penderita angina pektoris stabil didapatkan jumlah EPC yang lebih rendah dibandingkan angina pektoris tidak stabil (Siddique et al., 2010).
pemulihan fungsi vaskular normal, menurunkan inflamasi vaskular, mencegah remodelling, angiogenesis, dan neovaskularisasi. Sebaliknya, respon EPC yang tidak adekuat menyebabkan keterlambatan reendotelialisasi dan inflamasi persisten sehingga menimbulkan restenosis dan gejala iskemia miokard (Padfield
et al., 2010; Pellicia et al., 2010).
1.2. Rumusan Masalah
1. Apakah terdapat peningkatan proliferasi EPC pada darah tepi penderita penyakit jantung koroner stabil antara kelompok yang diberikan simvastatin, atorvastatin, dan rosuvastatin dengan kelompok kontrol?
2. Apakah terdapat perbedaan proliferasi EPC pada darah tepi penderita penyakit jantung koroner stabil antara kelompok yang diberikan simvastatin, atorvastatin, dan rosuvastatin?
3. Apakah terdapat perbedaan proliferasi EPC pada dosis rendah, sedang, dan tinggi dari pemberian simvastatin, atorvastatin, dan rosuvastatin yang diberikan pada darah tepi penderita penyakit jantung koroner stabil?
1.3. Tujuan Penelitian 1.3.1. Tujuan Umum
Penelitian ini bertujuan untuk menganalisis efek pemberian statin terhadap proliferasi EPC pada darah tepi penderita penyakit jantung koroner stabil.
1.3.2. Tujuan Khusus
Tujuan khusus penelitian ini adalah :
2. Menganalisis perbedaan proliferasi EPC pada darah tepi penderita penyakit jantung koroner stabil antara kelompok yang diberikan simvastatin, atorvastatin, dan rosuvastatin.
3. Menganalisis perbedaan proliferasi EPC pada dosis rendah, sedang, dan tinggi dari pemberian simvastatin, atorvastatin, dan rosuvastatin yang diberikan pada darah tepi penderita penyakit jantung koroner stabil.
1.4. Manfaat Penelitian 1.4.1. Manfaat Akademik
1. Menambah dasar pemahaman dan ilmu pengetahuan mengenai efek statin terhadap proliferasi EPC.
2. Memberikan sarana informasi dalam hal regenerative medicine
sehingga dapat dijadikan acuan untuk penelitian selanjutnya yang berhubungan dengan EPC.
1.4.2. Manfaat Klinis
1. Menambah dasar pemahaman dan ilmu pengetahuan mengenai upaya peningkatan EPC pada penderita penyakit arteri koroner stabil.
2. Sebagai bahan pertimbangan untuk jenis dan dosis statin yang dapat diberikan untuk penderita penyakit arteri koroner stabil.
BAB 2
TINJAUAN KEPUSTAKAAN
2.1. Endothelial Progenitor Cell (EPC)
2.1.1. Definisi dan Karakteristik EPC
Endotel vaskular berperan penting dalam meregulasi tonus vaskular, struktur, pertumbuhan, fibrinolisis, dan homeostasis. Oleh karena itu, endotel memproteksi pembuluh darah dari inflamasi, respon imun, thrombosis, dan penyakit kardiovaskular. Disfungsi endotel merupakan kejadian awal yang kemudian dapat mengakibatkan kelainan di dinding vaskular. Proses ini menyebabkan lepasnya sel endotel dan pengambilan sel progenitor yang terlibat dalam perbaikan vaskular. Banyak studi yang menunjukkan, dimana pertama ditunjukkan oleh Asahara dan kawan-kawan, EPC berperan penting dalam perbaikan endotel yang rusak dengan melawan kerusakan yang disebabkan faktor risiko kardiovaskular. Oleh karena itu, EPC memiliki kontribusi penting dalam neovaskularisasi fisiologis dan patologis (Du et al., 2012).
EPC merupakan bagian dari sel berinti tunggal atau mononuclear cell
(MNC) yang memiliki ciri khas ekspresi dari 3 marker yaitu CD133, CD34, dan
vascular endothelial growth factor receptor-2 (VEGFR-2) yang disebut juga
kerusakan. Pada sirkulasi perifer orang dewasa, EPC yang lebih matur ditemukan telah kehilangan CD133 namun positif untuk CD34 dan VEGFR-2. Sel endotel yang matur menunjukkan ekspresi tinggi dari VEGFR-2, VE-cadherin, dan faktor von Willebrand. Oleh karena itu, hilangnya CD133 kemungkinan merefleksikan transformasi EPC dalam sirkulasi menjadi sel endotel yang matur. Namun, hingga saat ini belum jelas kapan EPC mulai kehilangan CD133 (Hristov et al., 2003; Fadini et al., 2007)
Seperti halnya stem cell, EPC juga memiliki kemampuan proliferasi dan diferensiasi namun lebih terbatas. Sel ini bersifat unipoten, hanya dapat berdiferensiasi menjadi sel endotel matang (Leone et al., 2009).
dengan HSC. EPC, atau angioblast, terletak di bagian perifer (Murasawa dan Asahara, 2005).
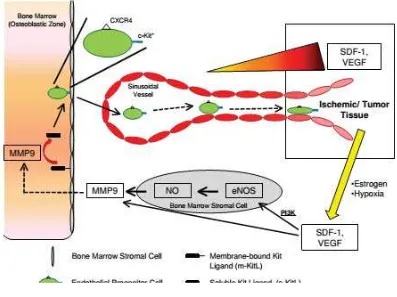
2.1.2. Mobilisasi dan Homing EPC
EPC dapat mengalami mobilisasi akibat berbagai stimulus, menuju sirkulasi dan berkontribusi pada proses neoangiogenesis atau proses perbaikan lapisan sel endotel yang mengalami kerusakan.
Gambar 2.2. Mobilisasi EPC dari sumsum tulang (Sumber: George et al., 2011)
hematopoetik menuju zona vaskular dari lingkungan sumsum tulang (Hristov et al., 2003).
Setelah mobilisasi, EPC menemukan jalan menuju endotel yang mengalami kerusakan dan memerlukan perbaikan. Homing adalah proses awal yang cepat (diukur dalam hitungan jam dan tidak sampai 1-2 hari). Molekul adhesi (selectin dan integrin) melakukan mediasi homing sel menuju dinding pembuluh darah (Tousoulis et al., 2008).
Langkah awal homing sel progenitor menuju jaringan iskemik yaitu adhesi sel progenitor dengan sel endotel yang diaktivasi oleh sitokin dan iskemia, lalu transmigrasi sel progenitor menuju lapisan sel endotel.
Gambar 2.3. Mekanisme homing dan diferensiasi EPC (Sumber: Urbich dan Dimmeler, 2004)
Integrin bertugas membantu adhesi dari berbagai sel menuju sel endotel.
β1-Integrin diekspresikan pada bermacam-macam tipe sel termasuk sel endotel
hematopoetik. Banyak studi menunjukkan kemokin seperti SDF-1 menstimulasi pengambilan sel progenitor menuju jaringan iskemik. Selain itu, invasi sel imunokompeten ke jaringan iskemik meningkatkan kemokin di dalam jaringan tersebut, misalnya monocyte chemoattractant protein-1 (MCP-1) dan interleukin, yang kemudian dapat menarik sel progenitor di dalam sirkulasi. Pada akhirnya, EPC mengalami maturasi manjadi sel endotel yang fungsional (Urbich dan Dimmeler, 2004).
2.1.3. Isolasi dan Kuantifikasi EPC
Ada 2 tipe EPC yaitu early EPC dan late EPC. Early EPC biasanya merupakan populasi EPC angiogenik yang didapatkan dari kultur jangka pendek
in vitro selama 4-7 hari. Early EPC ini membentuk colony forming units (CFU) dan memiliki banyak karakteristik endotel seperti marker CD31 dan VEGFR2.
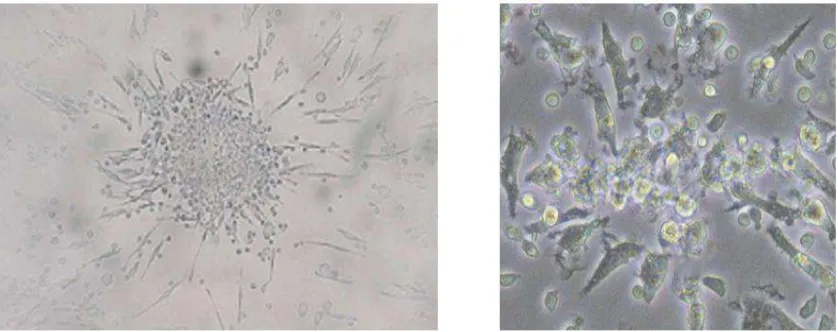
Late EPC, biasa juga disebut out-growth EPC, memiliki pola pertumbuhan yang berbeda dan didapatkan dari kultur jangka panjang yaitu selama 2-3 minggu in vitro (Lee dan Poh, 2014). Kemampuan EPC untuk bermigrasi menuju satu sama lain untuk membentuk suatu koloni menunjukkan fungsi EPC. Penghitungan koloni merepresentasikan karakteristik kumulatif kuantitas EPC dan karakteristik fungsional, termasuk diferensiasi, proliferasi, senecence, dan aktivitas migrasi (Shantsila et al., 2007).
spindle-shape sedangkan late EPC berbentuk cobblestone-like shape (Lee dan Poh, 2014).
Gambar 2.4. Morfologi early EPC dan late EPC (Sumber: Lee dan Poh, 2014)
EPC dapat diisolasi dan dikultur dari sumsum tulang, hati janin, tali pusat serta sirkulasi darah perifer. Setelah diisolasi, sel dikultur dalam medium dengan penambahan growth factor yang spesifik (VEGF, bovine brain extract, atau
epidermal growth factor/EGF) untuk memfasilitasi pertumbuhan sel endotel. Isolasi dan kuantifikasi EPC dapat dilakukan melalui 2 pendekatan: seleksi kultur karena sifat adhesi dan pertumbuhan in vitro dan seleksi berdasarkan fenotip sel menggunakan agen berlabel fluoresensi dan dibaca dengan flow cytometer
al., yang mengisolasi sel-sel mononuklear dan melakukan kultur sel pada piringan yang dilapisi fibronektin. Setelah adhesi selama 24 jam, sel-sel yang tidak melekat dikeluarkan dan dikultur kembali ke piringan yang berlapiskan fibronektin, kemudian jumlah kelompok yang muncul pada hari ke-7 dihitung sebagai koloni EPC. Pelapisan kembali sel-sel mononuklear selama 24 jam bertujuan untuk menghilangkan kontaminasi yang dapat mengganggu sistem penilaian EPC. Modifikasi lainnya oleh Hill et al., pelapisan ulang sel-sel mononuklear pada piringan yang dilapisi fibronektin dilakukan selama 48 jam dan perhitungan CFU dilakukan beberapa hari kemudian. Modifikasi ini kini lebih banyak didapatkan dan telah digunakan untuk menunjukkan hubungan terbalik antara konsentrasi CFU-Hill dengan skor risiko Framingham untuk kardiovaskular (Hirschi et al., 2008).
dilakukan pada medium kaya fetal calf serum (FCS) akan secara langsung berdiferensiasi menjadi tipe sel lainnya, seperti: osteoblas, kondroblas, serta adiposit. Proliferasi tampak nyata setelah kultur berjalan 30-60 hari. Hal ini berlawanan dengan pertumbuhan awal derivat sel endotel dari dinding pembuluh darah yang mempunyai kemampuan proliferasi terbatas (Hristov et al., 2003).
2.2. Transduksi Sinyal pada Proliferasi EPC
Sebagian besar sel mamalia memerlukan stimulus untuk mengontrol pembelahan sel dan juga untuk mempertahankan hidup. Diperlukan transduksi sinyal sebagai pengendali utama proses biologi sel (Xu et al., 2008). Transduksi sinyal adalah suatu proses yang diawali oleh aktivasi reseptor yang berada di membran oleh sinyal molekul dari luar sel yang kemudian mengakibatkan molekul dari dalam sel mengeluarkan respon tertentu. Dengan transduksi sinyal, sinyal molekul kecil dari luar sel dapat menghasilkan respon yang besar dan diharapkan dapat menghasilkan perubahan pada sel baik melalui ekspresi
Deoxyribose Nucleic Acid (DNA) atau aktivitas enzim di dalam sitoplasma. Pada organisme multiseluler, koordinasi sel dilakukan oleh beberapa molekul kecil dan polipeptida melalui aktivitas biologi diantaranya hormon, growth factors, komponen ECM, sitokin, kemokin, neurotransmiter, ROS, dan lain-lain (Roberts dan Der, 2007).
2.2.1. Reseptor Transmembran
permukaan sel akan menstimulasi serial kejadian di dalam sel dan respon yang dihasilkan sangat tergantung pada tipe reseptor. Ligan mengawali transmisi sinyal melewati membran plasma dengan cara mengubah bentuk atau menyesuaikan diri sesuai dengan model molekul tertentu. Perubahan tersebut akan menghasilkan aktivitas enzimatik atau membuka ikatan untuk protein sinyal lain di dalam sel (Xu et al, 2008).
Terdapat beberapa kelas reseptor transmembran yang dapat mengenal molekul sinyal ekstraselular yang berbeda, antara lain tyrosine kinase receptors
(RTK), integrins, G-protein coupled receptors, dan toll-like receptors (Xu et al, 2008). RTK merupakan salah satu reseptor yang ikut berperan dalam transduksi sinyal pada proliferasi EPC. RTK adalah protein transmembran dengan domain intraselular dan domain ekstraselular yang mengikat ligan. Interaksi ligan dan reseptor ini akan menstimulasi fosforilasi tyrosine dan akhirnya menyebabkan perubahan konformasi yang diperlukan untuk proses selular (Dhillon et al., 2007). 2.2.2. Second Messenger
Second messenger merupakan molekul yang sebagian besar sebagai pembawa dalam transduksi sinyal intraseluler. Beberapa molekul yang merupakan
second messenger antara lain kalsium, beberapa derivat lipid, dan nitric oxide
yang disebabkan terganggunya sintesis, rilis, dan aktivitas NO (Dhillon et al., 2007; Xu et al., 2008; Yu dan Feng, 2008).
2.2.3. Jalur Transduksi Sinyal
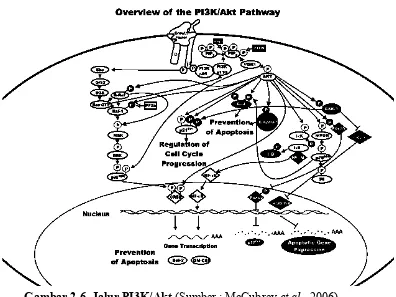
Jalur transduksi sinyal yang berperan dalam proliferasi EPC masih memerlukan penelitian lebih lanjut. Dari penelitian oleh Dimmeler et al. dan Llevadot et al., diketahui bahwa salah satu mekanisme yang memediasi peningkatan diferensiasi EPC in vitro maupun mobilisasi EPC in vivo oleh statin yaitu jalur phosphatidyl inositol-3-kinase/Akt. Dari penelitian lain juga didapatkan bahwa inhibisi ERK1/2 menurunkan fosforilasi Akt dan eNOS. Hal ini menunjukkan bahwa ERK 1/2 mempengaruhi fosforilasi Akt (Merla et al., 2007).
Jalur Ras/Raf/MEK/ERK dan PI3K/Akt berperan penting dalam transmisi sinyal untuk regulasi survival sel, proliferasi, metabolisme, dan migrasi. Stimulasi dari tyrosine kinase receptor (RTK) mengaktifkan MAPK dengan proses yang membutuhkan beberapa langkah.
Salah satunya antara lain dari reseptor epidermal growth factor
Gambar 2.5. Kaskade MAP kinase (Sumber: Zhang dan Hui, 2002) Jalur PI3K/Akt diaktivasi oleh subunit p85 yang terikat dengan tyrosine yang teraktivasi atau reseptor growth factor yang teraktivasi.
Hal ini mengakibatkan PI3K menempel pada membran sel dan menjadi aktif. Phosphatidylinositol biphosphate (PIP2) terfosforilasi oleh PI3K membentuk phosphatidilinositol triphosphate (PIP3) yang kemudian mengaktifkankan pyruvate dehydrogenase kinase 1 (PDK1). PDK1 yang terfosforilasi kemudian mengaktivasi Akt (McCubrey et al., 2006).
2.3. EPC dan Faktor Risiko Kardiovaskular
Peran penting endotel dalam proses kardiovaskular semakin lama semakin diketahui lebih luas (Shantila et al., 2007). Endotel memiliki kemampuan memperbaiki diri sendiri. Endotel yang masih muda dan sehat dapat memperbaiki diri secara komplit. Sedangkan pada endotel yang sudah tua atau telah terpapar oleh salah satu faktor risiko kardiovaskular seperti kolesterol, hipertensi, atau hiperglikemia, kemampuan memperbaiki diri menjadi terganggu dan plak dapat berkembang sebagai akibat dari proses inflamasi terutama akibat akumulasi makrofag. Injuri endotel berkontribusi pada inisiasi proses atherosklerosis. Disfungsi endotel berhubungan dengan vasokonstriksi yang disebabkan terganggunya sintesis, rilis, dan aktivitas nitric oxide (NO). Telah diketahui bahwa kemampuan endotel untuk memperbaiki diri tidak hanya diregulasi oleh sel lokal, namun juga dipengaruhi oleh sel di dalam sirkulasi yaitu EPC. EPC berasal dari sumsum tulang dapat dimobilisasi menuju sirkulasi perifer. Di dalam sirkulasi, EPC membentuk kumpulan sel yang dapat memperbaiki lapisan endotel yang rusak secara aktif (Fadini et al., 2007).
yang sehat maupun pada penderita penyakit jantung koroner (Shantsila et al., 2007).
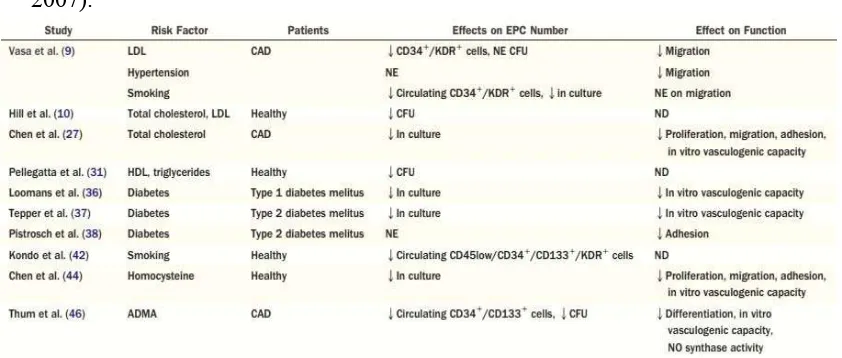
Tabel 2.1 Faktor Risiko Kardiovaskular dan EPC (Shantsila et al., 2007)
Studi pada hewan dan manusia menunjukkan bahwa pada diabetes mellitus tipe 1 dan 2, EPC mengalami reduksi dan disfungsi yang signifikan. Hiperglikemia yang kemudian mengakibatkan peningkatan stress oksidatif mungkin merupakan penyebab terjadinya perubahan ini. Akumulasi advanced glycation endproducts (AGEs) mengganggu fungsi EPC dan mengubah lingkungan di sumsum tulang dan target jaringan. Penderita diabetes memiliki risiko terjadinya atherosklerosis yang cepat dan iskemia miokard atau perifer. Hal ini dihubungkan dengan regenerasi endotel dan kompensasi angiogenesis yang menurun, dimana hal ini berhubungan dengan penurunan jumlah dan disfungsi EPC. Merokok merupakan pencetus disfungsi vaskular dan atherosklerosis. Merokok mengakibatkan gangguan EPC yang global (proliferasi, diferensiasi, adhesi, migrasi, dan tubulisasi) (Fadini et al., 2007).
2.4. EPC dan Kolesterol
Mekanisme dimana hiperkolesterolemia menurunkan jumlah dan aktivitas EPC masih belum pasti. Jumlah EPC berbanding terbalik dengan level kolesterol total dan low-density lipoprotein (LDL). Peningkatan stress oksidatif yang berhubungan dengan dislipidemia berhubungan dengan disregulasi mobilisasi, maturasi, dan survival EPC (Siddique et al., 2010).
LDL di dalam darah dapat memasuki lapisan intima, dimana LDL kemudian terikat pada matriks ekstraseluler. Selanjutnya, LDL teroksidasi oleh
reactive oxygen species (ROS) serta sel lain seperti monosit, yang berkontribusi pada proses atherosklerosis. LDL yang teroksidasi ini (oxLDL) dapat terikat pada reseptor membran sel, dimana salah satunya yang teridentifikasi adalah Lectin-like oxidized low density lipoprotein receptor 1 (LOX-1). LOX-1 berhubungan dengan terjadinya senescence EPC dan apoptosis, penurunan kapasitas survival, adhesi, migrasi, dan tube formation.
Dari analisis, didapatkan bahwa oxLDL menekan jalur PI3K/Akt/eNOS/NO yang menyebabkan penurunan diferensiasi, mobilisasi, proliferasi, migrasi, dan EPC.
Phosphoinositide 3-kinase (PI3K) adalah enzim yang berguna untuk pertumbuhan sel, proliferasi, diferensiasi, dan sebagainya. Akt merupakan regulator dari berbagai macam biologi sel. Akt yang terfosforilasi kemudian akan memfosforilasi substrat berikutnya yaitu eNOS, selanjutnya mengakibatkan aktivasi eNOS dan rilis NO. Stimulasi produksi NO ini kemudian dapat meningkatkan jumlah dan fungsi EPC sehingga mengurangi kerusakan endotel (Yang et al., 2012).
2.5. EPC dan Penyakit Jantung Koroner
Hubungan antara jumlah EPC dengan penyakit jantung koroner (PJK) telah dibuktikan dalam beberapa hasil penelitian. Jumlah dan aktivitas EPC menurun pada kondisi risiko tinggi PJK. Rendahnya jumlah EPC merupakan prediktor untuk peningkatan derajat keparahan dan mortalitas penyakit kardiovaskular. Tiga mekanisme yang mungkin mendasari hasil temuan tersebut antara lain terjadi penurunan mobilisasi EPC dari sumsum tulang, peningkatan konsumsi EPC pada lokasi pembuluh darah yang cedera, dan penurunan waktu paruh EPC yang berada pada sirkulasi. Hal sebaliknya terjadi pada kondisi iskemia tungkai akut, IMA, luka bakar, dan CABG, yaitu jumlah EPC meningkat sangat cepat dalam sirkulasi sebagai respon akut terhadap cedera vaskular (Shantsila et al., 2007).
atherosklerosis. CIMT merupakan suatu biomarker kuat risiko kardiovaskular dan sangat berhubungan dengan remodelling vaskular, serta pengukurannya menjadi salah satu cara terbaik untuk mendeteksi atherosklerosis tahap awal pada individu yang asimptomatik. Oleh karena itu, selain efek dari faktor risiko kardiovaskular, EPC juga semakin berkurang sejalan dengan bertambahnya atherosklerosis (Fadini et al., 2007).
Ketika plak atherosklerotik semakin progresif hingga menurunkan aliran darah ke jaringan target, iskemia kronik timbul, dalam hal ini yaitu angina pektoris stabil dan klaudikasio tungkai. Selanjutnya, arteri kolateral menjadi satu-satunya jalan untuk mengatasi obstruksi vaskular dan di sini juga kontribusi EPC sangat diperlukan. Telah diketahui bahwa level EPC berhubungan dengan indeks aliran kolateral koroner, suatu pengukuran bantuan kolateral pada sirkulasi koroner (Fadini et al., 2007).
karena itu, regulasi EPC tidak hanya merefleksikan respon endogen, namun juga menunjukkan tingkat kesehatan vaskular (Fadini et al., 2007).
Gambar 2.8. Regulasi EPC pada perjalanan atherosklerosis (Sumber: Fadini et al., 2012).
2.6. HMG-CoA reductase inhibitor (Statin)
Statin telah menjadi agen penurun lipid yang utama dan sebagai prevensi primer dan sekunder dari penyakit arteri koroner. Studi randomisasi dan metanalisis menunjukkan penurunan yang dignifikan pada kejadian koroner mayor, morbiditas kardiovaskular, dan kematian oleh sebab apapun (Patel et al., 2007). Selain itu, telah diketahui bahwa kelebihan dari statin tidak hanya efek menurunkan kolesterol, namun juga efek independen kolesterol atau efek pleiotropik. Statin secara langsung berperan dalam perbaikan fungsi endotel, menghambat remodeling vaskular, respon inflamasi vaskular, dan stabilisasi plak atherosklerotik, meningkatkan bioavailabilitas nitric oxide, antioksidan (Davignon, 2004; Zhou dan James, 2009)
reductase mengkatalisasi konversi HMG-CoA menjadi mevalonate. Inhibisi kompetitif pada enzim ini oleh statin, menurunkan sintesis kolesterol di hepatosit. Penurunan konsentrasi kolesterol intraseluler menginduksi ekspresi reseptor LDL pada permukaan hepatosit, yang mengakibatkan peningkatan ekstraksi LDL dari sirkulasi darah sehingga menurunkan konsentrasi LDL dalam sirkulasi. Statin juga memiliki efek yang menguntungkan terhadap parameter lipid lainnya yaitu meningkatkan high-density lipoprotein cholesterol (HDL-C) dan menurunkan konsentrasi trigliserida (Schachter, 2004). Statin memiliki efek inhibisi terhadap
oxidized LDL (oxLDL) pada eNOS. Selain itu statin juga memiliki efek antioksidan langsung terhadap LDL in vitro dan in vivo. Metabolit atorvastatin menghambat oksidasi LDL dan very-low-density lipoprotein (VLDL). Statin juga menurunkan aktivitas makrofag CD36 yang merupakan reseptor untuk oxLDL, namun mekanismenya masih belum diketahui (Davignon, 2004). Statin memiliki beberapa kemungkinan mekanisme dalam stabilisasi plak. Reduksi kolesterol-LDL dapat berkontribusi dalam menurunkan ukuran inti lipid. Statin juga menghambat pengambilan LDL yang teroksidasi dan menghambat akumulasi makrofag pada lesi atherosklerotik dan menghambat produksi matrix metalloproteinase oleh makrofag. (Davignon, 2004; Liao, 2005).
Dengan menghambat sintesis mevalonate, statin juga mencegah sintesis intermediet lain yaitu farnesyl pyrophosphate dan geranylgeranylpyrophosphate
Gambar 2.9. Jalur Mevalonate (Sumber : Schachter, 2004) PP: pyrophosphate
Walaupun semua statin memiliki kesamaan mekanisme aksi, masing-masing statin memiliki struktur kimia, profil farmakokinetik, dan efektivitas modifikasi lipid yang berbeda. Struktur kimia statin mempengaruhi sifat solubilitas terhadap air, yang selanjutnya mempengaruhi sifat absorpsi, distribusi, metabolisme, dan ekskresi (Schachter, 2004).
Simvastatin berasal dari metabolit jamur dan memiliki eliminasi waktu paruh sekitar 1-3 jam. Simvastatin masuk sebagai lactone prodrug, dan dihidrolisis secara enzimatik menjadi zat aktif yaitu dalam bentuk hydroxy acid, sedangkan statin jenis lain masuk sebagai zat aktif hydroxy acid. Atorvastatin dan rosuvastatin seluruhnya merupakan komponen sintetik, dengan eliminasi waktu paruh masing-masing 14 jam dan 19 jam. Metabolit aktif dari komponen utama atorvastatin memperlama efek inhibisi HMG Co-A reduktase, sehingga waktu paruh inhibisi enzim ini menjadi 20-30 jam (Schachter, 2004).
Atorvastatin dan simvastatin memiliki komponen yang relatif lipofilik, sedangkan rosuvastatin lebih hidrofilik karena adanya gugus methane sulphonamide. Struktur ini mengakibatkan statin jenis ini merupakan statin yang paling efisien dalam hal menurunkan aktivitas HMG-CoA reduktase sebanyak 50%. Statin yang bersifat lipofilik, lebih cepat mengalami first-pass effect karena difusi yang pasif melalui membran sel hepatosit, sehingga menurunkan bioavailabilitas, sedangkan statin hidrofilik mekanismenya dengan bantuan
carrier. Pada liver, organic anion transporting polypeptides (OATP) dapat mentransport substrat obat dari aliran darah portal ke hepatosit (Gazzerro P, et al., 2012). Statin sebagian besar dimetabolisir oleh famili sitokrom P450 (CYP450). Isoenzim CYP3A4 memetabolisir simvastatin dan atorvastatin, sedangkan rosuvastatin tidak melalui metabolisme oleh CYP450, melainkan melalui CYP2C9 dan CYP2C19. Statin yang dimetabolisme oleh CYP450 lebih mudah mengakibatkan toksisitas otot karena risiko interaksi obat dengan obat yang menghambat CYP450 (Schachter, 2004; Gazzerro P, et al., 2012).
disfungsi endotel adalah terganggunya sintesis, rilis, dan aktivitas NO dari endotel. NO dari endotel ini menghambat beberapa komponen proses atherogenik, antara lain relaksasi vaskular, menghambat agregasi platelet, proliferasi otot polos vaskular, dan interaksi antara endotel dan leukosit (Liao, 2005). Terapi statin jangka pendek telah menunjukkan perbaikan disfungsi endotel dan peningkatan perfusi miokard. Salah satu penelitian menunjukkan pada penderita dislipidemia dengan abnormalitas perfusi, terapi dengan fluvastatin (40 – 80 mg/hari) dalam 6 sampai 12 minggu meningkatkan perfusi miokard secara signifikan pada segmen yang mengalami iskemia (30%; P<0.001), dan perubahan dari awal lebih besar secara signifikan dibandingkan dengan segmen yang normal (5%; P<0.005) (Hw
et al., 1995).
Perbaikan disfungsi endotel oleh statin sebagian akibat penurunan kolesterol LDL, dimana LDL meningkatkan level caveolin-1, salah satu inhibitor aktivitas eNOS, sehingga statin mencegah penurunan eNOS, enzim yang mengatalisasi pembentukan NO, sehingga meningkatkan bioavailabilitas NO. Ada beberapa mekanisme yang mungkin terjadi yaitu penurunan caveolin-1 dan peningkatan Hsp90 yang memfasilitasi aktivasi eNOS jangka panjang. Selain itu, statin juga meningkatkan produksi NO endotel dengan menstimulasi dan meningkatkan eNOS. Statin juga meningkatkan ekspresi tissue-type plasminogen activator dan menghambat ekspresi endothelin-1 yang merupakan vasokonstriktor poten (Liao, 2005).
sensitivitas otot polos vaskular terhadap kalsium pada hipertensi dan spasme koroner. Inaktivasi jalur ROCK menstabilisasi mRNA dari eNOS dan mengaktivasi kaskade PI3K/Akt yang kemudian meningkatkan aktivitas eNOS, produksi dan bioavailabilitas NO. Statin menghambat protein Rac yang terlibat dalam hipertrofi jantung, remodeling sitoskeleton aktin, dan pembentukan
reactive oxygen species (ROS). Statin juga berperan dalam prenilasi Rho GTPase melalui geranylgeranyl pyrophosphate (GGPP), yang menghambat regulasi aktivitas eNOS. (Liao, 2005).
Statin juga mengaktivasi serine-threonine kinase Akt pada sel endotel, yang kemudian meningkatkan fosforilasi substrat Akt endogen lalu meningkatkan NO (Davignon, 2004; Zhou dan James, 2009). Karena proses ini dihambat oleh
phosphatidylinositol-3 kinase (PI3K) inhibitor, wortmannin dan LY294002, dapat disimpulkan bahwa statin mengaktivasi Akt dengan meningkatkan regulasi PI3K (Kureishi et al., 2000). Melalui jalur PI3K/Akt, statin juga meningkatkan mobilisasi EPC dari sumsum tulang menuju pembuluh darah yang baru terbentuk (Dimmeler et al., 2001). Penelitian oleh Llevadot et al. menunjukkan hasil assay kemotaksis dari sel mononuklear sumsum tulang in vitro dan dari kultur EPC dari darah tepi hewan yang diberikan simvastatin bahwa simvastatin meningkatkan proliferasi EPC, migrasi, dan survival sel in vitro melalui jalur Akt.
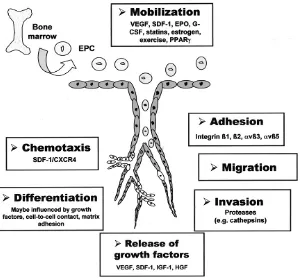
anggota faktor transkripsi forkhead seperti FOXO1, FOXO3a, dan FOXO4. FOXO mengatur transkripsi inhibitor cell cycle p27 dan Bcl-2-like-protein Bim. Bim diketahui membatasi signaling survival sel progenitor hematopoetik yang diinisiasi oleh sitokin. Fosforilasi Akt mengakibatkan inhibisi aktivitas faktor transkripsi forkhead, sehingga menghambat apoptosis (Urbich et al., 2005).
Gambar 2.11. Intervensi terapi untuk peningkatan EPC (Sumber :Tousoulis et al., 2008)
Studi yang dilakukan oleh Merla dan kawan-kawan menunjukkan bahwa atorvastatin meningkatkan fosforilasi ERK1/2. ERK1/2 memfasilitasi fosforilasi Akt yang kemudian mengaktifkan fosforilasi eNOS. Hal ini mempelihatkan adanya peran ERK1/2 dalam proses aktivasi Akt yang selanjutnya memosforilasi eNOS (Merla et al., 2007).
Gambar 2.12. Skema representasi aktivasi ERK 1/2, Akt, dan eNOS oleh Atorvastatin (Sumber: Merla, 2007)
Walaupun dosis statin yang lebih tinggi meningkatkan ekspresi protein eNOS, penelitian akhir-akhir ini menunjukkan statin dengan dosis yang lebih tinggi menimbulkan efek toksik pada sel endotel, yang dapat disebabkan oleh inhibisi berlebihan pada prenilasi protein (Laufs et al., 1998).
(SAA) berhubungan dengan peningkatan risiko kejadian kardiovaskular pertama ataupun rekuren (Davignon, 2004; Kavalipati et al., 2015)). Beberapa studi menunjukkan bahwa infus CRP pada hewan dan manusia mengakibatkan peningkatan inflamasi dan atherosklerosis, serta aktivasi koagulasi. Hal ini membuktikan adanya peran CRP dalam patogenesis penyakit arteri koroner (Patel
et al., 2007).
Terapi statin dapat menghambat efek inflamasi pada risiko kardiovaskular (Davignon, 2004). Statin menurunkan sel inflamasi pada plak atherosklerosis dan menstabilkan plak melalui kombinasi penurunan lipid, makrofag, dan matrix metalloproteinase (MMP). Molekul seluler lain yang dihambat oleh statin antara lain nuclear factor-ҡβ (NF-ҡβ), monocyte chemoattractant protein-1, dan hsCRP. Penurunan ekspresi monocyte chemoattractant protein-1 mengurangi interaksi antara monosit dan dinding pembuluh darah, kemotaksis monosit, dan pertumbuhan serta proliferasi makrofag. Statin juga menurunkan produksi
bermacam-macam marker inflamasi antara lain tumor necrosis factor- ,
interleukin-1β, dan sitokin kemotaktik (Kavalipati et al., 2015). Pada penelitian
Platelet berperan penting dalam proses sindroma koroner akut. Platelet dalam sirkulasi berhubungan dengan terbentuknya trombus pada tempat ruptur plak dan injuri vaskular. Statin mempengaruhi fungsi platelet, walaupun mekanismenya masih belum sepenuhnya diketahui. Salah satu mekanisme yaitu statin meningkatkan eNOS yang berhubungan dengan penurunan reaktivitas platelet. Mekanisme lain yakni penurunan produksi thromboxane A2 dan modifikasi bagian kolesterol dari membran platelet yang kemudian dapat mengurangi potensi trombogenik dari platelet (Liao, 2005).
Gambar 2.13. Peran Statin pada inflamasi dalam patogenesis penyakit jantung koroner (Sumber : Patel et al., 2007)
meningkatkan fosforilasi Akt dengan mekanisme yang belum jelas. SDF-1 terikat dengan G-protein coupled membrane receptor CXCR4 memfosforilasi PI3 kinase dan Akt. Aktivasi Akt kemudian meningkatkan aktivitas MMP dan eNOS. NOS mengkatalisasi sintesis NO yang penting untuk migrasi EPC. MMP mendegradasi matriks ekstraseluler untuk menginisiasi migrasi sel. Aktivasi Akt juga mencegah apoptosis sel. Reaksi ini kemudian meningkatkan migrasi sel dan proliferasi, serta survival EPC. EPC dari sumsum tulang kemudian mobilisasi ke dalam sirkulasi dan selanjutnya homing menuju area iskemia. EPC berkontribusi pada neovaskularisasi secara langsung yaitu dengan bergabung dengan endotel dan berdiferensiasi menjadi sel endotel atau secara tidak langsung dengan mensekresi protein signaling dan enzim struktural yang diperlukan untuk proses angiogenesis. Efek statin dan SDF-1 saling tumpang tindih, dan kombinasinya memberi efek sinergistik pada sel progenitor (Yu dan Feng, 2008).
DARAH TEPI PASIEN PENYAKIT JANTUNG KORONERSTABIL
BAB 3
KERANGKA KONSEP DAN HIPOTESIS
3.1. Kerangka Konsep
= variabel bebas
= variabel eksperimental = variabel tergantung
Gambar 3.1. Kerangka konseptual penelitian Keterangan kerangka konseptual
Proses atherosklerosis diawali dengan adanya disfungsi endotel. EPC berhubungan secara langsung dengan tingkat keparahan penyakit kardiovaskular. Ada beberapa terapi yang dapat mempengaruhi fisiologi EPC, salah satunya adalah statin atau HMG-CoA reductase inhibitor. Statin memiliki efek yang menguntungkan terhadap EPC yaitu salah satunya meningkatkan proliferasi dan diferensiasi EPC melalui jalur Akt yang kemudian akan mengaktivasi jalur eNOS dan VEGF yang menyebabkan terjadinya migrasi sel endotel. Statin jenis yang berbeda dengan dosis yang berbeda memiliki efektivitas yang berbeda pula. Simvastatin, atorvastatin, dan rosuvastatin saat ini merupakan jenis statin yang
EPC
Rosuvastatin
Proliferasi EPC ↑
banyak digunakan. Tujuan perlakuan ini adalah untuk mengetahui efektivitas statin dengan jenis dan dosis yang berbeda dalam meningkatkan proliferasi EPC yang dinilai dengan peningkatan proliferasi EPC dan jumlah koloni yang terbentuk.
3.2. Hipotesis Penelitian
1. Terdapat peningkatan proliferasi EPC pada darah tepi penderita penyakit jantung koroner stabil antara kelompok yang diberikan simvastatin, atorvastatin, dan rosuvastatin dengan kelompok kontrol. 2. Terdapat perbedaan proliferasi EPC pada darah tepi penderita penyakit
jantung koroner stabil antara kelompok yang diberikan simvastatin, atorvastatin, dan rosuvastatin.
BAB 4
MATERI DAN METODE PENELITIAN
4.1. Rancangan Penelitian
Penelitian ini merupakan penelitian eksperimental laboratoris (in vitro study) dengan melakukan pemberian statin pada darah tepi penderita penyakit jantung koroner stabil menggunakan pendekatan atau desain “posttest only control group design”.
T1 T2
Kelompok 1 a. 0.1 µmol/L X1 O1
Simvastatin b. 0.5 µmol/L X2 O1
c. 2.5 µmol/L X3 O1
Kelompok 2 a. 0.1 µmol/L X4 O1
Atorvastatin b. 0.5 µmol/L X5 O1
Sampel c. 2.5 µmol/L X6 O1
Kelompok 3 a. 0.1 µmol/L X7 O1
Rosuvastatin b. 0.5 µmol/L X8 O1
c. 2.5 µmol/L X9 O1
Kontrol O1
Gambar 4.1. Desain penelitian “posttest only control group design”
Keterangan :
Unit eksperimen yang digunakan pada penelitian ini adalah darah tepi yang diambil dari penderita penyakit jantung koroner stabil, kemudian dikelompokkan menjadi kelompok 1 yang diberikan Simvastatin, kelompok 2 yang diberikan Atorvastatin, kelompok 3 yang diberikan Rosuvastatin, dan kelompok kontrol. Sel mononuklear diisolasi dari darah tepi sampel kemudian dibiakkan dalam media selama 3 hari. Perlakuan diberikan pada hari ke-4 berupa penambahan simvastatin, atorvastatin dan rosuvastatin. Pengamatan terhadap respon sel dilakukan 2 hari setelah diberikan perlakuan, begitu pula dengan kelompok kontrol. Pemeriksaan meliputi imunofluoresensi menggunakan CD34 dan penilaian terhadap proliferasi EPC menggunakan MTT proliferation assay
dan kuantifikasi jumlah koloni EPC yang terbentuk.
4.2. Tempat dan Waktu Penelitian
Penelitian ini merupakan penelitian laboratoris yang akan dilakukan di Laboratorium Stem Cell, Institute of Tropical Disease (ITD) Universitas Airlangga. Penelitian ini dilaksanakan selama 6 bulan (Februari 2016 – Juli 2016).
4.3. Sampel Penelitian
4.3.1. Cara Pengambilan Sampel
Sampel pada penelitian ini adalah EPC darah tepi yang diisolasi dari penderita penyakit jantung koroner stabil yang diambil secara purposive sampling
Penderita penyakit jantung koroner stabil yang dimaksud merupakan pasien IDIK RS Dr. Soetomo Surabaya yang memenuhi kriteria penelitian berikut ini:
Kriteria inklusi: a. Laki-laki
b. Umur : 40-59 tahun
c. Penderita angina pektoris stabil
d. Hasil angiografi koroner menunjukkan lesi dengan stenosis ≥50% arteri koroner left main dan ≥70% pada satu atau lebih pembuluh darah koroner mayor lainnya berdasarkan angiografi e. Bersedia mengikuti prosedur penelitian dan menandatangani
informed consent
Kriteria eksklusi:
a. IMA (Infark Miokard Akut) b. Iskemia tungkai akut
c. Riwayat pemasangan stent
d. Riwayat CABG (Coronary Artery Bypass Grafting)
e. Diabetes mellitus f. Merokok
g. Anemia 4.3.2. Besar Sampel
Rumus besar sampel atau replikasi yang digunakan adalah: (Sudigdo, 2008).
(Z1 - /2 + Z1 – β)2 S2
n1 = n2 ≥
n = besar sampel atau replikasi Z = tingkat kesalahan tipe 1
Zβ = tingkat kesalahan tipe 2
X1 – X2 atau δ = perbedaan rerata minimal yang dianggap
bermakna
S = simpang baku atau standar deviasi
Setelah dilakukan penghitungan dengan menggunakan tingkat kesalahan
tipe 1 sebesar 5% (Z1 - /2 = 1,96), kesalahan tipe 2 sebesar 20% (Z1 – β = 0,84),
perbedaan rerata minimal yang dianggap bermakna sebesar 3,28 dan simpang baku sebesar 2,8 (Xu, et al., 2008), maka didapatkan n1 = n2 ≥ 6. Untuk mengantisipasi kemungkinan drop out atau kerusakan pada unit eksperimen yang mengakibatkan loss to follow-up, maka dilakukan koreksi sebesar 20% terhadap besar sampel pada penghitungan semula.
n n =
( 1 – f )
n = besar sampel dari perhitungan semula f = perkiraan proporsi drop out
Berdasarkan perhitungan tersebut, besar sampel atau replikasi yang akan digunakan pada penelitian ini adalah 8.
4.4. Variabel Penelitian 4.4.1. Variabel Bebas
4.4.2. Variabel eksperimental 1. Simvastatin
2. Atorvastatin 3. Rosuvastatin 4.4.2. Variabel Tergantung
Proliferasi EPC
4.5. Definisi Operasional
1. EPC : EPC adalah bagian dari sel berinti tunggal atau MNC yang diperoleh dari isolasi darah tepi dan kemudian dikultur dalam medium CFU, dengan marker stem cell hematopoetik CD34. Satuan : sel
Skala data : rasio
2. Proliferasi EPC : Pembiakan atau bertambahnya jumlah EPC dengan bentuk yang sama yang diperiksa dengan MTT cell proliferation assay.
Satuan : optical density (OD) Skala data : rasio
3. Simvastatin : salah satu jenis HMG Co-A reductase inhibitor yang digunakan untuk bahan penelitian laboratoris pada kultur sel (Abcam®). Pada penelitian ini akan digunakan 3 dosis yaitu 0.1 µmol/L, 0.5 µmol/L, dan 2.5 µmol/L.
4. Atorvastatin : salah satu jenis HMG Co-A reductase inhibitor yang digunakan untuk bahan penelitian laboratoris pada kultur sel (Tocris®). Pada penelitian ini akan dibagi menjadi 3 dosis yaitu 0.1 µmol/L, 0.5 µmol/L, dan 2.5 µmol/L.
Satuan : µmol/L Skala data : interval
5. Rosuvastatin adalah salah satu jenis HMG Co-A reductase inhibitor yang digunakan untuk bahan penelitian laboratoris pada kultur sel (Sigma®). Pada penelitian ini akan dibagi menjadi 3 dosis yaitu 0.1 µmol/L, 0.5 µmol/L, dan 2.5 µmol/L.
Satuan : µmol/L Skala data : interval
4.6. Bahan dan Alat Penelitian
Bahan dan alat yang diperlukan dalam penelitian ini adalah : 1. Sampel darah tepi @40 ml dalam tabung EDTA 2. Bahan dan alat untuk isolasi dan kultur EPC :
a. Phosphate buffer saline (PBS) dengan Fetal bovine serum
(FBS) 2%
b. Ficoll Histopaque-1077 (Sigma-Aldrich, USA)
c. CFU-Hill Liquid Medium Kit (Stemcell Technologies, Vancouver Canada)
d. Trypan blue
e. Tabung conical 50 ml
g. Micropipette tip h. Cylinder pipette
i. Fibronectin coated 24-wells plate
j. Fibronectin coated 96-wells plate
k. Mesin sentrifugasi OneMed model 0512-1 l. Hemositometer
3. Bahan dan alat untuk mengukur proliferasi EPC:
a. MTT Cell Proliferation Assay Kit (Sigma-Aldrich, USA) b. Pembaca microplate pada panjang gelombang 595 nm 4. Bahan dan alat untuk menghitung jumlah koloni:
a. Inverted light microscope
5. Bahan dan alat untuk menilai imunofluoresensi CD34: a. Phosphate buffer saline (PBS)
b. Formaldehide 3% c. CD34 berlabel FITC
d. mikroskop imunofluorescence 6. Simvastatin (Abcam®)
7. Atorvastatin (Tocris®) 8. Rosuvastatin (Sigma®)
4.7. Prosedur Penelitian 4.7.1. Koleksi Sampel
dan memiliki lesi stenosis ≥50% arteri koroner left main dan ≥70% pada satu atau lebih pembuluh darah koroner mayor lainnya berdasarkan angiografi. Subyek dengan riwayat pemasangan stent, infark miokard akut, diabetes mellitus, merokok, critical limb ischemia, atau dengan riwayat operasi bedah pintas arteri koroner, dan anemia dieksklusi dari kriteria subyek penelitian.
4.7.2. Isolasi Sel Darah Tepi dan Kultur EPC
Berikut ini adalah penjelasan langkah kerja isolasi sel darah tepi dan kultur EPC:
1. Sampel darah tepi sebanyak 40 ml diambil dari sheath yang terpasang pada arteri femoralis durante angiografi koroner.
2. Distribusi masing-masing 20 ml darah ke dalam tabung conical 50 ml. Lakukan pengenceran dengan PBS + 2% FBS dengan perbandingan darah : pengencer adalah 1:1 dan kemudian dicampur sehingga menjadi homogen.
3. Distribusikan 20 ml ficoll histopaque-1077 ke tabung conical 50 cc baru.
4. Teteskan perlahan-lahan 20 ml campuran darah + PBS dengan 2% FBS, ke tabung berisi ficoll histopaque-1007 melalui dinding tabung.
5. Sentrifugasi pada 800 g x 30’.
6. Ambil lapisan awan (PBMNC) yang terbentuk dari hasil sentrifugasi untuk selanjutnya dipisahkan dalam tabung baru. 7. PBMNC dicuci dengan PBS+2% FBS (1:1) dan disentrifugasi pada
8. Buang supernatan. Pelet ditambahkan dengan PBS + FBS 2% secukupnya dan disentrifugasi kembali pada 300 g x 10’. Proses ini diulang dua kali.
9. Buang supernatan. Pelet dilarutkan dengan medium basal+suplemen CFU-Hill Liquid Medium Kit ± 10 ml.
10. Lakukan perhitungan sel dengan hemasitometer. 11. Sel dikonsentrasikan sehingga mencapai 5x106 sel/ml.
12. Tambahkan sebanyak 1 ml suspensi sel ke dalam masing-masing sumur pada fibronectin coated 6-well plate.
13. Inkubasi pada suhu 37ºC dan kandungan CO2 5% selama 48 jam. 14. Setelah 48 jam, pisahkan cairan yang berisi non-adherent cell dari
adherent cell yang menempel pada dasar plate. Cairan yang akan digunakan adalah cairan berisi non adherent cell.
15. Kumpulkan seluruh cairan (yang berisi non-adherent cell) dari seluruh sumurhasil inkubasi ke 1 tabung.
16. Sentrifugasi pada 300 g x 7’. Buang Supernatan.
17. Pelet dilarutkan dengan medium basal+suplemen dengan konsentrasi 1x106 sel/ml.
18. Pisahkan sel sesuai assay. Suspensi sel dibagi ke dalam fibronectin coated 96-well plate untuk MTT cell proliferation assay dan ke dalam fibronectin coated 24-well plate untuk penghitungan koloni yang terbentuk. Inkubasi selama 24 jam.
dosis yang berbeda. Kelompok kontrol tidak ditambahkan perlakuan. Inkubasi kembali selama 48 jam.
20. Setelah inkubasi selama 48 jam, dilakukan pemeriksaan proliferasi EPC, CD34, dan penghitungan jumlah koloni yang terbentuk pada seluruh sumur.
4.7.3. Pemeriksaan untuk Menilai Proliferasi EPC
3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) Cell Proliferation Assay Kit digunakan dalam pemeriksaan proliferasi sel. Pemeriksaan ini bekerja berdasarkan reduksi ekstraseluler MTT oleh nicotinamide adenine dinucleotide (NADH) yang diproduksi dalam mitokondria melalui transplasma membrane electron transport dan suatu mediator elektron. Pada prinsipnya, reagen MTT ditambahkan pada setiap sumur dan diinkubasi dalam inkubator bersuhu 37°C dengan kandungan CO2 5% selama 4 jam. Absorbansi diukur dengan menggunakan pembaca microplate pada panjang gelombang 595 nm. 4.7.4. Pemeriksaan Menghitung Jumlah Koloni EPC
Koloni CFU-Hill yang terdapat pada seluruh sumur 24-well plate dihitung menggunakan inverted light microscope. Koloni CFU-Hill merupakan gabungan
15 EPC yang berbentuk bulat, spindle atau cobblestone.
4.7.5. Pemeriksaan Imunofluoresensi
4.8. Alur Penelitian
Anamnesis, pemeriksaan fisik, pemeriksaan penunjang (EKG, laboratorium, rontgen foto, ekhokardiografi)
Analisis statistik Pengumpulan data
Penderita jantung koroner stabil yang akan dilakukan angiografi