PENGARUH SERBUK LIDAH BUAYA (
Aloe vera
) TERHADAP PATOGENITAS
IKAN JELAWAT (
Leptobarbus hoevenii
)YANG DIUJI TANTANG BAKTERI
Aeromonas hydrophila
THE EFFECT OF
Aloe vera
POWDER ON PATHOGENICITY JELAWAT (
Leptobarbus
hoevenii
) TESTED THE CHALLENGE
Aeromonas hydrophila
Eko prasetio1, Hastiadi Hasan1, Wahyu Nopi Chana2
1. Staff pengajar Fakultas Perikanan dan Ilmu Kelautan, Universitas Muhammadiyah Pontianak
2. Alumni FakultasPerikanandanIlmuKelautan, UniversitasMuhammadiyah PontianakEmail:eko.prasetio@unmuhpnk.ac.id
ABSTRAK
Infeksi bakteriAeromonas hydrophilamerupakan salah satu penyebabMotile Aeromonad Septicemia (MAS). Pada penelitian ini, pakan yang mengandung serbuk lidah buaya diaplikasikan sebagai imunostimulan untuk mengobati penyakit MAS pada ikan jelawat (Lebtobarbus hoevenii). Metode penelitian ini adalah eksperimen dengan 5 perlakuan 3 ulangan yaitu perlakuan A (KN 0 g/kg pakan serbuk), B (KP 0 g/kg pakan serbuk), C (10 g/kg pakan serbuk), D (20 g/kg pakan serbuk) dan E (40 g/kg pakan serbuk).Ikan uji diberikan pakan perlakuan selama 7 hari sebelum uji tantang dan 14 hari setelah uji tantang. Uji tantang tantang dilakukan dengan menyuntikan suspensi bakteriAeromonas hydrophiladengan dosis 108sel/cfu sebanyak 0,1 ml secaraintramuscular. Sedangkan variabel pengamatan meliputi patogenitas (gejala klinis), respon makan, pertambahan bobot, organ dalam dan kelangsungan hidup. Hasil yang diperoleh menunjukkan bahwa gejala klinis ikan pasca infeksi diantaranya radang, radang dan hemoragi, tukak, dan sembuh. Sedangkan pakan yang mengandung serbuk lidah buaya sebanyak 10, 20, dan 40 g/kg dapat mengurangi tingkat mortalitas dibandingkan dengan kontrol negatif dan kontrol positif. Pemberian serbuk lidah buaya melalui pakan memberikan pengaruh nyata terhadap kelangsungan hidup ikan jelawat pasca infeksi. Dosis serbuk lidah buaya 40 g/kg menunjukkan hasil terbaik dan berbeda sangat nyata dengan dosis yang lain.
Kata kunci:Lidah buaya, Ikan Jelawat , Aeromonas hydrophila,Patogenita, Organ Dalam
ABSTRACT
Aeromonas hydrophila infection is one of problem causes Motile Aeromonas Septicemia (MAS).In this study, diets containing crude aloe vera extract as immunostimulant was applied to treat MAS disease in Carpfish. The method in this research was experimental with 5 treatments 3 replicatons. The treatment were A (KN 0 g/kg powder feed), B (KP 0 g/kg powder feed), C (10 ppt 10 g/kg powder feed), D (20 g/kg powder feed) dan E (40 g/kg powder feed).Experimental fish were fed daily for 7 days prior to challenge tests and 14 days after challenge tests. Challenge test was done by injection a suspension of A. hydrophila at a dose of 108 cfu/ml as mus as 0,1 ml. Intramuscularly. While observed variables is pathogenicity (clinical symptoms), response to eating, weight gain, internal organsand survival rate. The results showed that the clinical symptoms including inflammation of fish post-infection, inflammation and hemorrhage, ulcers and heal. While that diets containing 10, 20, and 40 g/kg of aloe extract reduced the mortality and clinical signs of wounds compared to those of controlfish. Dosages aloe vera powder 40 g/kg showed best effect and highly significant effect another dosages.
Ikan jelawat (Leptobarbus hoeveni) merupakan ikan asli Indonesia yang terutama terdapat di sungai, danau dan perairan umum lainnya di Kalimantan dan Sumatera. Jelawat termasuk ikan yang memiliki nilai ekonomis tinggi dibandingkan dengan ikan-ikan air tawar lainnya yang sudah populer dimasyarakat, berdasarkan hasil pengamatan di Kota Pontianak, harga ikan jelawat mencapai Rp. 50.000 – 70.000/kg. Harga jelawat yang tinggi dan pasar yang terbuka menjadikan ikan ini sebagai komoditas bisnis yang prospektif, baik usaha produksi benih maupun ikan konsumsi. Saat ini sebagian besar kegiatan budidaya ikan dilakukan dengan menggunakan sistem budidaya intensif, begitu pula dengan budidaya ikan jelawat. Sistem budidaya intensif yang menerapkan padat penebaran tinggi menyebabkan ikan lebih rentan terserang penyakit. Pemeliharaan ikan jelawat sebagai ikan komoditas budidaya seringkali terkendala oleh penyakitMotile Aeromonad Septicemia(MAS) yang disebabkan oleh bakteri Aeromonas hydrophila. Penyakit ini dapat menyebabkan kematian massal, baik pada ukuran benih maupun induk dalam waktu yang relatif singkat sehingga mengakibatkan kerugian yang cukup besar.
Upaya pengendalian penyakit MAS pada budidaya ikan, sampai saat ini masih menggunakan antibiotik. Namun, pemakaian antibiotik untuk jangka panjang, tidak terkontrol dan tidak tepat dosis dapat menimbulkan dampak negatif. Dampak ini bukan saja dikhawatirkan dengan munculnya strain bakteri resisten terhadap antibiotik yang dapat membayakan manusia, tetapi juga dapat mencemari lingkungan perairan, bahkan berdampak pada kesehatan dengan adanya residu kimia dari antibiotik pada produk perikanan yang dikonsumsi.
Menghindari dampak negatif dari penggunaan antibiotik, perlu dicari alternatif pengobatan yang efektif, murah, aman terhadap manusia dan ramah lingkungan. Upaya pencegahan dan pengobatan terhadap serangan bakteri Aeromonas hydrophila dapat menggunakan bahan herbal. Salah satu bahan herbal yang dapat meningkatkan sistem kekebalan tubuh dan tidak menimbulkan residu pada ikan adalah lidah buaya (Aloe vera). Menurut Jatnika dan Saptoningsih (2009), lidah buaya mampu menstimulasi kekebalan tubuh. Hal ini dikarenakan lidah buaya mengandung senyawa aktif flavonoid yang mampu mengaktifkan sel imun (Wahyuningrumet al.,2013). Lidah buaya juga mengandung saponin berfungsi sebagai antiseptik selain itu senyawa quinon pada lidah
buaya digunakan sebagai antibakteri. Senyawa alkaloid dalam lidah buaya mampu meningkatkan daya tahan tubuh (Gusviputri et al., 2012). Berdasarkan hal tersebut maka perlu dilakukan penelitian mengenai penggunaan serbuk lidah buaya yang dapat ditambahkan kedalam pakan dalam mengobati ikan jelawat yang di uji tantang dengan menggunakan bakteri Aeromonas hydrophila. Penelitian ini bertujuan untuk menentukan dosis serbuk lidah yang efektif, yang diaplikasikan melalui pencampuran pakan sebagai upaya pengobatan ikan jelawat yang diuji tantang dengan bakteri Aeromonas hydrophila.
METODEPENELITIAN
Penelitian ini dilaksanakan selama ± 30 hari, 7 hari persiapan dan 14 hari pengamatan bertempat di Laboratorium Basah (Wed lab) Fakultas Perikanan dan Ilmu Kelautan Universitas Muhammadiyah Pontianak yang terletak di Kecamatan Sungai Ambawang Kabupaten Kubu Raya Provinsi Kalimantan Barat. Alat dan bahan yang akan digunakan dalam penelitianyaitu Aquarium berukuran 60x30x40 jarum suntik, jarum ose, mikropipet, mikroskop, mortar, pisau dan alat tulis. Alat sterilisasi meliputi Autoclave, bunsen, beker glass, cawan petri, eppendorf, tabung reaksi, pipet tetes, labu erlenmayer dan oven. Sedangkan alat untuk mengkur kualitas air meliputi, Termometer DO meter, pH meter, dan DO meter. Sedangkan bahan yang digunakan yaitu daun lidah buaya,Aeromonas hydrophila, benih jelawat nila 8-12 cm yang diperoleh dari BBI Kota Pontianak,Putih telur, pellet, NaCl, TSA, TSB dan akuades yang steril.
Metode penelitian ini dilakukan dengan menggunakan 5 perlakuandan 3 ulangan yang mengacu pada penelitian Prasetio (2015). Adapun perlakuan yang digunakan adalah sebagai berikut:
- A : 0 g Serbuk lidah buaya per kg pakan (KN) + diinjeksi PBS
- B : 0 g Serbuk lidah buaya per kg pakan (KP) + diinjeksiA. hydrophila
- C : 10 g Serbuk lidah buaya per kg pakan (10 ppt) + diinjeksiA. hydrophila
- D : 20 g serbuk lidah buaya per kg pakan (20 ppt) + diinjeksiA. hydrophila
Pelaksaan penelitian ini dimulai dengan menyiapkan wadah penelitianya itu berupa wadah akuarium. Sebelum digunakan akuarium harus dalam keadaan bersih dan steril, selanjutnya dapat di isi air dan dilengkapi dengan aerasi agar kebutuhan oksigen terlarut dapat tercukupi. Untuk setiap akuarium harus diberi no plot sesuai dengan perlakuan yang telah ditentukan. Setelah itu masukan benih ikan jelawat sesuai dengan perlakuan masing-masing. Ikan Uji benih ikan jelawat ukuran 8-12 cm dan bobot sekitar 10-15 g sebanyak 150 ekor.
Ikan dipelihara selama 7 hari sampai kondisinya benar-benar stabil dengan nafsu makan yang tinggi dan tidak terjadi kematian. Selama proses aklimatisasi, pada hari pertama ikan diberi pakan komersil tanpa penambahan serbuk lidah buaya. Selanjutnya hari kedua sampai dengan tujuh hari, ikan diberi pakan perlakuan yang dicampur dengan serbuk lidah buaya sebagai immunostimulant untuk meningkatkan sistem kekebalan tubuh ikan jelawat. Pakan diberikan sebanyak 3% dari bobot tubuh dengan frekuensi pemberian pakan 3 kali sehari yaitu pada pagi, siang dan sore hari. Untuk menjaga kualitas air, dilakukan penyiponan setiap 2 hari sekali dan pergantian air setiap 3 hari sekali.
Isolat bakteri Aeromonas hydrophila berasal dari koleksi Laboratorium Karantina Ikan Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas I Pontianak, Kalimantan Barat. Inokulum dari agar miring dipindahkan secara aseptik ke media Tripticase Soy Agar (TSA) selanjutnya diinkubasi didalam inkubator dengan suhu 24-28⁰C selama 18-24 jam. Setelah diinkubasi selama 18-24 jam, dari media TSA dilihat koloni berwarna putih kekuningan. Koloni tersebut diinokulasi kembali kedalam media Tripticase Soy Broth (TSB) 10 ml dalam tabung reaksi, diinkubasikan di dalam inkubator selama 18-24 jam. Kemudian untuk memperoleh dosis 108 cfu/ml maka dilakukan pengenceran berseri dengan menggunakan eppendorf dan mikropipet secara aseptik (Utami, 2009).
Untuk menentukan kepadatan bakteri dapat dilakukan dengan menggunakan alat berupa spektrofotometer yang berfungsi untuk mengukur konsentrasi beberapa molekul seperti DNA/ RNA (UV light, 260 nm), protein (UV, 280 nm), kultur sel bakteri, ragi/ yeast (Vis light, 600 nm), dan lain-lain. Lidah buaya didapat dari kecamatan siantan Kabupaten Pontianak. Lidah buaya masih segar dikupas, sehingga tertinggal gelnya. Gel lidah buaya
di potong-potong menjadi beberapa bagian kemudian dicuci dengan air bersih dan dikeringkan. Pengeringan dilakukan dalam udara terbuka (kering udara) diluar pengaruh cahaya matahari langsung untuk menghindari kerusakan bahan aktif yang terdapat dalam lidah buaya. Kemudian di oven selama 15 menit pada suhu 450C sampai kering. Lidah buaya yang telah kering dihaluskan dengan menggunakan blender lalu diayak dengan saringan sampai mendapatkan serbuk halus (Sariet al.,2012). Pembuatan campuran pakan dengan serbuk lidah buaya, diawali dengan ditimbangnya lidah buaya (bobot kering) sesuai dengan dosis yang diperlukan: 0 g/kg pakan (kontrol), 10 g/kg (dosis 10 ppt), 20 g/kg (dosis 20 ppt), dan 40 g/kg (dosis 40 ppt). Langkah selanjutnya adalah pakan (pellet) dicampurkan dengan serbuk lidah buaya yang telah ditimbang kemudian dicampurkan dengan putih telur sebanyak 2% dari bobot pakan, putih telur diberikan sedikit demi sedikit dan diaduk hingga merata dengan menggunakan kedua tangan hingga homogen. Pakan yang telah tercampur merata dengan serbuk lidah buaya selanjutnya dikering udarakan. Setelah itu sejumlah pakan yang sudah ditimbang sesuai dengan kebutuhan untuk masing-masing perlakuan dimasukan ke dalam toples/wadah tertutup dan disimpan di kulkas. Pakan tersebut telah siap digunakan.
Ikan yang telah melalui proses adaptasi selama 7 selanjutnya diuji tantang. Pada saat uji tantang, perlakuan kontrol negatif diinjeksi dengan Posphate Buffered Saline (PBS) sebanyak 0,1 ml, sedangkan untuk perlakuan kontrol positif dan perlakuan dosis serbuk lidah buaya (10 ppt, 20 ppt, dan 40 ppt) diinjeksi dengan bakteri A. hydrophila hasil pengenceran dengan dosis 108cfu/ml sebanyak 0,1 ml yang mengacu pada hasil LD 50 oleh Faridah (2010).
Pemberian pakan sebanyak 3% pada perlakuan dimulai 1 hari setelah ikan diuji tantang. Frekuensi pemberian pakan diberikan sebanyak 3 kali sehari, yaitu pada pagi, siang, dan sore hari dengan metode at satiation. Jumlah pakan yang dikonsumsi dicatat dengan cara menghitung selisih bobot pakan awal dengan sisa pakan. Pemberian pakan perlakuan dilakukan sampai 14 hari pasca uji tantang. Sedangkan pada pengamatan kelangsungan hidup dilakukan selama 21 hari pasca uji tantang.
Variabel Pengamatan
Respons makan pada ikan diukur secara visual dan dianalisis secaradeskriptif setiap hari, yaitu 7 hari sebelum dan sesudah ikan diuji tantang. Pengamatan respons makan dilakukan dengan pemberian skor sebagaimana yang dilakukan Faridah (2010) sebagai berikut :
- = Tidak ada respon makan (Σ pakan
terkonsumsi 0-10%)
+ = Respon makan rendah (Σ pakan terkonsumsi
11-14%)
++ = Respon makan sedang (Σ pakan terkonsumsi
41-70%)
+++ = Respon makan sedang (Σ pakan terkonsumsi
71-100%) X = Tidak diberi pakan
Pengamatan respon makan pada ikan jelawat dilakukan dari awal hingga akhir perlakuan. Berikut ini adalah cara perhitungan respon makan:
-Respon makan (%)
Jumlah pakan yang dikonsumsi
Jumlah Pakan Yang diberikan x 100 %
Pengukuran bobot tubuh ikan uji dilakukan pada awaldanakhirperlakuan menggunakan timbangan digital. Ikan pada masing-masing akuariumditimbang bobot biomassanyadan dihitung nilairataan bobot tiap perlakuan dan pertambahan bobotnya. Nilai perubahan bobot diketahui dengan cara menghitung selisih bobot ikan pada akhir masa pengamatan dengan bobot awal ikan pada saat di uji tantang. Menurut Effendi (1997) pertumbuhan berat mutlak dapat dinyatakan dengan rumus:
Keterangan:
G= Pertumbuhan Mutlak (gr) Wt = Berat rata-rata akhir ikan (gr) Wo = Berat rata-rata awal ikan (gr)
Gejala Klinis dan Penyembuhan Luka
Gejala klinis diamati secara visual setiap hari setelah ikan diuji tantangsampai akhir masa pemeliharaan selama kurun waktu 21 hari. Perkembangan dan perubahan dari gejala klinis yang timbul diamati secara deskriptif dengan modifikasi dari Kamaludin (2011), yaitu pada tabel 1.
Tabel 1. Gejala Klinis Ikan jelawat
Gejala Klinis Penandaan Radang, Hemoragi dan Nekrosis 7
Tukak 8
Pengamatan organ dalam secara deskriptif. Organ dalam yang diamati meliputi organ hati, empedu dan ginjal. Pengamatan organ dalam dilakukan secara visual pada akhir masa pengamatan dengan cara membedah ikan perlakuan. Kelainan yang diamati berupa perubahan warna dan ukuran organ dalam.
Kelangsungan Hidup
Perhitungan jumlah ikan yang mati akhir pengamatan dilakukan setelah ikan jelawat diuji tantang sampai hari ke-14 pasca uji tantang. Tingkat kelangsungan hidup ikan dihitung dengan rumus yang dikemukakan Effendi (1997) sebagai berikut :
Nt
SR = x 100%
No Keterangan :
SR: Tingkat kelangsungan hidup %
Nt : Jumlah ikan yang hidup pada akhir pengamatan (ekor)
No: Jumlah ikan awal yang hidup pada uji tantang (ekor)
Kualias Air
Sebagai data pendukung penelitian, pengamatan parameter kualitas air yang diamati adalah pH, suhu, DO dan NH3. Pengukuran suhu dilakukan setiap hari yaitu pada pagi dan sore hari. Sedangkan parameter kualitas air lainnya seperti pengukuran pH, DO dan NH3 dilakukan pada awal, pertengahan dan akhir penelitian.
HASILDAN PEMBAHASAN
Respon Makan Ikan Jelawat
berpengaruh terhadap jumlah serapan serbuk lidah buaya yang terkandung pada pakan dan semakin efektif proses pengobatan
Masing-masing perlakuan memiliki jumlah konsumsi pakan yang bervariasi. Hal ini didukung oleh hasil pengamatan respon makan ikan jelawat ketika diberikan pakan perlakuan selama percobaan (tabel 2).
Tabel 2. Respon makan ikan jelawat pada perlakuan pemberian kontrol negatif (KN), kontrol positif (KP) dan pemberian serbuk lidah buaya (10 ppt, 20 ppt, 40 ppt) selama masa percobaan
Pakan perlakuan diberikan selama 21 hari masa penelitian dan dilakukan pengamatan respon makan ikan terhadap pakan sebelum dan sesudah dilakukan
Pakan perlakuan diberikan selama 21 hari masa penelitian dan dilakukan pengamatan respon makan ikan terhadap pakan sebelum dan sesudah dilakukan penyuntikan dengan bakteri A. hydrophila. Hari ke 0 pasca infeksi ikan tidak langsung diberi pakan karena ikan tampak stres akibat penyuntikan. Menurut Kurniawan (2010),
salah satu pemicu stres ikan adalah handling (penanganan) pada saat sampling atau penyuntikan.
Pada hari ke 1 hingga hari ke 2 pasca penyuntikan terlihat bahwa perlakuan kontrol negatif memiliki respon makan tinggi dan sedang, sedangkan pada kontrol positif dan pada perlakuan serbuk lidah buaya pada perlakuan (10 ppt, 20 ppt dan 40 ppt) mengalami penurunan nafsu makan rendah. Pada hari ke 3 pasca penyuntikan respon makan sedang di tunjukan pada perlakuan kontrol negatif dan pada perlakuan serbuk lidah buaya (10 ppt, 20 ppt dan 40 ppt). Sedangkan Ikan uji pada kontrol positif menunjukan respon makan rendah pada hari ke 3, 4, 5, 6, 7 dan hari ke 8. Hari ke 9 hingga hari ke 14 kondisinya mulai stabil dan respon makan kembali meningkat hingga akhir pengamatan. Respon makan pada kontrol negatif dan perlakuan serbuk lidah buaya (10 ppt, 20 ppt dan 40 ppt) lebih cepat kembali normal bila dibandingkan dengan kontrol positif. Terlihat bahwa pada ikan uji kontrol positif memiliki respon makan rendah sampai akhir masa perlakuan, sedangkan pada perlakuan kontrol negatif dan serbuk lidah buaya (10 ppt, 20 ppt dan 40 ppt) menunjukkan respon makan sedang dan tinggi mulai hari ke 4 hingga hari ke 14. Sedikit demi sedikit terjadi peningkatan nafsu makan hingga akhir pengamatan. Menurut Aniputri et al., (2014) semakin baik respon makan ikan semakin cepat pula terjadi proses penyembuhan.
Pertambahan Bobot
Pengukuran bobot tubuh ikan uji dilakukan pada awal dan akhir perlakuan Nilai perubahan bobot diketahui dengan cara menghitung selisih bobot ikan pada akhir masa pengamatan dengan bobot awal ikan pada saat di uji tantang. Grafik pertambahan bobot dapat dilihat pada gambar 7. 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3
Keterangan :x = Tidak diberi pakan - = Tidak ada respon makan
(Σ pakan terkonsumsi 0-10%) + = Respons makan rendah
(Σ pakan terkonsumsi 11-40%) ++ = Respons makan sedang
(Σ pakan terkonsumsi 41-70%) +++ = Respons makan tinggi
Gambar1. Pertambahan bobot ikan jelawat pada perlakuan KN, KP dan perlakuan pemberian serbuk
lidah buaya (10 ppt, 20 ppt, 40 ppt)
Pada gambar 1 menunjukkan selisih perubahan bobot yang rendahpadaperlakuan Kontrol positif (KP) sebesar 1,68±0,20(g). Sedangkan pada perlakuan kontrol negatif (KN) sebesar 0,73±0,15(g). Untuk perlakuan dosis serbuk 10 ppt, 20 ppt dan 40 ppt mengalami peningkatan sebesar 1,35±0,22 (g), 1,56±0,21 (g) dan 1,77±0,21 (g).
Hasil pengamatan selama 21 hari Pertambahan bobot akhir terendah pada perlakuan kontrol positif sebesar 0,73 gram. Sedangkan pertambahan bobot akhir tertinggi terdapat pada perlakuan serbuk 40 ppt dengan pertambahan bobot sebesar 1,77 gram. Pertambahan bobot ikan dikarenakan oleh adanya pengaruh respon makan jika pakan yang dimakan oleh ikan lebih banyak maka laju pertambahan bobot semakin meningkat sebaliknya jika respon makan menurun laju
pertambahan bobot lebih sedikit. Penurunan bobot dikarenakan ikan diinjeksi dengan bakteri A. hydrophila sehingga ikan lamban merespon pakan. Hal ini sesuai dengan pernyataan Kabata (1985), Bahwa ikan yang terserang bakteri Aeromonas hydrophila memperlihatkan gejala berupa nafsu makan yang menurun. Semakin baik respon makan ikan semakin cepat pula terjadi proses penyembuhan (Aniputri,et al.,2014).
Patogenitas
Patogenitas diamati secara visual dengan Skoring diberikan sesuai dengan tingkat kerusakan klinis yang terjadi pada permukaan tubuh ikan. Semakin parah kerusakan klinis, maka skornya akan semakin tinggi. Gejala klinis yang muncul pada perlakuan dosis dan kontrol positif berupa hemoragi, radang, nekrosis, dan tukak dengan panjang yang berbeda-beda pada setiap ikan dapat dilihat pada (gambar 2).
Gambar 2. Gejala klinis perlakuan kontrol negatif, kontrol positif, perlakuan serbuk 10 ppt, 20 ppt dan 40 ppt selama penelitian
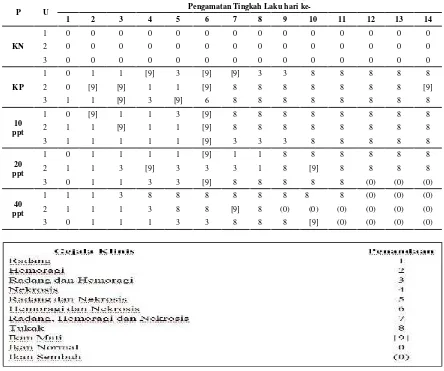
Tabel 3. Perubahan gejala klinis pada ikan jelawat disampling sebanyak 15 ekor
P U Pengamatan Tingkah Laku hari
ke-1 2 3 4 5 6 7 8 9 10 11 12 13 14
KN
1 0 0 0 0 0 0 0 0 0 0 0 0 0 0
2 0 0 0 0 0 0 0 0 0 0 0 0 0 0
3 0 0 0 0 0 0 0 0 0 0 0 0 0 0
KP
1 0 1 1 [9] 3 [9] [9] 3 3 8 8 8 8 8
2 0 [9] [9] 1 1 [9] 8 8 8 8 8 8 8 [9]
3 1 1 [9] 3 [9] 6 8 8 8 8 8 8 8 8
10 ppt
1 0 [9] 1 1 3 [9] 8 8 8 8 8 8 8 8
2 1 1 [9] 1 1 [9] 8 8 8 8 8 8 8 8
3 1 1 1 1 1 [9] 3 3 3 8 8 8 8 8
20 ppt
1 0 1 1 1 1 [9] 1 1 8 8 8 8 8 8
2 1 1 3 [9] 3 3 3 1 8 [9] 8 8 8 8
3 0 1 1 3 3 [9] 8 8 8 8 8 (0) (0) (0)
40 ppt
1 1 1 3 8 8 8 8 8 8 8 8 (0) (0) (0)
2 1 1 1 3 8 8 [9] 8 (0) (0) (0) (0) (0) (0)
3 0 1 1 1 3 3 8 8 8 [9] (0) (0) (0) (0)
Perlakuan kontrol positif di hari ke 5 masih mengalami gejala klinis berupa radang dan hemoragi. Snieszko dan Axelord (1971) menyebutkan bahwa pada daerah suntikan, bakteri yang berkumpul akan menyebabkan kematian
radang dan hemoragi. Gejala klinis berupa tukak terjadi pada hari 7 panjang tukak 3 cm dan lebar 1,2 cm, hari ke 9 panjang tukak 2,7 cm dan lebar tukak 1,2 cm , hari ke 11 panjang tukak 3,7 cm dan lebar 1,5 cm sedangkan pada hari 14 panjang tukak 3,8 cm dan lebar 2 cm. Tukak dapat terjadi karena regenerasi sel- sel yang rusak berjalan lebih lambat dibandingkan dengan kematian sel yang terjadi (Runnels et al., 1965 dalam Abdullah, 2008). Sedangkan pada perlakuan C (10 ppt) gejala klinis yang tampak pada hari ke 5, 7, 9, 11 dan ke 14 berupa tukak. Ulcer atau kerusakan jaringan tubuh terbentuk karena aktivitas proteolitik dari bakteri, dimana keadaan kemungkinan adanya subtansi ekstraseluler bakteri protease dan sitokin yang menghidrolisis jaringan inang (Lukistyowati dan Kurniasih, 2011).Ulcer mulai membesar hingga mengakibatkan daging rusak menimbulkan tukak, hari ke 5 diameter tukak 0,5 cm, hari ke 7 dan ke 9 diameter tukak 2 cm, hari ke 11 diameter tukak 1,5 cm sedangkan pada hari 14 diameter tukak 1,2 cm.
Perlakuan D (20 ppt) di hari ke 5 dan ke 7 terjadi peradangan, Gejala klinis berupa tukak terjadi pada hari ke 9 panjang tukak 1,5 cm dan lebar 1 cm, hari ke 11 panjang tukak 2,6 cm dan lebar tukak 1,6 cm dan pada hari 14 panjang tukak 2 cm dan lebar 1,3 cm. Sedangkan pada perlakuan D (40 ppt) gejala klinis berupa tukak terjadi pada hari ke 5 panjang tukak 1,1 cm dan lebar 1,1 cm, hari ke 7 panjang tukak 1,3 cm dan lebar tukak 1 cm, hari ke 9 panjang tukak 0,5 cm dan lebar tukak 0,5 cm, hari ke 11 tukak 0,2 cm dan lebar tukak 0,1 cm dan pada hari 14 tukak sudah tertutup, ikan terlihat normal dan sehat. Proses penyembuhan luka pada sebagian ikan uji mulai terjadi pada hari ke-8 dan mengalami penyembuhan pada hari ke-12 sampai hari ke-14 untuk perlakuan D (20 ppt) dan E (40 ppt). Diameter tukak yang berubah dari besar menjadi kecil merupakan salah satu indikator penyembuhan luka. Proses pemulihan morfologi ditandai dengan adanya daging ikan mulai tertutupi jaringan-jaringan barubekas luka pasca infeksi bakteriA. hydrophila. Hal tersebut diduga adanya pengaruh penambahan serbuk lidah buaya didalam pakan. Haryani et al., (2012) kandungan flavonoid dapat mengurangi peradangan dan meningkatkan sistem imun ikan. Selain mengandung flavonoid didalam lidah buaya juga terkandung protein yang berperan dalam membentuk dan memperbaiki jaringan. Hal ini juga dilaporkan oleh Morsy (1991), kadar protein dalam lidah buaya secara kualitatif kaya akan asam-asam amino esensial yang berperan dalam pembentukan
jaringan baru dan memperbaiki sel-sel tubuh yang rusak. Menurut Furnawanti ( 2002), Enzim protease bekerjasama dengan glukomannan mampu memecah dinding sel bakteri yang menyerang luka. Zat aktif acemannan (acetylated mannose) berfungsi sebagai immunostimulator yang menyebabkan respon imun meningkat (Weidosari, 2007).
Kelangsungan Hidup Ikan
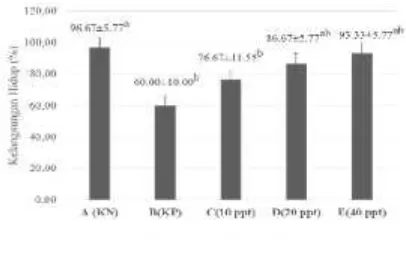
Kelangsungan hidup merupakan sejumlah organisme yang hidup pada akhir pemeliharaan yang dinyatakan dalam persentase. Nilai kelangsungan hidup akan tinggi jika faktor kualitas dan kuantitas pakan serta kualitas lingkungan mendukung. Kelangsungan hidup ikan jelawat selama pemeliharaan 21 hari didapatkan databerkisar antara 69,00% - 96,67%. Adapun persentase kelangsungan hidup ikan jelawat digambarkan dalam bentuk grafik seperti pada gambar 3.
Gambar 3. Grafik kelangsungan hidup ikan jelawat pada perlakuan KN, KP dan perlakuan pemberian serbuk lidah buaya (10 ppt, 20 ppt, 40 ppt)
Berdasarkan beberapa hasil penelitian, Lidah buaya mengandung zat aktif manosa, glukomannan, asam krisofandan Acetylated mannose(acemannan). Acemannan berfungsi sebagai imunostimulator yang meningkatkan respon imun sebagai pertahanan terhadap patogen intraseluler seperti virus, bakteri dan parasit yang berfungsi sebagai antibiotik (Stuart et al., 1997).
Kematian tertinggi pada perlakuan kontrol positif (KP) pasca uji tantang bakteriA. hydrophila, hal ini menujukkan patogenitas bakteri A. hydrophila dapat membunuh ikan dalam waktu kurang dari 24 jam dengan gejala klinis berupa radang dan hemoragi. Bakteri A. hydrophila merupakan bakteri yang bekerja secara sistemik atau melalui peredaran darah sehingga penyebarannya dapat ke organ-organ dalam. Luka terparah dialami pada daerah sekitar injeksi karena merupakan daerah yang pertama kali kontak dengan bakteriA. hydrophila. Menurut Affandi dan Usman (2002) Adanya luka pada kulit merupakan jalan masuk utama (port of entry) untuk beberapa infeksi bakteri. Proses injeksi merupakan jalan masuk yang sangat cepat bagi bakteriA. hydrophila untuk menginfeksi.
Rendahnya tingkat kelangsungan hidup ikan jelawat pada perlakuan kontrol positif diduga karena pakan yang diberikan tidak ditambahkan dengan serbuk lidah buaya, sehingga manfaat serbuk lidah buaya yang dapat meningkatkan sistem imun tidak terjadi pada perlakuan kontrol positif. Pada perlakuan kontrol positif ikan di injeksi dengan bakteriA. hydrophilasehingga ikan pada perlakuan kontrol positif lebih rentan terhadap serangan penyakit akibatnya ikan mudah stres. Menurut Ghufron dan Kordi (2004), stres pada ikan akan mengakibatkan kepekaan ikan tersebut terhadap penyakit sehingga mempengaruhi pada kelangsungan hidup ikan.
Pengamatan Organ Dalam
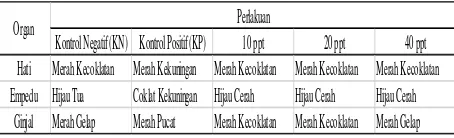
Hasil pengamatan organ dalam ikan jelawat pada masa akhir penelitian diketahui dan perbedaan di antara perlakuan baik perlakuan kontrol negatif (KN), kontrol positif (KP), perlakuan dosis 10 ppt, 20 pptdan 40 ppt yang dapat dilihat pada pada tabel 4 dan gambar 4.
Tabel 4. Pengamatan terhadap organ dalam ikan jelawat
Gambar 4. Organ dalam ikan jelawat pada perlakuan KN, KP, dosis serbuk lidah buaya (10 ppt, 20 ppt dan 40 ppt). Pada akhir pengamatan (keterangan: A= hati; B = empedu; C = ginjal).
Organ dalam yang diamati berupa organ hati, empedu dan ginjal. Hasil pengamatan menunjukan bahwa organ dalam pada perlakuan dosis 10 ppt, 20 ppt dan 40 ppt memiliki kondisi yang sama atau mendekati perlakuan kontrol yang ada pada perlakuan kontrol negatif (normal), yaitu hati berwarna merah kecoklatan, empedu berwarna hijau tua dan ginjal berwarna merah gelap. Hal ini sesuai dengan pernyataan Setiaji, (2009) organ dalam ikan normal yaitu hati berwarna merah coklat, empedu berwarna hijau dan ginjal bewarna merah gelap/merah kecoklatan. Sedangkan pada perlakuan kontrol positif menunjukan perbedaan yaitu kelainan organ dalam seperti organ hati yang berwarna pucat dan merah kekuningan, empedu berwarna pucat dan coklat kekuningan, ginjal berwarna merah pucat.
Menurut penjelasan Affandi dan Tang (2002) ginjal merupakan suatu organ yang berperan dalam filtrasi (penyaringan) beberapa bahan buangan sisa metabolisme. Bahan-bahan yang dibuang lewat ginjal, antara lain ureum, air, dan garam mineral. Sel yang bertanggung jawab pada filtrasi di ginjal adalah sel glomerulus. Bagian sel glomerulus yang berperan dalam proses filtrasi ini adalah kapsul bowman. Sedangkan bagian lain yang berperan dalam proses reabsorbsi ion adalah tubuli ginjal. Unit terkecil dari ginjal adalah nepron yang terdiri dari badan malphigi dan tubuli ginjal. Badan malphigi berfungsi untuk menyaring hasil buangan metabolik yang terdapat dalam darah. Darah tidak ikut tersaring dan masuk ke dalam pembuluh darah balik ginjal (vena renalis). Protein tertahan dalam darah. Cairan ekskresi ini kemudian masuk ke tubuli ginjal. Karena fungsi utamanya mensekresikan sebagian besar produk
Kontrol Negatif (KN) Kontrol Positif (KP) 10 ppt 20 ppt 40 ppt Perlakuan
Organ
KN
KN KP
akhir metabolisme tubuh dan mengatur konsentrasi cairan tubuh (Fujaya, 2004), maka ginjal rentan untuk terserang bakteri A. hydrophila yang bersifat sistemik. Seperti yang terlihat pada ikan perlakuan kontrol positif.
Kualitas Air
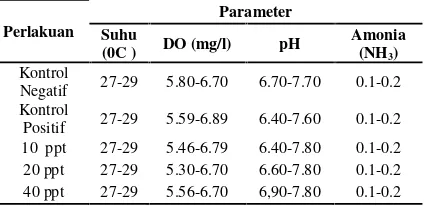
Kualitas air merupakan faktor yang sangat penting dan pembatas bagi mahluk hidup dalam air baik faktor kimia, fisika dan biologipada tabel 5.
Tabel 5. Kualitas Air Ikan Jelawat
Perlakuan
Negatif 27-29 5.80-6.70 6.70-7.70 0.1-0.2 Kontrol
Positif 27-29 5.59-6.89 6.40-7.60 0.1-0.2 10 ppt 27-29 5.46-6.79 6.40-7.80 0.1-0.2 20 ppt 27-29 5.30-6.70 6.60-7.80 0.1-0.2 40 ppt 27-29 5.56-6.70 6,90-7.80 0.1-0.2
Berdasarkan hasil pengukuran suhu selama penelitian didapat pada setiap perlakuan rata-rata berkisar antara 27 - 29 oC, Do 5.80-6.70 mg/l, pH 6.70-7.70 dan NH3 berkisar antara 0,1-0,2. Suhu perlakuan sesuai untuk kelangsungan hidup ikan jelawat. Menurut pendapat Brotowijoyo (1995), suhu optimum untuk selera makan ikan adalah 25-27 0C dan kisaran suhu air optimal untuk budidaya ikan air tawar adalah 15-29 oC.Brotowijoyo (1995), kisaran suhu air optimal untuk budidaya ikan air tawar adalah pH air 6,5-8.Sukadi.,et al(1989) bahwa oksigen terlarut pada umumnya berkisar antara 5,0-6,6 mg/l.
KESIMPULAN DAN SARAN
Kesimpulan
Dari hasil penelitian bahwa:
Pemberian serbuk lidah buaya yang diaplikasikan melalui pencampuran pakan memberikan hasil Perubahan bobot ikan jelawat terbaik pada perlakuan serbuk lidah buaya 40 ppt dengan nilai 1,77 gramdan kelangsungan hidup sebesar 93,33 %.
Berdasarkan hasil penelitian yang dilakukan, maka disarankan : pencegahan dan pengobatan bakteri A. hydrophila yang menyerang ikan-ikan budidaya diperlukan dosis serbuk lidah buaya melalui percampuran pakan sebanyak 40 g/kg
pakan.Sebaiknya dalam pengobatan diperlukan waktu pengamatan lebih lama agar tingkat kesembuhan lebih optimal.
DAFTAR PUSTAKA
Brotowijoyo,1995 Pengantar Lingkungan dan Budidaya Air. Liberty. Yogyakarta.
Faridah, N., 2010. Efektivitas Ekstrak Lidah Buaya (Aloe vera) dalam Pakan sebagai Imunostimulan untuk Mencegah Infeksi Aeromonas hydophila pada Ikan Lele Dumbo Clarias sp. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Bogor.
Effendie, M. I., 1997. Metode Biologi Perikanan. Yayasan Pustaka Nusantara, Yogyakarta. 163 Hal.
Boyd, C.E., 1990. Water Quality in Ponds for Aquaculture. Albama Agricultural. Experiment Station. Alburm univesity, Albama. 477pp.
Kamaludin, I.,2011. Efektivitas Ekstrak Lidah Buaya (Aloe vera) untuk Pengobatan Infeksi Aeromonas hydophila pada Ikan Lele Dumbo (Clarias sp) Melalui Pakan. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Bogor. 54 hlm. Lukistyowati, I dan Kurniasih. 2011. Kelangsungan
Hdup Ikan Mas (Cyprinus carpio L.) yang diberi Pakan Ekstak Bawang Putih ( Allium sativum ) dan diinfeksi Aeromonas hydrophila. Jurnal Perikanan dan Kelautan, 16 (1): 144-160.
Minggawati, Infa dan Saptono. 2012. Parameter Kualitas Air untuk Budidaya Ikan Patin (Pangasius pangasius) di Karamba Sungai Kahayan, Kota Palangka Raya. Jurnal Ilmu Hewan Tropika. Vol. 1 (1)
Nabib R, Pasaribu FH. 1989. Patologi dan Penyakit Ikan. Departemen Pendidikan dan Kebudayaan. Direktorat Jendral Pendidikan Tinggi. Pusat Antar Universitas Bioteknologi Institut Pertanian Bogor. Bogor.
Prasetio,E., M. Mursin 2015. Pengaruh Serbuk
Lidah Buaya (Aloe Vera) Sebagai
Immunostimulan Terhadap Tingkat
Dengan Bakteri Aeromonas Hydrophila. Buletin Al Ribaat. Vol. 12. No.2
Sari. N.W., I. Lukistyowati dan N. Aryani. 2012. Pengaruh Pemberian Temulawak ( Curcuma xanthorriza Roxb) Terhadap Kelulushidupan Ikan Mas ( Cyprinus carpio L) Setelah Di Infeksi Aeromonas hydrophila. J. Perikanan dan Kelautan., 17 (2) : 43-59.
Setiaji, A., 2009. Efektivitas Ekstrak Daun Papaya Carica papaya L. untuk Pencegahan dan Pengobatan Ikan Lele Dumbo Clarias sp. yang diinfeksi Bakteri Aeromonas hydrohila. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Bogor.
Stuart, R.W., Lefkowitz, D.L., Lincoln, J.A., Howard, K., Gelderman, M.P., Lefkowitz, S.S., 1997.Upregulation of phagocytosis and candidicidal activity of macrophages exposed to the immunostimulant acemannan. Int. J. Immunopharmacol. 19, 75-82.
Suryowidodo, C.W. 1988. Lidah Buaya (Aloe vera) sebagai Bahan Baku Industri. Warta IHP. Balai Besar Penelitian dan Pengembangan Industri Hasil Pertanian (BBIHP). Bogor. Wahjuningrum, D., R. Astrini dan M. Setiawati.