BAB I PENDAHULUAN
A. Latar Belakang Masalah
Kanker payudara merupakan jenis kanker yang paling banyak terjadi pada wanita di dunia. Hingga tahun 2008 terdapat 1,4 juta kasus baru dan sebanyak 458,400 diantaranya telah meninggal akibat kanker payudara. Kondisi ini semakin mengkhawatirkan karena insidensinya yang terus meningkat terutama negara di benua Afrika dan Asia (American Cancer Society, 2011). Agen kemoterapi yang sering digunakan pada terapi kanker payudara adalah doxorubicin. Permasalahan muncul ketika penggunaan doxorubicin jangka panjang justru menyebabkan efek samping pada jaringan normal, penekanan sistem imun, dan kardiotoksisitas (Wattanapitayakul et al., 2005), serta terjadinya resistensi pada aplikasi klinis (Mechetner et al., 1998). Penurunan efek samping doxorubicin dapat diatasi dengan menurunkan dosis, namun hal ini juga menyebabkan penuruna efikasinya terhadap sel kanker. Oleh karena itu, pada perkembangannya agen kemoterapi tidak hanya diberikan secara tunggal tetapi dikombinasikan dengan senyawa lain untuk meningkatkan efektivitas dan menjamin keamanan terapi.
Ko-kemoterapi merupakan strategi terapi kanker dengan mengkombinasikan suatu senyawa dengan agen kemoterapi. Ko-kemoterapi dapat meningkatkan efikasi agen kemoterapi karena adanya kombinasi yang sinergis dan memperkecil kemungkinan efek samping karena mengurangi dosis agen kemoterapi (Alison, 2004). Secang (Caesalpinia sappan L.) merupakan tanaman
Indonesia yang memiliki senyawa potensial untuk dikembangkan sebagai agen ko-kemoterapi. Secang mengandung senyawa brazilein yang bersifat sitotoksik pada sel Hep G2 dan Hep 3b (hati), MDA-MB-231 dan MCF-7 (payudara), A549 (paru-paru), dan Ca9-22 (mulut) dengan nilai IC50 antara 2-10 μg/mL (Yen et al.,
2010). Brazilein juga mampu menginduksi apoptosis melalui penurunan ekspresi mRNA survivin, diikuti peningkatan aktivasi caspase 9 dan caspase 3 pada sel kanker HepG2 (Zhong et al., 2009). Caspase 3 merupakan efektor apoptosis yang berperan penting dalam proses apoptosis pada inti sel, degradasi protein, dan inhibitor enzim endonuklease, sehingga caspase 3 menjadi target yang strategis dalam penelusuran mekanisme apoptosis. Kendala penggunaan brazilein adalah ketidaktersediannya di pasaran, sehingga alternatif yang bisa dilakukan adalah isolasi brazilein secang atau melalui pendekatan ekstraksi secang yang diharapkan mampu mendapatkan kandungan brazilein. Penelusuran pertama dilakukan oleh Nurulita and Muflih (2006) menggunakan ekstrak metanol secang dengan hasil nilai IC50 sebesar 150,9 µg/mL dan mampu menginduksi apoptosis pada sel
T47D. Ekstraksi secang selanjutnya menggunakan pelarut etanol dengan nilai IC50
pada sel T47D yang lebih poten yaitu sebesar 35 µg/ml, dan kombinasinya dengan doxorubicin mampu meningkatkan sitotoksisitas doxorubicin konsentrasi 9 nM, serta meningkatkan jumlah kematian sel pada tahap late apoptosis sebesar 39,88% (Nurjizah et al., 2012). Upaya untuk memperoleh kandungan brazilein yang lebih murni dilakukan dengan membuat fraksi etil asetat secang dan telah diuji pada sel T47D dengan hasil nilai IC50 55,9 µg/mL, mampu meningkatkan sitotoksisitas
fragmentasi sel yang mengalami apoptosis (Kristiani, 2013). Kandungan senyawa selain brazilein yang terdapat pada fraksi etil asetat adalah senyawa sappanchalcone yang bersifat estrogenik sehingga dapat menurunkan efek sitotoksik melalui meningkatkan proliferasi sel kanker payudara T47D yang terekspresi esterogen receptor (ER) (Lai et al., 2011). Oleh karena itu, penelusuran potensi ekstrak secang selanjutnya adalah dengan melakukan fraksinasi untuk mendapatkan fraksi yang mengandung senyawa brazilein dan tidak mengandung senyawa bersifat estrogenik.
Fraksi brazilein secang (FBS) koleksi CCRC Farmasi UGM yang diperoleh dari hasil isolasi yang dilakukan oleh Laksmiani (2013) merupakan fraksi yang teridentifikasi mengandung senyawa brazilein dan kandungan senyawa lain yang lebih sedikit sehingga kemungkinan lebih berpotensi untuk dikembangkan sebagai agen ko-kemoterapi. Pada penelitian ini ingin diketahui potensi aplikasi ko-kemoterapi kanker payudara dengan mengkombinasikan doxorubicin dengan FBS. Pengembangan yang dilakukan pada penelitian ini adalah uji sitotoksik dan uji induksi apoptosis FBS dan kombinasinya dengan doxorubicin pada sel kanker payudara T47D, serta uji penambatan molekul senyawa brazilein dan brazilin pada caspase 3 untuk memprediksi potensi senyawa dalam FBS dalam mekanisme apoptosis. Hasil penelitian ini diharapkan dapat menjadi acuan bagi penelitian lebih lanjut untuk mengembangkan FBS pada strategi ko-kemoterapi kanker payudara.
B. Rumusan Masalah
1. Apakah FBS dapat meningkatkan sitotoksisitas doxorubicin pada sel kanker payudara T47D?
2. Bagaimana pengaruh kombinasi doxorubicin dan FBS terhadap induksi apoptosis pada sel kanker payudara T47D?
3. Bagaimana interaksi senyawa brazilein dan brazilin pada caspase 3?
C. Tujuan Penelitian 1. Tujuan Umum
Mengeksplorasi bahan alam yang berpotensi sebagai agen ko-kemoterapi kanker payudara.
2. Tujuan Khusus
a. Mengetahui kemampuan FBS dalam meningkatkan aktivitas sitotoksik doxorubicin dalam kadar kombinasi yang efektif.
b. Mengetahui pengaruh FBS dan kombinasinya dengan doxorubicin terhadap induksi apoptosis pada sel kanker payudara T47D.
c. Mengetahui interaksi senyawa brazilein dan brazilin pada caspase 3.
D. Pentingnya Penelitian Dilakukan
Penelitian ini diusulkan untuk mengeksplorasi bahan alam yang berpotensi dalam usaha penanganan kanker, terutama terkait dengan permasalahan resistensi dan munculnya efek samping agen kemoterapi doxorubicin. Hasil
penelitian ini akan sangat bermanfaat untuk menambah data ilmiah yang valid mengenai potensi FBS pada strategi ko-kemoterapi sel kanker payudara sehingga dapat dipublikasikan menjadi sebuah artikel dalam jurnal ilmiah serta menjadi sumber data yang bermanfaat bagi pengembangan penelitian selanjutnya.
E. Tinjauan Pustaka
1. Kanker dan Kanker Payudara
Kanker merupakan suatu penyakit yang ditandai dengan adanya abnormalitas pada regulasi pertumbuhan sel dan menyebabkan sel dapat berinvasi ke jaringan dan menyebar ke organ yang lain. Sel kanker dapat meneruskan sinyal proliferasi sel, menghindari sinyal penekan pertumbuhan, mengaktifkan proses invasi dan metastasis, dapat mereplikasi diri terus menerus, menginduksi angiogenesis, dan menentang proses kematian sel (Hanahan and Weinberg, 2011).
Kanker payudara adalah tumor ganas (karsinoma) yang tumbuh di dalam payudara. Insidensi kanker payudara pada wanita lebih banyak dibanding pria dengan perbandingan pria terkena kanker payudara hanya 1:100 dibanding wanita (King, 2000). Faktor utama penyebab adanya risiko kanker payudara adalah usia dari pasien. Risiko kanker payudara semakin meningkat dengan adanya beberapa faktor lain seperti, mutasi pada gen BRCA1 dan BRCA2, silsilah keluarga penderita kanker payudara, adanya hiperplasia pada uji biopsi,
dan adanya riwayat pengobatan menggunakan radiasi dosis tinggi (Chen et al., 2007; Worsham et al., 2009; Ma et al., 2008). Faktor lain yang turut mempengaruhi resiko kanker payudara adalah, durasi menstruasi yang lama, penggunaan kontrasepsi oral, dan adanya kelahiran anak pertama ketika ibu berusia diatas 30 tahun (Hulka et al., 2001).
Mekanisme molekuler yang berperan dalam kanker payudara adalah mutasi pada onkogen c-myc, ERBB2 dan Ras (Ruddon, 2007), maupun mutasi pada gen p53 (Ruddon, 2007). p53 merupakan tumor supressor gene yang merupakan sensor dari cellular stress dan merupakan faktor penting dalam apoptosis (Van Dyke, 2007; Foster, 2008). Selain dipengaruhi oleh p53, protein caspase, dan survivin juga ikut berperan dalam proses terjadinya apoptosis (King and Robins, 2006). Hormon yang paling berperan pada dalam karsinogenesis kanker payudara adalah estrogen. Interaksi estrogen pada esterogen receptor (ER) dapat menstimulasi sinyal transduksi yang menyebabkan proliferasi sel dan penghambatan apoptosis. ERα pada sel payudara adalah yang paling dominan sehingga salah satu pengobatan kanker khususnya kanker payudara adalah dengan menghambat aktivitas estrogen pada reseptor tersebut (Foster et al., 2001).
2. Sel T47D
Sel kultur T47D (Gambar 1) merupakan model sel kanker payudara yang sering digunakan pada penelitian. Sel T47D diperoleh dari jaringan payudara seorang wanita berumur 54 tahun yang menderita infiltrating ductal
carcinoma. Sel ini mempunyai morfologi seperti sel epitelial dan memiliki doubling time 32 jam (ATCC, 2005).
Sel T47D bersifat ER positif dan merupakan sel kanker yang mengekspresikan caspase 3 wild type, caspase 7 wild type, serta p53 termutasi (Schafer et al., 2000). Adanya ER pada sel T47D menyebabkan sel ini sensitif terhadap doxorubicin (Zampieri et al., 2002). Interaksi estradiol dengan ER dapat meregulasi ekspresi P-glikoprotein (P-gp) yang dapat menyebabkan resistensi doxorubicin. Sel T47D memiliki karakter adanya mutasi posisi 194 pada tumor supressor gene p53 berupa missence mutation yang menyebabkan terjadi pengurangan respon terhadap agen yang menginduksi apoptosis (Crawford and Bowen, 2002). Sel kanker payudara lain yang sering digunakan antara lain MCF-7 (ER+, p53 wild type) dan MDA-MB-231 (ER-, p53 mutan).
3. Ko-kemoterapi
Ko-kemoterapi merupakan aplikasi kombinasi terapi kanker, di mana kombinasi dapat berupa sinergis, aditif, dan antagonis (Zhao et al., 2004;
Reynolds and Maurer, 2005). Kombinasi tersebut memungkinkan penggunaan obat dosis rendah dengan aktivitas meningkat, sehingga toksisitas terhadap jaringan normal menurun (Alison, 2004). Pendekatan utama dalam menekan efek samping agen kemoterapi dalam pengatasan kanker adalah penggunaan agen pendamping yang kombinasinya bersifat sinergis. Salah satu alternatif yang berpotensi sebagai agen pendamping adalah bahan alam. Senyawa yang terkandung dalam bahan alam terbukti dapat meningkatkan sensitivitas sel terhadap agen kemoterapi dengan efek samping yang relatif rendah (Sharma et al., 2004; Tyagi et al., 2004). Parameter yang lazim digunakan dalam mengevaluasi karakteristik efikasi kombinasi secara kuantitatif adalah nilai CI (Zhao et al., 2004).
4. Isobologram dan Combination Index (CI)
Pada pengobatan menggunaan strategi kombinasi seperti ko-kemoterapi, evaluasi interaksi obat merupakan satu hal yang penting untuk dilakukan. Interaksi yang terjadi bisa bersifat sinergis, aditif, atau antagonis. Interaksi obat yang sinergis dapat memberikan beberapa efek, diantaranya 1) meningkatkan efektivitas dari efek terapi, 2) mengurangi dosis tetapi meningkatkan atau mempertahankan efikasi yang sama untuk menghindari toksisitas, 3) meminimalkan atau memperlambat perkembangan resistensi obat, dan 4) menyediakan selektif sinergisme terhadap target (atau efikasi sinergisme) versus host (atau toksisitas antagonisme) (Chou, 2006). Efek aditif berarti setiap komponen memiliki kontribusi untuk menghasilkan efek yang sesuai
dengan potensinya sendiri (Chou, 2006; Merlin, 1994). Salah satu model pendekatan evaluasi kombinasi obat adalah model Loewe Additivity. Model Loewe mengasumsikan bahwa obat tidak dapat beriteraksi dengan obat itu sendiri dan menggambarkan hubungan dosis-efek dalam bentuk kurva sigmoid (Zhao, 2004). Tahun 1972 Loewe memperkenalkan pertama kali grafik evaluasi interaksi obat bernama isobologram. Grafik isobologram tersusun atas konsentrasi tunggal masing-masing obat yang membentuk sistem koordinat. Pada grafik tersebut terdapat garis hipotenusa bernama “line of additivity” yang digunakan untuk menentukan adanya interaksi yang aditif, sinergi, atau antagonis (Tallarida, 2006).
Evaluasi interaksi kombinasi obat dengan rasio konsentrasi tetap menggunakan isobologram berdasarkan Zhao et al. (2010) diperoleh dengan cara memplotkan konsentrasi yang memiliki efek tertentu dari masing-masing obat pada sumbu x dan sumbu y dengan titik koordinat (CA, 0) dan (0, CB). Kedua titik tersebut saling dihubungkan membentuk garis hipotenusa yang dinamakan “line of additivity”. Konsentrasi kombinasi 2 obat yang memberikan efek yang sama ditulis dalam satu titik koordinat (cA, cB).
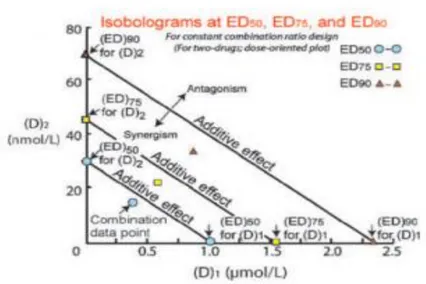
Interaksi obat dikatakan sinergis apabila titik koordinat berada dibawah garis line of additivity, interaksi aditif jika titik koordinat berada di garis line of additivity, sedangkan interaksi antagonis jika titik koordinat berada diatas garis line of additivity (Gambar 2).
Gambar 2. Plot isobologram untuk rasio konsentrasi kombinasi tetap (Chou, 2010).
Konsentrasi obat A (CA) dan obat B (CB) dengan efek tertentu diplotkan pada titik koordinat (CA,0) dan (CB,0). Pada kedua titik tersebut dihubungkan dengan garis hipotenusa bernama “line
of additivity”. Kombinasi kedua obat yang memberikan efek sama ditulis dalam satu titik
koordinat (cA, cB). Kombinasi bersifat sinergis apabila (cA, cB)berada dibawah garis line of additivity, kombinasi bersifat aditif apabila (cA, cB) tepat berada digaris line of additivity,
sedangkan kombinasi bersifat antagonis apabila (cA, cB) berada diatas garis line of additivity
CI secara kuantitatif mengevaluasi sifat interaksi obat dan didefinisikan dengan persamaan berikut:
Pembilang (D)1 dan (D)2 adalah dosis masing-masing obat dalam
campuran tertentu yang berasal dari fa yang sama. Penyebut (Dx)1 dan (Dx)2
adalah konsentrasi senyawa uji yang diperlukan untuk mencapai efek dengan tingkat tertentu (fa). Evaluasi kombinasi diperoleh dengan membuat grafik plot
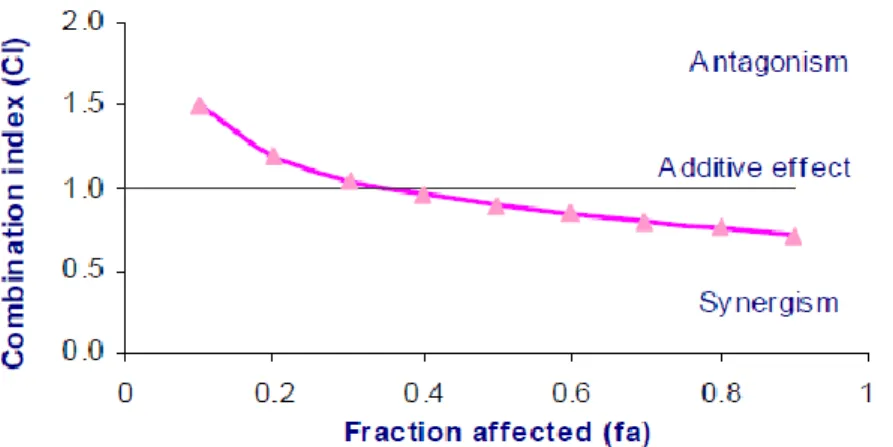
hubungan fa-CI. Kombinasi bersifat sinergis apabila CI<1, bersifat aditif apabila CI=1, dan bersifat antagonis apabila CI>1 (Gambar 3).
Gambar 3. Grafik plot fa-CI (Pinto et al., 2011). Interaksi menunjukkan sinergis (CI<1), aditif
(CI=1), dan antagonis (CI>1).
5. Apoptosis
Kematian sel merupakan suatu proses normal yang mempunyai dua fungsi, yaitu perbaikan jaringan dan pelepasan sel rusak yang mungkin membahayakan tubuh (De Vita et al., 2011). Proses kematian sel terdiri dari dua macam yaitu nekrosis dan apoptosis. Nekrosis terjadi ketika sel terpapar patogen, zat kimia atau tekanan fisik yang berpengaruh terhadap membran sel (De Vita et al., 2011). Sedangkan, apoptosis merupakan proses bunuh diri suatu sel yang terprogram. Apoptosis diperlukan apabila sel sudah tidak memungkinkan untuk berkembang karena adanya kerusakan yang tidak dapat diperbaiki atau adanya regenerasi sel muda (Alberts, 2008). Induksi Apoptosis dipengaruhi oleh beberapa faktor antara lain kerusakan DNA, kekurangan faktor pertumbuhan (FGF, EGF, PDGF) dan penggunaaan obat kemoterapi (King, 2000).
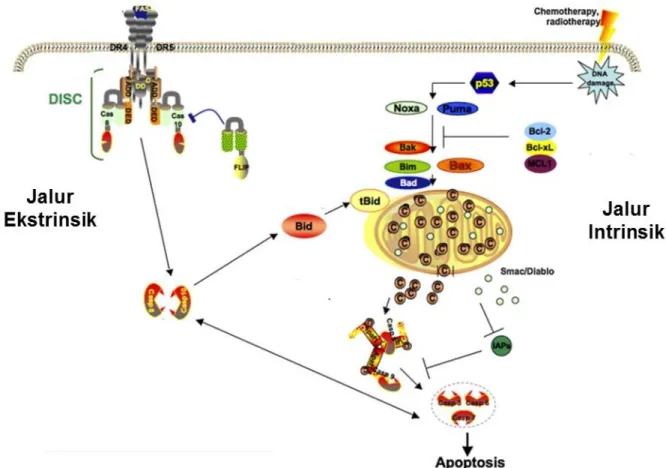
Apoptosis terjadi melalui 2 jalur utama, yaitu ekstrinsik dan intrinsik (Gambar 4). Jalur intrinsik menjadi target blokade tumorigenesis (Hanahan and
Weinberg, 2011). Jalur ini disebut juga jalur mitokondria dan aktivasinya bergantung pada keseimbangan aktivitas protein pro dan anti apoptosis dari famili Bcl-2 (Vogler et al., 2009). Pada aktivasi jalur intrinsik, protein p53 berperan sebagai detektor terjadinya cellular stress. Aktivasi protein p53 mampu menginisiasi apoptosis dengan aktivasi protein famili Bcl-2 Puma dan Noxa. Kedua protein tersebut mengaktivasi protein multidomain Bax atau Bak, yang kemudian masuk bax atu bak tersebut masuk ke dalam mitokondria dan menyebabkan pelepasan sitokrom C (Reuter et al., 2008). Aktivasi Bax dan bak oleh Puma dan Noxa diregulasi oleh protein antiapoptosis Bcl-2, Bcl-xL, MCL1. Sitokrom C yang terlepas akan membentuk kompleks dengan yang akan membentuk kompleks dengan Apaf-1 sehingga terbentuklah trimer Apaf-1/sitokrom C/procaspase 9 yang disebut apoptosom. Apoptosom ini menginduksi aktivasi procaspase 9 menjadi caspase 9. Cysteine Aspartyl Specific Protease-9 (Caspase 9) selanjutnya mengaktivasi caspase yang lain seperti caspase 3 dan 7, lalu caspase 3 akan menginisiasi apoptosis melalui aktivasi caspase-activated DNAse (CAD, DNA fragmentation factor) dengan jalan melepaskannya dari inhibitor CAD sehingga akan terjadi fragmentasi DNA. Berbagai protetin seluler seperti PARP, laminin, dan β-lactin juga didegradasi oleh caspase (Jaeschke and Bajt, 2006).
Jalur ekstrinsik terjadi karena adanya ikatan antara ligan penginduksi kematian sel dengan reseptor kematiannya. Aktivasi reseptor tersebut mengakibatkan domain sitoplasmik dari reseptor kematian ini akan mengikat protein adaptor Fas-associated death domain (FADD), kemudian membentuk
kompleks bernama death-inducing signaling complex (DISC) (Ricci and Zong, 2006; Ashkenazi, 2002). Kompleks DISC tersebut akan menginisiasi pengaktifan pro-caspase 8 yang dapat mengaktifkan cysteine aspartyl specific protease-8 (caspase 8). Caspase 8 selanjutnya mengaktivasi Bid dan berinteraksi dengan jalur intrinsik atau langsung mengaktivasi caspase 3 untuk menginisiasi apoptosis sel (Reuter et al., 2008).
Gambar 4. Jalur intrinsik dan ekstrinsik pada mekanisme apoptosis (Reuter et al., 2008).
Mekanisme apoptosis melalui jalur intrinsik terjadi akibat adanya celluler stress yang memacu p53 untuk mentranskripsi beberapa protein pro-apoptosis seperti Bax/Bid. Bax/Bid ini lalu berikatan dengan membran luar mitokondria dan mengakibatkan pelepasan sitokrom c yang membentuk apoptosom serta mengaktivasi caspase 3 untuk menginisiasi apoptosis. Mekanisme
apoptosis melalui jalur ekstrinsik diinduksi oleh aktivasi reseptor kematian yang kemudian membentuk kompleks DISC dan mengaktifkan caspase 8. Aktivasi caspase 8 dapat mengtifkan bid yang melanjutkan mekanisme apoptosis melalui jalur intrinsik atau mengaktivasi caspase 3
untuk menginisiasi apoptosis.
6. Deteksi Apoptosis dengan Flow Cytometry Annexin V
Flow cytometry merupakan teknologi yang secara simultan mampu menghitung dan mengkarakterisasi berbagai macam sifat fisika dari partikel tunggal (biasanya sel). Flow cytometry dapat menganalisis suspensi partikel atau sel dengan dari ukuran 0,2-150 µm. Prinsip kerja flow cytometry adalah setiap sel akan dialirkan dalam sistem fluida, lalu ditembak dengan sinar laser, kemudian disebarkan oleh setiap sel. Selain itu, sinar laser tersebut juga dapat mengaktivasi senyawa fluoresen yang terdapat dalam sel. Setiap sinyal sinar yang disebarkan maupun yang difluoresensikan akan diubah menjadi impuls elektrik sehingga dapat terdeteksi dan tersimpan sebagai data di dalam komputer. Flow cytometry dapat digunakan untuk deteksi adanya perubahan morfologi sel yang mengalami apoptosis menggunakan nuclear staining dan mampu menghitung jumlah sel yang mengalami apoptosis menggunakan flow cytometry Annexin V (Koopman et al., 1994).
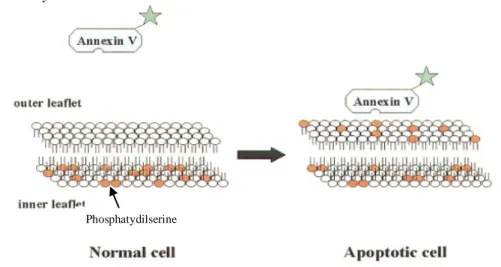
Apoptosis merupakan mekanisme kematian sel yang terprogram dan terjadi secara alami pada sel yang abnormal atau mengalami penbelahan yang berlebihan (Cohen, 1991). Pada tahap awal apoptosis terjadi perubahan pada permukaan sel, yaitu adanya translokasi phosphatidylserine (PS) dari bagian dalam membran plasma menjadi berada di bagian luar membran plasma sehingga melingkupi seluruh bagian permukaan sel (Vermes et al., 1995).
Annexin V adalah Ca2+-dependent phospholipid-binding protein dengan ukuran 35-36 kDa yang mempunyai afinitas tinggi terhadap PS. Annexin V akan berikatan dengan PS yang telah mengalami translokasi sehingga berada
Phosphatydilserine
pada permukaan sel yang mengalami apoptosis (Gambar 5) (Casciola-Rosen et al., 1996; van Engeland et al., 1996; Vermes et al., 1995). Annexin V dapat dikonjugasikan dengan fluorochromes dan berfungsi sebagai probe yang sensitif untuk analisis sel yang mengalami apoptosis menggunakan flow cytometry.
Gambar 5. Skema perubahan asimetri membran pada sel yang mengalami apoptosis (van
Engeland et al., 1998). Pada sel yang apoptosis, phosphatydilserine akan terekspos di bagian membran dan berinteraksi dengan Annexin V.
Pewarnaan dengan Annexin V biasanya digunakan bersamaan dengan pewarna propidium iodida (PI) yang dapat mewarnai sel dengan cara berinterkalasi dengan DNA, sehingga dapat digunakan untuk mengidentifikasi sel yang mengalami apoptosis awal atau akhir. Sel hidup (viable cells) mempunyai membran yang utuh sehingga PI tidak dapat melewati membran sebaliknya, PI dapat menembus membran dan berinterkalasi dengan DNA dan mewarnai sel pada membran sel yang mati dan rusak. Oleh karena itu, sel-sel yang hidup bersifat Annexin V dan PI negatif, sedangkan sel-sel-sel-sel yang mengalami apoptosis awal bersifat Annexin V positif dan negatif PI, dan
sel-sel yang mengalami apoptosis akhir atau sudah mati bersifat Annexin V dan PI positif (Hingorani et al., 2011).
7. Penambatan Molekul atau Molecular Docking
Molecular docking atau penambatan molekul merupakan metode komputasi yang mampu memperkirakan interaksi suatu senyawa dengan protein melalui jalur energi terendah (Nadendla, 2004). PLANTS adalah program aplikasi penambatan molekul berdasarkan algoritma Ant Colony Optimization (ACO) (Korb et al., 2006). Software ini sederhana dan mudah diaplikasikan, namun PLANTS tidak menyediakan fungsi preparasi protein, ligan, maupun visualisasi (Purnomo, 2011). PLANTS tidak memiliki aplikasi untuk Windows, sehingga hanya bisa dijalankan dengan LINUX. Penggunaan PLANTS dengan Windows memerlukan Co-Pendrivelinux-KDE (suatu software untuk hibridisasi LINUX dalam Windows), YASARA (untuk visualisasi dan preparasi protein), serta ChemSketch (untuk preparasi senyawa atau ligan yang akan di-docking-kan dengan protein target). Hasil dari PLANTS adalah skor docking yang menunjukkan potensi interaksi ligan terhadap protein target. Senyawa yang memiliki skor docking terendah merupakan ligan dengan konformasi terbaik pada protein target (Purnomo, 2011).
8. Doxorubicin
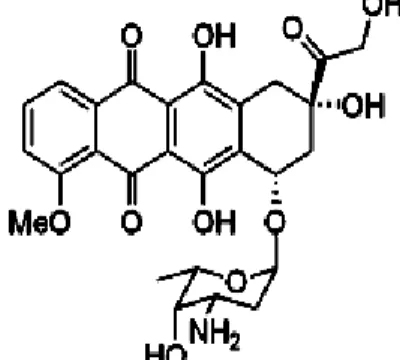
Doxorubicin (Gambar 6) merupakan obat golongan antibiotik antrasiklin dengan nama dagang Adriamycin® yang digunakan dalam terapi berbagai jenis kanker. Obat ini memicu kerusakan DNA, dengan mekanisme pengikatan DNA sel kanker dan pengeblokan topoisomerase II, sehingga DNA kusut dan sel kanker tidak dapat membelah (Potter et al., 2002). Mekanisme tersebut umumnya membutuhkan p53 untuk menginduksi apoptosis dan menghambat siklus sel (Drummond, 2007).
Gambar 6. Struktur kimia doxorubicin (Chen et al., 2006)
Permasalahan dalam terapi kanker menggunakan doxorubicin adalah timbulnya efek samping dan terjadinya resistensi. Di samping bersifat toksik pada sel kanker, senyawa ini juga toksik pada jaringan normal. Efek samping yang timbul segera setelah pengobatan adalah rasa mual, aritmia reversibel, serta terjadinya imunosupresi. Doxorubicin juga bersifat kardiotoksik akibat terbentuknya Reactive Oxygen Species (ROS), meningkatnya kadar anion superoksida, dan penurunan ATP. Hal tersebut menyebabkan terjadi perlukaan pada jaringan, sehingga terapi dalam jangka waktu lama menimbulkan efek samping kardiomiopati yang diikuti dengan gagal jantung (Tyagi et al., 2004). Kardiotoksisitas doxorubicin bersifat dose dependent (Wattanapitayakul et al.,
2005). Uji klinis fase III menunjukkan bahwa penderita kanker payudara dengan mutasi p53 lebih resisten terhadap doxorubicin jika dibandingkan dengan penderita kanker payudara tanpa mutasi p53 (Di Leo et al., 2007).
9. Tanaman Secang (Caesalpinia sappan L.)
a. Klasifikasi tanaman secang
Kayu secang (Caesalpinia sappan L.) (Gambar 7) banyak dijumpai di kawasan Asia Tenggara, termasuk Indonesia (Wicaksono et al., 2008). Sinonim secang adalah Bianca sappan (L) serta memiliki beberapa nama lokal Sappanwood, Indian redwood (Inggris); Sappan, bresillet des Indes (Prancis); Secang, Kayu Secang, soga jawa (Indonesia); Sapang (Malaysia) (Verheij and Coronel, 1992).
Morfologi dan klasifikasi tanaman: Kingdom : Plantae Divisi : Magnoliphyta Kelas : Magnoliphyta Ordo : Fabales Famili : Caesalpiniaceae Genus : Caesalpinia
Species : Caesalpinia Sappan L.
(Backer and Van Den Brink, 1965)
Tanaman ini berbentuk perdu atau pohon kecil, tinggi 5-10 m, batang dan percabangannya berduri tempel yang bentuknya bengkok dan letaknya
tersebar. Batang bulat dan berwarna hijau kecoklatan. Daun majemuk, menyirip ganda, panjang 25-40 cm, jumlah anak daun 10-20 pasang yang letaknya berhadapan. Anak daun tidak bertangkai, bentuknya lonjong, pangkal rompang, ujung bulat, tepi rata dan hampir sejajar, panjang 10-25 mm, lebar 3-11 mm, berwarna hijau. Bunganya bunga majemuk berbentuk malai, keluar dari ujung tangkai dengan panjang 10-40 cm, mahkota bentuk tabung, berwarna kuning (Verheij and Coronel, 1992).
(a) (b) (c)
Gambar 7. Tanaman secang (Caesalpinia sappan L.) (Badami et al., 2004; Foto pribadi diambil
di koleksi tanaman B2P2TOOT). Tanaman secang (a); Bunga secang (b); Kulit kayu secang (c)
b. Penelitian terdahulu
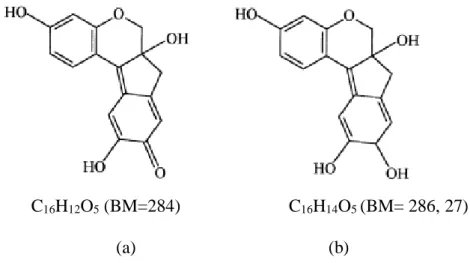
Kulit kayu secang mengandung senyawa komponen fenolik yang dibagi menjadi khalkon, protosapanin, homoisoflavonoid, zat warna brazilin, dan brazilein (Lin et al., 2008). Senyawa brazilin (Gambar 8a) dan brazilein (Gambar 8b) diketahui sebagai senyawa kandungan secang yang berperan pada aktivitas kemopreventif, hepatoprotektif, imunostimulan, antiinflamasi, dan analgesik (Xie et al., 2000).
C16H12O5 (BM=284) C16H14O5 (BM= 286, 27)
(a) (b)
Gambar 8. Struktur kimia brazilein (a) dan brazilin (b) (Oliveira et al., 2012; pubchem compound, 2014).
Aktivitas sitotoksik isolat brazilein dan brazilin telah teruji pada sel Hep G2 dan Hep 3b (hati), MDA-MB-231 dan MCF-7 (payudara), A549 (paru-paru), dan Ca9-22 (mulut) dengan nilai IC50 antara 2-15 μg/ml (Yen et al.,
2010). Brazilin secara dose-dependent dapat menginduksi apoptosis pada sel glioma dan menurunkan ekspresi pro-caspase 3 dan pro-caspase 7 pada sel glioma U87 yang artinya adanya aktivasi caspase 3 dan caspase 7 (Lee et al., 2013). Pada proses apoptosis, caspase 3 dan caspase 7 berperan sebagai eksekutor sehingga sel mengalami apoptosis (Reuter et al.2008). Brazilin juga dapat menginduksi apoptosis pada sel multiple myeloma (MM) U266 yang ditunjukkan dengan adanya peningkatan ekspresi caspase 3, dan penurunan beberapa protein anti-apoptosis seperti, Bcl-xL dan Bcl-2 (Kim et al., 2012).
Mekanisme penghambatan proliferasi brazilein pada sel MCF-7 adalah melalui aktivasi GSK-3β, penurunan β-Catenin dan cyclin D1, sehingga sel
mengalami penumpukan pada fase G1 (Tao et al., 2013). Brazilein dapat menurunkan ekspresi mRNA survivin, diikuti aktivasi caspase, induksi apoptosis, dan penghambatan pertumbuhan pada sel kanker hati Hep G2 (Zhong et al, 2009). Survivin merupakan protein yang berperan pada regulasi kematian sel, perkembangan siklus sel, dan divisi sel (Fortugno et al., 2002; Altieri, 2003). Pada jalur siklus sel, survivin terlibat dalam resistensi apoptosis dengan menghambat aktivasi caspase 7 dan caspase 3 (Blanc et al., 2003).
9. Fraksi Brazilein Secang
Fraksi brazilein secang diperoleh dari ekstrak metanolik serbuk secang yang telah dipartisi dengan n-heksan dan etil asetat, kemudian difraksinasi menggunakan kromatografi kolom dengan komposisi eluen klorofrom:etil asetat: (40:60 v/v). Fraksi tersebut berupa cairan berwarna kuning dan akan berwarna merah kegelapan ketika diuapkan menjadi bentuk serbuk kristal padatan. Hasil KLT fraksi tersebut menggunakan fase diam silika gel F254 dan fase gerak kloroform:metanol:asam asetat (5:1:1 v/v) diperoleh spot pada hRf 40;55;65. Pada spot hRf 65 dengan ciri warna merah dan tebal telah dilakukan isolasi dan elusidasi oleh Laksmiani (2013). Hasil elusidasi menunjukkan bahwa spot tersebut merupakan senyawa brazilein, sehingga pada penggunaannya fraksi tersebut dinamakan fraksi brazilein secang (FBS). FBS disimpan dalam wadah tertutup rapat, terlindungi dari cahaya, dan dalam suhu 4oC. FBS memiliki kandungan senyawa yang lebih sedikit dibanding ekstrak
F. Landasan Teori
FBS merupakan hasil fraksinasi ekstrak metanol secang yang teridentifikasi mengandung senyawa brazilein. FBS memiliki kandungan senyawa lain yang lebih sedikit dibanding ekstrak metanol, ekstrak etanol, dan fraksi etil asetat. Penelitian sebelumnya telah membuktikan bahwa senyawa brazilein dan brazilin mempunyai efek sitotoksik terhadap beberapa jenis sel kanker diantaranya sel Hep G2, Hep 3b, MDA-MB-231, MCF-7, A549, dan Ca9-22. Oleh karena itu, diduga FBS juga mempunyai efek sitotoksik pada sel T47D.
Doxorubicin merupakan agen kemoterapi golongan antibiotik antrasiklin yang sering digunakan untuk kemoterapi kanker payudara, namun penggunaan doxorubicin telah banyak menimbulkan masalah diantaranya, menurunnya efektivitas akibat munculnya resistensi dan adanya potensi munculnya efek samping. Beberapa ekstrak secang yang mengandung komponen senyawa brazilein telah terbukti mampu meningkatkan sitotoksisitas doxorubicin. Oleh karena itu, pemberian FBS yang memiliki kandungan brazilein dan senyawa lain yang lebih sedikit diprediksi juga dapat meningkatkan sitotoksisitas doxorubicin terhadap sel kanker payudara T47D.
Peningkatan sitotosisitas doxorubicin dapat terjadi melalui induksi apoptosis pada sel kanker. Ekstrak metanol, etanol, dan fraksi etil asetat secang mampu meningkatkan induksi apoptosis sel T47D baik secara tunggal maupun kombinasi dengan doxorubicin. Senyawa brazilein dapat menginduksi
apoptosis melalui jalur penurunan ekspresi mRNA survivin yang diikuti dengan aktivasi caspase. Oleh karena itu, FBS maupun kombinasinya dengan doxorubicin diprediksi dapat menginduksi apoptosis melalui interaksi senyawa brazilein dengan caspase 3 secara komputasi pada uji penambatan molekul.
G. Hipotesis
1. FBS dapat meningkatkan efek sitotoksik doxorubicin pada sel kanker payudara T47D.
2. FBS dan kombinasinya dengan doxorubicin dapat menginduksi apoptosis pada sel kanker payudara T47D.
3. Senyawa brazilein dan brazilin dapat berinteraksi dengan caspase 3 secara komputasi pada uji penambatan molekul.