Reproduksibilitas Teknik
Terminal Restriction Fragment Length
Polymorphism
Untuk Analisis Komunitas Bakteri
Reproducibility of Terminal Restriction Fragment Length
Polymorphism Technique for Bacterial Community Analysis
LUKAS ARDITYA MULYO
Fakultas Teknobiologi, Universitas Katolik Indonesia Atma Jaya, Jalan Jenderal Sudirman 51, Jakarta 12930
Abstrak. Teknik T-RFLP banyak digunakan untuk analisis komunitas bakteri. Oleh karena itu, perlu diuji tingkat sensitivitas dan reproduksibilitas teknik ini untuk mencari upaya yang dapat dilakukan dalam mengatasi masalah yang ada, seperti pembentukan pseudo T-RF dan konsistensi teknik ini. Hasil analisis T-RFLP (in vitro) dibandingkan kesesuaiannya dengan hasil analisis in silico. Penelitian ini menggunakan empat isolat genom bakteri kontrol antara lain Escherichia coli, Pseudomonas sp., P. stutzeri, dan P. aeruginosa. Dilakukan perbandingan antara jumlah siklus PCR, yaitu 26 atau 20 siklus, serta pengaruh tahap pemberian enzim Mung bean nuclease. Hasil analisis yang lebih baik dicapai dengan penggunaan 26 siklus, penambahan mung bean setelah digesti restriksi, dan peningkatan waktu injeksi sampel. Terdapat pergeseran ukuran T-RF antara in vitro dan in silico dari -1.55 hingga -7.37 basa dengan rata-rata -3.53 basa.
Kata kunci : analisis komunitas bakteri, T-RFLP, reproduksibilitas
Abstract. T-RFLP technique is widely used for bacterial community analysis. Therefore, sensitivity and reproducibility test is needed to find a way to solve the problems within this technique, such as pseudo T-RF formation and T-T-RFLP’s consistency. T-T-RFLP analysis results (in vitro) were compared to in silico analysis. This study used four bacterial genome isolates as control, namely Escherichia coli, Pseudomonas sp., P. stutzeri, and P. aeruginosa. Comparison was carried out in PCR cycle number effect, between 26 and 20 cycles, and the effect of mung bean nuclease digestion step. Better analysis results were achieved by 26 PCR cycles, addition of mung bean nuclease after restriction, and by increasing sample injection time. There is T-RF drift factor between in vitro and in silico from -1.55 up to -7.37 base with an average of -3.53 base.
Key words : bacterial community analysis, T-RFLP, reproducibility
PENDAHULUAN
Teknik Terminal Restriction Fragment Length Polymorphism (T-RFLP) adalah teknik untuk menganalisis komunitas bakteri yang pertama kali dideskripsikan oleh Liu et al. (1997). Teknik ini dapat digunakan untuk mengamati keragaman, struktur, dan dinamika dari populasi mikrob (Kitts 2001). T-RFLP banyak digunakan karena produksi dan analisis data yang cepat dan akurat serta merupakan metode yang efektif untuk membedakan komunitas mikrob pada sampel lingkungan yang kisarannya luas (Dunbar et al. 2001, Kitts 2001). T-RFLP menawarkan beberapa keuntungan dibandingkan metode sidik jari genetik lain, seperti memberikan hasil ulangan yang sama (Osborn et al. 2000), resolusi yang lebih tinggi (Marsh 1999), serta lebih sensitif daripada teknik DGGE (Moeseneder et al. 1999).
Di lain pihak, terdapat beberapa masalah yang dapat mempengaruhi reproduksibilitas dari hasil analisis menggunakan teknik T-RFLP, seperti pembentukan fragmen restriksi terminal (T-RF) palsu yang disebut juga
pseudo T-RF (Egert & Friedrich 2003) dan perbedaan antara panjang T-RF sebenarnya dengan yang diamati yang disebut juga T-RF drift (Kaplan & Kitts 2003), yang selanjutnya akan diamati pada penelitian ini.
Penelitian ini bertujuan untuk mengetahui reproduksibilitas hasil analisis teknik T-RFLP, tahap pemberian enzim nuklease mung bean yang tepat dan jumlah siklus yang optimal untuk mengatasi pembentukan pseudo T-RF.
TINJAUAN PUSTAKA
Teknik sidik jari Terminal Restriction Fragment Length Polymorphism (T-RFLP) adalah perangkat yang penting dalam ekologi mikrob (Marsh et al. 1998). Teknik ini dapat digunakan untuk mengamati keragaman, struktur, dan dinamika dari populasi mikrob dengan metode statistik yang mencukupi (Kitts 2001).
Sidik jari T-RFLP menggunakan prinsip amplifikasi PCR terhadap campuran gen yang mewakili mikroorganisme berbeda pada ekstrak asam nukleat dari lingkungan Seringkali, small-subunit (SSU) gen rRNA
2
digunakan sebagai markter filogenetik, danpenggunaan T-RFLP untuk menginvestigasi kisaran luas dari berbagai kelompok pada ekosistem alami telah dilakukan, meliputi bakteri (Liu et al. 1997, Moeseneder et al. 1999), eukariot (Marsh et al. 1998), dan archaea (Moeseneder et al. 2001). Pada penelitian yang dilakukan, gen yang diamplifikasi adalah gen penyandi 16S (SSU) rRNA atau yang disebut juga 16S rDNA.
Secara umum, analisis T-RFLP melibatkan amplifikasi gen target dari ekstrak DNA komunitas dengan pasangan primer spesifik,
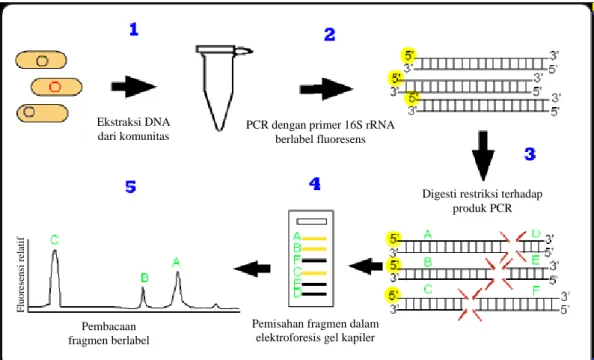
yang satu atau keduanya dilabel dengan fluoresens. Oleh karena itu, fragmen hasil pemotongan enzim restriksi dapat dipisahkan dan dikenali dengan elektroforesis pada mesin sekuensing, di mana hanya fragmen ujung terlabel saja yang dideteksi dan dikuantifikasi. Fragmen ujung tersebut dapat diduga sebagai kehadiran spesies tertentu berdasarkan pencarian in silico terhadap situs restriksi yang sama dari sumber yang diketahui (Egert & Friedrich 2003). Pada Gambar 1 akan diilustrasikan prosedur dari metode ini.
Gambar 1 Ilustrasi prosedur kerja metode T-RFLP (Grüntzig et al. 2002).
Pada teknik T-RFLP, primer yang digunakan memiliki molekul fluorescent yang menempel pada ujung 5’ primer sehingga akan dihasilkan amplikon dengan label pada bagian terminal. Ujung amplikon dengan pewarna 6-carboxylfluorescein (6-FAM) akan dikenali sebagai warna biru pada alat deteksi laser dan menghasilkan puncak biru pada elektroferogram yang dihasilkan analisis GeneScan™, sedangkan amplikon dengan VIC dye akan dikenali sebagai warna hijau (Mroske et al. 2007).
Proses digesti amplikon menggunakan enzim restriksi endonuklease yang umumnya memiliki situs pengenalan tetra-nukleotida atau 4-hitter (Lueders & Friedrich 2003). Penelitian Engebretson & Moyer (2003) melaporkan 4 enzim restriksi endonuklease yang menghasilkan frekuensi tertinggi dalam membedakan populasi tunggal pada model komunitas yang digunakan, yaitu BstUI, DdeI,
Sau96I, dan MspI. Enzim DdeI dan MspI digunakan dalam penelitian ini.
T-RF yang unik yang mewakili Operational Taxonomic Unit (OTU) tertentu dapat digunakan sebagai satuan pengukuran keragaman pada komunitas (Saikaly et al. 2005). T-RF hasil in vitro akan diidentifikasi dengan mencari persamaan hasil pemotongan in silico dalam basis data Microbial Community Analysis (MiCA) 3 pada situs mica.ibest.uidaho.edu (Shyu et al. 2007) dengan keterangan sekuen primer, enzim restriksi, panjang fragmen dan tingkat intensitas. Daftar bakteri terduga dari kedua enzim akan diiris dengan program FragSort 5.0 untuk memisahkan nama bakteri yang muncul pada kedua analisis sampel dengan enzim berbeda.
Teknik T-RFLP merupakan salah satu teknik sidik jari yang menggunakan prinsip PCR sehingga potensi bias dari proses PCR
Ekstraksi DNA dari komunitas
PCR dengan primer 16S rRNA berlabel fluoresens
Digesti restriksi terhadap produk PCR
Pemisahan fragmen dalam elektroforesis gel kapiler Pembacaan fragmen berlabel F luor es ens i re lati f
juga diaplikasikan terhadap teknik ini. Bias karena PCR ini, seperti konsentrasi cetakan DNA, preferensi amplifikasi dari cetakan DNA tertentu (seleksi PCR) (Polz & Cavanaugh 1998), pelekatan kembali cetakan DNA seiring penambahan siklus PCR (Suzuki & Giovannoni 1996) ataupun karena suhu pelekatan (annealing), dan pemilihan DNA polimerase dapat mempengaruhi hasil sidik jari dan harus diperhitungkan dalam interpretasi data (Osborn et al. 2000). Oleh karena itu, interpretasi kuantitatif (intensitas relatif dari puncak yang dihasilkan) dan kualitatif (kehadiran atau tidaknya populasi lain pada sampel) dari data sidik jari ini memerlukan kontrol yang cukup dan hati-hati (Lueders & Friedrich 2003).
Pada penelitian yang dilakukan oleh Egert & Friedrich (2003), dinyatakan bahwa selain T-RF yang diharapkan muncul, terdapat tambahan puncak T-RF sekunder pada analisis T-RFLP terhadap amplikon gen 16S rRNA dengan frekuensi yang tinggi. Puncak ini disebut sebagai ―pseudo T-RF‖ karena juga dapat dideteksi sebagai fragmen dengan ujung yang terlabel pada analisis T-RFLP tetapi tidak merepresentasikan situs pemotongan terminal utama dari analisis data sekuen. Pseudo T-RF juga dapat diidentifikasi pada profil T-RFLP dari kultur murni dan ekstrak DNA lingkungan.
Digesti amplikon dengan enzim mung bean, suatu nuklease spesifik utas tunggal, dalam analisis T-RFLP dapat mengeliminasi keseluruhan pseudo T-RF yang diyakini merupakan amplikon utas tunggal hasil PCR yang membentuk struktur sekunder sendiri sehingga tidak bisa dikenali dan dipotong oleh enzim restriksi. Egert & Friedrich (2003) juga menyatakan bahwa jumlah siklus PCR sebaiknya dibatasi sedikit mungkin karena pembentukan pseudo T-RF meningkat sebanding dengan jumlah siklus. Di lain pihak, penelitian Osborn et al. (2000) menyatakan bahwa tidak terdapat perbedaan signifikan antara jumlah siklus PCR sebanyak 25 dan 35 kali terhadap profil T-RFLP.
Selain faktor PCR, komposisi dari profil T-RFLP dapat dipengaruhi oleh faktor digesti restriksi, seperti digesti parsial produk PCR pada T-RFLP pada kultur murni atau dari sampel lingkungan. Penambahan T-RF tersebut dapat disebabkan oleh digesti tidak sempurna dari amplikon atau heterogenitas sekuen pada cetakan, misalnya beberapa kopi gen 16S rRNA pada satu spesies dengan situs restriksi terminal yang berbeda. Keberadaan profil T-RF tambahan pada hasil pembacaan
dapat mengakibatkan kesalahan interpretasi dan estimasi yang berlebihan dari keragaman mikrob sampel tersebut (Osborn et al. 2000, Egert & Friedrich 2003).
BAHAN DAN METODE
Sampel Bakteri. Sampel yang digunakan adalah kultur bakteri Pseudomonas sp., P. aeruginosa, P. stutzeri, dan Escherichia coli yang merupakan koleksi laboratorium Mikrobiologi Fakultas Teknobiologi, Unika Atma Jaya.
Ekstraksi DNA Genom. Kultur bakteri ditumbuhkan dalam Luria Broth selama ±20 jam. Metode ekstraksi yang digunakan adalah metode ekstraksi DNA menggunakan setil trimetil amonium bromida (CTAB) oleh Murray & Thompson (1980).
Pengurutan Basa 16S rDNA. Disiapkan campuran dengan komposisi sebagai berikut: 12.5 µl DreamTaq™ Green PCR Master Mix dan 11 µl Nuclease Free – Water (Fermentas, Lithuania), primer forward dan reverse masing-masing 0.5 µl (10 pmol/ µl), dan 0.5 µl DNA genom. Pasangan primer yang digunakan yaitu 63f (5’-CAGGCCTAACAC ATGCAAGTC-3’) dan 1387r (5’-GGGCGG WGTGTACAAGGC-3’) yang dilaporkan dan dievaluasi oleh Marchesi et al. (1998). Campuran tersebut diinkubasi pada thermal cycler (GeneAmp PCR system 2400, Perkin Elmer, USA). Reaksi PCR dilakukan sebanyak 25 siklus dengan kondisi pra-denaturasi pada 94oC selama 5 menit, denaturasi pada 94oC selama 30 detik, pelekatan primer pada 55oC selama 30 detik, pemanjangan pada 72oC selama 1 menit, dilanjutkan dengan polimerasi akhir pada 72oC selama 10 menit. Hasil positif dipurifikasi dan disekuensing di Macrogen Inc. (Korea) dengan menggunakan primer 63f, 357f (5’-CCTACGGGAGGC AGCAG-3’), dan 1387r. Ketiga sekuen disejajarkan dan disusun menjadi satu sekuen lengkap yang kemudian diidentifikasi ulang dengan program Basic Local Alignment Search Tool (BLAST) (Altschul et al. 1990) pada http://www.ncbi.nlm.nih.gov/.
Analisis T-RFLP in silico. Ketiga hasil sekuens masing-masing bakteri disusun menjadi sekuen kontig dengan penyejajaran dan dilengkapi sampai dengan sekuen primer. Selanjutnya, masing-masing sekuen didigesti in silico dan dihitung panjang fragmen sebenarnya untuk dibandingkan dengan fragmen in vitro.
PCR T-RFLP. PCR dilakukan duplo dengan mencampurkan 1 µl isolat genom ke
4
dalam 49 µl master mix yang terdiri dari:DreamTaq™ Green PCR Master Mix 25 µl dan Nuclease Free – Water 22 µl (Fermentas, Lithuania), dengan 1 µl primer 63f (10 pmol/µl) yang dilabel dengan
phosphoramidite fluorochrome
6-carboxylfluorescein (5’ 6-FAM–CAGGCCTA ACACATGCAAGTC–3’) dan 1 µl primer 1387r (10 pmol/µl) yang dilabel dengan VIC dye (5’VIC–GGGCGGWGTGTACAAGGC– 3’) (Applied Biosystem, California). Selanjutnya dilakukan PCR pada Thermalcycler (GeneAmp PCR System 2400, PerkinElmer, USA) dengan pre-denaturasi pada 94 oC selama 5 menit, denaturasi pada 94 o
C selama 30 detik, pelekatan primer pada 55 oC selama 30 detik, pemanjangan pada 72 oC selama 1 menit, siklus sebanyak 19 atau 25 kali, dilanjutkan pemanjangan akhir pada suhu 72 oC selama 10 menit, dan disimpan pada suhu 4 oC. Purifikasi dengan pemotongan pita berukuran ±1360 bp dipotong dan dipurifikasi menggunakan QIAquick Gel Extraction Kit (Qiagen, California).
Digesti Amplikon. Sebanyak ±200 ng DNA hasil purifikasi, 2 µl larutan penyangga digesti, 5 U enzim restriksi, dan ddH2O untuk 20 µl reaksi dimasukkan ke dalam tabung mikrosentrifugasi 1.5 ml. Restriksi dilakukan pada suhu 37 oC selama ±16 jam. Amplikon didigesti menggunakan enzim restriksi MspI (5’–C^CGG–3’) atau DdeI (5’–G^TNAG–3’) (New England Biolabs, MA).
Digesti Mung Bean Nuclease. Sebanyak 2 U enzim mung bean nuclease (New England Biolabs, MA) ditambahkan ke dalam campuran sampel, 2.5 µl buffer MB 10×, dan 2.3 µl ddH2O untuk 25 µl reaksi. Digesti dilakukan pada suhu 30 oC selama 1 jam, dilanjutkan dengan presipitasi etanol.
Optimasi T-RFLP. Pengujian pengaruh tahap penambahan enzim nuklease mung bean (MB) dilakukan dengan menggunakan isolat genom Escherichia coli yang di PCR T-RFLP sebanyak 25 siklus dan didigesti dengan enzim DdeI dan MspI. Perlakuan yang diberikan adalah kontrol tanpa MB (kode K), pemberian MB sebelum digesti restriksi (kode I), dan pemberian MB setelah digesti (kode II). Sedangkan pengujian pengaruh siklus PCR menggunakan keempat isolat bakteri dengan perlakuan 26 siklus PCR dan 20 siklus, kemudian didigesti dengan kedua enzim dan digesti dengan MB.
Purifikasi Etanol. Metode presipitasi etanol oleh Sambrook & Russel (2001) digunakan sebagai langkah purifikasi. Hasil
tersebut dikuantifikasi menggunakan alat GeneQuant Pro (Amersham Biosciences, Sweden).
Analisis T-RFLP. Hasil purifikasi dilarutkan dalam 13 µL HiDi™ Formamide (Applied Biosystem, California) dan 0.5 µL standar internal (GeneScan™-500LIZ®; Applied Biosystem). Campuran tersebut didenaturasi pada suhu 96 ºC selama 2 menit. Kemudian sampeldidinginkan di es selama 4 menit dan dielektroforesis pada mesin sekuensing ABI PRISM™ 310 Genetic Analyzer (Applied Biosystem, California). Panjang T-RF dideterminasi menggunakan program GeneScan (Applied Biosystem). Analisisdata menggunakan programFragSort 5.0 (www.oardc.ohio-state.edu/trflpfragsort/ index.php) dengan basis data MiCA (mica.ibest.uidaho.edu/) (Shyu et al. 2007).
Uji Reproduksibilitas. Dicampurkan ±500 ng DNA isolat genom keempat bakteri menghasilkan campuran 100 ng/µl. Dilakukan 6 kali ulangan PCR T-RFLP dengan 1 µl campuran DNA dalam 50 µl reaksi dengan pengaturan 25 siklus PCR. Hasil pemotongan gel dipurifikasi menggunakan QIAEX II Gel Extraction Kit (Qiagen, California). Amplikon didigesti dengan DdeI (5’–G^TNAG–3’) (New England Biolabs, MA) dilanjutkan dengan digesti mung bean, purifikasi etanol, dan analisis T-RFLP.
HASIL
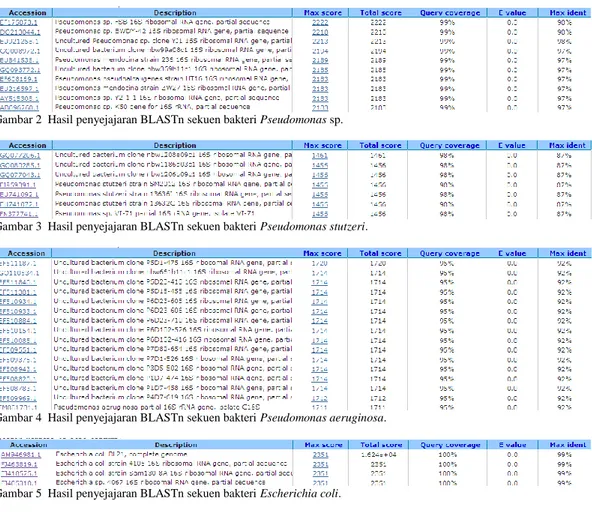
Hasil sekuen keempat bakteri yang sudah digabungkan dan dilengkapi situs restriksi dapat dilihat pada Lampiran 1, Lampiran 2, Lampiran 3, dan Lampiran 4, serta tampilan hasil analisis BLASTn terhadap bakteri sampel Pseudomonas sp. (Gambar 2), Pseudomonas stutzeri (Gambar 3), Pseudomonas aeruginosa (Gambar 4), dan Escherichia coli (Gambar 5).
Analisis GeneScan™ perlakuan tahap penambahan enzim nuklease mung bean terhadap bakteri E. coli terdapat pada Tabel 1 yang merupakan konversi dari elektroferogram pada Gambar 6.
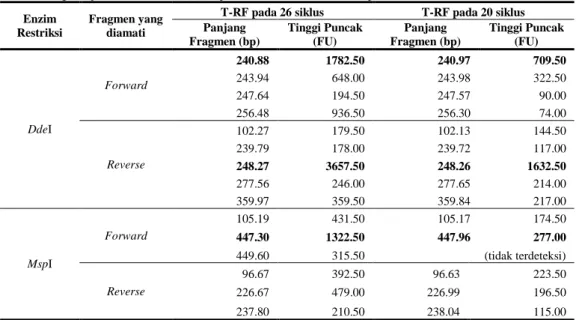
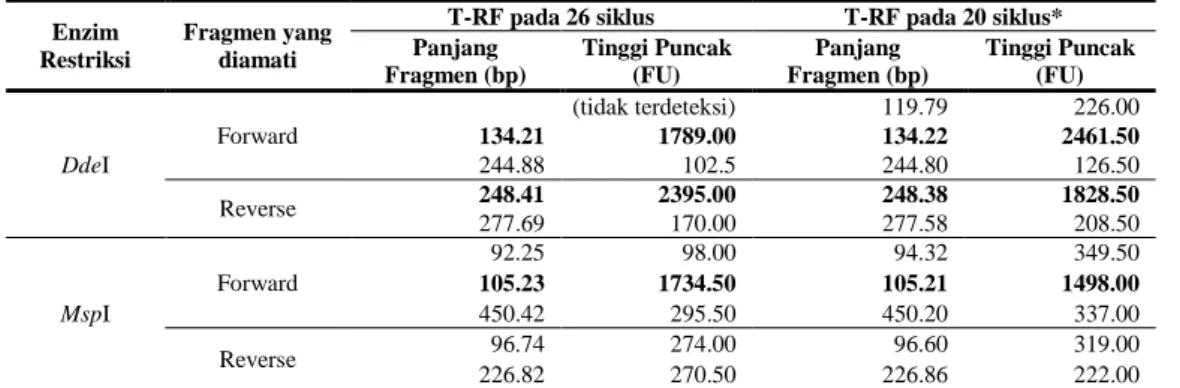
Hasil optimasi variabel jumlah siklus PCR terhadap keempat sampel dapat dilihat pada Tabel 2, Tabel 3, Tabel 4, dan Tabel 5 yang memuat data berupa ukuran relatif T-RF (base pair) beserta tingkat pendarannya atau tinggi puncak (Fluorescence Unit). Tabel tersebut merupakan konversi dari data elektroferogram yang dapat dilihat pada Lampiran 5, Lampiran 6, Lampiran 7, dan Lampiran 8.
Digesti restriksi secara in silico terhadap sekuen lengkap masing-masing bakteri menghasilkan fragmen sebenarnya yang dibandingkan dengan fragmen yang diamati (in vitro)pada Tabel 6.
Program FragSort 5.0 digunakan untuk mengidentifikasi puncak-puncak pada masing-masing profil T-RF forward dari setiap bakteri dan menghasilkan daftar bakteri terduga yang
dapat dilihat pada Gambar 7, Gambar 8, Gambar 9, dan Gambar 10.
Pengulangan analisis T-RFLP sebanyak 6 kali terhadap campuran genom bakteri sebagai perwakilan komunitas dengan menggunakan 25 siklus amplifikasi (PCR) dan pemberian nuklease mung bean setelah restriksi DdeI. Hasil kuantifikasi elektroforesis kapiler ditampilkan pada Tabel 7 yang merupakan keterangan T-RF pada Gambar 3.
Gambar 2 Hasil penyejajaran BLASTn sekuen bakteri Pseudomonas sp.
Gambar 3 Hasil penyejajaran BLASTn sekuen bakteri Pseudomonas stutzeri.
Gambar 4 Hasil penyejajaran BLASTn sekuen bakteri Pseudomonas aeruginosa.
Gambar 5 Hasil penyejajaran BLASTn sekuen bakteri Escherichia coli. Tabel 1 Jumlah dan panjang T-RF pada perbedaan perlakuan nuklease mung bean
Enzim Restriksi
Fragmen yang diamati
Kontrol Perlakuan I Perlakuan II Jumlah T-RF Panjang Fragmen (bp) Jumlah T-RF Panjang Fragmen (bp) Jumlah T-RF Panjang Fragmen (bp) DdeI Forward 3 249, 250, 277 3 249, 250, 277 3 249, 250, 277* Reverse 0 — 0 — 0 — MspI Forward 2 454, TT 0 — 2 454, TT Reverse 6 TT, 97, 260, 264, 409*, TT 0 — 6 TT, 97, 260, 264, 409*, TT Nilai merupakan pembulatan rata-rata dari dua pengulangan. Nilai yang ditebalkan menunjukkan T-RF yang memiliki pendaran tertinggi. *Hanya terdeteksi pada satu dari dua pengulangan. TT = Tidak terdeteksi karena berada di luar batas standar (35–500 bp).
6
Gambar 6 Profil T-RF analisis pengaruh penambahan nuklease mung bean (MB). Perlakuan K, I, dan II diulang dua kali pada masing-masing enzim. Puncak biru merupakan fragmen forward (63f-FAM), sedangkan puncakhijau merupakan fragmen reverse (1387r-VIC).
Tabel 2 Pengaruh jumlah siklus PCR terhadap T-RF bakteri Pseudomonas sp. Enzim
Restriksi
Fragmen yang diamati
T-RF pada 26 siklus T-RF pada 20 siklus Panjang Fragmen (bp) Tinggi Puncak (FU) Panjang Fragmen (bp) Tinggi Puncak (FU) DdeI Forward 240.88 1782.50 240.97 709.50 243.94 648.00 243.98 322.50 247.64 194.50 247.57 90.00 256.48 936.50 256.30 74.00 Reverse 102.27 179.50 102.13 144.50 239.79 178.00 239.72 117.00 248.27 3657.50 248.26 1632.50 277.56 246.00 277.65 214.00 359.97 359.50 359.84 217.00 MspI Forward 105.19 431.50 105.17 174.50 447.30 1322.50 447.96 277.00 449.60 315.50 (tidak terdeteksi) Reverse 96.67 392.50 96.63 223.50 226.67 479.00 226.99 196.50 237.80 210.50 238.04 115.00 Nilai merupakan rata-rata dari dua pengulangan. Nilai yang ditebalkan menunjukkan T-RF yang memiliki pendaran tertinggi.
Tabel 3 Pengaruh jumlah siklus PCR terhadap T-RF bakteri Pseudomonas stutzeri Enzim
Restriksi
Fragmen yang diamati
T-RF pada 26 siklus T-RF pada 20 siklus Panjang Fragmen (bp) Tinggi Puncak (FU) Panjang Fragmen (bp) Tinggi Puncak (FU) DdeI Forward 244.49 309.00 244.41 78.00 248.80 220.00 248.38 50.00 Reverse 248.55 472.50 248.58 137.00 MspI Forward 450.00 277.00 449.60 103.50 453.65 258.50 453.46 76.50 Reverse 96.80 128.00 96.55 97.00 Nilai merupakan rata-rata dari dua pengulangan. Nilai yang ditebalkan menunjukkan T-RF yang memiliki pendaran tertinggi.
KD1 (tanpa MB) KM1
KD2 KM2
ID1 (MB+Digest) IM1
ID2 IM2
IID1 (Digest+MB) IIM1
IID2 IIM2
Digesti
Dde
I
Digesti
Msp
I
Base pairF lu o re sc en ce U n it — 250 bp — 250 bp — 250 bp — 250 bp — 250 bp — 250 bp — 454 bp — 454 bp — 454 bp — 454 bp
Tabel 4 Pengaruh jumlah siklus PCR terhadap T-RF bakteri Pseudomonas aeruginosa
Enzim Restriksi
Fragmen yang diamati
T-RF pada 26 siklus T-RF pada 20 siklus* Panjang Fragmen (bp) Tinggi Puncak (FU) Panjang Fragmen (bp) Tinggi Puncak (FU) DdeI Forward (tidak terdeteksi) 119.79 226.00 134.21 1789.00 134.22 2461.50 244.88 102.5 244.80 126.50 Reverse 248.41 2395.00 248.38 1828.50 277.69 170.00 277.58 208.50 MspI Forward 92.25 98.00 94.32 349.50 105.23 1734.50 105.21 1498.00 450.42 295.50 450.20 337.00 Reverse 96.74 274.00 96.60 319.00 226.82 270.50 226.86 222.00 Nilai merupakan rata-rata dari dua pengulangan. Nilai yang ditebalkan menunjukkan T-RF yang memiliki pendaran tertinggi. *Waktu injeksi sampel dinaikkan menjadi 10 detik untuk memperbaiki hasil.
Tabel 5 Pengaruh jumlah siklus PCR terhadap T-RF bakteri Escherichia coli Enzim
Restriksi
Fragmen yang diamati
T-RF pada 26 siklus T-RF pada 20 siklus Panjang Fragmen (bp) Tinggi Puncak (FU) Panjang Fragmen (bp) Tinggi Puncak (FU) DdeI Forward 248.65 619.50 248.37 179.00 250.21 1577.00 250.05 457.50 MspI Forward 454.32 988.50 453.82 367.50 Reverse 96.965 138 97.12 118.5
Nilai merupakan rata-rata dari dua pengulangan. Nilai yang ditebalkan menunjukkan T-RF yang memiliki pendaran tertinggi.
Tabel 6 Perbandingan antara fragmen digesti in silico dengan T-RF in vitro Nama Bakteri Fragmen yang Diamati DdeI MspI Panjang fragmen digesti in silico (bp) Panjang T-RF in vitro (bp) Pergeseran Ukuran T-RF (bp) Panjang fragmen digesti in silico (bp) Panjang T-RF in vitro (bp) Pergeseran Ukuran T-RF (bp) T-RF yang mirip T-RF lain T-RF yang mirip T-RF lain Escherichia coli Forward 253 250.15 248.62 -2.85 461 454.74 -6.26 280 276.86 -3.14 Reverse 645 TD — 19 TD — 100 97.13 -2.87 262 260.18 -1.82 266 264.45 -1.55 Pseudomona s sp. Forward 247 243.96 240.92 247.61 256.39 -3.04 455 447.63 105.18 449.60 -7.37 Reverse 252 248.26 102.20239.76 -3.74 19 TD — 281 277.60 -3.40 100 96.65 -3.35 364 359.91 -4.09 230 226.83 -3.17 402 — — 241 237.92 -3.08 439 — — Pseudomona s stutzeri Forward 247 244.45 248.59 -2.55 456 449.80 453.56 -6.20 280 — — Reverse 646 TD 248.57 — 19 TD — 101 96.68 -4.32 Pseudomona s aeruginosa Forward 137 134.22 119.79 244.83 -2.78 108 105.22 92.29 -2.78 184 — 114 — — 272 — 453 450.31 -2.69 408 — Reverse 252 248.40 277.64 -3.60 19 TD — 100 96.67 -3.33 230 226.84 -3.16
Nilai merupakan rata-rata panjang T-RF yang pernah dideterminasi. Nilai yang ditebalkan menunjukkan T-RF yang memiliki pendaran tertinggi. TD = Tidak dapat dideterminasi (berukuran di luar 35–500 bp).
8
Gambar 7 Hasil FragSort data fragmen forward sampel Pseudomonas sp.
Gambar 8 Hasil FragSort data fragmen forward sampel Pseudomonas stutzeri.
Gambar 9 Hasil FragSort data fragmen forward sampel Pseudomonas aeruginosa.
Gambar 10 Hasil FragSort data fragmen forward sampel Escherichia coli.
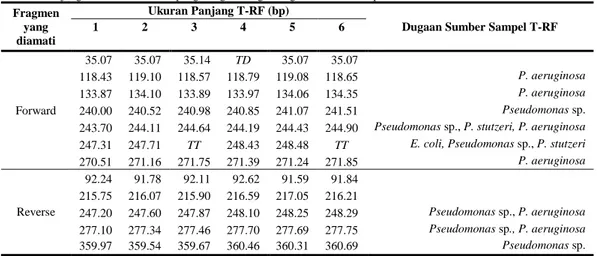
Tabel 7 Panjang T-RF dari keenam pengulangan dengan dugaan sumber sampel bakteri Fragmen
yang diamati
Ukuran Panjang T-RF (bp)
Dugaan Sumber Sampel T-RF 1 2 3 4 5 6 Forward 35.07 35.07 35.14 TD 35.07 35.07 118.43 119.10 118.57 118.79 119.08 118.65 P. aeruginosa 133.87 134.10 133.89 133.97 134.06 134.35 P. aeruginosa 240.00 240.52 240.98 240.85 241.07 241.51 Pseudomonas sp. 243.70 244.11 244.64 244.19 244.43 244.90 Pseudomonas sp., P. stutzeri, P. aeruginosa
247.31 247.71 TT 248.43 248.48 TT E. coli, Pseudomonas sp., P. stutzeri
270.51 271.16 271.75 271.39 271.24 271.85 P. aeruginosa Reverse 92.24 91.78 92.11 92.62 91.59 91.84 215.75 216.07 215.90 216.59 217.05 216.21 247.20 247.60 247.87 248.10 248.25 248.29 Pseudomonas sp., P. aeruginosa 277.10 277.34 277.46 277.70 277.69 277.75 Pseudomonas sp., P. aeruginosa 359.97 359.54 359.67 360.46 360.31 360.69 Pseudomonas sp. 292.833 3 TD = Tidak dapat dideterminasi. TT = Tidak terdeteksi.
.
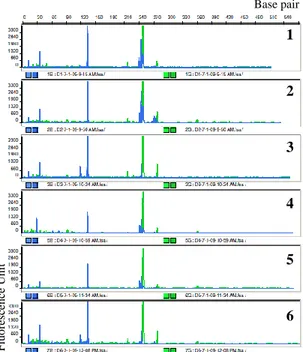
Gambar 11 Profil T-RF pengulangan analisis T-RFLP terhadap campuran genom E. coli, Pseudomonas sp., P. stutzeri,
dan P. aeruginosa. Angka 1–6 menandakan nomor pengulangan.
PEMBAHASAN
Penyejajaran sekuen dengan program BLASTn memberikan hasil pencarian yang menyatakan bahwa bakteri yang digunakan adalah bakteri Pseudomonas sp. (Gambar 2), Pseudomonas stutzeri (Gambar 3), Pseudomonas aeruginosa (Gambar 4), dan Escherichia coli (Gambar 5).
Kehadiran fragmen yang sama pada hasil digesti enzim DdeI terhadap gen E. coli (Tabel 1) menunjukkan bahwa enzim tersebut dapat bekerja pada ketiga perlakuan tanpa terganggu oleh kehadiran larutan penyangga nuklease mung bean yang ditambahkan sebelum reaksi. Sedangkan pada hasil digesti enzim MspI tidak dihasilkan T-RF yang dapat diamati karena proses digesti mungkin terganggu oleh kehadiran larutan penyangga digesti mung bean sebelum digesti restriksi MspI (Gambar 6).
Jumlah T-RF yang sama antara kontrol, perlakuan I dengan DdeI, dan perlakuan II (Gambar 6 dan Tabel 1) menunjukkan bahwa perbedaan tahap pemberian enzim nuklease mung bean tidak menghasilkan perbedaan pada jumlah T-RF dan komposisi T-RF dengan pendaran tinggi maupun rendah. Dengan kata lain, tidak terbentuk pseudo T-RF yang didigesti oleh nuklease mung bean dan dapat diamati pada perlakuan tersebut sehingga efektivitas pemberian nuklease mung bean untuk mengatasi masalah pseudo T-RF tidak dapat diamati secara langsung. Ketidakhadiran pseudo T-RF ini juga
diperkuat oleh keterangan bahwa enzim mung bean dapat bekerja pada larutan penyangga restriksi MspI dari produsen yang sama sehingga pseudo T-RF yang muncul akan didigesti oleh enzim mung bean. Hal ini mungkin juga dipengaruhi oleh jumlah siklus yang digunakan, yaitu 25 siklus, yang tergolong rendah dalam PCR T-RFLP sehingga tidak terbentuk pseudo T-RF yang merupakan produk dari tingginya siklus PCR (Egert & Friedrich 2003).
Pengaruh lain dari pemberian enzim MB yaitu intensitas pendaran T-RF yang terlihat berkurang pada setiap perlakuan dengan penambahan enzim mung bean (I dan II). Hal ini dapat disebabkan oleh berkurangnya pendaran sampel karena pemaparan cahaya akibat waktu kerja yang relatif lebih lama, efisiensi purifikasi etanol, atau penurunan jumlah DNA yang masuk saat injeksi elektrokinetik karena kehadiran ion-ion tambahan dari larutan penyangga enzim nuklease mung bean (Grüntzig et al. 2002).
Tabel 2, Tabel 3, dan Tabel 5 menunjukkan pola dan jumlah kehadiran T-RF yang sama antara analisis T-T-RFLP menggunakan 26 siklus PCR dengan 20 siklus PCR dengan dua kali pengulangan, namun terlihat jelas perbedaan antara intensitas pendaran perlakuan 26 siklus yang lebih baik dibandingkan perlakuan 20 siklus. Misalnya, pada T-RF 449.6 bp hasil pemotongan MspI pada Pseudomonas sp. (Tabel 2), rendahnya pendaran puncak pada perlakuan 20 siklus
Base pair F lu o re sc en ce U n it 1 2 3 4 5 6
10
tidak dapat dideteksi oleh program. Perbedaanintensitas pendaran tentu berkorelasi langsung dengan jumlah amplikon PCR yang dipengaruhi oleh siklus PCR itu sendiri. Semakin tinggi siklus PCR, semakin banyak amplikon yang dihasilkan dan semakin tinggi pendaran yang didapatkan.
Berbeda dengan perlakuan sebelumnya, analisis pengaruh jumlah siklus PCR terhadap T-RF bakteri P. aeruginosa (Tabel 4) melibatkan peningkatan waktu injeksi sampel pada mesin sekuensing dari 5 detik menjadi 10 detik pada perlakuan 20 siklus PCR. Peningkatan ini menyebabkan peningkatan intensitas puncak–puncak kecil yang sebelumnya kurang jelas sehingga jumlah T-RF yang diamati dapat bertambah (Grüntzig et al. 2002). Berdasarkan tabel-tabel di atas, analisis T-RFLP menggunakan 26 siklus PCR menghasilkan profil T-RF yang lebih baik dan jelas dibandingkan dengan profil dengan 20 siklus PCR, terlepas dari masalah pembentukan pseudo T-RF dan digesti parsial yang terjadi.
Di lain pihak, keempat tabel yang sama menunjukkan perbedaan ukuran T-RF yang dihasilkan antara genus Escherichia dan Pseudomonas. Bahkan terdapat polimorfisme yang cukup jelas antara spesies di dalam genus tersebut. Dengan kata lain, teknik T-RFLP ini merupakan teknik yang sensitif membedakan polimorfisme antar spesies bila menggunakan enzim restriksi yang tepat.
Beberapa fragmen dominan tidak dapat dideterminasi karena berada di luar batas standar yang digunakan (35–500 bp) seperti pada T-RF reverse hasil pemotongan MspI terhadap keempat sampel (Tabel 2, Tabel 3, Tabel 4, dan Tabel 5) dengan ukuran kurang dari 35 bp. Sedangkan ketidakmunculan T-RF dominan pada pemotongan ampikon E. coli oleh DdeI (Tabel 5) menunjukkan bahwa tidak terdapat situs pemotongan DdeI dalam 500 basa awal sehingga T-RF yang dimiliki berukuran lebih dari 500 bp dan tidak dapat dideterminasi serta dianalisis. Hal ini didukung oleh hasil pemotongan fragmen secara in silico yang ditampilkan pada Tabel 6, yang menunjukkan bahwa T-RF reverse hasil restriksi MspI berukuran 19 bp sedangkan untuk T-RF reverse E. coli hasil restriksi DdeI berukuran 645 bp.
Berdasarkan data pada Tabel 6 yang memuat situs pemotongan terminal dan situs berikutnya beserta panjang fragmen alternatif, diduga bahwa munculnya beberapa puncak pada elektroferogram selain puncak tertinggi merupakan hasil dari digesti parsial atau
karena terdapat kopi gen 16S rRNA lain yang memiliki polimorfisme pada situs pemotongan terminalnya. Masalah ini dapat diatasi dengan optimasi proses digesti atau dengan pembuatan klon gen 16S rRNA bakteri.
Hasil pemotongan in silico MspI terhadap amplikon reverse keempat bakteri (Tabel 6) menghasilkan T-RF berukuran 19 bp yang tidak dapat dideterminasi panjangnya dengan standar yang digunakan. Hal ini dipengaruhi oleh urutan basa setelah primer reverse yang secara kebetulan merupakan situs restriksi terminal pada genus Pseudomonas dan Escherichia. Oleh karena itu, sebaiknya analisis fragmen reverse kedua genus tersebut tidak menggunakan pasangan enzim MspI dan primer 1387r berlabel.
Sesuai pernyataan yang dipublikasikan oleh Kaplan & Kitts (2002), bahwa terdapat pergeseran antara hasil pemotongan in silico yang disebut sebagai T-RF yang sebenarnya dengan hasil analisis in vitro atau yang disebut sebagai T-RF yang diamati. pada penelitian ini juga terdapat pergeseran ukuran T-RF atau T-RF drift sebesar -1.55 hingga -7.37 basa dengan rata-rata –3.53 basa. Pergeseran ini mempersulit proses identifikasi yang dilakukan dan dapat memberikan hasil pendugaan bakteri yang tidak sesuai. Pergeseran ini berkorelasi dengan panjang T-RF yang mempengaruhi migrasi dari standar dan sampel pada saat elektroforesis (Kaplan & Kitts 2002). Perbedaan mesin dan pengaturan dapat memberikan hasil berbeda.
Pada Tabel 6 juga dapat diamati beberapa T-RF lain yang tidak muncul pada hasil pemotongan in silico. Beberapa fragmen tersebut berdekatan dengan fragmen dominan dengan jarak hingga 4 basa yang diduga merupakan sebagian dari kumpulan fragmen yang sama yang mengalami hambatan pada elektroforesis kapiler sehingga terpisah dengan kelompok dominan. Namun selain fragmen tersebut, terdapat pula fragmen dengan perbedaan ukuran yang cukup jauh dari ukuran in silico dan muncul pada sebagian pengulangan (ditandai dengan cetak miring pada tabel), bahkan pada hasil pemotongan amplikon forward gen P. stutzeri dengan MspI ditemukan T-RF dengan ukuran 248.57 bp, selain fragmen seharusnya yang tidak dapat dideterminasi (> 500 bp). Munculnya fragmen-fragmen baru ini mungkin disebabkan oleh masalah seleksi PCR terhadap gen target atau kopi 16S yang berbeda dengan hasil sekuensing, sekuen basa yang kurang baik sehingga situs pemotongan kurang akurat (nilai maximum identity pada
Gambar 2 hanya 87%), fragmentasi selama proses, atau renaturasi utas DNA sehingga strukturnya semakin kompak dan bergerak lebih cepat pada elektroforesis gel kapiler.
Gambar 7, Gambar 8, Gambar 9, dan Gambar 10 menunjukkan bahwa hasil pencarian bakteri terduga yang sama dari fragmen forward hasil pemotongan dengan enzim DdeI dan MspI menggunakan program FragSort 5.0 memberikan dugaan nama spesies yang sama, walaupun terdapat perbedaan dalam ukuran fragmen basis data dengan fragmen in silico. Sedangkan pada fragmen reverse lebih banyak ditemukan T-RF yang berukuran di luar 35-500 bp sehingga pencarian dengan program yang sama tidak mengajukan nama bakteri terduga yang diinginkan.
Dalam enam kali pengulangan analisis T-RFLP pada Tabel 7 dapat dilihat kehadiran fragmen dengan ukuran yang relatif sama dari keenam pengulangan. Namun, pada ulangan ke-3 dan ke-6 dihasilkan profil T-RFLP yang sedikit berbeda (Gambar 11), yaitu meningkatnya pendaran fragmen berukuran 118.61 bp bersamaan dengan menghilangnya fragmen 247.51 bp yang diduga muncul karena preferensi seleksi PCR (Tabel 7), sedangkan profil T-RF lain muncul secara konsisten. Hal ini dapat disebabkan oleh seleksi PCR dalam pemilihan kopi 16S rRNA yang ternyata memiliki situs berbeda atau karena digesti parsial saja. Kemunculan fragmen 35.08, 92.03, dan 216.26 bp yang tidak diketahui asalnya mungkin merupakan fragmentasi gen 16S rRNA selama proses berlangsung. Bila faktor-faktor masalah ini dapat diatasi, teknik ini terbukti sensitif dan memiliki tingkat reproduksibilitas yang tinggi. Empat dari enam kali pengulangan memberikan nilai yang sesuai sehingga dapat disimpulkan pula bahwa sebaiknya pengulangan analisis T-RFLP dilakukan sebanyak tiga kali untuk mencari hasil yang sama setidaknya pada dua dari tiga pengulangan untuk mendapatkan hasil yang benar dan untuk mencari rata-rata nilai panjang fragmen yang lebih sesuai.
Penelitian ini membuktikan bahwa T-RFLP untuk mencapai hasil analisis yang dapat diamati, sebaiknya dilakukan analisis dengan kondisi siklus PCR sebanyak ±25 kali, penambahan enzim nuklease mung bean setelah restriksi untuk mengurangi pseudo T-RF, penambahan waktu injeksi sampel pada saat elektroforesis untuk mendapatkan profil T-RFLP yang lebih jelas, serta pengukuran pergeseran T-RF pada mesin agar proses
identifikasi menjadi lebih akurat dan terpercaya.
KESIMPULAN
Teknik T-RFLP merupakan teknik yang sensitif dan memiliki tingkat reproduksibilitas yang tinggi. Walaupun demikian, teknik ini juga memiliki kelemahan dalam analisisnya, seperti pembentukan pseudo T-RF dan perbedaan ukuran antara T-RF sebenarnya dengan T-RF yang diamati. Masalah pseudo T-RF dapat diatasi dengan pemberian enzim nuklease mung bean setelah digesti restriksi atau penggunaan jumlah siklus PCR yang rendah, sedangkan untuk mendapatkan identifikasi yang benar dapat menggunakan nilai T-RF drift sebagai perkiraan ukuran fragmen yang sebenarnya. Jumlah pengulangan yang lebih tinggi dapat membantu meningkatkan akurasi teknik ini.
DAFTAR PUSTAKA
Altschul SF, Gish W, Miller W, Myers EW, Lipman DJ. 1990. Basic local alignment search tool. J Mol Biol 215:403-410. Dunbar J, Ticknor LO, Kuske CR. 2001.
Phylogenetic specificity and reproducibility and new method for analysis of terminal restriction fragment profiles of 16S rRNA genes from bacterial communities. Appl Environ Microbiol 67:190-197.
Egert M, Friedrich MW. 2003. Formation of pseudo-terminal restriction fragments, a PCR-related bias affecting terminal restriction fragment length polymorphism analysis of microbial community structure. Appl Environ Microbiol 69:2555–62. Engebretson JJ, Moyer CL. 2003. Fidelity of
select restriction endonucleases in determining microbial diversity by terminal-restriction fragment length polymorphism. Appl Environ Microbiol 69:4823–4829.
Grüntzig V, Stres B, del Rio HLA, Tiedje JM. 2002. Improved Protocol for T-RFLP by Capillary Electrophoresis. [terhubung berkala]. http://rdp8.cme.msu.edu/html/t-rflp_jul02.html [13 Juli 2009].
Kaplan CW, Kitts CL. 2003. Variation between observed and true terminal restriction fragment length is dependent on true TRF length and purine content. J Microbiol Methods 1776:1-5.
Kitts CL.2001. Terminal restriction fragment patterns: a tool for comparing microbial communities and assessing community
12
dynamics. Curr Issues Intest Microbiol2:17–25.
Liu WT, Marsh TL, Cheng H, Forney LJ. 1997. Characterization of microbial diversity by determining terminal restriction fragment length polymorphisms of genes encoding 16S rRNA. Appl Environ Microbiol 63:4516–4522.
Lueders T, Friedrich MW. 2003. Evaluation of PCR amplification bias by terminal restriction fragment length polymorphism analysis of small-subunit rRNA and mcrA genes by using defined template mixtures of methanogenic pure cultures and soil DNA extracts. Appl Environ Microbiol 69:320–326.
Marsh TL, Liu WT, Forney LJ, Cheng H. 1998. Beginning a molecular analysis of the eukaryal community in activated sludge. Water Sci Technol 37:455–460. Marsh TL. 1999. Terminal restriction
fragment length polymorphism (T-RFLP): an emerging method for characterizing diversity among homologous populations of amplification products. Curr Opin Microbiol 2:323-327.
Moeseneder MM, Arrieta JM, Muyzer G, Winter C, Herndl GJ. 1999. Optimization of terminal-restriction fragment length polymorphism analysis for complex marine bacterioplankton communities and comparison with denaturing gradient gel electrophoresis. Appl Environ Microbiol 65:3518–3525.
Moeseneder MM, Winter C, Arrieta JM, Herndl GJ. 2001. Terminal-restriction fragment length polymorphism (T-RFLP) screening of a marine archaeal clone library to determine the different phylotypes. J Microbiol Methods 44:159-72.
Mroske C, MuciJ, Wang J, Li K, Song W, Yan J, Feng J, Liu Q, Sommer SS. 2007. Toward a fluorescent single-strand conformation polymorphism technique that detects all mutations: F-DOVAM-S. Anal Biochem 368:250–257.
Murray MG, Thompson WF. 1980. Rapid isolation of high molecular weight plant DNA. Nucleic Acids Res 8:4321-4325. Osborn AM, Moore ERB, Timmis KN. 2000.
An evaluation of terminal-restriction fragment length polymorphism (T-RFLP) analysis for the study of microbial community structure and dynamics. Environ Microbiol 2:39-50.
Polz MF, Cavanaugh CM. 1998. Bias in Template-to-Product Ratios in Multitemplate PCR. Appl Environ Microbiol 64: 3724–3730.
Saikaly PE, Stroot PG, Oerther DB. 2005. Use of 16S rRNA gene terminal restriction fragment analysis to assess the impact of solids retention time on the bacterial diversity of activated sludge. Appl Environ Microbiol 71:5814–5822.
Sambrook J, Russell DW. 2001. Molecular Cloning: A Laboratory Manual. Ed. Ke-3. New York: Cold Spring Harbor Laboratory Pr.
Shyu C, Soule T, Bent SJ, Foster JA, Forney LJ. 2007. MiCA: a web-based tool for the analysis of microbial communities based on terminal-restriction fragment length polymorphisms of 16S and 18S rRNA genes. Microbial Ecol 53:562–570. Suzuki MT, Giovannoni SJ. 1996. Bias caused
by template annealing in the amplification of mixtures of 16S rRNA genes by PCR. Appl Environ Microbiol 62:625–630.