Patofisiologi dan Penanganan Gastropati
Obat Antiinflamasi Nonsteroid
Fandy Gosal, Bram Paringkoan, Nelly Tendean Wenas Bagian Ilmu Penyakit Dalam, Fakultas Kedokteran Universitas Sam Ratulangi, Manado
Abstrak
Gastropati obat antiinflamasi nonsteroid (OAINS) adalah lesi mukosa gaster yang berhubungan dengan penggunaan OAINS. Gastropati OAINS dapat disebabkan oleh efek terperangkapnya OAINS dalam sel mukosa gaster dan efek sistemik melalui penghambatan siklooksigenase(COX) yang menyebabkan sintesis prostaglandin terhambat. Pencegahan dan penanganan gastropati OAINS terdiri atas penghentian OAINS, pemilihan OAINS, dan penggunaan obat gastroprotektif dengan mempertimbangkan risiko gastrointestinal dan kardiovaskuler. J Indon Med Assoc. 2012;62:444-9.
Kata kunci: gastropati, OAINS, patofisiologi, penanganan
Pathophysiology and Treatment of
Nonsteroidal Anti-inflammatory Drug Gastropathy
Fandy Gosal, Bram Paringkoan, Nelly Tendean Wenas
Department of Internal Medicine, Faculty of Medicine Universitas Sam Ratulangi, Manado
Abstract
Gastropathy nonsteroidal anti-inflammatory drugs (NSAID) is a gastric mucosal lesions associ-ated with NSAID used. The mechanisms of NSAID induced gastropathy due to topical damage caused by ion trapping of NSAID in gastric mucosa and systemic effect by inhibiting cyclooxygenase (COX) which causes inhibition of prostaglandins synthesis. Prevention and treatment of gastropathy NSAID consist of cessation of NSAID, selection of NSAID, and the use of gastroprotective drugs with gastrointestinal and cardiovascular risks consideration. J Indon Med Assoc. 2012;62:444-9.
Keywords: gastropathy, NSAID, pathophysiology, treatment
Korespondensi: Fandy Gosal,
Pendahuluan
Obat antiinflamasi nonsteroid (OAINS) digunakan untuk mengobati reumatoid artritis, osteoartritis atau nyeri.1,2 Berbagai jenis OAINS dapat menghambat sintesis prostag-landin (PG) yang merupakan mediator inflamasi dan mengakibatkan berkurangnya tanda inflamasi. Akan tetapi, PG khususnya PGE2 sebenarnya merupakan zat yang bersifat protektor untuk mukosa saluran cerna atas. Hambatan sintesis PG akan mengurangi ketahanan mukosa, dengan efek berupa lesi akut mukosa gaster bentuk ringan sampai berat.3 Gastropati OAINS adalah lesi mukosa gaster yang berhubungan dengan terapi OAINS.1,4
Manifestasi klinis bervariasi dari tanpa gejala, gejala ringan dengan manifestasi tersering dispepsia, heartburn, abdominal discomfort, dan nausea; hingga gejala berat seperti tukak peptik, perdarahan, perforasi.1,3,5 Tidak ada korelasi antara kerusakan mukosa dengan gejala abdominal bagian atas pada penderita pengguna OAINS.1,6 Selain itu, tidak ada dosis OAINS yang benar-benar aman sehingga identifikasi faktor risiko penting pada penggunaan OAINS.1,3,5 Faktor risiko gastropati OAINS adalah usia lebih tua dari 60 tahun, beratnya kerusakan, pengobatan lebih dari satu macam OAINS atau penggunaan bersama dengan kortikosteroid, OAINS dosis tinggi, riwayat tukak peptik, penggunaan bersama dengan antikoagulan, infeksi Helicobacter pylori sebelum terapi, dan mengidap penyakit sistemik yang berat. 1,3-5 Diagnosis gastropati OAINS ditegakkan melalui anamne-sis, pemeriksaan fianamne-sis, laboratorium, endoskopi, dan peme-riksaan histopatologi.1,7
Jika tidak tertangani dengan baik, komplikasi gastropati OAINS dapat muncul pada penderita. Komplikasi tersebut meliputi perdarahan gastrointestinal (hematemesis, melena), perforasi, striktura, syok hipovolemik, dan kematian.1,2
Berdasarkan Arthritis, Rheumatism, and Aging Medi-cal Information System diperkirakan sekitar 107 000 penderita dirawat di rumah sakit setiap tahunnya karena komplikasi saluran cerna akibat OAINS dan sekurang-kurangnya 16 500 di antara penderita artritis meninggal setiap tahunnya karena komplikasi OAINS di Amerika Serikat.1,4 Oleh karena itu, artikel ini bertujuan untuk membahas patofisiologi dan penanganan gastropati OAINS yang tepat.
Sistem Pertahanan Mukosa
Epitel gaster terpajan dengan bahan berbahaya (faktor agresif) secara endogen yaitu asam hidroksi klorida (HCl), pepsin, dan garam empedu, maupun secara eksogen seperti obat, alkohol, dan bakteri. Karena itu, terdapat sistem pertahanan mukosa untuk mencegah kerusakan mukosa dan memperbaiki kerusakan yang terjadi. Sistem pertahanan tersebut terdiri atas tiga lapisan yaitu preepitel, epitel dan subepitel.3,5,7
Sistem pertahanan pertama adalah lapisan mukus-bikarbonat sebagai rintangan fisikokimia terhadap molekul seperti ion hidrogen. Mukus disekresi oleh sel epitel
permukaan gastroduodenal, terdiri atas air (95%), lemak, dan glikoprotein. Mukus berfungsi sebagai lubrikan yang bersifat fleksibel seperti gel dan melekat pada mukosa untuk men-cegah difusi ion dan molekul seperti pepsin.3,5 Sementara itu, bikarbonat disekresi oleh sel epitel permukaan mukosa gas-troduodenal ke lapisan mukus sehingga terbentuk perbedaan pH sebesar 1-2 pada permukaan lumen gaster dan 6-7 pada permukaan sel epitel.5,7 Perbedaan pH dalam lapisan mukosa akan mempengaruhi ketahanan mukosa. Ketahanan mukosa gaster ditunjukkan oleh kemampuan epitel gaster memper-tahankan perbedaan konsentrasi ion H+ dari lumen ke mukosa dalam kondisi fisiologis. Kondisi tersebut digambarkan sebagai difusi rendah ion H+ dari lumen ke mukosa untuk menjaga perbedaan potensial transmukosa lumen tetap negatif. Prostaglandin akan meningkatkan gradien pH sesuai dengan kemampuan proteksinya. Zona alkali pada permukaan mu-kosa akan mencegah asam mencapai permukaan mukosa.3 Sel epitel permukaan merupakan mekanisme pertahanan selanjutnya yang bekerja melalui pembentukan mukus, transportasi ionik sel epitel untuk mempertahankan pH intrasel, dan produksi bikarbonat serta ikatan antara epitel. Jika rintangan praepitel ditembus dan terjadi kerusakan epitel, sawar mukosa akan segera diperbaiki dalam satu jam. Sel epitel gaster yang berbatasan dengan daerah kerusakan akan bermigrasi untuk memulihkan daerah yang rusak (restitusi). Pada proses tersebut dibutuhkan sirkulasi darah yang baik dan lingkungan yang bersifat basa. Namun demikian, proses itu bukanlah suatu proses pembelahan sel. Beberapa faktor pertumbuhan seperti epidermal growth factor (EGF), trans-forming growth factor (TGF)-α dan basic fibroblast growth
factor (FGF) mengatur proses restitusi.
Kerusakan yang lebih berat tidak dapat diperbaiki secara efektif oleh restitusi sehingga membutuhkan proliferasi sel. Regenerasi sel epitel diatur oleh PG dan growth factors seperti EGF dan TGF-α. Bersamaan dengan pembentukan sel epitel
baru, terjadi angiogenesis dalam jaringan mikrovaskular yang rusak. Baik FGF dan vascular endothelial growth factor (VEGF) penting dalam mengatur angiogenesis pada mukosa gaster. Prostaglandin memegang peranan utama dalam meka-nisme pertahanan epitel gaster. Mukosa gaster mengandung PG berlimpah yang mengatur pelepasan bikarbonat mukosa dan mukus, menghambat sekresi sel parietal, dan berperan penting dalam mempertahankan aliran darah mukosa serta restitusi sel epitel.3,5,7
Sistem mikrovaskular dalam lapisan submukosa meru-pakan komponen utama sistem pertahanan subepitelial yang menyediakan bikarbonat (HCO3-) untuk menetralkan asam yang dihasilkan oleh sel parietal. Sistem mikrovaskular juga menyediakan mikronutrien, oksigen, dilusi, dan netralisasi dari difusi kembali asam lambung, serta mengeliminasi metabolik toksik.3,5,7 Selain itu sebagai penghasil nitrit oksida. Nitrit oksida (NO) merupakan zat yang diproduksi oleh endotel kapiler melalui aktivitas endothelium derived vascular re-laxation factor.3 Enzim NO sintetase yang terekspresi pada
mukosa berperan sebagai sitoproteksi melalui stimulasi mukus gaster, meningkatkan aliran darah mukosa, dan mem-pertahankan fungsi ketahanan sel epitelial.5
Fisiologi Sekresi Gaster
Asam hidroklorida adalah hasil utama sekresi gaster yang dapat menyebabkan perlukaan mukosa. Sel parietal sebagai penghasil HCl memiliki reseptor histamin (H2), gas-trin (reseptor kolesistokinin/gasgas-trin), dan asetilkolin (muskarinik, M3). Pengikatan histamin pada reseptor H2 mengaktivasi adenilat siklase dan meningkatkan siklik AMP. Aktivasi reseptor gastrin dan muskarinik menyebabkan aktivasi jalur persinyalan fosfoinositida/protein kinase C. Setiap jalur perangsangan mengatur suatu kaskade kinase yang mengontrol sekresi pompa asam H+, K+-ATPase. Enzim H+, K+- ATPase bertanggung jawab membentuk konsentrasi H+ yang tinggi dengan menggunakan ATP sebagai sumber energi untuk mentransfer ion H+ dari sitoplasma sel parietal ke secretory canaliculi disertai pertukaran ion K+.5,7,8 Sel parietal juga memiliki reseptor yang dapat menghambat produksi asam, seperti PG, somatostatin, dan EGF. Soma-tostatin dilepaskan oleh sel D pada mukosa gaster sebagai respon terhadap HCl. Molekul tersebut mampu menghambat produksi asam secara langsung pada sel parietal maupun tidak langsung dengan menurunkan pelepasan histamin dari enterochromaffin-like (ECF) cell dan gastrin dari sel G.
Patofisiologi
Patofisiologi utama kerusakan gastroduodenal akibat OAINS adalah disrupsi fisiokimia pertahanan mukosa gaster dan inhibisi sistemik terhadap pelindung mukosa gaster melalui inhibisi aktivitas COX mukosa gaster.1
Kerusakan pertahanan mukosa terjadi akibat efek OAINS secara lokal. Beberapa OAINS bersifat asam lemah sehingga bila berada dalam lambung yang lumennya bersifat asam (pH kurang dari 3) akan berbentuk partikel yang tidak terionisasi. Dalam kondisi tersebut, partikel obat akan mudah berdifusi melalui membran lipid ke dalam sel epitel mukosa lambung bersama dengan ion H+. Dalam epitel lambung, suasana menjadi netral sehingga bagian obat yang berdifusi terperangkap dalam sel epitel dan terjadi penumpukan obat pada epitel mukosa. Akibatnya, epitel menjadi sembab, pembentukan PG terhambat, dan terjadi proses inflamasi.2-5 Selain itu, adanya uncoupling of mitochondrial oxidative phosphorylation yang menyebabkan penurunan produksi adenosine triphosphate (ATP), peningkatan adenosine monophosphate (AMP), dan peningkatan adenosine diphos-phate (ADP) dapat menyebabkan kerusakan sel. Perubahan itu diikuti oleh kerusakan mitokondria, peningkatan pembentukan radikal oksigen, dan perubahan keseimbangan Na+/K+ sehingga menurunkan ketahanan mukosa lambung. Lebih lanjut lagi, kondisi itu memungkinkan penetrasi asam, pepsin, empedu, dan enzim proteolitik dari lumen lambung
ke mukosa dan menyebabkan nekrosis sel.2,4,5,10
Inhibisi sistemik terhadap pelindung mukosa gaster terjadi melalui penghambatan aktivitas COX mukosa gaster. Prostaglandin yang berasal dari esterifikasi asam arakidonat pada membran sel berperan penting dalam memperbaiki dan mempertahankan integritas mukosa gastroduodenal. Enzim utama yang mengatur pembentukan PG adalah COX yang memiliki dua bentuk yaitu COX-1 dan COX-2. Masing-masing enzim tersebut memiliki karakteristik berbeda berdasarkan struktur dan distribusi jaringan. COX-1 yang berada pada lambung, trombosit, ginjal, dan sel endotelial, memiliki peran penting dalam mempertahankan integritas fungsi ginjal, agregasi trombosit, dan integritas mukosa gastrointestinal. Sementara itu, COX-2 yang diinduksi oleh rangsangan inflamasi terekspresi pada makrofag, leukosit, fibroblas, dan sel sinovial.5
Pada jaringan inflamasi, OAINS memiliki efek mengun-tungkan melalui penghambatan COX-2 dan efek toksik melalui penghambatan COX-1 yang dapat menyebabkan ulserasi mukosa gastrointestinal dan disfungsi ginjal. Penghambat COX-2 selektif mempunyai efek menguntungkan dengan menurunkan inflamasi jaringan dan mengurangi efek toksik terhadap saluran cerna. Namun demikian, golongan tersebut memiliki efek samping pada sistem kardiovaskular berupa peningkatan risiko infark miokard, stroke, dan kematian mendadak.5,11 Efek samping tersebut berkaitan dengan efek antiplatelet yang minimal pada penghambat COX-2 karena tidak memengaruhi tromboksan A2 (TX-A2). TX-A2 merupakan suatu agonis platelet dan vasokonstriktor serta secara selektif menyupresi prostasiklin endotel.6,9 Oleh karena itu, Food and Drugs Administration (FDA) telah menarik valdekoksibdan rofekoksibyang memiliki efek samping pada kardiovaskular dari pasaran.5,11 Selekoksibadalah penghambat COX-2 dengan efek kardiovaskular paling minimal dan aman digunakan dengan dosis rendah 200 mg/hari.12
Sebagai konsekuensi penghambatan COX, sintesis leukotrien meningkat melalui perubahan metabolisme asam arakidonat ke jalur 5-lipoxygenase (5-LOX). Leukotrien terlibat dalam proses kerusakan mukosa gaster karena menyebabkan iskemik jaringan dan inflamasi.2,4,13 Peningkatkan ekspresi molekul adhesi seperti intercellular adhesion molecule-1 oleh mediator proinflamasi menyebabkan aktivasi neutrophil-endothelial. Perlekatan neutrofil ini berkaitan dengan patogenesis kerusakan mukosa gaster melalui dua mekanisme utama: yaitu oklusi mikrovaskular gaster oleh mikrotrombus menyebabkan penurunan aliran darah gaster dan iskemik sel serta peningkatan pelepasan oksigen radikal. Radikal bebas tersebut bereaksi dengan asam lemak tak jenuh mukosa dan menyebabkan peroksidasi lemak serta kerusakan jaringan.1,2,4 OAINS juga memiliki efek lain seperti menurunkan angio-genesis, memperlambat penyembuhan, dan meningkatkan endostatin (faktor antiangiogenik) relatif terhadap endothe-lial cell growth factor (suatu faktor proangiogenik).10
Penanganan Gastropati OAINS
Penanganan perlukaan mukosa karena OAINS terdiri dari penanganan terhadap ulkus aktif dan pencegahan primer terhadap perlukaan di kemudian hari. Rekomendasi penanganan dan pencegahan kerusakan mukosa untuk gastropati OAINS dapat dilihat pada tabel 1. Idealnya, OAINS dihentikan sebagai langkah pertama terapi ulkus. Selanjutnya, pada penderita diberikan obat penghambat sekresi asam (penghambat H2, PPIs). Akan tetapi, penghentian OAINS tidak selalu memungkinkan karena beratnya penyakit yang mendasari. Penggunaan protein pump inhibitor (PPI) berhubungan dengan penyembuhan ulkus dan mencegah relaps pada penderita yang menggunakan OAINS jangka panjang.5,11
Tabel 1. Rekomendasi Penanganan Kerusakan Mukosa karena OAINS5
Klinis Rekomendasi
Ulkus aktif
NSAID dihentikan Antagonis reseptor H2 , Protein pump inhibitor
NSAID dilanjutkan Protein pump inhibitor Terapi profilaksis Misoprostol
Protein pump inhibitor Pengambat COX-2 selektif
Infeksi H. pylori Eradikasi jika terdapat ulkus aktif atau riwayat ulkus peptik
Pencegahan untuk gastropati OAINS juga dapat dilakukan dengan menggunakan OAINS yang secara teori kurang menyebabkan kerusakan, menggunakan PAINDS bersama dengan obat pencegah kerusakan, dan eradikasi H. pylori.4,5 Untuk pencegahan ulkus primer dapat digunakan misoprostol (4 kali 200 µg per hari) atau PPI. Penghambat H2 dosis tinggi (famotidine 2 kali 40 mg per hari) dapat dianjurkan sebagai pengganti PPI walaupun PPI seperti omeprazole dan pantoprazole lebih superior.5,11,12 Penghambat COX-2 selektif, selesoksib dan rofesoksib, nyatanya 100 kali lebih selektif dalam menghambat COX-2 dibanding OAINS standar, tetapi penggunaannya meningkatkan gangguan kardiovas-kular.5,14-16 Castellsague et al15 menemukan risiko komplikasi ulkus peptik pada penggunaan selesoksib dan rofesoksib setengah kali lebih rendah dibanding OAINS tidak selektif. Efek pencegahan komplikasi gastrointestinal oleh selesoksib dan rofesoksib hilang ketika digunakan bersama aspirin dosis
Tabel 2. Pendekatan Penggunaan Terapi OAINS5
Risiko OAINS gastrointestinal rendah/ Risiko OAINS gastropati tinggi tidak ada
Tanpa risiko kardiovaskuler OAINS tradisional Koksib atau OAINS tradisional + PPI (tanpa aspirin) Pertimbangkan terapi non-OAINS Risiko kardiovaskuler OAINS tradisional + PPI jika risiko gastro- Agen gastroprotektif harus ditambahkan
(pertimbangkan aspirin) intestinal membutuhkan gastroproteksi jika OAINS tradisional diresepkan Pertimbangkan terapi non-OAINS Pertimbangkan terapi non-OAINS
rendah6,16,17 Oleh karena itu, terapi untuk melindungi lambung dibutuhkan pada penderita yang menggunakan penghambat COX-2 dan aspirin.5
Risiko gastrointestinal OAINS dibagi menjadi risiko rendah (tidak ada faktor risiko), sedang (1 atau 2 faktor risiko berupa usia di atas 65 tahun, OAINS dosis tinggi, riwayat ulkus tidak terkomplikasi, penggunaan bersama aspirin, kortikosteroid atau antikoagulan), tinggi (>2 faktor risiko atau riwayat ulkus yang terkomplikasi).16 Petunjuk pendekatan penggunaan OAINS dapat dilihat pada tabel 2 dan alternatif lainnya pada tabel 3. Penderita yang tidak berisiko kardio-vaskular, tidak menggunakan aspirin, dan tidak berisiko komplikasi gastrointestinal dapat menerima OAINS non-selektif tanpa perlindungan lambung.5,12,16 Pada penderita tanpa risiko kardiovaskular tetapi dengan risiko sedang gas-trointestinal dapat digunakan penghambat COX-2 selektif, OAINS tidak selektif dengan PPI, atau misoprostol. Penderita dengan riwayat ulkus peptik dengan atau tanpa komplikasi dan menggunakan aspirin, antiplatelet, kortikosteroid, atau memiliki dua atau lebih faktor risiko dikategorikan sebagai risiko tinggi dan diterapi dengan penghambat COX-2 selektif disertai PPI atau misoprostol.5,6,12,16 Penderita yang baru mengalami ulkus peptik terkomplikasi, misalnya perdarahan, memiliki faktor risiko yang sangat tinggi dan sebaiknya tidak menggunakan OAINS atau jika harus menggunakan dapat dipilih penghambat COX-2 selektif disertai PPI atau miso-prostol.16 Perdarahan gastrointestinal berulang tidak berbeda pada penderita menggunakan OAINS nonselektif dengan PPI dibanding penghambat COX-2 selektif.11,14
Pada penderita dengan faktor risiko kardiovaskular yang membutuhkan aspirin dosis rendah dan memiliki risiko rendah toksisitas oleh OAINS dapat dipertimbangkan penggunaan terapi non-OAINS. Jika tidak ada pilihan, penderita dapat diberikan pelindung lambung (PPI atau misoprostol) dengan apapun OAINS yang diberikan.6,12,14,17 Sebaiknya, pada penderita dipilih OAINS yang kurang kardiotoksik seperti naproksen. Selain naproksen, ibuprofen dosis kurang dari 1200 mg memiliki toksisitas kardiovaskular rendah. Penderita dengan risiko kardiovaskular dan risiko tinggi gastrointesti-nal seharusnya tidak menggunakan OAINS atau penghambat COX-2. 9,16
Metaanalisis memperlihatkan H. pylori dan OAINS secara independen maupun sinergis meningkatkan risiko tukak peptik maupun perdarahan ulkus.4,18,19 Menurut
konsensus Maastricht 2-2000 disarankan menguji dan mengobati H. pylori pada pasien yang direncanakan terapi dengan OAINS dan memiliki risiko tukak peptik.4,19 Untuk penggunaan OAINS jangka panjang, eradikasi H. pylori tidak cukup untuk melindungi ulkus/perdarahan berulang sehingga dapat dilakukan profilaksis dengan PPI atau mengganti dengan penghambat COX-2 selektif.4,19 Skrining untuk infeksi H. pylori sebelum terapi dengan aspirin dosis kecil hanya dianjurkan pada mereka dengan riwayat penyakit tukak peptik.
Obat Gastroprotektif
Antagonis Reseptor H2
Dengan struktur serupa dengan histamin, antagonis reseptor H2 tersedia dalam empat macam obat yaitu simetidin, ranitidin, famotidin, dan nizatidin. Walaupun setiap obat memiliki potensi berbeda, seluruh obat secara bermakna menghambat sekresi asam secara sebanding dalam dosis terapi. Tingkat penyembuhan ulkus sama ketika digunakan dalam dosis yang tepat. Dua kali sehari dengan dosis standar dapat menurunkan angka kejadian ulkus gaster.4,20 Selain itu, antagonis reseptor H2 dapat menurunkan risiko tukak duode-num tetapi perlindungan terhadap tukak lambung rendah.19 Dosis malam yang sesuai adalah ranitidin 300 mg, famotidin 40 mg dan nizatidin 300 mg.5
Proton Pump (H+,K+-ATPase) Inhibitors
Proton pump inhibitors merupakan pilihan komedikasi untuk mencegah gastropati OAINS.4 Obat ini efektif untuk penyembuhan ulkus melalui mekanisme penghambatan HCl, menghambat pengasaman fagolisosom dari aktivasi neutrofil, dan melindungi sel epitel serta endotel dari stres oksidatif melalui induksi haem oxygenase-1 (HO-1).10 Enzim HO-1 adalah enzim pelindung jaringan dengan fungsi vasodilatasi, anti inflamasi, dan antioksidan.4,21 Waktu paruh PPIs adalah 18 jam dan dibutuhkan 2-5 hari untuk menormalkan kembali sekresi asam lambung setelah pemberian obat dihentikan. Efikasi maksimal didapatkan pada pemberian sebelum makan.5 Obat PPI menyebabkan pengurangan gejala klinis dispepsia karena OAINS dibanding antagonis reseptor H2 maupun miso-prostol. Lansoprazol dan misoprostol dosis penuh
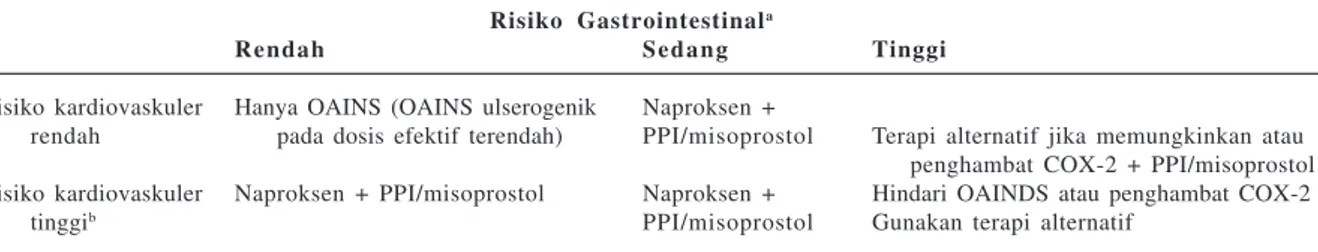
Tabel 3. Rekomendasi Pencegahan Komplikasi Ulkus Akibat OAINS16
Risiko Gastrointestinala
Rendah Sedang Tinggi
Risiko kardiovaskuler Hanya OAINS (OAINS ulserogenik Naproksen +
rendah pada dosis efektif terendah) PPI/misoprostol Terapi alternatif jika memungkinkan atau penghambat COX-2 + PPI/misoprostol Risiko kardiovaskuler Naproksen + PPI/misoprostol Naproksen + Hindari OAINDS atau penghambat COX-2
tinggib PPI/misoprostol Gunakan terapi alternatif
a Risiko gastrointestinal distratifikasikan menjadi rendah (tanpa faktor risiko), sedang (terdapat satu atau dua faktor risiko), dan tinggi
(faktor risiko multipel, atau terdapat riwayat komplikasi ulkus, atau terdapat penggunaan kortikosteroid atau antikoagulan). b Risiko
kardiovaskuler tinggi didefinisikan sebagai kebutuhan penggunaan aspirin dosis rendah sebagai pencegahan kejadian kardiovaskular. Seluruh pasien dengan riwayat ulkus yang membutuhkan OAINS sebaiknya dilakukan tes terhadap H. pylori, jika terdapat infeksi, terapi eradikasi harus dilakukan.
secara klinis menunjukkan efek ekuivalen. Esomeprazole 20 dan 40 mg meredakan gejala gastrointestinal bagian atas pada penderita yang tetap menggunakan OAINS.
Analog Prostaglandin
Misoprostol adalah analog prostaglandin E1 yang digunakan secara lokal untuk mengganti PG yang dihambat oleh OAINS.4,20 Analog PG meningkatkan sekresi mukus bikarbonat, stimulasi aliran darah mukosa dan menurunkan pergantian sel mukosa.5 Namun demikian, misoprostol tidak mengurangi keluhan dispepsia.4,20 Toksisitas paling sering adalah diare (angka kejadian 10-30%). Toksisitas lainnya dapat berupa kontraksi dan perdarahan uterus. Dosis terapi standar dengan misoprostol adalah 200 ìg empat kali sehari.5,19
Ringkasan
Gastropati OAINS adalah lesi mukosa gaster yang berhubungan dengan penggunaan OAINS. Mekanisme terjadinya gastropati OAINS berhubungan dengan efek lokal yang disebabkan oleh terperangkapnya OAINS dalam sel mukosa gaster dan efek sistemik melalui penghambatan COX yang menyebabkan sintesis PG terhambat. Penghentian OAINS, pemilihan OAINS, dan penggunaan obat gastro-protektif dengan mempertimbangkan risiko gastrointestinal dan kardiovaskular merupakan tatalaksana dalam menangani gastropati OAINS.
Daftar Pustaka
1. Simadibrata MK. Diagnosis of NSAID gastropathy and its com-plications. In: Simadibrata MK, Abdullah M, Syam AF, editors. Procedings of the 4th international endoscopy workshop &
inter-national symposium on digestive disease. Jakarta: Pusat Penerbitan Departemen IPD FK UI; 2008. p. 85-7.
2. Wenas NT. Pathophysiology and prevention of NSAID gastro-pathy. In: Simadibrata MK, Abdullah M, Syam AF, editors. The 4th international endoscopy workshop & international
sympo-sium on digestive disease. Jakarta: Pusat Penerbitan Departemen IPD FK UI; 2008. p. 83-4.
3. Manan C. Gastropati obat antiinflamasi nonsteroid. In: Rani AA, Manan C, Djojoningrat D, Simadibrata MK, Makmun D, Abdullah M, et al, editors. Dispepsia sains dan aplikasi klinik. Jakarta: Pusat Penerbitan Departemen IPD FKUI; 2005. p. 68-76.
4. Becker JC, Domschke W, Pohle T. Current approaches to pre-vent NSAID-induced gastropathy - COX selectivity and beyond. Br J Clin Pharmacol. 2004;58:587-600.
5. Valle JD. Peptic ulcer disease and related disorders. In: Kasper DL, Fauci AS, Longo DL, Braunwald E, Hauser SL, Jameson JL, et al, editors. Harrison’s principle of internal medicine. 16th Ed.
New York: McGraw-Hill; 2008. p. 1746-62.
6. Risser A, Donovan D, Heintzman J, Page T. NSAID prescribing precautions. Am Fam Physician. 2009;80(12):1371-8. 7. Tarigan P. Tukak gaster. In: Sudoyo AW, Simadibrata M, Setiyohadi
B, Setiati S, Alwi I, editors. Buku ajar ilmu penyakit dalam. 5th Ed.
Jakarta: Internal Publishing; 2009. p. 513-22.
8. Pisegna JR. Peptic ulcer disease. In: Bayless TM, Diehl AM, editors. Advanced therapy in gastroenterology and liver disease. 5th Ed. London: B.C Decker Inc; 2005. p. 147-55.
9. Bertouch J, Stiel D. Non-steroidal anti-inflammatory drugs. In: Yeomans N, editor. NSAIDs and the gastrointestinal track. 2nd
Ed. Sydney: Sydney NSW 2000; 2008. p. 6-17.
10. Blandizzi C, Tuccori M, Colucci R, Gori G, Fornai M, Antonioli L, et al. Clinical efficacy of esomeprazole in the prevention and healing of gastrointestinal toxicity associated with NSAIDs in elderly patients. Drugs Aging. 2008;25:197-208.
11. Singh G, Triadafilopoulos G. Appropriate choice of proton pump inhibitor therapy in the prevention and management of NSAID-related gastrointestinal damage. Int J Clin Pract. 2005;59:1210-7.
12. Scheiman JM, Cryer B. Panel discussion: treatment approaches to control gastrointestinal risk and balance cardiovascular risks and benefits: proposals and recommendations. Aliment Pharmacol Ther Symp Ser. 2005;1:26-32.
13. Pelletier JM, Lajeunesse D, Reboul P, Pelletier JP. Therapeutic role of dual inhibitors of 5-LOX and COX selective and non-selective non-steroidal anti-inflammatory drugs. Ann Rheum Dis. 2003;62:501-9.
14. Fendrick AM. COX-2 inhibitor use after vioxx: careful balance of end of the rope? The Am J Manag Care. 2004;10:740-1. 15. Castellsague J, Holick CN, Hoffman CC, Gimeno V, Stang MR
and Gutthann SP. Risk of upper gastrointestinal complications associated with cyclooxygenase-2 selective and nonselective nonstreroidal anti-inflammatory drugs. Pharmacotherapy. 2009; 29(12):1397-407.
16. Lanza FL, Chan FKI, Quigley EMM. Guidelines for prevention of NSAID-related ulcer complication. Am J Gastro. 2009;104: 728-38.
17. Elnacef N, Scheiman JM, Fendrick AM, Howden CW, Chey WD. Changing perceptions and practices regarding aspirin, nonsteroi-dal anti-inflammatory drugs, and cyclooxygenase-2 selective nonsteroidal anti-inflammatory drugs among US primary care providers. Aliment Pharmacol Ther. 2008; 28(10):1249-58. 18. Papatheodoridis GV, Papadelli D, Cholongitas E, Vassilopoulos
D, Mentis A, Hadziyannis SJ. Effect of helicobacter pylori infec-tion on the risk of upper gastrointestinal bleeding in users of nonsteroid anti-inflammatory drugs. Am J Med. 2004;116:601-5.
19. Sung JJY, Russel RI, Yeomans N, Chan FKL, Chen SL, Fock KM, et al. Non-steroidal anti-inflammatory drug toxicity in the upper gastrointestinal track. J Gastroenterol Hepatol. 2000;15:58-68. 20. Scheiman JM. Nonsteroidal anti-inflammatory drug (NSAID)-induced gastropathy. In: Kim KE, editors. Acute gastrointestinal bleeding. New Jersey: Humana Press; 2003. p. 75-96.
21. Pohle T, Brzozowski T, Becker JC, Vort IR, Markmann A, Konturek SJ, et al. Role of reactive oxygen metabolites in aspi-rin-induced gastric damage in human: gastroprotection by vita-min C. Aliment Pharmacol Ther. 2001;15:677-87.