S T A N D A R
O P E R A S I O N A L
R U A N G M E D I A
BALAI LABORATORIUM
KESEHATAN PROVINSI
KALTIM
Oleh:
Radita Ning Anggraeny S., S.Si
Balai Laboratorium Kesehatan
Provinsi Kalimantan Timur
2009 “Mitra Diagnostik Anda Menuju Sehat”K a t a P e n g a n t a r
---
Assalamu’alaikum warrahmatullahi wabarakatuh, Salam Sejahtera, bagi pembaca sekalian.
Alhamdulillah akhirnya terselesaikan juga penulisan Standar Operasional Ruang Media di akhir tahun 2009 ini. Panduan ini dilatar-belakangi atas dorongan dan keinginan balai laboratorium menuju laboratorium yang bersertifikasi ISO 9001 dan Akreditasi Balai Laboratorium Kesehatan tingkat provinsi (ISO 17025). SOP Ruang Media ini dibuat atas kerjasama dan masukan banyak pihak. Panduan ini juga merupakan kompilasi dari beberapa tulisan serupa.
Ucapan terimakasih, saya berikan atas dukungan dan bimbingan pada seluruh staf Balai Laboratorium Kesehatan Provinsi Kaltim, serta pada PT. Merck Tbk, dan banyak pihak yang tidak dapat disebutkan satu-persatu.
Semoga buku panduan SOP Ruang Media ini memberikan banyak pencerahan ilmu dan manfaat dalam aplikasinya bagi pembaca.
Wassalamu’alaikum warrahmatullahi wabarakatuh.
Samarinda, Desember 2009 Penulis Radita Ning Anggraeny S., S.Si
D a f t a r I s i
---
Cover Standar Operasional Ruang Media ... i
Kata Pengantar ... ii
Daftar Isi ... iii
Latar Belakang ... iv
Isi Media ... 1
Ruangan & Fasilitas Penunjang ... 3
Penyimpanan Bahan & Reagen Media ... 3
Pemilihan Bahan Media serta Reagen ... 4
Air (Aquadest) ... 5
Uji Kualitas Media ... 6
Kontrol Kualitas Ruangan Media ... 9
Penyimpanan Media Jadi ...10
Pencatatan & Pelaporan ...11
Lemari Pendingin (Refrigerator/ Freezer) ...11
Hot Plate-Stirrer ...12
Timbangan ...13
Autoklaf (Autoclave) ...14
Tempat Penyimpanan Alat-alat Gelas ...16
Meja Peracikan & Persiapan Media ...16
Laminar Air Flow ...17
Penangas Air (Waterbath) ...17
Pemecahan Masalah (Trouble Shooting) pada Kerusakan Alat ...17
Alat-alat Gelas serta Logam yang digunakan di Ruang Media ...19
Bahan-bahan habis pakai yang diperlukan di Ruang Media ...19
Pencucian Alat-alat Gelas ...20
Kesalahan-kesalahan yang Terjadi selama Proses Pembuatan Media ...22
Sistem Pembuangan (Waste Disposal) ...23
L a t a r B e l a k a n g
---
Uji kualitas media merupakan satu-satunya upaya dalam penjaminan mutu media atau hasil (output). Jaminan mutu atau kualitas adalah seluruh rangkaian kegiatan laboratorium untuk meyakinkan hasil-hasil yang dikeluarkan dengan mempertimbangkan segi-segi reabilitas, kecepatan, biaya dan relevansinya terhadap klinis serta lingkungan.
Sebagai komponen penting dalam pelayanan kesehatan, hasil laboratorium digunakan untuk penetapan diagnosis, pemberian pengobatan, serta penentuan prognosis. Oleh karena itu hasil pemeriksaan laboratorium harus selalu terjamin mutunya.
Masalah kualitas pada bidang kimia klinik agak lebih sederhana dibanding bidang mikrobiologi. Karena kualitas hasil akhir dapat diukur dengan parameter secara obyektif terutama akurasi dan presisi, dimana kedua-duanya dapat dipertanggung jawabkan, serta penilaian berupa angka atau statistik.
Mikrobiologi merupakan suatu cabang ilmu yang kurang kuantitatif sehingga pengertian kualitas hasil akhir lebih ditekankan kepada kesempurnaan teknis. Untuk mencapai, menjaga, melakukan perbaikan berkesinambungan dan meningkatkan kualitas hasil akhir, mutlak perlu dilaksanakan pemantapan mutu (Quality Assurance) yang mencakup komponen: Pemantapan Mutu Internal, Pemantapan Mutu Eksternal, Akreditasi, Audit, Validasi Hasil, Diklat Berkelanjutan. Pelaksanaan pemantapan mutu bidang mikrobiologi merupakan manajemen pengendalian mutu laboratorium mikrobiologi mencakup: Pengendalian mutu tahap pra analitik, Pengendalian mutu tahap analitik dan Pengendalian mutu tahap pasca analitik.
Kualitas pemeriksaan bidang mikrobiologi sangat bergantung kepada kualitas media yang dipakai. Media kultur dapat disediakan baik dalam bentuk base (dasar) kering secara komersial, dari racikan bahan-bahan baku yang berbeda atau dari media yang siap pakai yang dikemas dalam tabung dan cawan plastik. Walaupun media siap pakai ini masih diperdebatkan penggunaannya, kebanyakan ahli sangat setuju terutama dalam bentuk cairan karena lebih efisien dan ekonomis.
Perusahaan-perusahaan komersial yang ternama itu juga mempunyai program quality control sendiri dan dapat membuat media dengan hasil jauh lebih baik, serta kepekaan yang lebih tinggi dibanding yang dibuat sendiri oleh laboratorium pemakai. Jika biaya
tenaga kerja meningkat dan waktu yang dibutuhkan untuk quality control bertambah maka penyediaan media dari ramuan bahan-bahan mentah tidak dianjurkan.
Bakteri seperti mahluk hidup lainnya memerlukan nutrisi untuk pertumbuhan. Pengetahuan akan nutrisi pertumbuhan ini akan membantu di dalam mengkultivasi (penanaman), mengisolasi dan mengidentifikasi mikroorganisme. Mikroorganisme memiliki karakteristik dan ciri-ciri yang berbeda di dalam persyaratan pertumbuhannnya. Ada mikroorganisme yang bisa hidup hanya pada media yang mengandung sulfur dan ada pula yang tidak mampu, dan hal lain seterusnya. Karakteristik persyaratan pertumbuhan mikroorganisme.
Bakteri atau mikroorganisme lainnya agar dapat dibiakkan didalam laboratorium memerlukan media yang memungkinkan tumbuh dan berkembang secara optimal. Oleh karena itu media pembiakan harus mengandung cukup nutrien untuk pertumbuhan mikroorganisme, selain suhu dan pH. Meskipun persyaratan nutrien bakteri amat beragam, namun sebagai mahluk hidup, mereka mempunyai kebutuhan dasar yang sama, yaitu meliputi air, karbon, energi, mineral.
Untuk itu hasil laboratorium mikrobiologi yang berkualitas tinggi dapat diartikan sebagai suatu laporan yang sangat membantu dalam pencegahan atau penanggulangan penyakit. Tes laboratorium yang dikerjakan dengan sempurna diharapkan akan berkualitas tinggi, jika didukung media dan bahan dasar yang baik pula. Oleh karenanya penulisan panduan ini memiliki sasaran yaitu standar yang baik pada media.
Pa ge
1
Pa ge1
MediaMedia/ media adalah suatu bahan yang terdiri atas campuran nutrisi (nutrient) yang dipakai untuk menumbuhkan mikrobia.
Supaya mikrobia dapat tumbuh dengan baik dalam suatu media, perlu dipenuhi syarat-syarat sebagai berikut:
1. Harus mengandung semua nutrisi yang mudah digunakan oleh mikrobia. 2. Harus mempunyai tekanan osmose, tegangan permukaan dan pH yang sesuai. 3. Tidak mengandung zat-zat penghambat.
4. Harus steril.
Jenis media dapat digolongkan berdasarkan: a. Susunan kimia
Berdasarkan susunan kimianya, terdapat berbagai jenis media yaitu:
1) Media anorganik : media yang tersusun dari bahan-bahan anorganik, misalnya silika gel.
2) Media organik : media yang tersusun dari bahan-bahan organik.
3) Media sintetis : media buatan, dengan ramuan yang tertentu, baik ready for use maupun ramuan sendiri.
4) Media non sintetis : media alamiah, misalnya media wortel, media kentang dan lain-lain.
b. Konsistensi/ kepadatan
Berdasarkan konsistensinya, terdapat berbagai jenis media yaitu:
1) Media cair (liquid medium), yaitu media bentuk cair (broth) misalnya; air pepton, Nutrient Broth, Tarozzi dan lain-lain.
2) Media setengah padat (semi solid medium), misalnya; SIM, Carry & Blair, dan lain- lain.
3) Media padat (solid medium), yaitu media bentuk padat/ beku misalnya; Potato Dextrose Agar, Nutrient Agar, Blood Agar, serta media-media lainnya yang berbasis agar.
ge
2
ge
2
c. Fungsi
Berdasarkan fungsinya, terdapat berbagai jenis media yaitu:
1) Transport media: perbenihan yang digunakan untuk mengirimkan spesimen dari suatu tempat ke laboratorium.
Contoh : Carry and Blair untuk tinja/ rectal swab
Stuart dan medium Amies untuk usap nasofaring
2) Enrichment media: perbenihan yang digunakan untuk memperbanyak bakteri, baik yang ada di dalam spesimen maupun koloni-koloni yang kecil-kecil.
Contoh : Brain Heart Infussion Broth untuk darah (aerob) Thioglycolate Broth untuk darah (anaerob)
3) Enrichment exclusive media: perbenihan yang dapat memperbanyak segolongan bakteri sedangkan bakteri lainnya dihambat atau tidak dapat tumbuh.
Contoh : Alcalis pepton water untuk Vibrio spp.
Selenite Broth, Tellurite Broth, Azide broth untuk Salmonella spp. 4) Exclusive media: perbenihan yang hanya dapat ditumbuhi segolongan bakteri
saja, sedangkan bakteri lainnya tidak tumbuh dan dapat dibeda-bedakan koloni spesies satu dengan lainnya.
Contoh : Blood Tellurite plate untuk Vibrio cholera
Azide agar untuk Salmonella
5) Selective media: perbenihan yang dapat digunakan untuk membedakan golongan satu dengan lainnya, sehingga dapat dipilih koloni-koloni bakteri yang akan dicari.
Contoh : Blood agar, Brain Heart Infussion agar
Salmonella Shigella Agar untuk Salmonella Shigella d. Cara pembuatan
Berdasarkan cara pembuatannya, terdapat 2 jenis media yaitu: 1) Media buatan sendiri
a) dari bahan dasar
b) dari media dehidrasi (dehydrated) 2) Media jadi/ instan (komersial)
Pa ge
3
Pa ge3
Ruangan & Fasilitas Penunjang
Untuk pembuatan media khusus di bidang mikrobiologi sebaiknya memiliki ruangan tersendiri. Persyaratan standar konstruksi ruangan media skala Balai Laboratorium Kesehatan Provinsi dan Rumah Sakit adalah:
1. Dinding terbuat dari bahan porselin atau keramik setinggi 1,5 m dari permukaan lantai, sisanya dicat dengan warna terang.
2. Tinggi langit-langit antara 2,70 – 3,30 m dari lantai. 3. Lebar pintu minimal 1,20 m dan tinggi minimal 2,10 m. 4. Ambang bawah jendela minimal 1,00 m dari lantai.
5. Semua stop kontak dan saklar dipasang minimal 1,40 m dari lantai.
6. Lantai terbuat dari bahan yang kuat, mudah dibersihkan, berwarna terang dan tahan terhadap korosi akibat bahan kimia.
7. Meja beton dilapisi porselin/ keramik dengan tinggi 0,80 – 1,00 m.
8. Meja untuk instrumen elektronik harus tahan getaran, dengan permukaan berlapis polyvinil, atau kaca atau porselin (tanpa nat).
9. Penerangan yang cukup, dengan jenis lampu bercahaya putih atau neon.
10. Aliran udara yang terbatas dilengkapi Air Conditioner untuk menghindarkan dari kelembaban dalam ruangan. Dibatasi dengan sekat atau pintu kedua, sehingga ruangan tidak kontak langsung dengan udara luar yang dapat menyebabkan kontaminasi.
11. Temperatur serta kelembaban ruangan yang terkontrol dengan cara mensetting AC ruangan sekitar 20-22 °C dengan kelembaban sekitar 60-80 %.
12. Lemari atau rak-rak penyimpanan media yang terbuat dari bahan kaca-aluminium atau kayu (bebas rayap), dengan kondisi terlindung dari cahaya dan tidak lembab.
Penyimpanan Bahan & Reagen Media
Bahan laboratorium yang sudah ada harus ditangani secara cermat dengan mempertimbangkan:
1. Perputaran pemakaian dengan menggunakan kaidah: pertama masuk-pertama keluar (FIFO= first in - first out), yaitu bahwa barang yang lebih dahulu masuk persediaan harus digunakan lebih dahulu.
ge
4
ge
4
Hal ini adalah untuk menjamin barang tidak rusak akibat penyimpanan yang terlalu lama.
2. Tempat penyimpanan. 3. Suhu/ kelembaban.
4. Lama/ waktu penyimpanan dengan melihat masa kadaluarsa. 5. Incompatibility.
Pemilihan Bahan Media serta Reagen
Bahan media serta reagen yang akan digunakan sebaiknya merupakan bahan yang baik, tepat dan sesuai dalam peruntukannya. Oleh karenanya diperlukan upaya pemilihan bahan yang benar pula.
Pada umumnya untuk memilih bahan laboratorium yang akan dipergunakan harus mempertimbangkan hal-hal sebagai berikut:
1. Kebutuhan
2. Produksi pabrik yang telah dikenal
3. Deskripsi lengkap dari bahan atau produk 4. Mempunyai masa kadaluarsa yang panjang 5. Volume atau isi kemasan
6. Digunakan untuk pemakaian ulang atau sekali pakai 7. Mudah diperoleh di pasaran
8. Besarnya biaya tiap satuan (nilai ekonomis) 9. Pemasok/ vendor
10. Kelancaran dan kesinambungan pengadaan 11. Pelayanan purna jual
Hal-hal khusus yang harus diperhatikan pada media dan reagen adalah: Media
a. Media dehidrasi
1. Media yang didehidrasi tidak dapat disimpan untuk waktu yang tak terbatas, terutama bila penutup wadah telah dibuka.
2. Jumlah keseluruhan harus dikemas dalam wadah yang akan habis digunakan dalam 1-2 bulan.
Pa ge
5
Pa ge5
3. Saat diterima, semua wadah tertutup rapat.
4. Tanggal penerimaan harus dicatat pada setiap wadah.
5. Semua media dehidratasi harus disimpan di tempat gelap, sejuk (suhu < 25° C) dan berventilasi baik. Rak-rak penyimpanan tidak boleh ditempatkan di dekat autoklaf atau tempat pencucian karena suhu dan kelembaban yang tinggi. 6. Tanggal membuka kemasan harus dicatat pada wadah tersebut.
b. Media yang telah dilarutkan:
1. Hindari terkena cahaya matahari langsung atau panas.
2. Media yang diperkaya dengan darah, bahan organik atau antibiotik harus disimpan di dalam lemari es.
3. Harus dijaga agar media tidak mengalami kekeringan. Untuk media dalam petridish sebaiknya disimpan dalam kantong plastik tertutup dan disimpan di dalam lemari es.
4. Harus diperhatikan batas lama penyimpanannya, yaitu: • Tabung dengan sumbat kapas : 1 minggu • Tabung dengan sumbat longgar : 1 minggu • Cawan petri (dalam bungkus plastik) : 3 minggu • Botol dengan tutup ulir (screw cap) : 3 bulan
Reagen
Adapun beberapa reagen yang dibutuhkan dalam proses pembuatan media disimpan dan diusulkan dalam logistik secara berkala oleh penanggung jawab ruangan. Penyimpanan reagen didasarkan atas sifat reagen; berbahaya, korosif, eksplosif, dll. Reagen-reagen tersebut dibuatkan buku log reagen yang mencakup; nama jenis reagen, merek, fungsi, tanggal pengadaan (produksi), tanggal kadaluarsa.
Air (Aquadest)
Akuadestilata/ aquadest kemungkinan merupakan bahan termurah dari semua bahan yang digunakan di laboratorium, tetapi tetap merupakan bahan penunjang utama dalam pembuatan media. Akuades yang merupakan bahan terpenting dan yang paling
ge
6
ge
6
sering digunakan, karenanya kualitas air yang digunakan harus memenuhi standar seperti halnya bahan lain yang digunakan dalam analisis.
Laboratorium harus menetapkan tingkat kualitas air yang diperlukan sesuai dengan jenis pemeriksaan yang dilakukan.
Syarat:
1. pH sekitar 7 (bisa turun karena terpapar dengan udara) 2. Bebas materi
3. Kekeruhan
4. DHL (Daya Hantar Listrik)
Uji Kualitas Media
Agar media mempunyai kualitas seperti yang diharapkan perlu dilakukan uji kualitas, seperti uji sterilitas dan uji spesifitas. Uji sterilisasi di lakukan untuk mengetahui apakah bahan atau sediaan yang harus steril, sudah memenuhi syarat atau tidak. Uji sterilitas dapat dilakukan dengan mengeramkan (inkubasi) media selama 2-3 hari di dalam inkubator. Pada media idealnya tidak boleh ditemukan pertumbuhan bakteri. Akan tetapi koloni yang tumbuh < 2 dapat diterima.
Sedangkan uji spesifitas dilakukan dengan menggunakan bakteri kontrol yang sesuai dengan jenis dan fungsi media yang dibuat. Hal ini bermanfaat untuk membantu mengetahui kelompok dan jenis serta fungsi media yang dibutuhkan.
Uji kualitas media mencakup aspek yang luas, baik media buatan sendiri maupun media jadi, oleh karena itu penyiapan media harus mendapat perhatian.
Hal-hal yang perlu diperhatikan dalam penyiapan media:
a. Sampel media dehidrasi ditimbang dan ditambahkan ke dalam air suling dan bebas mineral, lalu dicampur untuk membuat suspensi yang homogen. Kemudian panaskan untuk melarutkan zat-zat dalam medium. Jumlah panas yang digunakan harus diatur hanya cukup sampai membuat larutan yang sempurna, kecuali dinyatakan lain dalam prosedur. Agitasi yang tetap selama proses pemanasan penting sebab bongkahan kecil agar, kecuali dalam suspensi, dapat turun ke dasar wadah dan pemecahannya memerlukan jumlah panas yang tinggi. Pemanasan lebih lama akan mengakibatkan denaturasi
Pa ge
7
Pa ge7
protein, karamelisasi karbohidrat, inaktivasi zat-zat gizi dan kehilangan kadar air yang berarti karena penguapan.
b. Media dilarutkan ke dalam wadah yang berukuran cukup dan sterilisasi dengan autoklaf, setelah selesai harus segera dikeluarkan dari autoklaf untuk menghindari pemanasan yang lebih lama. Wadah berisi media agar harus dipindahkan ke penangas air (waterbath) bersuhu 48-50° C sampai mencapai suhu yang diperlukan. Penyimpanan lebih lama di penangas air harus dihindari. c. pH setiap batch media harus diperiksa dengan pH meter setelah media
dibiarkan dingin sampai suhu kamar. Untuk menguji media agar, dapat digunakan elektrode permukaan atau permukaan biasa. Media yang menyimpang > 0,2 unit pH dari pH optimum harus dibuang.
d. Media dapat dituang ke dalam tabung atau cawan petri dalam ruangan bersih atau di bawah aliran udara laminar. Ruangan tersebut harus dijaga cukup terang, bebas dari bahan-bahan lain (kecuali yang diperlukan untuk prosedur penuangan media) dan bebas dari lalu lalang selama proses pembagian. Setiap usaha harus dilakukan untuk mencegah kontaminasi media pada tahap ini.
Oleh karenanya selama proses pembuatan media sebaiknya diawasi oleh seorang pengawas, agar dapat terjamin kualitasnya. Kualitas media harus diperiksa dahulu sebelum media digunakan. Ada bermacam-macam cara untuk menguji mutu media yang telah dibuat, yaitu:
a. Secara visual
Yaitu dengan memperhatikan atau melihat warna, kekeruhan dan lain-lain. Contoh:
1) Media gula-gula yang dilengkapi tabung Durham bila terlihat gelembung udara berarti sudah tidak dapat dipergunakan lagi.
2) Bila warna media tidak sesuai dengan warna standar maka harus dicurigai adanya perbedaan pH, untuk itu periksalah dengan pH meter.
Bila pH media berbeda ± 0,2 satuan, tambahkan asam atau basa atau dibuat baru.
ge
8
ge
8
b. Uji sterilitas
Uji sterilitas merupakan suatu keharusan terutama pada media yang diperkaya dengan bahan-bahan tertentu seperti agar darah atau agar coklat.
Cara:
1) Ambil sejumlah 5 % dari tiap batch media yang dibuat. 2) Inkubasi selama 1-2 hari pada suhu 35° C.
3) Bila terdapat pertumbuhan lebih dari 2 koloni mikroorganisme/ cawan petri atau lebih, berarti seluruh media dari batch tersebut tidak dapat dipakai. c. Uji spesifitas dengan penanaman mikroorganisme kontrol positif dan kontrol
negatif
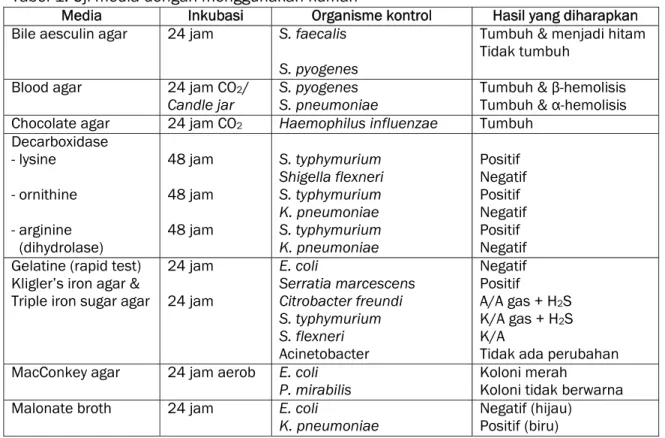
Mikroorganisme kontrol kualitas (strain kuman) adalah mikroorganisme spesifik yang seharusnya tumbuh pada media tertentu. Mikroorganisme tersebut memiliki ciri morfologi, biokimia, serologi yang dapat diuji dan mampu menunjukkan stabilitas reproduksi yang tetap bilamana ditempatkan pada kondisi yang sesuai.
Uji media dengan menggunakan mikroorganisme kontrol positif dan kontrol negatif ini dapat dilihat pada Tabel 1.
Tabel 1. Uji media dengan menggunakan kuman
Media Inkubasi Organisme kontrol Hasil yang diharapkan Bile aesculin agar 24 jam S. faecalis
S. pyogenes
Tumbuh & menjadi hitam Tidak tumbuh
Blood agar 24 jam CO2/
Candle jar S. pyogenes S. pneumoniae Tumbuh & β-hemolisis Tumbuh & α-hemolisis Chocolate agar 24 jam CO2 Haemophilus influenzae Tumbuh
Decarboxidase - lysine - ornithine - arginine (dihydrolase) 48 jam 48 jam 48 jam S. typhymurium Shigella flexneri S. typhymurium K. pneumoniae S. typhymurium K. pneumoniae Positif Negatif Positif Negatif Positif Negatif Gelatine (rapid test)
Kligler’s iron agar & Triple iron sugar agar
24 jam 24 jam E. coli Serratia marcescens Citrobacter freundi S. typhymurium S. flexneri Acinetobacter Negatif Positif A/A gas + H2S K/A gas + H2S K/A
Tidak ada perubahan MacConkey agar 24 jam aerob E. coli
P. mirabilis Koloni merah Koloni tidak berwarna Malonate broth 24 jam E. coli Negatif (hijau)
Pa ge
9
Pa ge9
Manitol salt agar 24 jam aerob S. aureus T. epidermidis E. coli
Koloni kuning Koloni merah muda Tidak tumbuh Methyl red/ Voges
Proskauer 48 jam E. coli K. pneumoniae Positif/ negatif Positif/ negatif Mueller Hinton Agar 24 jam E. coli ATCC 25922
S. aureus ATCC 25923 P. aeruginosa ATCC 27853
Pertumbuhan koloni tersuspensi merata Nitrate broth 24 jam E. coli
Acinetobacter Positif Negatif OF dextrose (tanpa
parafin) 24 jam P. aeruginosa
Acinetobacter calcoaceticus biovar Iwofii
Oksidasi pada permukaan
Tidak ada perubahan Peptone water
(indole) 24 jam E. coli P. mirabilis Positif Negatif Phenylalanine
deaminase 24 jam E. coli P. mirabilis Negatif Positif Rappaport broth Selenite broth Tetrahionate broth 24 jam S. typhimurium E. coli Tumbuh setelah subkultur
Tumbuh tanpa subkultur Salmonella/ Shigella
agar 24 jam aerob 24 jam suhu kamar E. coli S. typhimurium Yersinia enterolitica Shigella flexneri Tumbuh Tidak tumbuh
Tumbuh tidak berwarna Tumbuh tidak berwarna Simmons Citrate 48 jam E. coli
K. pneumoniae Tidak tumbuh Tumbuh warna biru TCBS 24 jam Vibrio (non aglutinasi)
E. coli Koloni kuning Tidak tumbuh Thayer Martin agar 24 jam CO2 N. meningitidis
M. gonorrhoeae Staphylococcus E. coli Candida albicans Tumbuh Tumbuh Tumbuh Tidak tumbuh Tumbuh Thioglycollate broth 24 jam Bacteroides fragilis Tumbuh Urea medium 24 jam E. coli
P. mirabilis Negatif Positif (merah muda)
Sehingga untuk keperluan uji kualitas diatas, laboratorium idealnya memiliki stok kultur (strain kuman) sebagai syarat uji kualitas kontrol.
Kontrol Kualitas Ruangan Media
Sebagai ruang/ tempat penyimpanan, peracikan dan pengolahan media, diperlukan kondisi ruangan yang cukup terkontrol secara kualitatif. Syarat bersih saja pada ruang media belum cukup apabila tidak diuji dengan kontrol sterilitas. Belum ada standar baku mutu yang telah ditetapkan untuk kontrol kualitas (sterilitas) pada ruang media,
ge
10
ge
10
tetapi hal ini dilakukan untuk meningkatkan pengawasan personal yang bertanggung jawab terhadap media tentang keadaan sterilitas ruangannya. Selain itu, keadaan kebersihan ruang media pun dapat diketahui serta analis/ personal yang bertanggung jawab yakin akan jaminan mutu dari media yang dihasilkan.
Tindakan yang dapat dilakukan adalah menguji secara berkala dengan menempatkan media NA plate atau PCA steril dalam keadaan terbuka di beberapa sudut ruangan selama setengah hingga satu jam. Kemudian media diinkubasi selama 24 jam pada temperatur 35-37°C, atau pada 44,5 °C khusus untuk media selektif E. coli, lalu dihitung jumlah koloni bakteri yang tumbuh. Hasil yang didapat dicatat pada catatan khusus, dan dapat diberikan solusi terhadap kondisi ruang media yang kurang memenuhi syarat.
Kebersihan ruangan dijaga setiap saat, termasuk meja peracikan, lemari penyimpan stok media serta lemari pendingin penyimpanan media jadi. Bila menggunakan pendingin ruangan (Air Conditioner) idealnya dibersihkan secara berkala minimal 1 kali dalam 2 bulan, bila perlu sekali dalam 6 bulan dilakukan fumigasi menggunakan tablet formaldehid.
Penyimpanan Media Jadi
Setelah pembuatan media instan (siap pakai) selesai, media serta bahan pendukung yang ditempatkan dalam wadah-wadah petridish (dalam posisi terbalik) segera disimpan di dalam kantung-kantung plastik bening yang telah diberi keterangan berupa; Nama media dan tanggal pembuatan, disimpan dalam refrigerator dengan suhu yang relatif stabil ± 4°C.
Adapun media yang menggunakan wadah tabung-tabung reaksi bertutupkan kapas, sebaiknya ditutup lagi dengan aluminium foil atau plastic wrap atau parafilm. Agar menghindari evaporasi atau penguapan dari media selama penyimpanan, serta dapat menghindarkan media dari kontaminasi. Hal tersebut mampu menjamin kualitas media dan masa simpan yang relatif lebih lama. Tetapi banyaknya volume media yang dibuat disesuaikan kembali dengan kebutuhan laboratorium atau trend pemeriksaan. Sehingga media siap pakai yang dibuat sifatnya akan selalu fresh bagi spesimen uji.
Pa ge
11
Pa ge11
Pencatatan & Pelaporan
Pencatatan dan pelaporan setiap kegiatan di dalam laboratorium, khususnya di ruang media diperlukan untuk perencanaan, pemantauan dan evaluasi serta pengambilan keputusan untuk peningkatan kualitas pemeriksaan yang berdampak pada peningkatan kualitas laboratorium. Untuk itu kegiatan dalam ruangan media, pencatatan dan pelaporan harus dilakukan secara cermat dan teliti, karena kesalahan dalam pencatatan dan pelaporan akan mengakibatkan kesalahan dalam menetapkan suatu tindakan.
1. Pencatatan
Pencatatan kegiatan di ruang media dilakukan sesuai dengan jenis kegiatannya. Ada 4 jenis pencatatan, yaitu:
1) Pencatatan kegiatan pembuatan media 2) Pencatatan logistik
3) Pencatatan kegiatan pemeliharaan alat
4) Pencatatan kegiatan pemantapan mutu internal, seperti uji sterilitas media 2. Pelaporan
Pelaporan kegiatan di ruang media meliputi: 1) Laporan kegiatan rutin harian & bulanan
2) Laporan akhir tahun dan evaluasi sebagai bahan referensi pengusulan bahan tahun berikutnya.
Sebagai penunjang dalam pembuatan media diperlukan alat-alat berikut. Untuk penggunaan dan perawatannya terlebih dahulu user harus mengenali sifat alat dan harus memahami cara dan langkah-langkahnya.
Lemari Pendingin (Refrigetor/ Freezer)
1) Catat suhu setiap hari dengan termometer atau suhu yang terlihat pada digital display pada freezer.
Termometer yang digunakan harus sesuai dengan suhu alat yang dikalibrasi, misalnya 2-8.
ge
12
ge
12
2) Secara berkala periksa dengan menggunakan termometer standar.
3) Cocokkan hasil yang didapat antara suhu yang ditunjukkan oleh thermometer digital display dengan termometer standar.
Cara penggunaan lemari pendingin (Refrigerator/ Freezer)
1. Lemari pendingin (refrigerator), lemari pembeku (freezer) dan tabung es kering (dry ice) harus dibersihkan dan esnya dicairkan (defrost) secara teratur.
2. Buang ampul, tabung, botol dan wadah lain yang pecah selama disimpan. Gunakan alat pelindung muka dan sarung tangan karet tebal saat bekerja. Setelah dibersihkan, permukaan dalam lemari pendingin dan lemari pembeku harus desinfeksi dengan desinfektan yang tidak korosif.
3. Semua wadah yang disimpan harus diberi label yang jelas berisi nama bahan, tanggal disimpan dan nama orang yang menyimpan.
4. Wadah yang tidak berlabel dan bahan yang sudah kadaluarsa harus diautoklaf. 5. Cairan yang mudah terbakar tidak boleh disimpan dalam lemari pendingin. Pemeliharaan dan Pencegahan
Bersihkan dan defrost freezer lemari pendingin sekali setiap bulan. Setiap hari catat suhu yang ditunjukkan oleh termometer.
Hot plate-stirrer
Alat ini berguna untuk melarutkan (memanaskan) atau menghomogenkan media serta reagen.
Pemeliharaan dan Pencegahan
1. Gelas piala atau erlenmeyer yang digunakan upayakan pada bagian bawahnya kering.
2. Usahakan alat selalu dalam keadaan bersih, hindari panas yang berlebihan dan meninggalkan media yang sedang dipanaskan agar tidak menyebabkan media gosong.
3. Catat penggunaannya; Nama pengguna, No Hot plate yang digunakan, serta sistem data alat yang dijalankan (% panas dan kecepatan putar).
Pa ge
13
Pa ge13
4. Gunakan magnetic stirrer yang sesuai dengan standar untuk menghindari gesekan pada gelas piala maupun erlenmeyer.
5. Sebelum alat dimatikan, pastikan pada setiap tempat pemanas tidak dalam keadaan ON dengan meng-NOL-kan semua tempat pemanas.
Timbangan
1. Periksalah selalu selalu jarum penunjuk angka (angka menunjuk 0) setiap kali akan menimbang.
2. Gunakan selalu pinset untuk mengangkat anak timbangan. 3. Bahan yang akan ditimbang harus sesuai suhu kamar.
4. Mengurangi atau menambah beban dilakukan pada saat timbangan dalam keadaan istirahat.
5. Pintu kotak selalu tertutup pada waktu menimbang. a. Timbangan Elektrik (Electrical Balance)
Kalibrasi timbangan dilakukan setiap hari dengan memakai anak timbangan standar yang bersertifikasi kelas S.
Cara kalibrasi anak timbangan:
1) Lakukan penimbangan anak timbangan standar. 2) Catat hasil penimbangan.
3) Ulangi sampai 5 kali, hitung nilai rata-rata toleransi perbedaaan berat yang masih dapat diterima adalah:
Untuk berat 1 – 50 mg = ± 0,014 mg Untuk berat 100 – 500 mg = ± 0,025 mg Untuk berat 1 – 5 mg = ± 0,054 mg b. Timbangan Analitik (Analytical Balance)
Kalibrasi anak timbangan dilakukan dengan anak timbangan standar yang bersertifikasi kelas M, yang memperlihatkan nilai nominal setiap anak timbangan, deviasi sistematik dari nilai nominal, kelas ketelitian, ketidak pastian, nilai massa dan massa jenis bahan atau volume.
Cara kalibrasi anak timbangan:
ge
14
ge
14
2) Letakkan anak timbangan standar yang teringan. Timbang anak timbangan yang dipakai sehari-hari. Baca dan catat hasilnya.
3) Ulangi penimbangan dengan anak timbangan standar yang lebih berat.
4) Anak timbangan dianggap masih tepat bila berat yang ditunjukkan oleh anak timbangan tidak menyimpang lebih dari 0,1 % dari berat masing-masing anak timbangan standar.
Pemeliharaan dan Pencegahan
Bersihkan alas timbang dan layar digital dari debu, ceceran zat yang ditimbang setiap habis menggunakan.
Autoklaf (Autoclave)
Penggunaan autoklaf dengan prinsip penguapan dalam kondisi jenuh dan bertekanan (autoclaving) adalah cara yang paling efektif dan terbaik untuk mensterilkan bahan atau alat-alat laboratorium. Untuk berbagai tujuan, siklus berikut akan memastikan sterilisasi yang terpat bagi proses penggunaan autoklaf:
• Waktu tinggal 3 menit pada 134°C • Waktu tinggal 10 menit pada 126°C • Waktu tinggal 15 menit pada 121°C • Waktu tinggal 25 menit pada 115°C
Bahan atau alat yang akan didesinfeksi atau sterilisasi di dalam ruang autoklaf harus dibungkus dan tidak dikencangkan atau tetap longgar agar untuk kemudahan perpindahan udara dan penetrasi uap. Penggunaan kantong harus dilakukan dengan benar agar uap air tetap dapat menjangkau isinya.
Aturan berikut dapat memperkecil resiko yang mungkin terjadi ketika mengoperasikan bejana bertekanan.
1. Tanggung jawab untuk pengoperasian dan pemeliharaan rutin harus diserahkan kepada operator yang terlatih dan program pencegahan yang meliputi pemeriksaan reguler pada ruang autoklaf, lapisan pintu dan semua gauges serta kontrol oleh personil yang berkompeten.
Pa ge
15
Pa ge15
2. Uap air harus dijenuhkan dan terbebas dari bahan-bahan penghambat atau korosif atau bahan kimia lain, yang bisa mencemari materi yang telah disterilkan.
3. Semua bahan yang akan diautoklaf harus berada di dalam kontainer yang memudahkan perpindahan udara dan penetrasi panas yang baik: ruang dalam autoklaf jangan terlalu padat sehingga uap air tidak bisa menjangkau bahan atau alat yang disterilisasi dengan merata.
4. Untuk autoklaf tanpa alat keselamatan interlocking yang mencegah pintu dibuka ketika ruang autoklaf diberi tekanan, saluran uap utama harus tertutup dan temperatur dibiarkan untuk turun dibawah 80°C sebelum pintu dibuka.
5. Operator perlu memakai sarung tangan dan perlindungan wajah perlindungan wajah pelindung muka (visor) yang sesuai untuk perlindungan ketika membuka autoklaf, bahkan ketika temperatur telah turun dibawah 80°C.
6. Pada setiap monitoring rutin untuk menjaga kinerja autoklaf, indikator biologi atau thermocouples seharusnya ditempatkan di pusat dari setiap beban. Monitoring reguler dengan thermocouples dan alat perekam dalam “kasus terburuk” sangat diperlukan untuk menentukan siklus operasional yang sesuai.
7. Saringan saluran ruang autoklaf (jika tersedia) harus dikeluarkan dan dibersihkan setiap hari.
8. Perawatan yang baik harus dikerjakan untuk memastikan bahwa klep untuk udara keluar dari autoklaf panci bertekanan tidak terhalangi oleh kertas, dan benda lainnya yang dimasukkan.
Pemeliharaan dan Pencegahan
Bersihkan alat, serta mengganti air (akuades) dalam autoklaf sekali dalam sebulan. Uji Sterilitas Autoclave
Secara berkala yaitu sekali dalam sebulan autoclave yang biasa digunakan untuk pembuatan media diuji kesterilannya. Adapun uji sterilitas yang paling sederhana adalah dengan menggunakan autoclave tape indicator, yang biasa ditempelkan pada setiap kemasan bahan yang akan disterilisasi. Uji sterilitas autoklaf lainnya bisa menggunakan thermocouples seperti yang telah dijelaskan diatas, yaitu dengan cara berikut.
ge
16
ge
16
• Kemudian setelah turut disterilisasi bersama bahan, thermocouples diinkubasi dalam inkubator (37° C, 24 jam), jika terjadi kekeruhan maka bahan yang disterilisasi bersama thermocouples dianggap tidak streril dan autoklaf perlu dibersihan dengan desinfektan kemudian diulang proses sterilisasinya.
Cara lain yang juga sederhana untuk dilakukan adalah dengan membungkus sekitar 10 gr tanah dengan aluminium foil dan kertas, kemudian turut disterilisasi bersama bahan. Lalu tanah tersebut diinkubasi ke dalam larutan media penyubur (37° C, 24 jam), jika terjadi kekeruhan dalam media tersebut maka bahan yang disterilisasi bersama tanah dianggap tidak steril dan autoklaf perlu dibersihkan dengan desinfektan kemudian diulang proses sterilisasinya.
Tempat Penyimpanan Alat-alat Gelas
Umumnya berbentuk lemari atau rak display atau laci, sehingga tampak dari luar alat-alat gelas yang sedang tersimpan. Bahan lemari atau rak dapat terbuat dari kayu-kaca atau aluminium-kaca, ataupun plastik.
Tata cara penyimpanan alat-alat gelas adalah sebagai berikut. 1. Simpan alat-alat gelas dalam keadaan kering dan bersih.
2. Apabila tempat penyimpan tertutup, sediakan silica gel sebagai kontrol kelembaban.
3. Apabila tempat penyimpanan bergabung dengan tempat tiris setelah pencucian alat, upayakan terdapat penampung air pada bagian bawah lemari.
4. Simpan alat-alat gelas sesuai dengan kelompok jenisnya, dengan ukuran kecil berada paling depan.
5. Buat inventaris alat gelas yang ada di ruang media serta catat logistik alat-alat gelas yang didistribusikan dari gudang.
Meja Peracikan & Persiapan Media
Untuk menyiapkan media, diperlukan meja untuk menyusun bahan serta alat. Meja peracikan haruslah bersih. Sebaiknya permukaan meja terbuat dari bahan porcelain atau polivinyl, sehingga mudah untuk dibersihkan. Bahan meja sebaiknya dipilih bahan yang kuat dan memiliki desain kokoh, sehingga tidak mudah goyang. Tinggi meja sekitar 1,1 – 1,25 m. Diatas meja peracikan sebaiknya tidak ditumpuk berbagai benda
Pa ge
17
Pa ge17
yang tidak diperlukan dalam persiapan media. Hal tersebut dapat mengganggu proses preparasi media. Alat timbangan dapat diletakkan di atas meja preparasi media ataupun terpisah pada meja tersendiri dengan konstruksi yang permanen.
Laminar Air Flow
Untuk pembuatan media siap pakai, baik dalam wadah petridish maupun tabung reaksi, pasca media disterilisasi sebaiknya menggunakan laminar air flow dalam penuangannya. Alat ini dilengkapi dengan lampu UV dan pompa-filter udara, sehingga dapat mengurangi adanya resiko kontaminasi pada pembuatan media siap pakai. Penggunaan laminar air flow sebaiknya dibersihkan dengan menyemprotkan alkohol 70% pada seluruh permukaan bagian dalam sebelum dan sesudah penggunaan, serta menyalakan lampu UV ketika tidak digunakan.
Penangas Air (Waterbath)
Yang perlu dipantau adalah suhu. Cara pemantauan pengatur suhu sama seperti pemantauan suhu pada refrigerator atau oven.
Pemeliharaan dan Pencegahan
Bersihkan dinding bagian dalam dan ganti air sekali dalam sebulan. Setiap hari cek ketinggian air serta periksa suhu pada setiap kali pemakaian. Gunakan wadah-wadah yang terbuat dari bahan aluminium atau stainless steel, hindari penggunaan rak ataupun wadah-wadah yang mudah berkarat dalam inkubasinya, karena akan mempengaruhi air dan alat waterbath.
Pemecahan Masalah (Trouble Shooting) pada Kerusakan Alat
Troubleshooting adalah proses atau kegiatan untuk mencari penyebab terjadinya penampilan alat yang tidak memuaskan, dan memilih cara penanganan yang benar untuk mengatasinya. Makin canggih suatu alat, akan makin kompleks permasalahan yang mungkin terjadi.
Didalam ruang media terdapat beberapa alat elektronik yang perlu diperhatikan dalam penggunaan, pemeliharaannya. Oleh karenanya buku petunjuk atau manual
ge
18
ge
18
penggunaan alat perlu disimpan baik sebagai panduan. In house training oleh suplier alat harus dilakukan sebelum alat digunakan, hal ini dimaksudkan sebagai uji kinaerja alat sebelum serah terima alat. Serta manual penggunaan alat perlu ditempel didekat setiap alat sehingga alat dipakai sesuai dengan prosedur.
Hal-hal yang perlu diperhatikan bila terjadi permasalahan pada peralatan: 1. Tetaplah tenang dan berpikirlah dengan jernih.
2. Pastikan masalahnya. Jangan membuat asumsi tentang kemungkinan permasalahan.
3. Jika penanganan sederhana gagal, minta bantuan supervisor/ atasan atau hubungi agen untuk menanyakan masalah tersebut.
4. Tempelkan label bahwa alat rusak.
5. Catatlah semua tindakan/ upaya perbaikan pada catatan khusus seperti contoh formulir di bawah ini.
FORMULIR PENCATATAN KONDISI PERALATAN Alat :
Ruang : Bulan : Suhu :
Tgl Suhu yg diukur Petugas Kondisi kerusakan Jenis perbaikan Tindakan Tgl servis, Oleh
Penanggungjawab (...)
Pa ge
19
Pa ge19
Alat-alat Gelas serta Logam yang digunakan di Ruang Media
Berikut ini adalah beberapa alat gelas yang digunakan dalam pembuatan media. 1. Erlenmeyer ; 1000, 750, 500, 250, 100, 50 mL
2. Gelas ukur ; 500, 100, 50 mL
3. Gelas piala ; 1000, 500, 100, 50 mL 4. Pipet ukur ; 10, 5, 1 mL
5. Spatula, batang pengaduk 6. Gelas timbang
7. Petridish 8. Tabung reaksi 9. Tabung tutup ulir 10. Glass bead
11. Jarum suntik dengan selang 12. Corong gelas
13. Botol bekas infus (dengan tutup karet) 14. Cincin pemberat
15. Syringe 1 – 5 mL 16. Bola hisap
Bahan-bahan habis pakai yang diperlukan di Ruang Media
1. Aquades 2. Kapas 3. Kassa
4. Aluminium foil 5. pH indicator strip
6. Indicator tape for autoclave 7. Spidol
8. Plastik bening (2 kg) 9. Spritus
10. Bahan dasar media, media instant 11. Reagen-reagen untuk media
ge
20
ge
20
Pencucian Alat-alat Gelas
1. Alat-alat gelas yang masih baru:
a. Dengan sepotong kain, debu yang menempel dibersihkan
b. Rendam dalam larutan HCl 1-2% semalam untuk menetralisasi sisa alkali pada gelas
c. Cuci hingga bersih dengan air (dapat dengan air hangat) kemudian dibilas dengan aquadest/ air bebas ion
Pa ge
21
Pa ge21
d. Keringkan, disumbat/ dibungkus, kemudian siap untuk disterlisasi kering (oven) 2. Alat-alat gelas bekas pakai:
a. Cuci dengan sabun cair, lebih baik dengan Extrant hingga bersih
b. Setelah dicuci air, direndam dalam larutan HCl 1-2% 10-15 menit untuk melunturkan sisa alkali pada permukaan gelas
c. Cuci hingga bersih dengan air (dapat dengan air hangat), kemudian dibilas dengan aquadest / air bebas ion
d. Keringkan, disumbat/ dibungkus, kemudian siap untuk disterlisasi kering (oven) 3. Alat-alat gelas bekas pakai, infeksius:
a. Rebus dengan air sampai mendidih, atau dimasukkan ke dalam autoklaf dengan waktu 15 menit, 121°C, 1,5 atm
b. Setelah dingin, cuci dengan air, kemudian rendam dengan air yang diberi sabun cair semalam
c. Setelah dicuci,direndam dalam larutan HCl 1-2% semalam untuk melunturkan sisa alkali pada permukaan gelas
d. Cuci hingga bersih dengan air, kemudian dibilas dengan aquadest/ air bebas ion
e. Keringkan, disumbat/ dibungkus, kemudian siap untuk disterlisasi kering (oven) 4. Pipet bekas pakai:
a. Pipet bekas pakai yang infeksius direndam dalam desinfektan, misalnya fenol 5% semalam
b. Setelah dicuci dengan air, rendam dalam air sabun (sabun cair) c. Cuci dengan air kemudian direndam dalam HCl 1-2% semalam
d. Cuci hingga bersih dengan air, kemudian dibilas dengan aquadest/ air bebas ion (jika ada bekas yang sukar dihilangkan, direndam dulu semalam pakai kalium bikromat)
e. Keringkan, disumbat/ dibungkus, kemudian siap untuk disterlisasi kering (oven) 5. Peralatan lain;
Alat-alat plastik
a. Rendam dalam larutan hypochlorite 3% secukupnya
ge
22
ge
22
c. Dikeringkan dan siap disterilisasi dengan autoklaf atau sinar ultraviolet Peralatan Seitz filter dan milipore filter
a. Bagian-bagian dari peralatan filter dibuka dan diperiksa apakah filter masih utuh (tidak sobek, berlubang), bila filter cacat maka penyaringan harus diulangi dengan filter yang baru
b. Bersihkan bagian-bagian dari peralatan saringan dengan air hangat, kemudian dengan air dan dibilas dengan aquadest atau air bebas ion
c. Pasang kembali filter tersebut atau diganti yang baru, dibungkus dengan aluminium foil atau kertas dan siap disterilisasi dengan autoklaf atau dengan oven
Kesalahan-Kesalahan Yang Terjadi Selama Proses Pembuatan Media
Di setiap pembuatan media, dapat terjadi beberapa kesalahan yang disebabkan oleh beberapa faktor berikut.
1. Penimbangan yang tidak benar serta pengukuran volume pengencer yang kurang tepat.
2. Kualitas akuades yang tidak standar. Karena terdapat beberapa kendala dibeberapa area di Indonesia contohnya Kalimantan Timur, sumber air memiliki pH yang cukup rendah sehingga akuades yang dihasilkan terkadang masih bersifat asam. Sehingga perlu dicek kembali akuades yang akan digunakan, baik itu akuades didapatkan dengan cara penyulingan sendiri maupun produk kemasan siap pakai. Adapun pilihan beberapa nama produsen akuades cukup menjaga kualitasnya.
3. Wadah yang tercemar, baik petridish maupun tabung reaksi. Hal ini membuat media siap pakai menjadi terkontaminasi.
4. Terlalu panas (overheating) pada proses pembuatannya; sebagai contoh, terdapat instruksi pembuatan pada kemasan yang menunjukkan pada suhu berapa media tersebut dipanaskan. Hal tersebut bertujuan agar kerusakan bahan-bahan yang terdapat dalam komposisi media dapat dihindari.
Overheating dapat menghilangkan daya gel agar, memecah karbohidrat, mengubah pH, membentuk endapan dan merubah warna. Hal ini dapat terjadi
Pa ge
23
Pa ge23
disebabkan oleh pengamatan yang kurang teliti terhadap waktu dan tekanan di dalam autoklaf, kelalaian mengeluarkan uap dari dalam autoklaf pada waktunya, terlalu lama menempatkan bahan-bahan media yang larut dalam panas di dalam waterbath atau karena melarutkan bahan atau media dengan pemanasan yang berulang-ulang.
Terkadang media yang mengandung agar juga dibatasi suhu pemanasannya, sehingga membuat proses melarutkan agar berlangsung lama. Hal ini dapat diatasi dengan memanaskan media tersebut pada suhu yang lebih tinggi dengan waktu yang relatif singkat, dapat menggunakan waterbath ataupun microwave.
5. Terlalu lama disimpan pada suhu 50° C. Media yang disterilisasi dalam autoklaf terkadang memakan waktu yang cukup lama untuk membuat kondisi tekanan dalam autoklaf menjadi 0. Kemudian tindakan meninggalkan media di dalam autoklaf tanpa mengeluarkan dan mendinginkannya akan berakibat media mengalami karamelisasi. Sehingga media tidak akan dapat digunakan lagi.
6. Cara melarutkan beberapa jenis media yang mengandung agar yang kurang sempurna. Hal ini akan menyebabkan media tidak dapat memadat dengan sempurna, sehingga media tidak dapat digunakan.
7. Kesalahan penyimpanan media/ bahan baku. Akibat dari kesalahan pembuatan media:
• Terjadi kekeruhan/ pengendapan
• Warna terlalu gelap (kadang media menjadi gosong) • Agar-agar/media terlalu lunak
• Pertumbuhan kuman yang jelek atau bahkan tidak tumbuh
Sistem Pembuangan (Waste Disposal)
Limbah adalah segala sesuatu yang harus dibuang. Kebanyakan dari kasus limbah di ruang media adalah dari instrumen, serta peralatan gelas yang pecah, serta media yang terkontaminasi atau kadaluarsa. Penanganan limbah tersebut dipisah berdasarkan sifat bahaya masing-masing bahan.
ge
24
ge
24
a. Bahan gelas
Pecahan gelas cukup berbahaya apabila dibuang secara sembarang di tempat sampah umum, bercampur dengan bahan lain karena bahan ini dapat didaur ulang. Untuk menghindari luka, pecahan kaca ditempatkan dalam wadah kardus yang memiliki tutup.
b. Bahan media yang terkontaminasi
Bahan media yang telah terkontaminasi tidak lagi dapat digunakan dan harus dibuang. Pembuangan bahan tersebut upayakan menggunakan berita acara pemusnahan serta dibuang dalam satu wadah misal kardus. Hubungi distributor atau agen penyedia media untuk membantu menampung atau memusnahkan media yang terkontaminasi tersebut.
c. Bahan media yang kadaluarsa
Bahan media kadaluarsa tidak lagi dapat digunakan dan harus dibuang. Pembuangan bahan tersebut upayakan menggunakan berita acara pemusnahan serta dibuang dalam satu wadah misal kardus. Hubungi distributor atau agen penyedia media untuk membantu menampung atau memusnahkan media kadaluarsa tersebut.
Untuk menghindari kondisi tersebut, perlu dilakukan pengecekan yang seksama terhadap logistik bahan media yang datang mengedai kondisi fisik, tanggal kadaluarsa, serta strategi order yang disesuaikan dengan pemakaian agak penumpukan bahan dalam gudang bahan tidak terjadi.
Pa ge
25
Pa ge25
D a f t a r P u s t a k a
---Anonim, 2004, Pedoman Praktek Laboratorium Yang Benar (Good Laboratory Practice), Departemen Kesehatan RI (Dirjen Pelayanan Medik-Direktorat Labkes), Jakarta.
Anonim, 2005, Pengetahuan Media, Samarinda.
Anonim, Standard Operating Procedures in Microbiology.
Dewi, Atika Ratna., Uji Kualitas Media & Reagensia, Balai Laboratorium Kesehatan Yogyakarta, 2009.
Sri Harjati S dkk., 2008, Pedoman Keselamatan Kerja di Laboratorium Mikrobiologi dan Rumah Sakit, PT. Merck Tbk. (PT. Multazam Mitra Prima), Jakarta.
ge