PROGRAM STUDI TEKNIK LINGKUNGAN FAKULTAS TEKNIK
UNIVERSITAS SUMATERA UTARA MEDAN
2019
ADSORPSI LOGAM Pb DAN Cd MENGGUNAKAN SABUT KELAPA DAN KARBON AKTIF DARI SABUT KELAPA
TUGAS AKHIR
Oleh
LAURA THERESIA TURNIP 140407046
Pembimbing
Prof. Dr. Ir. Muhammad Turmuzi, M.S
TA/TL-USU/2019/122
PROGRAM STUDI TEKNIK LINGKUNGAN FAKULTAS TEKNIK
UNIVERSITAS SUMATERA UTARA MEDAN
2019
ADSORPSI LOGAM Pb DAN Cd MENGGUNAKAN SABUT KELAPA DAN KARBON AKTIF DARI SABUT KELAPA
TUGAS AKHIR
Oleh
LAURA THERESIA TURNIP 140407046
TUGAS AKHIR INI DIAJUKAN UNTUK MELENGKAPI SEBAGIAN PERSYARATAN MENJADI SARJANA TEKNIK
Saya menyatakan dengan sesungguhnyabahwa tugas akhir dengan judul:
ADSORPSI
LOGAM Tb DAN
CdMENGGUNAKAN
SABUTKELAPA
DANKARBON AKTM'DARI
SABUTIMLAPA
Dibuat untuk melengkapi sebagian persyaratan menjadi Sarjana Teknik pada Program Studi Teknik Lingkungan Fakultas Teknik Universitas Sumatera Utara. Tugas akhir ini adalah hasil karya saya kecuali kutipan-kutipan yang telah saya sebutkan sumbernya.
Demikian persyaratan ini dibuat, apabila dikemudian hari terbukti bahwa karya ini bukan karya saya atau merupakan hasil jiplakan maka saya bersedia menerima sanksi sesuai dengan aturan yang berlaku.
Medan, April2019
LAURA THERESIA TURNIP NrM. 140407046
IIALAMAN PENGESAIIAN
Tugas akhir dengan judul:
ADSORPSI
LOGAM
PbDAN
CdMENGGUNAKAN
SABUTKELAPA DAN KARBON
AKTTFDARI
SABUTKELAPA
Dibuat untuk melengkapi persyaratan menjadi Sarjana Teknik pada Program Studi Teknik Lingkungan Fakultas Teknik Universitas Sumatera Utara. Tugas Akhir ini telah diujikan pada Sidang Tugas Akhir pada 06 Februari 2019 dan dinyatakan telah memenuhi syarat/sah sebagai Tugas Akhir pada Program Studi Teknik Lingkungan Fakultas Teknik Universitas Sumatera Utara.
Medan,
April2019 DosenPembimbingDosen Penguji I
D;r$ot"n
Penguji II-/l-
Dr. Amir Husin. S.T.. M.T..
}\IIP. 19690215 l99st2 1 001 NIP. 19680425 199903 2 004
Mengetahui,
KetuaProgram Studi
Ir. Netti Herlin Isra' Survati. S.T.. M.Si.
NrP. 19790622 201404 2 001 NrP. 19611225 198903 2 003
Menyetujui,
NIP. 19680425 1999A3 2 004
ABSTRAK
Perkembangan dunia industri memberikan dampak terhadap peningkatan jumlah limbah yang dihasilkan termasuk limbah yang mengandung logam berat. Logam berat dapat berbahaya bagi kesehatan karena bersifat karsinogenik. Timbal (Pb) dan kadmium (Cd) adalah jenis logam yang paling banyak ditemukan di lingkungan air. Salah satu metode untuk menyisihkan logam berat dalam lingkungan air adalah adsorpsi. Tujuan dilakukan penelitian ini adalah untuk mengkaji tingkat efisiensi penyisihan Pb dan Cd menggunakan biosorben maupun karbon aktif dan untuk mengkaji kinetika adsorpsi dan isoterm adsorpsi yang sesuai. Pada penelitian ini sabut kelapa digunakan sebagai adsorben untuk menyisihkan logam Pb dan Cd dalam sistem batch. Ada dua jenis adsorben dari sabut kelapa yang digunakan yaitu biosorben dari sabut kelapa tanpa diolah dan karbon aktif dari sabut kelapa yang diaktivasi secara kimia. Variabel yang dikaji adalah pengaruh waktu kontak, pH dan dosis adsorben terhadapa efisiensi penyisihan logam Pb dan Cd. Pada biosorben diperoleh kondisi optimum yaitu waktu kontak 30 menit pada pH 5 dengan dosis adsorben 0,5 gram sedangkan karbon aktif diperoleh kondisi optimum yaitu waktu kontak 45 menit pada pH 5 dengan dosis adsorben 1,0 gram. Model kinetika yang sesuai dalam proses adsorpsi logam Pb dan Cd oleh biosorben dan karbon aktif dari sabut kelapa adalah pseudo orde kedua. Model isoterm adsorpsi yang sesuai baik untuk biosorben maupun karbon aktif adalah Isoterm Langmuir. Pengujian SEM-EDS, iodin dan FTIR untuk mengetahui karakterisrik adsorben.
Kata kunci: Adsorpsi; Sabut Kelapa; Pb; Cd; Batch
ABSTRACT
The development of the industrial sector has an impact on increasing the amount of waste produced including wastes containing heavy metals. Heavy metals can be harmful to health because it is carcinogenic. Lead (Pb) and cadmium (Cd) are the types of metals most commonly found in water environments. One method for removing heavy metals in the water environment is adsorption. The purpose of this study was to examine the efficiency of removal of Pb and Cd using biosorbent and activated carbon and to assess the adsorption kinetics and adsorption isotherms accordingly. In this study coconut fiber was used as an adsorbent to remove Pb and Cd metals in a batch system. There are two types of adsorbents from coconut fiber used, namely biosorbent from coconut husk without processing and activated carbon from coconut husk which is chemically activated. The variables studied were the effect of contact time, pH and adsorbent dose on the efficiency of Pb and Cd metal removal. In the biosorbent optimum conditions were obtained, namely contact time of 30 minutes at pH 5 with an adsorbent dose of 0,5 grams whereas activated carbon obtained by optimum conditions, namely contact time of 45 minutes at pH 5 with an adsorbent dose of 1,0 grams. The appropriate kinetic model in the process of Pb and Cd metal adsorption by biosorbent and activated carbon from coconut husk is second-order pseudo. The adsorption isotherm model which is suitable both for biosorbent and activated carbon is Langmuir Isotherm. SEM-EDS, iodine and FTIR tests to determine the characteristics of the adsorbent.
Keyword: Adsorption; Coconut Husk; Pb; Cd; Batch
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa, karena atas berkat dan penyertaan-Nya penulis mampu menyelesaikan Tugas Akhir dengan judul
“Adsorpsi Logam Pb dan Cd Menggunakan Sabut Kelapa dan Karbon Aktif Dari Sabut Kelapa” sebagai persyaratan lulus sarjana pada Program Studi Teknik Lingkungan Universitas Sumatera Utara. Penulis ingin mengucapkan terima kasih yang sebesar- besarnya kepada seluruh pihak yang telah membantu serta memberikan dukungan dari awal sampai akhir proses pembuatan Tugas Akhir ini, khususnya kepada :
1. Bapak Prof. Dr. Ir. Muhammad Turmuzi, MS selaku dosen pembimbing, yang telah memberikan bimbingan, ilmu, masukan, dukungan, waktu, serta bantuan kepada penulis selama pengerjaan Tugas Akhir ini;
2. Ibu Ir. Netti Herlina, MT. selaku Ketua Program Studi Teknik Lingkungan USU, atas segala bimbingan dan bantuan yang telah diberikan;
3. Bapak Dr. Amir Husin, S.T., M.T. selaku Sekertaris Jurusan Program Studi Teknik Lingkungan USU;
4. Ibu Isra’ Suryati, S.T., M.Si. selaku koordinator Tugas Akhir, atas segala bimbingan dan bantuan yang telah diberikan;
5. Saudari Devi selaku Koordinator Laboratorium Penelitian Fakultas Farmasi yang memberi masukan maupun arahan saat melakukan aktivasi dan pengujian adsorpsi di laboratorium tersebut ;
6. Seluruh asisten Lab. Ekologi, Lab. PIK dan Lab. OTK yang memberi bantuan dalam penggunaan alat di laboratorium tersebut;
7. Saudari Kana Teknik Kimia 2014 yang memberi bantuan dalam menggunakan alat pirolisis saat penelitian;
8. Staff Administrasi Lab. Beton yang memberi bantuan dalam perihal surat izin dan juga waktu penggunaan alat;
9. Bapak Juna selaku Koordinator Lab di Politeknik Kimia Industri yang memberi bantuan dalam menganalisa sampel;
10. Saudari Riana selaku Koordinator lab Fisika UNIMED yang memberi bantuan dalan pengujian SEM-EDS;
11. Serta semua pihak yang telah membantu yang tidak bisa disebutkan satu persatu.
Penulis menyadari bahwa penyusunan Tugas Akhir ini masih jauh dari kesempurnaan.
Oleh karena itu, segala kritik, saran, dan masukan yang membangun dari semua pihak sangat diharapkan agar di masa yang akan datang laporan ini lebih sempurna. Akhir kata, penulis berharap semoga laporan ini dapat memberikan manfaat bagi kita semua.
Medan, April 2019
Penulis
DAFTAR ISI
PERNYATAAN KEASLIAN TUGAS AKHIR LEMBAR PENGESAHAN
ABSTRAK ABSTRACT
KATA PENGANTAR
DAFTAR ISI... i
DAFTAR TABEL ... iv
DAFTAR GAMBAR ... v
DAFTAR RUMUS ... vii BAB I PENDAHULUAN ... I - 1
1.1 Latar Belakang... I - 1 1.2 Rumusan Masalah ... I - 3 1.3 Tujuan Penelitian ... I - 4 1.4 Manfaat Penelitian ... I - 4 1.5 Ruang Lingkup Penelitian ... I - 5 BAB II TINJAUAN PUSTAKA ... II - 1 2.1 Logam Berat ... II - 1
2.1.1 Timbal ... II - 1 2.1.2 Kadmium ... II - 1 2.2 Sabut Kelapa... II - 2 2.3 Adsorpsi ... II - 3 2.4 Impregnasi dan Pirolisis ... II - 5 2.5 Kinetika Adsorpsi ... II - 5 2.5.1 Orde Pertama ... II - 6 2.5.2 Orde Kedua ... II - 6 2.6 Kesetimbangan Isotherm... II - 7 2.6.1 Isotherm Freundlich ... II - 8 2.6.2 Isotherm Langmuir ... II - 8 2.7 Scanning Electron Microscope (SEM) dan Energy Dispersion Spectrometry (EDS)
... II – 9 2.8 Uji Daya Serap Iodin ... II – 9 2.9 FTIR (Fourier Transform Infrared) ... II – 10 BAB III METODE PENELITIAN ... III - 1
3.1 Lokasi Penelitian ... III - 1 3.2 Waktu Penelitian... III - 1 3.3 Jenis Penelitian ... III - 1
3.4 Variabel Penelitian... III - 1 3.5 Sumber Data ... III - 2 3.6 Kerangka Penelitian ... III - 2 3.7 Langkah Penelitian ... III - 4 3.7.1 Pembuatan Air Limbah Sintetik ... III - 4 3.7.2 Reaktor Penelitian ... III - 4 3.8 Persiapan dan Pengujian ... III - 5 3.8.1 Tahap Persiapan ... III - 5 3.8.2 Tahap Pengujian Adsorpsi Logam ... III - 7 3.8.3 Pengujian Daya Serap Iodin ... III - 10 3.8.4 Scanning Electron Microscope (SEM) dan Energy Dispersion Spectrometry (EDS ... III - 10 3.8.5 Fourier Transform Infrared (FTIR) ... III - 10 3.8.6 Analisa Sampel ... III - 11 3.9. Analisa Data ... III - 11 3.9.1 Efisiensi Penyisihan (%RE) ... III - 11 3.9.2 Kinetika Adsorpsi ... III - 11 3.9.3 Isoterm Adsorpsi... III - 12 BAB IV HASIL DAN PEMBAHASAN ... IV - 1
4.1 Scanning Electron Microscope (SEM) dan Energy Dispersion Spectrometry (EDS) ... IV - 1 4.2 Fourier Transform Infrared (FTIR) ... IV – 4 4.3 Uji Daya Serap Iodin ... IV – 5 4.4 Pengaruh Waktu Kontak Terhadap Penyisihan Timbal (Pb) dan Kadmium (Cd) IV - 5 4.4.1 Pengaruh Waktu Kontak Terhadap Penyisihan Timbal (Pb) ... IV - 6 4.4.2 Pengaruh Waktu Kontak Terhadap Penyisihan Timbal (Cd) ... IV - 7 4.5 Pengaruh Nilai pH Terhadap Penyisihan Timbal (Pb) dan Kadmium (Cd)IV - 8 4.5.1 Pengaruh Nilai pH Terhadap Penyisihan Timbal (Pb) ... IV - 8 4.5.2 Pengaruh Nilai pH Terhadap Penyisihan Kadmium(Cd) ... IV - 9 4.6 Pengaruh Dosis Adsorben Terhadap Penyisihan Timbal (Pb) dan Kadmium
(Cd) IV - 10
4.6.1 Pengaruh Dosis Adsorben Terhadap Penyisihan Timbal (Pb) ... IV - 10 4.6.2 Pengaruh Dosis Adsorben Terhadap Penyisihan Kadmium (Cd).... IV - 12 4.7 Kinetika Adsorpsi ... IV - 13 4.8 Isoterm Adsorpsi ... IV - 19 BAB V PENUTUP ... V - 1
5.1 Kesimpulan ... V - 1 5.2 Saran ... V - 2 DAFTAR PUSTAKA
LAMPIRAN
DAFTAR TABEL
Tabel 4.1 Uji Daya Serap Iodin ... IV - 5 Tabel 4.2 Persamaan dan Nilai Korelasi Kinetika ... IV - 16 Tabel 4.3 Parameter Model Kinetika Adsorpsi Pb dan Cd ... IV - 17 Tabel 4.4 Persamaan dan Nilai Koefisien Korelasi Pemodelan Isoterm Adsorpsi . IV - 21 Tabel 4.5 Parameter Isoterm Adsorpsi Pb dan Cd ... IV– 22
DAFTAR GAMBAR
Gambar 2.1 Plot Konsentrasi Dan Log Konsentrasi Terhadap Waktu... II - 6 Gambar 3.1 Diagram Alir Penelitian ... III - 3 Gambar 3.2 Flowchart Pembuatan Sampel Air Limbah Sintetik ... III - 4 Gambar 3.3 Reaktor Batch ... III - 4 Gambar 3.4 Flowchart Preparasi Sabut Kelapa ... III - 5 Gambar 3.5 Flowchart Biosorben ... III - 6 Gambar 3.6 Flowchart Pembuatan Karbon Aktif ... III - 7 Gambar 3.7 Flowchart Uji Penyisihan Logam Pb dan Cd ... III - 9 Gambar 4.1a Hasil Uji SEM Biosorben ... IV - 2 Gambar 4.1b Hasil Uji SEM Karbon Aktif ... IV - 2 Gambar 4.2a Hasil Uji EDS Biosorben ... IV - 3 Gambar 4.2b Hasil Uji EDS Karbon Aktif ... IV – 3 Gambar 4.3 FT-IR Biosorben dan Karbon Aktif ... IV – 4 Gambar 4.4 Pengaruh Waktu Kontak Terhadap Penyisihan Pb ... IV - 6 Gambar 4.5 Pengaruh Waktu Kontak Terhadap Penyisihan Cd ... IV - 7 Gambar 4.6 Pengaruh Nilai pH Terhadap Penyisihan Pb ... IV - 9 Gambar 4.7 Pengaruh Nilai pH Terhadap Penyisihan Cd ... IV - 10 Gambar 4.8 Pengaruh Dosis Adsorben Terhadap Penyisihan Pb ... IV - 11 Gambar 4.9 Pengaruh Dosis Adsorben Terhadap Penyisihan Cd ... IV - 12 Gambar 4.10a Grafik Linear Kinetika Adsorpsi Pb Pseudo Orde Pertama... IV - 14 Gambar 4.10b Grafik Linear Kinetika Adsorpsi Pb Pseudo Orde Kedua ... IV - 14 Gambar 4.11a Grafik Linear Kinetika Adsorpsi Cd Pseudo Orde Pertama ... IV - 15 Gambar 4.11b Grafik Linear Kinetika Adsorpsi Cd Pseudo Orde Kedua... IV - 15 Gambar 4.12a Grafik Linear Isoterm Adsorpsi Pb Langmuir ... IV - 19 Gambar 4.12b Grafik Linear Isoterm Adsorpsi Pb Freundlich ... IV - 19 Gambar 4.13a Grafik Linear Isoterm Adsorpsi Cd Langmuir ... IV - 20 Gambar 4.13b Grafik Linear Isoterm Adsorpsi Cd Freundlich ... IV - 20
DAFTAR RUMUS
Persamaan 2.1 Kapasitas Adsorpsi... II - 4 Persamaan 2.2 Efisiensi Penyisihan (%) ... II - 4 Persamaan 2.3 Persamaan Orde Pertama ... II - 6 Persamaan 2.4 Persaman Orde Kedua ... II - 6 Persamaan 2.5 Rumus qe ... II - 7 Persamaan 2.6 Konstanta Distribusi ... II - 7 Persamaan 2.7 Persamaan Langmuir... II - 8 Persamaan 2.8 Rumus RL... II - 8 Persamaan 2.9 Persamaan Freundlich ... II - 8 Persamaan 2.10 Daya Serap Iodin ... II - 9
BAB I PENDAHULUAN 1.1 Latar Belakang
Seiring dengan perkembangan zaman, jumlah perindustrian di Indonesia mengalami peningkatan. Peningkatan jumlah ini terjadi berdasarkan tuntutan industri maupun pabrik yang juga semakin meningkat dalam memenuhi kebutuhan kehidupan manusia sehari- hari. Adanya pertambahan jumlah industri mengakibatkan meningkatnya jumlah limbah yang dihasilkan dari setiap industri. Salah satu jenis limbah yang dihasilkan oleh industri yakni limbah yang mengandung logam berat dimana logam berat bersifat karsinogenik yang dapat membahayakan atau mengganggu kesehatan (Yadav et al., 2013).
Sumber utama logam berat dalam limbah cair terbagi dua yaitu alami dan antropogenik.
Sumber alami meliputi erosi tanah, aktivitas vulkanik, pelapukan batuan dan mineral, sedangkan sumber antropogenik terdiri dari pengolahan mineral, pembakaran bahan bakar, limpasan jalan, tempat pembuangan sampah, kegiatan pertanian, dan kegiatan industri (penambangan, pembuatan papan cetak, finishing dan pelapisan logam, pembuatan semikonduktor, pewarna extile (Akpor et al., 2014). Berdasarkan Organisasi Kesehatan Dunia (WHO), konsentrasi maksimum Pb (II) yang diperbolehkan yaitu 0,05 mg/l dalam air minum dan konsentrasi maksimum Cd (II) yang diperbolehkan yaitu 0,003 mg/l dalam air minum. Berdasarkan Peraturan Menteri Lingkungan Hidup Republik Indonesia Nomor 5 Tahun 2014 Tentang Baku Mutu Air Limbah pada lampiran XLVII menetapkan kadar maksimum timbal yaitu 0,1 mg/l dan kadmium 0,05 mg/l.
Demi menjaga kualitas air, beberapa teknik telah dikembangkan untuk memurnikan limbah industri sebelum dibuang ke aliran utama. Teknik-teknik ini termasuk membran filtrasi, ekstraksi pelarut, pertukaran ion, presipitasi kimia, oksidasi dan elektrodeposisi (Singanan dan Peter, 2013, Heidari et al., 2012, Reddy et al., 2010). Namun, banyak dari teknik-teknik tersebut tidak praktis untuk diterapkan karena beberapa kelemahan seperti biaya operasi tinggi, energi ion yang dikonsumsi tinggi, selektivitas yang rendah dan menghasilkan buangan beracun. Oleh karena itu, pendekatan fisikokimia dengan menggunakan metode adsorpsi telah diusulkan untuk menyelesaikan masalah ini.
Adsorpsi dianggap sebagai metode yang menjanjikan dan hemat biaya dalam menghilangkan logam berat. Teknik ini tidak menghasilkan residu padat dan cocok untuk
berbagai konsentrasi ion logam (Rangabhasiyam et al., 2014, Yadav et al., 2013, Demirbas, 2008).
Karbon aktif telah banyak digunakan sebagai adsorben karena memiliki luas permukaan yang besar dan kapasitas adsorpsi yang tinggi. Pembuatan karbon aktif umumnya melibatkan dua langkah: pirolisis dan aktivasi fisik dan / atau kimia zat arang yang dihasilkan. Aktivasi fisik melibatkan oksidasi dan gasifikasi pada suhu tinggi. Dalam proses aktivasi kimia, aktivasi dilakukan dalam satu langkah dengan dekomposisi termal dari material yang diresapi dengan bahan kimia tertentu seperti ZnCl2, NH4 Cl, BaCl2, MgCl2, NaOH, KOH, K2CO3, K2HPO4 and H3PO4. Selama aktivasi, sifat tekstur bahan juga bisa berubah. Kapasitas adsorpsi bahan telah terbukti ditingkatkan dengan proses aktivasi (Namasivayam and Sangeetha, 2004). Terlepas dari kemampuannya yang sangat baik untuk mengolah limbah industri, karbon aktif sangat mahal. Oleh karena itu, adsorben alternatif yang berasal dari bahan alami seperti limbah pertanian dan industri yang tersedia dalam jumlah besar dan murah perlu digunakan (Bhatnagar dan Sillanpaa, 2010, Kaur et al, 2013, Zhao et al., 2012).
Kelapa (Cocos nuciferas L.) adalah salah satu jenis pohon yang paling banyak ditanam di daerah tropis seperti Brazil, India, Filipina, Malaysia, Indonesia dan beberapa negara lain.
Kelapa dikenal memiliki fleksibilitas yang besar seperti yang terlihat dalam penggunaan bagian-bagian dari kelapa (tempurung kelapa, serat, dan pith) secara komersial dan industri Produksi kelapa Indonesia periode 2010-2015 menunjukkan tren kenaikan.
Berdasarkan data dari Komunitas Kelapa Asia Pasifik (apccsec.org), produksi kelapa di Indonesia merupakan yang terbesar kedua setelah Filipina. Sebagai data tambahan pada tahun 2016, produksi kelapa di Indonesia mencapai 18,3 juta ton dan ini merupakan yang tertinggi di dunia. Akibatnya, sejumlah besar limbah pengolahan kelapa menjadi masalah.
Sejauh ini, limbah kelapa telah digunakan untuk pupuk, rumah tangga, bantalan, bahan bangunan dan komponen otomotif atau dibiarkan membusuk di lading (Castro, et al, 2012; Ganiron, 2013).
Limbah sabut kelapa dapat digunakan sebagai bahan yang mampu mengurangi beberapa kadar logam yang terkandung dalam sistem perairan. Pinandari et al. (2011) mengemukakan bahwa sabut kelapa (Cocos nucifera) dapat dimanfaatkan sebagai salah satu bahan biomaterial yang dapat menyerap ion logam. Serat sabut kelapa mampu
menyerap ion logam seng, tembaga dan kromium sampai 50% dari konsentrasi ion logam tersebut dalam limbah pewarna tekstil (Gopalakrishnan et al., 2009). Potensi penggunaan serat sabut kelapa sebagai arang aktif untuk menghilangkan logam berat dari perairan cukup tinggi karena serat sabut kelapa mengandung lignin dan selulosa (Sudiarta et al., 2011). Konstituen sabut kelapa termasuk lignin-29,2%, selulosa-23,9% sebagai bahan yang tidak larut air sedangkan pektin dan hemiselulosa (26,0% sebagai bahan yang larut dalam air) dan sekitar 5% sebagai bahan anorganik (Grinwood dan Ashman, 1975).
Studi tentang sabut kelapa dilakukan oleh Agbozu dan Emoruwa (2014), persen penyisihan logam meningkat dimana konsentrasi ion logam awal (0,3-0,9 mg /l) dan perbandingan penyisihan logam yaitu Cr> Cu>Cd> Fe> Pb. Studi batch skala laboratorium juga telah dilakukan untuk menilai potensi sabut sebagai adsorben yang murah untuk menghilangkan timbal dan tembaga (Quek et al, 1998). Adsorpsi ion Cr (III) menggunakan sabut kelapa (C. nucifera) telah dipelajari menggunakan teknik radiotracer dan batch. Maksimum adsorpsi (sekitar 91%) dari Cr (III) dicapai dalam 30 menit penggunaan 100 mg sabut kelapa (dosis adsorben) (Ahmad et al., 2005). Karbon aktif, dikembangkan dari pith sabut kelapa, digunakan untuk adsorpsi Cd (II) dari larutan berair oleh Kadirvelu dan Namasivayam (2003). Persen penghapusan meningkat dengan pH dari 2 menjadi 4 dan tetap konstan hingga pH 10.
Berdasarkan penelitian yang telah dikemukakan sebelumnya, maka penulis akan melakukan studi penelitian mengenai penyisihan timbal dan kadmium menggunakan dua jenis adsorben yaitu biosorben sabut kelapa dan karbon aktif yang dibuat dari sabut kelapa. Objek penelitian yaitu studi kinetika adsorpsi (Model Pseudo-first Order dan Pseudo-second Order) dan studi isoterm adsorpsi (Model Langmuir dan Freundlich).
1.2 Rumusan Masalah
Rumusan masalah dari penelitian ini adalah untuk mengetahui efektivitas penyisihan timbal dan kadmium menggunakan dua jenis adsorben, yaitu: sabut kelapa dan karbon aktif dari sabut kelapa. Karbon aktif dibuat dari sabut kelapa dengan cara mengimpregnasi secara kimia menggunakan H3PO4 kemudian dioptimasi pengaruh variasi waktu kontak, dosis adsorben, dan pH terhadap efesiensi adsorpsi Pb dan Cd.
1.3 Tujuan Penelitian Tujuan penelitian ini adalah :
1. Untuk mengetahui dan mengkaji tingkat efisiensi adsorpsi penyisihan timbal dan kadmium dengan menggunakan 2 jenis adsorben, yaitu: sabut kelapa dan karbon aktif dari sabut kelapa melalui pengaruh variasi waktu kontak, dosis adsorben dan pH dalam sistem batch;
2. Untuk mengkaji kinetika adsorpsi dan isoterm adsorpsi.
1.4 Manfaat Penelitian Manfaat penelitian ini adalah:
1. Dapat mengetahui tingkat efektifitas adsorpsi menggunakan sabut kelapa sebagai adsorben;
2. Dapat mengetahui pengaruh variasi waktu kontak, dosis adsorben dan pH terhadap tingkat penyisihan timbal dan kadmium dengan menggunakan sabut kelapa sebagai adsorben dalam sistem batch;
3. Dapat memberikan informasi tentang model kinetik adsorpsi (Model Pseudo-first Order dan Pseudo-second Order) dan kesetimbangan adsorpsi (Model Langmuir dan Freundlich) dengan menggunakan adsorben dari sabut kelapa;
4. Sebagai referensi dan bahan kajian untuk penelitian selanjutnya terhadap penyisihan kandungan timbal dan kadmium yang terkandung dalam air limbah dengan menggunakan sabut kelapa sebagai adsorben dalam sistem batch.
1.5 Ruang Lingkup Penelitian
Adapun ruang lingkup penelitian ini akan dibatasi pada masalah sebagai berikut:
1. Limbah yang digunakan dalam penelitian ini adalah air limbah yang berasal dari limbah sintetik dengan melarutkan beberapa jumlah garam timbal Pb(NO3)2, dan Cd(CH3CO2)2 dalam air suling (aquadest).
2. Parameter yang akan diteliti adalah kandungan timbal dan kadmium.
3. Proses pengolahan limbah cair dilakukan dengan metode adsorpsi menggunakan sistem batch dengan adsorben dari bahan sabut kelapa.
4. Percobaan ini dilakukan dengan beberapa variasi variabel bebas yaitu:
a. Waktu kontak (menit) : 0, 5, 15, 30, 45 dan 60
b. Dosis adsorben (gram/liter) : (0; 1,25; 2,5; 3,75; 5,0 dan 6,25)
c. pH : 3, 4, 5 dan 6
5. Pengujian karakteristik adsorben melalui uji SEM-EDS, iodin dan FTIR.
BAB II
TINJAUAN PUSTAKA 2.1. Logam Berat
Logam berat adalah kelompok elemen yaitu logam dan metaloid dengan kerapatan atom lebih besar dari 4 ± 1 g / cm 3, misalnya, Cu, Zn, Hg, Cd, Pb, Sn, Fe, Mn, Ag, Cr, Co, Ni, As, Al dll ion logam ini umumnya dianggap sebagai kontaminan mineral beracun yang paling luas dari sistem tanah dan air (Salem dkk., 2000; Mohammed et al., 2011). Ion logam berat adalah salah satu pencemaran akuatik yang paling beracun dari berbagai industri. Logam berat sangat berbahaya bagi semua tanaman, hewan dan kehidupan manusia karena mobilitas yang tinggi di tanah dan air dan juga kecenderungan yang kuat untuk bioakumulasi dalam jaringan hidup melalui rantai makanan (Akar et al., 2012).
Contoh – contoh logam berat sebagai berikut:
2.1.1. Timbal
Timbal termasuk kelompok 14 dari tabel periodik, yang juga termasuk C, Si, Ge dan Sn.
Timbal memiliki karakteristik paling logam dari grup ini. Unsur ini memiliki nomor atom 82, massa atom 207, dua bilangan oksidasi (+2 dan +4) dan empat isotop alami (204Pb,
206Pb, 207Pb dan 208Pb) di mana 208Pb adalah yang paling berlimpah yaitu 52% dari total massa. Timbal adalah unsur logam transisi yang paling melimpah (Greenwood and Earnshaw 1984). Menurut World Health Organization (WHO), timbal adalah racun kumulatif yang mempengaruhi berbagai sistem tubuh, termasuk sistem neurologis, hematologi, gastrointestinal, kardiovaskular, dan ginjal. Anak-anak sangat rentan terhadap efek neurotoksik dari timbal, dan bahkan tingkat paparan yang relatif rendah dapat menyebabkan akibat yang serius dan pada beberapa kasus kerusakan neurologis ireversibel.
2.1.2 Kadmium
Kadmium adalah logam transisi baris kedua milik kelompok 12 dari tabel periodik, bersama dengan Zn dan Hg. Elemen ini memiliki nomor atom 48, massa atom 112, satu oksidasi utama (+2) dan delapan isotop alami (106Cd, 108Cd dan 110Cd ke 116Cd), yang
114Cd, 112Cd, 111Cd, 110Cd dan 113Cd memiliki kelimpahan 28,73%, 24,13%, 12,80%, 12,49% dan 12,22% masing-masing. Kimia kadmium paling mirip dengan Zn. Kadmium
murni adalah logam yang lunak, berwarna perak-putih. Kadmium klorida dan kadmium sulfat larut dalam air.
Kadmium (Cd) adalah logam alami yang terletak di Tabel Periodik Unsur antara seng (Zn) dan merkuri (Hg), dengan perilaku kimia yang mirip dengan Zn. Ini umumnya ada sebagai kation divalen, dikomplekskan dengan yang lain elemen (mis., CdCl2). Cd ada di kerak bumi sekitar 0,1 bagian per juta, biasanya ditemukan sebagai pengotor dalam timbunan Zn atau timbal (Pb), dan oleh karena itu diproduksi terutama sebagai produk sampingan dari peleburan Zn atau Pb (Wedepohl, 1995).
Berdasarkan WHO, paparan kadmium kronis menghasilkan berbagai macam efek akut dan kronis pada manusia. Kadmium terakumulasi dalam tubuh manusia dan terutama di ginjal. Menurut pengetahuan saat ini kerusakan ginjal (tubular ginjal kerusakan) mungkin merupakan efek kesehatan yang penting. Efek lain dari paparan cadmium adalah gangguan metabolisme kalsium, hiperkalsiuria dan pembentukan batu di ginjal. Paparan tinggi dapat menyebabkan kanker paru-paru dan kanker prostat.
2.2 Sabut Kelapa
Sabut kelapa merupakan bagian yang cukup besar dari buah kelapa, yaitu 35% dari berat keseluruhan buah. Sabut terdiri dari 70% empulur / pith dan 30% serat berdasarkan berat kering. Sabut kelapa terdiri dari serat dan gabus yang menghubungkan satu serat dengan serat lainnya. Sabut kelapa (Cocos nucifera) memiliki proporsi yang tinggi dari struktur polimer yang terdefinisi dengan baik dalam bentuknya komposisi: selulosa polisakarida dan hemiselulosa, dan lignin (masing-masing 28%, 38% dan 32,8%) (Pollard et al.,1992;
Van Dam, 2002). Bagian-bagian sabut kelapa sebagai berikut:
a. Serat Sabut Kelapa
Serat sabut kelapa adalah salah satu produk limbah pertanian yang sering digunakan sebagai adsorben dalam pengolahan air limbah. Ketersediaannya dan kelimpahannya sepanjang tahun di lingkungan membuatnya menjadi sumber adsorben yang tepat untuk menghilangkan ion logam dari lingkungan air. Unsur – unsur serat sabut kelapa yaitu ligmin-36,15%, selulosa-33,61%, pentosana-29,27%, abu-0,61%, basis kering (Woodroof, 1979). Konstituen lainnya adalah kemiselulosa dan ekstraktif. Ekstraktif ini
mengandung tanin, pektin, dengan gugus polyhenolic, karboksil dan hidroksil. Ligmins dan selulosa dalam sabut memberi sifat pertukaran adsorpsi / ion.
b. Pith Serat Kelapa
Dalam ekstraksi serat sabut dari sabut kelapa dan dalam produksi bahan jadi dari serat yang diekstrak, sejumlah besar debu/pith sabut dihasilkan. Debu/pith sabut kelapa digambarkan sebagai partikel coklat, spons dengan berat rendah yang jatuh ketika serat diparut dari kulit. Debu/pith sabut adalah sekitar 70% dari berat sabut kelapa (Tejano, 1985). Debu/pith sabut kaya akan selulosa, tanin, pentosan, furtural dan lignin (Gonzales, 1970; Joachim, 1930). Struktur berpori dari debu/pith sabut memungkinkan untuk menyerap air dalam jumlah besar tapi tetap, tetap tidak larut sangat mirip dengan hidrogel sintetis (Armstrong, 2008).
2.3 Adsorpsi
Adsorpsi adalah salah satu metode yang paling menjanjikan dibandingkan dengan yang lain karena berguna, biaya yang murah dan efisiensi yang tinggi di bawah konsentrasi logam yang rendah serta penting bagi purifikasi air limbah. Dengan demikian, adsorben dengan biaya rendah dan effektifitas tinggi yang berasal dari materi yang melimpah dan berkelanjutan di alam yang dibutuhkan. Bahan biomassa, seperti selulosa, hemiselulosa, lignin, bakteri, jamur, kitosan, dan limbah pertanian, memiliki banyak keuntungan yaitu sumber daya yang berkelanjutan, biaya rendah, biokompatibilitas, dan dampak lingkungan yang rendah. Oleh karena itu, bahan-bahan ini telah menarik perhatian besar pada pengembangan adsorben biomassa ( Das, 2010; Guo et al., 2008 ).
Adsorpsi merupakan proses perpindahan massa dengan cara zat ditransfer dari fase cair ke permukaan zat padat (adsorben) dimana proses perpindahan zat tersebut dapat terikat secara fisika maupun kimia (Davis M. L dan David A. Cornwell, 2008). Proses adsorpsi umumnya dianggap lebih baik untuk pengolahan air, karena kemudahan operasi dan kesederhanaan desain. Proses adsorpsi dapat menyisihkan berbagai jenis polutan organik maupun anorganik dari air maupun air limbah (Bhatnagar A dan Mika Sillanpaa, 2011).
Ada dua jenis adsorpsi yaitu adsorpsi fisik, di mana terjadi peningkatan dalam konsentrasi adsorbat pada antarmuka adalah karena tidak spesifik (yaitu, tidak tergantung pada sifat substansi) gaya van der Waals, dan kimia (chemisorption) yang disebabkan oleh reaksi
kimia antara adsorbat dan adsorben yang menciptakan ikatan kovalen atau ion. Adsorpsi fisik memiliki spesifik lemah, reversibel, efek termal kecil (unit kJ / mol), sedangkan kemisorpsi selektif, biasanya ireversibel, panasnya berkisar dari puluhan hingga ratusan kJ / mol (Gupta et al., 2015; Tripathi dan Ranjan, 2015; Singh dan Gupta, 2016).
Adapun kapasitas adsorpsi pada waktu t, qe (mg/g) diberikan pada persamaan berikut (Kumari, 2017) :
𝑞𝑡 = (𝐶𝑜−𝐶𝑡)𝑉𝑚 (2.1)
Keterangan :
C0 = konsentrasi logam mula-mula dalam fase cair (mg/l) Ct = konsentrasi logam pada waktu t dalam fase cair (mg/l) V = volume larutan (L)
m = massa resin (g)
Untuk efisiensi penyisihan diberikan pada persamaan berikut (Kumari, 2017) :
𝐸𝑓𝑓𝑖𝑠𝑖𝑒𝑛𝑠𝑖 𝑃𝑒𝑛𝑦𝑖𝑠𝑖ℎ𝑎𝑛 (%) = (𝐶𝑜−𝐶𝑡)𝐶𝑜 𝑥 100% (2.2) Mekanisme serapan bisa tergantung pada banyak faktor, termasuk jenis sorben, sorbat dan afinitas mutual mereka, sifat permukaan sorben, sifat dari situs aktif, serta sifat-sifat larutan berair. Efisiensi adsorben untuk menghilangkan logam berat dari air limbah dipengaruhi beberapa faktor misalnya, konsentrasi awal, suhu, dosis adsorben, pH, waktu kontak, dan kecepatan pengadukan. Persentase (laju) dari adsorpsi logam berat biasanya meningkat dengan meningkatnya faktor-faktor yang disebutkan di atas (Sahu et al., 2009;
Bish et al., 2016).
2.4 Impregnasi dan Pirolisis
Metode impregnasi ada dua macam, yaitu impregnasi kering (dry impregnation) dan impregnasi basah (wet impregnation). Pada impregnasi basah, penambahan jumlah larutan prekursor fasa aktif lebih besar dari 1,5 kali volume pori penyangga. Metode ini dapat menghasilkan deposisi prekursor fasa aktif yang sangat banyak pada bagian luar penyangga setelah dilakukan proses pengeringan dan juga menghasilkan distribusi fasa aktif pada bagian luar penyangga. Distribusi ini bermanfaat untuk mengurangi penetrasi reaktan ke dalam katalis, sehingga dapat meningkatkan aktivitas katalis. Sedangkan metode impregnasi kering, penambahan larutan prekursor fasa aktif kurang dari 1,2 kali volume pori panyangga. Metode yang umum digunakan dalam pembuatan katalis adalah impregnasi basah. Hal ini dilakukan karena proses pengerjaannya lebih mudah (Dirwan, 2006).
Pirolisis adalah proses dekomposisi termokimia dari material organik, yang berlangsung tanpa udara atau oksigen. Menurut Basu (2010), pirolisis biomassa umumnya berlangsung pada rentang temperatur 300 oC sampai dengan 600 oC. Produk dari proses pirolisis ini tergantung dari beberapa faktor diantaranya temperatur pirolisis dan laju pemanasan.
2.5 Kinetika Adsorpsi
Data kinetika memberikan informasi mengenai mekanisme adsorpsi untuk efisiensi proses adsorpsi tersebut. Penting mengetahui tingkat adsorpsi selama penyisihan kontaminan dari air limbah untuk mengoptimalkan desain parameter, karena kinetik sistem mengontrol adsorbat waktu tinggal dan dimensi reaktor. Akibatnya, memprediksi tingkat adsorpsi yang terjadi untuk sistem yang diberikan mungkin faktor yang paling penting dalam desain sistem adsorpsi (Quintelas, et al, 2006).
Waktu kontak adalah salah satu parameter yang paling penting yang mempengaruhi efektivitas proses adsorpsi. Untuk menyelidiki pengaruh waktu kontak dan kinetika pada proses sorpsi, kapasitas serapan serat kelapa diukur pada waktu yang berbeda untuk konsentrasi awal yang berbeda. Model persamaan orde pertama dan orde kedua digunakan pada data kinetika adsorpsi pertukaran ion dalam studi batch. Adapun kedua persamannya adalah sebagai berikut :
2.5.2 Orde Pertama
Dalam model ini, diasumsikan bahwa tingkat pelepasan logam dari waktu ke waktu secara langsung sebanding dengan perbedaan antara massa logam teradsorpsi dalam keadaan kesetimbangan dan massa logam teradsorpsi pada sorben pada waktu tertentu (qe-qt). Persamaan linear untuk ini model diwakili oleh persamaan berikut (Yoosefian et al, 2017):
log (qe-qt) = log (qe) - 2.303𝐾1 (𝑡) (2.3)
keterangan :
qt dan qe = kapasitas adsorpsi pada waktu t (mg N/g) dan pada waktu kesetimbangan k1 = konstanta laju kesetimbangan adsorpsi pada orde pertama (1/menit)
Gambar 2.1 Plot Konsentrasi Dan Log Konsentrasi Terhadap Waktu 2.5.3 Orde Kedua
Model pseudo-second order mengasumsikan bahwa proses proses sorpsi adalah sifat pseudo-kimia. Dalam model ini, kekuatan pendorong adalah perbedaan antara kapasitas kesetimbangan dari sorben dan massa adsorbat teradsorpsi dalam waktu tertentu (qe-qt).
Tingkat serapan keseluruhan sebanding dengan kuadrat laju adsorpsi. Pada orde kedua, urutan model serapan kinetika dinyatakan oleh persamaan berikut (Tadjarodi et al, 2016):
𝑡
𝑞𝑡= 𝐾2𝑞𝑒1 2+ 𝑞𝑒1 (2.4)
Keterangan :
qt dan qe = jumlah yang terserap pada waktu t (mg N/g) dan pada waktu kesetimbangan k2 = konstanta laju kesetimbangan adsorpsi pada orde kedua (g/mg menit)
2.6 Kesetimbangan Isoterm
Adsorpsi isotermis penting dalam memahami mekanisme adsorpsi. Informasi penting dapat ditafsirkan berdasarkan isoterm adsorpsi tentang bagaimana adsorbat molekul mendistribusikan antara fase cair dan fase padat. Beberapa isoterm adsorpsi dapat digunakan untuk menghubungkan adsorpsi kesetimbangan dalam adsorpsi logam berat pada beberapa adsorben (Febrianto, dkk, 2009).
Mengetahui keadaan kesetimbangan memungkinkan pemodelan proses sorpsi dan menjelaskan mekanisme serapan. Sorbat dapat diserap dari larutan berair pada permukaan sorben padat oleh beberapa jenis mekanisme. Kesetimbangan adsorpsi dibuat bila konsentrasi adsorbat dalam larutan massal adalah dalam keseimbangan dinamis dengan yang dari antarmuka. Selain itu, studi kesetimbangan adsorpsi menentukan kapasitas adsorben, yang dapat digambarkan oleh isoterm adsorpsi, ditandai dengan konstanta tertentu yang nilainya menginformasikan sifat permukaan, heterogenitas, intensitas adsorpsi dan afinitas adsorben tertentu. Hubungan keseimbangan antara adsorben dan adsorbat dijelaskan oleh isoterm adsorpsi. Isoterm sorpsi berguna untuk mengevaluasi kapasitas serapan dari agen penyerap dan parameter termodinamika seperti panas dari penyerapan (Bueno et al., 2008). Variasi serapan dengan konsentrasi sorbat itu untuk isoterm serapan yang berbeda, yaitu Langmuir, Freundlich dan Dubinin- Radushkevich (D-R). Jumlah adsorpsi pada saat kesetimbangan qe, dapat dilihat pada persamaan berikut :
𝑞𝑒 = (𝐶𝑜−𝐶𝑒)𝑉𝑊 (2.5)
dimana CO dan Ce( mg / l) adalah konsentrasi logam pada kesetimbangan awal dan masing-masing. V adalah volume larutan (l) dan W adalah massa adsorben kering digunakan (g).
Konstanta distribusi Kd dapat dilihat pada persaman berikut : 𝐾𝑑 = 𝐽𝑢𝑚𝑙𝑎ℎ 𝑙𝑜𝑔𝑎𝑚 𝑑𝑎𝑙𝑎𝑚 𝑎𝑑𝑠𝑜𝑟𝑏𝑒𝑛
𝐽𝑢𝑚𝑙𝑎ℎ 𝑙𝑜𝑔𝑎𝑚 𝑑𝑎𝑙𝑎𝑚 𝑙𝑎𝑟𝑢𝑡𝑎𝑛 𝑥 𝑚𝑉 (2.6)
Dimana :
V = Volume larutan m = Massa adsorben
2.5.1 Isotherm Langmuir
Model isoterm Langmuir yang diusulkan oleh Langmuir (1916) didasarkan pada asumsi bahwa adsorpsi terjadi pada bagian sisi spesifik homogen tertentu dalam adsorben. Ini secara kuantitatif menggambarkan pembentukan monolayer pada lapisan luar adsorben.
Model Langmuir mewakili distribusi keseimbangan ion logam antara fase cair dan padat.
Langmuir isoterm benar untuk adsorpsi single-layer permukaan termasuk sejumlah lokasi identik yang terbatas. Berdasarkan asumsi ini, Langmuir isoterm diwakili oleh persamaan berikut (Khaled et al, 2009):
𝐶𝑒
𝑞𝑒 = 𝐾𝑎.𝑞𝑚1 + 𝑞𝑚1 𝑋 𝐶𝑒 (2.7)
Dimana :
Ce = konsentrasi kesetimbangan (mg /l)
Qe = jumlah logam teradsorpsi per unit massa adsorben pada kesetimbangan (mg / g) Qmax = kapasitas adsorpsi maksimum teoritis (mg/g 1)
KL = Langmuir isotherm konstan (l/mg 1).
Proses adsorpsi model Langmuir, kemungkinan terjadi dimensionles (RL) dapat dilihat dengan rumus :
𝑅𝑙 = 1+𝐾𝑙 𝐶𝑜1 (2.8)
2.6.2 Isotherm Freundlich
Model isoterm ini menjelaskan sistem adsorpsi heterogen dengan energi seragam. Model Isotherm Freundlich merupakan model empiris dan dapat diterapkan pada adsorpsi multilayer, dengan distribusi adsorpsi, panas dan afinitas yang tidak seram pada heterogen surface dengan persamaan (Hannachi, 2014) :
log 𝑞𝑒 = log 𝐾𝑓 + 𝑛1log 𝐶𝑒 (2.9)
Keterangan :
Ce = Konsentrasi logam pada saat kesetimbangan (mg N/L)
qe = Jumlah logam yang terserap per satuan massa adsorben pada saat kesetimbangan (mgN/g)
Kf = Konstanta isotherm adsorpsi Freundlich yang berkaitan dengan tingkat kapasitas adsorpsi
Intensitas adsorpsi yang baik (n) pada nilai n = 2-10, n = 1-2 untuk adsorpsi sedang dan n<1 untuk adsorpsi buruk (Li Haigang et al, 2015).
2.7 Scanning Electron Microscope (SEM) dan Energy Dispersion Spectrometry (EDS)
Melanjutkan studi penyerapan serat kelapa, analisis lebih lanjut dilakukan dengan SEM untuk membandingkan kelapa morfologi serat dengan dan tanpa pengobatan plasma.
analisis SEM memungkinkan pemahaman yang lebih baik tentang perubahan morfologi permukaan serat (Narendar dan Dasan, 2014). Struktur permukaan dan morfologi sabut kelapa diperiksa dengan SEM. Dalam analisis SEM, sampel sabut kelapa dilapisi dengan lapisan tipis emas dan dipasang pada rintisan tembaga menggunakan double-stick pita karbon. Sampel kemudian dipindai oleh model SEM S-3000N (Perusahaan Hitachi, Jepang). Pada saat yang sama, energi dispersif X-ray spektroskopi (EDX) dipekerjakan untuk memperkirakan komposisi unsur sampel sabut kelapa.
Energy Dispersion Spectrometry (EDS) merupakan alat yang digunakan untuk mengetahui komposisi unsur dari suatu material. EDS dapat digunakan untuk menganalisa secara kuantitatif dari persentase masing-masing elemen dan dapat juga membuat pemetaan elemen dengan memberikan warna berbeda-beda dari masing-masing elemen di permukaan bahan. Berdasarkan penelitian Mopoung et al. (2015) hasil EDS menunjukkan komposisi unsur yang terkandung didalam karbon aktif berupa persentase dari setiap elemen.
2.8 Uji daya serap iodin
Besarnya daya serap iodin berkaitan dengan terbentuknya pori-pori pada karbon aktif yang semakin banyak dengan meningkatnya waktu tinggal aktivasi. Besarnya daya serap iodin terhadap karbon aktif berhubungan dengan pola struktur mikropori yang terbentuk yang mengindikasikan besarnya diameter pori karbon aktif (Wijayanti, 2009).
Analisis daya serap arang aktif secara iodometri ini didasarkan atas reaksi oksidasi reduksi dimana suatu oksidator direaksikan dengan ion iodida yang kemudian melepaskan iodium. Iodium yang dilepaskan tersebut dititrasi oleh larutan standar
natrium thiosulfat. Iodium yang terserap merupakan hasil pengurangan dari larutan iodium awal dengan larutan iodium setelah dicampur dengan arang aktif teknis. Iodium yang terserap didalam arang aktif teknis diharapkan mencapai 750 mg/g (SNI 06-3730- 1995).
2.9 FTIR (Fourier Transform Infrared)
FTIR (Fourier Transform Infrared) merupakan salah satu mtode spektroskopi inframerah yang dilengkapi dengan transformasi Fourier untuk menganalis hasil spektrumnya.
Metode spektroskopi yang digunakan dalam FTIR adalah metode absorpsi, yaitu metode yang didasarkan pada perbedaan penyerapan radiasi inframerah. Suatu materi dapat terabsorpsi oleh inframerah apabila telah memenuhi dua syarat, yaitu kesesuaian antara frekuensi radiasi inframerah dengan frekuensi vibrasi molekul sampel dan perubahan momen dipol selama bervibrasi (Chatwal, 1985). Pada data FTIR, ukuran puncak (peak) menggambarkan jumlah atau intensitas senyawa yang terdapat pada sampel. Data hasil FTIR berupa grafik 21 intensitas dan frekuensi. Intensitas menunjukkan tingkatan jumlah senyawa, sedangkan frekuensi menunjukkan jenis senyawa yang terdapat dalam suatu sampel (Alfaruqy, 2008).
BAB III
METODOLOGI PENELITIAN
Kajian yang dilakukan adalah adsorpsi penyisihan logam timbal (Pb) dan kadmium (Cd) dengan dua jenis adsorben yang digunakan yaitu biosorben sabut kelapa dan karbon aktif yang dibuat dari sabut kelapa . Sabut kelapa berasal dari produsen kue lokal di Tanjung Morawa. Uji adsorpsi dilakukan dalam sistem batch dengan variasi waktu kontak, pH dan dosis adsorben. Hasil uji akan dilakukan analisa data yaitu kinetika adsorpsi dan isoterm adsorpsi.
3.1 Lokasi Penelitian
Penelitian dilaksanakan di Laboratorium Ekologi Teknik Kimia USU dan Laboratorium Beton Teknik Sipil USU untuk pengeringan sampel. Laboratorium Operasi Teknik Kimia USU untuk penghalusan ukuran sampel menggunakan Ball Mill. Laboratorium Penelitian Fakultas Farmasi USU untuk aktivasi adsorben, dan pengujian adsorpsi logam Pb dan Cd.
Laboratorium Proses Industri Kimia USU untuk pirolosis bahan karbon aktif.
Laboratorium Fisika UNIMED untuk pengujian SEM-EDS adsorben. Laboratorium Pengembangan PTKI untuk analisa konsentrasi logam Pb dan Cd.
3.2 Waktu Penelitian
Penelitian dilakukan selama ± 4 bulan yaitu mulai bulan Agustus hingga November 2018 yang dilanjutkan dengan pengolahan dan penyusunan data serta penyusunan laporan.
3.3 Jenis Penelitian
Penelitian ini termasuk dalam jenis penelitian eksperimental yang dilaksanakan dalam skala laboratorium dengan metode penelitian secara kuantitatif.
3.4 Variabel Penelitian
Variabel penelitian yang digunakan dalam penelitian ini meliputi:
1. Variabel bebas (independent variable) meliputi:
a. Waktu Kontak : (0, 5, 15, 30, 45 dan 60) menit
b. pH : (3, 4, 5 dan 6).
c. Dosis Adsorben : (0; 1,25; 2,5; 3,75; 5,0 dan 6,25) gram/liter 2. Variabel Terikat (dependent variable) meliputi:
Kandungan Timbal (Pb) dan Kadmium (Cd).
3.5 Sumber Data
Data yang dikumpulkan meliputi:
a. Data Primer
Data primer merupakan data yang diperoleh dari hasil analisa penelitian di laboratorium ataupun penelitian di lapangan secara langsung mulai dari pengujian awal sampai pengujian akhir.
b. Data Sekunder
Data sekunder merupakan data yang diperoleh dari studi literatur pustaka.
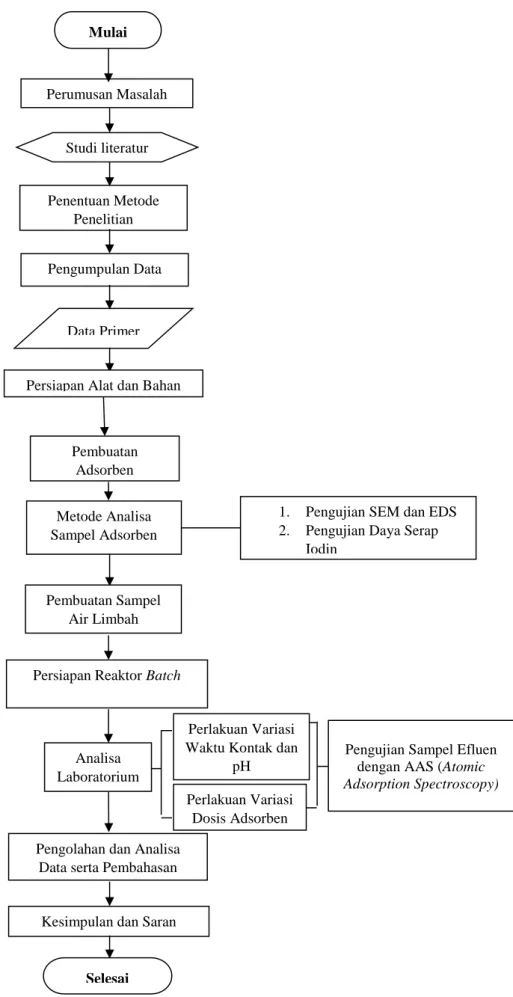
3.6 Kerangka Penelitian
Penelitian diawali dengan perumusan masalah yang akan dijadikan untuk bahan penelitian. Kemudian melakukan studi literatur untuk lebih memahami rumusan masalah yang ada dan ditentukan metode penelitian yang akan dilakukan. Selanjutnya memasuki tahap persiapan dan pengujian Tahap persiapan diawali dengan persiapan alat dan bahan.
Kemudian pembuatan adsorben yang akan digunakan pada tahap pengujian adsorpsi.
Dilakukan metode analisa pada adsorben melalui uji SEM-EDS, uji iodin dan uji FTIR untuk memperoleh karakteristik adsorben. Setelah adsorben selesai dibuat selanjutnya pembuatan limbah air sintetik dan persiapan rekator batch. Berikutnya tahap pengujian adsorpsi dengan variabel waktu kontak, pH dan dosis adsorben. Sampel effluen dari pengujian adsorpsi diuji menggunakan AAS (Atomic Adsorption Spectroscopy) untuk mengetahui konsentrasi akhir logam. Setelah hasil uji diperoleh, dilakukan pengolahan dan analisa data penelitian kemudian dibuat kesimpulan dari penelitian dan saran utnuk penelitian berikutnya. Adapun kerangka penelitian untuk tugas akhir ini dapat dilihat dalam bentuk diagram alir penelitian pada Gambar 3.1.
Gambar 3.1 Diagram Alir Penelitian
Pengujian Sampel Efluen dengan AAS (Atomic Adsorption Spectroscopy) 1. Pengujian SEM dan EDS 2. Pengujian Daya Serap
Iodin
Persiapan Reaktor Batch
Pengolahan dan Analisa Data serta Pembahasan
Kesimpulan dan Saran
Selesai Perumusan Masalah
Penentuan Metode Penelitian
Data Primer Studi literatur
Pembuatan Sampel Air Limbah Metode Analisa Sampel Adsorben
Perlakuan Variasi Waktu Kontak dan
pH Perlakuan Variasi
Dosis Adsorben Mulai
Analisa Laboratorium Persiapan Alat dan Bahan
Pembuatan Adsorben Pengumpulan Data
3.7 Langkah Penelitian
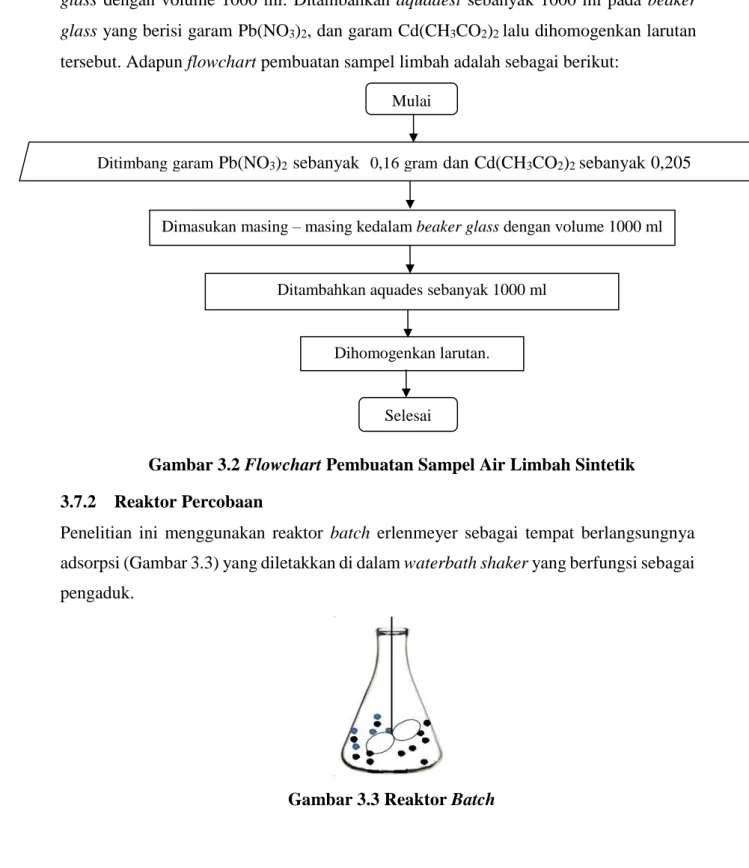
3.7.1 Pembuatan Air Limbah Sintetik
Langkah pembuatan air limbah sintetik yaitu ditimbang sebanyak 0,16 gram garam Pb(NO3)2, dan 0,205 gram garam Cd(CH3CO2)2, kemudian dimasukan kedalam beaker glass dengan volume 1000 ml. Ditambahkan aquadest sebanyak 1000 ml pada beaker glass yang berisi garam Pb(NO3)2, dan garam Cd(CH3CO2)2 lalu dihomogenkan larutan tersebut. Adapun flowchart pembuatan sampel limbah adalah sebagai berikut:
Gambar 3.2 Flowchart Pembuatan Sampel Air Limbah Sintetik 3.7.2 Reaktor Percobaan
Penelitian ini menggunakan reaktor batch erlenmeyer sebagai tempat berlangsungnya adsorpsi (Gambar 3.3) yang diletakkan di dalam waterbath shaker yang berfungsi sebagai pengaduk.
Gambar 3.3 Reaktor Batch
Ditambahkan aquades sebanyak 1000 ml
Ditimbang garam Pb(NO3)2 sebanyak 0,16 gram dan Cd(CH3CO2)2 sebanyak 0,205 gram
Dimasukan masing – masing kedalam beaker glass dengan volume 1000 ml
Dihomogenkan larutan.
Mulai
Selesai
3.8. Persiapan dan Pengujian
Penelitian dilakukan dalam dua tahap yaitu persiapan adsorben dan pengujian adsorpsi logam. Tahapan persiapan adalah tahap dimana dilakukan pembuatan adsorben yang kemudian akan digunakan pada tahap pengujian adsorpsi logam.
3.8.1. Tahap Persiapan
Tahap ini diawali dengan preparasi sabut kelapa yang kemudian dilanjutkan dengan pembuatan biosorben (tanpa perlakuan) dan pembuatan karbon aktif (diaktivasi dengan H3PO4 lalu dipirolisis). Adapun langkah-langkah tersebut sebagai berikut :
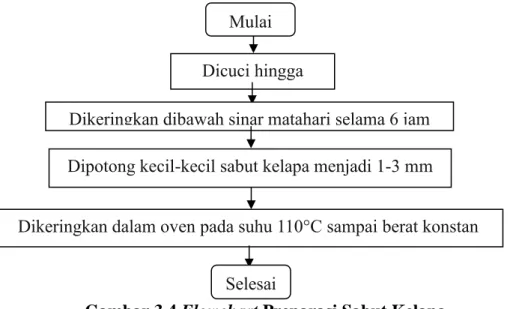
1. Preparasi Sabut Kelapa
Sabut kelapa dicuci dengan air mengalir dari kran hingga bersih, kemudian dipotong kecil-kecil dengan ukuran sekitar 1-3 mm. Setelah itu, dikeringkan dibawah sinar matahari selama 6 jam. Lalu dikeringkan dalam oven dengan suhu 110 °C sampai berat konstan. Adapun flowchart preparasi sabut kelapa sebagai berikut :
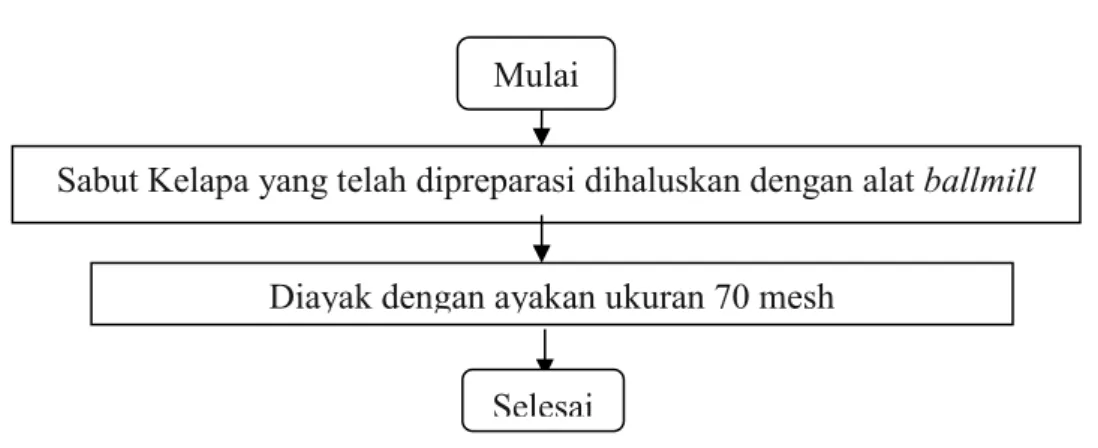
Gambar 3.4 Flowchart Preparasi Sabut Kelapa 2. Pembuatan Biosorben (Tanpa Aktivasi)
Sabut kelapa yang telah dipreparasi dihaluskan di dalam diballmill kemudian diayak menggunakan ayakan ukuran 70 mesh. Biosorben kemudian disimpan dalam wadah plastik tertutup dan kedap udara untuk menghindari kelembapan dan kontaminasi Adapun flowchart biosorben sebagai berikut :
Dikeringkan dalam oven pada suhu 110°C sampai berat konstan Dipotong kecil-kecil sabut kelapa menjadi 1-3 mm
Dicuci hingga bersih Mulai
Selesai
Dikeringkan dibawah sinar matahari selama 6 jam
Gambar 3.5 Flowchart Biosorben 3. Pembuatan Karbon Aktif (Pengaktifan dengan H3PO4)
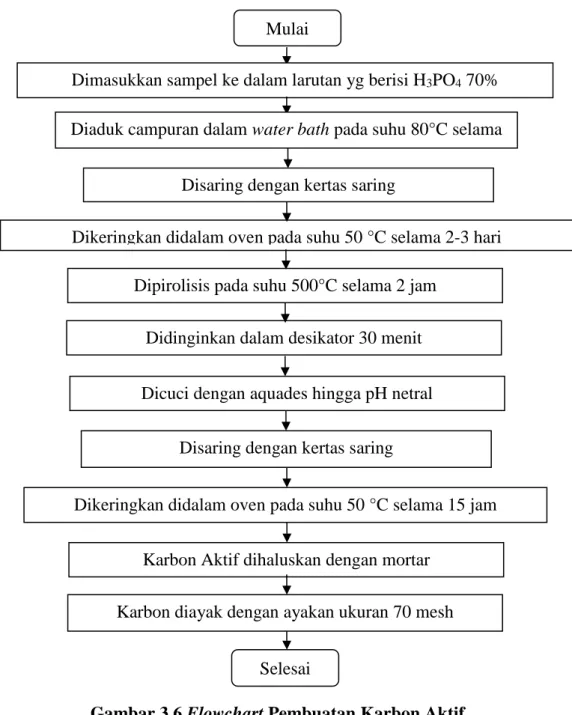
Sabut kelapa yang telah dipreparasi dimasukkan ke dalam larutan yg berisi H3PO4 70%
dengan perbandingan 1:10 kemudian diaduk pada suhu 80°C selama 2 jam menggunakan waterbath shaker. Setelah 2 jam, sabut kelapa disaring dengan kertas saring. Lalu dikeringkan didalam oven pada suhu 50°C sekitar 2-3 hari. Setelah cukup kering, didinginkan di dalam desikator selama 30 menit. Sabut kelapa dipirolisis dalam tungku pada suhu 500°C selama 2 jam. Karbon aktif hasil pirolisis dicuci dengan aquades sampai pH netral, kemudian disaring dengan kertas saring. Karbon aktif dikeringkan didalam oven pada suhu 50°C selama 15 jam. Karbon aktif yang diperoleh dihaluskan dengan menggunakan mortar. Setelah dihaluskan, diayak karbon dengan ayakan ukuran 70 mesh.
Adapun flowchart persiapan adsorben adalah sebagai berikut:
Sabut Kelapa yang telah dipreparasi dihaluskan dengan alat ballmill Mulai
Selesai
Diayak dengan ayakan ukuran 70 mesh
Gambar 3.6 Flowchart Pembuatan Karbon Aktif 3.8.2 Tahap Pengujian Adsorpsi Logam
Setelah tahap persiapan selesai, penelitian dilanjutkan dengan tahap pengujian menggunakan reaktor batch. Pengujian yang dilakukan adalah pengujian pengaruh waktu kontak, pH dan dosis untuk menentukan model kinetika dan isotherm adsorpsi yang sesuai untuk menggambarkan proses adsorpsi yang terjadi. Dalam pengujian ini, volume limbah cair sintesis yang digunakan adalah sebanyak 200 mL per erlenmeyer dan diambil sebanyak 50 – 100 mL sampel effluen untuk dianalisa konsentrasinya menggunakan AAS (Atomic Adsorption Spectroscopy).
Mulai
Dimasukkan sampel ke dalam larutan yg berisi H3PO4 70%
Diaduk campuran dalam water bath pada suhu 80°C selama 2 jam
Dikeringkan didalam oven pada suhu 50 °C selama 15 jam Disaring dengan kertas saring
Disaring dengan kertas saring
Selesai
Dipirolisis pada suhu 500°C selama 2 jam Didinginkan dalam desikator 30 menit
Karbon Aktif dihaluskan dengan mortar
Dikeringkan didalam oven pada suhu 50 °C selama 2-3 hari
Dicuci dengan aquades hingga pH netral
Karbon diayak dengan ayakan ukuran 70 mesh
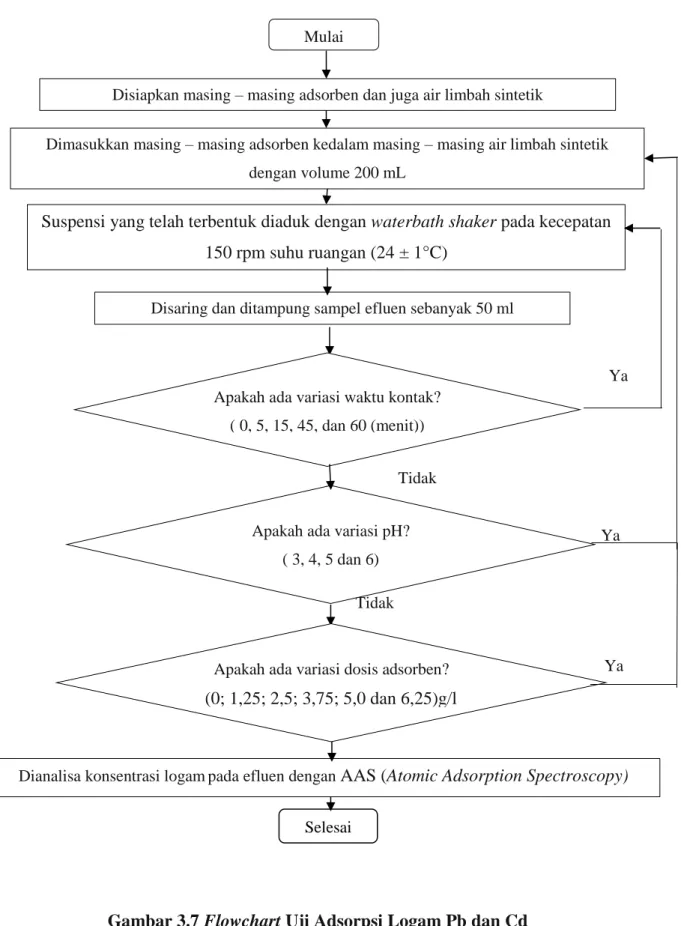
1. Kinetika Adsorpsi
Pengujian kinetika dilakukan dengan memasukkan adsorben sebanyak 1 gram kedalam reaktor yang telah terisi 200 ml cairan sintesis (diuji terlebih dahulu untuk mengetahui konsentrasi logam). Reaktor diaduk dalam waterbath shaker dengan kecepatan 150 rpm selama waktu tertentu (0, 5, 15, 30, 45 dan 60 menit) pada suhu ruangan (24 ± 1 °C).
Setiap selang waktu yang telah ditetapkan, sampel diambil untuk dianalisa konsentrasi akhir timbal dan cadmium menggunakan AAS (Atomic Adsorption Spectroscopy).
2. Isoterm Adsorpsi Kesetimbangan
Pengujian isoterm adsorpsi kesetimbangan dilawali dengan pengujian pH dan dosis adsorben. Pada pengujian pengaruh pH, dimasukkan 1 gram adsorben ke dalam reactor yang telah berisi 200 ml cairan sintesis dengan pH yang berbeda (pH 3, 4, 5 dan 6), Pengaturan pH menggunakan larutan 0,1 M CH3COOH atau 0,1 M NaOH. Reaktor diletakkan di dalam Waterbath Shaker untuk diaduk dengan kecepatan 150 rpm selama waktu optimum (waktu yang diperoleh dari uji pengaruh waktu kontak sebelumnya).
Setelah pengadukan selesai, sampel diambil untuk dianalisa konsentrasi akhir logam.
Tahap berikutnya pengujian pengaruh dosis adsorben terhadap penyisihan logam Pb dan Cd. Adsorben dengan dosis yang berbeda ((0; 1,25; 2,5; 3,75; 5,0 dan 6,25) gram/liter) dimasukkan ke dalam reaktor yang telah berisi 200 ml cairan sintesis pada pH optimum (pH yang diperoleh dari uji pengaruh pH sebelumnya) pada suhu ruangan (24 ± 1°C).
Reaktor diletakkan di dalam Waterbath Shaker untuk diaduk dengan kecepatan 150 rpm selama waktu optimum (yang diperoleh dari uji pengaruh waktu kontak sebelumnya) sehingga tercapai kesetimbangan adsorpsi. Selanjutnya sampel diambil untuk dianalisa konsentrasi akhir logam.
Adapun flowchart tahapan pengujian adsorpsi logam dengan menggunakan sistem batch yang akan dilakukan adalah sebagai berikut :
Tidak Apakah ada variasi pH?
( 3, 4, 5 dan 6) Mulai
Disiapkan masing – masing adsorben dan juga air limbah sintetik
Dimasukkan masing – masing adsorben kedalam masing – masing air limbah sintetik dengan volume 200 mL
Suspensi yang telah terbentuk diaduk dengan waterbath shaker pada kecepatan 150 rpm suhu ruangan (24 ± 1°C)
Disaring dan ditampung sampel efluen sebanyak 50 ml
Ya Apakah ada variasi waktu kontak?
( 0, 5, 15, 45, dan 60 (menit))
Ya
Selesai
Dianalisa konsentrasi logampada efluen dengan AAS (Atomic Adsorption Spectroscopy) Apakah ada variasi dosis adsorben? Ya
(0; 1,25; 2,5; 3,75; 5,0 dan 6,25)g/l Tidak
Gambar 3.7 Flowchart Uji Adsorpsi Logam Pb dan Cd Menggunakan Sistem Batch
3.8.3 Pengujian Daya Serap Iodin
Pertama-tama ke dalam erlenmeyer tutup asah ditimbang sekitar 1 gram arang aktif, selanjutnya ditambahkan dengan di pipet 25 ml larutan iod monoklorida dan erlenmeyer ditutup dengan tutup yang telah dibasahi dengan KI, kemudian dikocok dengan hati-hati dan disimpan di tempat yang gelap selama 2 jam, ke dalam erlenmeyer ditambahkan 10 ml larutan kalium iodide (KI) 20% dan 150 ml air suling, kemudian dikocok dan seterusnya dititrasi dengan larutan tiosulfat 0,1 N. Sebagai penunjuk adalah larutan pati/kanji dan untuk perbandingan digunakan larutan blanko dengan cara yang sama (SNI, 1995). Persamaan yang digunakan untuk menghitung daya serap iodin adalah persamaan 2.10 sebagai berikut :
Daya serap terhadap larutan iod = 10−(𝑏𝑥𝑎)/𝑁𝑥126.9𝑓𝑝
𝑔𝑟𝑎𝑚 𝑐𝑜𝑛𝑡𝑜ℎ (2.10)
Dimana :
b = Jumlah titar untuk contoh a = Normalitas larutan
N = Normalitas larutan Na2SO3
126.9 = Berat atom iod fp = Faktor pengenceran
3.8.4. Scanning Electron Microscopy – Energy Dispersive Spectroscopy (SEM-EDS) Analisa SEM-EDS dilakukan dengan membersihkan specimen holder hingga bersih lalu dikeringkan dengan vakum (sampel harus bebas dari H2O), kemudian menempatkan adsorben sabut kelapa pada specimen holder dan dimasukkan kedalam specimen chamber. Sampel dapat langsung diletakkan kedalam alat SEM-EDS dan akan dikarakterisasi dengan menggunakan metode SEM-EDS untuk mengetahui morfologi dan komponen kimia yang terkandung dalam adsorben.
3.8.5. Fourier Transform Infrared (FT-IR)
Analisa gugus fungsi adsorben sabut kelapa dilakukan dengan mempersiapkan terlebih dahulu pellet KBr sebagai background analisa yaitu dengan menimbang serbuk KBr halus (0.1 gram) dan adsorben sabut kelapa (1% dari berat KBr). Selanjutnya serbuk KBr dicampurkan dengan adsorben sabut kelapa dalam mortal agate, kemudian digerus
sampai halus dan homogen. Kemudian sampel diletakkan ke plat sampel dan diuji menggunakan alat FT-IRPrestige21 pada interval bilangan gelombang 400-4000 cm-1 3.8.6. Analisa Sampel
Pengukuran konsentrasi limbah cair sintesis dan sampel (Pb dan Cd) dilakukan menggunakan AAS (Atomic Adsorption Spectroscopy) sesuai dengan metode SNI 6989.46:2009 untuk uji timbal dan metode SNI 6989.16:2009 untuk uji kadmium.
3.9. Analisa Data
Data yang diperoleh akan dilihat nilai yang paling optimal dari perubahan konsentrasi timbal dan kadmium. Data hasil percobaan akan dihitung menggunakan Microsoft Excel dan disajikan dalam bentuk tabel dan grafik dengan pemodelan persamaan pada sistem batch yaitu persamaan Orde Pertama dan persamaan Orde Kedua (untuk kinetika adsorpsi), persamaan Langmuir dan persamaan Freundlich (untuk isoterm adsorpsi kesetimbangan). Data yang diperoleh akan menunjukkan nilai yang paling optimal tentang perubahan konsentrasi timbal dan kadmium.
3.9.1.Efisiensi Penyisihan (%RE)
Untuk mengetahui efisiensi penurunan kadar timbal dan kadmium. pada sampel air limbah, maka dalam penelitian ini dapat dihitung efisiensinya dengan membandingkan influen dan efluen yang dinyatakan dalam persen (%). Persamaan yang digunakan untuk menghitung daya serap iodin adalah persamaan 2.2 sebagai berikut :
𝐸𝑓𝑓𝑖𝑠𝑖𝑒𝑛𝑠𝑖 𝑃𝑒𝑛𝑦𝑖𝑠𝑖ℎ𝑎𝑛 (%) = (𝐶𝑜−𝐶𝑡)𝐶𝑜 𝑥 100% (2.2) Dimana :
C0 = konsentrasi logam mula-mula dalam fase cair (mg/l) Ce = konsentrasi logam pada waktu t dalam fase cair (mg/l) 3.9.2. Kinetika Adsorpsi
Penentuan model kinetika diperlukan untuk menjelaskan proses yang terjadi dalam adsorpsi. Data yang telah diolah akan disajikan dalam tabel dan grafik untuk dapat menentukan model kinetika yang sesuai dengan uji adsorpsi tersebut.
3.9.3. Isoterm Adsorpsi
Penentuan model isoterm adsorpsi diperlukan untuk dapat menjelaskan mekanisme adsorpsi yang terjadi. Data yang telah diolah akan disajikan dalam bentuk tabel dan grafik untuk dapat menentukan model isoterm adsorpsi yang sesuai.
BAB IV
HASIL DAN PEMBAHASAN
Uji adsorpsi untuk penyisihan logam Timbal (Pb) dan Kadmium (Cd) pada sistem batch dilakukan dalam penelitian ini. Ada dua jenis adsorben dari sabut kelapa yang digunakan dalam penelitian ini yaitu berupa biosorben dan karbon aktif. Untuk pembuatan karbon aktif, sabut kelapa diaktivasi menggunakan H3PO4 70%. Variabel yang digunakan pada penelitian ini meliputi variabel terikat (Pb dan Cd) dan variabel bebas (waktu kontak, pH dan dosis adsorben).
Persiapan untuk uji adsorpsi logam dalam penelitian ini dimulai dengan preparasi sabut kelapa, kemudian pembuatan biosorben dan pembuatan karbon aktif. Setelah itu dilakukan uji adsorpsi Pb dan Cd menggunakan adsorben yang telah dibuat dengan konsentrasi awal untuk logam Pb 100 mg/l dan logam Cd 98 mg/l. Biosorben dan karbon aktif dilakukan pengujian SEM-EDS untuk mengetahi morfologi permukaan dari adsorben dan komposisi kimianya, sedangkan hasil efluen yang didapatkan dari uji adsorpsi logam (Pb dan Cd) menggunakan alat Atomic Adsorption Sprectroscopy (AAS) untuk mengetahui konsentrasi logam yang terdapat pada efluen.
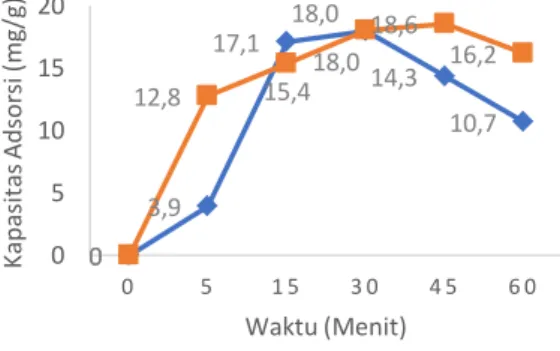
4.1 Scanning Electron Microscope (SEM) dan Energy Dispersion Spetrometry (EDS) Uji SEM dilakukan untuk mengetahui morfologi dari adsorben. Hasil SEM dapat dilihat pada Gambar 4.1 yang menunjukkan perubahan morfologi yang terjadi pada adsorben sabut kelapa yang diaktivasi. Ada tiga perbesaran yang dilakukan utnuk melihat morfologi adsorben melalui uji SEM yaitu perbesaran 100x, 3000x dan 5000x.
Berdasarkan hasil uji SEM dapat dilihat bahwa permukaan karbon aktif lebih kasar dan juga pori – porinya lebih besar dibandingkan dengan biosorben. Hal ini terjadi karena proses aktivasi yang dilakukan pada adsorben sabut kelapa mengubah morfologi dari adsorben awal dan juga kandungan yang ada di adsorben. Perlakuan aktivasi menggunakan larutan asam dapat melarutkan pengotor pada material tersebut, sehingga mulut pori menjadi lebih terbuka, akibatnya luas permukaan spesifik porinya menjadi meningkat. Selain itu, situs aktifnya juga mengalami peningkatan oleh oleh karena situs yang tersembunyi terbuka dan kemungkinan juga akan memunculkan situs aktif baru akibat reaksi pelarutan. Peningkatan luas permukaan spesifik pori dan situs aktifnya akan dapat meningkatkan kemampuan adsorpsinya (Widihati, 2008). Pori-pori menjadi
jelas dan sejumlah besar lubang ditempatkan secara teratur juga diamati pada permukaan adsorben empulur kelapa yang diaktivasi (Brigida et al., 2010). Proses aktivasi ini bertujuan untuk menghilangkan zat-zat yang menutupi pori-pori pada permukaan arang aktif (Diao et al., 2002) sehingga saat pemanasan dilakukan, senyawa kontaminan yang berada dalam pori menjadi lebih mudah terlepas. Hal ini menyebabkan luas permukaan yang aktif bertambah besar dan meningkatkan daya adsorp arang aktif (Danarto dan Samun, 2008).
(a) (b)
Gambar 4.1 (a) Hasil Uji SEM Biosorben (b) Hasil Uji SEM Karbon Aktif Aktivasi H3PO4
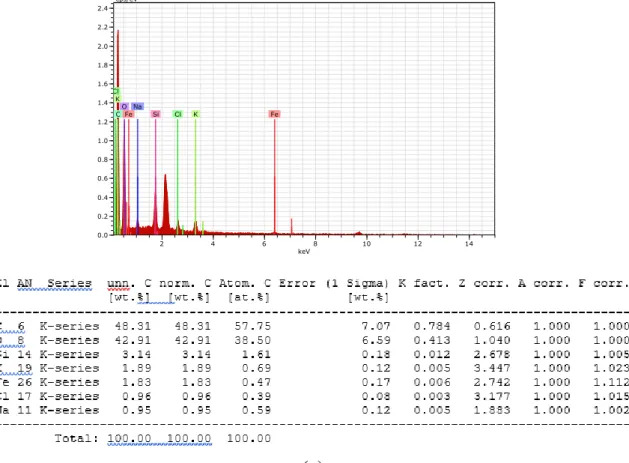
Uji EDS digunakan untuk mengetahui komponen – komponen yang terkandung di dalam adsorben. Hasil uji EDS dapat dilihat pada Gambar 4.2 yang menunjukkan bahwa pada biosorben terdapat kandungan mineral yaitu C, O, Si, K, Fe, Cl dan Na.
Mineral C dan O merupakan komponen paling banyak yang terkandung di biosorben yaitu 48% dan 42%. Sedangkan pada karbon aktif kandungan mineral yang terkandung yaitu C, P, O, Si, N dan F dengan komponen paling banyak yaitu C sebesar 85%. Dan dapat dilihat juga perbedaan komposisi dari biosorben dengan yang telah diaktivasi menjadi karbon aktif. Ada kandungan dari biosorben seperti K, Fe, Cl dan Na tidak terdapat di karbon aktif tetapi terdapat kandungan mineral baru yaitu P, N dan F akibat dari aktivasi. Pada penelitian Bhatnagar et al. (2008) menjelaskan bahwa apabila tidak dilakukan pecucian untuk menghilangkan residu asam maka didapat kandungan unsur kimia K yang masih tinggi.
(a)
(b)
Gambar 4.2 a) Hasil Uji EDS Biosorben (b) Hasil Uji EDS Karbon Aktif yang Diaktivasi H3PO4
2 4 6 8 10 12 14
keV 0.0
0.2 0.4 0.6 0.8 1.0 1.2 1.4 1.6 1.8 2.0 cps/eV
C P
O Si N
F
2 4 6 8 10 12 14
keV 0.0
0.2 0.4 0.6 0.8 1.0 1.2 1.4 1.6 1.8 2.0 2.2 2.4
cps/eV
C O
Si K K
Fe
Fe Cl
Cl Na