Olek
TIEAI TIER TAMOJO
F 25. 1160
5 9 9 2
FAKULTAS TEKNOLOGI PERTAM14M INSTlTUT PERTANIAN
BOGQR
Tien Tien Tanojo. F25.1160. Analisis protease Aspergillus oryzae dengan elektroforesis gel poliakrilamid. Di bawah bimbingan : Maggy T. Suhartono.
RINGKASAN
Penelitian ini terdiri dari 4 tahap yang meliputi isolasi kapang proteolitik, produksi, dan pemurnian protease yang dihasilkan, serta analisis berat molekul protease tersebut. Kapang diisolasi dari tahap ke 2 dalam fermentasi kecap Zebra, Bogor, yaitu fermentasi garam/ fase moromi. Dari hasil identifikasi yang dilakukan, yang dikonfirmasikan dengari Laboratorium Mikologi, Jurusan Biologi, IPB, kapang yang diisolasi adalah Aspergillus oryzae. Isolat A. oryzae tersebut terbukti bersifat proteolitik baik pada media SMA ataupun media fermentasi yang dipergunakan.
Protease diproduksi pada media campuran dedak dan tepung kedelai (7 : 3, w/w) yang disuplementasikan dengan KH2P04. Ekstrak protease kasar diperoleh dari media fermentasi dengan larutan Tween 80. Aktivitas protease kasar tersebut adalah 0,2 IU/mg protein. Uji aktivitas p r o t e a s e dilakukan berdasarkan h i d r o l i s i s k a s e i n
pengikatan zat pewarna (Bradford, 1976). Pemurnian yang dilakukan adalah berturut-turut pengendapan dengan ammonium sulfat (70%, w/v) dan pengendapan dengan 100% aseton (v/v), yang masing-masing meningkatkan aktivitas protease menjadi 0,5 IU/mg protein, dan 1,2 IU/mg protein. Pemisahan protease dengan kromatografi filtrasi gel pada kolom Sephadex G-100 menghasilkan 2 puncak protein dan 2
puncak protease. Kedua jenis protease tersebut mempunyai aktivitas 1,5 IU/mg protein dan 2,4 IU/mg protein, dengan kemurnian 7,8 dan 12,3 kali enzim kasar.
Elektroforesis dilakukan sesuai dengan metode yang dipergunakan Laemmli (1970), dengan konsentrasi akrilamid 10%. Jumlah sampel yang diaplikasikan 30
-
40 pg. Pada konsentrasi tersebut protease A. oryzae dapat diwarnai dengan pewarnaan Coomassie dan pewarnaan Ag, tetapi tidak dengan pewarnaan Cu. Berat molekul protease diestimasi dengan SDS-PAGE, dengan pewarnaan Coomassie. ~ n t u k menentukan pita protease dilakukan pewarnaan spesifik berdasarkan hidrolisis kasein. Hasil yang diperoleh adalah 2 macam protease yang mempunyai BM 105.300 Da dan 27.800 D a , yang diduga adalah protease netral dan protease asam.ANALISIS PRWEASE Aspergillus oryzue DENGAN ELEKTROFORE'IS GEL POLIAKRILAMKD
Oleh
TIEN TIEN TANOJO F 25.1160
SKRKI'SI
Sehagai salah salu syarat unluk rncmperolch gclar SARJANA TEKNOLOGI PEIUANIAN
pada JURIJSAN TEKNOLOGI I'ANCiAN DAN CilZI FAKULTAS TEKNOLOGI PEKI'ANIAN
KNSTITOT I'EKI'ANIAN BOGOR
1992
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR IZAKIJLTAS TEKNOLOGI PERTANIAN
ANALISIS PROTEASE Aspergilluv oryzue DENGAN ELEKTROFORESIS GEL 1'OLIAKIIILAMID
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN
pada JURUSAN TEKNOLOGI PANGAN DAN GIZI FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
Oleh
TIEN TIEN TANOJO F 25.1160
Dilahirkan pada tanggal 6 Desember 1969 di Surabaya
Tiriggal lulus : 8 Desernber 1992
Disetujui,
KATA PENGANTAR
Puji, hormat dan kemuliaan bagi Tuhan, Allah yang luar biasa. Karena hanya oleh kasih dan penyertaan-Nya, penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini.
Tulisan ini disusun berdasarkan hasil penelitian tentang " ~ n a l i s i s protease Aspergillus oryzae dengan gel poliakrilamid", yang telah dilakukan d i Lab. Teknologi Mikroba dan ~ i o k i m i a , PAU Bioteknologi IPB, dari bulan ~ p r i l sampai dengan bulan Oktober 1992.
~ e n u l i s mengucapkan terima kasih yang tulus kepada : 1. Dr. Ir. Maggy T. Suhartono, yang telah membimbing
penulis selama penelitian dan penyusunan skripsi.
2. Dr. Ir. Srikandi Fardiaz dan Ir. Sutrisno Koswara, yang berkenan menjadi dosen penguji dan membantu menyempurnakan tu1i:;an ini.
3. Pimpinan Perusahaan Kecap Zebra, Bogor, yang mengijinkan penulis mengambil sampel.
4. Veralin, Witono, Wirjanto, Daniel, Lily, Handi, Filosa, Eni, Ika, dan Ujang, yang banyak membantu penulis selama berlangsungnya penelitian.
5. Saudara-saudara penulis d i Kopelkhu pada khususnya dan PMK pada umumnya, serta di "MUSASHI", atas dukungan doa dan bantuan yang diberikan.
Penulis menyadari bahwa tulisan ini masih jauh dari sempurna, tetapi penulis berharap tulisan ini dapat dimanfaatkan oleh semua pihak' yang membutuhkannya.
I M M A N U E L !
Bogor, 14 Desember 1992
DAFTAR IS1
Halaman
Kata Pengantar
...
iDaftar Gambar
...
.
viDaftar Tabel
...
viiDaftar Lampiran
...
viiiI
.
PENDAHULUAN...
1 A.
LATAR BELAKANG...
1...
B.
TUJUAN 4 I1.
TINJAUAN PUSTAKA...
5 A.
PROTEASE...
51
.
Definisi dan Klasifikasi...
52
.
Sumber dan Peranan...
6B
.
PROTEASE Aspergillus oryzae...
7C
.
PEMURNIAN ENZIM...
10...
D.
PEMURNIAN PROTEASE DARI ASPERGILLUS 12 E.
TEXNIK ELEKTROFORESIS DI DALAM ANALISIS ENZIM...
131
.
Elektroforesis...
13...
2.
Elektroforasis Gel Poliakrilamid 16 3.
PAGE dengan Sodium Dodesil Sulfat...
19...
4.
Faktor-Faktor yang Mempengaruhi 20 5.
Pewarnaan Protein...
225.1. Pewarnaaan Coomassie
...
23Xalaman
...
5.3. Pewarnaan Ag 2 5...
5.4. Pewarnaan ~pesifik 2 5.
6 ~nalisis Xasil Elektroforesis
...
2 7 I11.
METODE PENELITIAN...
2 9 A.
BAHAN DAN ALAT...
2 91
.
Bahan...
2 92
.
Alat...
3 0B
.
METODE PENELITIAN...
3 0 1.
ISOLASI XAPANG PROTEOLITIK...
3 02
.
PRODUXSI PlZOTEASE...
31a
.
Penyiapiin Media Fermentasi...
3 1 b.
Pembuatan Inokulum dan Inokulasi...
32c
.
Ekstraksi...
32d
.
Pengukuran Jumlah Protein...
33e
.
Pengujinn Aktivitas Protease...
333
.
PEMURNIAN PROTEASE...
3 6 a.
Pengendapan dengan Ammonium Sulfat...
36b
.
Dialisis...
3 8 c.
Pengendapan dengan Aseton...
38d
.
Pemisahan dengan Sephadex G-lo0...
3 8 4.
ELEKTROFORESIS PROTEASE...
3 9...
4.1. Pewarnaan Coomassie 3 9 4.2. Pewarnaancu
...
4 0...
4.3. Pewarnaan Ag 4 0Halaman
...
IV
.
HASIL DAN PEMBAHAGAN 42A
.
ISOLASI KAPANG PROTEOLITIK...
4 2 B.
PEMURNIAN PROTEASE Aspergillus oryzae...
49 C.
ELEKTROFORESIS PROTEASE Aspergillusoryzae
...
5 8 1.
Uji Metode Pewarnaan...
58 2.
Uji Aktifitas Proteolitik...
61 3.
Estimasi Berat Molekul Protease...
63 V.
KESIMPULAN DAN SARAN...
6 8 A.
KESIMPULAN...
6 8 B.
SARAN...
69 VI.
DAFTAR PUSTAKA...
70DAFTAR GAMBAR Gambar 1
.
Gambar 2.
Gambar 3.
Gambar 4.
Gambar 5.
Gambar 6.
Gambar 7.
Gambar 8.
Gambar 9.
Gambar 10.
Gambar 11.
Gambar 12.
Gambar 13.
Gambar 14.
Gambar 15.
Halaman Cara pembuatan kurva standar untuk...
estimasi BM 28
...
Penetapan jumlah protein 33
Prosedur pernurnian protease
...
3 7Pembuatan kecap di pabrik kecap Zebra
....
42...
Fermentasi garam 43
substrat fermentasi garam
...
44Hasil isolasi kapang proteolitik
...
45Deskripsi makroskopik Aspergillus
oryzae
...
46Deskripsi mikroskopik Aspergillus
oryzae
...
4 7Uji proteolitik Aspergillus oryzae
...
4 8Profil pemisahan protease Aspergillus
oryzae dengan Sephadex 6-100
...
56Uji metode pewarnaan
...
59Perbandingan pewarnaan Coomassie dengan
pewarnaan Ag
...
60 Uji aktivitas proteolitik...
62DAFTAR TABEL
Halaman
...
Tabel 1. Pengujian aktivitas protease 35 Tabel 2. Pemurnian protease Aspergillus oryzae... 50 Tabel 3. Pengendapan burtahap protease dengan Ammoniumsulfat... 5 3
Tabel 4. Penentuan BM protease Aspergillus oryzae... 66 Tabel 5. Perbandingan dengan protease Aspergillus
DAFTAR LAMPIRAN Lampiran 1
.
Lampiran 2.
Lampiran 3.
Lampiran 4.
Lampiran 5.
Lampiran 6.
l am pi ran 7.
HalamanSeperangkat Alat Kromatografi
...
75Seperangkat Alat Elektroforesis
...
76Kurva Standar Tirosin
...
77Kurva Standar Bovine Serum Albumin
...
78Kurva Standar Protein Standar untuk Penentuan Berat Molekul
...
79Xunci Identifikasi Spesies Aspergillus
..
80Pembuatan ~ e r e a k s i Uji ~ k t i v i t a s
Protease
...
8 2 Elektroforesis Gel Poliakrilamid...
8 3Enzim merupakan salah satu produk bioteknologi yang dewasa ini bnnyak dimanfaatkan dalam berbagai cabang ilmu pengetahuan dan industri. Beberapa bi.dang ilmu yang berhubungan dengan enzim diantaranya adalah kedokteran, pertanian, pangan dan lain-lain. Sedang industri yang memanfaatkan aktivitas enzim adalah industri penyamakan kulit, roti, bir, sari buah, detergen, pemanis bukan tebu, keju, fotografi, dan f armasi
.
Dengan berkembangnya industri-industri tersebut di Indonesia, maka lcebutuhan enzim dari tahun k e tahun makin bertambah. Sayangnya, sampai saat ini seluruh kebutuhan enzim Indonesia masih disuplai dari negara- negara lain. Dari data statistik diketahui bahwa pada tahun 1990, impor enzim Indonesia dari berbagai negara mencapai 34.811.625 kg atau sebesar $ 51.970.458,
sedang tahun berikutnya 39.333.411 k g atau
$ 61.645.720 (BPS, 1991).
Hal ini patut disayangkan, mengingat bahwa sebenarnya Indonesia mempunyai potensi sebagai negara penghasil enzim. Sejak dulu bangsa Indonesia telah menguasai teknologi fermentasi dan mempergunakannya untuk memproduksi makanan tradisional seperti tempe,
oncom, kecap, tauco, dan lain-lain. Di samping itu banyaknya mikroorgnnisme dan bahan baku fermentasi
juga merupakan potensi untuk memproduksi enzim.
Mikroba yang dapat dimanfaatkan untuk
memproduksi protease diantaranya Bacillus
licheniformis, 5 . :;tearothermophillus, Mucor miehei, Asperqillus oryzae, dan A. niger. Diantara mikroba- mikroba tersebut, pcnggunaan kapang sebagai penghasil protease masih belum banyak dikembanykan. Pemakaian protease Bacillus dunia sudah mencapai 500 tonltahun, sedang protease kapilng 11 ton/tahun (Aunstrup, 1980). oleh sebab itu pengembangan dan penelitian tentang protease kapang masih sangat dibutuhkan.
Da lam penelitian ini dilakukan isolasi kapang proteolitik, yaitu A. oryzae. Kapang ini merupakan kapang utama pada pembuatan kecap. Protease yang diproduksi oleh kapang ini dimurnikan dan berat molekulnya diperkirnkan dengan SDS
-
PAGE.Penyempurnaan teknik-teknik produksi enzim dan pemurniannya sangat mendukung pengembangan industri biokatalisator. Penelitian tentang pemurnian protease dari A. oryzae dan spesies Aspergillus lainnya telah banyak dilakukan. Pada dasarnya pemurnian tersebut meliputi pengendapan protein, kromatograf i dan elektroforesis. Pengendapan protein dapat dilakukan dengan merubah pH atau kekuatan ion, menambahkan
larutan atau polimer organik, atau dengan mendenaturasi protein. Sedang metode kromatografi untuk pemurnian meliputi kromatoyrafi gel filtrasi, affinitas, penukar ion, dan adsorbsi.
Teknik elektroforesis umumnya dipergunakan dalam tahap pemurnian lanjut, untuk karakterisasi protein, misalnya untuk estimasi berat molekul, titik isoelektrik, uji kemurnian, dan lain-lain. Elektroforesis juqo merupakan metode analisis sifat- sifat enzim yang telah dimurnikan. Ada bermacam-macam teknik elektroforesis, tetapi yang paling baik untuk memisahkan protein adalah elektroforesis gel poliakrilamid. Elektroforesis ini dapat memisahkan protein berdasarkan ukuran yang seragam dan menghasilkan resolusi yang baik.
Pewarnaan protein yang telah terpisah diperlukan untuk menampilkan pita-pita protein tersebut. Ada banyak pewarna dan metode pewarnaan yang dapat dipergunakan. Interaksi antara pewarna-pewarna ini berbeda untuk protein yang berbeda, sehingga sensitif itasnya pun tidak sama. Pewarnaan Ag dinyatakan 100 kali lebih sensitif dibanding pewarnaan Coomassie. Sampai saat ini, pewarna yang umum dipergunakan untuk mendeteksi hasil elektroforesis protein adalah Coomassie Brilliant Blue.
11. TINJAUAN PUSTAKA
A . PROTEASE
1. Definisi dan Klafisikasi
Protease adalah enzim proteolitik yang merupakan biokatalisator untuk reaksi pemecahan protein. Berdasarkan reaksi yang dikatalisisnya, enzim ini tergolong hidrolase, karena mengkatalis pemecahan substrat dengan pertolongan air. Protease dapat dibagi menjadi 2 macam, berdasarkan cara hidrolisisnya, yaitu proteinase Yang menghidrolisis protein menjadi fragmen-fragmen besar atau polipeptida dan peptidase yang menghidrolisis fragmen-£ragmen polipeptida menjadi asam-asam amino. Protease dari mikroorganisme biasanya mempunyai campuran keduanya (casida,
1968).
Protease, menurut Winarno (1986), dapat diklasifikasikan dalam 2 golongan besar, yaitu eksopeptidase dan endopeptidase. Golongan eksopeptidase dapat dibagi lagi menjadi karboksipeptidase dan aminopeptidase yang berturut- turut memotong peptida dari arah gugus karboksil terminal dan gugus amino terminal. Golongan endopeptidase memecah protein atau ikatan peptida dari arah dalam.
Klasifikasi protease berdasarkan sifat-sifat kimia dari lokasi aktifnya, menurut Winarno (1986)
adalah sebagai berikut :
a. Protease Serin, yang mempunyai residu serin pada lokasi aktifnya.
b. Protease Sulfhidril, yang mempunyai residu sulfhidril pnda lokasi aktifnya.
c. Protease Metal, yang keaktifannya tergantung pada adanya logam. Logam tersebut dapat terdiri dari Mg, Zn, Co, Fe, Hg, dan Ni.
d. Protease Asam, yang pada lokasi aktifnya terdapat 2 gugus karboksil. Enzim ini hanya aktif pada pll rendah.
2. Sumber dan Peranan
Protease dapat dihasilkan oleh tanaman, hewan, dan mikroorganisme. Protease dari tanaman misalnya papain yang berasal dari getah pepaya, fisin yang berasal dari getah pohon ficus, dan bromelin yang bcrasal dari nenas. Protease dari hewan, contohnya renin, yang berasal dari lambung anak sapi. Sedangkan mikroorganisme yang merupakan penghasil protease yang cukup potensial adalah berbagai bakteri seperti Bacillus, Pseudomonas, Clostridium, Proteus dan Serratia, dan kapang seperti Aspergillus, Mucor, dan Penicillium.
Secara komersil, beberapa enzim diproduksi dari mikroorganisme karena mempunyai beberapa keuntungan, diantaranya pertumbuhan mikrorganisme yang relatif cepat dan mudah diatur menyebabkan enzim yang dihasilkan lebih seragam. Di samping itu mikroorganismenya sendiri dapat direkayasa, sehingga enzim dari mikroba mudah diproduksi dalam jumlah besar. Selain itu prosedur isolasinya pun relatif mudah.
Peranan protease dalam industri diantaranya untuk mempercepat pengempukan daging, klarifikasi dan pematangan bir, bahan aditif detergen, pembersih lensa kontak, dan untuk memproduksi bahan pangan dari kedelai. Di Jepang, enzim ini telah dimanfaatkan dalam pembuatan kecap untuk mempercepat proses fermentasi.
B. PROTEASE Aspergillus olyzae
Aspergillus oryzae merupakan sumber yang baik untuk memproduksi protease (Aunstrup, 1980). D i Amerika, enzim-enzim yanq diproduksi oleh Becillus subtilis, A.oryzae, dan A. niger dianggap aman dan boleh dipergunakan dalam makanan. Senyawa tersebut termasuk dalam 9o:Longan GRAS / Generally Recognized as Save (Winarno, 1986).
Menurut Aunstrup (1980), enzim diproduksi di dalam sel dengan dua sifat, yaitu dapat disekresikan ke luar sel atau tetap berada di dalam sel. Enzim yang disekresikan ke luar sel disebut enzim ekstraseluler, sedang enzim yang tetap berada di dalam sel disebut enzim intraseluler. Enzim intraseluler lebih sulit dimanfadtkan dalam industri karena metode ekstraksinya lebih sulit dan sifatnya lebih labil.
Protease dari A. oryzae tergolong enzim ekstraseluler yang dapat menghidrolisis substrat disekitarnya. Enziln ini bersifat terinduksi, artinya pada substrat yang sesuai produksinya akan meningkat. Tanpa penginduksi, enzim tetap diproduksi, tetapi dalam jumlah yang lebih kecil (Meyrath dan Volavsek, 1975).
Ada 3 macam protease yang dihasilkan oleh Aspergillus, yaitu protease alkali, karboksil, dan netral (Ward, 1983). Aunstrup (1980) menyatakan bahwa
A. oryzae dapat memproduksi protease asam dan alkali, sedang menurut Njoku (1989) A. oryzae dapat menghasilkan ketiga macam protease tersebut. Kasai et al. (1984) menerangkan bahwa A. oryzae menghasilkan metalloproteinase, yang mempunyai pH optimum 6,5, dan Lestario (1991) menambahkan bahwa aktivitas protease ini ditingkatkan olfh logam-logam Mn, Co, Zn, dan Ca, tetapi dihambat oleh EDTA, KCN, dan pCMB.
Tipe protease yang terbentuk tergantung pada media pertumbuhannya. Kandungan nitrogen dalam bentuk protein / peptida yong tinggi dan senyawa karbon yang rendah akan mengintiuksi pembentukan protease netral dan alkali. Sebaliknya kandungan karbohidrat yang tinggi dan adanya asam amino bebas dapat menekan pembentukan protease (Meyrath dan Volavsek, 1975). Hal ini didukung oleh Aunstrup (1980) dan Fardiaz (1987) yang menyatakan produksi protease sebaiknya dilakukan pada substrat yang mengandung rasio N/C tinggi, seperti corn steep liquor, ekstrak khamir, pepton, atau tepung kedelai.
Fermentasi substrat padat sangat cocok untuk memproduksi enzim-enzim dari Aspergillus, Mucor, dan Penicillium; dan sudah dibuktikan baik untuk pertumbuhan A.oryzne. Media fermentasi yang terdiri dari campuran 7 bagian dedak dan 3 bagian tepung kedelai, yang disuplementasi dengan KH2P04 paling baik untuk memproduksi protease A. oryzae (Lestario, 1991).
Ion fosfat yang ditambahkan dapat menginduksi produksi protease (Ueno et a l . , 1987).
Umumnya enzi~n dari kapang dibentuk setelah 24 jam dan terus meninqkat sampai mencapai maksimum pada saat persediaan makanan pada media habis. Dalam berbagai penelitian mengenai protease A. oryzae, waktu fermentasi bervariasi dari 65 jam sampai 5 hari,
tergantung lingkungan tumbuh dan strain mikroorganisme yang dipergunakan (Kasai et al., 1984; Ueno et al.,
1987; Lestario, 1991).
C. PEMURNIAN ENZIM
Pada umumnya enzim terdapat dalam campuran yang kompleks, sehingga untuk mempelajari karakteristik dan cara kerja suatu enzim diperlukan pemurnian enzim tersebut. Adanya enzim lain akan mengganggu dengan beberapa cara, seperti turut bereaksi dengan substrat sehingga memberikan hasil reaksi yang lain, dan menyerang koenzim atau bahkan enzim itu sendiri (Clark dan Switzer, 1977).
Langkah awal dalam pemurnian adalah mengekstrak protein yang dikehendaki. Lokasi protein yang bersangkutan dan sifat-sifatnya sangat berpengaruh terhadap metode ekstraksi yang dipergunakan. Ada beberapa larutan yang dapat dipergunakan dalam ekstraksi, misalnya dengan buffer fosfat pH . 7
(Impoolsup et al., :1981), 2% NaCl (Wang et al., 1974), dan Tween 80 (Saputro, 1987; Lestario 1991).
Penggunaan bahan pengekstrak tergantung pada sifat enzim yang diltehendaki. Impoolsup et al. (1981) menyatakan bahwa penggunaan buffer fosfat pH 7 dapat merusak protease asam, sehingga pada hasil penelitiannya tidalc ditemui adanya enzim tersebut.
Larutan detergen encer, seperti Tween, memberi keuntungan lain bila dipergunakan sebagai pengekstrak enzim, yaitu dapat mengekstrak enzim yang terikat pada struktur mitokondria (Dixon et dl., 1979)
Untuk protein ekstraseluler, yang disekresikan k e dalam medium fermentasi, sebelum dimurnikan diperlukan tahap pfnjernihan atau pemisahkan sel dan partikel-partikel yang tidak dikehendaki. Pemisahan ini dapat dilakukdn dengan metode pengendapan atau mikrofiltrasi. Metode pemurnian enzim pada dasarnya tidak berbeda dengan pemurnian protein. Tahap yang umum dipergunakan meliputi pengendapan protein, kromatografi, dan elektroforesis (Scopes, 1987).
Beberapa metode yanq umum dipergunakan dalam pemisahan protein dengan pengendapan, yaitu berdasarkan peruba- han pH, perubahan lcekuatan ion (salting
in
/
salting out), menggunakan pelarut organik atau polimer organik, serta denyan pendenaturasian. Sedangkan metode pemurnian dengan kromatografi dapat dibagi dalam tiga bagian besar, yaitu kromatografi adsorbsi, kromatografi gas, dan HPLC. Kromatografi adsorbsi dapat dibagi lagi menjadi kromatografi filtrasi gel, penukar ion, affinitas, pengikatan pewarna; yang merupakan pemisahan berdasarkan keseragaman ukuran a molekul, muatan, substrat spesifik, dan kemampuan mengikat suatu pewarna.1). I'EMUItNIAN PROTEASE DARI ASPERGILLUS
Impoolsup et al. (1981) memurnikan protease dari A. flavus var columnaris dan memperoleh protease netral dan alkali. Pemurnian diawali dengan pengendapan enzim kasar dengan ammonium sulfat, endapan yang diperoleh didialisis dengan buffer fosfat p H 7,
hasilnya dipekatkan dengan ultrafiltrasi dan diaflo- membran. Larutan enzim yang sudah pekat dituang k e kolom kromatografi dengan bahan pengisi berturut-turut DEAE Sephadex A-50, CMC-CM 52, Sephadex G-100.
Pada pemurnian karboksipeptidase 0-1 dari A. oryzae, Takeuch-i dan Ichisima (1981) menggunakan DEAE Sephadex dan CMC. Mula-mula enzim diendapkan dengan ammonium sulfat, lalu diikuti dengan kromatografi. Uji kemurnian dilakukan dengan Elektroforesis Gel Poliakrilamid (PAGE) dan Isoelektrik Fokusing Gel Poliakrilamid (PAGIF).
Beberapa peneliti lain, Yagi et al. (198G),
memurnikan karboksil proteinase dari A. kawachii
dengan kromatografi DEAE Sephadex A-50, SP-Sephadex C-50, dan Sephadex G-100. Homogenitas enzim ditentukan dengan PAGE.
Pemurnian metalloproteinase dari A. oryzae
pernah dilakukan oleh Kasai et al. (1384) dengan menggunakan Talopeptin-Aminohexyl-Sepharose. Cara ini
dikombinasikan denqan pemekatan dengan diafilter dan kromatografi dengan Sephadex G-100, serta pengendapan dengan ammonium sulfat.
Isolasi protaase alkali dari A. oryzae yang telah dilakukan oleh Feinstein dan Gertler (1973) berhasil dilakukan dengan satu tahap saja, yaitu dengan kromatografi affinitas pada kolom Ovoinhibitor Sepharose.
E. TEICNIK ELEKTROFOI1ESIS Dl DALAM ANALISIS ENZlM
1. Elektroforesis
Elektrofornsis adalah suatu cara untuk memisahkan fraksi-fraksi suatu zat berdasarkan migrasi partilcel bermuatan atau ion-ion makromolekul di bawah pengaruh medan listrik (Pomeranz dan Meloan, 1380). Miqrasi partikel bermuatan tersebut dapat terjadi karena perbedaan ukuran, bentuk, muatan, atau sifat kimia molekul. Sedangkan menurut Morris dan Morris (1976), perpindahan molekul bermuatan pada elektroforesis merupakan aksi dari medan listrik.
Jika sebuah molekul bermuatan q berada dalam larutan atau suspensi di sebuah medium cair dan menjadi subyek dari medan listrik dengan kekuatan H, maka gaya yang bekerja pada molekul tersebut, yang mengakibatkan pergerakannya, adalah sebesar qH.
Di dalam medium, molekul yang bergerak dengan kecepatan v menginlami hambatan yang disebabkan oleh koefisien geselcan f, sebesar fv. Pergerakan molekul terjadi sampai gaya listrik qH mengalami kesetimbangan dengan hambatan gesek yang ada, sehingga berlaku persamaan :
SB
v = - (Morris dan Morris, 1976)
f
Menurut hukum Stokes, molekul bulat dengan jari-jari r yang melalui medium polar dengan viskositas n akan mengalami gesekan sebesar :
sehingga :
Dengan demikian mobilitas elektroforetik
( H atau p ) dari sebuah molekul, yang didefinisikan sebagai pergerakan per unit kekuatan medan listrik dapat dituliskan dengan persamaan :
Dalam pemisahan berdasarkan muatan, molekul-molekul protein yang mempunyai muatan berbeda akan terpisah selama bergerak k e arah elektroda yang polaritasnya berlawanan dengan muatan molekul tersebut (Boyer, 1986).
Boyer (1986) juga mengatakan bahwa elektroforesis umumnya dipergunakan untuk karakterisasi dan analisis molekul-molekul besar / polimer, diantsranya untuk menentukan berat molekul, mendeteksi kemurnian dan kerusakan protein, menetapkan titik isoelektrik, memisahkan spesies-spesies molekuler yang berbeda secara kualitatif maupun kuantitatif.
Berdasarkan jenis media penyangganya, Boyer (1986) mengklasifikasikan elektroforesis dalam Elektroforesis Cairan dan Elektroforesis Zona. Dalam Elektroforesis Cairan media yang dipergunakan adalah larutan buffer, sedang dalam Elektroforesis Zona media penyinngga berupa padatan, yaitu kertas atau gel. Dengan adanya medium penyangga, gangguan karena konveksi dapat dihilangkan.
Elektroforesis Zona sering dipergunakan dalam analisis kemurnian dan penentuan berat molekul. Pada elektroforesis ini migrasi molekul dipengaruhi oleh besarnya medan listrik dan kekakuan medium penyangga yang dipergunakan. Lebih lanjut Boyer
(1986) membagi Elektroforesis Zona berdasarkan media penyangganya, menjadi Elektroforesis Kertas / selulosa Asetat dan Elektroforesis Gel
2. Elektroforesis Gel Poliakrilamid (PAGE)
Ada dua macam bahan penyangga yang umum dipergunakan dalam Elektroforesis Gel, yaitu gel pati dan gel poliakrilamid. Gel pati menghasilkan resolusi yang lebih baik dibanding kertas / selulosa asetat, tetapi penggunaannya terbatas karena ukuran porinya tidak seragam. Analisis isoenzim dan beberapa protein tertentu masih menggunakan bahan ini. Gel poliakrilamid mempunyai beberapa keunggulan dibanding gel pati, terutama dalam pengontrolan ukuran pori. Ukuran pori pada gel poliakrilamid dapat dibuat seragam, dua macam (gel diskontinyu), ataupun bervariasi sepanjang gel (gel gradien)
.
Poliakrilalnid merupakan bahan penyangga yang relatif baru dalam elektroforesis. Bahan ini lebih menguntungkan, karena di samping ukuran porinya dapat diatur, bahan ini bersifat transparan sehingga dapat diwarnai pada daerah sinar tampak maupun daerah ultra violet. Selain itu poliakrilamid merupakan medium yang secara kimia bersifat inert, tidak bereaksi dengan sampel, dan tidak bermuatan (Nur dan Adijuwana, 1988).
Gel poliakrilamid diperoleh dengan cara polimerisasi akrilamid.dengan adanya sejumlah kecil
cross-linking agent N,N1-metilen-bis-akrilamid dan ammonium persulfat sebagai katalisator. Selain itu diperlukan TEMEII (Tetrametil-etilendiamid) yang juga bertindak sebagai katalisator terutama dalam mengawali terjndinya polimerisasi (Nur dan Adijuwana, 1988).
Menurut Nur dan Adijuwana (1988), reaksi pembentukan poliakrilamid adalah : radikal-radikal bebas yang terbentuk dari ammonium persulfat akan bereaksi dengan akrilamid, sehingga terbentuk akrilamid aktif. Akrilamid ini dapat bereaksi dengan molekul akrilamid lain dengan cara yang sama, sehingga dihasilkan rantai polimer yang pan jang
.
Larutnn yang mengandung rantai polimer ini kental tetapi tidak membentuk gel. Untuk membentuk gel diperlukan N,N1-metilen-bis-akrilamid yang bertindak sebagai cross-linking agent.Polimerisasi menyebabkan terbentuknya jala dari rantai akrilamid. Ukuran pori dari jala tersebut ditentukan oleh jumlah akrilamid yang dipergunakan per unit volume medium reaksi dan derajat ikatan silangnya (Boyer, 1986).
PAGE dapat dipergunakan untuk uji homogenitas, estimasi BM, mobilitas relatif, muntan netto, dan koefisien difusi apparent (Maurer, 1974). Menurut Mayes et al. (1987), homogenitas protein paling baik diuji dengan PAGE. Makin rendah konsentrasi poliakrilamid yang dipergunakan dan makin kecil ukuran molekul yang akan dipisahkan, mobilitas molekul tersebut makin besar. Pada konsentas
i
standar (7,5%) senyawa yang mempunyai berat molekul 10.000-
1.000.000 dapat dipisahkan dengan baik. Gel dengan konsentrasi poliakrilamid 3 , 5 % dapat dipergunakan untuk memisahkan makromolekul yang mempunyai berat molekul 1.000.000-
5.000.000 (Boyer, 1986).PAGE dapat dilakukan pada 2 macam gel, yaitu gel yang berbentuk batang atau lempeng tipis diantara dua plat kaca. Tidak seperti pada gel berbentuk batanq yang hanya dapat memuat satu sampel tiap batang, pada gel berbentuk lempeng lebih dari 1 sampel dapat dielektroforesis secara simultan (Boyer, 1986). Gel berbentuk lempeng dapat dielektroforesis secara vertikal atau bila adanya pengaruh grafitasi tidak diinginkan, dapat dilakukan elektroforesis horisontal.
3. PAGE dengan Sodium Dodesil SulEat (SDS-PAGE)
Variasi yang terkenal dalam PAGE adalah SDS- PAGE, yaitu PAGE yang'dilakukan pada sampel yang terdenaturasi (Mayes et al., 1987)
.
SDS (Sodium Dodesil Sulfat) merupakan anionik deterjen yang bersama dengan D-merkaptoetanol dan pemanasan menyebabkan rusaknya struktur tiga dimensi protein. Hal ini disebablian oleh pecahnya ikatan disulfida yang selanjutnya tereduksi menjadi gugus sulfhidril (Smith, 1984). Mula-mula SDS merusak struktur sekunder,
tersier, dan kuaterner protein, menghasilkan ' rantai polipeptida yang acak.Selanjutnya 8-merkaptoetanol memecah semua ikatan disulfida yang ada. Kedua reaksi tersebut menyebabkan protein terdenaturasi (Boyer, 1986). SDS mengikat protein yang terdenaturasi pada sisi hidrofobik dengan perbandingan yang selalu sama, yaitu 1,4 gram SDS per gram protein (Smith, 1984).
SDS-PAGE dilakukan pada pH sekitar netral. Pada pH 7 , SDS akan membentuk kompleks dengan protein dan kompleks ini bermuatan negatif karena adanya gugus-gugus anion dari SDS. Dengan demikian seluruh sampel yang ditambahkan akan bergerak k e elektroda positif. Kompleks SDS-protein yang lebih besar mempunyai mobilitas yang lebih kecil dibandingkan dengan kompleks yang lebih kecil (Nur
dan Adijuwana, 1988). SDS-PAGE dapat dipergunakan untuk mengetahui apakah suatu protein monomerik ataukah oligomerik. Selain itu juga untuk menetapkan berat molekul dan jumlah rantai polipeptida suatu protein.
4. Faktor-Faktor yang Mempengaruhi
Keberhasilan pemisahan suatu senyawa dengan elektroforesis dipengaruhi oleh banyak hal. Diantaranya sistem buffer, suhu, waktu dan besarnya arus listrik yanq dipergunakan. Keempat parameter tersebut saling mempengaruhi. Semakin tinggi arus yang dipergunalcan, semakin pendek waktu yang dibutuhkan, tetaj~i suhu akan meningkat.
Waktu yang diperlukan untuk menghasilkan pola pemisahan yang optimum tergantung pada jenis molekul yang dipisahkan dan buffer Yang dipergunakan. Menurut Morris dan Morris (1976),
mobilitas suatu molekul dipengaruhi oleh waktu ionisasi dan deionisasi molekul tersebut. Sedangkan besarnya arus listrik yang dibutuhkan tergantung pada banyaknya kolom elektroforesis yang ditanggungnya (Nur dan Adijuwana, 1988).
Pengaruh suhu terhadap mobilitas dapat dilihat dari hukum Stokes. Suhu dapat mempengaruhi kekentalan media (n) dan jari-jari ion (r),
dan Morris (19'76) menyatakan bahwa secara kasar terjadi peningkdtan mobilitas ionik sebesar 2,5%
per derajat kenaikan suhu.
Buffer berfungsi mempertahankan pH baik dalam reservoir ataupun dalam gel, dan merupakan elektrolit pembawa aliran listrik. Untuk tercapainya kedud fungsi tersebut, menurut Nur dan Adijuwana (1988), diperlukan 3 kondisi sebagai berikut :
(1) Buffer yang dipilih harus tidak bereaksi dengan makromolekul ydng dipisahkan. Interaksi yang terjadi akan menyebabkan perubahan kecepatan pergerakan molekul dalam medan listrik; dan mengakibatkan 1 spesies terlihat menjadi 2.
(2) pH yang dipergunakan dalam elektroforesis harus sedemikian rupa sehingga campuran makromolekul dapat terpisah satu sama lain. Kisaran pH yang umum dipergunakan untuk protein 4,5-9,O.
(3) Kekuatan ionik dan konsentrasi buffer harus diperhitungkan dengan tepat. Apabila konsentrasi elektrolit di dalam gel terlalu rendah, makromolekul akan bergerak terlalu cepat
.
Akibatnya pita-pita yang terbentuk tidak tajam, melainkan tampak seperti daerah difusi yang sangat menurunkan resolusi. Sebaliknya, apabila konsentrasi elelctrolit sangat tinggi, maka timbulpanas yang dapat menimbulkan denaturasi; sehingga meskipun pita yang diperoleh tajam, pergerakan molekul hanya mencapai jarak yang pendek. Kekuatan ionik buffer yang dipergunakan berkisar antara 0,05-0,15.
5. Pewarnaan Protein
Pewarnaan berguna untuk memperjelas pita protein hasil pernisahan dengan elektroforesis. Ada bermacam-macam pewarna yang dapat dipergunakan untuk mendeteksi adanya protein, diantaranya Amido Black, Nigrosinc, Coomassie Brilliant Blue R-250 dan G-250, CuC12, AgN03, dan lain-lain (Blakesley dan Boezi, 1977; Merril, 1983; Scopes, 1987; Lee et dl., 1987).
Menurut Maurer (1974), kapasitas ikatan suatu pewarna terhadap protein sangat bervariasi. Meskipun demik ian, selama molar extinction coefficient pewdrna yang dipergunakan masih lebih besar daripada molekul sampel, pewarnaan merupakan metode deteksi yang paling sensitif.
Sebelum pevarnaan dilakukan fiksasi protein, yaitu denaturasi protein dengan asam. Bahan-bahan yang umum dipergunakan adalah campuran Metanol, Asam Asetat, dan air; Asam Sulfosalisilat; Formaldehid; Glutaraldehid; TCA; atau Asam Perklorat 5-10% (Laemmli, 1970; Smith, 1984;
Scopes, 1987; Dunn, 1989). Fiksasi berguna untuk mengendapkan dan mengimobilisasikan protein yang telah terpisah pada gel dan menghilangkan komponen- komponen non protein yang dapat menghalangi pengikatan pewarna oleh protein. Pada gel yang mengandung SDS, SDS harus dikeluarkan dari gel. Demikian pula senyawa amfolit. Senyawa-senyawa ini dapat terdifusi keluar pada saat fiksasi (Scopes,
1987).
Pewarna yang dipergunakan harus dapat bereaksi dengan molekul sampel yang dipisahkan, tetapi tidak bereaksi dengan gel elektroforesis. Ikatan antara pewarna dan gel bukan ikatan kovalen, sehingga mudah dilepaskan oleh pencucian yang intensif dan penyinaran (Maurer, 1974). Setelah pewarnaan, di Lakukan penghilangan warna / pelunturan dengan merendam gel dalam larutan peluntur sampai latar belakangnya relatif jernih dibanding pita ydng dihasilkan (Nur dan Adijuwana,
1988). Menurut Ounn (1989), waktu yang diperlukan
untuk destaining tergantung pada ketebalan gel dan konsentrasi polidkrilamid.
5.1. Pewarnaan Coomassie
Pewarna yang umum digunakan untuk mendeteksi protein adalah Coomassie Brilliant Blue. Tetapi
kelemahannya, pewarna ini hanya dapat mendeteksi protein yang berjumlah besar. Menurut Dunn (1989),
pewarna ini dapat ' mendeteksi protein pada konsentrasi 0,5 pg/cm2. Selain itu, menurut Scopes
(1987), pewarna ini tidak sesuai untuk protein yang
bersifat asam.
Interaksi antara pewarna ini berbeda untuk protein yang berbeda. Jumlah molekul pewarna yang terikat tergantung pada muatan positif protein yang bersangkutan, sekitar 1,5
-
3 molekul pewarna / muatan (Tal et al).5.2. Pewarnaan Cu
Interaksi antara cu2+ dengan protein telah banyak dijelasknn dan bahkan merupakan dasar dari beberapa metode pengukuran jumlah protein, seperti metode Biuret, Lowry, dan Asam Bicinchoninat. Selain itu CuC12 mampu mengimobilisasi protein pada gel elektroforesis. Dengan dasar itu, Lee e t al.
(1987) mempergunakan CuC12 sebagai pewarna aan
menyebutnya Copper Staining. Metode pewarnaan ini tergantung pada 2 reaksi yang berlawanan, yaitu pengendapan CU++ oleh SDS dan pembentukan kompleks antara Cu dan protein. Menurut Mehl et al. (1949),
pada kompleks Cu-Protein, 1 atom Cu berikatan dengan 4 atom N pada ikatan peptida.
Pewarnaan
cu
bermanfaat untuk analisa protein secara cepat pada SDS-PAGE. Metode pewarnaan ini juga memungkinkan untuk mendapatkan polipeptida yang dipisahkan dengan elektroforesis untuk dikarakterisasi lebih lanjut. Prosedur pewarnaan ini mempunyai beberapa keunggulan, diantaranya paling sedikit 3 kali lebih sensitif dibanding pewarnaan Coomassie, cepat, mudah, dan tidak memerlukan tahap pelunturan. Selain itu protein yang telah dipisahkan dapat diperoleh kembali secara kuantitatif setelah Cu dikelat dengan EDTA.5.3. Pewarnaan Ag
Ion perak mampu mengikat protein pada pita transparan sehinqga dapat terlihat pada gel. Sifat transparan tersebut dapat disebabkan oleh perubahan struktur air dan interaksi antara ion dan ~ 1 - . Merril (1983) menyatakan bahwa pewarnaan ini 100 kali lebih sensitif dibanding pewarnaan Coomassie dan 10 kali dibanding pewarnaan Cu. Dengan pewarnaan ini, protein yang terdapat dalam skala nanogram masih dapat terdeteksi (Lee et al., 1987).
5.4. Pewarnaan Spesif ik
Ada suatu metode pewarnaan yang dapat dipergunakan untuk mendeteksi enzim, yaitu Pewarnaan Spesifik, yang bekerja berdasarkan reaksi
spesifik enzim
-
substrat. Pemakaian metode pewarnaan ini terbatas pada gel tanpa denaturasi, baik oleh SDS atau Ukea, sebab denaturasi dapat menghilangkan alctifitas katalitik enzim. Metode ini umumnya dipergunakan untuk protein yang tidak difiksasi, oleh sebab itu pereaksi yan9 dipergunakan harus dapat berdifusi lebih cepat sebelum protein/
enzim itu sendiri terdifusi(Scopes, 1987)
.
Menurut Scopes (1987), ada 2 metode pewarnaan ini. Pertama, dengan merendam gel pada pereaksi yang sesuai. Metode ini cukup memuaskan jika hasil reaksi akhir bersifat insoluble. Kedua, pereaksi diimobilisasi pada bahan penyangga, seperti gel Agarose, Seluloaa Asetat, atau kertas saring. Sehubungan dengan itu, Scopes (1987) memberikan salah satu cara yang dapat dilakukan untuk menentukan pita mana yang mengandung enzim, yaitu dengan membelah gel yang telah dielektroforesis, kemudian salah satu belahan diwarnai dengan pewarnaan Spesifik dan belahan yang lain dengan metode pewarnaan protein biasa. Pita enzim dapat ditentukan dengan membandingkan kedua hasil pewarnaan tersebut.
6. Analisis Hasil Elektroforesis
Analisis hasil elektroforesis pada umumnya didasarkan pada mobilitas elektroforetik protein. Menurut Nur dan Adijuwana (1988), mobilitas suatu partikel adalah kecepatan yang dicapai oleh partikel tersebut pada suatu medan listrik. Sedang menurut Suhartono (1988), mobilitas relatif suatu protein adalah perbandingan jarak antara titik awal k e pita protein dengan titik awal k e titik akhir elektroforesis. Pada kondisi yang sama, besarnya mobilitas selalu sama untuk setiap ion, sehingga dapat dibuat hubungan antara berat molekul dan mobilitasnya (Nur dan Adijuwana, 1988).
Mobilitas := iarak miarasi protein relatif jarakyigrasi %t warna
Menurut Conn et al. (1987), estimasi BM protein dapat dilakukan berdasarkan protein standar yang sudah diketahui BM-nya. Ada dua cara pembuatan kurva standar untuk estimasi BM. cara pertama dilakukan dalam dua tahap, yaitu mencari hubungan antara mobilitas relatif protein standar dengan konsentrnsi gel yang dipergunakan. Dan membuat kurva stilndar yang-menghubungkan BM dengan kemiringan kurva pertama. Sedangkan cara kedua adalah cara esti~nasi BM dengan SDS-PAGE, yang mampu memisahkan protein berdasarkan ukuran / berat
111. METODE P E N E L I T I A N
A . B A H A N DAN A L A T
1. Bahan
Bahan-bahan yang dipergunakan dalam penelitian ini adalah :
-
Substrat fermentasi kecap (fase moromi) dari pabrik kecap Zebra, Bogor-
Substrat/
media pertumbuhan, yaitu dedak, tepung kedelai, dan media sintetik PDA-
Bahan-bahan kimia untuk isolasi : media sintetik Potato Dextrose Agar dan Skim Milk Agar-
Bahan-bahan kimia untuk pengujian aktivitas enzim : Na2HP04, NaH2P04, Kasein, Tirosin,
TCA, CaC12, Na2C03, Folin-ciocalteau, H2S04, Etanol 95%, Coomassie Brilliant Blue G-250-
Bahan-bahan kimia untuk pemurnian enzim Ammonium Sulfat, Aseton, Sephadex G-100-
Bahan-bahan kimia untuk analisis dengan elektroforesis : Buffer Fosfat, Buffer Tris-HC1, Buffer ~ r i s - ~ l i s i n , SDS, Akrilamid, N,Nt-Metilen Bis-Akrilamid, Ammonium Persulfat, TEMED, Bromofenol Blue, B-Mercaptoetanol, Metanol, Asam Asetat Glasial, Coomassie Brilliant Blue R-250, CuC12, TCA, Etanol, KMn04, AgN03, DTT, Glutaraldehid, Na2C03, Formaldehid, Asam Sitrat.2. Alat
Alat-alat yang diperlukan ini adalah :
-
Alat-alat gelos-
pengering beku- Timbangan analitik
- Pengaduk magnetik
-
Pembakar Bunsen, jarum ose-
Satu set alat kromatografi-
Satu set pengumpul fraksi-
Satu set alat elektroforesisuntuk penelitian
-
Autoclaf-
Inkubator-
Lemari pendingin-
Spektrofotometer-
pH meter-
Penangas air-
Pompa vakum-
Sentrifus B. METODE PENELITIANPenelitian ini terdiri dari 4 tahap, yaitu isolasi kapang proteolitik, produksi, pemurnian, dan analisis protease. Masing-masing tahap dijelaskan di bawah ini.
I . ISOLASI KAPANG PROTEOLITIK
5 g substrat fermentasi kecap (fase moromi) dipanaskan sebentar pada suhu 70°c, diblender, disuspensikan dalam 45 ml air steril, kemudian diencerkan 10-I
-
dan ditumbuhkan pada media PDA dengan metode tuang. Inkubasi pada suhu 30°cselama 3 hari. Hal yang sama juga dilakukan pada substrat yang tidak dipanaskan. Kapang yang tumbuh
diinokulasikan pada media SMA dengan metode permukaan dan diinkubasi pada suhu 30°c selama 3 hari. Kapang yang menghasilkan areal bening disekeliling koloni ditumbuhkan pada agar miring PDA.
Identifikasi isolat kapang dilakukan sesuai dengan metode yang dikemukakan oleh Klich dan Pitt (1988)
.
Kapany ditumbuhkan pada media Czapek Yeast Agar (CYA) dan CYA yang mengandung 20%Sukrosa (CYZOS), kemudian diinkubasikan pada suhu ruang selama 7 hari. Hasil pengamatan makroskopik disesuaikan dengan kunci identifikasi spesies Aspergillus, seperti yang terlampir pada lampiran
6. Pengamatan mikroskopik dilakukan dengan slide culture pada media CYA. Pewarna yang dipergunakan adalah Lacto-fenol Cotton Blue.
2. PRODUKSI I'ROTEASE
Pada tahap ini diproduksi protease dari A.
oryzae pada media campuran dedak dan tepung kedelai sesuai dengan hanil penelitian Lestario (1391). a. Penyiapan Media Fermentasi
10 g media fermentasi (campuran dedak dan tepung kedelai, 7:3, berdasar berat) ditambah 10 ml KH2PO4 4 mM, pH diatur menjadi 6.
b. Pembuatan Inokulum dan Inokulasi
Sebelum pembuatan inokulum, dilakukan pengujian aktivitas proteolitik pada media SMA. Adanya aktivitas proteolitik ditandai dengan terbentuknya areal bening di sekeliling kultur. Biakan A. oryzae pada agar miring, yang telah diinkubasikan pada suhu 30°c dan berumur 4 hari, diberi air steril sebanyak 10 ml. 2 ml suspensi ini diinokulasikan pada media yang telah disiapkan dan diinkubasi pada suhu 3o0c selama 3 hari (72 jam).
c. Ekstraksi
Enzim diekstraksi dengan 100 ml 0,1% larutan Tween 80 ddn pengadukan selama 1 jam pada kecepatan 160 rpm. Suspensi enzim yang telah terekstrak dipisahkan dari media dengan penyaringan menggunakan kain kassa dan kapas. Untuk memisahkan sel-sel mikroba dan sedikit media fermentasi yang tertinggal, filtrat tersebut discntrifus dengan kecepatan 4000 rpm selama 10 menit. Pada filtrat yang diperoleh dilakukan pengukuran aktivitas protease dan jumlah protein. Aktivitas protease ditentukan dengan hidrolisis kasein (Bergmeyer, 1983), sedang jumlah protein dengan metode pengikatan zat pewarna (Bradford, 1976).
d. Pengukuran Jumlah Protein
Protein terlarut ditetapkan berdasarkan kurva standar BSA. Pembbatan larutan Bradford adalah sebagai berikut: 100 mg Coomassie Brilliant Blue G250 dilarutkan dalam 50 ml Etanol 95%, kemudian ditambah 100 ml Asam Fosfat 85% dan diencerkan snmpai 1 liter. Pewarna yang tidak larut dipisnhkan dengan penyaringan. Skema metode ini dapat dilihat pada gambar di bawah ini. SAMPEL STANDAR 0 , 2 ml enzim 0,2 ml BSA
I
konsentrasi 0,l-1 mg/ml-r----
- -- ---'
I+
5 ml larutan BradfordI
Ididiamkan 20 menit pada suhu ruang
I
Idilakukan pengukuran Absorbansi pada panjang gelombang 595 nm
Gambar 2. Penetapan jumlah protein (Dradford, 1976)
e. Pengujian Aktifitas Protease Prinsip pengujian ini adalah :
Kasein Hz0 Peptida
+
Asam AminoProtease
Laju pembentukan peptida dan asam amino dari reaksi tersebut dapat dijadikan tolok ukur
akktivitas katalisis protease. Asam-asam amino yang telah terbentuk harus diisolasi dan dipisahkan dari substrat yang masih tersisa. Cara yang paling umum adalah dengan TCA. Pengukuran asam-asam amino yang telah diisolasi tersebut dapat dilakukan pada panjang gelombang
280 nm atau pada daerah sinar tampak, setelah terlebih dahulu diwarnai dengan pereaksi Folin. Tahap penqujian aktivitas protease ini terdapat pada tabel 1.
Berdasarkan perjanjian Internasional, aktivitas protease dinyatakan dalam Internasional Unit (IU). Satu IU protease menyatakan jumlah enzim yang dapat menghasilkan 1 wmol produk (tirosin) per menit. IJnit aktivitas tiap sampel dihitung dengan persamaan :
dimana : UA = jumlah tirosin yang dihasilkan per ml enzim per menit
= nilai absorbansi sampel Abl = nilai absorbansi blanko P = faktor koreksi
T = lamanya reaksi (menit)
T a b e l 1. ~ e n g u j i a n a k t i v i t a s p r o t e a s e ( B e r g m e y e r , 1 9 8 3 )
...
P e r e a k s i S a m p e l B l a n k o...
B u f f e r f o s f a t ( 0 , O l M , pH 7 ) 1 , 0 0 m l 1 , 0 0 m l S u b s t r a t k a s e i n ( 2 % , pH 7 ) 1 , 0 0 m l 1 , 0 0 m l A q u a d e s---
0 , 2 0 m l Enzim d a l a m CaC12 0 , 2 0 m l---
...
D i i n k u b a s i k a n selama 1 0 m e n i t p a d a s u h u 3 7 ' ~...
TCA ( 0 , 1 M ) 2 , 0 0 m l 2 , 0 0 m l Enzim d a l a m CaC12---
0 , 2 0 m l D i i n k u b a s i k n n s e l a m a 1 0 m e n i t p a d a s u h u 3 7 O ~ , l a l u d i s e n t r i f u s p a d a 4 0 0 0 rpm selama 1 0 m e n i t...
F i l t r a t 1 , 5 0 m l 1 , 5 0 m l P e r e a k s i F o l i n ( 1 : 2 ) 1 , O O m l 1 , O O m l...
D i i n k u b a s i k a n s e l a m a 2 0 m e n i t p a d a s u h u 3 7 O ~ , l a l u d i u k u r a b s o r b a n s i n y a p a d a p a n j a n g g e l o m b a n g 5 7 8 nm...
3. PEMURNIAN PROTEASE
~ e m u r n i a n enzim yang dilakukan meliputi pengendapan enziin yang diinginkan dan kromatografi. Enzim harus dijaga tetap dalam kondisi dingin selama tahap pemurnian. Prosedur pemurnian ini dapat dilihat pada gambar 3. Pada akhir tiap tahap pemurnian dilakukan pengukuran jumlah protein dan aktivitas protease untuk mengetahui kelipatan pemurniannya.
a. Pengendapan dengan Ammonium Sulf at
Filtrat enzim kasar yang diperoleh dari tahap sebelumnya didinginkan pada refrigerator, kemudian 70% bubuk halus Ammonium Sulfat ditambahkan sedikit-sedikit sambil cliaduk dengan pengaduk magnetik sampai semua Ammonium Sulfat selesai ditambahkan. Selama pengadukan suhu dijaga tetap rendah dengan menempatkannya pada wadah berisi es. Filtrat ini didiamkan selama 30 menit sebelum disentrifus denban kecepatan 4000 rpm selama 20 menit. Endapan dilarutkan pada buffer fosfat 0,02 M , pH 7 , 5 dengan volume minimum.
Filtrat enziln kasar hasil fermentasi
I
1
Ditambah 70% Ammonium'Sulfat sambil diaduk dengan pengaduk magnetik pada suhu rendah
I
1
Didiamkan selama 30 menit pada suhu ~ O Cuntuk menyempurnakan pengendapan
I
i
Disentrifus 4000 rpm, 20 menit!
4Endapan enzim dikumpulkan
I
1
Dilarutkan pada 0,02
M
buffer fosfat pH 7,5dengan volume minimum
I
I 1
Dialisis dalam 0,02 M buffer fosfgt pH 7,5
selama semalam pada suhu 4 C
I
i
Filtrat yang diperoleh dikumpulkan
I
i
Ditambah 100% Aseton yang telah didinginkan
I
1
Disentrifus 4000 rpm, 20 menit
I
1
Endapan enzim dikumpulkan
I
i
Dilarutkan pada 0,02 M buffer fosfat pH 7,5 dengan volume minimum
I
1Pemekatan dengan pengering beku
I
1
Kromatografi kolom dengan Sephadex G-100
I
1Pemekatan dengan pengering beku
b. Dialisis
Dialisis dilakukan untuk membebaskan endapan protein dali2m buffer fosfat dari Ammonium Sulfat. Endapan protein dari tahap 3a. dimasukkan ke dalam kantong dialisis (merek Visking, ukuran 30/32) dan didialisis semalam pada buffer fosfat, di ruang dingin sambil diaduk dengan kecepatan rendah.
c. Pengendapan dengan Aseton
Pada larutan enzim ditambahkan 100% Aseton yang telah didinginkan, kemudian disentrifus dengan kecepatan 4000 rpm selama 20 menit. Endapan putih yang dihasilkan dipisahkan dan dilarutkan dalam buffer fosfat dengan volume minimum.
d. Pemisahan dengan Sephadex G-100
Sebelum dipisahkan dengan kromatografi, filtrat enzim dipekatkan terlebih dahulu dengan pengering beku. Kromatografi gel filtrasi dilakukan pada kolom Sephadex G-100. Diameter kolom 1,6 cln dan panjangnya 30 cm. Sebagai
pengelusi dipergunakan buffer fosfat 0,02 M, pH 7 , 5 . Eluen ditampung dengan pengumpul fraksi, tiap tabung menampung 5 ml eluen. Tahap ini juga dilakukan dalam ruang dingin. Pada tiap friiksi dilakukan pengukuran aktifitas
protease dan jumlah protein. Fraksi yang ada aktivitas proteasenya digabungkan, kemudian diukur aktivitas gabungannya.
4. ELEKTKOFORESIS PROTEASE
Gel poliakrilamid disiapkan dan
dielektroforesis sesuai dengan metode Laemmli (1970) yang dimodifikasi oleh Divisi Bioscienses Politeknik Hatficzld (1992), seperti Gang terdapat pada lampiran 8. Analisis yang dilakukan dalam penelitian ini adalah berturut-turut uji metode pewarnaan, uj i aktifitas proteolitik, dan estimasi berat molekul.
Untuk mencari metode pewarnaan yang sesuai, dibandingkan pitd protein hasil elektroforesis pada gel berbentuk batang, yang ditampakkan oleh pewarnaan Coomassie, pewarnaan c u , dan pewarnaan Ag. Makin sesuai pewarna yany dipergunakan, makin tajam pita yancj dihasilkan dan makin sensitif pendeteksiannya.
4.1. Pewarnaan Coomassie
Gel yang telah dielektroforesis direndam dalam larutan pewarna (0,25% Coomassie Brilliant Blue R-250, 46% Metanol, 9% Asam Asetat Glasial) selama 10
-
20 jam. Bilas dengan air destilata, kemudian rendam dalamlarutan poluntur (7,5% Asam Asetat ~ l a s i a l , 30% Metanol) sampai diperoleh pita dengan latar belaltang jernih.
4.2. Pewarnaan Cu (Lee et al., 1987)
Gel yang telah dielektroforesis dicelup beberapa detik dalam air, kemudian direndam dalam 100 ml 0,3 M CuClz selama 5 menit pada suhu ruanq. Gel tersebut ditempatkan pada rak plastik dan digoyang perlahan. Kemudian dicuci 2-3 menit dengan air dan disimpan dalam air destilata.
4.3. Pewarnaan Ag (Morrissey, 1981)
Gel yang telah dielektroforesis berturut- turut direndam selama 30 menit dalam Glutaraldehid lo%, DTT 5 pg/ml, AgN03 0,1%. Selanjutnya gel dicuci dan direndam dalam developer (50 ~1 Formaldehid 37% dalam Na2C03 3%) sampai tingkat pewarnaan yang diinginkan (15 menit). Pewarnaan dihentikan dengan menambahkan Asam sitrat 2,3 M sebanyak 5 ml dan digoyangkan selama 10 menit. Terakhir, gel dicuci dan disimpan dalam air destilata.
Pada pengujian aktifitas proteolitik, dilakukan elektroforesis pada gel tanpa SDS, yang berbentuk lempeng. Setengah bagian gel yang telah
dielektroforesis dilapisi dengan Agarose 1,5% yang mengandung 3% kasein, kemudian diinkubasi selama 3
jam pada suhu 3 7 O ~ . Sedang bagian yang lain diwarnai dengan pewarnaan Ag untuk mendeteksi posisi pita protease. Mobilitas relatif enzim ditentukan dengan membandingkan jarak antara titik awal k e pita protein dengan titik awal k e titik akhir elektroforesis yang ditandai dengan pewarna tanda.
Estimasi berat molekul enzim dilakukan dengan SDS-PAGE. Berat molekul ditentukan berdasarkan kurva standar yang menghubungkan mobilitas relatif protein standar dengan nilai log berat molekulnya. Protein standar yang dipergunakan diperoleh dari Sigma, khusus untuk menentukan berat molekul dengan elektroforesis.
IV. HASlL DAN PEMBAHASAN
A . ISOLASI KAPANG PROTEOLIT~K
Dalam penelitian ini dilakukan isolasi kapang proteolitik dari tahap fermentasi garam pembuatan kecap di pabrik kecap Zebra, Bogor. Prosedur pembuatan kecap di perusahan tersebut adalah sebagai berikut :
200 kg kedelai hitam
+
120 1 airI
1
direbus selama 4 jam, ditiriskan
I
ifermentasi kapang (5-7 hari)
I
i
koji
I
1
dijemur sa~npai kering (& 3 hari)
I
1
fermentasi garam (+- 2minggu)
.
25 kg koji + 25 kg garam
+
60 1 air * )I
1 moromiI
1 dimasak berulang-ulangI
1 kecap (Sumber : Tjangjahdi, 1992)Keterangan : * ) = pengambilan sampel
Pada tahap fermentasi kapang, kedelai yang telah direbus ditumbuhi ol.eh kapang yang terdapat secara alarni pada ruang inkubasi. Kapang yang berperanan pada pembuatan koji ini pada umumnya bersifat proteolitik dan amilolitik kuat. Jenis-jenis kapang yang berhasil diisolasi dari koji pabrik kecap Zebra adalah Aspergillus, Penicillium, dan Rhizopus (Judoarnijoyo, 1986). Selanjutnya koji dikeringkan dan dimasukkan dalam larutan garam. Tahap fermentasi ini berlangsung di tempat terbuka, seperti yang tampak pada gambar 5. Substrat fermentasi yang diambil dapat dilihat pada gambar 6.
Gambar 6 . Substrat fermentasi garam
Konsentrasi yaram yang tinggi bertindak sebagai media selektif baqi pertumbuhan bakteri dan khamir osmofilik. Pada fermentasi garam, pada umumnya kapang tidak tumbuh tetapi sporanya ada. Isolasi dilakukan pada tahap ini karena jumlah kapanq yang akan diperoleh t.idak terlalu banyak. Hal ini memudahkan isolasi kapang yang diharapkan. Perlakuan pemanasan yany dilakukan sebelum isolasi tidak memberikan perbedaan yang nyata dalam jenis kapang yang tumbuh. Gambar di bawah ini nienunjukkan mikroorganisme yang terdapat pada substrat fermentasi garam sebelum diisolasi dan kapang proteolitik yang telah diisolasi.
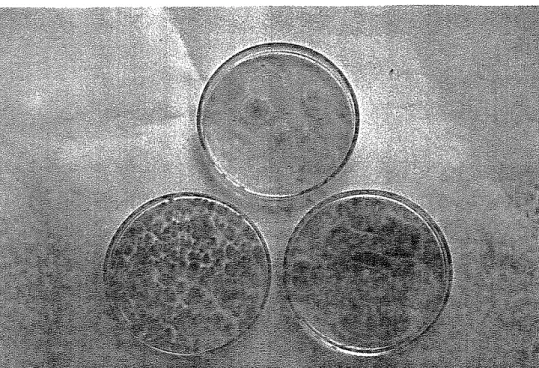
Gambar 7. Hasil isolasi kapany proteolitik
Salah satu cdra isolasi kapang adalah dengan mengisolasi spora ydnq dihasilkannya (Siefert, 1990).
Kapang koji yang terkenal adalah dari genus Aspergillus, seperti Aspergillus oryzae dan A. sojae.
spora Aspergillus mudah dikenali karena berwarna, ada yang hijau, coklat, dan hitam. Dalam isolasi, dari semua koloni yang tumbuh ditemukan 2 jenis kapang yang menghasilkan spora hijau. Kedua kapang tersebut diisolasi dan ditumbuhkan pada media SMA, untuk mengetahui ada tidaknya aktivitas proteolitik. Kapang
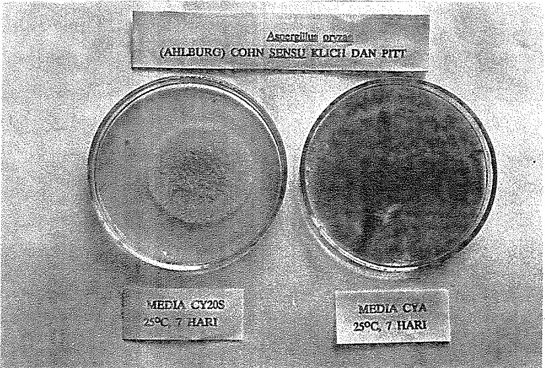
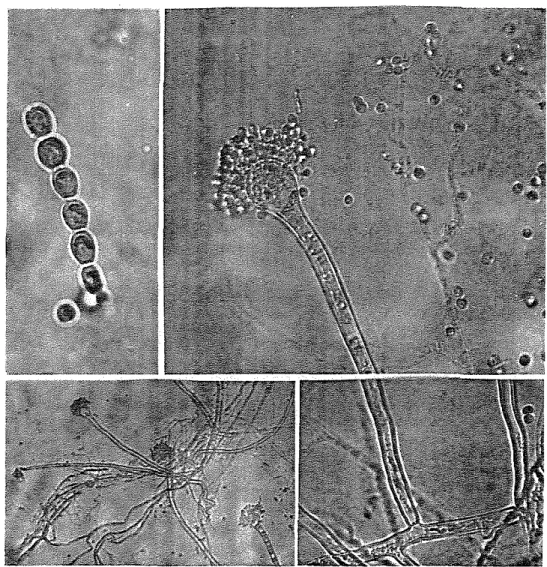
Dengan slide culture pada media PDA diketahui bahwa kapang tersebut tergolong genus Aspergillus. Selanjutnya dilakukan identifikasi khusus untuk spesies Aspergillus (Klich dan Pitt, 1988). Dalam identifikasi ini isolat kapang yang diperoleh ditumbuhkan pada media CYA dan CY20S. Deskripsi kapang tersebut adalah sebagai berikut :
- Makroskopik :
-
spora yang dihasilkan pada kedua media mempunyai warna yang berbeda. Pada CYA hijau kekuningan, pada CY20S kuning keabuan- miselia berwarna putih dan floccose
-
Mikroskopik-
kepala konidia berbentuk kolumnar sampai radiat- dinding spora halus sampai kasar
-
tidak mempunyai metula (Uniseriate)'- tidak mempunyai kleistotesia
Lestario (1991) telah membuktikan bahvia
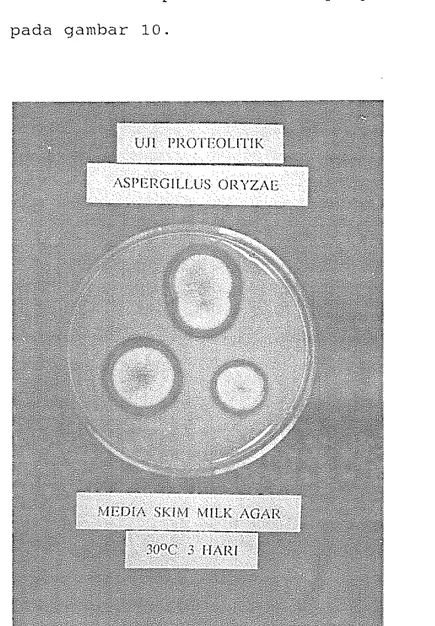
A s p e l - y i l u s o r y z a e yang diisolasi dari fase moromi pada fermentasi kecap Zebra niempunyai aktivitas proteolitik yang lebih besar dibanding strain CBS 570.65, dari Belanda. Aktifitas proteolitik kapany ini dapat dilihat pada gambar 10.
P r o t e a s e e k s t r a s e l u l e r A . o r y z a e y a n g d i e k s t r a k d a r i m e d i a d ~ ? d a l i d a n t e p i ~ n g I i e d e l i ~ i ditiiitt:n.iIc;in n ~ f l . i ~ l . i i i 3 t a h a p p e m u r n i a n , y a i t u p e n g e n d a p c l n cleiignn Amrnoriiuri~ S u l f a t . 7 0 % ( w / v ) , p e n g e n d a p a n d e n q a n A c e t o n d i n g i n 1.00% ( v j v )
,
d a n p e m i s a h a n d e n y a n S e p h a d e x G - 1 0 0 . P a d a a l t h i r s e t i a p t i l l l a p d i l a k u l t i ~ n p e n c j u k u r a t i a k t i v i . t . i ~ s p r o t e o 1 i t j . k d a n j u m l a h p r o t e i n . I i a s i . 1 perigulcurrln k e d u a p a r a m e t e r p e m u r n i a n i n i t e r d a p a t p a d a t a b e l 2 . T a b e l 2 j u g a m e n u n j u k k a n d a t a a k t i v i t a s s p e s i f i k , r e n d e m e n / h a s i l yancj d i p e r o l e l i , d i ~ n p e n i n g l c a t a n k e m u r n . i a n masing-macjitiij !xi-ii>p p e m i i r t i j . a n . P e n i n g k a t a r i k e m u r n . i a n p a d a s u a t u t a h a p d i t e n t u l c a n b e r d a s a r k a n p e r b a n d i n g a n a k t i v i t a s s p e s i f i k p r o t e a s e p a d a t a h a p t e r s e b u t denclan a l c t i f i t i r : ; ::pc?sifi.lc t?tizi.tii l t a s a r ( T P 1 ).
A k t i v i t a s s p e s i f i k i n c r u p a k i i n e i l < t i v i t : . i ~ s p r o t e o l . i t i k p e r tiig p r o t e i n . Sedainq l ~ a s i l y a n c j d i p e r n l e h p a d a t y i a p t a h a p d i d a s a r k i ~ n ]?aria p e r b a n i 1 i n y a r . t t o t a l u n i t a k t i v i t a ! ; pacia t a l - t a p t e r s e b u t - d e n q i l n enzi.nl k a s a r.
Tabel 2. Pemurnian protease =_pergillus oryzae
Tahap Vol Aktifitas Total [Protein] A. spesifik Hasil Pemur- (ml) (IU/ml) unit (m9/ml) (IU/mg prot) ( 2 ) nian Filtrat enzim kasar (TP1) 375 0,102 38,250 0,522 0,195 100,000 1,000 Pengendapan dengan ammonium sulfat, dialisis (TP2) 100 0,464 .1-6,400 0,918 0,505 121,307 2,590 Pengendapan dengan Aseton (TP3) 3 0 0,093 2,790 0,075 1,240 7,294 6,359 Penisahan dengan Sephadex G-100 ( T P h A ) 1 1 , 0 c ? 1,043 0,689 1,514 0,027 7,764
Pemurnian suatu protein selalu disertaj. denyan pemisahan protein-protein lain yang tidak dikehendaki. Sehingga, dengan makin banyaknya tahap pemurnian yang dilakukan, tingkat kemurnian protein yany dikehendaki makin tinggi, tetapi hasil yang diperoleh makin rendah. Berdasarlcan ha1 ini, pemilihan tahap pemurnian yany akan dipergunakan disesuaikan d e n y a n
tujuan pemurnian tersebut, apakah untuk memperoleh tingkat kemurnian yong tinggi denyan konsekwensi hasil yang lebih rendah, ataukah untuk memaksimumkan hasil. Dalam penelitian ini, kemurnian protease lebih diutamakan. Suhu yang rendah dan pengerjaan yang cepat diperlukan untuk menghindari penurunan aktivitas protease selama pemurnian.
1. TAHAP 1. Pengendapan dengan Ammonium Sulfat
Pengendapan protein pada larutan garam berkonsentrasi tinggi merupakan metode yang banyak dipergunakan daiam pemurnian enzim. KeLarutan suatu protein tergantung pada 1carakteristi.l; 1-irotei.n tersebut, yany diantaranya nteliputi banyalcnya qt~cjii:; hidrofobik, muatan total, ukuran, dan lain-lain. Selain itu kelarutan protein juga teryantuny pada kekuatan ionik dan pH larutan. Pcngaruli konsentrasi garan terhadap kelarutan protein adalah sebagai berikut : pada konsentrasi rendah, kelarutan protein meningkat (salting in) ; dengan
peningkatan konsentrasi garam, kelarutan protein menurun dan protein mulai mengendap. Masing-masing protein mempunyai karakteristik kelarutan yang spesifik pada tinp konsentrasi yaram.
Untuk menentukan jumlah ammonium sulfat yang mengendapkan protease secara maksinium, dilakulian penelitian penddhuluan. Tabel 3 menunjukkan data aktivitas spesifik enzim yanq diendapkan pada beberapa % kejenuhan ammonium sulfat. Dari data tersebut terlihat bahwa enzim yang dikehendaki (protease) mengendap secara merata, haik pada kejenuhan 0-40%, 40-70%, maupun pada supernatan hasil pengendapan dengan 70% kejenuhan ammonium sulfat. Hal ini berarti pengendapan bertahap dengan Ammonium Sulfat (Scopes, 1937) tidak dapat diterapkan pado protease A. oryzae. Pada konsentrasi garam yang rendah, sudah ada protease yang mengendap, dan pada konsentrasi tinggi tidali semua protease mengendap.
Berdasarkan ha1 tersebut, jumlah ammonium sulfat yang ditnmbahkan disesuaikan denyan hasil uji pengendapan maksimum untuk mencari konsentrasi ammonium sulfat yang dapat mengendapkan protease
A. oryzae secara maksimum, yang dilakukan oleh Lestario (1991). Diantara konsentrasi 50-80% (wjv), endapan protein terbesar disebabkan oleh
penambahan 70% ammonium sulfat. Maka konsentrasi inilah yang dipergunakan dalam pemurnian. Setelah diendapkan dengan 70% ammonium sulfat dan didialisis, kemurnian protease dalam filtrat meningkat 2,6 kali.
Tabel 3 . Pengendopan bertahap protease dengan Ammonium Sulf at
[Ammonium Aktivitas [Protein] Akt. spesifik Sulfat] (:[U/ml) (mg/ml) ( ~ u / m g prot.)
0
-
40% 0,376 0,811 0,4644 0
-
70% 11,195 0,533 0,366supernatan 0,453 0,460 1,002
Dialisis berguna untuk memisahkan komponen- komponen ber-BI4 rendah dari larutan protein. Kantong dialisis yang dipergunakan dapat menahan molekul yang mempunyai BM lebih besar dari 10.000. Jadi selama dialisis, molekul ammonium sulfat dan molekul-molekul kecil lainnya keluar dan protease yang umumnya meinpunyai BM lebih besar dari 20.000 (Feinstein dan Gertler, 1973; Kasai et al., 1984, Lestario, 1991) tertahan di dalam kantong. Setelah dialisis aktivitas protease dapat mengalami penurunan, apabila kofaktornya, yang umumnya adalah logam ber-BM rendah, terpisah dari enzim dnn terlarut keluar dari kantong dialisis.