UJI AKTIVITAS PENGHAMBATAN ENZIM ALFA-AMILASE OLEH DEKOKTA BATANG BROTOWALI
(Tinospora crispa L.) Hook. F. & Thomson SECARA IN VITRO
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh: Fila Delfia NIM : 168114158
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
UJI AKTIVITAS PENGHAMBATAN ENZIM ALFA-AMILASE OLEH DEKOKTA BATANG BROTOWALI
(Tinospora crispa L.) Hook. F. & Thomson SECARA IN VITRO
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh: Fila Delfia NIM : 168114158
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
“Serahkanlah segala kekuatiranmu kepada-Nya, sebab Ia yang memelihara kamu”
(1 Petrus 5:7)
Skripsi ini saya persembahkan untuk:
Tuhan Yesus Kristus sumber pengharapan, kekuatan, sukacita dan kasih, Papa, Mama, Kak Imanuel dan seluruh keluarga besar saya,
Semua sahabat yang selalu mendukung dan mendoakan saya, Serta almamater saya, Universitas Sanata Dharma.
vii PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus atas segala kebaikan dan kasih setia-Nya yang selalu penulis rasakan hari demi hari, sehingga penulis mampu menyelesaikan skripsi yang berjudul “ Uji Aktivitas Penghambatan Enzim Alfa-Amilase oleh Dekokta Batang Brotowali (Tinospora crispa L.) Hook.F. & Thomson secara In Vitro” dengan baik. Penulisan skripsi ini bertujuan untuk memenuhi salah satu syarat dalam memperoleh gelar Sarjana Farmasi (S.Farm) Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Penyelesaian skripsi ini tentunya tidak lepas dari bantuan berbagai pihak yang sudah mendukung baik secara langsung maupun tidak langsung. Oleh karena itu, dengan tulus hati penulis mengucapkan terima kasih kepada:
1. Ibu Dr. Yustina Sri Hartini, Apt., selaku Dekan Fakultas Farmasi Universitas Sanata Dharma dan dosen pembimbing skripsi yang selalu memberikan arahan serta nasihat dalam penelitian maupun penyusunan naskah skripsi ini.
2. Ibu Dr. Christine Patramurti, Apt., selaku Ketua Program Studi Fakultas Farmasi Universitas Sanata Dharma.
3. Ibu Damiana Sapta Candrasari, S.Si., M.Sc., selaku Kepala laboratorium Fakultas Farmasi Universitas Sanata Dharma.
4. Bapak Maywan Haryono, P.hD., Apt., selaku dosen penguji yang selalu memberikan masukan dan kritik untuk membangun penelitian skripsi ini. 5. Ibu Dr. Erna Tri Wulandari, Apt., selaku dosen penguji skripsi yang selalu
memberikan masukan dan kritik untuk membangun penelitian skripsi ini. 6. Ibu Dina Christin Ayuning Putri M.Sc., Apt., selaku Dosen Pembimbing
Akademik, yang selalu memberikan saran dan bantuan selama perkuliahan di Fakultas Farmasi Universitas Sanata Dharma.
viii
7. Pak Dwi Priyana dan Pak Sarwanto selaku Sekretariat S1 Fakultas Farmasi Universitas Sanata Dharma yang selalu membantu dalam pemberian informasi dan kemudahan selama perkuliahan dari awal hingga akhir. 8. Pak Wagiran, Pak Kayat, Mas Bimo, dan Pak Ketul selaku laboran dan
karyawan yang selalu membantu dan memberikan kemudahan selama pelaksanaan penelitian skripsi.
9. Segenap Dosen dan Karyawan Fakultas Farmasi Universitas Sanata Dharma yang selalu membantu dan memberikan dukungan selama perkuliahan.
10. Keluarga tercinta, Bapak, Ibu dan Kakak yang selalu mendoakan, menyertai, dan mendukung selama proses perjalanan hidup hingga saat ini. 11. Fetiana Chrismaureen, selaku “team brotowali” serta kawan perjuangan skripsi yang dari awal penyusunan proposal, penelitian hingga penyusunan naskah skripsi tanpa lelah memberikan semangat dan saran agar penyusunan dan penelitian berjalan dengan baik.
12. Teman-teman seperjuangan skripsi lainnya yang tiada henti-hentinya membantu dan memberikan saran dalam proses penelitian, Maria Cyrilla Iglesia Adi N, Maria Josephine Vivian Chang, Yohana Trisnawati Ardiyanti, Ayu P D, Maria Carolina, Agustinus Nara, Oskar Howay dan Dewi Samura.
13. Sahabat dalam berbagi segala keluh kesah selama perkuliahan, Maya Samantha Okada, Katarina Noralita Bahar Gumilar, Yohana Trisnawati Ardiyanti, Elin Nidia Safitri, dan Lenny Setiawan yang selalu memberikan semangat dan doa selama penyusunan naskah skripsi.
14. Keluarga “Revival Generation” yang selalu mendoakan dan mendukung dari kejauhan.
15. Sahabat “Lion King” yang selalu menjadi support system dan selalu memberikan dukungan selama proses penyusunan skripsi ini.
16. Sahabat sekaligus saudara #PBY angkatan 1, yang tanpa lelah mengirimkan doa dan memberikan dukungan moral serta semangat selama pengerjaan naskah skripsi ini.
ix
17. Teman-teman FSMD 2016 yang dengan sangat baik hati memberikan doa, semangat, perhatian, dan kebersamaan selama berkuliah di Fakultas Farmasi, sehingga banyak pengalaman berharga yang penulis rasakan. 18. Teman-teman Farmasi angkatan 2016 yang memberikan semangat untuk
terus berjuang selama perkuliahan.
19. Seluruh pihak yang terlibat dalam penyusunan skripsi ini yang tidak dapat penulis sebutkan satu-persatu.
Penulis menyadari bahwa masih banyak kekurangan dalam penyusunan naskah ini, mengingat keterbatasan pengetahuan dan kemampuan penulis dalam penyusunan naskah. Maka dari itu, penulis ingin meminta maaf sebesar-besarnya apabila terdapat kesalahan baik dalam penulisan kata maupun pemilihan kata, serta banyaknya kekurangan dalam naskah skripsi ini. Penulis juga mengharapkan adanya kritik dan saran agar naskah ini dapat menjadi lebih baik. Akhir kata, semoga skripsi ini dapat bermanfaat bagi pihak yang membutuhkan, terutama dapat bermanfaat dalam perkembangan ilmu pengetahuan khususnya dibidang kefarmasian.
Yogyakarta, 17 Juli 2020
x DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ...iii
HALAMAN PERSEMBAHAN ... iv
HALAMAN KEASLIAN KARYA ... v
LEMBAR PERSETUJUAN PUBLIKASI ... vi
PRAKATA ... vii
DAFTAR ISI ... x
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
ABSTRAK ... xiv
ABSTRACT ... xv
PENDAHULUAN ... 1
METODE PENELITIAN ... 3
HASIL DAN PEMBAHASAN ... 12
KESIMPULAN DAN SARAN ... 29
DAFTAR PUSTAKA ... 30
LAMPIRAN ... 34
xi
DAFTAR TABEL
Tabel I. Perhitungan Nilai RF Serbuk... 18
Tabel II. Perhitungan Nilai RF Ekstrak ... 18
Tabel III. Nilai Persen Inhibisi Acarbose ... 22
xii
DAFTAR GAMBAR
Gambar 1. Hasil Elusi KLT Serbuk Batang Brotowali... 17
Gambar 2. Hasil Elusi KLT Ekstrak Air Batang Brotowali ... 18
Gambar 3. Grafik Hubungan Konsentrasi Acarbose dengan Persen Penghambatan ... 23
Gambar 4. Struktur Acarbose dan Amilum ... 24
Gambar 5. Grafik Hubungan Konsentrasi Ekstrak Air Batang Brotowali dengan Persen Penghambatan ... 26
Gambar 6. Struktur Borapetosida C ... 28
Gambar 7. Serbuk dan Ekstrak Air Batang Brotowali ... 36
Gambar 8. Ekstrak Air Serbuk Batang Brotowali ... 36
xiii
DAFTAR LAMPIRAN
Lampiran 1. Hasil Determinasi Serbuk Batang Brotowali... 34
Lampiran 2. Certificate of Analysis Alfa-Amilase ... 35
Lampiran 3. Gambar Serbuk dan Ekstrak Air Batang Brotowali ... 36
Lampiran 4. Perhitungan Kadar Air Serbuk Batang Brotowali ... 37
Lampiran 5. Data Penimbangan Serbuk Batang Brotowali dan % Rendemen ... 38
Lampiran 6. Data Penimbangan Bahan... 39
Lampiran 7. Pembuatan Larutan Seri Ekstrak Air Batang Brotowali dan Acarbose ... 39
Lampiran 8. Tabel Hasil Optimasi Panjang Gelombang Maksimal dan OT ... 40
Lampiran 9. Pengukuran Absorbansi Ekstrak Air Batang Brotowali dan Acarbose ... 41
xiv ABSTRAK
Diabetes Mellitus (DM) adalah sekelompok gangguan metabolisme yang ditandai dengan hiperglikemia dan kelainan metabolisme karbohidrat, lemak, dan protein. Salah satu strategi pengobatan yang dapat dilakukan adalah mengurangi absorbsi glukosa di gastrointestinal dengan menghambat metabolisme karbohidrat oleh enzim alfa-amilase. Brotowali merupakan salah satu tanaman yang diduga memiliki aktivitas penghambatan enzim alfa-amilase. Senyawa yang dipercaya dapat memberikan efek penghambatan enzim alfa-amilase adalah borapetosida C. Ekstraksi senyawa menggunakan pelarut air dengan metode dekokta yang diuapkan sampai menjadi ekstrak kental. Uji aktivitas penghambatan enzim alfa-amilase dilakukan dengan metode spektrofotometri ultraviolet-visibel pada panjang gelombang 536 nm. Berdasarkan hasil pengujian yang dilakukan, didapatkan hasil, bahwa terdapat aktivitas penghambatan enzim alfa-amilase oleh ekstrak air batang brotowali, dilihat dari nilai % penghambatan dan nilai IC50.
Hasil nilai rata-rata persen inhibisi ekstrak pada konsentrasi 4 mg/mL, 8 mg/mL, 15 mg/mL, dan 20 mg/mL masing-masing sebesar 32,46%, 50,53%, 59,91% dan 68,77%. IC50 untuk acarbose sebesar 5,662 ± 0,390 mg/mL, sementara IC50 untuk
ekstrak sebesar 10,348 ± 0,313 mg/mL. Data diolah secara statistik dan didapatkan perbedaan persen inhibisi yang signifikan P < 0,05 pada setiap perbedaan konsentrasi ekstrak. Perbedaan signifikan P < 0,05 dengan uji T juga ditemukan pada perbandingan IC50 acarbose dengan ekstrak.
Kata Kunci: Ekstrak air, batang brotowali, metode dekokta, enzim alfa-amilase, spektrofotometri ultraviolet –visibel.
xv ABSTRACT
Diabetes mellitus (DM) is a complication characterized by hyperglycemia and metabolism abnormality of carbohydrates, fats and proteins. One of the strategies that can be done is to reduce the absorption of sugar in the gastrointestinal tract by inhibiting carbohydrate metabolism using the enzyme amylase. Brotowali is one of the herbals that is predicted to have an alpha-amylase enzyme inhibitory activity. The compound is believed to provide an inhibitory effect on alpha-amylase enzymes are borapetosides C. The brotowali stem was extracted using decoction method with the water solvent followed by evaporating to produce a sticky extract. The alpha-amylase enzyme inhibitor activity determination using ultraviolet-visible spectrophotometry method at a wavelength of 536 nm. The results showed that there was an inhibitory activity of the alpha-amylase enzyme by water extract of brotowali stem, seen from the % inhibitory value and IC50 value. The average value of percent inhibition of water
extract of brotowali stem at concencration of 4 mg/mL, 8 mg/mL, 15 mg/mL and 20 mg/mL were 32,46%, 50,53%, 59,51% and 68,77%, respectively. IC50 for the
acarbose was 5,662 ± 0,390, while IC50 for the extract was 10,348 ± 0,313
mg/mL. The data has been processed statistically and obtained a significant percent inhibition difference P < 0.05% at each concenctration of the extract. A significant difference P < 0.05 with the T-test method was also found in the comparison of IC50 acarbose with the extract.
Keywords: water extract, brotowali stem, decoction method, alpha-amylase enzyme, ultraviolet-visible spectrophotometry.
1 PENDAHULUAN
Diabetes mellitus (DM) adalah sekelompok gangguan metabolisme yang ditandai dengan hiperglikemia dan kelainan metabolisme karbohidrat, lemak, dan protein (Dipiro et al., 2015). Menurut hasil Riskesdas (2018), prevalensi diabetes melitus berdasarkan pemeriksaan darah pada penduduk usia ≥ 15 tahun pada tahun 2013 sebesar 6,9% dan meningkat menjadi 10,9% pada tahun 2018. Menurut data IDF yang dikutip dalam Depkes RI, terdapat 382 juta orang di dunia sebagai penderita DM pada tahun 2013 dan pada tahun 2035 jumlah tersebut diperkirakan akan mengalami peningkatan menjadi 592 juta orang (Depkes RI, 2014).
Tiga komponen utama untuk terapi diabetes mellitus adalah obat (insulin dan agent antidiabetes oral) dan olahraga (Alldredge et al., 2013). Selain tiga terapi tersebut, upaya pencegahan lain perlu dilakukan untuk menekan jumlah penderita DM, yaitu dengan memanfaatkan inhibitor alfa-amilase (Pramitasari dkk., 2017).
Pencernaan karbohidrat dan penyerapan glukosa adalah target yang jelas untuk kontrol glikemia yang lebih baik setelah makan tinggi karbohidrat. Alfa-amilase dan alfa–glukosidase adalah enzim kunci yang bertanggung jawab untuk pencernaan karbohidat menjadi glukosa (Hanhineva et al., 2010). Alfa–amilase disekresi dari air liur dan pankreas serta mengkatalisasi pembelahan alfa–1,4 ikatan glikosidik untuk mengkonversi polisakarida menjadi oligosakarida yang lebih kecil seperti maltose, maltotriosa, dan sejumlah alfa–1,4 dan alfa–1,6-oligoglan. Fragmen–fragment ini selanjutnya akan mengalami degradasi lebih lanjut oleh alfa–glukosidase yang terletak di perbatasan sekat usus kecil (Trinh et al., 2016). Degradasi oleh alfa-glukosidase ini akan berubah menjadi glukosa yang akan diserap memasuki aliran darah, degradasi pati makanan ini berlangsung dengan cepat dan menyebabkan peningkatan hiperglikemia post prandial (Sudha et al., 2011).
Masyarakat Indonesia sudah lama menggunakan ramuan obat tradisional Indonesia sebagai upaya pemeliharaan kesehatan, pencegahan penyakit, dan
2
perawatan kesehatan. Ramuan obat tradisional Indonesia tersebut dapat berasal dari tumbuhan, hewan, dan mineral, namun umumnya berasal dari tumbuhan dengan bentuk sediaan yang paling banyak disukai adalah cairan, diikuti berturut-turut seduhan/serbuk, rebusan/rajangan, dan bentuk kapsul/pil/tablet (Menteri Kesehatan RI, 2017).
Brotowali, bratawali, akar aliali atau yang dikenal dengan nama lain Tinospora crispa (L.) Hook.F. & Thomson merupakan tanaman perdu, merambat dan telah banyak digunakan untuk pengobatan tradisional di Amerika, India, Vietnam, Thailand, Malaysia dan Indonesia (Rosidah dkk., 2015). Ekstrak batang brotowali yang diisolasi mengandung 11 komponen aktif yaitu Borapetosida C, 4-hydroxybenzaldehyde, β-sitosterol, Liriodenine, Lysicamine, Dihydrodiscretamine, Columbamine, Magnoflorine, formylannonaine, N-formylnornuciferine, dan N-trans feruloyltyramine. Borapetosida C adalah senyawa aktif utama dalam ekstrak ini yang dapat menghambat alfa-amilase dan alfa-glukosidase (Hamid et al., 2015).
Penelitian tentang brotowali telah banyak dilakukan, baik dalam negeri maupun luar negeri. Senyawa – senyawa yang ditemukan pada batang , daun, akar dan bunga tumbuhan brotowali dapat menjadi potensi besar ditemukannya senyawa metabolit sekunder lain yang menarik yang bisa dijadikan obat ataupun manfaat lainnya. Terutama pada bagian batang yang diinformasikan memiliki banyak kandungan senyawa metabolit sekunder yang menarik dan belum banyak diteliti. Selain itu, batang brotowali juga mudah diperoleh dibandingkan daun, akar dan bunga brotowali (Musdalifa et al., 2014).
Awal mulanya, masyarakat mengenal obat herbal dengan istilah jamu godog, untuk rebusan simplisia segar dan kering. Perebusan berguna untuk memindahkan zat-zat berkhasiat ke dalam air. Selain itu dibuat dalam sediaan dekokta karena dekokta diperuntukkan untuk simplisia nabati yang keras seperti kayu, batang, dan biji (Sudrajat, 2016).
3
Berdasarkan penelitian yang telah dilakukan oleh Kuswati et al (2017), dapat diketahui bahwa ekstrak etanol brotowali memiliki aktivitas sebagai penurun kadar glukosa dalam darah berdasarkan kadar darah puasa pada tikus yang terinduksi tes toleransi secara oral pada dosis 40,25; 80,5 dan 161 mg/dL dengan dosis terbaik yaitu dosis 161 mg/kgBB dan berpotensi sebagai antidiabetes dibandingkan dengan metformin. Selain itu berdasarkan penelitian Hamid et al, (2015), menyatakan bahwa batang brotowali memiliki aktivitas penghambatan alfa-amilase yang dilakukan ekstraksi dengan etanol secara perkolasi dan dianalisis dengan ultra-high performance liquid chromatography-quadrupole time-of-flight/mass spectrometry (UPLC-QToF/MS). Menurut penelitian Chang., (2020) daun salam yang dibuat dalam sediaan ekstrak air (dekokta) dapat melakukan penghambatan enzim alfa-amilase secara in vitro dengan nilai persen penghambatan yang dihasilkan untuk konsentrasi 2,5 mg/mL sebesar 36,69%, konsentrasi 5 mg/mL sebesar 39,12%, konsentrasi 7,5 mg/mL sebesar 40,66%, dan konsentrasi 10 mg/mL sebesar 46,00%.
Berdasarkan beberapa uraian di atas, peneliti ingin melakukan penelitian lebih lanjut terhadap batang brotowali (Tinospora crispa L.) Hook.F. & Thomson sebagai aktivitas penghambatan enzim alfa-amilase secara in vitro yang akan dibuat dalam bentuk sediaan ekstrak air yaitu dekokta.
METODE PENELITIAN Alat Penelitian
Alat yang digunakan pada penelitian ini adalah timbangan analitik (Mettler Toledo®), spektrofotometer UV-Vis (SHIMADZU) dan kuvet, panci dekokta, lampu UV (CAGMA), seperangkat alat penyulingan untuk penetapan kadar air (MTOPS®), penangas air, hot plate,vortex, mortar dan stamper, mikropipet (SOCOREX), blue tips, yellow dan white tips, chamber, plat silica gel GF254,
kertas saring, cawan porselen, corong buchner, glass firm, serta alat-alat gelas seperti tabung reaksi, corong, labu ukur, pipet tetes, batang pengaduk, gelas ukur, sendok, pipet ukur, labu erlenmeyer dan kaca arloji.
4 Bahan Penelitian
Bahan penelitian yang digunakan dalam penelitian ini adalah serbuk batang brotowali, enzim alfa-amilase (Sigma Aldrich), larutan pembanding kuersetin, pati kentang, tablet acarbose @50 mg, iodin-iodida, toluen, DMSO (Dimethyl Sulfoxide), aquabidest, natrium fosfat, natrium klorida, HCl, kloroform, dan methanol.
Tata Cara Penelitian
Pengumpulan serbuk batang brotowali
Serbuk batang brotowali yang digunakan dalam penelitian ini diperoleh dari PT. HRL Internasional, Jawa Timur. Serbuk yang digunakan homogen, berwarna coklat, bau yang khas, dan memiliki rasa pahit.
Identifikasi serbuk batang brotowali
Identifikasi serbuk batang brotowali dilakukan secara mikroskopis di Laboratorium Departemen Biologi Farmasi, Fakultas Farmasi, Universitas Gadjah Mada Yogyakarta.
Penetapan kadar air pada serbuk kering batang brotowali
Menurut Farmakope Herbal Indonesia tahun 2013, penetapan kadar air dilakukan dengan metode destilasi toluen. Sebanyak 10 gram simplisia kering batang brotowali dan lebih kurang 200 mL toluen jenuh air dimasukkan kedalam labu, lalu pasang rangkaian alat. Masukkan toluen jenuh air kedalam tabung penerima melalui pendingin sampai leher alat penampung. Panaskan labu hati- hati selama 15 menit. Setelah toluen mulai mendidih, atur penyulingan dengan kecepatan lebih kurang 2 tetes tiap detik, hingga sebagian besar air tersuling, kemudian naikkan kecepatan penyulingan hingga 4 tetes tiap detik. Setelah semua air tersuling, bagian dalam pendingin dicuci dengan toluen jenuh air, sambil dibersihkan dengan sikat tabung yang disambungkan pada sebuah kawat tembaga dan telah dibasahi dengan toluen jenuh air. Lanjutkan penyulingan selama 5 menit. Dinginkan tabung penerima hingga suhu ruang. Jika ada tetes air yang melekat, gosok tabung pendingin dan tabung penerima dengan karet yang diikatkan pada sebuah kawat tembaga dan dibasahi dengan toluen jenuh air hingga
5
tetesan air turun. Baca volume air setelah air dan toluen memisah sempurna. Kadar air dihitung dalam % v/b.
(Departemen Kesehatan Republik Indonesia, 2013) Pembuatan ekstrak air batang brotowali
Pembuatan ekstrak air batang brotowali dilakukan dengan cara dekokta. Serbuk batang brotowali ditimbang sebanyak 10 gram, kemudian dimasukkan kedalam panci, lalu ditambahkan air sebanyak 100 mL, kemudian dipanaskan di atas penangas air selama 30 menit, terhitung mulai suhu mencapai 90oC sambil sekali-kali diaduk, lalu disaring panas dengan kain flannel (Merwanta et al., 2019). Filtrat hasil dekokta kemudian diuapkan menggunakan cawan porselen di atas penangas air hingga terbentuk ekstrak kental batang brotowali, kemudian dicari bobot tetapnya. Selanjutnya, rendemen dihitung dengan menggunakan rumus:
(Departemen Kesehatan Republik Indonesia, 2011) Uji kualitatif batang brotowali
Uji kandungan fitokimia batang brotowali mengikuti Farmakope Herbal Indonesia menggunakan metode Kromatografi Lapis Tipis (KLT).
Dilakukan penjenuhan bejana sebagai tahap awal pengujian KLT. Tempatkan kertas saring dalam bejana kromatografi. Tinggi kertas saring 18 cm dan lebarnya sama dengan lebar bejana. Masukkan larutan fase gerak kloroform P: methanol P (9:1) sebanyak 20 mL. Tutup kedap dan biarkan kertas saring basah seluruhnya. Kertas saring harus selalu tercelup ke dalam larutan fase gerak pada dasar bejana.
Larutan uji KLT serbuk dibuat dengan cara timbang seksama lebih kurang 1 gram serbuk simplisia batang brotowali, rendam sambil diaduk di atas penangas
6
air dengan 10 mL metanol P selama 10 menit. Masukkan filtrat dalam labu ukur 10 mL tambahkan metanol sampai batas tanda. Larutan pembanding kuersetin 1% dibuat dengan cara timbang seksama lebih kurang 0,05 mg senyawa pembanding kuersetin kemudian dilarutkan dalam 5 mL metanol P. Larutan uji KLT ekstrak air batang brotowali dibuat dengan konsentrasi 4 mg/mL dengan cara menimbang 20 mg ekstrak kemudian dilarutkan dalam metanol P dan dimasukkan dalam labu ukur 5 mL.
Fase diam yang digunakan adalah plat KLT silica gel GF254 dengan ukuran
panjang 15 cm dan lebar 5 cm, kemudian plat dipanaskan terlebih dahulu dalam oven pada suhu 100oC selama 5-10 menit. Setelah dipanaskan, plat KLT diberi tanda untuk menentukan tepat penotolan dan jarak rambat saat elusi. Jarak penotolan tepi bawah lempeng 2 cm, jarak antara tepi kanan dan kiri lempeng 1,5 dan batas jarak rambat 10 cm. Dilakukan penotolan larutan uji sebanyak 10 µL dan larutan pembanding kuersetin sebanyak 5 µL, kemudian dibiarkan mengering. Plat KLT dimasukkan ke dalam bejana tertutup yang telah dijenuhkan dan fase gerak dibiarkan merambat sampai batas jarak elusi. Plat diangkat dan dikeringkan lalu bercak diamati dengan sinar tampak ultraviolet pada panjang gelombang 254 nm dan 366 nm. Ukur dan catat jarak tiap bercak dari titik penotolan. Tentukan harga Rf tiap totolan (Departemen Kesehatan Republik Indonesia, 2013).
Uji aktivitas penghambatan enzim alfa-amilase
Uji aktivitas penghambatan enzim alfa-amilase merujuk pada penelitian Bhutkar et al (2018), Ibrahim et al (2017), dan Tran et al (2013) dengan beberapa modifikasi.
Pembuatan Larutan Uji
Larutan pati 0,5% dibuat dengan menimbang 0,25 gram pati kentang kemudian ditambahkan aquabidest sebanyak 50 mL dan dipanaskan selama ±15 menit (sampai mendidih) diatas hot plate. Larutan DMSO 1% dibuat dengan melarutkan 1 mL DMSO dalam 100 mL aquabidest. Larutan dapar fosfat pH 6,9 dibuat dengan cara menimbang dan mencampurkan 3,28 gram Na Fosfat dan 391,95 mg NaCl dan dilarutkan dalam aquabidest hingga 100 mL. Larutan enzim
7
dibuat mencampurkan 0,15 mL enzim alfa-amilase dalam 100 mL dapar fosfat. Larutan HCl yang digunakan memiliki konsentrasi 1 M dan larutan iodin-iodida.
Larutan seri konsentrasi ekstrak dibuat dalam konsentrasi 4, 8, 15, dan 20 mg/mL. Sebanyak 200 mg ekstrak kental batang brotowali dilarutkan kedalam labu ukur 10 mL dengan menggunakan DMSO 1%, dihasilkan konsentrasi ekstrak 20 mg/mL (labu 1), diambil sebanyak 7,5 mL dari labu pertama dan dimasukan labu ukur kedua kemudian ditambah DMSO 1% hingga tanda batas dan dihasilkan konsentrasi ekstrak 15 mg/mL (labu 2), kemudian diambil 5,33 mL larutan dari labu kedua dan dimasukkan ke dalam labu ukur ketiga kemudian ditambah DMSO 1% hingga tanda batas dan dihasilkan konsentrasi ekstrak 8 mg/mL (labu 3), kemudian konsentrasi ekstrak 4 mg/mL dibuat dengan mengambil sebanyak 5 mL larutan dari labu ketiga dan dimasukkan ke dalam labu ukur keempat kemudian ditambah DMSO 1% hingga tanda batas.
Larutan seri konsentrasi acarbose dibuat dalam konsentrasi 4, 8, 15, 20 mg/mL. Sebanyak 4 tablet acarbose digerus kemudian dilarutkan ke dalam labu ukur 10 mL dengan menggunakan aquabidest, dihasilkan konsentrasi acarbose 20 mg/mL (labu 1), diambil sebanyak 7,5 mL dari labu pertama dan dimasukan labu ukur kedua kemudian ditambah aquabidest hingga tanda batas dan dihasilkan konsentrasi acarbose 15 mg/mL (labu 2), kemudian diambil 5,33 mL larutan dari labu kedua dan dimasukkan ke dalam labu ukur ketiga kemudian ditambah aquabidest hingga tanda batas dan dihasilkan konsentrasi acarbose 8 mg/mL (labu 3), kemudian konsentrasi acarbose 4 mg/mL dibuat dengan mengambil sebanyak 5 mL larutan dari labu ketiga dan dimasukkan ke dalam labu ukur keempat kemudian ditambah aquabidest hingga tanda batas.
Penentuan Panjang Gelombang Maksimum
Penentuan panjang gelombang maksimum dilakukan sebelum uji aktivitas penghambatan enzim alfa-amilase. Larutan uji dibuat dengan mencampurkan sebanyak 1 mL pati kentang 0,5% ditambah dengan 1 mL sampel ekstrak konsentrasi terkecil yang digunakan dalam uji penghambatan aktivitas enzim
alfa-8
amilase yaitu 4 mg/mL. Setelah itu, ditambah 1 mL DMSO 1%, lalu ditambah 1 mL larutan enzim alfa-amilase, kemudian ditambah 1 mL dapar fosfat pH 6,9. Setelah itu, larutan dihomogenkan dengan menggunakan vortex kemudian diinkubasi selama 15 menit. Reaksi kemudian dihentikan dengan penambahan 1 mL HCl 1 M dan ditambahkan indikator warna iodin-iodida sebanyak 0,01 mL, kemudian dihomogenkan lagi menggunakan vortex. larutan uji kemudian dibaca serapannya di spektrofotometer pada panjang gelombang 400-800 nm. Pengujian dilakukan sebanyak 3 kali.
Penentuan Optimization Time
Penentuan optimization time dilakukan untuk menentukan waktu optimum yang dibutuhkan oleh enzim untuk bereaksi dengan menggunakan panjang gelombang maksimal yang sudah didapatkan sebelumnya. Larutan uji dibuat dengan mencampurkan sebanyak 1 mL pati kentang 0,5% ditambah dengan 1 mL sampel ekstrak konsentrasi terkecil yang digunakan dalam uji aktivitas pengambatan alfa-amilase yaitu 4 mg/mL. setelah itu ditambah 1 mL DMSO 1%, lalu ditambah 1 mL larutan enzim alfa-amilase, kemudian ditambah 1 mL dapar fosfat pH 6,9. Setelah itu, larutan dihomogenkan dengan menggunakan vortex lalu diinkubasi selama 5, 10, 20, 30 menit untuk menentukan waktu optimum enzim bereaksi. Reaksi kemudian dihentikan dengan penambahan 1 mL HCl 1 M dan ditambahkan indikator warna iodin-iodida sebanyak 0,01 mL, kemudian dihomogenkan lagi menggunkan vortex. Larutan uji kemudian dibaca serapannya menggunkan spektrofotometer UV-Vis pada panjang gelombang 536 nm.
Pengujian Efek Penghambatan Larutan Blanko dan Kontrol Blanko Acarbose Larutan blanko acarbose dibuat dengan mencampurkan 1 mL pati kentang 0,5% ke dalam tabung reaksi, lalu ditambahkan 1 mL aquabidest, kemudian ditambah 1 mL enzim alfa-amilase dan ditambah dengan 2 mL dapar fosfat pH 6,9. Setelah itu larutan dihomogenkan dengan menggunakan vortex lalu diinkubasi selama 5 menit. Reaksi dihentikan dengan penambahan 1 mL HCl 1 M dan ditambahkan indikator warna iodin-iodida sebanyak 0,01 mL, kemudian
9
larutan dihomogenkan lagi dengan menggunakan vortex. Larutan uji kemudian dibaca serapannya menggunakan spektrofotometer UV-Vis pada panjang gelombang 536 nm. Larutan blanko acarbose dibuat replikasi sebanyak 3 kali.
Larutan kontrol blanko acarbose dibuat dengan mencampurkan 1 mL pati kentang 0,5% ke dalam tabung reaksi, lalu ditambahkan 1 mL aquabidest, kemudian ditambah dengan 3 mL dapar fosfat pH 6,9. Setelah itu larutan dihomogenkan dengan menggunakan vortex lalu diinkubasi selama 5 menit. Reaksi dihentikan dengan penambahan 1 mL HCl 1 M dan ditambahkan indikator warna iodin-iodida sebanyak 0,01 mL, kemudian larutan dihomogenkan lagi dengan menggunakan vortex. Larutan uji kemudian dibaca serapannya menggunakan spektrofotometer UV-Vis pada panjang gelombang 536 nm. Larutan kontrol blanko acarbose dibuat replikasi sebanyak 3 kali.
Pengujian Efek Penghambatan Larutan Acarbose dan Kontrol Acarbose
Larutan acarbose dibuat dengan mencampurkan 1 mL pati kentang 0,5% ke dalam tabung reaksi, kemudian ditambah 1 mL masing-masing larutan seri acarbose dengan konsentrasi 4, 8, 15, dan 20 mg/mL. Setelah itu, ditambah 1 mL aquabidest, lalu ditambah 1 mL enzim alfa-amilase, kemudian ditambah 2 mL dapat fosfat. Larutan kemudian dihomogenkan dengan vortex dan diinkubasi selama 5 menit. Reaksi dihentikan dengan penambahan 1 mL HCl 1 M dan ditambahkan indikator warna iodin-iodida sebanyak 0,01 mL, kemudian larutan dihomogenkan lagi dengan menggunakan vortex. Larutan uji kemudian dibaca serapannya menggunakan spektrofotometer UV-Vis pada panjang gelombang 536 nm. Larutan acarbose dibuat replikasi sebanyak 3 kali.
Larutan kontrol acarbose dibuat dengan mencampurkan 1 mL pati kentang 0,5% ke dalam tabung reaksi, kemudian ditambah 1 mL masing-masing larutan seri acarbose dengan konsentrasi 4, 8, 15, dan 20 mg/mL. Setelah itu, ditambah 1 mL aquabidest, lalu ditambah 3 mL dapar fosfat. Larutan kemudian dihomogenkan dengan vortex dan diinkubasi selama 5 menit. Reaksi dihentikan dengan penambahan 1 mL HCl 1 M dan ditambahkan indikator warna
iodin-10
iodida sebanyak 0,01 mL, kemudian larutan dihomogenkan lagi dengan menggunakan vortex. Larutan uji kemudian dibaca serapannya menggunakan spektrofotometer UV-Vis pada panjang gelombang 536 nm. Larutan kontrol acarbose dibuat replikasi sebanyak 3 kali.
Pengujian Efek Penghambatan Larutan Blanko dan Kontrol Blanko Ekstrak
Larutan blanko ekstrak dibuat dengan mencampurkan 1 mL pati kentang 0,5% ke dalam tabung reaksi, lalu ditambahkan 1 mL DMSO 1%, kemudian ditambah 1 mL enzim alfa-amilase dan ditambah dengan 2 mL dapar fosfat pH 6,9. Setelah itu larutan dihomogenkan dengan menggunakan vortex lalu diinkubasi selama 5 menit. Reaksi dihentikan dengan penambahan 1 mL HCl 1 M dan ditambahkan indikator warna iodin-iodida sebanyak 0,01 mL, kemudian larutan dihomogenkan lagi dengan menggunakan vortex. Larutan uji kemudian dibaca serapannya menggunakan spektrofotometer UV-Vis pada panjang gelombang 536 nm. Larutan blanko ekstrak dibuat replikasi sebanyak 3 kali.
Larutan kontrol blanko ekstrak dibuat dengan mencampurkan 1 mL pati kentang 0,5% ke dalam tabung reaksi, lalu ditambahkan 1 mL DMSO 1%, kemudian ditambah dengan 3 mL dapar fosfat pH 6,9. Setelah itu larutan dihomogenkan dengan menggunakan vortex lalu diinkubasi selama 5 menit. Reaksi dihentikan dengan penambahan 1 mL HCl 1 M dan ditambahkan indikator warna iodin-iodida sebanyak 0,01 mL, kemudian larutan dihomogenkan lagi dengan menggunakan vortex. Larutan uji kemudian dibaca serapannya menggunakan spektrofotometer UV-Vis pada panjang gelombang 536 nm. Larutan kontrol blanko ekstrak dibuat replikasi sebanyak 3 kali.
Pengujian Efek Penghambatan Larutan Ekstrak dan Kontrol Ekstrak
Larutan ekstrak dibuat dengan mencampurkan 1 mL pati kentang 0,5% ke dalam tabung reaksi, kemudian ditambah 1 mL masing-masing larutan seri ekstrak dengan konsentrasi 4, 8, 15, dan 20 mg/mL. Setelah itu, ditambah 1 mL DMSO 1%, lalu ditambah 1 mL enzim alfa-amilase, kemudian ditambah 2 mL dapar fosfat. Larutan kemudian dihomogenkan dengan vortex dan diinkubasi selama 5
11
menit. Reaksi dihentikan dengan penambahan 1 mL HCl 1 M dan ditambahkan indikator warna iodin-iodida sebanyak 0,01 mL, kemudian larutan dihomogenkan lagi dengan menggunakan vortex. Larutan uji kemudian dibaca serapannya menggunakan spektrofotometer UV-Vis pada panjang gelombang 536 nm. Larutan ekstrak dibuat replikasi sebanyak 3 kali.
Larutan kontrol ekstrak dibuat dengan mencampurkan 1 mL pati kentang 0,5% ke dalam tabung reaksi, kemudian ditambah 1 mL masing-masing larutan seri ekstrak dengan konsentrasi 4, 8, 15, dan 20 mg/mL. Setelah itu, ditambah 1 mL DMSO 1%, lalu ditambah 3 mL dapar fosfat. Larutan kemudian dihomogenkan dengan vortex dan diinkubasi selama 5 menit. Reaksi dihentikan dengan penambahan 1 mL HCl 1 M dan ditambahkan indikator warna iodin-iodida sebanyak 0,01 mL, kemudian larutan dihomogenkan lagi dengan menggunakan vortex. Larutan uji kemudian dibaca serapannya menggunakan spektrofotometer UV-Vis pada panjang gelombang 536 nm. Larutan kontrol ekstrak dibuat replikasi sebanyak 3 kali.
Perhitungan % penghambatan
Perhitungan % penghambatan enzim alfa-amilase oleh sampel ekstrak air batang brotowali maupun acarbose dapat dihitung dengan menggunkan rumus:
% Penghambatan =
(Elya et al, 2015) Keterangan:
A1 : Absorbansi blanko – absorbansi kontrol dari blanko A2 : Absorbansi sampel – absorbansi kontrol dari sampel Perhitungan IC50
Nilai IC50 dihitung menggunakan persamaan regresi linear, dimana
konsentrasi sampel sebagai sumbu x dan nilai % penghambatan sebagai sumbu y. Dari persamaan y = a + bx, nilai IC50 dapat dihitung dengan rumus:
12
(Elya et al, 2015) Teknik pengumpulan data dan analisis hasil
Analisis data persen penghambatan diukur secara statistik yang diawali dengan menguji distribusi normalitas dengan uji Shapiro-Wilk dan menguji homogenitas dengan uji Levene. Apabila data yang didapatkan terdistribusi normal (nilai P > 0,05), maka dilanjutkan dengan uji One-Way ANOVA, dan apabila ditemukan perbedaan maka dilanjutkan dengan Post-Hoc Tukey pada taraf kepercayaan 95%. Sedangkan apabila didapatkan data yang tidak terdistribusi normal (nilai P < 0,05), maka dilanjutkan dengan uji Kruskal-Wallis, dan apabila ditemukan perbedaan maka dilanjutkan dengan uji Mann-Whitney pada taraf kepercayaan 95%. Sedangkan analisis data nilai IC50 dilakukan dengan menguji
distribusi normalitas dengan uji Shapiro-Wilk dan menguji homogenitas dengan uji Levene, yang kemudian dilanjutkan dengan uji T tidak berpasangan.
HASIL DAN PEMBAHASAN
Penyiapan Serbuk Batang Brotowali dan Determinasi Serbuk
Bahan yang digunakan berupa serbuk simplisia batang brotowali yang diperoleh dari PT. HRL Internasional Surabaya, Jawa Timur.
Serbuk simplisia batang brotowali kemudian dilakukan determinasi yang bertujuan untuk memastikan kebenaran spesies tanaman yang akan digunakan merupakan spesies dari (Tinospora crispa L.) Hook.F. & Thomson. Hasil determinasi menyatakan bahwa spesimen serbuk tersebut adalah benar-benar tanaman Tinospora crispa (L.) Hook.F. & Thomson dari keluarga menispermaceae (Lampiran 1).
Penetapan Kadar Air pada Serbuk Batang Brotowali
Tujuan penetapan kadar air adalah untuk memberikan batasan minimal atau rentang tentang besarnya kandungan air di dalam bahan. Kandungan air yang
13
tinggi pada simplisia dapat menjadi media tumbuhnya bakteri dan jamur yang dapat merusak senyawa yang terkandung di dalam simplisia tersebut. Prinsip penetapan kadar air adalah pengukuran kandungan air yang berada di dalam bahan, dilakukan dengan cara yang tepat diantara cara titrasi, destilasi atau gravimetri (Departemen Kesehatan RI, 2000). Penetapan kadar air dalam serbuk batang brotowali mengacu pada Farmakope Herbal Indonesia tahun 2013 yaitu dengan metode destilasi toluen. Kadar air nantinya dihitung dengan menggunakan rumus berikut:
Volume air yang diperoleh adalah 0,9 mL, dengan bobot serbuk yang ditimbang adalah 10,0067 gram, sehingga kadar air yang diperoleh adalah 8,994%. Persen kadar air yang baik adalah kurang dari 10% (Departemen Kesehatan Republik Indonesia, 2011). Maka dari itu, serbuk batang brotowali yang digunakan dalam penelitian ini dapat dikatakan serbuk yang baik.
Pembuatan Ekstrak Air Serbuk Batang Brotowali
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Simplisia yang diekstrak mengandung senyawa aktif yang dapat larut dan senyawa yang tidak dapat larut seperti serat, karbohidrat dan protein (Departmen Kesehatan RI, 2000).
Ekstraksi serbuk batang brotowali dilakukan dengan cara dekokta. Dekokta merupakan salah satu metode ekstraksi yang dibuat dengan cara mengekstraksi sediaan herbal dengan air pada suhu 90oC selama 30 menit (Badan Pengawas obat dan Makanan, 2010). Sesuai prinsip “like dissolves like”, maka borapetosida C yang merupakan golongan furanoditerpen glikosida yang bersifat polar akan sesuai diekstraksi dengan pelarut air yang sama-sama bersifat polar (Bandiola, 2018). Metode dekokta dipilih karena cocok digunakan untuk bagian tanaman yang keras seperti akar atau kulit batang tanaman (Azwanida, 2015).
14
Selain itu, pelarut air dapat digunakan untuk menyari metabolit sekunder berupa terpenoid yang merupakan jenis senyawa aktif yang ditargetkan untuk uji aktivitas penghambatan alfa-amilase ini (Tiwari et al, 2011). Pengunaan air sebagai pelarut ekstraksi memiliki beberapa keuntungan seperti murah, mudah diperoleh, serta merupakan pelarut universal dan pelarut yang paling aman digunakan (Bandiola, 2018). Diterpen juga termasuk senyawa yang sukar menguap (Kementrian Kesehatan Republik Indonesia, 2016), sehingga metode dekokta ini bisa digunakan untuk mengekstraksi senyawa yang nonvolatil (Zhang et al, 2018).
Serbuk kering batang brotowali ditimbang sebanyak 10 gram dan disiapkan aquabidest sebanyak 50 mL. Panaskan panci dekokta yang berisi air diatas hot plate, setelah suhu termometer mencapai 90oC masukkan serbuk dan aquabidest ke dalam panci terpisah dan letakkan dalam panci pertama yang berisi air mendidih tadi. Lalu waktu dihitung selama 30 menit sambil sesekali diaduk. Setelah 30 menit, kemudian disaring diatas kain flannel pada cawan porselen dan kemudian filtrat diuapkan diatas penangas air sampai terbentuk ekstrak kental.
Ekstrak dibuat dengan tiga kali replikasi. Setelah itu ditimbang hingga mencapai bobot tetap. Bobot tetap dilakukan untuk memastikan bahwa pelarut tidak ada lagi didalam ekstrak. Menurut Departemen Kesehatan Republik Indonesia (2011), bobot tetap dikatakan tercapai apabila perbedaan penimbangan dua kali berturut-turut setelah dikeringkan selama satu jam tidak lebih dari 0,25% atau perbedaan penimbangan tidak melebihi 0,5 mg pada penimbangan dengan timbangan analitik.
Bobot tetap ekstrak kental yang didapatkan pada replikasi pertama adalah 2,4685 gram dan serbuk yang ditimbang sebanyak 10,0008 gram sehingga didapatkan % rendemen sebesar 24,68%. Pada replikasi kedua, bobot tetap ekstrak kental yang didapatkan adalah 3,6989 gram dan serbuk yang ditimbang sebanyak 10,0058 gram sehingga didapatkan % rendemen sebesar 36,97%. Sedangkan pada replikasi ketiga, bobot tetap ekstrak kental yang didapatkan adalah 2,1330 gram dan serbuk yang ditimbang sebanyak 10,0039 gram, sehingga didapatkan % rendemen sebesar 21,32%. Rendemen merupakan salah satu parameter mutu
15
ekstrak yang ditetapkan dengan satuan persen (%), semakin tinggi nilai rendemen yang dihasilkan menandakan nilai ekstrak yang dihasilkan semakin banyak. Rendemen suatu ekstrak dapat dipengaruhi oleh beberapa faktor, salah satunya adalah metode ekstraksi yang digunakan (Wijaya, 2018).
Uji Kandungan Fitokimia Serbuk Batang Brotowali
Pada penelitian ini dilakukan uji kandungan fitokimia pada serbuk maupun ekstrak air batang brotowali secara kualitatif dengan metode KLT. Tujuan dilakukan uji kualitatif ini untuk standarisasi serbuk maupun ekstrak air batang brotowali untuk mengetahui keberadaan kandungan senyawa metabolit yang dapat dipergunakan sebagai acuan parameter standar mutu.
Kromatografi didefinisikan sebagai prosedur pemisahan zat terlarut oleh suatu proses migrasi diferensial dinamis dalam sistem yang terdiri dari dua fase, salah satu diantaranya bergerak secara berkesinambungan dengan arah tertentu dan didalamnya zat-zat itu menunjukkan perbedaan mobilitas disebabkan adanya perbedaan dalam adsorbsi, partisi, kelarutan, tekanan uap, ukuran molekul atau kerapatan muatan ion. Dengan demikian masing-masing zat dapat diidentifikasikan atau ditetapkan dengan metode analitik (Departemen Kesehatan Republik Indonesia, 2013).
Teknik kromatografi umum membutuhkan zat terlarut terdistribusi diantara dua fase, satu diantaranya diam (fase diam), yang lainnya bergerak (fase gerak). Fase gerak membawa zat terlarut melalui media, hingga terpisah dari zat terlarut lainnya, yang terelusi lebih awal atau lebih akhir. Fase diam dapat bertindak sebagai zat penjerap, seperti halnya penjerap alumina yang diaktifkan, silica gel dan resin penukar ion, atau dapat bertindak melarutkan zat terlarut sehingga terjadi partisi antara fase diam dan fase gerak (Departemen Kesehatan Republik Indonesia, 2013).
KLT umumnya lebih banyak digunakan untuk tujuan identifikasi, karena mudah dan sederhana serta memberikan pilihan fase diam yang lebih luas dan
16
berguna untuk pemisahan masing- masing senyawa secara kuantitatif dari suatu campuran (Departemen Kesehatan Republik Indonesia, 2013).
Lempeng silica yang akan digunakan harus diaktifkan terlebih dahulu dengan memanaskan lempeng silica dalam oven pada suhu 120oC selama 30 menit. Aktivasi lempeng ditujukkan untuk mengurangi kadar airnya, karena jika silica masih basah akan sulit menyerap senyawa yang akan dipisahkan. Temperatur dan lama aktivasi lempeng merupakan faktor penting yang harus diperhatikan dalam aktivasi lempeng, terlalu pendek waktu aktivasi akan mengakibatkan tidak sempurnanya penghilangan kelembaban air yang berakibat lempeng akan memberikan latar belakang yang tidak seragam. Sebaliknya, waktu aktivasi yang terlalu lama akan menghilangkan air kimia yang terikat yang dapat merubah sifat fisika kimia lempeng (Wulandari, 2011).
Sesuai dengan acuan Suplemen III, Farmakope Herbal Indonesia tahun 2013, fase diam yang digunakan dalam penelitian ini adalah silica gel GF254 dan
digunakan fase gerak yaitu kloroform P-metanol P dengan perbandingan 9:1. Larutan pembanding yang digunakan adalah kuersetin 1% dalam metanol P. Larutan uji serbuk simplisia dibuat dengan melarutakan 1 gram serbuk dalam 10 mL metanol P, sedangkan larutan uji ekstrak air serbuk simplisia dibuat dalam konsentrasi 4 mg/mL dengan melarutkan 20 mg ekstrak dengan metanol P dalam labu ukur 5 mL. Volume penotolan yang ditotolkan adalah 10 µL untuk larutan uji dan 5 µL untuk larutan pembanding. Deteksi yang digunakan adalah deteksi fisik pada UV 254 nm dan UV 366 nm.
Faktor retardasi (Retardation factor atau Rf) adalah parameter yang digunakan untuk menggambarkan migrasi senyawa dalam KLT. Nilai Rf merupakan parameter yang menyatakan posisi noda pada fase diam setelah dielusi. Penentuan harga Rf analit yaitu membandingkan jarak migrasi noda analit dengan jarak migrasi fase gerak/ eluen. Harga Rf dapat dihitung sebagai rasio:
17
(Wulandari, 2011) Nilai Rf berkisar antara 0 dan 1. Nilai Rf terbaik antara 0,2-0,8 untuk deteksi UV dan 0,2-0,9 untuk deteksi visibel. Pada Rf kurang dari 0,2 belum terjadi kesetimbangan antara komponen senyawa dengan fase diam dan fase gerak sehingga bentuk noda biasanya kurang simetris, sedangkan pada Rf diatas 0,8 noda analit akan diganggu oleh absorbansi pengotor lempeng fase diam yang teramati pada visualisasi dengan lampu UV (Wulandari, 2011).
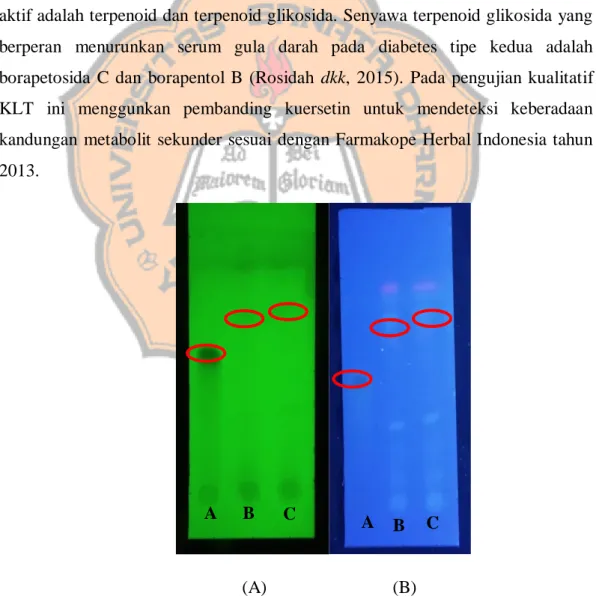
Secara kimia tanaman brotowali mengandung alkaloid, diterpenoid, flavonoid, fenol, lakton dan lignin. Komponen utama yang telah diidentifikasi aktif adalah terpenoid dan terpenoid glikosida. Senyawa terpenoid glikosida yang berperan menurunkan serum gula darah pada diabetes tipe kedua adalah borapetosida C dan borapentol B (Rosidah dkk, 2015). Pada pengujian kualitatif KLT ini menggunkan pembanding kuersetin untuk mendeteksi keberadaan kandungan metabolit sekunder sesuai dengan Farmakope Herbal Indonesia tahun 2013.
(A) (B)
Gambar 1. Hasil elusi KLT serbuk batang brotowali dan pembanding kuersetin pada UV 254 nm (A) dan UV 366 nm (B).
A A B B C C
18
Tabel I. Perhitungan nilai RF Serbuk
Jarak Bercak (cm) Jarak Elusi (cm) Nilai Rf Pembanding kuersetin (A) 5,7 cm 10 cm 0,57 cm
Replikasi I serbuk (B) 6,2 cm 0,62 cm
Replikasi II serbuk (C) 6,5 cm 0,65 cm
(A) (B)
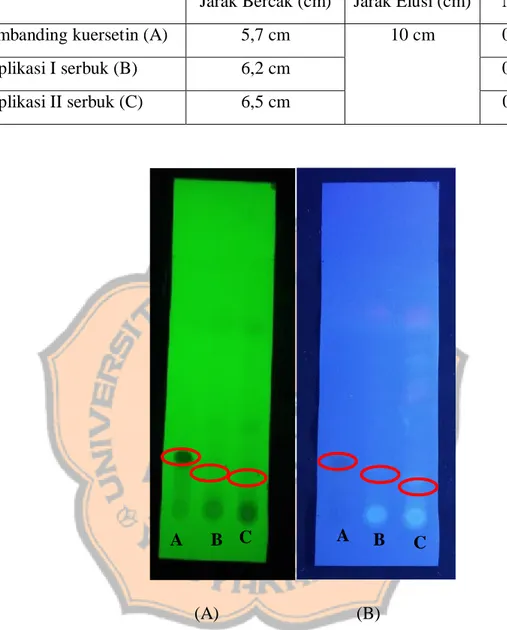
Gambar 2. Hasil elusi KLT ekstrak air batang brotowali dengan pembanding kuersetin pada UV 254 (A) nm dan UV 366 nm (B)
Tabel II. Perhitungan nilai RF Ekstrak Jarak Bercak
(cm) Jarak Elusi (cm) Nilai Rf Pembanding kuersetin (A) 2,2 cm
10 cm
0,22 cm
Ekstrak air (B) 1,8 cm 0,18 cm
Ekstrak etanol (C) 1,6 cm 0,16 cm
19
Hasil uji KLT serbuk maupun ekstrak menghasilkan beberapa bercak. Perbedaan jumlah bercak dikarenakan pada serbuk maupun ekstrak air batang brotowali memiliki kandungan senyawa metabolit lain, sehingga pada saat elusi dapat dihasilkan lebih dari satu bercak, sedangkan pada pembanding kuersetin hanya dihasilkan satu bercak karena kandungan kimia yang terdapat pada pembanding adalah kandungan murni kuersetin.
Hasil KLT serbuk simplisia menghasilkan nilai Rf untuk standar kuersetin sebesar 0,57 cm dan untuk serbuk simplisia pada replikasi I menghasilkan nilai Rf sebesar 0,62 dan untuk serbuk simplisia replikasi II menghasilkan nilai Rf sebesar 0,65 cm. Hasil yang didapatkan pada KLT ekstrak menunjukkan nilai Rf pada pembanding kuersetin sebesar 0,22 dan untuk ekstrak air menghasilkan nilai Rf sebesar 0,18 cm.
Hasil bercak pada KLT ekstrak air serbuk simplisia apabila dilihat pada UV 366 nm bermacam-macam, salah satunya menampilkan warna ungu- merah muda yang menandakan bahwa batang brotowali mengandung senyawa terpenoid (Alen et al, 2017). Selain itu, hasil KLT ekstrak air serbuk simplisia menampilkan hasil beberapa bercak dengan warna yang berbeda, ini menunjukkan bahwa di dalam ekstrak air serbuk simplisia tersebut terkandung beberapa jenis metabolit sekunder yang lain selain terpenoid. Hal ini disebabkan karena pelarut yang digunakan untuk melarutkan ekstrak merupakan pelarut semi polar yang memiliki gugus polar dan gugus non polar, sehingga dapat menarik analit-analit yang bersifat polar maupun non polar (Astarina et al, 2013).
Uji Aktivitas Penghambatan Enzim Alfa-Amilase
Human alfa-amilase (HA) adalah sekelompok dua isoenzim yang berbeda, diproduksi dan dilepaskan terutama dikelenjar ludah yaitu Human Salivary Amylase (HSA) dan Human Pancreas Amylase (HPA) (Ventura et al., 2017). Alfa-amilase, enzim saliva atau pankreas memainkan peran penting dalam pemecahan awal karbohidrat kompleks menjadi molekul sederhana. Modulasi aktivitas alfa-amilase mempengaruhi pemanfaatan karbohidrat sebagai sumber
20
energi dan pemanfaatan yang lebih penting adalah pengurangan karbohidrat kompleks (De Sales et al., 2012). Pati adalah sumber utama karbohidrat dan pencernaannya dimulai pada mulut, dimana saliva alfa-amilase memulai hidrolisis pati sebelum mencapai perut. Setelah pati masuk perut, pankreas alfa-amilase melengkapi konversi menjadi disakarida dan oligosakarida pendek. Selanjutnya, alfa-glukosidase usus memecah disakarida menjadi monosakarida (glukosa), yang mudah diserap melalui sel–sel usus kecil ke aliran darah ( Oboh et al., 2011).
Alfa-amilase mengkatalisasi pembelahan alfa-1,4 ikatan glikosidik untuk mengkonversi polisakarida menjadi oligosakarida yang lebih kecil seperti maltose, maltotriosa dan sejumlah alfa-1,4 dan alfa-1,6 oligoglan. Fragment- fragment ini selanjutnya akan mengalami degradasi lebih lanjut oleh alfa-glukosidase yang terletak di perbatasan sekat usus kecil (Trihn et al, 2016). Degradasi oleh alfa-glukosidase ini akan berubah menjadi glukosa yang akan diserap memasuki aliran darah, degradasi pati makanan ini berlangsung dengan cepat dan menyebabkan peningkatan hiperglikemia post prandial (Sudha et al, 2011).
Prinsip dari pengujian aktivitas penghambatan alfa-amilase ini adalah berdasarkan pada pembentukan kompleks iodin-pati, aktivitas enzim alfa-amilase diamati sebagai penurunan intensitas warna biru pada kompleks iodin-pati karena berkurangnya substrat pati akibat hidrolisis yang dilakukan oleh enzim alfa-amilase (Sudha et al, 2011). Sebelum dilakukan pengujian, dilakukan optimasi panjang gelombang maksimal dan Operating Tme (OT). Tujuan dilakukan optimasi panjang gelombang untuk dapat menentukan panjang gelombang yang menghasilkan serapan maksimum dari larutan uji. Berdasarkan optimasi panjang gelombang yang dilakukan pada panjang gelombang 400-800 nm, didapatkan panjang gelombang maksimum sebesar 536 nm. Penentuan Operating Time bertujuan untuk menentukan waktu optimal suatu reaksi bekerja. Pada penelitian optimasi OT ini dibuat dalam 4 rentang waktu yang berbeda yaitu 5 menit, 10 menit, 20 menit, dan 30 menit. Pengukuran dilakukan pada rentang panjang gelombang maksimal yang sebelumnya sudah didapat yaitu 536 nm. Hasil OT yang didapat adalah selama 5 menit.
21
Setelah dilakukan optimasi, dilanjutkan dengan uji aktivitas penghambatan enzim alfa-amilase. Pada uji ini, untuk mendapatkan nilai akhir berupa % penghambatan dan IC50 perlu dilakukan beberapa rangkaian uji pada beberapa
kelompok. Uji aktivitas untuk ekstrak air serbuk batang brotowali maupun untuk acarbose dibuat kelompok larutan uji masing-masing adalah larutan blanko, kontrol blanko, sampel dan kontol sampel.
Pengujian larutan blanko dan kontrol blanko bertujuan untuk mengetahui aktivitas dari enzim alfa-amilase tanpa penambahan sampel uji. Kelompok blanko dimaksudkan untuk mengetahui aktivitas pelarut yang digunakan tanpa adanya sampel. Kelompok kontrol blanko dimaksudkan untuk mengetahui aktivitas pelarut tanpa adanya sampel uji maupun enzim. Kelompok sampel digunakan untuk mengetahui aktivitas sampel yang digunakan penghambatan enzim alfa-amilase. Kelompok kontrol sampel digunakan untuk melihat aktivitas sampel tanpa adanya enzim.
Pati kentang digunakan sebagai substrat dari enzim alfa-amilase. DMSO digunakan sebagai pelarut karena DMSO dapat melarutkan senyawa polar dan non polar serta DMSO tidak akan mengganggu hasil penelitian karena tidak memberikan aktivitas terhadap sampel uji (Octaviani et al, 2019). Aquabidest digunakan sebagai pelarut, penggunaan aquabidest bersifat murni dan bebas dari zat-zat pengotor karena merupakan hasil destilasi. Enzim alfa-amilase bekerja pada pH tertentu, pH optimum untuk aktivitas inhibitor terdapat pada pH 4,5-5,0 dan pH 6,9 merupakan pH optimum untuk enzim alfa-amilase (Prahesti et al, 2018). HCl digunakan sebagai penghenti reaksi, karena apabila enzim berada pada pH yang terlalu rendah akan mengakibatkan denaturasi pada enzim. Dapar fosfat digunakan untuk mempertahankan kondisi pH, agar selama reaksi berlangsung enzim tetap bekerja optimal. Larutan iodin-iodida digunakan sebagai pewarna bagi pati kentang yang tersisa pada reaksi sehingga dapat dibaca serapannya pada spektrofotometri UV-VIS.
22
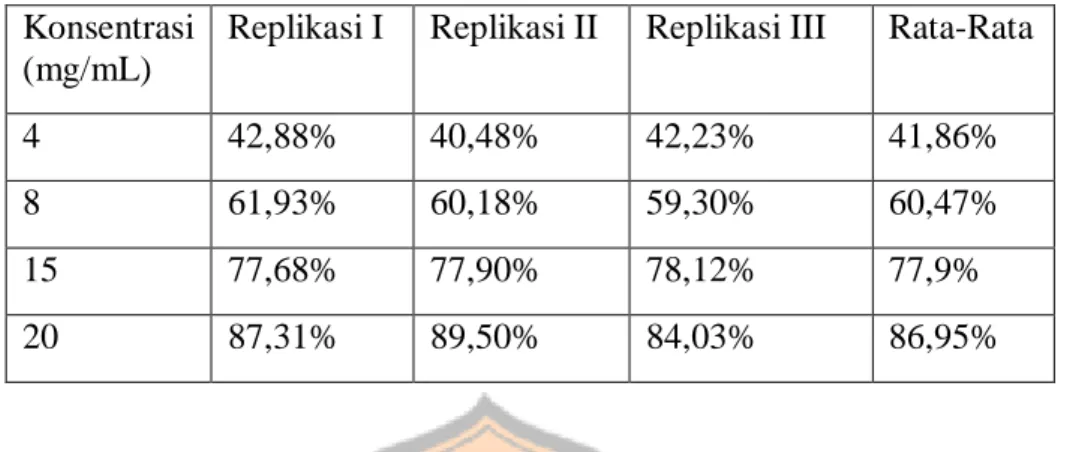
Tabel III. Nilai Persen Inhibisi Acarbose Konsentrasi
(mg/mL)
Replikasi I Replikasi II Replikasi III Rata-Rata
4 42,88% 40,48% 42,23% 41,86%
8 61,93% 60,18% 59,30% 60,47%
15 77,68% 77,90% 78,12% 77,9%
20 87,31% 89,50% 84,03% 86,95%
Uji penghambatan enzim alfa-amilase oleh kontrol positif menggunakan acarbose. Acarbose adalah pseudotetrasaccharida dan menghambat alfa-amilase serta alfa-glukosidase dengan aktivitas antihiperglikemik. Acarbose ini mencegah pemecahan karbohidrat yang lebih besar menjadi glukosa dan mengurangi kenaikan kadar glukosa darah posprandial. Selain itu, acarbose juga bekerja menghambat alfa-amilase dengan mencegah hidrolisis pati kompleks menjadi oligosakarida di usus kecil (Pubcem online). Konsentrasi acarbose yang digunakan adalah 4 mg/mL, 8 mg/mL, 15 mg/mL dan 20 mg/mL dengan 3 kali replikasi. Hasil nilai persen inhibisi acarbose sesuai dengan tabel III. Kemudian hasil yang didapatkan akan di analisis secara statistik.
23
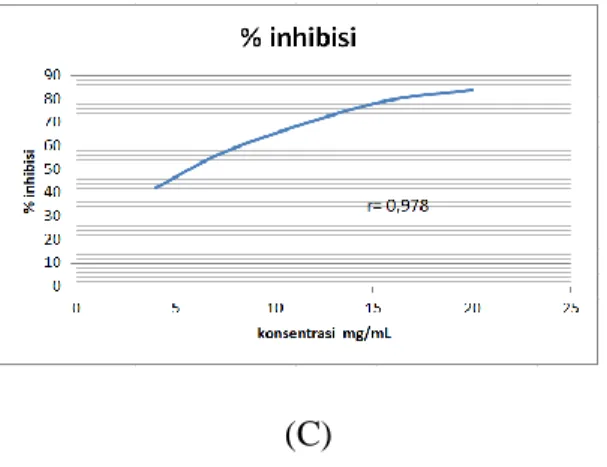
(C)
Gambar 3. Grafik hubungan konsentrasi acarbose dengan nilai persen inhibisi enzim alfa-amilase pada replikasi I (A), replikasi II (B), dan replikasi III (C).
Pada grafik hubungan persen inhibisi dengan konsentrasi acarbose sesuai gambar diatas (gambar 3) didapatkan nilai r pada replikasi 1 sebesar 0,981, replikasi 2 sebesar 0,987 dan replikasi 3 sebesar 0,978. Nilai r menyatakan korelasi antara peningkatan konsentrasi dengan peningkatan persen inhibisi. Apabila nilai r mendekati 1 maka semakin menggambarkan korelasi sempurna (Gandjar dan Rohman, 2017). Pada ketiga replikasi nilai r mendekari 1 maka dapat dikatakan terdapat hubungan antara peningkatan konsentrasi dengan peningkatan nilai persen inhibisi.
Pada uji statistik persen inhibisi acarbose, dialukan uji normalitas menggunakan uji Shapiro-Wilk. Nilai P yang didapat > 0,05 (lampiran 10) sehingga dapat dikatakan bahwa data terdistribusi normal. Kemudian dilanjutkan dengan Levene Test untuk mengetahui homogenitas data, nilai P yang didapat > 0,05 yang berarti data yang diperoleh homogen. Data yang terdistribusi normal kemudian dilanjutkan dengan uji One-Way ANOVA, pada uji ini dibandingkan dari keempat kelompok konsentrasi 4 mg/mL, 8 mg/mL, 15 mg/mL, dan 20 mg/mL, hasil nilai P menunjukkan bahwa < 0,05 yang menunjukkan bahwa terdapat perbedaan yang signifikan dari keempat kelompok perlakuan antar konsentrasi. Hal ini menandakan bahwa semakin tinggi konsentrasi maka semakin
24
besar pula persen inhibisi yang dihasilkan. Peningkatan konsentrasi mempengaruhi peningkatan efek penghambatan enzim alfa-amilase oleh acarbose. Setelah itu, nilai persen inhibisi yang didapat digunakan untuk menghitung nilai IC50 yang menjadi parameter aktivitas penghambatan. Dengan menggunakan
persamaan regresi linear, dimana konsentrasi sampel sebagai sumbu x dan persen penghambatan sebagai sumbu y, didapatkan nilai a dan b masing-masing replikasi. Hasil nilai IC50 replikasi I sebesar 5,2247 mg/mL, replikasi 2 sebesar
6,0034 mg/mL, replikasi III sebesar 5,6385 mg/mL, dengan nilai rata-rata 5,662 ± 0,390 mg/mL dan CV sebesar 6,888%. Nilai CV untuk senyawa dengan kadar kecil dapat berkisar 5-15% (Gandjar dan Rohman, 2017), sehingga nilai CV sebesar 6,888% sesuai dengan teori. Maka, tujuan dari kontrol positif untuk memastikan metode yang digunakan benar sudah tercapai, sehingga metode ini dapat dilakukan untuk pengujian sampel.
(A) (B)
Gambar 4. Struktur acarbose (A) dan struktur amilum (B) Acarbose merupakan obat antidiabetes yang termasuk dalam inhibitor kompetitif alfa-amilase. Pada penghambatan inhibitor kompetitif, acarbose akan bersaing dengan pati kentang sebagai substrat untuk mendapatkan sisi aktif dari enzim alfa-amilase sehingga hal tersebut mengganggu reaksi antara enzim dengan substrat (De Sales et al, 2012). Hal ini juga dapat dibuktikan karena inhibitor acarbose memiliki struktur yang mirip dengan substrat amilum (gambar 4).
25
Tabel IV. Nilai Persen Inhibisi Ekstrak Air Batang Brotowali Konsentrasi
(mg/mL)
Replikasi I Replikasi II Replikasi III Rata-Rata
4 32,63% 33,95% 30,79% 32,46%
8 48,95% 51,84% 50,79% 50,53%
15 59,47% 58,95% 61,32% 59,91%
20 70% 69,21% 67,11% 68,77%
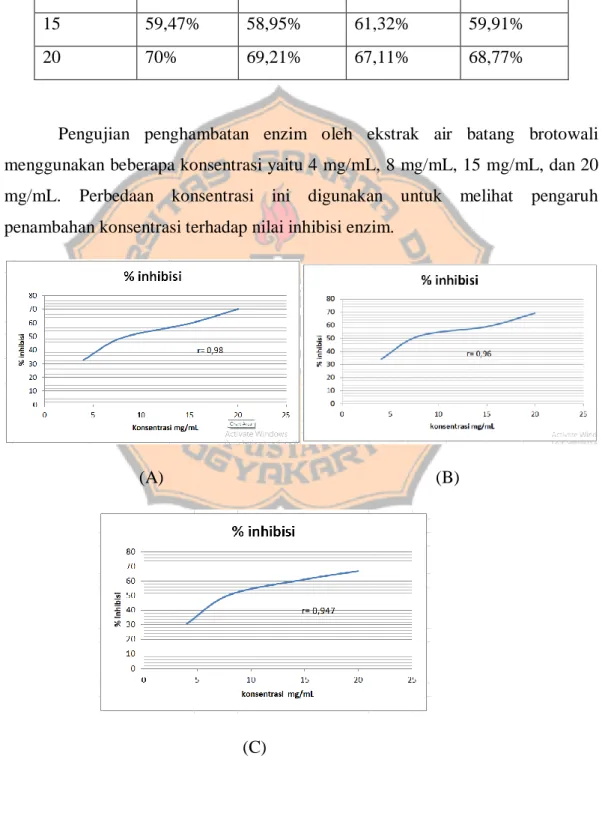
Pengujian penghambatan enzim oleh ekstrak air batang brotowali menggunakan beberapa konsentrasi yaitu 4 mg/mL, 8 mg/mL, 15 mg/mL, dan 20 mg/mL. Perbedaan konsentrasi ini digunakan untuk melihat pengaruh penambahan konsentrasi terhadap nilai inhibisi enzim.
(A) (B)
26
Gambar 5. Grafik hubungan konsentrasi ekstrak air batang brotowali dengan nilai persen inhibisi enzim alfa-amilase pada replikasi I (A), replikasi II (B), dan replikasi III (C)
Pada grafik hubungan persen inhibisi dengan konsentrasi ekstrak air batang brotowali sesuai dengan gambar di atas (Gambar 5) didapatkan nilai r pada replikasi 1 sebesar 0,98, replikasi 2 sebesar 0,96, dan replikasi 3 sebesar 0,947. Apabila nilai r mendekati 1 maka semakin menggambarkan korelasi yang sempurna (Gandjar dan Rohman, 2017). Pada ketiga replikasi nilai r mendekati 1, maka dapat dikatakan terdapat hubungan antara peningkatan konsentrasi dengan peningkatan nilai persen inhibisi ekstrak air batang brotowali.
Pada pengujian statistik, persen inhibisi ekstrak air batang brotowali dilakukan uji normalitas dengan uji Shapiro-Wilk. Nilai P yang didapatkan > 0,05 (lampiran 10) yang menunjukkan bahwa data terdistribusi normal. Uji homogenitas dilakukan dengan Levene Test, hasil yang didapatkan nilai P sebesar > 0,05 yang menunjukkan bahwa data yang didapatkan homogen. Data yang terdistribusi normal kemudian dilanjutkan dengan uji One-Way ANOVA, pada uji ini dibandingkan dari keempat kelompok konsentrasi 4 mg/mL, 8 mg/mL, 15 mg/mL, dan 20 mg/mL, hasil nilai P menunjukkan bahwa < 0,05 yang menunjukkan bahwa terdapat perbedaan yang signifikan dari keempat kelompok perlakuan antar konsentrasi. Hal ini menandakan bahwa semakin tinggi konsentrasi maka semakin besar pula persen inhibisi yang dihasilkan. Peningkatan konsentrasi mempengaruhi peningkatan efek penghambatan enzim alfa-amilase oleh ekstrak air batang brotowali.
Pengujian kemudian dilanjutkan dengan menghitung nilai IC50 dengan
menggunakan persamaan regresi linear pada 3 kali replikasi berturut-turut. Nilai IC50 replikasi 1 sebesar 10,4840 mg/mL, replikasi 2 sebesar 9,99% dan replikasi 3
sebesar 10,5708, dengan nilai rata-rata 10,348±0,313 mg/mL dan CV sebesar 3,024%. Nilai IC50 yang dihasilkan lebih besar dibandingkan dengan kontrol
27
terdapat di dalam ekstrak sehingga dapat menurunkan aktivitas penghambatan enzim alfa-amilase.
Pengujian IC50 merupakan parameter dari aktivitas penghambatan yang
menyatakan suatu sampel mempunyai aktivitas penghambatan enzim alfa-amilase sebesar 50% yang diperoleh dari persamaan regresi linear untuk menyatakan hubungan konsentrasi sampel dengan persen inhibisi. Nilai % inhibisi dari ekstrak ataupun acarbose meningkat seiring kenaikan konsentrasi yang akan mempengaruhi kekuatan efek yang dihasilkan (Fitrianingsih et al, 2016). Dari hasil pengujian diatas, didapat persen inhibisi ekstrak dengan tiga kali replikasi adalah lebih kecil dibandingkan dengan acarbose, sehingga nilai IC50 pada ketiga
ekstrak akan lebih besar dari acarbose.
Data IC50 acarbose dan ekstrak air batang brotowali dibandingkan dengan
melakukan uji statistik dengan menggunakan R statistik (lampiran 10) dengan tujuan untuk membandingkan antara kedua kelompok tersebut. Berdasarkan uji normalitas dengan Shapiro-Wilk dan uji homogenitas dengan Levene Test, didapatkan nilai p > 0,05 yang menunjukkan data terdistribusi normal dan homogen. Selanjutnya dilakukan uji T tak berpasangan dan didapatkan hasil yang berbeda bermakna, dilihat dari nilai p < 0,05, sehingga dapat disimpulkan bahwa terdapat perbedaan efek penghambatan terhadap aktivitas enzim alfa-amilase antara ekstrak air batang brotowali dengan acarbose.
Menurut penelitian Ibrahim et al (2017) nilai IC50 acarbose yang
didapatkan pada uji penghambatan alfa-amilase sebesar 200,19 ± 7,29 mg/mL. Pada penelitian yang dilakukan 5,662 ± 0,390 mg/mL. Perbedaan nilai IC50 yang
cukup jauh ini dapat disebabkan karena penggunaan substrat yang berbeda, kandungan dapar fosfat yang berbeda dan perbedaan metode yang digunakan. Pada penelitian Ibrahim et al (2017), digunakan para-nitrophenyl-alpha-D-maltopentoglycoside sebagai substrat. Sementara, penelitian ini menggunakan pati kentang sebagai substrat. Selain itu, kandungan dapar fosfat yang digunakan adalah bovine serum albumin dan NaN3, sedangkan pada penelitian ini kandungan
28
Ibrahim et al menggunakan instrument microplate reader, sedangkan pada penelitian ini menggunakan instrument spektrofotometer UV-VIS.
Apabila dibandingkan dengan penelitian Chang., (2020) nilai IC50 acarbose yang didapatkan pada uji aktivitas penghambatan alfa-amilase sebesar 0,968 ± 0,051 mg/mL. Pada penelitian didapatkan nilai IC50 sebesar 5,662 ± 0,390 mg/mL. Perbandingan antara kedua nilai IC50 ini cukup berdekatan, karena menggunaan metode dan perlakuan uji yang sama, namun hanya berbeda pada konsentrasi dan sampel uji yang digunakan. Menurut penelitian Bhutkar et al (2017), pengujian dengan menggunakan acarbose murni diperoleh nilai IC50 sebesar 383,7 µL/mL.
Gambar 6. Struktur borapetosida C
Menurut penelitian Ruan et al (2012), salah satu kandungan dari batang brotowali yaitu borapetosida C dapat menunda perkembangan resistensi insulin dengan peningkatan sensitivitas insulin. Aktivasi atau peningkatan stimulasi insulin dari jalur IR/Akt/GLUT2 dapat berkontribusi pada efek penurun glukosa plasma dari borapetosida C pada tikus T1DM. Borapetosida A dan C pada Tinospora crispa berperan dalam menurunkan kadar glukosa plasma pada tikus diabetes 1 yang diinduksi streptosozin dan dilakukan pemeriksaan pada aktivitas hipoglikemik in vivo (Koay and Faheem, 2013).
Senyawa pada tanaman batang brotowali yang diduga memiliki aktivitas penghambatan terhadap enzim alfa-amilase adalah borapetosida C. Menurut Elya
29
et al (2012), alfa-amilase memecah pati dengan memutus ikatan glikosida. Borapetosdia C yang sama-sama memiliki ikatan glikosida dapat mengubah peran pati sebagai substrat. Dengan mekanisme inilah, pati di dalam tubuh tidak diubah menjadi bentuk disakarida. Hal ini bisa membantu kerja dari glukosidase yang mengubah disakarida menjadi monosakarida (glukasa) dan kadar glukosa pun dapat dikontrol. Borapetosida C yang dapat menggantikan pati sebagai substrat tersebut dapat dikategorikan sebagai inhibitor kompetitif, karena saling bersaing untuk sisi aktif pada enzim. Selain itu, apabila dilihat struktur borapetosida C dan pati kentang memiliki struktur yang mirip.
KESIMPULAN
Berdasarkan uji aktivitas penghambatan enzim alfa-amilase yang telah dilakukan, ekstrak air batang brotowali menunjukkan hasil bahwa sampel tersebut dapat melakukan penghambatan enzim alfa-amilase secara in vitro dengan nilai persen inhibisi yang dihasilkan untuk konsentrasi 4 mg/mL yaitu 32,46%, konsentrasi 8 mg/mL yaitu 50,53%, konsentrasi 15 mg/mL yaitu 59,91% dan konsentrasi 20 mg/mL yaitu 68,77%. Hasil nilai IC50 sebesar 10,348 ± 0,313
mg/mL dan nilai IC50 acarbose sebesar 5,662 ± 0,390 mg/mL. Hasil uji statistik
IC50 ekstrak dan acarbose menunjukkan hasil yang berbeda bermakna yaitu
terdapat perbedaan efek penghambatan terhadap aktivitas enzim alfa-amilase antara ekstrak air batang brotowali dengan acarbose.
SARAN
Perlu dilakukan penelitian lebih lanjut untuk mengukur keberadaan borapetosida C yang terdapat dalam ekstrak air batang brotowali (Tinospora crispa L.) Hook. F & Thomson. Semakin tinggi kandungan borapetosida C pada ekstrak, diharapkan efek penghambatan pada aktivitas enzim alfa-amilase akan semakin tinggi. Selain itu, perlu dilakukan uji lanjutan untuk membuktikan bahwa ekstrak air batang brotowali dapat menghambat enzim alfa-amilase secara in vivo. Penggunaan acarbose juga disarankan menggunakan acarbose murni, karena apabila menggunakan produk tablet acarbose, zat-zat tambahan yang terkandung dalam tablet akan mempengaruhi hasil penelitian.
30
DAFTAR PUSTAKA
Alen, Y., Fitria, L. A., and Yori, Y., 2017. Analisis Kromatografi Lapis Tipis (KLT) dan Aktivitas Antihiperurisemia Ekstrak Rebung Schizostachyum brachycladum Kurz (Kurz) pada Mencit Putih Jantan. Jurnal Sains Farmasi dan Klinis.
Alldredge, B.K., Corelli, R.L., Ernst, M.E., Gugleilmo, B.J., Jacobson, P.A., Kradjan, W.A., Williams, B.R., 2013. Koda-Kimble & Young’s Applied Theurapeutics.
Astarina, N. W. G., Astuti, K. W., dan Warditiani, N. K., 2013. Skrining Fitokimia Ekstrak Metanol Rimpang Bangle (Zingiber purpureium Roxb). Jurnal Farmasi Udayana.
Azwanida, NN. 2015. A review on the Extraction Methods Use in Medicinal Plants, Principle, Strenght and Limitation. Review Medicinal and Aromatic Plants.
Badan Pengawas Obat dan Makanan RI, 2010. Acuan Sediaan Herbal. Volume 5, Edisi 1, Jakarta: Badan Pengawas Obat dan Makanan. Bandiola, T. M., 2018. Extraction and Qualitative Phytochemical Screening of
Medicinal Plants: A Brief Summary. International Journal of Pharmacy. Bhutkar, M. A., Bhinge, S.D., Randive, D.S., Wadkar, G. H., and Todkar, S. S.,
2018. In Vitro Studies on Alpha Amylase Inhibitory Activity of Some Indigenous Plans. Modern Applications in Pharmacy and Pharmacology., 1(4), 1-5.
Chang, M. J. V., 2020. Uji Aktivitas Penghambatan Enzim Alfa-Amilase oleh Ekstrak Air Daun Sambiloto (Andrographis paniculata Nees.) Secara In Vitro. Universitas Sanata Dharma.
De Sales, P. M., Paula, M. S., Luiz, A. S., Perola O. M. and Damaris, S., 2012. α- Amylase Inhibitors: A Review of Raw Material and Isolated Compounds from Plant Source. J PharmSci.15(1).
Departemen Kesehatan Republik Indonesia, 2000. Parameter Standar Umum Ekstrak Tumbuhan Obat. Badan POM Republik Indonesia, Jakarta.
Departemen Kesehatan Republik Indonesia, 2011. Farmakope Herbal Indonesia, Suplemen II.Edisi 1. Kementrian Kesehatan Republik Indonesia, Jakarta. Departemen Kesehatan Republik Indonesia, 2011. Farmakope Herbal Indonesia,
Suplemen III.Edisi 1. Kementrian Kesehatan Republik Indonesia, Jakarta. Elya, B., Katrin, B., Abdul, M.., Wulan, Yuliastuti., Anastasia, B., and Eva, K. S.,
2012. Screening of α-Glucosidase Inhibitory Activity From Some Plants of Apocynacea, Clusiaceae, Euphorbiaceae, and Rubiaceae. Journal of Biomedicine anf Biotechnology.