(Vigna unguiculata subsp. sesquipedalis)
HARYANTO
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
HARYANTO. Pemanfaatan Kitosan Untuk Menekan Infeksi Virus Mosaik pada
Tanaman Kacang Panjang (Vigna unguiculata subsp. sesquipedalis). Dibimbing oleh TRI ASMIRA DAMAYANTI dan SURYO WIYONO
Penelitian ini bertujuan untuk menguji efektifitas kitosan dalam mengendalikan penyakit mosaik pada kacang panjang (VMKP). Efektivitas kitosan dalam menekan infeksi virus diuji dengan cara menularkan virus secara mekanis pada 7 hari setelah tanam (HST). Adapun perlakuan yang digunakan adalah (1) perlakuan benih dengan kitosan 0,1% (PB0,1), (2) perlakuan benih dengan kitosan 1% (PB1), (3) perlakuan kitosan 0,1% sebelum inokulasi (SB0,1), (4) perlakuan kitosan 1% sebelum inokulasi (SB1), (5) perlakuan kitosan 0,1% setelah inokulasi (ST0,1), (6) dan perlakuan kitosan 1% setelah inokulasi (ST1), kontrol tanpa perlakuan kitosan yang diinfeksi virus (K+) dan kontrol sehat (K-). Masing-masing perlakuan terdiri dari 9 tanaman. Perlakuan SB dilakukan pada 5 HST dan perlakuan ST dilakukan pada 9 HST. Parameter yang diamati adalah masa inkubasi, tipe gejala, kejadian dan keparahan penyakit, pertumbuhan tanaman (tinggi dan diameter batang) pada 2, 4, 6, 8 minggu setelah inokulasi (MSI), masa berbunga, jumlah daun, bobot kering tanaman, dan akumulasi virus. Data yang diperoleh dianalisis dengan ANOVA dilanjutkan uji selang Duncan pada taraf nyata α = 0,05% menggunakan SAS versi 6.12.
Hasil pengujian menunjukkan bahwa tanaman yang diberi perlakuan kitosan 0,1% menunjukkan adanya variasi gejala seperti mosaik ringan, mosaik berat dan malformasi daun sedangkan perlakuan kitosan 1 % hanya menimbulkan gejala berupa mosaik ringan hingga mosaik sedang. Semua perlakuan kitosan menyebabkan masa inkubasi yang nyata lebih lama dibandingkan dengan kontrol. Dari 9 tanaman uji yang diberi perlakuan kitosan 1%, terdapat 3 tanaman yang tidak bergejala, sedangkan perlakuan kitosan 0,1% terdapat 2 tanaman yang tidak bergejala. Semua perlakuan kitosan menunjukkan akumulasi virus yang nyata lebih rendah dibandingkan dengan kontrol positif (K+) terutama SB1 dan ST1. Dari perlakuan kitosan 0,1% dan 1%, penghambatan infeksi virus tertinggi adalah tanaman yang diberi perlakuan kitosan SB1 dan ST1. Penghambatan virus terendah adalah tanaman yang diberi perlakuan kitosan ST0,1. Perlakuan kitosan 1% juga menunjukkan nilai penghambatan penyakit yang lebih tinggi bila dibandingkan dengan perlakuan kitosan 0,1%. Perlakuan kitosan menunjukkan perbedaan yang nyata terhadap tinggi tanaman, diameter batang, jumlah daun, dan bobot kering bila dibandingkan dengan kontrol tanaman sakit. Secara umum tanaman yang diberi perlakuan kitosan memiliki pertumbuhan yang sama dengan kontrol sehat.
PEMANFAATAN KITOSAN UNTUK MENEKAN INFEKSI
VIRUS MOSAIK PADA TANAMAN KACANG PANJANG
(Vigna unguiculata subsp. sesquipedalis)
HARYANTO
A34062081
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman, Institut Pertanian Bogor
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Pemanfaatan Kitosan Untuk Menekan Infeksi Virus Mosaik pada Tanaman Kacang Panjang (Vigna unguiculata subsp.
sesquipedalis) Nama Mahasiswa : Haryanto NRP : A34062081
Menyetujui,
Dosen Pembimbing 1 Dosen Pembimbing 2
(Dr. Ir. Tri Asmira Damayanti, M.Agr) (Dr. Ir. Suryo Wiyono, M.Sc Agr) NIP. 19681017 199302 2001 NIP. 19690212 199203 1003
Mengetahui,
Plh. Ketua Departemen Proteksi Tanaman
(Dr. Ir. Abdjad Asih Nawangsih, M.Si) NIP. 19650621 198910 2001
RIWAYAT HIDUP
Penulis dilahirkan di Makassar, Sulawesi Selatan pada tanggal 17 Juni 1988 sebagai anak ke-6 dari tujuh bersaudara dari pasangan Bapak Drs. Abd. Karim dan Ibu Siti khadijah.
Tahun 2006 penulis menamatkan Sekolah Menengah Atas Negeri 04 Makassar. Pada tahun yang sama penulis diterima di Institut Pertanian Bogor melalui jalur USMI (Undangan Seleksi Masuk IPB). Penulis diterima di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor tahun 2007.
Selama kuliah penulis pernah magang di Laboratorium Nematoda pada tahun 2008 dan menjadi anggota Ento-Club pada tahun 2008.
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT Rabb semesta alam, yang telah melimpahkan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan tugas akhir dengan judul “Pemanfaatan Kitosan Untuk Menekan Infeksi Virus Mosaik pada Tanaman Kacang Panjang (Vigna unguiculata subsp. sesquipedalis)” sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Departemen Proteksi Tanaman, Fakultas Pertanian, IPB.
Penulis mengucapkan banyak terima kasih kepada semua pihak yang telah membantu penulis, mulai dari kegiatan penelitian sampai dengan selesainya tugas akhir ini. Khususnya kepada:
1. Ibunda dan ayahanda serta kakak dan adik tercinta yang telah memberikan dukungan moral maupun materil, kasih sayang dan do’a restu kepada penulis.
2. Dr. Ir. Tri Asmira Damayanti, M.Agr dan Dr. Ir. SuryoWiyono, M.Sc Agr yang telah memberikan bimbingan, bantuan, arahan, masukan, serta nasehat kepada penulis sejak awal penelitian sampai akhir penyusunan tugas akhir ini.
3. Dr. Ir. Giyanto, MSi selaku pembimbing akademik penulis yang telah memberikan nasehat selama menjalani pendidikan di Departemen Proteksi Tanaman.
4. Anief nugroho, Windi Dhita, Nurihidayati, Fitrah Murgianto, Satrio Harjono, M. Chandra Putra, Eka Retnosari, dan Teman-teman DPT 43 lainnya yang telah memberikan kenangan terindah selama menempuh perkuliahan di Departemen Proteksi Tanaman.
5. Semua laboran Departemen Proteksi Tanaman Bapak Edi, bapak Saefuddin, bapak Gatot, bapak Dadang yang telah membantu dalam melaksanakan kegiatan praktikum perkuliahan dan penelitian di Rumah Kaca Cikabayan dan Laboratorium Virologi Tumbuhan.
6. Teman-teman laboratorium Virologi Tumbuhan: Sari nurulita, Amelia Indriani, Lara Hikmahayati, Nissa Fawwaz Adillah, Mbak Tuti Legiastuti, dan Devi agustina yang membantu penelitian baik di laboratorium maupun di rumah kaca.
7. Teman-teman kontrakan : Kang Okto, Ahmad sifa, Erwan, Kang Febi, Kang Aeb, dan Kang Usep atas dukungannya selama ini kepada penulis. Dan semua pihak yang telah memberikan bantuan, dukungan, dan motivasi.
Bogor, 10 November 2010
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix DAFTAR LAMPIRAN ... x PENDAHULUAN ... 1 Latar Belakang ... 1 Tujuan Penelitian ... 3 Manfaat Penelitian ... 3 TINJAUAN PUSTAKA ... 4
Taksonomi Kacang Panjang ... 4
Morfologi Tanaman Kacang Panjang ... 4
Hama dan Penyakit Tanaman Kacang Panjang ... 4
Virus mosaik pada tanaman kacang panjang (VMKP) ... 5
Kitosan ... 7
ELISA (Enzyme- linked immunosorbent assay) ... 9
BAHAN DAN METODE ... 10
Tempat dan Waktu Penelitian ... 10
Bahan dan Alat ... 10
Metode ... 10
Perbanyakan Inokulum... 10
Penanaman Kacang panjang... 10
Pembuatan Larutan Kitosan... 11
Perlakuan... 11
Inokulasi Tanaman Uji... 11
Parameter Pengamatan... 12
Perkembangan Penyakit... 12
Pertumbuhan Tanaman... 13
ELISA... 13
Analisis Data... 13
HASIL DAN PEMBAHASAN ... 14
Pengaruh Perlakuan Kitosan terhadap waktu inkubasi, dan tipe gejala... 14
Pengaruh perlakuan kitosan terhadap
kejadian penyakit dan keparahan penyakit... 15
Pengaruh perlakuan kitosan terhadap akumulasi Virus, penghambatan virus dan penyakit………….. ... 17
Pengaruh Perlakuan Kitosan Terhadap Tinggi Tanaman... 18
Pengaruh Perlakuan Kitosan Terhadap Diameter Batang... 20
Pengaruh Perlakuan Kitosan Terhadap Masa Berbunga, Jumlah Daun dan Bobot kering... 21
Pembahasan……….. 22
KESIMPULAN DAN SARAN ... 25
DAFTAR PUSTAKA ... 26
DAFTAR TABEL
Nomor Halaman
1. Pengaruh perlakuan terhadap
waktu inkubasi virus dan tipe gejala ... 14 2. Pengaruh perlakuan terhadap Kejadian penyakit (KP) dan
Keparahan penyakit………... 16 3. Pengaruh perlakuan terhadap akumulasi virus,
penghambatan virus dan penyakit... 17 4. Pengaruh perlakuan kitosan terhadap tinggi tanaman ... 18 5. Pengaruh perlakuan kitosan terhadap diameter batang ... 20 6. Pengaruh perlakuan kitosan terhadap masa berbunga,
DAFTAR GAMBAR
Nomor Halaman
1. Skala untuk keparahan penyakit ... 12 2. Perbandingan tinggi antara perlakuan
DAFTAR LAMPIRAN
Nomor Halaman
1. NAE pada kontrol positif ... 31
2. NAE pada kontrol negatif... 31
3. NAE perlakuan benih dengan kitosan 0,1 %... ... 32
4. NAE perlakuan benih dengan kitosan 1 %... ... 32
5. NAE perlakuan sebelum inokulasi dengan kitosan 0,1 %... ... 33
6. NAE perlakuan sebelum inokulasi dengan kitosan 1 %... ... 33
7. NAE perlakuan setelah inokulasi dengan kitosan 0,1 %... ... 34
8. NAE perlakuan setelah inokulasi dengan kitosan 1 %... ... 34
9. Keparahan penyakit tiap-tiap perlakuan... 35
10.Hasil analisis ragam pertumbuhan tinggi 2 MSI ... 36
11.Hasil analisis ragam pertumbuhan tinggi 4 MSI ... 36
12.Hasil analisis ragam pertumbuhan tinggi 6 MSI ... 36
13.Hasil analisis ragam pertumbuhan tinggi 8 MSI ... 36
14.Hasil analisis ragam pertumbuhan Diameter batang 2 MSI ... 37
15.Hasil analisis ragam pertumbuhan Diameter batang 4 MSI ... 37
16.Hasil analisis ragam pertumbuhan Diameter batang 6 MSI ... 37
17.Hasil analisis ragam pertumbuhan Diameter batang 8 MSI ... 37
18.Hasil analisis ragam masa berbunga ... 38
19.Hasil analisis ragam jumlah daun ... 38
20.Hasil analisis waktu inkubasi... 38
21.Hasil analisis ragam keparahan penyakit ... 38
PENDAHULUAN
Latar Belakang
Kacang panjang (Vigna unguiculata subsp. sesquipedalis) merupakan salah satu tanaman hortikultura yang banyak ditanam di wilayah Indonesia. Tanaman ini bersimbiosis mutualisme bersama Rhizobium sp. membentuk bintil-bintil akar yang berguna dalam proses fiksasi nitrogen yang mampu menyuburkan tanah. Kacang panjang merupakan sumber protein nabati yang baik dan mengandung berbagai sumber vitamin yaitu A, B, C serta mineral (Haryanto et al. 2007).
Peningkatan produktivitas kacang panjang menghadapi masalah hama dan penyakit. Hama yang paling banyak ditemukan pada tanaman kacang panjang adalah kutu daun Aphis craccivora (Hemiptera : Aphididae) sedangkan penyakit yang sering ditemui diantaranya layu (Fusarium sp.), antraknosa (Colletotrichum sp.), virus mosaik dan nematoda puru akar (Meloidogyne sp.). Kutu daun dan virus mosaik merupakan hama dan penyakit utama pada kacang panjang (Haryanto et al. 2007).
Virus tumbuhan sangat berbeda dengan semua patogen tumbuhan yang lain, tidak hanya dalam ukuran bentuk tetapi juga dalam kesederhanaan susunan kimia dan struktur fisik, cara menginfeksi, memperbanyak diri, translokasi dalam inang, penyebaran, dan gejala yang dihasilkan pada inang. Virus yang dapat menyebabkan mosaik dan umum menyerang pada tanaman kacang panjang adalah Bean common mosaic virus, Cowpea aphid-borne mosaic virus, Soybean mosaic virus. Virus ini dapat ditularkan melalui vektor dan terbawa oleh benih (CABI 2005).
Beberapa upaya pengendalian virus mosaik kacang panjang (VMKP) yaitu pengendalian vektor virus, penggunaan benih yang sehat dan penggunaan bahan-bahan antiviral. Pengendalian vektor virus dapat dilakukan dengan kultur teknis yaitu dengan sanitasi lahan dan membersihkan gulma yang dapat menjadi inang alternatif vektor serta penggunaan insektisida. Sedangkan untuk mendapatkan benih yang sehat, dilakukan dengan perlakuan benih yaitu perlakuan panas, sinar UV dan lain-lain (CABI 2005). Upaya pengendalian virus tanaman yang umum
dilakukan adalah dengan menggunakan varietas yang tahan. Namun tidak banyak tersedia kultivar yang tahan dengan VMKP. Setyastuti (2008) melaporkan bahwa dari 9 kultivar tanaman kacang panjang (Bogor Hijau I, asparagus, KP 888, Asri II, Sakura, KP 777, Dondot, Iguma dan Landung) yang banyak ditanam oleh petani rentan terhadap VMKP.
Salah satu teknik baru yang digunakan dalam pengendalian penyakit adalah dengan menginduksi ketahanan sistemik yang terdapat pada tanaman dengan bahan yang bersifat antiviral. Ketahanan sistemik dari suatu tanaman dapat diaktifkan dengan menginduksi gen-gen ketahanan yang terdapat di dalam tanaman (Kuc 1987). Salah satu agen yang dapat menginduksi ketahanan tanaman adalah ekstrak tumbuhan (Hersanti 2003) dan kitosan (Vasyukova et al. 2001).
Kurnianingsih (2010) melaporkan bahwa ekstrak daun Clerodendrum japonicum (bunga pagoda), Chenopodium amaranticolor, Mirabilis jalapa (bunga pukul empat), dan Andrographis paniculata (sambiloto) cukup efektif dalam menekan infeksi VMKP. Selain itu Hidayati et al. (2010) juga melaporkan bahwa ekstrak daun beberapa jenis gulma (Urena biloba, Phylanthus niruri, Cyperus rotundus, Bidens pilosa) mampu menekan infeksi VMKP.
Kitosan merupakan produk turunan dari kitin, yang banyak terdapat pada serangga, krustasea dan fungi, yang merupakan biopolimer alami kedua terbanyak di alam setelah selulosa (Sanford & Hutchings 1987). Diperkirakan lebih dari 109-1010 ton kitosan diproduksi di alam tiap tahun (Peter 1997). Indonesia sebagai negara maritim sangat berpotensi menghasilkan kitin dan kitosan. Data statistik menunjukkan bahwa negara yang memiliki industri pengolahan kerang menghasilkan sekitar 56.200 ton limbah/tahun. Limbah tersebut dapat diproses dan diubah menjadi kitosan. Oligomer kitosan adalah produk yang termahal, yaitu senilai $ 60.000/ton (Sandford 2003).
Kitosan memiliki banyak kegunaan diantaranya sebagai bahan pengawet alami dan bahan kosmetik. Selain itu kitosan juga digunakan untuk menekan perkembangan penyakit pada tanaman yang disebabkan oleh cendawan, bakteri dan virus. Wang et al. (2007) melaporkan bahwa pelapisan kitosan dengan konsentrasi 2% pada buah mangga mampu menghambat perkembangan penyakit antraknosa. Selain itu kitosan dilaporkan juga mampu untuk menekan infeksi
Alfalfa mosaic virus (AMV) (Pospieszny et al. 1991) dan infeksi Potato spindle tuber viroid (PSTVd) (Pospieszny 1993). Berdasarkan laporan-laporan tersebut, perlu dikaji potensi kitosan dalam menekan infeksi virus yang berbeda dan pada tanaman yang berbeda.
Tujuan Penelitian
Menguji efektifitas kitosan dalam mengendalikan penyakit virus mosaik pada kacang panjang (VMKP).
Manfaat Penelitian
Manfaat penelitian ini adalah sebagai informasi baru pengendalian penyakit VMKP dengan aplikasi kitosan.
TINJAUAN PUSTAKA
Taksonomi Kacang Panjang
Kacang panjang diklasifikasikan ke dalam divisi Spermatophyta, sub divisi Angiospermae, kelas Dicotyledoneae, ordo Rosales, famili Leguminosae (Papilionaceae), genus Vigna dan spesies Vigna cylindrica (L.) Skeels. Kacang panjang merupakan tanaman yang diduga berasal dari India dan Afrika Tengah. Tanaman ini tumbuh menyebar ke daerah-daerah Asia Tropika sehingga banyak dikenal kacang panjang jenis-jenis lokal yang sesuai dengan keadaan lingkungan tempat tumbuhnya (Haryanto et al. 2007).
Morfologi Kacang Panjang
Tanaman kacang panjang merupakan tanaman semak, menjalar dengan tinggi kurang lebih 2,5 m. Batang tanaman ini tegak, silindris, lunak, berwarna hijau dengan permukaan licin. Daunnya majemuk, lonjong, berseling dengan panjang 6-8 cm, pangkal daun membulat, ujung lancip, pertulangan menyirip, dan berwarna hijau. Bunga tanaman majemuk dan terdapat pada ketiak daun, tangkainya berbentuk silindris, berwarna ungu dan mahkota bunga berbentuk kupu-kupu. Buah tanaman berbentuk polong, berwarna hijau dan panjang 15-25 cm dan biji yang berbentuk lonjong, pipih, berwarna coklat muda. Tanaman ini berakar tunggang dengan warna coklat muda (Hutapea 1994).
Bunga pada kacang panjang memiliki struktur bunga yang lengkap yang dapat menyerbuk sendiri atau silang. Penyerbukan silang terjadi dengan bantuan serangga dengan tingkat keberhasilan 10% dan oleh manusia yang ingin mencoba menyilangkan tanaman kecang panjang untuk mendapatkan varietas unggul (Haryanto et al. 1999).
Hama dan Penyakit Tanaman Kacang Panjang
Hama yang umum menyerang tanaman kacang panjang antara lain: kutudaun Aphis craccivora Koch. (Hemiptera: Aphididae). Kutu daun ini menjadi vektor dari virus mosaik pada tanaman kacang panjang (Blackman & Eastop 2000), Ophiomyia phaseoli Tr. (Diptera: Agromizydae), ulat grayak (Spodoptera
litura) (Lepidoptera: Noctuidae), penggerek polong (Maruca testulalis) (Lepidoptera: Pyralidae) dan tungau merah (Tetranychus cinnabarinus Boisd).
Beberapa patogen yang menginfeksi kacang panjang antara lain: cendawan (Sclerotium rolfsii, Colletotrichum sp. Cercospora canescens, dan Fusarium oxysporum f.sp. phaseoli) dan virus mosaik [Cowpea-aphid borne mosaic virus (CaBMV), Bean common mosaic virus (BCMV) dan Soybean mosaic virus (SMV) ] (Haryanto et al. 2007).
Virus Mosaik Kacang Panjang (VMKP)
Penyakit yang disebabkan oleh virus merupakan salah satu dari beberapa penyakit penting yang dapat menyebabkan kehilangan hasil cukup tinggi. Menurut Agrios (2005) penyakit tumbuhan yang disebabkan oleh virus dapat menyebabkan kerusakan pada daun, batang, akar, buah, biji atau bunga, dan menimbulkan kerugian ekonomi dengan menurunkan hasil dan kualitas produk tumbuhan.
Virus mosaik termasuk kedalam genus Potyvirus yang merupakan salah satu kelompok virus terbesar. Partikel virus berbentuk batang lentur dengan panjang 720-770 nm dan lebar 11-12 nm. Tipe asam nukleatnya utas tunggal (single strand) RNA (ss-RNA). Kandungan asam nukeat dalam partikel virus sebesar 5% sedangkan kandungan protein dalam coat protein sebesar 95% (Shukla et al. 1994).
Virus mosaik pada tanaman kacang panjang (VMKP) merupakan virus yang umum menyerang tanaman kacang-kacangan (Drijfhout 1977) dan beberapa tanaman dari famili Leguminosae (CABI 2005). Virus ini dapat terbawa oleh benih, ditularkan melalui serangga vektor (kutu daun) ataupun dengan sap tanaman. Tanaman kacang-kacangan yang terserang VMKP menunjukkan gejala mosaik dan nekrosis. Tulang daun berwarna hijau tua sedangkan daerah interveinal menjadi hijau muda. Adanya perubahan warna daun biasanya diikuti dengan malformasi daun berupa kerutan, dan menggulung. Tipe gejala yang ditimbulkan ditentukan oleh strain virus itu sendiri, suhu lingkungan pertanaman dan genotipe inang. Bercak dan malformasi daun adalah indikasi bahwa infeksi primer terjadi melalui biji (Galvez 1980). Akibat pertumbuhan terhambat karena terjadinya malformasi daun maka akan mengganggu proses fotosintesis, sehingga
berakibat pada penurunan produksi atau bahkan tidak berproduksi sama sekali (Hadidi et al. 1998).
Kerugian hasil yang diakibatkan oleh suatu penyakit terlihat dari luas serangan, serta intensitas serangan pada suatu area. Dari nilai kerugian hasil tersebut kita dapat mengetahui arti penting suatu penyakit pada suatu lahan. Sebaran penyakit yang disebabkan oleh virus mosaik pada tanaman kacang panjang pada musim hujan lebih rendah dibandingkan pada musim kemarau. Hal ini mungkin disebabkan karena pada musim kemarau jumlah populasi serangga vektor lebih banyak dibandingkan pada musim hujan, sehingga penyebaran penyakit dapat terjadi secara cepat (Lazuardi 2005).
Pengendalian penyakit yang disebabkan oleh VMKP yaitu melakukan eradikasi pada tanaman yang sakit. Hal ini berguna agar tanaman yang terserang VMKP tidak menyebar ke tanaman yang sehat. Pengendalian terhadap serangga vektor dalam hal ini Aphis craccivora dengan penyemprotan insektisida sintetik juga perlu dilakukan. Akan tetapi menurut Marwoso (2005), komoditas sayuran yang akan dikonsumsi langsung seperti kacang panjang, tidak dianjurkan untuk menggunakan insektisida. Hal tersebut disebabkan karena adanya residu insektisida yang dapat berbahaya bagi konsumen. Dari hasil penelitian yang telah dilakukannya, Plant Growth-Promoting Rhizobacteria (PGPR) mampu mengurangi berkembangnya tunas abnormal dan malformasi ukuran daun. Selain itu Jacob & Parlevliet (1993) melaporkan bahwa pengendalian dengan menggunakan varietas tahan merupakan salah satu komponen yang dapat dilakukan didalam program pengendalian hama terpadu dan merupakan tindakan preventif atau pencegahan. Setyastuti (2008), melaporkan bahwa sembilan kultivar kacang panjang (Bogor Hijau I, Asparagus, KP 888, Asri II, Sakura, KP 777, Dondot, Iguma dan Landung) menunjukkan respon rentan terhadap infeksi virus ini. Oleh karena itu dibutuhkan agen penginduksi yang dapat meningkatkan ketahanan sisemik tanaman.
Mekanisme pertahanan inang terhadap patogen terdiri dari pertahanan struktural melalui hambatan fisik yang menekan patogen saat masuk ke dalam tanaman dan pertahanan biokimia sel serta jaringan tanaman dengan memproduksi substansi yang bersifat toksin terhadap patogen (Agrios 2005). Matthews (1991)
juga melaporkan bahwa mekanisme reaksi ketahanan tanaman terhadap infeksi virus dibedakan menjadi tiga kelompok yaitu tanaman resisten, tanaman toleran dan tanaman rentan. Tanaman resisten menunjukkan reaksi hipersensitif dengan mematikan sel-sel terlokalisasi pada tempat yang diinfeksi tanpa penyebaran virus lanjut sehingga pertumbuhan patogen dapat dibatasi. Pada tanaman toleran, virus dapat bereplikasi dan menyebar kedalam tanaman tetapi pengaruhnya terhadap hasil hanya sedikit. Pada tanaman rentan, virus bereplikasi dan menyebar kedalam tanaman yang mengakibatkan pengaruh terhadap hasil yang signifikan bahkan kematian pada tanaman.
Salah satu agen yang dapat menginduksi ketahanan sistemik suatu tanaman adalah ekstrak tumbuhan (Hadidi et al. 1998). Induksi ketahanan sistemik tanaman menggunakan ekstrak daun Clerodendrum japonicum (bunga pagoda), Chenopodium amarinticolor, Mirabilis jalapa (bunga pukul empat) dan Androgaphis paniculata (sambiloto), cukup efektif dalam menekan infeksi virus mosaik pada tanaman kacang panjang tanpa mempengaruhi pertumbuhan tinggi tanaman, masa berbunga dan jumlah bobot basah polong (Kurnianingsih 2010).
Kitosan
Kitosan adalah kitin yang telah dihilangkan gugus asetilnya dan hanya menyisakan gugus amina bebas yang menjadikannya bersifat polikationik dan merupakan polimer rantai linier glukosamin. Berat molekul kitosan sekitar 1,036 x 105 dalton tergantung proses pembuatannya. Kitosan mudah mengalami degradasi secara biologi, tidak beracun dan tidak larut pada pH diatas 6,5 (Kurt et al. 1991).
Kitosan merupakan polisakarida yang diperoleh dari kulit terluar dari krustacea seperti kepiting dan udang (Sandford & Hutchings 1987; Sandford, 1989). Kitosan mempunyai muatan positif dengan banyak polimer yang secara fisiologis dan biologis unik dan digunakan dalam berbagai bidang industri seperti tata rias (lotion dan krim wajah), makanan (pengawet, antioksidan, antimikroba), bioteknologi, farmakologi dan obat-obatan serta pertanian (fungisida, elisitor) (Ren et al. 2001.).
Penelitian menggunakan kitosan dalam pengendalian berbagai jenis patogen seperti cendawan, bakteri dan virus saat ini telah banyak dilakukan.
Kitosan bukan hanya efektif dalam menghentikan pertumbuhan patogen, tetapi juga merubah morfologi, struktur dan disorganisasi molekul dari sel jamur (Benhamou 1996).
Pertumbuhan miselium dapat dihentikan atau menjadi lambat ketika media pertumbuhan jamur menggunakan kitosan. Peningkatan konsentrasi kitosan mengakibatkan pertumbuhan Alternaria alternata, Botrytis cinerea, Colletrotichum gloeosporioides dan Rhizopus stolonifer, menurun (El Ghaouth et al. 1992). Hal yang sama dilaporkan pada Sclerotinia sclerotiorum saat konsentrasi kitosan ditingkatkan dari 1% sampai 4% (Cheah et al. 1997). Penelitian lain menunjukkan penurunan pertumbuhan linier dari Rhizoctonia fragariae dengan konsentrasi kitosan yang meningkat secara bertahap 0,5-6,0 mg/ml (Wade & Lamondia 1994). Pertumbuhan miselium Fusarium solani f.sp. phaseoli dan F. solani f.sp pisi dapat dihambat dengan kitosan pada konsentrasi rendah, masing-masing 12 mg/ml dan 18 mg/ml (Hadwiger & Beckman 1980; Kendra & Hadwiger 1984). Kitosan mempunyai sifat anticendawan dan lebih baik dari kitin. Jika kitosan ditambahkan pada tanah, maka akan menstimulir pertumbuhan mikroba yang dapat mengurai cendawan. Selain itu kitosan dapat merangsang akumulasi fitoaleksin jaringan tanaman inang, kitinase, β glukanase dan lipoksigenase yang berguna untuk menghambat infeksi cendawan pada jaringan tanaman (Vasyukova et al. 2001).
Kitosan juga dapat memberikan pengaruh hambatan pada penyakit tanaman yang disebabkan oleh virus dan viroid dengan meningkatkan respon hipersensitif inang terhadap infeksi virus (Pospieszny et al. 1991). Sebagai contoh, pada daun kacang, infeksi lokal yang disebabkan oleh Alfalfa mosaic virus (AMV) dapat ditekan dengan penyemprotan kitosan 0,1% atau ditambahkan pada inokulum (Pospieszny et al. 1991). Hal tersebut juga dilaporkan pada daun tomat yang terinfeksi Potato spindle tuber viroid (PSTVd) dan diberi perlakukan dengan kitosan pada konsentrasi yang sama (Pospieszny 1997).
ELISA (Enzyme-linked immunosorbent Assays)
Metode deteksi virus dapat dibagi dalam beberapa metode seperti metode berdasarkan asam nukleat dan sifat protein. Metode deteksi virus yang didasarkan pada sifat asam nukleatnya umumnya dilakukan melalui teknik hibridisasi yakni menggunakan agen pelacak untuk mendeteksi virus dan polymerase chain reaction (PCR) yang mengamplifikasi rangkaian DNA dan divisualisasi menggunakan analisis gel elektroforesis. Sedangkan metode deteksi virus yang didasarkan pada sifat proteinnya umumnya dilakukan melalui teknik serologi dan elektroforesis yang memisahkan protein berdasarkan ukuran dan muatan.
Uji ELISA merupakan salah satu metode serologi yang banyak digunakan untuk mendeteksi virus. Uji ini mudah dilakukan, cepat, sensitif, akurat dan dapat digunakan untuk menguji sampel dalam jumlah yang banyak. Metode tersebut didasarkan pada konjugasi antar virus-antibodi dan enzim dengan menambahkan substrat pewarna, maka dapat diperlihatkan adanya konjugasi tersebut (Strange 2003).
Metode yang paling umum dalam uji ELISA yaitu double antibody sandwich ELISA (DAS ELISA) dan indirect ELISA. Dalam metode DAS ELISA, virus diikat oleh antibodi spesifik yang kemudian bereaksi lagi dengan antibodi spesifik yang telah diikat oleh enzim. Keuntungannya adalah memiliki spesifitas yang tinggi (Hadidi et al. 1998). Dalam metode indirect ELISA, uji didasarkan dengan adanya ikatan enzim dengan molekul antibodi yang dapat dideteksi oleh antiviral immunoglobulin.
ELISA memiliki keuntungan yaitu konsentrasi virus yang sangat rendah dapat dideteksi, penggunaan antibodi dalam jumlah yang sedikit, dapat digunakan untuk virus kasar maupun suspensi virus murni, cocok untuk menguji sampel dalam jumlah besar, dapat dilakukan dengan menggunakan kit dan dapat diuji secara kuantitatif (Djikstra & De Jager 1998).
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai Januari hingga Juli 2010, bertempat di Rumah Kaca Kebun Percobaan IPB Cikabayan Darmaga, Bogor dan Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Bahan dan Alat
Bahan yang digunakan pada penelitian ini adalah larutan kitosan 1% dan kitosan 0,1%, tanaman kacang panjang kultivar Parade, air, tanah, pupuk, inokulum bergejala VMKP, mercaptoethanol, carborundum, aquades, antiserum BCMV strain Peanut Stripe, dan general Potyvirus, Bufer phosphat, PNP, serta bufer-bufer ELISA.
Alat yang digunakan adalah gelas ukur, mortar, pistil, sarung tangan, timbangan digital, hand sprayer, polybag, pipet mikro, plate ELISA, dan ELISA Reader.
Metode Penelitian Perbanyakan Inokulum
Daun tanaman kacang panjang yang bergejala mosaik sebelumnya dideteksi secara serologi dengan metode ELISA menggunakan antiserum BCMV strain Peanut Stripe dan general Potyvirus. Hasil deteksi menunjukkan bahwa sampel negatif terhadap BCMV strain Peanut Stripe dan positif terhadap antiserum general Potyvirus. Hasil perunutan DNA parsial gen coat protein mengkonfirmasi bahwa VMKP yang digunakan adalah Bean common mosaic virus (Damayanti 2010; data sekuen tidak dipublikasikan). Inokulum kemudian diinokulasi dan diperbanyak ke tanaman kacang panjang yang sehat untuk sumber inokulum. Inokulasi dilakukan pada tanaman kacang panjang yang berumur 7 hari setelah tanam (HST).
Penanaman Kacang Panjang
Kacang panjang yang digunakan adalah kacang panjang kultivar Parade. Kacang panjang ditanam pada media tanam tanah dan pupuk kandang dengan
perbandingan 2:1 di dalam polybag. Untuk setiap polybag ditanam 3 benih kacang panjang. Pada saat tanaman telah berumur 7 hari, setiap polybag dipilih satu tanaman dengan pertumbuhan yang baik. Pada saat tanaman telah berumur 18 hari, setiap polybag diberi ajir yang berguna untuk memudahkan tanaman tumbuh menjalar dan diikat dengan menggunakan tali rafia.
Pembuatan Larutan Kitosan
Konsentrasi Kitosan yang digunakan pada penelitian ini sebesar 0,1% dan 1%. Kitosan diperoleh dari Laboratorium Teknologi Hasil Perikanan FPIK IPB dengan konsentrasi 6%. Kitosan dengan konsentrasi 0,1% dan 1 % diperoleh dengan cara diencerkan. Kitosan dengan konsentrasi 6% diencerkan menggunakan aquades dengan pengenceran 6 kali untuk kitosan 1% dan pengenceran 60 kali untuk memperoleh kitosan 0,1%.
Perlakuan
Adapun perlakuan yang digunakan adalah sebagai berikut ; (1) Perlakuan kitosan 0,1% pada benih (PB0,1)
(2) Perlakuan kitosan 1% pada benih (PB1)
(3) Perlakuan kitosan 0,1% sebelum inokulasi (SB0,1) (4) Perlakuan kitosan 1% sebelum inokulasi (SB1) (5) Perlakuan kitosan 0,1% setelah inokulasi (ST0,1) (6) Perlakuan kitosan 1% setelah inokulasi (ST1)
(7) Kontrol tanpa perlakuan kitosan yang diinokulasi dengan virus (K+) (8) Kontrol sehat (K-)
Perlakuan kitosan sebelum inokulasi (SB) dilakukan pada saat tanaman berumur 5 HST sedangkan perlakuan kitosan setelah inokulasi (ST) dilakukan pada saat tanaman berumur 9 HST. Penyemprotan pada daun dilakukan merata keseluruh permukaan daun.
Inokulasi Tanaman Uji
Tanaman kacang panjang yang telah berumur 7 HST siap untuk diinokulasi dengan virus. Inokulum digerus menggunakan mortar dan pistil steril bersama bufer phosphat yang mengandung 1% mercaptoethanol (ditambahkan sebelum digunakan), dengan perbandingan inokulum dan bufer adalah 1:10.
Inokulum yang terdapat pada mortar dipersiapkan di atas es. Daun pertama kacang panjang ditaburi
mekanis. Setelah diinokulasi daun dibilas dengan aquades.
Adapun parameter pengamatan yang diamati adalah sebagai berikut; Perkembangan Penyakit
Parameter yang digunakan
yaitu waktu inkubasi, kejadian penyakit, keparahan penyakit, dan akumulasi virus yang dideteksi dengan ELISA. Masa
sampai terjadinya gejala pertama yang muncul pada tanaman sedangkan kejadian penyakit diamati hingga akhir penelitian.
Perhitungan keparahan penyakit ditentukan dengan menggunakan skala yang telah ditentukan sebelum
pada saat tanaman berumur 2 MSI dan 4 MSI. Adapun skala yang digunakan seperti yang telah digunakan oleh
berikut:
0 = Tanaman tidak menunjukkan gejala 1 = Gejala mosaik rin
2 = Gejala mosaik sedang 3 = Gejala mosaik berat
4 = Gejala mosaik berat dengan malformasi daun yang parah, kerdil, atau mati.
Gambar 1 Skala untuk kearahan penyakit. (a) skor 0; (b) skor skor 3;(e)
Nilai akumulasi virus dari hasil ELISA digunakan untuk menghitung persentase penghambatan virus akibat perlakuan kitosan dengan rumus sebagai berikut:
Inokulum yang terdapat pada mortar dipersiapkan di atas es. Daun pertama kacang panjang ditaburi carborundum 600 mesh, lalu sap diinokulasi secara mekanis. Setelah diinokulasi daun dibilas dengan aquades.
Parameter Pengamatan
meter pengamatan yang diamati adalah sebagai berikut; Perkembangan Penyakit
Parameter yang digunakan untuk mengetahui perkembangan penyakit yaitu waktu inkubasi, kejadian penyakit, keparahan penyakit, dan akumulasi virus yang dideteksi dengan ELISA. Masa inkubasi dihitung sejak inokulasi virus sampai terjadinya gejala pertama yang muncul pada tanaman sedangkan kejadian
diamati hingga akhir penelitian.
Perhitungan keparahan penyakit ditentukan dengan menggunakan skala yang telah ditentukan sebelum dilakukan pengamatan. Pengamatan dilakukan pada saat tanaman berumur 2 MSI dan 4 MSI. Adapun skala yang digunakan seperti yang telah digunakan oleh Kurnianingsih (2010) (Gambar 1) sebagai
0 = Tanaman tidak menunjukkan gejala
1 = Gejala mosaik ringan disertai pemucatan tulang daun 2 = Gejala mosaik sedang
3 = Gejala mosaik berat
4 = Gejala mosaik berat dengan malformasi daun yang parah, kerdil, atau mati.
Skala untuk kearahan penyakit. (a) skor 0; (b) skor 1; (c) skor 2;(d) skor 3;(e) skor 4
Nilai akumulasi virus dari hasil ELISA digunakan untuk menghitung persentase penghambatan virus akibat perlakuan kitosan dengan rumus sebagai Inokulum yang terdapat pada mortar dipersiapkan di atas es. Daun pertama 600 mesh, lalu sap diinokulasi secara
meter pengamatan yang diamati adalah sebagai berikut;
untuk mengetahui perkembangan penyakit yaitu waktu inkubasi, kejadian penyakit, keparahan penyakit, dan akumulasi virus inkubasi dihitung sejak inokulasi virus sampai terjadinya gejala pertama yang muncul pada tanaman sedangkan kejadian
Perhitungan keparahan penyakit ditentukan dengan menggunakan skala dilakukan pengamatan. Pengamatan dilakukan pada saat tanaman berumur 2 MSI dan 4 MSI. Adapun skala yang digunakan (2010) (Gambar 1) sebagai
4 = Gejala mosaik berat dengan malformasi daun yang parah, kerdil, atau mati.
; (c) skor 2;(d)
Nilai akumulasi virus dari hasil ELISA digunakan untuk menghitung persentase penghambatan virus akibat perlakuan kitosan dengan rumus sebagai
Nilai rata-rata penghambatan penyakit,
Pertumbuhan Tanaman
Pertumbuhan tanaman yang diamati adalah tinggi tanaman, diameter batang, masa berbunga, jumlah daun dan bobot kering tanaman. Penghitungan tinggi dan diameter tanaman dilakukan pada 2, 4, 6, 8 minggu se
(MSI) (2, 4, 6, 8 MSI = 21, 35, 49, 63 HST) . Jumlah daun dihitung pada 7 MSI dan bobot kering dihitung diakhir masa penelitian.
Konsentrasi virus pada tanaman kacang panjang ditentukan dengan ACP-ELISA (
menggunakan antiserum dengan manual pembuatnya menggunakan ELISA
Percobaan ini disusun dalam Rancangan acak l perlakuan dengan masing
analisis sidik ragam dan pada taraf nyata α = 5%
rata skoring keparahan digunakan untuk meghitung persentase penghambatan penyakit, dengan rumus sebagai berikut:
Pertumbuhan Tanaman
Pertumbuhan tanaman yang diamati adalah tinggi tanaman, diameter batang, masa berbunga, jumlah daun dan bobot kering tanaman. Penghitungan tinggi dan diameter tanaman dilakukan pada 2, 4, 6, 8 minggu se
(MSI) (2, 4, 6, 8 MSI = 21, 35, 49, 63 HST) . Jumlah daun dihitung pada 7 MSI dan bobot kering dihitung diakhir masa penelitian.
ELISA
Konsentrasi virus pada tanaman kacang panjang ditentukan
ELISA (Antigen coated-plate enzyme-linked immunosorbent assay menggunakan antiserum Potyvirus (DSMZ). Prosedur yang digunakan
dengan manual pembuatnya (DSMZ). Kuantifikasi virus dilakukan dengan menggunakan ELISA Reader pada panjang gelombang 405 nm.
Analisis Data
Percobaan ini disusun dalam Rancangan acak lengkap (RAL)
asing-masing perlakuan 9 tanaman uji. Data diolah dengan dan dilanjutkan dengan uji selang berganda Duncan
α = 5% menggunakan SAS versi 6.12.
oring keparahan digunakan untuk meghitung persentase
Pertumbuhan tanaman yang diamati adalah tinggi tanaman, diameter batang, masa berbunga, jumlah daun dan bobot kering tanaman. Penghitungan tinggi dan diameter tanaman dilakukan pada 2, 4, 6, 8 minggu setelah inokulasi (MSI) (2, 4, 6, 8 MSI = 21, 35, 49, 63 HST) . Jumlah daun dihitung pada 7 MSI
Konsentrasi virus pada tanaman kacang panjang ditentukan secara serologi linked immunosorbent assay) Prosedur yang digunakan sesuai . Kuantifikasi virus dilakukan dengan
engkap (RAL) terdiri dari 8 masing perlakuan 9 tanaman uji. Data diolah dengan Duncan (DMRT)
HASIL DAN PEMBAHASAN
Pengaruh Perlakuan Kitosan terhadap Waktu Inkubasi dan Tipe Gejala Waktu inkubasi merupakan tenggang waktu antara masuknya virus
hingga timbulnya gejala pertama pada tanaman (Boss, 1990). Dari hasil penelitian ini waktu inkubasi yang diperoleh beragam untuk masing-masing perlakuan. Rata-rata waktu inkubasi tersebut dapat dilihat pada tabel 1.
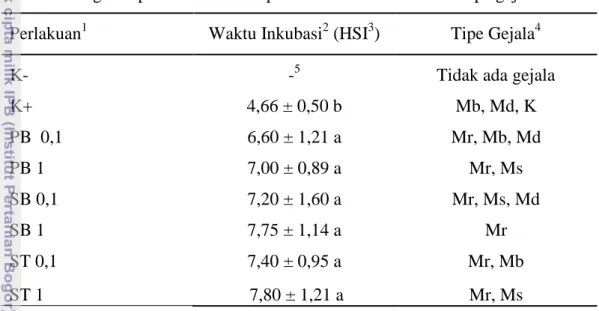
Tabel 1 Pengaruh perlakuan terhadap waktu inkubasi virus dan tipe gejala
Perlakuan1 Waktu Inkubasi2 (HSI3) Tipe Gejala4
K- -5 Tidak ada gejala
K+ 4,66 ± 0,50 b Mb, Md, K PB 0,1 6,60 ± 1,21 a Mr, Mb, Md PB 1 7,00 ± 0,89 a Mr, Ms SB 0,1 7,20 ± 1,60 a Mr, Ms, Md SB 1 7,75 ± 1,14 a Mr ST 0,1 7,40 ± 0,95 a Mr, Mb ST 1 7,80 ± 1,21 a Mr, Ms 1
K- : Kontrol negatif; K+ : Kontrol positif; PB0,1 : Perlakuan benih dengan kitosan 0,1%; PB1 : Perlakuan benih dengan kitosan 1%; SB0,1 : Perlakuan sebelum inokulasi dengan kitosan 0,1%; SB1 : Perlakuan sebelum inokulasi dengan kitosan 1%; ST0,1 : Perlakuan setelah inokulasi dengan kitosan 0,1%; ST1 : Perlakuan setelah inokulasi dengan kitosan 1%.
2
angka yang diikuti huruf mutu berbeda menunjukkan hasil berbeda nyata (uji selang ganda Duncan α = 0,05).
3
HSI : Hari setelah inokulasi
4 Ket: Mr= mosaik ringan; Ms= mosaik sedang; Mb= mosaik berat; Md= malformasi daun; K= kerdil 5
- = tidak ada
Tanaman yang diberi perlakuan kitosan dengan konsentrasi dan waktu perlakuan yang berbeda memiliki waktu inkubasi yang berbeda nyata dengan kontrol positif, namun antar perlakuan kitosan tidak menimbulkan perbedaan waktu inkubasi yang signifikan. Waktu inkubasi yang dibutuhkan virus untuk menunjukkan gejala pada kontrol positif rata-rata 5 hari. Sedangkan waktu inkubasi tanaman yang diberi perlakuan kitosan rata-rata 7-8 hari. Hasil tersebut menunjukkan bahwa perlakuan kitosan memperpanjang waktu inkubasi. Hal ini diduga karena kemampuan kitosan dalam menginduksi ketahanan tanaman menjadikan waktu inkubasi virus semakin lebih panjang.
Tipe gejala merupakan ekspresi dari tanaman akibat adanya gangguan
fungsi fisiologis baik disebabkan oleh patogen maupun kekurangan unsur hara. Gejala yang terekspresi akibat infeksi VMKP juga beragam. Pada kontrol positif tipe gejala yang muncul berupa mosaik berat, malformasi daun, dan kerdil. Sedangkan untuk setiap perlakuan kitosan tipe gejala yang muncul adalah mosaik ringan, mosaik sedang, mosaik berat, dan malformasi daun tergantung pada jenis perlakuan. Perbedaan konsentrasi dan waktu aplikasi yang dilakukan menimbulkan respon yang berbeda pada tanaman. Pada perlakuan kitosan 1% (PB1, SB1, ST1) gejala yang tampak yaitu mosaik ringan hingga sedang. Sedangkan pada perlakuan kitosan 0,1% (PB0,1, SB0,1, ST0,1) gejala yang tampak yaitu mosaik berat bahkan malformasi daun. Dari data ini terlihat bahwa gejala tanaman yang diberi perlakuan kitosan 1% lebih ringan dibandingkan dengan perlakuan kitosan 0,1% dan kontrol positif (Tabel 1).
Pengaruh Perlakuan Kitosan terhadap Kejadian Penyakit dan Keparahan Penyakit
Pengamatan kejadian penyakit dan keparahan penyakit sangat dibutuhkan untuk melihat pengaruh penghambatan kitosan terhadap perkembangan virus. Kejadian penyakit menunjukkan keberadaan suatu patogen pada tanaman. Sedangkan keparahan sangat berpengaruh akan jumlah kehilangan hasil yang mungkin terjadi akibat keberadaan patogen pada tanaman.
Kejadian Penyakit. Beberapa tanaman yang diberi perlakuan kitosan
menunjukkan tidak terserang oleh VMKP meskipun telah diinokulasi secara mekanis. Kejadian penyakit dengan perlakuan kitosan 1% dengan waktu aplikasi yang berbeda (PB1, SB1 dan ST1) yaitu dari 9 tanaman yang diinokulasi dengan virus, tiga tanaman diantaranya tidak terinfeksi VMKP. Sedangkan kejadian penyakit dengan perlakuan kitosan 0,1% dengan waktu aplikasi yang berbeda (PB0,1, SB0,1 dan ST0,1) yaitu dari 9 tanaman yang diinokulasi dengan virus ini dua tanaman diantaranya tidak terinfeksi virus (Tabel 2). Data ini menunjukkan bahwa perlakuan kitosan 1% (PB1, SB1 dan ST1) mampu menekan infeksi VMKP dengan baik.
Keparahan Penyakit. Perlakuan kitosan dengan konsentrasi 0,1% dan 1%
serta waktu aplikasi yang berbeda menunjukkan mampu menekan keparahan infeksi virus bila dibandingkan dengan kontrol tanaman sakit tanpa perlakuan kitosan (Tabel 2). Hal ini menunjukkan bahwa perlakuan kitosan 1% (PB1, SB1, ST1) memiliki nilai keparahan penyakit yang lebih rendah bila dibandingkan dengan perlakuan kitosan 0,1% maupun kontrol tanaman yang diinokulasi virus (K+) pada pengamatan 4 MSI. Adanya perbedaan konsentrasi sangat berpengaruh terhadap kemampuan untuk menghambat infeksi VMKP ini. Kitosan 1% lebih baik bila dibandingkan dengan kitosan dengan konsentrasi 0,1% dalam menekan VMKP.
Tabel 2 Pengaruh perlakuan terhadap kejadian penyakit (KP), keparahan penyakit. Perlakuan1 KP (n/N) 3 Keparahan 2 K- 0/9 0,00 ± 0,00 c K+ 9/9 3,11 ± 0,19 a PB 0.1 7/9 1,77 ± 0,69 b PB 1 6/9 1,33 ± 0,67 b SB 0.1 7/9 1,77 ± 0,19 b SB 1 6/9 1,11 ± 0,19 bc ST 0.1 7/9 1,88 ± 0,76 b ST 1 6/9 1,10 ± 0,69 bc
1 K- : Kontrol negatif; K+ : Kontrol positif; PB0,1 : Perlakuan benih dengan kitosan 0,1%; PB1 : Perlakuan
benih dengan kitosan 1%; SB0,1 : Perlakuan sebelum inokulasi dengan kitosan 0,1%; SB1 : Perlakuan sebelum inokulasi dengan kitosan 1%; ST0,1 : Perlakuan setelah inokulasi dengan kitosan 0,1%; ST1 : Perlakuan setelah inokulasi dengan kitosan 1%.
2
angka yang diikuti huruf mutu berbeda menunjukkan hasil berbeda nyata (uji selang ganda Duncan α = 0,05).
3
n/N : Jumlah tanaman yang terinfeksi/ Jumlah tanaman yang diamati.
Pengaruh Perlakuan Kitosan terhadap Akumulasi Virus, Penghambatan Virus, Penghambatan Penyakit.
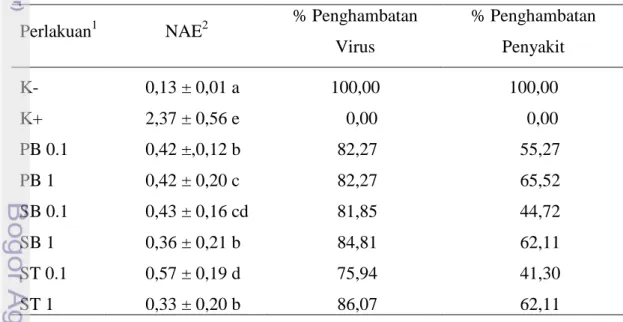
Akumulasi Virus. NAE (Nilai Absorban Elisa) adalah nilai absorbansi
virus untuk mendapatkan gambaran kuantitatif virus yang terdapat pada setiap tanaman perlakuan. Selain itu berdasarkan NAE, dapat digunakan untuk konfirmasi kejadian penyakit pada tiap perlakuan. Akumulasi virus (NAE) dari semua perlakuan kitosan dengan konsentrasi dan waktu aplikasi yang berbeda
memiliki nilai yang nyata lebih rendah jika dibandingkan dengan kontrol positif (Tabel 3). Akumulasi virus pada perlakuan SB1 dan ST1 menunjukkan NAE yang nyata lebih rendah bila dibandingkan dengan kontrol positif dan perlakuan kitosan lainnya. Hal ini mungkin disebabkan karena konsentrasi kitosan yang digunakan lebih tinggi dan waktu aplikasi yang dilakukan lebih tepat bila dibandingkan dengan perlakuan lainnya.
Penghambatan Virus. Kemampuan kitosan 0,1% (PB0,1 dan SB0,1) dan
1% (PB1, SB1 dan ST1) dalam menghambat virus cukup tinggi. Kecuali ST0,1, semua perlakuan kitosan lainnya menunjukkan penghambatan virus lebih dari 80% (Tabel 3).
Penghambatan Penyakit. Persentase penghambatan penyakit pada
perlakuan kitosan 1% (PB1, SB1, dan ST1) lebih tinggi jika dibandingkan dengan kontrol tanaman yang diinokulasi dengan virus (K+) dan perlakuan kitosan lainnya yaitu sebesar 62% dan 65%, sedangkan persentase penghambatan perlakuan kitosan 0,1% lebih rendah yaitu berkisar antara 40%-50% (Tabel 3).
Tabel 3 Pengaruh perlakuan kitosan terhadap akumulasi virus, penghambatan virus dan penghambatan penyakit.
Perlakuan1 NAE2 % Penghambatan
Virus % Penghambatan Penyakit K- 0,13 ± 0,01 a 100,00 100,00 K+ 2,37 ± 0,56 e 0,00 0,00 PB 0.1 0,42 ±,0,12 b 82,27 55,27 PB 1 0,42 ± 0,20 c 82,27 65,52 SB 0.1 0,43 ± 0,16 cd 81,85 44,72 SB 1 0,36 ± 0,21 b 84,81 62,11 ST 0.1 0,57 ± 0,19 d 75,94 41,30 ST 1 0,33 ± 0,20 b 86,07 62,11 1
K- : Kontrol negatif; K+ : Kontrol positif; PB0,1 : Perlakuan benih dengan kitosan 0,1%; PB1 : Perlakuan benih dengan kitosan 1%; SB0,1 : Perlakuan sebelum inokulasi dengan kitosan 0,1%; SB1 : Perlakuan sebelum inokulasi dengan kitosan 1%; ST0,1 : Perlakuan setelah inokulasi dengan kitosan 0,1%; ST1 : Perlakuan setelah inokulasi dengan kitosan 1%.
2
NAE: Nilai absorban ELISA. Angka yang diikuti huruf yang berbeda pada kolom yang sama menunjukkan hasil berbeda nyata (uji selang ganda Duncan α = 0,05)
Pengaruh Perlakuan Kitosan terhadap Tinggi Tanaman
Pada minggu ke-2 semua perlakuan kitosan tidak menunjukkan pertumbuhan tinggi tanaman yang berbeda nyata dengan kontrol tanaman sehat dan kontrol tanaman sakit. Sedangkan pada minggu ke-4 perlakuan benih (PB1) menunjukkan tinggi yang nyata lebih baik bila dibandingkan dengan kontrol tanaman yang diinokulasi dengan virus (K+). Penghambatan pertumbuhan mulai terlihat pada 4 MSI, dimana tanaman yang tidak diinokulasi dengan virus (K-) memiliki tinggi yang nyata lebih baik bila dibandingkan dengan tanaman yang diinokulasi dengan virus (K+). Pada 6 MSI semua perlakuan kitosan kecuali SB 0,1 meningkatkan tinggi secara nyata lebih baik bila dibandingkan dengan kontrol tanaman yang diinokulasi virus (K+), sedangkan pada 8 MSI semua tanaman yang diberi perlakuan kitosan menunjukkan tinggi yang sama dengan kontrol sehat; dan lebih tinggi bila dibandingkan dengan K+ (Tabel 4).
Tabel 4 Pengaruh perlakuan kitosan terhadap tinggi tanaman
Perlakuan1 Pertumbuhan Tinggi 2
(cm)
2 MSI 4 MSI 6 MSI3 8 MSI
K- 69,3 ± 14,8 a 167,2 ± 42,1 a 211,1 ± 51,9 a 225,3 ± 53,3 a K+ 62,9 ± 12,0 a 119,9 ± 19,1 b 156,2 ± 21,4 b 164,5 ± 24,4 b PB 0,1 64,9 ± 8,5 a 141,6 ± 24,8 ab 195,3 ± 22,0 a 215,4 ± 31,3 a PB 1 73,6 ± 17,2 a 171,1 ± 37,1 a 216,6 ± 38,8 a 233,6 ± 47,6 a SB 0,1 67,7 ± 20,5 a 154,0 ± 36,6 ab 188,5 ± 42,0 ab 207,6 ± 43,5 a SB 1 67,2 ± 18,2 a 146,1 ± 14,4 ab 190,5 ± 20,1 a 209,8 ± 35,2 a ST 0,1 72,4 ± 7,1 a 150,0 ± 21,2 ab 191,8 ± 22,6 a 213,1 ± 27,6 a ST 1 69,4 ± 7,8 a 154,5 ± 28,9 ab 200,2 ± 40,9 a 218,4 ± 30,4 a 1
K- : Kontrol negatif; K+ : Kontrol positif; PB0,1 : Perlakuan benih dengan kitosan 0,1%; PB1 : Perlakuan benih dengan kitosan 1%; SB0,1 : Perlakuan sebelum inokulasi dengan kitosan 0,1%; SB1 : Perlakuan sebelum inokulasi dengan kitosan 1%; ST0,1 : Perlakuan setelah inokulasi dengan kitosan 0,1%; ST1 : Perlakuan setelah inokulasi dengan kitosan 1%.
2
angka yang diikuti huruf yang berbeda pada kolom yang sama menunjukkan hasil berbeda nyata (uji selang ganda Duncan α =0,05)
3
MSI : Minggu setelah inokulasi
Pengaruh kitosan terhadap pertumbuhan tanaman, dapat dilihat pada gambar 2. Tanaman yang diinokulasi virus tanpa diberi perlakuan kitosan (K+) pertumbuhannya terhambat bahkan kerdil. Agrios (2005) menyatakan bahwa
infeksi virus dapat menyebabkan metabolisme yang ada di dalam sel terganggu dan mengakibatkan terjadinya perubahan biokimiawi dan fisiologi sel, sehingga pertumbuhan tanaman akan berbeda bila dibandingkan dengan tanaman sehat. Tanaman yang diberi perlakuan kitosan secara visual juga terlihat lebih baik bila dibandingkan dengan kontrol tanaman sakit (K+). Dari hasil ini terlihat bahwa kitosan memiliki pengaruh yang baik untuk pertumbuhan tanaman meskipun tanaman tersebut terinfeksi oleh virus.
Gambar 2 Perbandingan tinggi anatara perlakuan kitosan dengan kontrol
Pengaruh Perlakuan Kitosan terhadap Diameter Batang
Perlakuan kitosan dapat meningkatkan diameter batang tanaman kacang panjang. Pada 2, 4, 6, dan 8 MSI perlakuan kitosan 1% (PB1, SB1dan ST1) menunjukkan diameter batang yang lebih besar bila dibandingkan dengan kontrol tanaman yang diinokulasi dengan virus (K+), sedangkan tanaman yang diberi perlakuan kitosan 0,1% pada 2, 4, 6, dan 8 MSI menunjukkan diameter batang yang lebih kecil dan tidak berbeda nyata bila dibandingkan dengan kontrol tanaman yang diinokulasi dengan virus (K+). Akan tetapi secara umum semua tanaman yang diberi perlakuan kitosan dan diinfeksi virus menunjukkan pertumbuhan dan diameter batangnya tidak berbeda nyata dengan tanaman sehat (Tabel 5)
Tabel 5 Pengaruh perlakuan kitosan terhadap diameter batang
Perlakuan1
Diameter Batang (cm)
2 MSI2 4 MSI 6 MSI3 8 MSI
K- 0,27 ± 0,03 abc 0,31 ± 0,03 ab 0,32 ± 0,03 a 0,32 ± 0,04 a K+ 0,24 ± 0,04 c 0,25 ± 0,04 c 0,26 ± 0,05 b 0,26 ± 0,05 b PB 0,1 0,26 ± 0,02 bc 0,28 ± 0,01 abc 0,29 ± 0,02 ab 0,30 ± 0,02 ab PB 1 0,31 ± 0,05 ab 0,33 ± 0,05 ab 0,34 ± 0,05 a 0,36 ± 0,05 a SB 0,1 0,27 ± 0,04 abc 0,29 ± 0,05 abc 0,30 ± 0,05 ab 0,32 ± 0,04 a SB 1 0,31 ± 0,06 a 0,33 ± 0,06 a 0,34 ± 0,05 a 0,35 ± 0,05 a ST 0,1 0,27 ± 0,03 abc 0,29 ± 0,03 abc 0,30 ± 0,03 ab 0,30 ± 0,04 ab ST 1 0,30 ± 0,04ab 0,31 ± 0,04 ab 0,32 ± 0,04 a 0,33 ± 0,04 a 1
K- : Kontrol negatif; K+ : Kontrol positif; PB0,1 : Perlakuan benih dengan kitosan 0,1%; PB1 : Perlakuan benih dengan kitosan 1%; SB0,1 : Perlakuan sebelum inokulasi dengan kitosan 0,1%; SB1 : Perlakuan sebelum inokulasi dengan kitosan 1%; ST0,1 : Perlakuan setelah inokulasi dengan kitosan 0,1%; ST1 : Perlakuan setelah inokulasi dengan kitosan 1%.
2
angka yang diikuti huruf yang berbeda pada kolom yang sama menunjukkan hasil berbeda nyata (uji selang ganda Duncan α =0,05)
3
MSI : Minggu setelah inokulasi
Pengaruh Perlakuan Kitosan terhadap Jumlah Daun, Masa Berbunga dan Bobot Kering
Jumlah daun. Pengamatan jumlah daun dilakukan pada 4 MSI (minggu
setelah inokulasi). Perlakuan (PB1, SB1, ST0,1 dan ST1) menyebabkan jumlah daun yang nyata lebih banyak bila dibandingkan dengan kontrol sakit. Rata-rata jumlah daun hasil perlakuan tersebut berkisar antara 10-12 daun (Tabel 6). Hasil tersebut menunjukkan bahwa perlakuan kitosan sangat baik untuk pertumbuhan daun pada tanaman.
Masa Berbunga. Hasil analisis statistik menunjukkan bahwa rata-rata
masa berbunga dari semua perlakuan tidak menunjukkan perbedaan yang nyata bila dibandingkan dengan kontrol (Tabel 6). Akan tetapi perlakuan kitosan 1% (PB 1, SB 1, ST1) rata- rata memiliki interval masa berbunga yang cenderung lebih cepat bila dibandingkan dengan Kontrol sakita tanpa perlakuan yaitu 32 HSI. Hal ini menunjukkan bahwa perlakuan kitosan 1% mempengaruhi masa berbunga tanaman. Seperti yang telah dilaporkan pada tanaman Eustoma
glandiflorum, dimana perlakuan kitosan dapat mempercepat periode berbunga dan meningkatkan massa dan jumlah bunga (Ohta et al. 1999)
Bobot Kering. Penghitungan bobot kering tanaman dilakukan diakhir
penelitian. Perlakuan kitosan 1% dengan waktu aplikasi yang berbeda (PB1, SB1 dan ST1) memiliki bobot kering yang lebih berat bila dibandingkan dengan kontrol sakit. Sedangkan perlakuan kitosan 0,1% dengan waktu aplikasi yang berbeda (PB0,1, SB0,1 dan ST0,1) tidak menunjukkan bobot yang nyata berbeda bila dibandingkan dengan kontrol tanaman sakit (Tabel 6). Hal ini menunjukkan bahwa selain mempengaruhi jumlah daun, perlakuan kitosan 1% juga mampu mempengaruhi bobot kering tanaman. Hasil yang sama juga dikemukakan oleh Bautista et al. (2005) yang melaporkan bahwa apikasi kitosan yang disemprotkan pada daun tanaman dapat mempengaruhi bobot kering pada tanaman.
Tabel 6 Pengaruh perlakuan kitosan terhadap Masa berbunga, jumlah daun dan bobot kering
Perlakuan1 Masa Berbunga2 Jumlah Daun Bobot Kering
K- 33,00 ± 1,92a 9,22 ± 1,64 bc 1,92 ± 0,25 ab K+ 34,44 ± 3,32a 8,11 ± 1,25 c 1,82 ± 0,18 b PB 0,1 33,00 ± 0,69a 9,11 ± 0,50 bc 1,92 ± 0,34 ab PB 1 32,44 ± 3,38a 11,33 ± 0,33 a 1,98 ± 0,22 a SB 0,1 34,22 ± 1,34a 9,66 ± 0,66 abc 1,94 ± 0,32 ab SB 1 32,89 ± 1,26a 10,33 ± 0,33 ab 1,98 ± 0,55 a ST 0,1 34,00 ± 0,33a 10,66 ± 0,66 ab 1,90 ± 0,27 ab ST 1 32,00 ± 2,96a 11,33 ± 1,00 a 1,97 ± 0,44 a 1
K- : Kontrol negatif; K+ : Kontrol positif; PB0,1 : Perlakuan benih dengan kitosan 0,1%; PB1 : Perlakuan benih dengan kitosan 1%; SB0,1 : Perlakuan sebelum inokulasi dengan kitosan 0,1%; SB1 : Perlakuan sebelum inokulasi dengan kitosan 1%; ST0,1 : Perlakuan setelah inokulasi dengan kitosan 0,1%; ST1 : Perlakuan setelah inokulasi dengan kitosan 1%.
2
angka yang diikuti huruf yang berbeda pada kolom yang sama menunjukkan hasil berbeda nyata (uji selang ganda Duncan α =0,05)
PEMBAHASAN
Virus mosaik adalah virus penting pada kacang panjang dan merugikan. Pengujian kitosan untuk menekan infeksi VMKP sangat baik. Jika dibandingkan dengan kontrol, perlakuan kitosan menunjukkan mampu menekan kejadian penyakit dan keparahan infeksi virus mosaik. Hasil deteksi serologi juga memperkuat pengamatan kejadian dan keparahan penyakit virus mosaik pada tanaman kacang panjang.
Perbedaan konsentrasi yang digunakan dalam penelitian ini berpengaruh terhadap parameter yang diamati yaitu perkembangan penyakit dan pertumbuhan vigor tanaman. Perlakuan kitosan 1% dapat memperjanjang waktu inkubasi virus dan menunjukkan gejala yang lebih ringan bila dibandingkan dengan perlakuan kitosan 0,1% dan kontrol yang diinokulasi virus (Tabel 1). Pada perlakuan kitosan 1% (PB1, SB1 dan ST1) terdapat enam kejadian penyakit diantara 9 ulangan, sedangkan perlakuan kitosan 0,1% (PB0,1, SB0,1dan ST0,1) terdapat tujuh kejadian penyakit diantara 9 ulangan. Rata-rata hasil skoring keparahan yang muncul dari perlakuan kitosan 1% lebih rendah bila dibandingkan dengan perlakuan kitosan 0,1% dan kontrol tanaman sakit (Tabel 2).
Berdasarkan data pada tabel 3, perlakuan kitosan memiliki NAE yang rendah, penghambatan virus tertinggi dan penghambatan penyakit yang tinggi bila dibandingkan dengan perlakuan kitosan 0,1% dan kontrol tanaman sakit. Kemampuan kitosan dalam menekan infeksi virus karena kitosan mampu menginaktivasi replikasi yang dapat menyebabkan terhentinya multiplikasi dan penyebaran virus. Selain itu nano partikel kitosan juga dapat mengikat asam nukleat pada saat virus melakukan penetrasi dan menyebabkan kerusakan pada virus. Kitosan juga dapat menonaktifkan sintesis mRNA yang dikodekan oleh gen untuk metabolik dan infeksi dari virus atau viroid (Chirkov et al. 2006). Namun perlu dikaji lebih lanjut tentang mekanisme yang bekerja dalam menekan infeksi VMKP.
Persentase penghambatan virus tertinggi ditunjukkan oleh perlakuan kitosan 1% (ST1) sebesar 86% dan perlakuan kitosan 0,1% (PB0,1) sebesar 82,27%. Sedangkan persentase penghambatan penyakit dengan perlakuan kitosan 1% sebesar 65% (PB1) dan 55% pada perlakuan kitosan 0,1% (PB1). Hal ini
menunjukkan bahwa perlakuan kitosan 1% cukup baik dalam menekan infeksi VMKP. Pospieszny et al. (1991) juga melaporkan bahwa penyemprotan kitosan pada daun kacang dapat mengendalikan infeksi lokal yang disebabkan oleh Alfalfa mosaic virus (AMV).
Kemampuan kitosan untuk menekan infeksi VMKP mungkin disebabkan oleh kemampuan kitosan dalam menginduksi ketahanan sistemik kacang panjang terhadap infeksi VMKP. Perlakuan kitosan dapat meningkatkan akumulasi pathogenesis related-protein (PR protein) pada jaringan tanaman yang terinfeksi, seperti yang pernah dilaporkan oleh Benhamou & Theriault (1992) pada tanaman tomat untuk mengendalikan Fusarium oxysporum f.sp radicis lycopersici. Menurut Metraux et al. (1990), PR protein memiliki peranan dalam pencegahan multiplikasi, penyebaran, dan lokalisasi virus pada jaringan tanaman yang diinokulasi. PR protein juga akan terakumulasi banyak pada tempat terjadinya infeksi (Naylor et al. 1998).
Virus umumnya menyebabkan penurunan jumlah senyawa pengatur pertumbuhan dengan memperbanyak senyawa-senyawa penghambat pertumbuhan (Sastrahidayat 1990). Adanya penghambatan tinggi tanaman merupakan gejala penyakit virus yang lazim terjadi dan dari segi ekonomi, penyakit virus dapat mengurangi kuantitas hasil tanaman atau menyebabkan kegagalan panen (Bos 1990). Keberadaan virus dapat menimbulkan kondisi stres pada tanaman yang mengakibatkan pertumbuhan terhambat. Perlakuan kitosan mampu untuk meningkatkan toleransi tanaman terhadap kondisi stres serta dapat meningkatkan pertumbuhan tanaman (Ruan & Xu 2002).
Jika dilihat dari pertumbuhan tanaman kacang panjang secara visual, perlakuan kitosan menunjukkan perbedaan yang nyata terhadap tinggi tanaman, diameter batang, jumlah daun, dan bobot kering bila dibandingkan dengan kontrol tanaman sakit. Selain itu tanaman yang diberi perlakuan kitosan tumbuh dengan baik (vigornya lebih baik) walaupun tanaman terinfeksi virus. Namun secara umum pertumbuhannya sama seperti tanaman sehat. Sehingga kitosan sangat positif pengaruhnya terhadap infeksi VMKP.
Pada setiap pengamatan tinggi, diameter, jumlah daun, masa berbunga dan bobot kering tanaman, antara kontrol positif dan kontrol negatif menunjukkan
hasil yang berbeda nyata. Diantara perlakuan kitosan yang digunakan dalam penelitian ini, perlakuan kitosan 1% (PB1, SB1 dan ST1) sangat baik digunakan untuk meningkatkan pertumbuhan tanaman. Bautista et al. (2005) juga melaporkan bahwa tanaman yang diberi perlakuan kitosan secara signifikan lebih segar, bobot kering yang lebih berat dan jumlah daun yang lebih banyak bila dibandingkan tanaman sakit yang tidak diberi perlakuan kitosan. Kitosan dapat membentuk lapisan semipermeabel yang mengatur pertukaran gas, dimana lapisan tersebut dapat mengurangi laju transpirasi (kehilangan air) dan meningkatkan laju respirasi yang mengakibatkan tanaman dapat tumbuh dengan baik meskipun terserang penyakit. Efek tersebut telah dilaporkan untuk berbagai komoditas hortikultura seperti tomat (El Ghaouth et al. 1992).
KESIMPULAN
Perlakuan kitosan baik dengan perlakuan benih (PB1), penyemprotan tanaman sebelum inokulasi (SB1) dan penyemprotan tanaman setelah inokulasi (ST1) menunjukkan bahwa kitosan 1% lebih efektif dalam mengendalikan VMKP (kejadian dan keparahan penyakit, serta akumulasi virus nyata lebih rendah) bila dibandingkan dengan konsentrasi kitosan 0,1%. Hal ini kemungkinan karena kitosan memiliki kemampuan dalam menginduksi ketahanan tanaman terhadap VMKP dan mekanisme penekanan virus lainnya yang belum diketahui.
Selain itu pemberian kitosan konsentrasi 1% dengan waktu aplikasi yang berbeda (PB, SB dan ST) memberikan pengaruh yang nyata lebih baik terhadap pertumbuhan tanaman yaitu tinggi tanaman, diameter batang, jumlah daun dan bobot kering jika dibandingkan dengan kontrol.
SARAN
Berdasarkan hasil penelitian ini perlu dilakukan (1) optimasi perlakuan konsentrasi kitosan untuk mendapatkan penekanan VMKP yang lebih tinggi, (2) kajian mekanisme penekanan infeksi VMKP yang disebabkan oleh perlakuan kitosan, (3) pengujian waktu dan frekuensi aplikasi kitosan yang tepat pada tanaman dan (4) efektivitas aplikasi kitosan dalam percobaan lapang.
DAFTAR PUSTAKA
[CABI] Central for Agricultural and Bioscience International. 2005. Crop protection compendium [CD-ROM]. Wallingford: CAB International. Agrios GN. 2005. Plant Pathology. Ed ke-5. New York: Academic Press. Bautista BS, L Hernandes, Velazquez MG, Hernandes LM, Bosquez ME, Wilson
CL. 2005. Chitosan as a potential natural compound to control pre and postharvest diseases of horticultural commodities. Crop Protection 25: 108-118
Benhamou N, Theriault G. 1992. Treatment with chitosan enhances resistance of tomato plants to the crown and root pathogen Fusarium oxysporum f. sp. radicis-lycopersici. Physiol. Mol. Plant Pathol 41: 34-52
Benhamou N. 1996. Elicitor-induced plant defence pathways. Trends Plant Science 1: 233–240
Bos L. 1990. Pengantar Virologi Tumbuhan. Triharso, penerjemah. Yogyakarta: Gadjah Mada University Press. Terjemahan dari: Introduction to Plant Virology.
Cheah LH, Page BBC, Sheperd R. 1997. Chitosan coating for inhibition of Sclerotina carrots. N. Z. J. Crop Hort Science 25: 89–9
Chirkov SN, Kulikov SN, Il’ina AV, Lopatin SA, Varlamov VP. 2006. Effect of the molecular weight of chitosan on its antiviral activity in plants. Prik. Biokhim. Mikrobio 42(2): 224–228.
Dijkstra J, De Jagger CP. 1998. Practical Plant Virology: Protocols and exercise. Berlin.
Drijfhout E. 1977. Disease caused by viruses: Bean common mosaic virus. Di dalam: Drijfhout, editor. Compendium Bean Common Disease. New York. hlm 37-39.
El Ghaouth A, Arul J, Asselin A, Benhamou N. 1992. Antifungal activity of chitosan on post-harvest pathogens: induction of morphological and cytological alterations in Rhizopus stolonifer. Mycol 96: 769–779.
Galvez GE and Schwartz HF. 1980. Bean Production Problems. CIAT. Cali. Colombia.
Hadidi A, Khetarphal RK, Koganezawa H. 1998. Plant Virus Disease Control. Amerika: APS Press.
Hadwiger LA, Beckman JM. 1980. Chitosan as a component of pea-Fusarium solani interactions. Plant Physiol 66: 205–211.
Haryanto E, Suhartini T, Rahayu E. 2007. Budi Daya Kacang Panjang. Jakarta: Penebar Swadaya.
Hersanti. 2003. Pengujian potensi ekstrak 37 spesies tumbuhan sebagai agen penginduksi ketahanan sistemik tanaman cabai merah terhadap Cucumber Mosaic Virus. J. Fitopat. Ind. 7(2): 54-58.
Hidayati N, Nurulita S, Putra MC, Israhayu R. 2010. Potensi beberapa ekstrak gulma untuk mengendalikan penyakit mosaik pada kacang panjang [PKM]. Fakultas Pertanian, Institut Pertanian Bogor.
Hutapea, J.R. 1994. Inventaris Tanaman Obat Indonesia (III). Badan Penelitian dan Pengembangan Kesehatan Jakarta.
Jacobs TH, Par leu liet JE. 1993. Durability of Disease Resistance. Dordrecht: the Netherlands: Kluwer Academic Press.
Keller B, Feullit, Messmer. 2000. Genetic of disease resistance. Di dalam: Slusorenko A, Fraser R and van Loon LC, editors. Mechanism of Resistance to Plant Disease. Dordrecht, the Netherland: Kluwer Academic Publisher.
Kendra DF, Hadwiger LA. 1984. Characterization of the smallest chitosan oligomer that is maximally antifungal to Fusarium solani and elicits pisatin formation by Pisum sativum. Expt. Mycol 8: 276–281.
Kuc J. 1987. Plant imunization and its applicability for disease control. Di dalam: I Chet, Editor. Inovative Approaches to Plant Disese Control. New York: Jhon Wiley an Sons Ltd. Hlm 225-272
Kurnianingsih L. 2010. Potensi lima ekstrak tumbuhan dalam menekan infeksi virus mosaik pada tanaman kacang panjang (Vigna unguiculata subsp. sesquipedalis) [Skripsi]. Fakultas Pertanian, Institut Pertanian Bogor. Kurt ID, Varum KM, Smidsord O. 1991. Chitosan crosslinked with Mo (VI)
polyxyanions effect of chemical properties. Di dalam : Brine CJ, Sandford PA, Zikakis JP, Editor. Advances in Chitin and Chitosan. New York. Elsevier Applied Science.
Lazuardi F. 2005. Perkembangan beberapa penyakit penting pada kacang panjang (Vigna sinensis L.) di lahan petani sekitar kampus IPB Darmaga, kabupaten Bogor [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Marwoso E. 2005. Pemanfaatan bakteri perakaran pemacu pertumbuhan tanaman (Plant Growth-Promoting Rhizobacteria) untuk mengendalikan virus daun kecil kacang panjang (Cowpea little leaf virus) [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Matthews REF. 1991. Plant Virology, Ed ke-3. London: Academic Press. Metraux JP. 1990. Increase in salicylic acid at the onset of systemic aquired-
resistance in cucumber. Science 250: 1004-1006. http://www.ncbi.nlm.nih.gov [26 juli 2010].
Morales, Bos L. 1988. Bean Common Mosaic Virus. Http://www.dpvweb.net/dpv/showdpv.php?dpvno=337.
Naylor M, Murphy AM, Berry JO, and Carr JP. 1998. Salicylic acid can induce resistance to plant virus movement. Molecular Plant Microbe Interac 11: 860-866.
Ohta K, Taniguchi K, Konishi N, Hososki T. 1999. Chitosan treatment affects plant growth and flower quality in Eustoma glandiflorum. Hort Sci 34: 233–234.
Peter MG. (1997). Introduction remarks. Carb. Eur. 19 (1): 9-15.
Pitojo S. 2006. Penangkaran Benih Kacang Panjang. Yogyakarta: Kanisius. Pospieszny H & Atabekov, J.G. 1989. Effect of chitosan on the hypersensitive
reaction of bean Alfalfa mosaic virus (AMV). Plant Sci 62: 29–31. Pospieszny H, Chirkov S, and Atabekov J. 1991. Induction of antiviral resistance
in plants by chitosan. Plant Sci 79: 63-68.
Pospieszny H. 1993. Effect of chitosan on infection of potato spindle tuber viroid (PSTV). 6th International Congress of Plant Pathology Montreal. Canada.
Pospieszny H. 1997. Antiviroid activity of chitosan. Crop Protection 16: 105– 106.
Ren H, Endo H, Hayashi T. 2001. Antioxidative and antimutagenic activities and polyphenol content of pesticide-free and organically cultivated green vegetable using water-soluble chitosan as a soil modifier and leaf surface spray. J. Food Agric Science 81: 1426–1432.
Ruan SL, Xue QZ. 2002. Effects of chitosan coating on seed germination and salt-tolerance of seedlings in hybrid rice (Oryza sativa L.). Acta Agron Sinica 28: 803–808.
Sandford P.A. 1989. Chitin and Chitosan. Ed by Skjak-braek, G Athonsen, T. And Sandford, P. Elsevier Applied Science, London and New york. Sandford, P.A, Hutchings, G.P. 1987. Industrial polysaccharides. Di dalam:
Yalpani M, Editor. Chitosan A natural cationic biopolymer: Industrial applications. Amsterdam: Elsevier. Hlm 363–376.
Sastrahidayat IR. 1990. Ilmu Penyakit Tumbuhan. Surabaya: Fakultas Pertanian Universitas Brawijaya bekerja sama dengan Usaha Nasional.
Setyastuti L. 2008. Tingkat ketahanan sembilan kultivar kacang panjang terhadap infeksi Bean common mosaic virus (BCMV) [skripsi]. Fakultas Pertanian, Institut Pertanian Bogor.
Strange RN. 2003. Introduction to Plant Pathology. New York: John Willey and Sons Ltd.
Vasyukova NI, Zinov’eva SV, ll’inskaya LI, Perekhod EA, Chalenko GI, Gerasimova NG, ll’ina AV, Varmalov VP, Ozeretskovskaya OL. 2001. Modulation of plant resistance to desease by water-soluble chitosan. App Biochem Microbiol 37(1): 103-109.
Wade HE, Lamondia JA. 1994. Chitosan inhibits Rhizoctonia fragariae but not strawberry black root rot. Adv. Strawberry Res 13: 26–31.
Wang J, Wang B, Jiang B, dan Zhao Y. 2007. Quality and shelf life of mango (Mangifera indica l. cv. ‘Tainong’) coated by using chitosan and polyphenols. SAGE Publications. Food Sci Tech Int 13(4): 317-322.